Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. v.38 n.3 La Plata jul./sept. 2004
HEMOSTASIA Y TROMBOSIS
Efecto de la progesterona sobre la agregación plaquetaria y la producción de eicosanoides por aorta de rata*
Nélida Nélida Polini1, Virginia Laura Massheimer1,2, Juana Sellés1
1. Doctoras en Bioquímica.
2. Investigadora Adjunta del CONICET.
* Cátedra de Análisis Clínicos II, Departamento de Biología, Bioquímica y Farmacia, Universidad Nacional del Sur.
Resumen
En el presente trabajo se investiga la acción no genómica de la progesterona (Pg) sobre la síntesis de óxido nítrico (NO), prostaciclina (PGI2) y tromboxano (TX) y su vinculación con la regulación de la agregación plaquetaria (AP), utilizando anillos de aorta aislados de ratas hembras (RAS). Se obtuvo evidencia de que la Pg inhibe la AP en forma dosis-dependiente. El metil éster de N-nitro-L-arginina (L-NAME) revierte parcialmente el efecto antiagregante de Pg y sugiere que la inhibición de la AP inducida por la hormona es mediada en parte por el NO. Respecto a los eicosanoides, la Pg estimula significativamente la síntesis de 3H-6cetoPGF1alfa (42 al 182% con respecto al control). Por el contrario, la síntesis de tromboxano no es modificada a ninguna de las dosis ensayadas. En presencia de indometacina -inhibidor de la ciclooxigenasa constitutiva (COX)- la diferencia de la AP entre los grupos control y tratado se reduce significativamente, lo que sugiere que el efecto antiagregante inducido por la Pg es en parte mediado por la producción de PGI2. Estos resultados sugieren que la progesterona modula la agregación plaquetaria a través de un mecanismo que involucra la participación de NO y PGI2.
Palabras clave: Agregación plaquetaria; Progesterona; Óxido nítrico; Prostaciclina; Aterosclerosis; Hormonas ováricas; Aorta.
Summary
Effects of progesterone on platelet aggregation and rat aorta eicosanoid production
Using rat aortic tissue, the non genomic action of progesterone (Pg) on nitric oxide (NO), prostacyclin (PGI2), and tromboxane (Tx) synthesis and its relationship with platelet aggregation were studied. Treatment of female rat aortic rings (RAS) with Pg induced a dose-dependent inhibition of platelet aggregation (IPA), which was partially abolished when RAS were treated in the presence of the specific NOS inhibitor N-nitro-L-arginine methyl ester (L-NAME). This observation would indicate that the inhibition of platelet aggregation (PA) resulted partially dependent on NOS stimulation by the hormone. Pg also produced a dose-dependent increase in PGI2 synthesis (42 at 182% respect to control), but no changes in Tx liberation by aorta was observed, at any concentration of Pg used. RAS preincubation with indomethacine, a COX inhibitor, partially reduced Pg antiaggregatory effect, suggesting that the inhibition of PA induced by hormone is also dependent on PGI2 generation. These results provide evidence that Pg modulates PA involving NO and PGI2 metabolic pathways.
Key words: Platelet aggregation; Progesterone; Nitric oxide; Prostacyclin; Aterosclerosis; Ovarian hormones; Aorta.
Introducción
En condiciones fisiológicas, el óxido nítrico (NO) y la prostaciclina (PGI2), factores sintetizados y liberados por el endotelio, inhiben la activación endotelial, la expresión de moléculas de adhesión y la agregación plaquetaria (AP)(1-3). La disfunción del endotelio altera el equilibrio de síntesis de estos factores y conduce a su activación. Esta activación provoca adhesión de leucocitos y/o agregación/adhesión de plaquetas a la pared vascular. Ello es consecuencia de un incremento en la expresión por parte de las células endoteliales, de moléculas de adhesión VCAM (vascular cell adhesion molecule); ICAM (intercellular cell adhesion molecule); P-selectina y PECAM-1 (platelet endothelial cell adhesion molecule- 1), que atraen y unen a leucocitos y plaquetas. Las plaquetas activadas cambian de forma, emiten seudópodos y migran hacia el subendotelio donde se adhieren por unión al factor de Von Willebrand asociado al colágeno. Todos estos eventos, sumados a la migración de células musculares lisas hacia la túnica íntima, participan en la formación de la placa (4-6).
El NO producido por el endotelio es sintetizado por la enzima óxido nítrico sintasa endotelial (NOSe) a partir de la arginina (7). Luego de producido este radical libre puede difundir a la luz arterial e inhibir la agregación plaquetaria, o se trasloca a la capa muscular subyacente induciendo vasorrelajación dependiente de GMPc.
Las prostaglandinas (PG) y tromboxano (TX) se sintetizan a partir del ácido araquidónico por la acción catalítica de la ciclooxigenasa constitutiva (COX-1) o inducible (COX-2). Los eicosanoides PGD2, PGE2 y PGI2 son potentes vasodilatadores y tienen, además, acción antitrombótica, mientras que el TXA2 es un potente vasoconstrictor y estimulante de la AP (8)(9).
Diferentes agonistas, entre los que se incluyen las hormonas ováricas estrógenos y Pg, regulan a nivel del endotelio la producción de estos compuestos vasoactivos (NO, PGI2 y TXA2). Las hormonas esteroideas actúan a través de dos mecanismos: uno genómico, que comprende la unión al receptor citosólico nuclear y posterior regulación de la transcripción génica; y otro mecanismo no genómico de acción rápida (segundos, minutos), a nivel de la membrana plasmática con posterior activación de sistemas de transducción de señales intracelulares (10).
Recientemente en este laboratorio se ha demostrado que la Pg, en tejido aórtico de rata, estimula la producción de NO e inhibe la AP, en forma similar a lo reportado para 17 β-estradiol (11). Se demostró también que el mecanismo de acción de la Pg es de tipo no genómico ya que los efectos observados no fueron suprimidos ni por actinomicina (inhibidor de la transcripción génica) ni por cicloheximida (inhibidor de la síntesis proteica) (12).
En el presente trabajo se estudia la acción no genómica de la Pg sobre la síntesis de NO, PGI2, TX y su vinculación con la regulación de la AP, en anillos de aorta de ratas hembra.
Materiales y Métodos
MATERIALES
El ácido 3H-araquidónico fue adquirido en New England Nuclear (Chicago, USA); las placas de sílica gel G para cromatografía en capa fina, en Merck KGaA (Alemania); la Pg, la superóxido dismutasa (SOD), y las otras drogas empleadas, en Sigma (St. Louis, MO, USA).
ANIMALES
Se utilizaron ratas Wistar hembras, en edad fértil (3 a 6 meses). La madurez ovárica se determinó por observación con microscopía óptica de los extendidos vaginales; se consideró función ovárica activa a la presencia de tres estros consecutivos. Los animales fueron alimentados con dieta estándar para roedores, con provisión de agua ad libitum, permaneciendo expuestos a ciclos diarios de 12 horas de luz/oscuridad.
SISTEMA EXPERIMENTAL
Se emplearon anillos de aorta de rata (RAS) aislados y procesados de acuerdo a lo descripto previamente (11). Los animales se sacrificaron por dislocación cervical, inmediatamente se extrajo la aorta toráxica, se colocó en una solución salina Dulbeco tamponada (DPBS) fría, se lavó, se eliminó el tejido conectivo y se cortaron anillos de 5 mm de ancho. En todo momento se cuidó de no lesionar el endotelio vascular. Los anillos se preincubaron en un medio (D) que contenía: NaCl 125,4 mM; KCl 5,9 mM; MgCl2 1,2 mM; CaCl2 1,5 mM; glucosa 11,5 mM; Hepes 10 mM; pH: 7.35 durante 15 min en un baño termostatizado a 37 oC, con agitación constante (12).
DETERMINACIÓN DE LA INHIBICIÓN DE LA AGREGACIÓN PLAQUETARIA:
Los RAS se incubaron en medio D, se lavaron exhaustivamente y se transfirieron a 400 µL de un pool de plasma rico en plaquetas (PRP) (ajustado a 300 x 10 3 /µL) y se efectuó el tratamiento hormonal con las concentraciones de Pg a los intervalos de tiempo que se indican en cada figura. Los grupos controles fueron tratados con vehículo solamente (etanol < 0,1%). Para evitar la degradación del NO producido se utilizaron 60 U/mL de SOD (superóxido dismutasa), agregada al medio de incubación previo al tratamiento hormonal (13).
Finalizado el tratamiento, se tomaron alícuotas de 285 µL del PRP y se colocaron en la cubeta del agregómetro CronoLog 430 de un solo canal. Se determinó la agregación plaquetaria por el método turbidimétrico de Born. Se emplearon como agonistas ristocetina, ADP y epinefrina, a las concentraciones finales indicadas en la Tabla I (14). Los RAS se disolvieron con NaOH 1 N y se determinó proteínas por el método de Lowry (15). Los resultados se expresaron como porcentaje de inhibición de la agregación plaquetaria por mg de proteína.

Cuando se emplearon L-NAME (inhibidor de la NOS) e indometacina (inhibidor de COX), estos se agregaron al medio de preincubación 10 min antes del tratamiento hormonal.
DETERMINACIÓN DE LA PRODUCCIÓN DE EICOSANOIDES
Los RAS se premarcaron con ácido 3H-araquidónico (0,3 µCi/mL) durante 90 min y se trataron con Pg durante 5 min con las concentraciones indicadas. Se detuvo el tratamiento por aspiración del medio de incubación, se acidificó con ácido cítrico (pH 3.5-4.5) y se extrajo cuatro veces con 0,5 mL de acetato de etilo. Se colectó la fase orgánica, se evaporó bajo atmósfera de nitrógeno y se resuspendió en acetato de etilo. Se sembró en placas de sílica gel. Como solvente de corrida se empleó acetato de etilo: iso-octano: ácido acético: agua (66:30:12:60, respectivamente) y como revelador, vapores de yodo. Se cuantificó la radioactividad incorporada en cada banda por centelleo líquido, y los resultados se expresan como porcentaje del total de 3H-eicosanoides (16).
ANÁLISIS ESTADÍSTICO
Se utilizó el test t de Student con un nivel de significación p < 0,05. Cada condición experimental se reprodujo en al menos tres experimentos independientes realizados por cuadruplicado.
Resultados
En primer lugar se evaluó el efecto del tratamiento del tejido aórtico con Pg (10-8M) sobre la AP, utilizando ADP, epinefrina y ristocetina, como inductores de la misma. La Tabla I muestra los resultados de la AP en condiciones basales (PRP solo), control (RAS + vehículo) y Pg (RAS en presencia de la hormona). Puede observarse que la presencia de tejido aórtico en el PRP produce una disminución de la AP inducida por ADP (57% del control vs 100% del basal), y que el tratamiento del tejido con Pg incrementa más aún la inhibición (28% vs 57%, Pg vs control). Con epinefrina o ristocetina se obtuvieron resultados equivalentes. En virtud de ello se seleccionó ADP para la ejecución de los experimentos siguientes.
El efecto de la Pg sobre la AP demuestra ser dosis dependiente como puede observarse en la Figura 1. Las curvas de agregación muestran que dosis crecientes de Pg disminuyen la AP en forma progresiva respecto al control (20 al 80% de inhibición de la AP sobre el control).
Figura 1. Dosis-respuesta del efecto de la Pg sobre la AP: Los RAS se incubaron durante 1 min en PRP en presencia o ausencia (control) de las concentraciones indicadas de la hormona. La AP se midió como se describe en Métodos. Los resultados se expresan en porcentaje de AP con respecto al basal (PRP más ADP).
Con el objeto de determinar si la acción antiagregante de la Pg era mediada por la producción de NO por parte del tejido aórtico, se midió la AP en presencia de L-NAME, un inhibidor específico de la NOS. En la Figura 2 se puede observar que L-NAME 10-5 M revierte parcialmente el efecto antiagregante de la hormona y sugiere que la IAP inducida por la Pg es mediada en parte por el NO.

Se evaluó si los compuestos empleados en los diferentes tratamientos afectaban directamente la agregación de las plaquetas. Para ello se determinó la AP inducida por ADP en un PRP al cual se le agregó etanol, Pg, L-NAME o indometacina. Además se utilizó nitroprusiato de sodio (dador de NO) como control positivo del funcionamiento. En la Tabla II puede observarse que los diferentes compuestos que se utilizan para los tratamientos del tejido, cuando se agregan al PRP en ausencia de tejido aórtico no afectan la AP inducida por ADP, descartándose por consiguiente un efecto directo de dichos compuestos sobre la AP. El nitroprusiato produce una inhibición del 40%, lo que evidencia la capacidad de las plaquetas de responder al NO.

Dado que el proceso de activación y la AP son también modulados por los eicosanoides prostaglandinas y tromboxanos (17), se estudió el efecto de la Pg sobre la producción de PGI2 y Tx por parte del tejido aórtico,. Como puede observarse en la Figura 3, 5 min de tratamiento con Pg estimulan significativamente la síntesis de 3H-6cetoPGF1alfa en forma dosis dependiente (42 al 182% con respecto al control). Por el contrario, la síntesis de tromboxano no fue modificada por el tratamiento rápido con Pg a ninguna de las dosis ensayadas (Tabla III).


Teniendo en cuenta que la PGI2 es un potente antiagregante plaquetario y que en este sistema la Pg incrementa significativamente su producción (Fig. 3), se estudió la participación de la PGI2 sobre la IAP inducida por la hormona. Con tal fin el tejido aórtico fue pretratado con indometacina 10 µM para suprimir la actividad COX. En presencia del inhibidor la diferencia de la AP entre los grupos control y tratado con hormona se reduce significativamente, lo que sugiere que el efecto antiagregante inducido por la Pg es en parte mediado por la producción de PGI2 (Fig. 4).
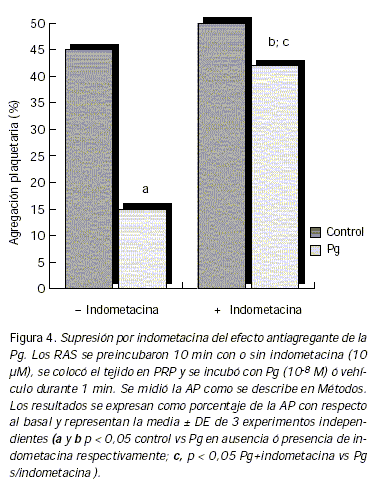
Discusión
En este trabajo se demuestra que la Pg a concentraciones fisiológicas ejerce un efecto directo sobre el tejido aórtico de rata y modula la AP a través de un mecanismo que involucra la participación de NO y PGI2. Los resultados obtenidos con NAME e indometacina evidencian que el efecto antiagregante de la Pg a través de su acción directa sobre el tejido vascular sería mediado por la regulación de la producción de los compuestos vasoactivos NO y PGI2. Es importante destacar que la síntesis de tromboxano no es afectada por la hormona, lo cual sugeriría una acción diferencial del esteroide sobre las enzimas tromboxano sintasa y prostaciclina sintasa, responsables de la síntesis de dichos eicosanoides.
Los prostanoides cumplen un rol fundamental en el control de la hemostasia a través de la regulación de la activación plaquetaria (18). El TxA2 es el responsable de la propagación de la activación y del reclutamiento de las plaquetas hacia el sitio de la agregación. Su unión al receptor plaquetario TP activa el sistema Gq/PLC (fosfolipasa C), estimula la liberación de calcio intracelular en forma dependiente de IP3 y activa el sistema contráctil CAM/Ca++/ MLCK (calmodulina/ miosina de cadena liviana) induciendo contracción y la posterior secreción del contenido de los gránulos plaquetarios. En cambio, la prostaciclina producida por las células del endotelio vascular constituye el principal factor antiagregante del organismo (19). Inhibe la agregación plaquetaria de dos maneras diferentes: a) en las plaquetas se une a su receptor IP, estimula la síntesis de AMPc e inhibe la secreción plaquetaria por fosforilación dependiente de PKA; b) en el lecho vascular suprime la expresión de moléculas quimiotácticas para plaquetas y leucocitos , evitando su adhesión y agregación al endotelio (20).
La postmenopausia es un período en la vida de la mujer en el que el riesgo de padecer enfermedades cardiovasculares aumenta significativamente, hecho que se ha atribuido a la disminución de los niveles de estrógenos circulantes. La aterosclerosis es una enfermedad multifactorial. Diversos agonistas, entre los que se incluye al estradiol, modulan dichos factores. La regulación de la actividad endotelial por parte del estradiol es un hecho bien documentado. Numerosos reportes en la literatura demuestran que el 17 β-estradiol ejerce una acción directa a nivel de la pared arterial regulando negativamente la expresión de algunos de los múltiples factores que conducen a la aterosclerosis. Se ha demostrado que promueve la vasorrelajación por activación de la NOS constitutiva, inhibe la migración y proliferación de las células del músculo liso, suprime la expresión de las moléculas de adhesión, e inhibe la activación plaquetaria (21). En la postmenopausia, con la pérdida de este efecto protector del estradiol, se establecerían condiciones más propensas para el desarrollo de lesiones ateromatosas.
La pérdida de la función ovárica también afecta a los niveles circulantes de Pg. Cuando se aplica una terapia hormonal de reemplazo, el protocolo recomendado es el que incluye la administración combinada de estrógenos y progesterona. No obstante ello, es escasa la información documentada concerniente a la acción de la Pg sobre la pared arterial a pesar de haberse encontrado receptores para dicha hormona en el endotelio (22). Estudios electrofisiológicos han demostrado que la Pg promueve vasorrelajación a través de la inhibición de la entrada de calcio a la célula endotelial en arterias coronarias de conejo (23)(24). Estos resultados estarían en concordancia con los hallazgos previos de los autores que muestran que la Pg induce la activación de la NOS con un significativo aumento de la producción de NO por parte del tejido aórtico (12), resultando en una acción vasodilatadora.
Las actuales investigaciones están dirigidas a identificar en la pared vascular, las vías mensajeras que median la acción de la Pg y que resultan en un efecto inhibitorio de la agregación plaquetaria inducida por la hormona; como así tambien la relevancia fisiológica de estos efectos observados in vitro. La pérdida de los mismos durante el período de declinación de la función ovárica, podría contribuir al desarrollo de las patologías vasculares observadas en la postmenopausia.
AGRADECIMIENTOS
Este trabajo fue realizado gracias al aporte del subsidio otorgado por la Secretaría de Ciencia y Tecnología de la Universidad Nacional del Sur (PGI: 24/ B047).
CORRESPONDENCIA
Dra. JUANA SELLÉS
Cátedra de Análisis Clínicos II
Departamento de Biología,
Bioquímica y Farmacia
San Juan 670
B8000ICN BAHÍA BLANCA
1. George JN. Platelets. Lancet 2000; 355 (9214): 1531-9.
2. Martí Vilalta JL, Matías Guiu J. Antiagregación y anticoagulación en el ictus: incorporando la evidencia a la práctica clínica. Rev Neurol 1999; 29 (8): 767-9.
3. Moncada S, Pamer R, Higgs E. Nitric oxide: physiology, pathology and pharmacology. Pharmacol Res 1991; 43: 109-42.
4. Kim CS, Wang T, Madri JA. Platelet endothelial cell adhesion molecule-1 expression modulates endothelial cell migration in vitro. Lab Invest 1998; 78 (5): 583-90.
5. Forastiero RR, Martinuzzo ME, Carreras LO. Anticuerpos antifosfolípido-proteína. Efectos sobre la interacción endotelio plaqueta. Sangre 1999; 44 (3): 223-30.
6. Ross R. Atherosclerosis: an inflammatory disease. New Engl J Med 1999; 340 (2): 115-26.
7. Michel T, Li G, Busconi C. Phosphorylation and subcellular translocation of endothelial nitric oxide synthase. Proc Natl Acad Sci 1993; 90: 6252-6.
8. Oravee S, Demuth K, Myara I, Hornych A. The effect of high density lipoprotein subfractions on endothelial eicosanoid secretion. Thromb Res 1998; 92: 65-71.
9. Ofosu FA. The blood platelet as a model for regulating blood coagulation on cell surfaces and its consequences. Biochemistry 2002; 67 (1): 47-55.
10. Falkenstein E, Tillman HC, Christ M, Feuring M, Wehling M. Multiple actions of steroid hormones, a focus on rapid, nongenomic effects. Pharmacol Rev 2000; 52: 513-56.
11. Sellés J, Polini NN, Alvarez C, Massheimer V. Progesterone and 17 b-estradiol acutely stimulate nitric oxide synthase activity in rat aorta and inhibit platelet aggregation. Life Sci 2001; 69: 815-27.
12. Sellés J, Polini NN, Alvarez C, Massheimer V. Nongenomic action of progesterone in rat aorta: Role of nitric oxide and prostaglandins. Cellular Signalling 2002; 14: 431-6.
13. Gryglewski RJ, Palmer RMJ, Moncada S. Superoxide anion is involved in the breakdown of endothelium derived vascular relaxing factor. Nature 1986; 320: 454-6.
14. Born GVR, Cross MJ. The aggregation of blood platelets. J Physiol 1963; 16: 178-95.
15. Lowry OH, Rosebrough NJ, Farr AL, Randall RJ. Protein measurement with the Folin phenol reagent. J Biol Chem 1951; 195: 265-77.
16. Salmon J, Flower R. Methods in enzymology. New York: Academic Press; 1982, pp 477-93.
17. Linton MF, Fazzio S. Ciclooxigenase-2 and atherosclerosis. Curr Opin Lipidol 2002; 13: 497-504.
18. Wise H, Wong YH, Jones RL. Prostanoid signal integration and cross talk. Neurosignals 2002; 11: 20-8.
19. Moncada S. Biological importance of prostacyclin. Br J Pharmacol 1982; 76: 3-31.
20. Murata T, Ushikubi F, Matsuoka T, Hirata M, Yamasaki A, Sugimoto Y, et al. Altered pain perception: an inflammatory response in mice lacking prostacyclin receptor. Nature 1997; 388: 678-82.
21. Andersen HL, Weis JU, Fjallad B, Korsgaard N. Effect of acute and long term treatment with 17 b-estradiol on the vasomotor responses in the rat aorta. Br J Pharmacol 1999; 126: 159-68.
22. Vazquez F, Rodriguez-Manzaneque JC, Lydon JP, Edwards DP, O'Malley W, Iruela-Arispe ML. Progesterone regulates proliferation of endothelial cells. J Biol Chem 1999; 274: 2185-92.
23. Jiang CW, Sarrel PM, Lindsay DC, Poole Wilson PA, Collins P. Progesterone induces endothelium independent relaxation of rabbit coronary in vitro. Eur J Pharmacol 1992; 211: 163-7.
24. Glusa E, Graser T, Wagner S, Oettel M. Mechanisms of relaxation of aorta in response to progesterone and synthetic progestins. Maturitas 1997; 28: 181-91. [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ]
Aceptado para su publicación el 13 de julio de 2004














