Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. v.38 n.4 La Plata sep./dic. 2004
MICROBIOLOGÍA
Detección y caracterización de Streptococcus agalactiae en muestras para urocultivo*
José Viegas Caetano1, Silvina Larre2, Carmen Lopreto3
Homenaje a la trayectoria del Prof. Dr. Nicolás Jamardo
1. Bioquímico Especialista en Microbiología, a cargo Sección Urocultivos.
2. Bioquímica, Tec. Lab., Sección Urocultivos.
3. Dra. en Farmacia y Bioquímica, Jefa del Laboratorio de Microbiología.
* Laboratorio de Microbiología. Hospital HIGA "Gral. San Martín", calle 1 y 70. 1900 La Plata, Prov. de Buenos Aires, Argentina.
Resumen
La frecuencia de los aislamientos de Streptococcus agalactiae en el laboratorio clínico es cada vez mayor. Dada su importancia como patógeno, fundamentalmente relacionado a infecciones del tracto urinario, sepsis neonatal y puerperal, se hace necesario mejorar los métodos de detección. El presente trabajo pretende estudiar la frecuencia de los aislamientos de Streptococcus agalactiae en muestras para urocultivo con especial atención en las pacientes embarazadas. Se evaluaron 17.160 aislamientos durante un período de dos años, tanto de pacientes ambulatorios como de internados, aislándose Streptococcus agalactiae en 170 muestras (1%). Con agar sangre de carnero como medio de aislamiento se logró aumentar la sensibilidad en la detección de este microorganismo al considerar la presencia de colonias beta hemolíticas en las muestras de pacientes embarazadas aún en bajas concentraciones. Sobre un total de 4.868 muestras provenientes de embarazadas se obtuvieron 107 aislamientos de Streptococcus agalactiae que corresponden al 2,2%. De esta forma, pudo detectarse un gran número de pacientes portadoras y prevenir efectivamente los riesgos potenciales. Sobre 88 aislamientos se ensayó la sensibilidad a diferentes agentes antimicrobianos, y pudo observarse una sensibilidad conservada a los agentes beta-lactámicos y una buena respuesta a los tratamientos instaurados.
Palabras clave: Streptococcus agalactiae; Infección urinaria.
Summary
Detection and characterization of Streptococcus agalactiae in urinary samples for culture
The frequency of Streptococcus agalactiae is growing in the clinical laboratory. Improved detection methods are needed due to its importance as urinary tract, neonatal and puerperal pathogen. The aim of the present work was to study the frequency of Streptococcus agalactiae isolations in urinary culture samples focused on pregnant women. 170 isolates (1%) Streptococcus agalactiae were obtained from 17,160 samples of ambulatory and hospitalized patients in a two year period. It was possible to increase the sensitivity of the detection of this microorganism by considering the presence of beta hemolytic colonies in low concentrations in samples of pregnant patients on sheep blood agar plates. Out of 4,868 samples of pregnant women, 107 isolates (2.2%) of Streptococcus agalactiae were obtained. By this means it was possible to detect a great number of carriers and to effectively prevent potential risks. The susceptibility of 88 isolates to different antimicrobial agents was tested. A preserved susceptibility to beta-lactam agents and also a positive response to the established treatments were observed.
Key words: Streptococcus agalactiae; Urinary infection.
Introducción
La detección de Streptococcus agalactiae en muestras clínicas es cada vez más frecuente. Este estreptococo b-hemolítico se reconoce como patógeno humano desde 1938, a partir de tres casos fatales de sepsis puerperal (1). En la década del 60 se transformó en el primer microorganismo en frecuencia, en sepsis neonatal (2).
La transmisión de madre a hijo puede ocurrir durante el parto en el caso de existir colonización vaginal, o antes del nacimiento, en el marco de la infección maternal. Hussain y col. en 1995 describieron infecciones por este microorganismo en pacientes pediátricos en un hospital de EEUU (3).
Si bien la transmisión vertical es la más frecuente, es importante considerar que puede producir diseminación horizontal, al generar brotes en unidades de cuidados intensivos neonatales (4). Noya y col. demostraron la transmisión nosocomial de bebé a bebé por medio de los trabajadores de la salud (5).
En adultos, además de la infección posparto, ha sido reconocido como patógeno en pacientes no embarazadas, al provocar una variedad de infecciones, principalmente en piel y tejidos blandos e infección urinaria. Se trata de adultos de 60 o más años de edad que generalmente presentan factores predisponentes como diabetes mellitus, cáncer y HIV (6-9).
El hábitat natural de este microorganismo es el intestino; intermitentemente coloniza la vagina, donde la portación es mayor en la primera etapa del ciclo menstrual de mujeres jóvenes (9-12). Estudios realizados en embarazadas demuestran una variación en la portación entre un 5 y un 25% (13).
Por su importancia como microorganismo relacionado con infecciones perinatales, con rotura de bolsa, parto prematuro y bajo peso, se hace necesaria la implementación de una búsqueda adecuada, con el objeto de establecer la prevención de sepsis neonatal por transmisión vertical de S. agalactiae de madre a hijo (13-18).
La última revisión de las normas internacionales para la prevención de la enfermedad perinatal por S. agalactiae, establece claramente que la búsqueda debe hacerse entre las 35 y 37 semanas de gestación a través de hisopado anal e introito vaginal. Estas recomendaciones abarcan a todas las embarazadas, con excepción de aquellas donde se aisló S. agalactiae en orina durante el presente embarazo, en cualquier concentración o con antecedentes de un parto con un niño con enfermedad invasiva (18)(19).
El objetivo del presente trabajo fue estudiar en muestras para urocultivo la frecuencia de aislamiento de S. agalactiae tanto en pacientes infectados como en mujeres embarazadas colonizadas.
También se evaluó el serotipo, la sensibilidad a los antimicrobianos y el valor del uso de agar sangre de carnero en urocultivo como medio de aislamiento primario, para la detección de pacientes colonizadas.
Materiales y Métodos
El estudio incluyó a todos aquellos pacientes, tanto ambulatorios como internados, en los cuales se aisló S. agalactiae de muestras para urocultivo, durante el período comprendido entre el 1 de marzo de 2000 y el 30 de abril de 2002, sobre un total de 17.160 muestras.
En las muestras positivas para S. agalactiae se evaluó el tipo de paciente, sexo, edad, patología de base, embarazo y tiempo del mismo, clínica, tratamiento, evolución, así como la serotipificación de la cepa aislada.
En este hospital el protocolo de seguimiento durante el embarazo consiste en efectuar 3 urocultivos, uno por trimestre, si bien la mayoría de las consultas por parte de las pacientes comenzó con posterioridad al quinto mes de embarazo.
A las muestras de orina tomadas en forma aséptica por la técnica del chorro medio se les midió el pH y se las centrifugó a 2.000 r.p.m. durante 10 min. Una gota del sedimento fue observada al microscopio entre porta y cubreobjetos con un aumento de 400 X. Luego se sembraron en agar triptosa soja con sangre de carnero al 5% y se incubaron entre 24 y 48 h a 35 ºC.
Para los fines de este estudio se consideraron cultivos positivos sólo aquellos que presentaban recuentos mayores a 105 ufc/mL o 104 ufc/mL acompañados de una leucocituria mayor a 5 elementos/campo.
La identificación de S. agalactiae se realizó a través de morfología y hemólisis b de las colonias, observación de cadenas en la coloración de Gram del cultivo en medio líquido, prueba de catalasa negativa, crecimiento en NaCl 6,5% variable, prueba de bilis esculina negativa, prueba de CAMP positiva y aglutinación con anticuerpos específicos contra polisacáridos de S. agalactiae.
Para la serotipificación se utilizó Pastorex B (Sanofi Diagnostics Pasteur, M. de la Coquette, France) mediante el cual se los clasificó en tipos I, II y III.
Se determinó la sensibilidad a ampicilina, eritromicina, clindamicina, vancomicina, cloranfenicol y cefotaxima utilizando monodiscos BBL, por el método de difusión en agar Mueller Hinton + 5% de sangre ovina, según las recomendaciones de la NCCLS (20). Eritromicina, clindamicina y cloranfenicol, si bien no están indicados para vías urinarias, fueron incluidos a los fines de completar el perfil de sensibilidad.
Resultados
Durante el estudio se evaluaron 17.160 muestras para urocultivo, de las cuales 3.003 (17,5%) resultaron positivas.
La distribución de los microorganismos aislados puede observarse en la Tabla I.

De todas las muestras, 4.868 (28,4%) correspondieron a pacientes de sexo femenino embarazadas, cuya edad oscilaba entre 20 y 40 años. De éstas, 418 fueron positivas.
El 56,7% ( N = 237) de estos aislamientos correspondieron a E. coli y 16% (N = 67) a S. agalactiae. Los datos correspondientes al resto de los microorganismos pueden observarse en la Tabla II.

De los 67 aislamientos de S. agalactiae, 37 correspondieron a cultivos puros con recuentos de 105 ufc/mL y sedimento normal; 22 casos presentaron sedimentos patológicos y cultivos puros de 105 ufc/mL y 8 casos tuvieron sedimentos patológicos y cultivos puros de 104 ufc/mL (Tabla III). Se define al sedimento patológico como aquel que presenta 5 o más leucocitos por campo a 400 X.
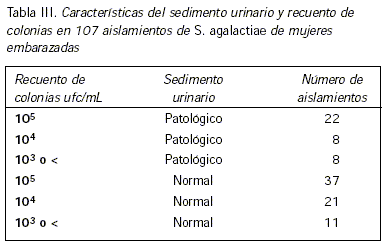
Los cultivos polimicrobianos o con recuentos no significativos donde se aisló S. agalactiae fueron 40, lo cual eleva el número de aislamientos de S. agalactiae en mujeres embarazadas a 107.
Al considerar los aislamientos significativos de S. agalactiae en otro tipo de pacientes, el número de aislamientos en esta muestra llegó a 170.
Sobre 88 aislamientos (47 cepas correspondientes a aislamientos de embarazadas y 41 cepas de no embarazadas) en los que se realizó la prueba de sensibilidad a los antimicrobianos, todos fueron sensibles a ampicilina, vancomicina, cloranfenicol y cefotaxima. Una cepa resultó resistente a eritromicina y otras dos mostraron sensibilidad intermedia a eritromicina y clindamicina respectivamente.
Los casos de infección urinaria por este microorganismo se trataron con 1 g de ampicilina cada 6 h durante 10 días, con controles post tratamiento negativos.
Todas las pacientes embarazadas en las cuales se detectó S. agalactiae fueron tratadas con ampicilina intravenosa en dosis de 2 g cada 4 h durante el trabajo de parto, observándose una transmisión nula al neonato durante todo el período estudiado.
Dentro de los antecedentes clínicos en la paciente embarazada, se consideró importante relacionar la presencia de síntomas de infección urinaria (IU) en el momento del estudio. Entre los 418 cultivos positivos sólo el 20% refería síntomas de IU en el momento de la toma de muestra, siendo la mayoría pacientes asintomáticas que acudían a un control de rutina. Se pudo comprobar que de 48 pacientes en las que se aisló S. agalactiae, 13 presentaron síntomas (27%) y el resto no refirió ningún síntoma en el momento de la toma de muestra.
La edad de las pacientes no embarazadas (N = 63), con IU por S. agalactiae, osciló entre 57 y 68 años y las patologías más frecuentes fueron diabetes y litiasis vesical; sobre 40 de estos pacientes sólo 3 (7,5%) no presentaban síntomas de infección y los tres casos correspondieron a controles de tratamiento por infecciones previas.
De las cuarenta y una (41) cepas que fueron serotipificadas, 19 correspondieron a aislamientos de embarazadas (Tabla IV).

Dos (2) cepas de no embarazadas aglutinaron con antisueros I y II, por lo que se las consideró no evaluables. Si bien los serotipos III y I fueron los más importantes en embarazadas, y el II en los otros pacientes, la distribución de los mismos es heterogénea.
Conclusiones
• La siembra en agar sangre de carnero debería considerarse como imprescindible, al menos en pacientes embarazadas, para detectar la portación de S. agalactiae.
• La presencia de S. agalactiae en cualquier concentración y en cualquier etapa del presente embarazo, se considera uno de los factores que determina la profilaxis intraparto, sin necesidad de realizar el screening en la semana 35-37, por lo cual es de suma importancia informar su hallazgo.
• En pacientes no embarazadas S. agalactiae se relaciona con infecciones urinarias principalmente en pacientes añosos, con patologías de base como diabetes o litiasis vesical.
• No se observó un biotipo significativamente predominante.
• La sensibilidad a ampicilina "in vitro", así como la respuesta a los tratamientos con este antimicrobiano sigue siendo buena y debería considerase la droga de elección.
AGRADECIMIENTOS
Los autores agradecen a los servicios de Neonatología y Obstetricia del Hospital San Martín de La Plata, en particular a los Dres. Pedro Haluska y María Silvina Marchisio por el aporte de datos necesarios para la realización de este trabajo.
CORRESPONDENCIA
DR. JOSÉ VIEGAS CAETANO
Calle 68 Nº 66
1900 LA PLATA
Tel: 54-221-15-494 3205
E-mail: ppjavc@biol.unlp.edu.ar
Referencias bibliográficas
1. Fry R M. Fatal Infections by haemolytic streptococcus group B. Lancet 1998; 1: 199-201.
2. Eickhoff TC, Klein JO. Neonatal sepsis and other infections due to group B beta hemolytic streptococci. N Engl J Med 1964; 271: 1221-8.
3. Hussain SM, Luedtke GS. Baker CJ, Schlievert PM, Leggiadro RJ.Invasive group B streptococcal disease in children beyond early infancy. Pediatr Infect Dis 1995; 14: 278-81.
4. Farinati AE, Gonzalez Beraldo de Quiros I, Tierno MC, Arduino S, Goldberg M, Casellas JM. Evidencias de transmisión horizontal en un brote por estreptococcus b hemolítico del grupo B en una unidad neonatológica. Congreso SEMIC, Granada, España 1988; Res. 29(05): 342-4.
5. Noya FJ, Rench MA, Metzger TG, Colman G, Naidoo J, Baker CJ. Unusual occurrence of an epidemic of type Ib/c group B streptococcal sepsis in a neonatal intensive care unit. J Infect Dis 1987 Jun; 155: 1135-44.
6. Pierotti MG, Gonzalez SE, Littvic AM, Vacaflor L, Kassar MA, Moreno S et al. Infecciones por estreptococos grupo B en adultos excluyendo infecciones genitales. Revista Argentina de Microbiología 2002; 34: 226-9.
7. Farley MM, Harvey C, Stull T, Snith D, Schuchat A, Wenger JD et al. A population based assessmnet of invasive disease due to group B streptococcus in nonpregnant adults. N Engl J Med 1993; 328: 1807-11.
8. Wessels MR, Kasper DL. The changing spectrum of group B streptococcal disease. N Eng J Med 1993; 318: 1843-4.
9. Schuartz B, Schuchat A, Oxtoby MJ. Invasive group B streptococcal disease in adults. JAMA 1991; 266: 1112-4.
10. Farinati A. Factores de virulencia de Streptococcus grupo B con importancia en las infecciones neonatales. Asociación Argentina de Microbiología, Ene-Febr 2001.
11. Baker CJ, Goroff DK, Alpert S, Crokett VA, Zinner SH, Evrard JR et al. Vaginal colonizations with group B Streptococcus; a study in college women. J Infect Dis 1977; 135: 392-7.
12. Jancey MK, Schuchat A, Brown LK, Ventura VL, Markenson GR. The accuracy of late antenatal screening cultures in predicting genital group B streptococcal colonization at delibery. Obstet Gynecol 1996; 88: 811-5.
13. Anthony BK, Okada DM, Hobel CJ. Epidemiology of group B streptococcus, longitudinal observations during pregnancy. J Infect Dis 1978; 137: 524-30.
14. CDC. Prevention of perinatal group B streptococcal disease, a public health perspective. MMWR 1996; 45 (RR-7): 1-24.
15. Regan JA, Klebanoff MA, Nugent RP. Vaginal infections and prematurity study group-the epidemiology of group B streptococcal colonization in pregnancy. Obstet Ginecol 1991; 77: 604-10.
16. Krohn MA, Hillier SL, Baker CJ. Maternal peripartum complications associated with vaginal group B streptococci colonization. J Infect Dis 1999; 179: 1410-5.
17. Maddoff LC, Kasper DL. Infección por estreptococos del grupo B en infecciones obstétricas y perinatales. De Mosby-Doyma 1994: 211-25.
18. Baker CJ, Eduards MS. Group B streptococcal infections. En: Remington JS, Klein JO, eds. Infectious diseases of the fetus and newborn. 3th Ed. Philadelphia: WB Saunders 1990: 742-811.
19. CDC. Revised Guidelines. Prevention of perinatal Group B Streptococcal Disease. August 16,2002/vol. 51/Nº RR-11.
20. NCCLS. Streptococcus spp. other than S. pneumoniae - Performance standards for antimicrobial disk susceptibility test; approved standard- 7th Ed.- Table 2H. M2- Disk diffusion - January 2000. [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ]
Aceptado para su publicación el 28 de septiembre de 2004














