Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. v.39 n.1 La Plata ene./mar. 2005
TOXICOLOGÍA
Hidrocarburos aromáticos policíclicos.Riesgos para la salud y marcadores biológicos
Carlos Mastandrea1, Carlos Chichizola1, Beatriz Ludueña1, Héctor Sánchez1, Horacio Álvarez2, Andrea Gutiérrez2
1. Bioquímico.
2. Ing. Químico.
* Alkemy-Center Lab. Departamento de Toxicología Clínica/Laboral e Higiene Industrial. Santa Fe. Argentina.
Resumen
Los Hidrocarburos Aromáticos Policíclicos (PAHs) y sus derivados se hallan en el medio ambiente y son el producto de diferentes procesos industriales y de combustión. Algunos de estos compuestos son carcinógenos y/o mutágenos y posibles disruptores endocrinos, por lo que su determinación en muestras biológicas es importante para el control de exposición. Se presenta aquí un análisis de las metodologías analíticas empleadas en la determinación de los PAHs y sus metabolitos en muestras biológicas.
Palabras clave: Hidrocarburos aromáticos policíclicos; Carcinógenos; Mutágenos; Disruptores endocrinos; Hidroxiderivados; Aductos; Biomarcadores.
Summary
Polyaromatic hidrocarbons. Helath risk and biomarkers
Polycyclic aromatic hydrocarbons (PAHs) and their derivatives are ubiquitous in the environment and they are produced in several industrial and combustion proceses. Some of the compounds are carcinogens/mutagens and act as possible endocrine disruptors. Their determination in biological samples is an important step for exposure control. A review of the analytical methodologies used for the determination of PAHs and their metabolites in biological samples is presented.
Key words: Polycyclic aromatic hydrocarbons; Carcinogens; Mutagens; Endocrin disruptors; Hydroxy derivatives; Adducts; Biomarkers.
INTRODUCCIÓN
Los Hidrocarburos Aromáticos Policíclicos (PAHs) y sus derivados están asociados al aumento en la incidencia de diversos tipos de cáncer en el hombre. Dadas las diferentes fuentes de estos compuestos y el hecho de que algunos grupos poblacionales que residen o trabajan en ambientes directamente influenciados por estas fuentes están sometidos a un riesgo mayor, se hace necesario el monitoreo biológico de exposición a estos compuestos que se puede realizar mediante la determinación de la concentración de sus metabolitos en fluidos biológicos acompañado de un efecto bioquímico resultante de su presencia en el organismo.
El objeto del presente trabajo es realizar una revisión de los Hidrocarburos Aromáticos Policíclicos, considerando sus orígenes, efectos sobre la salud y los aportes del laboratorio para evaluar la exposición a los mismos.
Los PAHs son compuestos orgánicos formados por dos o más anillos aromáticos condensados. Los anillos pueden estar en forma recta, angulados o racimados. La estructura condensada más sencilla, formada por sólo dos anillos aromáticos es el naftaleno (Fig. 1).

Figura 1. Estructura química del Naftaleno y el Benzo(a)pireno.
El Benzo(a)pireno (BaP) (Fig. 1) es uno de los PAHs que posee la capacidad de desarrollar efectos carcinogénicos, genotóxicos y/o mutagénicos y se halla presente en la mayoría de las fuentes de producción de estos compuestos. Lo anterior, sumado al tiempo de permanencia en el medio ambiente (vida media en el suelo de 162 días), hacen que este compuesto sea empleado como elemento de referencia en diferentes estudios ambientales (1)(2).
Formación: Los PAHs se forman por pirólisis o combustión incompleta de materia orgánica que contiene carbono e hidrógeno. A elevadas temperaturas, la pirólisis de compuestos orgánicos produce fragmentos de moléculas y radicales que se combinan para dar lugar a los PAHs. La composición de los productos de la pirosíntesis depende del combustible, la temperatura y el tiempo de permanencia a altas temperaturas. Los combustibles que forman PAHs son metano, otros hidrocarburos, hidratos de carbono, ligninas, péptidos, etc. Sin embargo, los compuestos insaturados y las estructuras cíclicas suelen favorecer la formación de las PAHs. Evidentemente, los PAHs se liberan de la zona de combustión en forma de vapores. Debido a sus bajas presiones de vapor, la mayoría de los PAHs se condensan en el acto sobre partículas de hollín o forman ellos mismos partículas muy pequeñas. Los PAHs liberados a la atmósfera en forma de vapor son adsorbidos por las partículas presentes en ella. Por ello, se producirá una diseminación de aerosoles que contiene PAHs, que pueden ser transportados a grandes distancias por los vientos (1-3).
Estabilidad: Los sistemas conjugados de orbitales π de los PAHs son los responsables de su estabilidad química. Son sólidos a temperatura ambiente y su volatilidad es pequeña. Dependiendo de su carácter aromático los PAHs absorben la luz ultravioleta y producen un espectro fluorescente característico. Son solubles en muchos disolventes orgánicos, pero prácticamente insolubles en agua, tanto menos cuanto mayor sea su peso molecular (1)(4).
Químicamente, los PAHs reaccionan por sustitución del hidrógeno o por adición cuando se produce la saturación, conservándose el sistema de anillos. La mayoría de los PAHs sufren fotooxidación, siendo ésta una forma para eliminarlos de la atmósfera. La reacción de fotooxidación más frecuente es la formación de endoperóxidos, que pueden convertirse a quinonas. Los PAHs reaccionan rápidamente con óxidos de nitrógeno o HNO3. Por ejemplo, el antraceno puede oxidarse a antraquinona por acción del HNO3 o dar un derivado nitrogenado mediante una reacción de sustitución con NO2. El hecho de que los PAHs considerados cancerígenos o no, al reaccionar con otras sustancias no significa que se inactiven como tales; por el contrario, muchos de ellos se transforman en cancerígenos más potentes que el correspondiente compuesto progenitor (1)(4).
Así el benzo(a)antraceno que está presente en el alquitrán de hulla, en el humo del cigarrillo, en las fábricas de gas; es un carcinógeno débil, pero algunos de sus derivados lo son mucho más como los 6-, 7-, 8- y 12-metilbenzo(a)antraceno y algunos de sus derivados dimetilados.
Utilidad de algunos PAHs
El antraceno se utiliza en la producción de antroquinona, una importante materia prima para la fabricación de colorantes rápidos. Se emplea también como diluyente para conservantes de madera y en la producción de fibras sintéticas, plásticos y monocristales.
El fenantreno se utiliza en la fabricación de colorantes y explosivos, en la investigación clínica y la síntesis de fármacos.
El benzofurano se emplea en la fabricación de resinas de cumarona-indeno.
El fluoranteno es un componente que se utiliza como material de revestimiento para proteger el interior de las tuberías de agua potable de acero y hierro dúctil y los tanques de almacenamiento (1)(2).
FUENTES DE EXPOSICIÓN
Los PAHs pueden hallarse casi en todas partes, en el aire, la tierra y el agua, procedentes de fuentes naturales o antropogénicas. La contribución de las fuentes naturales, como los incendios forestales y los volcanes, es mínima comparada con las emisiones causadas por el ser humano. La combustión de combustibles fósiles es la principal fuente de emisión de PAHs. Otras emisiones proceden de la combustión de residuos y madera, así como de los vertidos de petróleo crudo o refinado que en sí mismo contiene PAHs. Estos compuestos también están presentes en el humo del tabaco y en los alimentos a la parrilla, ahumados y fritos (5).
La principal fuente de PAHs es el aire de las atmósferas de trabajo de alquitrán de hulla, que se forman por pirólisis de la hulla en fábricas de gas y coque, donde se producen emisiones de humos de la brea calentada. Generalmente, el contenido de BaP es máximo en el aire situado en la parte superior de los hornos. El aire situado en la parte superior de los canales de humos y del precipitador de alquitrán es extremadamente rico en este compuesto, habiéndose medido concentraciones de hasta 500 mg/m3 de BaP.
En la siguiente lista se han utilizado las mediciones de BaP en diferentes tipos de lugares de trabajo para clasificarlos según el grado de exposición (1):
• Exposición muy alta a BaP (> 10 mg/m3): Trabajos en fábricas de gas y coque; plantas de aluminio; fábricas de electrodos de grafito; manipulación de breas y alquitranes calentados.
• Exposición moderada (0,1 a 10 mg/m3): Trabajos en fábricas de gas y coque; acerías; fábricas de electrodos de grafito; plantas de aluminio; fundiciones.
• Exposición baja (< 0,1 mg/m3): Fundiciones; producción de asfaltos; plantas de producción de aluminio con electrodos precocidos; talleres de reparación de automóviles y garajes; minas de hierro y construcción de túneles.
Los trabajadores que permanecen cerca de los hornos están altamente expuestos a estos PAHs. Mediante técnicas de muestreo personal, se ha podido comprobar la presencia de otros PAHs como naftaleno, fenantreno, fluoranteno, pireno y antraceno en las muestras de aire tomadas.
La producción de aluminio se realiza mediante un proceso electrolítico a temperaturas de 970 ºC. Existen dos tipos de ánodos: el de Soderberg y el de grafito ("precocido"). El primero de ellos, que es el más empleado, es la principal causa de exposición a los PAHs en la industria del aluminio. Este ánodo está formado por una mezcla de coque y alquitrán de hulla.
Los electrodos de grafito se utilizan en las plantas de reducción de aluminio, en los hornos eléctricos de acero y en otros procesos metalúrgicos. La materia prima para la fabricación de estos electrodos suele ser coque de petróleo mezclado con alquitrán como ligante. El cocido de los mismos se realiza calentando esta mezcla a temperaturas superiores a los 1.000 ºC, proceso durante el cual se liberan grandes cantidades de PAHs.
Otra fuente importante es la utilización del asfalto para pavimentar calles y carreteras que procede principalmente de los residuos de destilación del petróleo crudo. El asfalto de petróleo contiene pocos PAHs superiores. No obstante, en algunos casos este asfalto se mezcla con alquitrán de hulla, lo que aumenta el riesgo de exposición cuando se trabaja con el asfalto caliente. En otros trabajos donde se utiliza el alquitrán derretido como recubrimientos de grandes superficies (aislamiento de paredes, oleoductos, etc.), los trabajadores pueden sufrir una intensa exposición. Las fuentes de PAHs en el trabajo, además del alquitrán de hulla y el asfalto, son el negro de humo, la creosota, los aceites minerales (aceites lubricantes y aceites de corte), los humos y hollines procedentes de diferentes combustiones y los gases de escape de los vehículos (1)(2)(4).
PAHs - Efectos sobre la salud
En 1775, un médico inglés, Sir Percival Pott, describió por primera vez un cáncer de origen profesional. Asoció el cáncer de escroto de los deshollinadores con su prolongada exposición a alquitrán y hollín, en condiciones deficientes de higiene personal. En el decenio de 1930 se describió el cáncer de pulmón en los trabajadores de la industria del acero y del coque y en 1933 se demostró que el BaP, presente en el alquitrán de hulla era cancerígeno. Los estudios epidemiológicos indican una mayor frecuencia de cáncer de pulmón en los trabajadores de las industrias de coque, aluminio y acero (1)(2)(4). No todos los PAHs han mostrado poseer efectos carcinogénicos, genotóxicos o mutágenos y muchas veces el efecto se atribuye a la presencia conjunta de más de un compuesto de la familia y de algunos de sus derivados, principalmente los nitroderivados (Tabla I).
Los efectos tóxicos de algunos PAHs sobre la piel están asociados con dermatitis aguda y crónica con síntomas de quemazón, picor y edema, que son más pronunciados en las regiones de la piel expuesta. La exposición prolongada causa pigmentación en las zonas de la piel expuesta, con cornificación de las capas superficiales y telangioectasis. También se puede observar irritación de las vías aéreas superiores con bronquitis y tos crónica. En los ojos producen lagrimeo, fotofobia, edema de párpados e hiperemia conjuntival (1).
Tabla I. Datos relativos a los efectos carcinogénicos, genotóxicos y mutagénicos de algunos PAHs.

Actualmente se admite que los PAHs son previamente activados en el organismo antes de ejercer su efecto como disruptor endocrino o cancerígeno/mutágeno.
Tras la exposición prolongada pueden producir cáncer cutáneo (escroto y cara), cáncer broncogénico en vías respiratorias, cáncer de vejiga; en el sistema hematopoyético pueden originar leucemia y linfoma (2-4).
En la especie humana la vía respiratoria es considerada la más importante, particularmente para individuos ocupacionalmente expuestos, de igual manera la vía dérmica puede ser tanto o más importante.
Muchas de estas sustancias también tienen efecto negativo sobre el sistema inmunológico, característica que parece estar asociada a la capacidad carcinogénica (4).
Un esquema propuesto para la carcinogenicidad por exposición ambiental considera las siguientes etapas: exposición, activación metabólica, formación de aductos entre PAHs y ADN, mutaciones en genes críticos como, por ejemplo, el p53 (gen represor de tumores) y sucesión de mutaciones en otros genes (6-8).
Es importante recalcar que la aparición del cáncer es un proceso que involucra varias etapas, siendo también influenciado por susceptibilidad individual y otros factores, tales como la edad, sexo, etnia, estado de salud, nutrición y polimorfismo genético. En general, una mayor concentración de aductos PAHs-ADN se encuentra en personas ocupacionalmente expuestas.
En relación al efecto de los PAHs como posibles disruptores endocrinos, muchos estudios indican que diferentes compuestos químicos presentes en el ambiente, además de los PAHs, como los pesticidas, dioxinas, furanos y bifenilos policlorados, presentan actividad estrogénica in vitro. De cualquier manera la potencia de estos compuestos es muy baja comparada con estrógenos endógenos y además no está claro si los humanos ante una mezcla química ambiental reciben un efecto estrogénico neto (9).
BIOTRANSFORMACIÓN DE LOS PAHs
Los PAHs son agonistas de los receptores de hidrocarburos aromáticos (AhR) y está bien establecido que la inducción de muchas enzimas como la familia de los CYP son mediadas por los AhR.
El AhR y su patrón heterodinámico, el AhR traslocador nuclear (ARNT) y ARNT2 son miembros de la familia Per-ARNT-SIM(PAS) de factores de transcripción helix-loop-helix básicos (10).
En la unión al ligando y la liberación de la proteína 90-kDa HSP, el ARNT se une y el complejo AhR-ARNT entra al núcleo, donde en la regiones regulatorias 5´ del gen se produce la inducción de genes que codifican las enzimas de fase I y II.
La biotransformación de los PAHs involucra una serie de enzimas que catalizan reacciones de oxidación, reducción e hidrólisis (enzimas del citocromo P 450-CYP) y de enzimas que catalizan reacciones de conjugación (sulfotransferasa, epóxido hidrolasa, glutation-S-transferasa y UDP-glicotransferasa). Estos sistemas enzimáticos están distribuidos en todos los tejidos del organismo.
Las enzimas responsables de la activación metabólica de los PAHs, incluyendo el benzo(a)pireno son la CYP1A1, CYP1B1 y mucho menos la CYP1A2 conjuntamente con la epoxido hidrolasa (11). Estas dos enzimas se encuentran ampliamente distribuidas en el pulmón humano (12). En la figura 2 se representa la ruta metabólica del BaP.

Figura 2. Representación esquemática del metabolismo del Benzo(a)pireno en humanos (14). EH: Epóxido hidrolasa. GST: Glutation-S-Transferasa.
Las monoxigenasa dependientes del citocromo P 450 (CYP1A) son responsables de la oxidación enzimática de los PAHs. Ellas actúan sobre una zona de elevada densidad electrónica al nivel de la región angular de la molécula de los PAHs formando epóxidos que pueden espontáneamente formar fenoles, o por acción de las epóxido hidrolasas, producir dihidrodioles (13)(14).
De estos fenoles algunos son oxidados a quinonas y otros producen epóxidos secundarios (di-hidrodiolepóxidos), que son las formas más reactivas con el ADN. El carbono benzílico de los dihidrodiolepóxidos es capaz de reaccionar con las porciones nucleofílicas del ADN, fundamentalmente con guanidina, y eventualmente iniciar un proceso mutagénico. Reacciones semejantes se observan con otras macromoléculas como la albúmina y la hemoglobina.
Los dihidrodiolepóxidos son altamente inestables y cuando no reaccionan rápidamente, son hidrolizados a tetroles, cuya formación puede ser utilizada como bioindicador de formación de diolepóxidos.
Los fenoles, las quinonas y los dihidrofenoles pueden sufrir conjugación formando sulfatos y glucuronatos. Las quinonas y los diolepóxidos también reaccionan con el glutation (mediante una glutation-S-transferasa) y pueden ser eliminados por orina como tioéteres.
LOS PAHs Y SUS NITRODERIVADOS
Los nitroderivados de los PAHs (NPAHs), comprobados como potentes mutágenos para la Salmonella typimurium (test de Ames), para bacterias y células eucariotas (células de ovario de hamster, células epiteliales de ratón RL4). Los mononitroderivados son metabolizados generalmente a través de procesos de oxidación generando especies semejantes a las formadas por los PAHs (diolepóxidos y aminodiolepóxidos) capaces de formar aductos por reacción con la deoxiguanosina. Además, sufren igualmente reacciones de reducción del grupo nitro a N-hidroxilamina con formación de un intermediario capaz de reaccionar con el C-8 de la deoxiadenosina formando aductos (15). En general, los dinitroderivados son más potentes mutagénicos que los mononitroderivados.
Aspectos moleculares de los PAHs y sus nitroderivados
De acuerdo a lo anteriormente expuesto los PAHs y sus nitroderivados no son mutagénicos/cancerígenos directos, sino que necesitan sufrir una activación metabólica previa para tornarse capaces de reaccionar con el ADN u otras macromoléculas.
Es probable que el ataque electrofílico del ADN por los epóxidos ocurra por medio de un mecanismo de tipo SN1 que es un proceso a través de estados de transición en los cuales el hidrocarburo exhibe un importante carácter de ión carbonio. Así, la reactividad con el ADN, y consecuentemente la capacidad carcinogénica de estos compuestos, estaría directamente relacionada con la capacidad de formar estos iones (17).
Algunas relaciones han sido encontradas entre modelos teóricos que envuelven algunos parámetros moleculares como los orbitales moleculares de más baja energía, la hidrofobicidad y el número de anillos aromáticos con la mutagenicidad (18).
Los intermediarios electrofílicos que reaccionan con grupos nucleofílicos del ADN también reaccionan con grupos nucleofílicos de otras macromoléculas, como la albúmina, la hemoglobina, etc. En muchos casos se ha observado una buena correlación entre la cantidad de aductos formados por reacción con proteínas a los formados con el ADN.
Marcadores biológicos de exposición
El monitoreo biológico de exposición a estos compuestos se puede realizar mediante la determinación de la concentración de sus metabolitos en fluidos biológicos acompañado de un efecto bioquímico resultante de su presencia en el organismo, como los presentados en la Tabla II.
Se debe recordar que un indicador biológico de dosis interna indica la cantidad total de sustancia introducida en el organismo. Usualmente se trata de la propia sustancia o uno de sus metabolitos.
Un indicador de dosis biológica efectiva indica la cantidad de sustancia que actuó sobre sitios biológicos significativos. Generalmente esta indicación está dada a través de productos de interacción de la sustancia o sus metabolitos con macromoléculas celulares (ADN, ARN o proteínas).
En general, las sustancias electrofílicas son capaces de reaccionar con sitios nucleofílicos de macromoléculas biológicas formando aductos. Una vez que se han formado los aductos con ADN en una etapa crítica de la carcinogénesis química, la determinación de estos compuestos puede ser útil como bioindicador precoz para el cáncer.
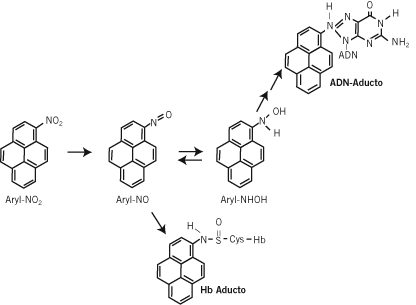
Figura 3. Activación metabólica del 1-nitropireno y la formación de aductos de ADN y hemoglobina (16).
Tabla II. Información aportada por los diferentes biomarcadores de exposición a los PAHs y sus derivados (19)(20).

A. Investigación de aductos con ADN y otras proteínas
Uno de los métodos más utilizados para la cuantificación de aductos de DNA es el realizado por marcación con 32P (21)(22).
Normalmente, la determinación cuantitativa del DNA químicamente alterado por formación de aductos, no es fácil debido a las pequeñas concentraciones de estos compuestos, a la eficiencia de los mecanismos biológicos de reparación, a la dilución de los aductos por la división celular y la dificultad de poner en evidencia al DNA humano, sobre todo teniendo en cuenta la gran variedad de órganos blancos de diversos PAHs.
Por esto, se ha puesto particular atención en el estudio de los aductos formados por reacción entre los agentes carcinógenos y las proteínas, como indicadores de nivel de reacción con el ADN. La hemoglobina es una proteína utilizada en estas técnicas y tiene una vida media de 120 días, pudiendo servir como indicador de exposición a agentes mutagénicos durante este período. Algo similar ocurre con la albúmina, que es una proteína sintetizada por el hígado, posee una vida media de 21-25 días y sirve como transportadora de compuestos lipofílicos. Los dihidrodiolepóxidos de muchos PAHs pueden formar ésteres con los residuos del ácido aspártico o glutámico de la albúmina.
Esquemáticamente se describen los pasos a seguir para realizar la investigación de aductos de la albúmina (23):
• Precipitación de las globulinas del plasma con solución saturada de sulfato de amonio.
• Precipitación de la albúmina a pH 4,5 a partir del sobrenadante.
• Digestión con pronasa (enzima proteolítica) (16 h, 37 ºC).
• Hidrólisis alcalina (2 h, pH 11, 80 ºC)
• Extracción con cartuchos de fase reversa C18.
• Extracción con acetato de etilo.
• Separación y recolección de las fracciones por HPLC.
• Extracción de las fracciones deseadas con acetato de etilo.
• Derivatización y análisis por GC-MS.
B. Investigación de metabolitos hidroxilados
La determinación de metabolitos hidroxilados de los PAHs, consiste en técnicas no muy trabajosas y que pueden ser empleadas en forma rutinaria en trabajadores expuestos. Generalmente la determinación de estos metabolitos urinarios (indicadores de dosis interna), no brindan información exacta sobre el riesgo carcinogénico (24).
La determinación de 1-hidroxipireno (metabolito del pireno), 3-hidroxibenzo(a)pireno (metabolito relacionado al benzo(a)pireno), 1-,2-,3-,4,-,9-hidroxifenantreno (productos del fenantreno), 1-,2-naftol (relacionados al naftaleno), han sido propuestos por diferentes autores con este propósito (Tabla III).
El pireno, si bien no es cancerígeno y sus efectos genotóxicos son limitados (Tabla I) es un elemento que está presente en la mayoría de los ambientes de trabajo donde existe una potencial liberación de PAHs. Por ello, el producto de su degradación metabólica, el 1-hidroxipireno, excretado por orina, es considerado en
diferentes trabajos científicos como el mejor indicador biológico de exposición a los PAHs (Tabla III).
No obstante, debido a que la composición de las mezclas de PAHs en los diferentes ambientes industriales no es fija y la proporción de pireno es variable, aún no se ha establecido un límite de exposición biológico para su metabolito, el 1-hidroxipireno (ACGIH) (25). No obstante R. Lawerys (2), propone un valor de referencia inferior a 2 µg/g creat. (1,04 µmol/mol creat). Por otro lado se puede observar en los no expuestos laboralmente la diferencia entre fumadores y no fumadores, demostrando que el hábito de fumar es una importante vía de ingreso de PAHs.
La determinación de 1-hidroxipireno (1-OHP) y 3-hidroxibenzo(a)pireno (3-OHBaP) en orina comprende los siguientes pasos (26-28):
• Una fracción de orina se mezcla con un buffer de acetato (pH:5) y se trata enzimáticamente con glucuronidasa-arilsulfatasa. Se incuba 12 h a 37 ºC.
• Luego de la hidrólisis enzimática se extraen los metabolitos empleando cartuchos rellenos con fase reversa RP-18.
• Luego del lavado y secado de los cartuchos, se eluyen los compuestos a analizar con acetonitrilo.
• Una fracción del eluido se aplica en el sistema cromatográfico.
Dado que los diferentes metabolitos de PAHs poseen fluorescencia nativa, el método por HPLC con detección fluorométrica brinda una elevada sensibilidad al método pudiendo detectarse niveles inferiores a 0,10 µmol/L, empleando pequeños volúmenes de muestra. En la Figura 4 se representa un cromatograma correspondiente a una muestra de orina que contiene 20 ng/L de 1-OHP y 3-OHBaP.
Límites de exposición aceptados
El largo período de latencia entre la primera exposición y la aparición de los síntomas, junto a muchos otros factores, ha hecho que el establecimiento de valores límite umbral para los PAHs en la atmósfera del lugar de trabajo sea una tarea ardua y difícil. Recién en 1967, la conferencia Americana de Higienistas Industriales del Gobierno de Estados Unidos (ACGIH) adoptó un Valor Límite Umbral (TLV) de 0,2 mg/m3 para los alquitranes de hulla volátiles, definiéndose como el peso de la fracción soluble en benceno de las partículas recogidas en un filtro. En 1997, la Administración sobre Salud y Seguridad Ocupacional (OSHA) de Estados Unidos estableció un Límite de Exposición Permisible (PEL) para el BaP de 0,2 mg/m3. El Límite de Exposición Recomendado (REL) por el Instituto Nacional de Salud y Seguridad Ocupacional (NIOSH) de Estados Unidos es de 0,1 mg/m3 (fracción extraíble en ciclohexano).
Tabla III. Comentarios de diferentes autores en relación a biomarcadores de exposición a los PAHs.

Figura 4. Cromatograma correspondiente a una muestra de orina que contiene 20 ng/L de 1-OHP y 3-OHBaP.
CONCLUSIÓN
Muchos de los biomarcadores propuestos para el estudio de exposición a mezclas químicas presentan limitaciones que van desde la baja sensibilidad a una gran variabilidad de los resultados obtenidos, mostrando la influencia de factores no totalmente controlados sobre las metodologías y reforzando la necesidad de validar las mismas. Particularmente esto ocurre con la investigación de aductos de ADN o proteínas, donde las complejas metodologías necesitan de mucha experiencia en el área.
En muchos casos, la existencia de otros agentes que pueden influenciar sobre los resultados, como el hábito de fumar o las mismas dificultades técnicas limitan su utilización. La importancia y actualidad del tema conjuntamente con las limitaciones analíticas disponibles justifican la necesidad de profundizar las investigaciones científicas.
Indicadores bioquímicos específicos de exposición, como el 1-OHP urinario se utilizan con buenos resultados en los estudios de exposición humana a determinados PAHs.
También es importante acompañar la investigación de marcadores biológicos con estudios de la composición química del aire en las áreas de trabajo, como lo establecen diferentes organismos internacionales (ACGIH,OSHA, NIOSH).
Todos aquellos avances en la vigilancia ambiental, el control biológico de la exposición y la detección de efectos biológicos que permitan evaluar el riesgo de contraer enfermedad deberían ser acompañados con medidas en salud laboral y seguridad industrial que reduzcan la producción y exposición a los PAHs y sus derivados.
Correspondencia
DR. CARLOS MASTANDREA
San Lorenzo 2780
S3000EUL Santa Fe. República Argentina
Tel./Fax: 54-342-455-1615
E-mail: cmastandrea@alkemyweb.com
Referencias bibliográficas
1. Stellman JM, McCan M. Hidrocarburos poliaromáticos. En: Enciclopedia de Salud y Seguridad en el Trabajo. 3ª edición. Madrid: Organización Internacional del Trabajo. Ministerio de Trabajo y Asuntos Sociales - Subdirección General de Publicaciones. 1998. p. 310-9.
2. Lawerys RR. Cánceres de Origen Profesional. En: Toxicología Industrial e Intoxicaciones Profesionales. Barcelona, Madrid: Masson S.A.; 1994. p. 553-76.
3. Ellenhorn MJ. Polycyclic Aromatic Hydrocarbons. En: Ellenhorn's Medical Toxicology: Diagnosis and Treatment of Human Poisoning. Second edition. Baltimore: Williams & Williams. 1997. p. 1420-47.
4. World Health Organization. International Programme on Chemical Safety (IPCS): Environmental Criteria 202. Selected non-heterocyclic PAHs. Geneva. WHO. 1998.
5. Kaserouni N, Sinha R, Hsu CH, Greemberg, Rothman N. Analysis of 200 food items for benzo[a]pyrene and estimation of its intake in an epidemiologic study. Food Chem Toxicol 2001; 39 (5):423-36.
6. Krewski D, Thorslund T, Withey J. Carcinogenic risk assessment of complex mixtures. Toxicology and Industrial Health 1989; 5: 851-67.
7. Jones S, Moore L, Shenk J, Wisely G. The pregnane X receptor: a promiscuous xenobiotic receptor that has diverged during evolution. Mol Endocrinol 2000; 14: 27-39.
8. Denissenko M, Pao A, Tang M. Preferential formation of benzo(a)pyrene adducts at lung cancer mutational hotspots in P53. Science 1996; 274: 430-2.
9. Liehr JG. Is estradiol a genotoxic mutagenic carcinogen? Endoc Rev 2000; 21: 40-54.
10. Hirose K, Morita M, Ema M. CDNA cloning and tissue-specific expression of a novel basic helix-loop-helix/PAS factor (Arnt2) with close sequence similarity to the aryl hydrocarbon receptor nuclear translocator (Arnt). Mol Cell Biol 1996; 16: 1703-6.
11. Keith B, Adelman D, Simon M. Targeted mutation of the murine arylhydricarbon receptor nuclear translocator 2 (Arnt 2) gene reveals partial redundancy with Arnt Proc Nath Acad sci USA. 2001; 98: 6692-7.
12. ShimadaT, Hayes C, Yamazaki H. Activation of chemically diverse procarcinogens by human cytochrome P450-1B1. Cancer Res 1996; 56: 2979-84.
13. Spivack S, Hurteau G, Reilly A, Aldours K. CYP1B1 expresion in human lung. Drug Metab Dispos 2001; 29: 916-22.
14. US Department of Health and Human Services (ATSDR).Toxicological profile for polycyclic aromatic hydrocarbons (PAHs)(Update). Atlanta, GA, US. 1995.
15. Talaska G, Underwood P, Maier A, Rothman N. Plycyclic aromatic hydrocarbons (PAHs), nitro-PAHs and related environmental compounds: Biological markers of exposure and effects. Environ Health Persp 1996; 104 (suppl 5): 901-6.
16. Neuman HS, Albrecht O, van Dorp C, Zwirner-Baier I. Macromolecular Adducts Caused by Environmental Chemicals. Clin Chem 1995; 41 (12): 1835-40.
17. Harvey R, Szeliga J, Lee H, Page J, Ross H, Routledge M, et al. Reaction with DNA and mutagenic specificity of syn-Benzo(g)chrysene 11,12-Dihydrodiol 13,14-epoxide. Chemical Research in Toxicology 1994; 7 (3): 420-7.
18. Winston G, Traynor C, Shane B, Hajos A. Modulation of the mutagenicity of three dinitropyrene isomers in vitro by rat-liver S9, cytosolic, and microsomal fractions following chronic ethanol ingestion. Mutat Res 1992; 279 (4): 289-98.
19. Neuman H. The role of biological monitoring in exposure control risk assessment and in defining acceptable limits for genotoxic. Symposium on exposure limits for occupational and environmental chemical pollutants, Prague, Czchoslovakia, Sc Total Environ 1989; 101 (1-2): 159.
20. Gandjean P. Biomarkers in Epidemiology. Clin Chem 1995; 41 (12): 1800-3.
21. Li K, Todorovic R, Rogan E, Jankoviak R. Identification and quantitation of dibenzo(a,I)pyrene-DNA adducts formed by rat liver microsomes in vitro: preponderance of depurinating adducts. Biochemistry 1995; 34 (25) 8043-9.
22. Scheppers P, Beenakkers M, Lepper A. Immunochemical detection of metabolites of parent and nitro polycyclic aromatic hydrocarbons in urine samples from persons occupationally exposed to diesel exhaust. Fresenius J Anal Chem 1995; 351 (7): 660-9.
23. Frank S, Renner T, Ruppert T. Determination of albumin adducts of (+)-anti-benzo(a)pyrene-diol-epoxide using an high-performance liquid chromatographic column awitching technique for sample preparation and gas chromatography-mass spectrometry for the final detection. Journal Chromat B 1998; 713: 331-7.
24. Greim H, Csanady G, Filser J, Werner S. Biomarkers as tools in human health risk assessment. Clin Chem 1995; 41 (12): 1804-8.
25. Threshold limit values and biological exposure Indices. En: American Conference of Govermental Industrial Hygienist. 8th Edition. USA. American Conference of Govermental Industrial Hygienist 2000.
26. Gundel J, Angerer J. High-Performance liquid chromatographic method with fluorescence detection of 3-hydroxybenzo(a)pyrene and 3-hydroxybenz(a)antrhacene in the urine of polycyclic aromatic hydrocarbon-exposed workers. J Chrom B 2000; 738: 47-55.
27. Simon P, Delsaut P, Nicot T. Automated column-switiching high-performance liquid chromatography method for the determination of 1-hydroypyrene in human urine. J Chrom B 1999; 732: 91-101.
28. Boogaard P, Van Sittert N. Urinary 1-hydroxypyrene as biomarker of exposure to polycyclic aromatic hydrocarbons in workers in petrochemical industries: baseline values and dermal uptake. The Science of the total Environment 1997; 163: 203-9.
29. Tolos W, Shaw P, Lowry L. 1-Pyrenol: A biomarker for Occupational Exposure to Polycyclic Aromatic Hydrocarbons. Appl Occup and Environ Hyg 1990; 5 (5): 303-9.
30. Gardiner K, Hale K, Walton S. Urinary 1-hydroxypirene: A biomarker for polycyclic aromatic hydrocarbons exposure in coal liquefaction workers. Occupational Medicine (Oxford). 1995; 45 (2): 63-8.
31. Grimmer G, Dettbarn G, Jacob J. Biomonitoring of poly-cyclic aromatic hydrocarbons in highly exposed coke plant workers by measurement of urinary phenanthrene and pyrene metabolites. Int Arch Occup Environ 1993; 65, 189-99.
32. Bienik G. The presence of 1-naphthol in the urine of industrial workers exposed to Naphthalene. Occup Environ. Medicine. 1994; 51: 357-9.
33. Hansen A, Omland O, Poulsen O. Correlation between work process-related exposure to polycyclic aromatic hydrocarbons and urinary levels of alpha-naphthol, beta-naphthylamine and 1-hydroxypirene in iron foundry workers. Int Arch Occup Environ Health 1994; 65: 385-94.
34. Gûndel J, Mannchreck K, Buttner K, Angerer J. Urinary levels of 1-hydroxypyrene 1,2,3 and 4-hydroxyphena- threne in females living in an industrial area of germany. Arch Environ Contam Toxicol 1996; 31 (4): 585-90.
35. Grimmer G, Jacob J, Dettbarn G. DNA single strand breakage, DNA adducts, and sister chromatid exchange in lymphocytes and phenanthrene and pyrene metabolites in urine of coke oven workers. Ocup Environ Med 1997. 654 (3): 176-83.
36. Merlo F, Andreassen A, Haugen A. Urinary excretion of 1-hydroxypyrene as a marker for exposure to urban air levels of polycyclic aromatic hydrocarbons. Cancer Epidemiology, Biomarkers & Prevention 1998; 7: 147-55.
37. Wu M, Mao I, Chen M. Temporal changes in urinary 1-hydroxypyrene concentrations in coke-oven workers. Cancer Epidemiology, Biomarkers & Prevention 1998; 7:169-73.
Aceptado para su publicación el 22 de diciembre de 2004














