Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. v.39 n.2 La Plata mar./jun. 2005
HEMOSTASIA Y TROMBOSIS
Aislamiento de una fracción pequeña del dermatán sulfato con potencial aplicación terapéutica
Eduardo Francisco Recondo1*, Graciela Cristina Calabrese2**, María Fabiana Alberto3***, María Lazzari4***, Marta Elena del Valle Fernández de Recondo5**
1. Doctor en Química.
2. Doctora en Bioquímica.
3. Bioquímica.
4. Doctora en Medicina.
5. Doctora en Bioquímica y Farmacéutica.
* Departamento de Química Biológica, Facultad de Ciencias Exactas y Naturales, Universidad de Buenos Aires. Ciudad Universitaria de Núñez, (1428) Ciudad Autónoma de Buenos Aires, Argentina.
** Cátedra de Biología Celular, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires. Junín 954, (1113) Ciudad Autónoma de Buenos Aires, Argentina.
*** Departamento de Hemostasia y Trombosis. Academia Nacional de Medicina. Ciudad Autónoma de Buenos Aires, Argentina.
Resumen
El descubrimiento del cofactor II de la heparina (HCoII), desplazó el enfoque de las investigaciones sobre el mecanismo de la coagulación desde la heparina, que se encuentra fundamentalmente en los mastocitos, hacia el dermatán sulfato (DS) que posee una distribución mucho más amplia en los tejidos y en las paredes de los vasos sanguíneos. El nuevo cofactor de la heparina es el único cuya actividad anticoagulante es estimulada por el DS, en concentraciones diez veces menores que la heparina y el heparán sulfato (HS). Se ha descripto el aislamiento de fracciones de la heparina con muy alta actividad anticoagulante a través de la interacción con la Concanavalina A y con la primera proteína del sistema del complemento (C1). En ambos casos fueron imprescindibles condiciones de baja fuerza iónica y presencia de iones calcio. Los experimentos con la heparina se extendieron al DS en presencia del C1, utilizando las mismas condiciones experimentales descriptas, y se determinaron la actividad biológica y el grado de sulfatación de las subpoblaciones aisladas después de la interacción. Se obtuvo en el precipitado una fracción del DS de bajo peso molecular con una actividad anticoagulante cuatro veces mayor que el material inicial, un contenido en sulfatos aproximadamente tres veces mayor, y tres veces más capacidad de inhibición de la formación de trombos. El peso molecular de esta fracción es inferior a 8.000 Daltons.
Palabras clave: Dermatán sulfato de bajo peso molecular; Alto contenido en sulfato; Poder de disolución de trombos; Interacciones moleculares; Primer componente del sistema del complemento; Cofactor II de la heparina; Baja fuerza iónica; Iones calcio
Summary
Isolation of a small fraction of dermatan sulfate with potencial therapeutical application
Heparin is mainly found in mastocytes, and during many decades the studies of the coagulation mechanism were focused on this hetero-polysaccaride. Dermatan sulfate has a more abundant distribution on tissues and on the blood vascular system. On the other hand, the anticoagulant activity of the second cofactor of heparin is stimulated by dermatan sulfate, but using ten times less concentration than heparin. Our earlier experiments with heparin and Concanavalin A, and heparin and the first protein of the complement system, C1, have shown the isolation in the heparin molecule by precipitation with both proteins of fractions with very high anticoagulant activity. In both cases the use of very low ionic strength and the presence of calcium ions were necesary. We have extended those experiments to the interaction with dermatan sulfate, and we have also obtained a fraction of dermatan sulfate in the precipitate with very low molecular weight, and with four times higher anticoagulant activity than the fraction that remains in the supernatant. The sulfate content of this fraction is three times higher, as well as its capacity for thrombous inhibition. Molecular weight of this fraction is 8000 Daltons.
Key words: Dermatán sulfate; Low molecular weight; High sulfate content; Thrombous dissolution; First component of the complement system; Molecular interactions; low ionic strength; Calcium ions; Heparin cofactor II
INTRODUCCIÓN
El dermatán sulfato (DS) pertenece a la familia de heteropolisacáridos denominados glicosaminoglicanos (GAGs) que se encuentran en los organismos unidos a un núcleo proteico formando macromoléculas llamadas proteoglicanos. Estos se pueden hallar ya en las superficies de las células o bien en la matriz extracelular y desempeñan importantes funciones para las interacciones entre célula y célula, y célula y matriz extracelular. Se los encuentra prácticamente en todos los organismos vivos y en casi todos los tejidos, a saber, piel, músculo esquelético, tendones, vasos sanguíneos, huesos y cartílagos. En el caso particular del DS se han identificado diversos proteoglicanos que difieren en el número de cadenas de heteropolisacáridos unidos a la proteína, como máximo 25 a 30 en los más grandes, y pequeños proteoglicanos como la decorina y el biglicano con una y dos cadenas de DS respectivamente unidas a la proteína. La trombomodulina es otro proteoglicano que se encuentra en la superficie luminal del endotelio vascular y en las células musculares lisas por debajo de dicho endotelio; contiene, como la decorina, una única cadena de GAG. Tanto la trombomodulina como la decorina y el biglicano pueden actuar como anticoagulantes inhibiendo la trombina (T), y pueden hacerlo directamente a través de la antitrombina (AT), o en el caso de la trombomodulina, indirectamente activando la proteína C, que, en presencia de la proteína S y fosfolípidos (PL) inactiva los factores VIII y V de la coagulación (1).
Al descubrirse en la década de los 80 que, además de la AT, existía un segundo cofactor de la actividad anticoagulante de la heparina, el llamado cofactor II de la heparina (HCoII), se introdujo un nuevo enfoque en las investigaciones sobre el mecanismo de la coagulación, desplazando los estudios desde la heparina, que se encuentra fundamentalmente en los mastocitos, hacia el DS que posee una distribución mucho más amplia en los tejidos y en las paredes de los vasos sanguíneos (2). En efecto, el nuevo cofactor de la heparina que es secretado por el hígado hacia la corriente sanguínea, es el único en la familia de las serpinas cuya actividad anticoagulante es estimulada por el DS, además de serlo por la heparina y el heparán sulfato (HS). Se ha demostrado que la velocidad de inhibición de la trombina por el HCoII aumenta más de 1.000 veces en presencia de los tres GAGs, pero en contraste con lo que ocurre con la AT, el HCoII se une a la heparina con mucha menor afinidad y se requiere una concentración 10 veces mayor que la del DS para obtener la misma aceleración de la inhibición de la trombina (3-5).
El objetivo fundamental de esta investigación ha sido estudiar en profundidad el mecanismo del reconocimiento entre las macromoléculas de importancia biológica. En particular el estudio de la cascada de la coagulación y su inhibición por la antitrombina, que es un proceso lento en ausencia de la heparina, pero cuya velocidad aumenta drásticamente en su presencia a través de la interacción entre la antitrombina y ese GAG. La incógnita era cómo moléculas que difieren sustancialmente en su estructura química son capaces de reconocerse íntima y específicamente y contribuir a la formación de un complejo muy estable con la trombina, e inhibirla irreversiblemente para accionar sobre el fibrinógeno, transformarlo en fibrina y, posteriormente, construir la red del coágulo. Paralelamente, un mecanismo similar ocurre cuando intervienen el DS y el HCoII.
Un gran avance en ese reconocimiento se logró entre 1976 y 1980 cuando en varios laboratorios, pero principalmente los de Lindahl en Suecia y Rosenberg en los EE.UU. se demostró que solamente un tercio de la molécula de heparina poseía gran actividad anticoagulante. El análisis de la estructura química de esa fracción permitió identificar el segmento de la molécula de heparina que se une a la antitrombina, el cual resultó ser un pentasacárido (6)(7). Como muestra la Figura 1, el disacárido de la unidad repetitiva está formado por un ácido urónico y una hexosamina cuya unión se realiza entre el carbono 1 del urónico y el 4 de la hexosamina en el caso de la heparina, pero con el carbono 3 cuando se trata de un DS. En ambos GAGs predomina casi absolutamente el ácido idurónico lo que les da propiedades biológicas especiales. La hexosamina presente es la glucosamina para la heparina, pero cambia a una hexosa muy similar, la galactosamina, en el DS. Ambos GAGs poseen, además, diversos grupos sulfatos que bloquean algunos hidroxilos de las hexosaminas y el hidroxilo 2 del ácido idurónico. Estos sulfatos y los carboxilos de los ácidos urónicos son los responsables del comportamiento como electrolitos de los dos GAGs. Sus abundantes cargas negativas les otorgan una gran capacidad de unirse a proteínas a través de las cargas positivas que aportan las cadenas laterales de aminoácidos como la lisina o arginina.

Figura 1. Estructura de la unidad disacarídica repetitiva del dermatán sulfato.
En lo que respecta al DS y su unión al HCoII, Maimone y Tollefsen (8) demostraron que el sitio de gran afinidad por el HCoII era en ese caso un hexasacárido constituido por tres unidades iguales del disacárido idurónico 2 sulfato, N-acetilgalactosamina 4 sulfato, aunque la posición de este último sulfato (en 4 o en 6) es dependiente de la especie en estudio o del tejido de donde se aísla el DS. En todos los casos se requiere un mínimo de 12 a 14 unidades de monosacáridos para obtener una actividad anticoagulante significativa (9).
En nuestro laboratorio se ha tomado como modelo para estudiar la relación entre la estructura de los GAGs y sus propiedades biológicas el complejo que ellos forman con la Concanavalina A (Con A). Se ha descripto el aislamiento de fracciones de la heparina no fraccionada (UFH), heparina de bajo peso molecular (LMWH) y DS con muy alta actividad anticoagulante a través de la interacción con esa lectina. Para ello resultaron imprescindibles condiciones de baja fuerza iónica y presencia de iones calcio (10-12). En el caso del DS la fracción que se une a la Con A a pH 4,4 tiene en promedio más de 5 veces la actividad anticoagulante específica que la que queda en el sobrenadante. Esta fracción constituye menos del 10% de la cantidad original de DS. En relación con los grupos sulfatos presentes se comprobó que por hidrólisis ácida con HCl 0,1M a 100.ºC se van liberando dichos grupos y paralelamente se va perdiendo la actividad anticoagulante. Así, en 5 min, más del 50% es liberado y la actividad anticoagulante descendió al 60%. Entre los 5 y los 10 min del tiempo de hidrólisis se frena la disminución de la actividad anticoagulante y no hay tampoco liberación de grupos sulfatos. Pero al llegar a los 20 min de tratamiento ácido la actividad anticoagulante cae a cero y se eliminan prácticamente todos los grupos sulfato. Esta pausa en la hidrólisis ácida de dichos grupos tiene su explicación en la conocida mayor estabilidad de los grupos que esterifican los hidroxilos primarios de los azúcares. En particular para el DS, el carbono primario de la posición 6 de la acetil galactosamina (13).
La idea subyacente en los primeros experimentos de los autores con la Con A era que las condiciones específicas necesarias de baja fuerza iónica y presencia de iones calcio tenían un carácter más general para que pudieran reconocerse entre sí macromoléculas tan distintas como las proteínas y los heteropolisacáridos (Con A y heparina en este caso particular). Por otra parte, se conocía por los estudios realizados en los últimos 25 años que la heparina regula muchos de los pasos de la cascada del complemento y, por trabajos más recientes, que inhibe in vivo la activación del sistema del complemento (14). Consecuentemente y buscando condiciones más fisiológicas para estos experimentos surgió naturalmente la extensión de los mismos a la interacción con C1, la primera proteína del sistema del complemento, o con su subunidad C1q.
Esta hipótesis de trabajo fue confirmada por los experimentos pues se obtuvieron resultados similares en la interacción del C1 tanto con la heparina no fraccionada (UFH) como con la heparina de bajo peso molecular (LMWH) (15-17). En ambos casos se pudo seleccionar en el precipitado de la interacción una subpoblación con gran afinidad por la AT. Estos resultados no coincidían con lo que se venía afirmando en publicaciones de varios laboratorios acerca de la independencia de las actividades anticoagulantes y de inhibición del complemento de la heparina (18). Sin embargo, la contradicción era sólo aparente ya que el uso de baja fuerza iónica y la presencia de iones calcio son condiciones específicas e imprescindibles para la obtención de aquellos resultados.
Finalmente, al igual que con la Con A se extendieron los experimentos con UFH y LMWH al DS en presencia del C1, utilizando las mismas condiciones experimentales descriptas, y se determinaron la actividad biológica y el grado de sulfatación de las subpoblaciones aisladas después de la interacción. Se obtuvo en el precipitado una fracción del DS de bajo peso molecular con cuatro veces más actividad anticoagulante que el material inicial, aproximadamente con más de tres veces en el contenido en sulfatos y con casi tres veces más capacidad de inhibición de la formación de trombos. El peso molecular de esta fracción es inferior a los 8.000 Daltons (19).
La muestra del DS de pureza analítica fue donada por el Licenciado Víctor Díaz.
La IgG-agarosa (A-6284) y los marcadores de pesos moleculares para los GAGs se compraron en Sigma (St. Louis, USA).
Los marcadores de pesos moleculares para proteínas se compraron en Bio-Rad Labs (Richmond, Canadá).
El sustrato cromogénico S-2238 se obtuvo a través de Chromogenix (Mondal, Sweeden).
Los demás reactivos fueron de pureza analítica o superior.
Aislamiento y purificación del complejo C1
El complejo proteico C1 se aisló como se describió previamente siguiendo la técnica de Bing (23), a partir de la fracción de euglobulinas precipitada del plasma humano por ajuste del pH.
El C1 se purificó por cromatografía de afinidad en IgG-agarosa y la pureza del producto se confirmó por electroforesis en gel de poliacrilamida.
Interacción entre el DS y la proteína C1
Los ensayos se realizaron en condiciones experimentales muy estrictas de baja fuerza iónica (25 mM) y presencia de iones calcio (2 mM final) (16). La reacción se inició por agregado de una solución de C1. Se leyó a 420 nm la turbidez desarrollada después de 1 h a 37 ºC. Se separó por centrifugación a 5.000 rpm durante 25 min el precipitado de DS (DS-pp) del que queda DS-libre en el sobrenadante (DS-libre). El DS-pp se disolvió por el agregado de 0,5 mL de ClNa 300 mM que disoció el complejo ternario formado, liberó el DS y desnaturalizó al C1 que precipita.
La concentración del DS se determinó por el método de Rodríguez Montelongo y col. que se basa en la reacción de los hidratos de carbono con el indol en HCl (13).
La concentración de sulfatos del DS material de partida y de sus subpoblaciones fue determinada por el método del rodizonato de sodio (24). La localización de los grupos sulfato fue analizada por RMN de 13C. El peso molecular del DS material de partida y el de sus subpoblaciones fue determinado por electroforesis en gel de poliacrilamida al 6%; el gel fue teñido luego de la corrida con azul de toluidina al 0,1% en ácido acético.
La actividad biológica in vitro del DS material de partida y de sus subpoblaciones fue determinada mediante la medida de la actividad residual de la trombina sobre el sustrato cromogénico S2238.
Estudio de la actividad biológica in vivo
Los experimentos in vivo fueron realizados con ratas macho Wistar a las que se les administró por vía endovenosa las distintas subpoblaciones del DS y solución fisiológica como control, de acuerdo al modelo de trombosis inducida por doble ligadura de la vena cava inferior descripto por Doutremepuich y col. (25).
RESULTADOS
La Tabla I muestra la distribución del DS entre el DS-pp y el DS-libre para una relación DS/C1= 5, y la actividad anticoagulante y el contenido en sulfatos de las subpoblaciones. En las condiciones empleadas se aisló en el precipitado el 5,85% del total del DS empleado, que posee una actividad anticoagulante más de 4 veces mayor que el material inicial y un contenido en sulfatos que casi triplica el original. La Figura 2 muestra el espectro de RMN 13C obtenido para la muestra de DS material de partida; se puede apreciar la sulfatación del C2 del ácido idurónico y del C4 y C6 de la N-acetilgalactosamina. Estos resultados concuerdan con los de otros laboratorios en relación con la exigencia de secuencias del DS con alto contenido en sulfatos para la estimulación de la actividad catalítica del HCoII. La Figura 3 muestra la fotografía de la electroforesis en gel de poliacrilamida correspondiente al DS material de partida y a las subpoblaciones obtenidas a través de la interacción con el complejo C1. La fracción del DS que es reconocida específicamente por la proteína C1 posee un peso molecular por debajo de 8.000 Daltons. Los resultados del estudio de la actividad biológica in vivo se muestran en la Figura 4. En el precipitado de la interacción con el complejo C1 se aísla la subpoblación de DS que concentra la actividad trombolítica.
Tabla I. Distribución, contenido en grupos sulfato y actividad biológica de las subpoblaciones de dermatán sulfato.
Figura 2. Espectro de resonancia magnética nuclear de 13C correspondiente al dermatán sulfato de alto peso molecular.

Figura 3. Electroforesis en gel de poliacrilamida de las subpoblaciones de dermatán sulfato.
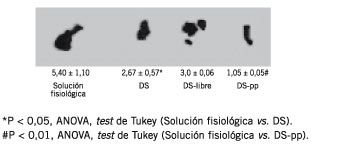
Figura 4. Actividad trombolítica in vivo de las subpoblaciones de dermatán sulfato.
DISCUSIÓN Y CONCLUSIONES
Los desórdenes vasculares y la trombosis son una de las causas principales de mortalidad en todo el mundo, y, desde hace más de 50 años, la UFH ha jugado un papel principal en la prevención y el tratamiento de esas patologías. Se conocen los efectos secundarios adversos de la UFH, a saber, la producción de hemorragias y la inducción de la disminución de las plaquetas, pero a pesar de ello la UFH sigue siendo el anticoagulante de elección tanto en la prevención y el tratamiento de las trombosis arterial y venosa, como así también en la cirugía. Hace 15 años surgieron las LMWHs obtenidas por despolimerización química de la UFH que resulta en fragmentos de aproximadamente un tercio del peso molecular original (entre 4.000 y 8.000 Daltons). Poseen las propiedades de los componentes de la UFH de menor peso molecular y tienen algunas ventajas sobre la sustancia madre: mayor biodisponibilidad, mayor duración en su acción y menor toxicidad pues su incidencia en trombocitopenia es mucho menor que con la UFH. Una desventaja en su uso es la heterogeneidad en su estructura, lógica consecuencia de las diferencias en los métodos químicos y enzimáticos utilizados para su síntesis. A diferencia de la UFH las LMWHs no son intercambiables sobre la base de la relación dosis/potencia.
La introducción de las LMWHs representó un gran avance en el uso de la heparina que se reflejó en el crecimiento exponencial de sus ventas en los últimos 10 años, mientras las de la UFH permanecieron estables en el mismo período. Sin embargo, según Fareed y col. (26) en los próximos años se producirán avances en el uso de la UFH y las LMWHs que significarán un mejor conocimiento del mecanismo de los desórdenes cardiovasculares y trombóticos. Dichos avances incluirán el uso de nuevas drogas, modificaciones de las heparinas, identificación de las diferencias entre las LMWHs, desarrollo de un antagonista farmacológico que neutralice el efecto de las LMWHs ya que el sulfato de protamina sólo posee un efecto limitado sobre ellas.
En los últimos 10 años se ha producido la incorporación del DS en las terapias antitrombóticas cuando comenzaron a prepararse DS de bajo peso molecular. Aunque su actividad anticoagulante es significativamente menor que la de la heparina, posee una actividad antitrombótica mucho más alta y reduce además significativamente los riesgos hemorrágicos. El DS activa específicamente el HCoII para inhibir la trombina, pero al contrario de la UFH y las LMWHs es efectivo tanto para la T libre como para la T unida a la fibrina (27).
La actividad biológica más importante asociada al DS es la aceleración que produce en la inhibición de la T mediada por el HCoII. Las heparinas en cambio son catalizadores de la inhibición por la AT de los factores Xa y IIa y de otros factores de la coagulación. Por el contrario, el DS no tiene efecto en la inhibición de los factores de la coagulación por la AT. Recién cuando Tollefsen y col. comenzaron a utilizar el HCoII que ellos habían purificado pudo encontrarse explicación a las propiedades anticoagulantes del DS encontradas in vitro (2). En efecto, el DS aumentaba más de 1.000 veces la velocidad de la inhibición de la T mediada por el nuevo factor. Casi simultáneamente Griffith y Marbet, por fraccionamiento en una columna de afinidad del HCoII, pudieron aislar una subpoblación del DS con 4 a 5 veces más actividad que el material inicial (28). El paso siguiente fue dado nuevamente por Tolefsen y col. para hallar el fragmento mínimo de DS capaz de estimular la inhibición de la T por el HCoII y analizar su estructura (9). Encontraron que era necesario al menos un dodesacárido para tener actividad anti T, pero el sitio de unión al HCoII demostró ser solamente una mezcla de hexasacáridos que estaba constituida por la repetición de un mismo disacárido con dos grupos sulfatos, uno en la posición 2 del ácido idurónico y el otro en la 4 de la acetilgalactosamina (8).
En este laboratorio se ha estudiado exhaustivamente la relación entre la estructura química molecular del DS y sus propiedades anticoagulantes y trombolíticas. Se utilizó para ello un sistema muy simple basado en su interacción con el primer componente C1 del sistema del complemento.
Los resultados obtenidos, que se presentan en la Tabla I y las Figuras 3 y 4, demuestran la existencia de una fracción muy pequeña de la molécula del DS con propiedades especiales y que se puede aislar por precipitación con el primer componente del sistema del complemento. En efecto, en condiciones muy estrictas de baja fuerza iónica y presencia de iones calcio, C1 reconoce y precipita aquella fracción del DS, cuyo peso molecular es menor de 8.000 Daltons, posee gran actividad anticoagulante, alto contenido en sulfato y notables propiedades trombolíticas. Las propiedades de la fracción de dermatán sulfato aislada permiten prever potenciales aplicaciones terapéuticas.
Agradecimientos
Este trabajo fue realizado con el apoyo de la Secretaría de Ciencia y Técnica de la Universidad de Buenos Aires.
Correspondencia
Dr. EDUARDO FRANCISCO RECONDO
Juncal 2186 - 6º Piso
1125 Ciudad Autónoma de Buenos Aires - Argentina
Referencias bibliográficas
1. Dahlback B. Blood coagulation. Lancet 2000; 355: 1627-32.
2. Tollefsen D, Majerus DW, Blank MK. Heparin Cofactor II. Purification and properties of a heparin-dependent inhibitor of thrombin in human plasma. J Biol Hem 1982; 257: 2162-9.
3. Tollefsen D. Insight into the mechanism of action of heparin cofactor II. Thromb Hem 1995; 74(5): 1209-14.
4. Bedayan P, Boccalon H, Dupouy D, Boneu B. Dermatan sulfate is a more potent inhibitor of clot-bound thrombin than unfractionated and low molecular weight heparins. Thromb and Haem 1994; 71(5): 576-80.
5. Tollefsen DM, Pestka CA, Monafo W. Activation heparin cofactor II by dermatan sulfate. J Biol Chem 1983; 258(11): 6713-6.
6. Rosenberg RD, Armand G, Lam L. Structure-function relationships of heparin species. Proc Natl Acad Sci USA 1978; 75(7): 3065-9.
7. Lindahl U, Backstrom G, Hook M, Thunberg L, Fransson LA, Linker A. Structure of antithrombin-binding site in heparin. Proc Natl Acad Sci USA 1979; 76(7): 3198-02.
8. Maimone M, Tollefsen DM. Structure of a dermatan sulfate hexasaccharide that binds to heparin cofactor II with high affinity. J Biol Chem 1990; 265(39): 18263-71.
9. Tollefsen DM, Peacock M E, Monafo WJ. Molecular size of Dermatan Sulfate oligosaccharides required to bind an activate Heparin Cofactor II. J Biol Chem 1986; (261): 8854-8.
10. Fernández de Recondo ME, Legorburu C, Monge, JC, Recondo EF. Heparin and Concanavalin A interaction. Isolation of fraction with higher anticoagulant activity. Biochem Biophys Res Commun 1988; 155, (Nº1): 216-23.
11. Monge JC, Recondo EF, Fernández de Recondo ME. Heparin and Concanavalin A interaction as a model for studying the mechanism of the anticoagulant activity. Thromb Res 1989; 54: 237-43.
12. Monge JC, Legorburu C, Fernández de Recondo ME, Recondo EF. Heparin and Concanavalin A interaction: a useful model for studying the mechanism of anti-coagulant activity. Ann New York Acad Sc 1989; 556: 462-4
13. Fernández de Recondo ME, Monge JC, Recondo EF. Interaction of Concanavalin A with a fraction of dermatan sulfate containing a very high anticoagulant activity. Cell Mol Biol 1995; 41(4): 465-72.
14. Cruse JM, Lewis RE Jr (eds) Complement Today. Complement Profiles. Basel, Karger, 1993. Heparin is not just an Anticoagulant Anymore: Six and one-Half Decades of studies on the Ability of Heparin to Regulate Complement Activity. R. Erik Edens, Robert J. Linhardt, John M. Weiler. Vol. I, pp 96-120.
15. Calabrese GC, Recondo MM, Fernández de Recondo ME, Recondo EF. The first component of the human complement system recognizes the active fraction of heparin. Cell and Mol Biol 1997; 43(2): 237-42.
16. Calabrese GC, Leocata Nieto F, Recondo EF, Fernández de Recondo ME. An active fraction of unfractionated heparin from a natural source is recognized by the first component of the complement system. Cell and Mol Biol 2001; 47(17): 127-31.
17. Calabrese GC, Recondo EF, Fernández de Recondo ME. Antithrombin and first protein C1 recognize the same active heparin fraction. Thromb Res 2002; 105: 537-41.
18. Almeda S, Rosenberg RD, Bing, DH. The binding properties of human complement component C1q; interaction with mucopolysaccharides. J Biol Chem 1983; 258: 785-91.
19. Calabrese GC, Alberto MF, Tubio R, Marani M, Fernández de Recondo ME, Lazzari M, et al. A small fraction of dermatan sulfate with significantly increased anticoagulant activity was selected by interaction with the first complement protein. Thromb Res 2004; 113: 243-50.
20. Imbimbo BP, Sié P, Agnelli G, Saivin S, Dupouy D, Damiani M, et al. Intramuscular dermatan sulfate MF701 in patients with hip fracture: relationship between pharmacokinetics and antithrombotic efficacy. Thromb Haem 1994; 71(5): 553-7.
21. Pavao M, Aiello KR, Werneck C, Silva L, Valente AP, Mulloy B, et al. Highly sulfated dermatan sulfate from ascidians. Structure versus anticoagulant activity of these glycosaminoglycans. J Biol Chem 1998; 273(43): 27848-57.
22. Mascellani G, Liverani L, Parma B, Bergonzini G, Bianchini P. Active site for heparin cofactor II in low molecular mass dermatan sulfate. Contribution to the antithrombotic activity of fractions with high affinity for heparin cofactor II. Throm Res 1996; 84(1): 21-32.
23. Bing D. Purification of the first component of human complement by affinity chromatography on human gamma globulin linked to sepharose. J Immunol 1971; 107 (5): 1243-9.
24. Twlikki T, Terho T, Hartiala K. Method for determination of the sulfate content of glycosaminoglycans. Anal Biochem 1971; 41: 471-6.
25. Doutremepuich C, Azougagh Oualane F, Doutreme-puich F, Fareed J. New class of heparin derivates with a potent antithrombotic effect and a very limited hemorrhagic activity. Thromb Res 1996; 83(3): 217-28.
26. Fareed J, Hoppensteadt D, Bick R. An update on heparins at the beginning of the new millennium. Sem Thromb Haem 2000; 26 (1): 5-21.
27. Bedayan P, Boccalon H, Dupouy D, Boneu B. Dermatan sulfate is a more potent inhibitor of clot-bound thrombin than unfractionated and low molecular weight heparins. Thromb Haem 1994; 71(5): 576-80.
28. Griffith MJ, Marbet GA. Dermatan sulfate and heparin can be fractionated by affinity for heparin cofactor II. Biochem Biophys Res Commun 1983; (112): 663-70. [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ]
Aceptado para su publicación el 14 de mayo de 2005.














