Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Acta bioquímica clínica latinoamericana
Print version ISSN 0325-2957On-line version ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.39 no.3 La Plata June/Sept. 2005
BIOQUÍMICA CLÍNICA
Farmacocinética de amicacina en ratones entrenados
Roberto Rule1, Sandra Arauz2, Guillermo Prozzi3
1. Médico Veterinario, Master en Microbiología Clínica y Sanitaria, Dr. en Ciencias Veterinarias, Investigador de la Comisión de Investigaciones Científicas de la Prov. de Buenos Aires.
2. Médica Veterinaria, Jefe del Servicio Central de Laboratorio. Facultad de Ciencias Veterinarias, Universidad Nacional de La Plata (U.N.L.P).
3. Médico, Docente de la Cátedra de Farmacología, Facultad de Ciencias Médicas, U.N.L.P. Argentina.
Resumen
Los objetivos de este trabajo fueron determinar la bioquímica sanguínea y el comportamiento farmacocinético de amicacina en ratones con y sin entrenamiento físico. Se utilizaron 147 ratones sanos y con pesos de 25 a 35 g. Sesenta y un animales fueron asignados a la Experiencia 1 (E1) y 86 a la Experiencia 2 (E2). Los ratones de la E1 fueron entrenados nadando 20 minutos por día, 5 días a la semana durante 7 semanas. Los ratones de la E2 permanecieron sin entrenamiento. A 75 animales [n(E1) = 25 y n(E2) = 50] se les recolectó sangre para determinar la bioquímica sanguínea. A 72 animales [n(E1) = 36 y n(E2) = 36] se les administró amicacina (10 mg/kg) vía intramuscular y se tomaron muestras sanguíneas a tiempos controlados. Para los análisis cinético y estadístico se utilizaron un modelo no compartimental y ANOVA multifactorial, respectivamente. Los resultados bioquímicos se expresaron como (medias ± 1 DE): Se encontraron diferencias (P < 0,05) en los valores de creatina quinasa (1.266,9 ± 1181,3 y 66,0 ± 43,3 UI/L) y aspartato aminotransferasa (186,2 ± 23,8 y 150,1 ± 80,5 UI/L) de los ratones con y sin entrenamiento físico, respectivamente. Resultados farmacocinéticos (medias): Concentración máxima [Cmax (E1)] = 10,2 y (E2) = 14,8 µg/mL; tiempo en el que se logra la Cmax (E1 y E2) = 0,25 h; Constante de velocidad de eliminación (E1) = 0,31 y (E2) = 0,54 h-1 ; tiempo medio de eliminación (E1) = 2,2 y (E2) = 1,3 h y área bajo la curva (E1)= 13,9 y (E2) = 15,6 µg/mL/h. Las concentraciones de amicacina obtenidas durante la E1 y E2 no presentaron diferencias estadísticas (P > 0,05).
Palabras clave: farmacocinética * amicacina * creatina quinasa * aspartato aminotransferasa * ratones * actividad física
Summary
Pharmacokinetics of amikacin administered in trained mice
The aim of the present paper was to determine the blood biochemistry and the pharmacokinetic behavior of amikacin administered to mice with and without physical training. One hundred and forty seven, adult male mice, weighing 25 to 35 gram b.w. were used. Sixty one animals were randomly assigned for Experience 1 (E1) and 86 for Experience 2 (E2). During E1, the mice were trained swimming 20 minutes a day 5 days a week during 7 weeks. E2 mice remained without training. Blood samples from 75 mice and [n(E1) = 25 and n(E2)= 50] were collected to determine the blood biochemistry. Seventy-two mice [n(E1)= 36 and n(E2)= 36] were administered with a single dose of amikacin by intramuscular route (10 mg/kg b.w.). One blood sample per animal (E1 and E2) was taken postadministration of the antibiotic. For kinetic and statistical analyses, non-compartment model and multifactorial ANOVA were used, respectively. The data for each time point was averaged and these values were used to calculate the pharmacokinetics parameters. Statistical differences (P< 0.05) were found in biochemical values (means ± 1 S.D) of creatine kinase (1,266.9 ± 1,181.3 and 66.0 ± 43.3 UI/L) and aspartate aminotransferase (186.2 ± 23.8 and 150.1 ± 80.5 UI/L) in mice with and without training, respectively. Results [Pharmacokinetic parameters (means)]: Maximum plasma concentration (E1) = 10.2 and (E2) = 14.8 µg/mL; time to reach maximum concentration (E1 and E2) = 0.25 h; smallest disposition rate constant (E1) = 0.31 and (E2) = 0.54 h-1; elimination half-life (E1) = 2.2 and (E2) = 1.3 h; area under the curve (E1) = 13.9 and (E2) = 15.6 µg/mL/h. Amikacin concentration-times obtained during E1 and E2 were not statistically different (P > 0.05).
Key words: pharmacokinetics * amikacin * creatine kinase * aspartate aminotransferase * mice * physical activity
INTRODUCCIÓN
La amicacina, 1-N-(L(-)-4-amino-2-hidroxibutiril) kanamicina A, es un antibiótico aminoglucósido semisintético que pertenece a la familia de la dibecacina, netilmicina y kanendomicina (1). La amicacina deriva de la kanamicina A, de la cual es similar farmacológica y toxicológicamente, aunque es más estable a las enzimas bacterianas que inactivan los aminoglucósidos (2-4).
La amicacina presenta actividad contra gérmenes gram negativos fundamentalmente, por ejemplo, Escherichia coli, Citrobacter freundii y diversus, Salmonella sp., Shigela sp., Pseudomonas aeruginosa, Acinetobacter sp. y gérmenes gram positivos como Estafilococos aureus (3-9).
Múltiples factores pueden modificar la farmacocinética de los antibióticos, entre ellos las endotoxinas bacterianas (10)(11), la alimentación (12)(13), el estado sanitario (14) y el entrenamiento físico (15).
En líneas generales, las células de los distintos órganos corporales contienen una serie de enzimas que les permiten realizar funciones específicas. Algunas enzimas están ampliamente distribuidas en el organismo; otras sólo se hallan en elevadas concentraciones en las células de un número limitado de órganos o de un solo órgano. Una pequeña cantidad de estas enzimas está presente en el plasma y no son específicas de este líquido corporal. Son enzimas celulares que pueden aumentar sus niveles en plasma tras su liberación ya sea porque la enzima es excretada o porque las células que las contienen están siendo repuestas. Se observa que cuando el nivel plasmático de una enzima es significativamente superior al normal es porque hay algún desorden en el órgano u órganos que la contiene normalmente. Esto estaría evidenciando la destrucción (necrosis) de un número sustancial de células o un daño subletal con aumento de la permeabilidad de membrana de la célula que contiene la enzima. Aunque las células pueden ser inducidas a sintetizar más enzimas de lo normal, como ocurre a menudo con algunos fármacos, una deficiencia de células en un órgano puede provocar una disminución del nivel enzimático en el plasma. Además del papel central de las enzimas en la bioquímica, las actividades enzimáticas en suero dan también información para el diagnóstico de varias enfermedades. La determinación de los niveles enzimáticos de creatina quinasa y aspartato aminotransferasa séricas es un componente esencial en el diagnóstico de las lesiones del músculo esquelético (16)(17).
La farmacocinética de amicacina ha sido estudiada en humanos (18) y diversas especies de animales (18-20) pero se desconoce su comportamiento en animales durante el ejercicio muscular.
Los objetivos de este trabajo han sido determinar el comportamiento farmacocinético de amicacina en ratones con y sin entrenamiento y verificar las modificaciones de creatina quinasa y aspartato aminotransferasa como indicares de daño muscular.
MATERIALES Y MÉTODOS
Animales: Se utilizaron 147 ratones cepa CF1, albinos, machos adultos sanos y con pesos de 25 a 35 g. Los animales, alojados en un bioterio con temperatura controlada y luz continua, fueron colocados en cajas metálicas provistas con camas estériles, alimentación comercial (Ganave Rata Ratón®) y agua ad libitum. Sesenta y un animales fueron asignados randomizadamente a la Experiencia 1 (E1) y 86 a la Experiencia 2 (E2).
Entrenamiento de los ratones: El entrenamiento de los ratones fue realizado en base a un protocolo propuesto por Orenstein y col. (21) y modificado por Rule y col. (15). Durante la E1 los ratones fueron entrenados nadando (20 minutos por día, 5 días a la semana, durante 7 semanas) en recipientes de plástico de 50 cm de diámetro y 30 cm de profundidad que contenían agua a temperatura controlada (entre 34 y 36 ºC). Finalizado el entrenamiento diario los animales se colocaron en camas nuevas para su secado, posteriormente se reubicaron en su cajas y se enviaron al bioterio. Todos los animales fueron revisados clínicamente cinco días a la semana y se controlaron semanalmente los pesos y cantidades de alimentos consumidos con la finalidad de descartar los animales considerados clínicamente no aptos.
Los ratones de la E2 permanecieron en las mismas condiciones que los de la E1 pero sin entrenamiento.
Toma de muestras para determinaciones bioquímicas: A 25 animales de la E1 y 50 de la E2 se les recolectó sangre (punción cardíaca) con anticoagulante (heparina) para realizar las determinaciones bioquímicas de creatina quinasa (CK) y aspartato aminotransferasa (AST).
Antibiótico, vía de administración y dosis: Setenta y dos animales (36 de la E1 y 36 de la E2) recibieron una monodosis de amicacina (10 mg/kg) vía intramuscular (músculos isquiotibiales izquierdos). Posteriormente se recogieron muestras sanguíneas (una por animal), con anticoagulante (EDTA) y mediante punción cardíaca, a las 0,25; 0,5; 1,0; 2,0; 4,0 y 6,0 horas.
La administración de amicacina (E1 y E2) y la toma de muestras sanguíneas para el análisis bioquímico (E1 y E2) se realizaron luego de veinticuatro horas de finalizados los entrenamientos.
Conservación de las muestras: Las muestras sanguíneas, previa centrifugación y obtención del plasma, fueron refrigeradas a –18 °C hasta su procesamiento.
Cuantificación del antibiótico: Las concentraciones plasmáticas de amicacina fueron determinadas por un método biológico utilizando una cepa bacteriana de referencia (Bacillus subtilis ATCC 6633) (22). Los coeficientes de variación fueron inferiores al 8% y el límite de sensibilidad fue de 0,1 µg/mL.
Análisis farmacocinético: Se realizó un análisis farmacocinético de las curvas concentración-tiempo a través de un modelo no compartimental (23). Se calculó la constante de velocidad de eliminación (lz), a partir de las 0,5 horas postadministración, a través del método de los mínimos cuadrados. Fueron observados la concentración máxima (Cmax) y el tiempo en el cual se determinó la Cmax, (tmax). El área bajo la curva (ABC) de la concentración plasmática versus tiempo y el tiempo medio de eliminación (t1/2) fueron calculados mediante el método de los trapezoides y la fórmula t1/2= 0,693/lz (23), respectivamente.
Análisis estadístico: Para el análisis estadístico se utilizó ANOVA multifactorial (Statgraphic Plus 4.0).
RESULTADOS
Los parámetros bioquímicos (media ± 1 DE) obtenidos previamente a la administración de amicacina en ratones con y sin entrenamiento físico se muestran en la Tabla I.
Las curvas de concentraciones plasmáticas versus tiempo y los parámetros farmacocinéticos de amicacina administrada por vía intramuscular en ratones con y sin entrenamiento físico se observan en la Figura 1 y en la Tabla II, respectivamente.
Tabla I. Parámetros bioquímicos en ratones con y sin entrenamiento físico.

Tabla II. Variables farmacocinéticas de amicacina administrada vía intramuscular (10 mg/kg) en ratones con y sin entrenamiento físico.
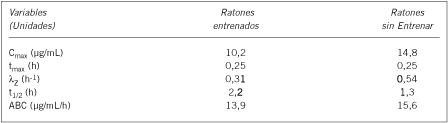
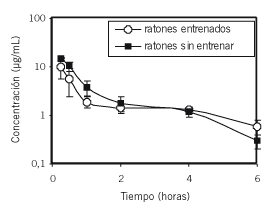
Figura 1. Concentraciones plasmáticas (Media ± 1 DE) de amicacina administrada vía intramuscular (10 mg/kg) en ratones con y sin entrenamiento físico.
DISCUSIÓN Y CONCLUSIONES
La farmacocinética de amicacina administrada por vía endovenosa ha sido estudiada en humanos y animales a través de modelos abiertos de dos compartimientos (14)(24-26). Los modelos no compartimentales o de un compartimiento han sido los más utilizados para describir el comportamiento de la amicacina cuando se administra por vía intramuscular (25)(27).
Las concentraciones medias de amicacina obtenidas durante 6 horas postadministración en ratones con y sin entrenamiento físico no presentaron, entre sí, diferencias estadísticamente significativas (P > 0,05). Estos resultados son coincidentes con los hallados por Rule y col. (15) para la ceftazidima administrada en ratones entrenados y sin entrenar. Dichos autores también observaron que un entrenamiento agudo y la posterior e inmediata administración del fármaco era la causal de las modificaciones en las concentraciones-tiempo y las áreas bajo la curva de la ceftazidima, independientemente de si los ratones habían sido entrenados o no durante un tiempo prolongado. Se atribuyeron estas diferencias a los posibles cambios en el flujo sanguíneo renal derivado por la liberación hormonal que podría producirse durante el entrenamiento previo a la dosificación del antibiótico.
Por otro lado, es sabido que la farmacología de la terapéutica antimicrobiana puede ser dividida en farmacocinética (PK) y farmacodinamia (PD) y que la PK comprende la absorción, distribución, metabolismo y eliminación (ADME) y la PD es la relación entre las concentraciones plasmáticas y los efectos farmacológicos y toxicológicos del fármaco. Moore y col. (28) observaron que los aminoglucósidos con niveles pico que superan de 8 a 10 veces la CIM presentan respuestas clínicas altas (≥ 90%). Opuestamente a lo observado para los betalactámicos en modelos experimentales de infección realizados en animales donde las proporciones ABC/ CIM muestran una mayor correlación con la eficacia terapéutica que la proporción pico/CIM. En el presente trabajo la administración de una monodosis de amicacina en ratones con y sin entrenamiento presentó una Cmax inferior (10,2 y 14,8 µg/mL, respectivamente) a la hallada en la misma especie de animales (20,18 µg/mL) (29) y en hombres adultos (27 µg/mL) (26) y fue levemente superior a las encontradas por Motohiro y col. (30) en niños prematuros (6,26 y 8,61 µg/mL).
Se sabe que los estudios en modelos experimentales en animales pueden ser utilizados como guías para establecer pautas de comportamiento de los antibióticos en humanos. Dicha práctica puede ser de utilidad en el diseño de regímenes terapéuticos para nuevos antimicrobianos o en situaciones donde resulta difícil obtener suficiente número de pacientes con determinadas condiciones corporales, por ejemplo regímenes alimentarios (12)(31), entrenamientos físicos (15), infecciones localizadas o estados de hipertermia (10)(32)(33). A los efectos de evitar errores deben tomarse precauciones al extrapolar resultados directamente de animales a humanos. Integrar los resultados obtenidos in vivo e in vitro también puede ser una alternativa para realizar la predicción de ciertos procesos.
En conclusión, aunque el entrenamiento físico realizado en ratones produjo, al igual que lo observado en humanos (34), aumento de los valores enzimáticos de creatina quinasa y aspartato aminotransferasa, las concentraciones plasmáticas de amicacina no fueron estadísticamente diferentes en los animales con entrenamiento físico respecto de los que permanecieron en reposo.
Correspondencia
ROBERTO RULE
Calle 63 Nro. 216
1900 La Plata. Argentina
E-mail: robertorule@yahoo.com.ar
Referencias bibliográficas
1. Kawaguchi H, Naito T, Nakagawa S, Fujisawa KI. BB-K 8, a new semisynthetic aminoglycoside antibiotic. J Antibiot 1972; 25 (12): 695-708.
2. Davies J, Courvalin P. Mechanisms of resistance to aminoglycosides. Am J Med 1977; 62 (6): 868-72.
3. Ristuccia AM. Antimicrobial Therapy. New York: Raven Press; 1984.
4. Carli S. Terapia Veterinaria. 2nd edition. Milan: OEMF Publishing; 1985.
5. Marks MI. In vitro antibacterial activity of amikacin, a new aminoglycoside, against clinical bacterial isolates from children. J Clin Pharmacol 1975; 15 (4): 246-51.
6. Briedis DJ, Robson HG. Comparative activity of netilmicin, gentamicin, amikacin, and tobramycin against Pseudomonas aeruginosa and Enterobacteriaceae. Antimicrob Agents Chemother 1976; 10 (4): 592-7.
7. Eickhoff TC, Ehret JM. In vitro activity of netilmicin compared with gentamicin, tobramycin, amikacin, and kanamycin. Antimicrob Agents Chemother 1977; 11 (5): 791-6.
8. Kantor RJ, Norden CW. In vitro activity of netilmicin, gentamicin, and amikacin. Antimicrob Agents Chemother 1977; 11 (1): 126-31.
9. Ziv G. Comparative clinical pharmacology of amikacin and kanamycin in dairy calves. Am J Vet Res 1977; 38 (3): 337-40.
10. Rule R, Lacchini R, Quiroga G, Moreno L, de Buschiazzo P. Pharmacokinetics and penetration into tissue fluid of ceftizoxime in normal and hyperthermic sheep. Small Rumin Res 2001; 1 (37): 43-9.
11. Bergeron M, Bergeron Y. Influence of endotoxin on the intrarenal distribution of gentamicin, netilmicin, tobramycin, amikacin and cephalothin. Antimicrob Agents Chemother 1986; 29 (1): 7-12.
12. Rule R, Lacchini R, Vita M, Antonini A, Mordujovich P. Influence of nutritional status on the pharmacokinetics of cephalothin administered in lactating goats. XXXV Reunión Anual de la Asociación Argentina de Farmacología Experimental. San Luis, 24 al 26 de diciembre de 2003, Buenos Aires: SAFE; 2003.
13. Oukessou M, Toutain PL. Effect of dietary nitrogen intake on gentamicin disposition in sheep. J Vet Pharmacol Ther 1992; 15: 416-20.
14. Canis F, Husson MO, Turck D, Vic P, Launay V, Ategbo S, et al. Pharmacokinetics and bronchial diffusion of single daily dose amikacin in cystic fibrosis patents. J Antimicrob Chemother 1997; 39: 431-3.
15. Rule R, Giampieri J, Marchetti S, Prozzi G, Buschiazzo H, Buschiazzo P. Effect of physical activity on the pharmacokinetics of ceftazidime in mice. Chemother 2002; 48 (4): 161-4.
16 Rule R, Moreno L, Serrano JM, Roman AG, Moyano R, Garcia J. Pharmacokinetics and residues in milk of oxytetracyclines administered parenterally to dairy goats. Aust Vet J 2001; 79 (7): 492-6.
17. Kaneko JJ, Harvey JW, Bruss ML. Clinical Biochemistry of Domestic Animals. Fifth edition. New York: Academic Press; 1997. p. 895-901.
18. Cabana BE, Targgart JG. Comparative pharmacokinetics of BB-K8 and kanamycin in dogs and humans. Antimicrob Agents Chemother 1973; 3 (4): 478-83.
19. Carli S, Montesissa C, Sonzogni O. Comparative pharmacokinetics of amikacin sulphate in calves and sheep. Res Vet Sci 1990; 48: 231-4.
20. Uppal RP, Verma SP, Verma V, Garg SK. Comparative pharmacokinetics of amikacin following a single intramuscular or subcutaneous administration in goats. Vet Res 1997; 28 (6): 565-70.
21. Orenstein TL, Parker TG, Butany JW, Goodman JM, Dawood F, Wen-Hu W, et al. Favorable left ventricular remodeling following large myocardial infarction by exercise training. Effect on ventricular morphology and gene expression. J Clin Invest 1995; 96 (2): 858-66.
22. Bergeron MG, Trottier S. Influence of single or multiple doses of gentamicin and netilmicin on their cortical, medullary, and papillary distribution. Antimicrob Agents Chemother 1979; 15: 635-41.
23. Gibaldi M. Biopharmaceutics and Clinical Pharmacokinetics. Compartmental and noncompartmental pharmacokinetics. 4th ed. Kent: Croydon Road Beckenham (UK); 1991.
24. Sardeman H, Colding H, Hendel J, Kampmann JP, Hvidberg EF, Vejlsgaard R. Kinetics and dose calculations of amikacin in the newborn. Clin Pharmacol Ther 1976; 20 (1): 59-66.
25. Lanao JM, Dominguez-Gil A, Tabernero JM, Corbacho L. Influence of the route of administration on the pharmacokinetics of amikacin. Eur J Clin Pharmacol 1981; 19 (5): 367-70.
26. El-Gammal AA, Ravis WR, Krista LM, Tolbert DS, Saad A. Pharmacokinetics and intramuscular bioavailability of amikacin in chickens following single and multiple dosing. J Vet Pharmacol Ther 1992; 15 (2): 133-42.
27. Barbhaiya RH, Knupp CA, Pfeffer M, Pittman KA. Lack of pharmacokinetic interation between cefepime and amikacin in humans. Antimicrob Agents Chemother 1992; 07: 1382-6.
28. Moore RD, Lietman PS, Smith CR. Clinical reponse to aminglycoside therapy: importance of the ratio of peak concentration to minimal inhibitory concentration. J Infect Dis 1987; 155: 93-9.
29. Szabo D, Mathe A, Filetoth Z, Anderlik P, Rokusz L, Rozgonyi F. In vitro and in vivo activities of amikacin, cefepime, amikacin plus cefepime, and imipenem against an SHV-5 extended-spectrum beta-lactamase-producing Klebsiella pneumoniae strain. Antimicrob Agents Chemother 2001; 45 (4): 1287-91.
30. Motohiro T, Tanaka K, Kawakami A, Koga T, Shimada S, Tomita S, et al. Pharmacokinetic of amikacin in children and neonates. J Antibiot 1987; 40 (6): 1200-14.
31. Rule R, Grattoni A, Arauz S, Lacchini R, Mordujovich P. Pharmacokinetics of amikacin administered to rabbits with normal and low protein diets. XXXV Reunión Anual de la Asociación Argentina de Farmacología Experimental. San Luis, 24 al 26 de diciembre de 2003, Buenos Aires, SAFE; 2003.
32. Rule R, Rubio M, Perelli MC. Pharmacokinetics of ceftazidime in sheep and its penetration into tissue and peritoneal fluids. Res Vet Sci 1991; 51 (3): 233-8.
33. Rule R, Buschiazzo H, Rubio M, Buschiazzo P. Pharmacokinetics and penetration into tissue fluid of cefotaxime administered intravenously and intramusculary in the bovine. Chemotherapy 1994; 40: 221-6.
34. Soeder G, Golf SW, Graef V, Temme H, Brustle A, Roka L, et al. Enzyme catalytic concentrations in human plasma after a marathon. Clin Biochem 1989; 22 (2): 155-9. [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ]
Aceptado para su publicación el 19 de julio de 2005














