Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. v.39 n.3 La Plata jun./sept. 2005
TOXICOLOGÍA AMBIENTAL
Disrupción endocrina: perspectivas ambientales y salud pública*
Federico Argemi1, Natalia Cianni2, Andrés Porta3
1. Licenciado en Zoología. Becario de la Agencia Nacional de Promoción de la Ciencia y la Tecnología (PICT Nº XXXX).
2. Médica. Becaria de la Comisión de Investigaciones Científicas y Tecnológicas de la Provincia de Buenos Aires (CIC).
3. Doctor en Bioquímica. Investigador de la CIC.
* CIMA, Centro de Investigaciones del Medio Ambiente. Departamento de Química, Facultad de Ciencias Exactas, Universidad Nacional de La Plata, Calle 47 esquina 115, La Plata, Argentina. Tel./Fax: (0221) 4229329
Resumen
Los casos crecientes de disfunciones del aparato reproductivo, tales como disminución del recuento y la funcionalidad espermática, pubertad precoz en niños y niñas, aumento en la aparición de cáncer de mamas, próstata y testículos y de malformaciones asociadas con problemas hormonales genera cierta inquietud generalizada. Concomitantemente, se observan casos de alteraciones en la función reproductiva de una creciente cantidad de especies animales, por exposición a sustancias químicas persistentes, como pesticidas, detergentes, dioxinas y furanos. Como respuesta, en las últimas décadas se ha promovido una intensa actividad de investigación para caracterizar a estos compuestos en función de su capacidad de alteración de la homeostasis del sistema endocrino-reproductivo, asignándoles el nombre de disruptores endocrinos. Entre los compuestos disruptores reconocidos, se pueden citar fitoestrógenos, pesticidas organoclorados, alquifenoles-polietoxilados, clorofenoles bifenilos policlorados, ftalatos, estrógenos artificiales, dioxinas, furanos y algunos hidrocarburos policíclicos aromáticos, es decir, compuestos que se encuentran presentes en la vida cotidiana. Esta situación comporta un replanteo de los sistemas de regulación y control para las aproximadamente 50.000 nuevas sustancias químicas, muchas de ellas con la capacidad potencial de disrupción. Esto incluye nuevos tests toxicológicos y nuevos objetivos de investigación, replantear la metodología de evaluación de los compuestos químicos y la re-evaluación de los existentes, utilizando como criterio central la estimación de riesgo. A tal efecto, se plantean como ejes centrales: la articulación de una red internacional, con su consecuente base de datos global, el desarrollo y validación de nuevos ensayos biológicos para la detección de compuestos disruptores, y aunar criterios para la caracterización de riesgo y peligro asociado, sobre la base de estudios epidemiológicos.
Palabras clave: disrupción endocrina * marcadores biológicos * salud pública * contaminantes orgánicos persistentes * biota * contaminación ambiental
Summary
Endocrine disruption: environmental perspectives and public health
The increase of reproductive dysfunction cases, such as diminution of count and spermatic functionality, precocious puberty in children, the increase of breast, prostate and testicles cancer and of malformations associated with hormonal problems generates certain uneasiness. At the same time, the description of alterations in the reproductive function of an increasing number of wild species, by exposure to persistent chemical substances, like pesticides, detergents, dioxins and furans, has promoted an intense activity of research that has given these compounds a central role in the interference (disruption) of the hormonal homeostasis. These compounds, endocrine disruptors, are characterized in the laboratory taking into account their hormonal or anti-hormonal capacity, and whether they can alter the homeostasis of the endocrine reproductive system. Some recognized disruptors are phytoestrogens, organochloride pesticides, alkylphenol-polyethoxylates, chlorophenols, PCBs, phtalates, artificial estrogens (contraceptive), dioxins, furans and aromatic polycyclic hydrocarbons, which are commonly used in our daily life. The recognition of their disruption capacity, implies a reframing of the regulation and control systems of approximately 50,000 new chemicals, many of wich with potential disruption capacity. This includes new toxicological tests and new research objectives, renewed evaluation methodology of chemical compounds and the re-evaluation of the existing one, using the risk estimation system as a principle. Thus, these priorities are considered: an international network, with a global data base; the validation of new biological tests for the detection of disruptor compounds, and the unification of criteria for the risk and associated damage characterization on the basis of epidemiological studies.
Key words: endocrine disruption * biological markers * public health * persistent organic pollutants * biota * environmental pollution
INTRODUCCIÓN
La descripción de alteraciones en la función reproductiva de una cantidad creciente de especies animales, junto a la demostración de la exposición humana y animal a sustancias químicas con actividad hormonal, principalmente estrogénica, dio lugar hace dos décadas a lo que se conoce hoy día con el nombre de "disrupción endocrina". Este fenómeno suele ir acompañado de disfunciones del aparato reproductor, neoplasias, malformaciones, algunas formas de neurotoxicidad o una disminución de la respuesta inmune. La evidencia de esta asociación, demostrada en la vida salvaje, ha dado lugar a la interpretación general de un fenómeno de interferencia de estos compuestos con la homeostasis hormonal (1-8).
A nivel de la salud pública, en las últimas cuatro décadas se han observado fenómenos relacionados con problemas en el sistema endocrino-reproductivo, tales como disminución del recuento y la funcionalidad espermática y aumento en la aparición de cáncer de mamas, próstata y testículos (Tabla I). En particular, en niños, pueden citarse alteraciones de ciertas funciones comportamentales y cognitivas, bajo peso al nacer y pubertad precoz. Sin embargo, mientras que se cuenta con abundante información de exposición de individuos o poblaciones a compuestos con propiedades disruptoras, por ejemplo la mayoría de los ciudadanos europeos tienen niveles detectables de algún compuesto disruptor endocrino (CDE) en el organismo, las evidencias de una asociación entre exposición y enfermedad todavía son controvertidas (2)(9-16).
Tabla I (Modificada de ISTAS 2002 y Olea et al. 2002)
Posibles efectos sobre la salud humana de los disruptores endocrinos.

Los CDE son sustancias químicas, naturales o artificiales, exógenas al organismo que tienen la capacidad de alterar la homeostasis del sistema endocrino-reproductivo. Debido a que los valores de hormonas circulantes varían en función de la edad, sexo o momento de la medición, cualquier intento de estimación precisa de las consecuencias de exposición a los CDE debe tener presente el patrón hormonal de cada especie. Entre las razones que hacen difícil establecer una relación de causalidad exposición-manifestación se pueden citar la universalidad de la exposición, la complejidad de los mecanismos de acción de los CDE sobre los distintos órganos blanco, la separación temporal entre la exposición y la manifestación patológica y el desconocimiento del efecto combinado de estas sustancias químicas (2)(5-7)(10)(17).
En la actualidad se conocen unos 45 compuestos con propiedades disruptoras confirmadas, y unos 600 considerados potenciales disruptores endocrinos, los cuales han sido introducidos en los circuitos ambientales y están presentes en la vida cotidiana (Tabla II) (Tabla III). En general, se trata de sustancias lipofílicas, persistentes y bioconcentrables. Como tales, suelen encontrarse en alimentos ricos en grasas, en particular aquellos elaborados a partir de grasas animales recicladas. Entre los CDE naturales más importantes se pueden mencionar las feromonas y los fitoestrógenos, como, por ejemplo, isoflavonas y lignanos, presentes en la soja y otras legumbres. Entre los CDE artificiales se encuentran insecticidas, muchos de ellos de uso doméstico, como el diclorodifeniltricloroetano (DDT) y sus metabolitos, el aldrin y el paratión; funguicidas (mancozeb, zineb), moluscocidas (tributilestaño) y herbicidas (atrazina, trifluoralin). Además, pertenecen a este grupo sustancias de uso cotidiano en el hogar o la industria como alquilfenoles (tensoactivos neutros en artículos de limpieza y en ciertos alimentos elaborados), bifenilos policlorados (PCBs) (lubricantes y aisladores en transformadores), ftalatos (componentes de plásticos blandos en juguetes infantiles), bisfenol-A (policarbonatos y resinas epoxi, en mamaderas transparentes y envases de alimentos, respectivamente), estrógenos artificiales como el dietilestilbestrol (DES) (anticonceptivo), componentes de los filtros UV en cremas (3-benzofenona) y contaminantes ambientales como las dioxinas, los furanos y ciertos hidrocarburos aromáticos policíclicos (HAPs). Muchos de estos CDE artificiales forman parte de los denominados "Contaminantes orgánicos persistentes" sobre los cuales, a partir la Convención de Estocolmo, existe el compromiso internacional de restringirlos o erradicarlos (2) (12-14)(17-21).
Tabla II (modificada de ISTAS 2002 y Olea 2002)
Compuestos plaguicidas listados en el censo Europeo de Disruptores Endocrinos.
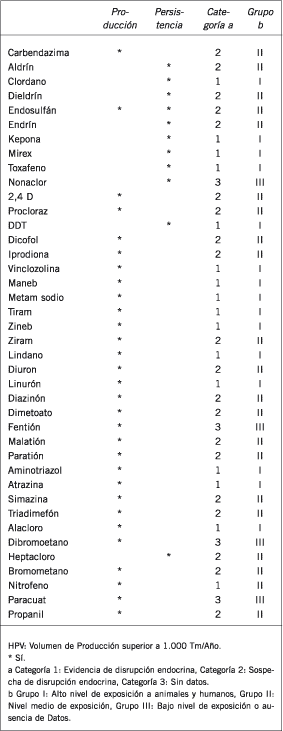
Tabla III. Compuestos Industriales listados en el censo Europeo de Disruptores Endocrinos.

Se trata de un problema emergente de salud ambiental que cuestiona los fundamentos del control y la regulación del uso de compuestos químicos. Más aún, cuando hay entre 60.000 y 100.000 sustancias a ser testeadas, y el número sigue creciendo (Fig. 1). En tal sentido, se hace necesario replantear la estrategia utilizada para la evaluación de efectos biológicos en sustancias químicas, incorporando la evaluación de la capacidad disruptora, de manera de adoptar medidas de protección del medio ambiente y la salud pública.

Figura 1. Notificación de sustancias nuevas en la Unión Europea (EU) y EEUU (US) período 1994-2000 (modificado de Blundell 2003).
Evaluación de la respuesta biológica
En primer lugar, deben realizarse estudios en condiciones controladas de laboratorio, de manera de establecer el accionar de las sustancias sospechadas como CDE, sobre diversos organismos. Seguido esto, debe estudiarse el funcionamiento de los compuestos sospechados en condiciones naturales. Generalmente, combinando las mediciones de la concentración del compuesto en el organismo (tejidos, sangre, orina), las mediciones en el medio (agua, sedimentos, suelos) y la recopilación de información referida a biomarcadores (2)(5-9)(22)(23).
Se han propuesto tres tipos de biomarcadores, los biomarcadores de exposición, que hacen referencia a la cuantificación de CDE y a la interacción de cualquiera de ellos con células o moléculas blanco, que puedan ser identificados y cuantificados en un compartimiento corporal determinado. Por otra parte, los biomarcadores de susceptibilidad son los que definen la capacidad del organismo, inherente o adquirida, para adaptarse a la exposición a CDE. Y por último, los biomarcadores de efecto, se definen en términos de la alteración hormonal, bioquímica o fisiológica cuantificable, con respecto a los niveles naturales, y que, según su magnitud, produzcan un efecto adverso o un signo de enfermedad (5-9)(22).
Entre los puntos finales bioquímicos (biomarcadores) que se aplican en estudios de disrupción endocrina, se pueden citar:
• Determinaciones de los niveles hormonales propios de cada especie: gonadotrofinas (GnRH), folículo estimulante (FSH), luteinizante (LH), 17 b-estradiol (E2), testosterona (T), entre otros (4)(22-24).
• Niveles de proteínas asociadas con compuestos estrogénicos, como por ejemplo, la glicofosfolipoproteína VTG que se expresa en vertebrados no vivíparos (24-28).
• Sistemas que asocian la respuesta específica a estrógenos con sistemas señaladores, como el sistema de expresión de luciferasa (ERE/Gal4), el ensayo de crecimiento de levaduras estrógeno inducibles, el ensayo de estrogenicidad E-Screen para la medida de la carga estrogénica total efectiva (TEXB), que asigna un valor de estrogenicidad a las muestras biológicas (tejido adiposo, sangre, leche materna, placenta, etc.) como biomarcador de exposición y de efecto (2)(5)(6)(19).
Complementariamente, y en particular desde la perspectiva de la salud pública, existe otro grupo de ensayos que originalmente fueron diseñados y estandarizados para estudios toxicológicos de tipo clásico, que pueden dar cuenta de algunos efectos adversos relacionados, por ejemplo los bioensayos de toxicidad aguda, subcrónica y crónica, ensayos de teratogenicidad y de funcionalidad reproductiva y de mutagenicidad, complementados con estudios histopatológicos. En la actualidad se plantea incorporar puntos adicionales como citología vaginal, desarrollo y funcionalidad espermática, monitoreo hormonal, desarrollo físico, modificaciones en el comportamiento, estudios detallados de órganos sexuales accesorios y estudios en líneas celulares específicas, de animales o humanas. Todos estos ensayos, su complementación y su significancia, se encuentran en franco estado de desarrollo y validación (11-14)(29).
La existencia de correlación entre los datos recolectados permite determinar si la exposición a un determinado compuesto presenta un riesgo no admisible que ponga en peligro la supervivencia de la especie. Aún conociendo todo aquello relacionado con los efectos biológicos de los CDE sobre humanos y animales, es necesario conocer detalladamente las distintas vías de exposición ambientales de manera de evaluar riesgos asociados y adoptar medidas de prevención (2) (5-9)(19)(22-24).
El estudio de los efectos derivados de la exposición a CDE presenta varios desafíos:
• En primer lugar hay una gran variedad de compuestos químicos (heterogeneidad) que actúan como CDE.
• Las distintas vías involucradas entre fuente y exposición son muchas y complejas. Así, por ejemplo, si bien los pesticidas organoclorados no se usan más en EE.UU., siguen circulando en el ambiente (aire, aguas, suelos) y por ejemplo siguen generando efectos adversos en los grandes lagos (2)(8)(19).
• Muchos de los CDE son persistentes y se bioacumulan en los tejidos. Además, suelen presentar un largo período de latencia entre la exposición y la expresión del efecto biológico, así, por ejemplo, la exposición fetal durante el embarazo, aun en repetidos períodos cortos a CDE, puede manifestar sus efectos recién en la pubertad (5-9)(14-16).
• Sitios fuertemente contaminados actúan como reservorios y fuentes de redistribución de CDE (5-9)(16)(17).
Disrupción Endócrina en animales silvestres
La Endocrinología ha tomado en los últimos tiempos un fuerte impulso como ciencia aplicada a los estudios ecofisiológicos, dada una creciente evidencia de que muchos compuestos químicos naturales o no, pueden producir una disfunción reproductiva, alterando el funcionamiento normal del sistema endocrino en las poblaciones naturales. Una de las bases fundamentales para el estudio de CDE en diversos organismos silvestres, se basa en que los sistemas hormonales son similares en todos los vertebrados, si bien existen diferencias entre los organismos tetrápodos y los peces. La primera de ellas radica en que estos últimos no poseen un sistema porta sanguíneo a nivel hipotálamo-hipofisal. Otra importante diferencia consiste en la presencia de 11-ceto-testosterona en peces como principal andrógeno, homologable a la dihidroxi-testosterona en tetrápodos y humanos (28)(30)(31).
Las posibles alteraciones reproductivas pueden evidenciarse por una potencialización de los caracteres sexuales propios (aumento de testosterona en machos, o bien 17-b estradiol en hembras), procesos de feminización en machos o masculinización en hembras, u organismos sexualmente indiferenciados o comúnmente llamados intersexo. Diferentes contaminantes pueden tener efectos de tipo androgénico o estrogénico sobre los organismos. Estas alteraciones no sólo son producidas a nivel gonadal, sino que pueden afectar en los distintos niveles del eje hipotálamo-hipófisis-gónada, de acuerdo al mecanismo de acción del CDE considerado (23)(25)(28).
Entre los biomarcadores que han sido tomados en cuenta para estudios de disrupción endocrina en organismos silvestres, se pueden destacar: alteraciones en la aromatasa citocromo P-450, alteración de los órganos reproductores (ovario-testículo), así como malformaciones e inviabilidad de las gametas (óvulos-espermatozoides). Existe un método muy particular utilizado sólo para organismos ovulíparos u ovíparos, para la determinación cuantitativa de la vitelogenina (VTG), que es una fosfolipo-glico proteína sérica (300-600 kDa nativa) precursora de la formación de la yema del huevo. Como se esquematiza en la Figura 2, la síntesis de VTG se produce por la estimulación de receptores estrogénicos hepáticos, por la acción de la hormona 17-b estradiol (E2), o bien por compuestos xenoestrógenos. Tanto machos como hembras, e incluso juveniles inmaduros, poseen dichos receptores, pero en condiciones normales sólo las hembras son capaces de producirla. La síntesis de VTG en machos o juveniles, o incluso en hembras no-vitelogénicas, provee un bioindicador de exposición a disruptores ambientales (22)(27)(28).
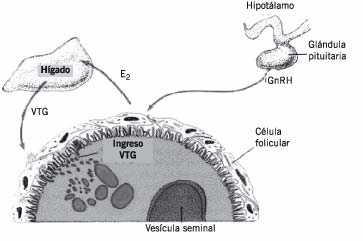
Figura 2. Formación y acumulación de vitelogenina.
Las hormonas GnRH estimulan la síntesis de E2 a nivel del ovario; éste es liberado al torrente sanguíneo estimulando las síntesis de VTG a nivel hepático.
Sitios de acción
Se pueden distinguir cuatro vías de acción principales de un CDE (12-14)(20-22):
1. Unión y activación de receptores estrogénicos-androgénicos (xenoestrógenos y xenoandrógenos). Existe una cantidad de receptores estrogénicos en una amplia variedad de tejidos como gónadas, hígado, cerebro y órganos sexuales accesorios. Muchos CDE pueden unirse y activar el receptor estrogénico presentando incluso efectos aditivos y/o sinérgicos con la consecuente acción más prolongada (Fig. 3); es el caso del butilbencilftalato y del di-n-butilftalato que aumentan el efecto estrogénico natural. Otros CDE que utilizan esta vía son DDT, dieldrín y endosulfán.
2. Unión sin activación del receptor estrogénico (actúan como antiestrógenos o antiandrógenos). Es el caso de dioxinas y PCBs (Fig. 4).
3. Modificación del metabolismo hormonal. Los PCBs y algunos pesticidas, como el Lindano y la Atrazina, pueden actuar sobre la ruta metabólica del estradiol, aumentando la concentración plasmática de dicho esteroide, impidiendo su síntesis, aumentando la velocidad de degradación, etc.
4. Modificación del número de receptores hormonales en la célula. El número de receptores hormonales en las células es un mecanismo de control complejo. Un CDE puede reducir o incrementar el número de receptores y, por lo tanto, afectar el estado de respuesta a las hormonas naturales o artificiales.
Más específicamente, se pueden distinguir dos modos de acción de los CDE, denominando a estos compuestos como xenobióticos o xenoestrógenos-xenoandrógenos en base a su mecanismo de acción. En la Figura 5 se muestra la cascada hormonal producida a lo largo de un eje imaginario trazado desde el hipotálamo hasta la gónada; en ella se puede observar el accionar de las hormonas GnRH (factor liberador de gonadotrofinas) que desencadenan la liberación de las hormonas secretadas por la glándula pituitaria (folículo estimulante y luteinizante) y éstas estimulan al ovario y testículo, produciendo la síntesis de E2 y T, los cuales actuarán sobre los tejidos y órganos blanco (32)(33).
Hasta aquí, todo compuesto que modifique este proceso natural, estimulando o inhibiendo cualquiera de sus distintas etapas, es considerado en endocrinología toxicológica como un compuesto xenobiótico. Aquellos compuestos que interfieran directamente sobre el accionar de los esteroides sexuales como E2 y T, son denominados xenoestrógenos o xenoandrógenos. En los organismos ovíparos u ovulíparos, aquellos compuestos que estimulen la síntesis y liberación de E2, o bien, mimeticen su accionar (xenoestrógeno) producirán alteraciones en las concentraciones normales de VTG (26-28).

Figura 3. Mimetizar la acción de hormonas.
Distintas formas de acción de los disruptores endocrinos en la unión a los receptores blanco (Modificado de ISTAS 2002).
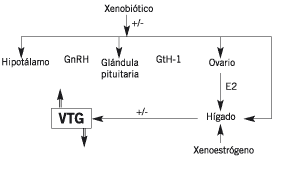
Figura 4. Puntos de acción de compuestos xenobióticos y xenoestrógenos.
Planteados a lo largo del eje neuroendocrino regulador de la síntesis de vitelogenina (Modificado de Kime et al. 1999).

Figura 5. Ejemplo de aplicación de un sistema de Evaluación de Riesgo para 564 compuestos con actividad estrogénica documentada (Unión Europea) (Modificada de Blundell 2003).
Efectos sobre la salud humana
Efectos en niños
Los niños son muy vulnerables a los tóxicos. Desde su concepción presentan menor capacidad detoxificante, ingieren más agua y alimento, y consumen más aire en relación con su tamaño que un adulto, encontrándose en un grado mayor de exposición si estos estuvieran contaminados.
Exposición transplacentaria a CDE y efectos en el desarrollo neonatal.
Tanto las especies animales como los seres humanos están expuestos a los disruptores endocrinos. En el hombre, además de la exposición ocupacional, por ejemplo en las áreas de agricultura intensiva donde se prodiga el uso de pesticidas que fácilmente acceden a los trabajadores y a los asentamientos humanos circundantes, se encuentra documentada la exposición de grupos de edad muy particular y de una profunda preocupación médico-social. Dentro de este contexto, la exposición intrauterina y postnatal se ha denunciado frecuentemente, sobre todo, para aquellas sustancias que se sabe atraviesan la barrera placentaria o son incorporadas a través de la leche materna. Se ha sugerido que la mayor fuente de exposición del individuo en desarrollo (en la etapa gestacional y en la lactancia) a CDE bioacumulables es a través del contacto materno, porque la madre actuaría como reservorio de estos compuestos (12-14)(34-39).
La exposición elevada a CDE también se ha relacionado con una alteración en el peso, la talla y el estado nutricional del recién nacido, tratándose en estos casos de compuestos disruptores de la acción de las hormonas específicas como la somatotropina, los factores de crecimiento asociados a insulina (IGFs) y hormonas tiroideas. También se han descripto asociaciones entre la exposición prenatal a CDE, efectos sobre el desarrollo del sistema nervioso y la exacerbación de prostatitis. Otras observaciones atribuibles a CDE, en particular los compuestos clorados persistentes, consisten en el incremento de anomalías seminales, cáncer testicular, criptorquidias conjuntamente con hipospadias, todos ellos defectos ligados probablemente a un origen común durante la embriogénesis. En particular, para la hipospadia, una malformación congénita del meato urinario, se ha encontrado un aumento de hasta cinco veces en los países desarrollados en los últimos 25 años (12-14)(34-39).
Otro tipo de efectos asociados con la exposición temprana a ciertos CDE, como pesticidas organoclorados, PCBs y dioxinas, es la producción de cambios profundos y permanentes en el desarrollo del sistema nervioso. Estos cambios pueden llevar al deterioro del rendimiento mental, conjuntamente con alteraciones en el sistema endocrino reproductivo. La exposición a un mismo agente puede resultar en efectos diferentes en el aprendizaje y la conducta, dependiendo del periodo del desarrollo y del lugar del cerebro donde se estén llevando adelante los procesos de neurodesarrollo en el momento de la exposición (12-14)(34-39).
Otros efectos
En hijas de mujeres tratadas con DES durante el embarazo, se han observado pubertad precoz, cáncer de vagina (células claras) y cérvix, y malformaciones de órganos reproductores (útero y cérvix). También presentan mayor riesgo de sufrir abortos espontáneos y partos ectópicos que las mujeres no expuestas. Debe destacarse que esta situación se refiere a una ingesta planificada y controlada (bajo supervisión médica) de sustancias con capacidad de disrupción y no a la exposición a sustancias liberadas al ambiente. Cabe aclarar que las excretas de las pacientes que ingieren DES sí pueden considerarse como CDE (12-14)(39)(40).
Se ha descripto que mujeres que padecen endometriosis (tejido endometrial aberrante en diversos sitios de la cavidad pélvica) tienen niveles más elevados de PCBs en la sangre que las mujeres que no la padecen. Consecuentemente, entre el 60 y el 70 por ciento de los embarazos se malogran en la fase embrionaria inicial y otro 10 por ciento termina en las primeras semanas por un aborto espontáneo. Si bien no hay estudios definitivos que demuestren una relación directa entre exposición a PCBs y riesgo de cáncer de mama en humanos, estos CDE serían un factor importante que favorece el desarrollo de este tipo de cáncer, cuando se lo compara con otros como obesidad, alcoholismo, edad y lactancia (12-14)(39)(40).
CONCLUSIONES
Evidentemente, el desafío planteado por los CDE impone la necesidad de incluir nuevos tests toxicológicos y nuevos objetivos de investigación, con referencia específica al desarrollo y crecimiento de las especies, en particular las etapas de mayor riesgo: embrionaria, infancia, embarazo, y a la homeostasis y funcionalidad de los sistemas hormonales, además de una renovada metodología de evaluación de los nuevos compuestos químicos y la re-evaluación de los existentes. Todo esto incide sobre la reglamentación y el comercio internacional, con un diseño y aplicación de sistemas de búsqueda de CDE, fundamentalmente en los países desarrollados. En éstos, asimismo, se implementan programas de investigación con objeto de cualificar y cuantificar los efectos adversos sobre la salud humana y animal, generando herramientas de acción para establecer adecuadas medidas de prevención (2)(5-9)(17).
El Comité de Expertos para Toxicología, Ecotoxicología y Medioambiente de la Unión Europea afirma que la disrupción endocrina no es un efecto toxicológico per se, como puede ser el cáncer o la alergia, sino una alteración del equilibrio hormonal, que puede o no conducir a una alteración patológica, y consecuentemente, se plantea, para su análisis, trabajar dentro del paradigma clásico de la estimación del riesgo. En tal sentido, se utilizan como criterios prioritarios: el volumen de producción del compuesto analizado, su persistencia en el ambiente, su biodisponibilidad, su efecto (comprobado o potencial) y su nivel de acción sobre personas o biota en relación con el grado de exposición y la susceptibilidad de los mismos (Fig. 5).
En tal sentido, en la recientemente celebrada Conferencia de Aronsborg (41), se señalaron cuatro ejes principales:
a) Definir las prioridades básicas en el marco de efectos biológicos derivados de la exposición a CDE, incluyendo la salud humana.
b) Articular la tarea constituyendo una red internacional, y generando una base de datos global.
c) Revisar y desarrollar nuevos ensayos biológicos para la detección de CDE y métodos de validación.
d) Armonizar criterios para la caracterización de riesgo y peligro asociado a CDE, incorporando endocrinólogos clínicos y desarrollando estudios epidemiológicos, dado que son escasos los estudios humanos sobre base poblacional.
En cumplimiento de estos objetivos, en la actualidad se encuentra en desarrollo el Programa GEDRI (Inventario Global de Investigaciones en Disruptores Endocrinos) liderado por los países miembros de la Organización de Cooperación y Desarrollo Económico (OCDE). En cumplimiento de alguno de estos objetivos, en la actualidad se encuentran en desarrollo unos 800 proyectos de investigación y desarrollo (5-7)(12-14)(17).
Mientras se desarrollan dichos programas y se logra erradicar la incertidumbre e inquietud reinantes, el "principio de precaución" debería ser el principio rector a partir del cual las autoridades ambientales y sanitarias de los distintos niveles, locales, nacionales e internacionales, adopten las diferentes regulaciones respectivas, teniendo siempre presente que existen grupos para los cuales la exposición es crítica, particularmente madres embarazadas y niños en los períodos prenatal y en la primera etapa de desarrollo, y que el bien que se preserva es muy valioso. De alguna manera, el desafío de los CDE es semejante al planteado por el tabaco, donde luego de décadas de trabajo de científicos y de la administración, fue posible cuantificar la magnitud social del problema. Además, extrapolando esto a los sistemas naturales, las consecuencias posibles son difíciles de evaluar. Debe tenerse presente la experiencia de los últimos 50 años, donde los niveles de inversión necesarios para remediar los sitios contaminados superan holgadamente las eventuales ganancias obtenidas en el uso y aplicación de tecnologías de inocuidad no claramente demostrada.
Correspondencia
DR. ANDRÉS PORTA
CIMA, Centro de Investigaciones del Medio Ambiente
Departamento de Química, Facultad de Ciencias Exactas, Universidad Nacional de La Plata
Calle 47 esquina 115 - 1900 La Plata, Prov. de Buenos Aires, Argentina
Correo electrónico: aporta@quimica.unlp.edu.ar
Referencias bibliográficas
1. Ankley GT, Giesy JP. Endocrine disruption in wildlife: a weight-of-evidence perspective. En: Kendall R., R. Dickerson, J. Giesy, W. Suk, editors. Principles and processes for evaluating endocrine disruption in wildlife. Pensacola: SETAC Press; 1998. Chapter 16.
2. Kendall RJ, Brouwer A, Giesy JP. A risk-based field and laboratory approach to asses endocrine disruption in wildlife. En: Kendall R., R. Dickerson, J. Giesy, W. Suk, editors. Principles and processes for evaluating endocrine disruption in wildlife. Pensacola: SETAC Press; 1998. Chapter 1.
3. Markaverich B, Mani S, Alejandro MA, Mitchell A, Markaverich D, Brown T, et al. A novel endocrine-disrupting agent in corn with mitogenic activity in human breast and prostatic cancer cells. Environ Health Perspect 2002; 110 (2): 169-77.
4. Melnick R, Lucier G, Wolfe M, Hall R, Stancel G, Prins G, et al. Summary of the National Toxicology Program's Report of the Endocrine Disruptors Low-Dose Peer Review. Environ Health Perspect 2002; 110 (4): 427-31.
5. Olea N, Fernández MF, Araque P, Olea-Serrano F. Perspectivas en disrupción endocrina. Gac Sanit 2002; 16 (3): 250-6.
6. Blundell T. "Chemicals in Products Safeguarding the Environment and Human". Health twenty-fourth Report. London: Royal Commission On Environmental Pollution. 2003. Informe Nº Cm 5827. 307 pp.
7. CDC (Centers for Disease Control and Prevention). "Second National Report on Human Exposure to Environmental Chemicals". Atlanta: Centers for Disease Control and Prevention. National Center for Environmental Health (NCEH). 2003. NCEH Pub. No. 02-0716. 257 pp.
8. Swan SH, Brazil C, Drobnis EZ, Fan Liu, Kruse RL, Hatch M, et al. Geographic differences in semen quality of fertile U.S. males. Environ Health Perspect 2003, 111 (4): 414-20.
9. Crisp TM. "Special Report On Environmental Endocrine Disruption: An Effects Assessment and Analysis". Washington D.C.: U.S. Environmental Protection Agency. 1997. EPA/630/R-96/012. 120 pp.
10. Miller WR, Sharpe RM. Environmental estrogens and human reproductive cancers. Endocr Relat Cancer 1998; 5: 69-96.
11. Safe SH. Endocrine disruptors and human health - Is there a problem? An update. Environ Health Perspect 2000; 108: 487-93.
12. Olea Serrano N, Zuluaga Gómez A. Exposición infantil a disruptores endocrinos. An Esp Pediatr 2001; 54 (1): 58-62.
13. ISTAS (Instituto Sindical de Trabajo, Ambiente y Salud de España). Curso de Introducción a los disruptores endocrinos. Madrid: Instituto Sindical de Trabajo Ambiente y Salud de España; 2002. 33 pp.
14. Porta M, Kogevinas M, Zumeta E, Sunyer J, Ribas-Fitó N. Concentraciones de compuestos tóxicos persistentes en la población española: el rompecabezas sin piezas y la protección de la salud pública. Gac Sanit 2002; 16 (3): 257-66.
15. Mori C, Komiyama M, Adachi T, Sakurai K, Nishimura D, Takashima K, et al. Application of toxicogenomic analysis to risk assessment of delayed long-term effects of multiple chemicals, including endocrine disruptors in human fetuses. Environ Health Perspect 2003; 111: 803-9.
16. Brody JG, Aschengrau A, McKelvey W, Rudel RA, Swartz CH, Kennedy T. Breast cancer risk and historical exposure to pesticides from wide-area applications assessed with GIS. Environ Health Perspect 2004; 112 (8): 889-97.
17. Ch. Groshart, P.C. Okkerman (BKH, Consulting Engineers). Towards the establishment of a priority list of substances for further evaluation of their role in endocrine disruption. Delft: EUROPEAN COMMISSION DG ENV. 2000. Informe M0355008/1786Q/10/11/00. 35 pp.
18. PNUMA (Programa de las Naciones Unidas para el Medio Ambiente). Conferencia de las Partes. Convenio de Estocolmo sobre contaminantes orgánicos persistentes. UNEP/POPS/COP.1/23. Informe de Primera reunión, Punta del Este, Uruguay, Mayo 2005. Documento K0473589(S) 250105 270105.
19. Oberdorster E, Chee AO. Gender benders at the beach: endocrine disruption in marine and estuarine organisms (Annual Review). Environ Toxicol Chem 2000; 20 (1): 23-36.
20. Fox JE, Starcevic M, Jones PE, Burow ME, McLachlan JA. Phytoestrogen signaling and symbiotic gene activation are disrupted by endocrine-disrupting chemicals. Environ Health Perspect 2004; 112 (6): 672-7.
21. Tabb MM, Kholodovych V, Grün F, Zhou C, Welsh WJ, Blumberg B. Highly chlorinated PCBs inhibit the human xenobiotic response mediated by the steroid and xenobiotic receptor (SXR). Environ Health Perspect 2004; 112 (2): 163-9.
22. Shugart LR. Molecular markers to toxic agents. En: Newman CM & Jagoe CH, Editors, Ecotoxicology. A Hierarchical Treatment. New York: Lewis Publishers; 1996, Capítulo 5.
23. Goodbred SL, Gilliom RJ, Gross TS, Denslow NP, Bryant WL, Schoeb TR. Reconnaissance of 17b-estradiol, 11- ketotestosterone, vitellogenin, and gonad histopathology in common carp of United States streams: potential for contaminant induced endocrine disruption. Sacramento: U. S. Geological Survey Open-File, 1997, Report nr 96-627. 47 pp.
24. Schmitt CJ, Dethloff G M, Eds. Biomonitoring of Environmental Status and Trends (BEST) Program: selected methods for monitoring chemical contaminants and their effects in aquatic ecosystems. Columbia: U.S. Geological Survey, Biological Resources Division, 2000, Information and Technology Report USGS/BRD-2000-0005. 2000. 81 pp.
25. Solé M, Raldua D, Piferrer F, Barcelo D, Porte C. Feminization ofwild carp, Cyprinus carpio, in a polluted environment: plasma steroid hormones, gonadal morphology and xenobiotic metabolizing system. Compar Biochem and Physiol 2003; 136: 145–56.
26. Blázquez M, Bosma PT, Fraser EJ, Van Look KJW, Trudeau VL. Fish as models for the neuroendocrine regulation of reproduction and growth. Comparative Biochemistry and Physiology Part C, 1998; 119: 345-64.
27. Denslow ND, Chow MC, Kroll KJ, Green L. Vitellogenin as a biomarker of exposure for estrogen or estrogen mimics. Ecotoxicology 1999; 8: 385-98.
28. Kime DE, Nash JP, Scott AP. Vitellogenesis as a biomarker of reproductive disruption by xenobiotics. Aquaculture 1999; 177: 345–52.
29. OECD (Organisation For Economic Co-Operation And Development), 2001. Detailed Review Paper Appraisal of Test Methods for Sex Hormone Disrupting Chemicals. Environment Health and Safety Publications Series on Testing and Assessment No. 21. Evironment Directorate OECD. Paris, Francia. May 2001. 320 PP.
30. Kime DE, Nash JP. Gamete viability as an indicator of reproductive endocrine disruption in fish. Sci Total Environ 1999; 233: 123-9.
31. Schreck CB, Contreras-Sanchez W, Fitzpatrick MS. Effects of stress on fish reproduction, gamete quality, and progeny. Aquaculture 2001; 197: 3–24.
32. Yaron Zvi. Endocrine control of gametogenesis and spawning induction in the carp. Aquaculture 1995; 129: 49-73.
33. Nagahama Y. 17a,20b-Dihydroxy-4-pregnen-3-one, a maturation-inducing hormone in fish oocytes: Mechanisms of synthesis and action. Steroids 1997; 62: 190-6.
34. Campoy Folgoso C, Jiménez-Torres M, Machado I, Sierra P, Fernández JM, Olea MF, et al. Paso transplacentario de disruptores endocrinos y desarrollo neonatal. An Pediatr (Barc) 2004; 60, Supl. 2: 93.
35. Matlai P, Beral V. Trends in congenital malformations of external genitalia. Lancet 1985; 1 (8420): 108.
36. Toppari J, Larsen JC, Christiansen P, Giwercman A, Grandjean P, Guillette LJ Jr et al. Male reproductive health and environmental xenoestrogens. Environ Health Perspect 1996; 104 (4): 741-803.
37. Silver R. What is the etiology of hypospadias? A review of recent research. Del Med J 2000; 72 (8): 343-7.
38. Olea N, Pazos P, Expósito J. Inadvertent exposure to xenoestrogens. Eur J Cancer Preven 1998; 7: 17-23.
39. Gilberto F. Chavez, GF., JF. Cordero, JE. Becerra. Birth Defects and Genetic Diseases Branch Division of Birth Defects and Developmental Disabilities. Atlanta: Center for Disease Control and Prevention. MMWR Morb Mortal Wkly Rep 1988, 37: 17-24.
40. Lucena RA, Allam MF, Costabeber IH, Villarejo ML, Navajas J. Breast cancer risk factors: PCBS congeners. Eur J Cancer Prev 2001; 10 (1): 117-9.
41. CEC (COMMISSION OF THE EUROPEAN COMMUNITIES). Bruselas: Commission staff working document on implementation of the Community Strategy for Endocrine Disrupters. 1999. Segundo Informe sobre la estrategia comunitaria sobre disruptores endocrinos (SEC (2004) 1372). 55 pp. [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ]
Aceptado para su publicación el 14 de mayo de 2005














