Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. v.39 n.3 La Plata jun./sept. 2005
BIOQUÍMICA CLÍNICA
Valores de referencia para marcadores tumorales séricos dosados por inmunoensayo*
Rosa Silvina Guber1, Nilda Arias de Sandoval1, Norma Ruiz de Martínez2, Analía Graciela Soria de González2
1. Bioquímica
2. Doctora en Bioquímica
* Laboratorio de Patología Molecular "LAPAM". Facultad de Bioquímica, Química y Farmacia. Universidad Nacional de Tucumán. Hospital Centro de Salud "Zenón Santillán". Av. Avellaneda 750, (4000) San Miguel de Tucumán. Argentina.
Este trabajo fue realizado con fondos provenientes del Consejo de Investigaciones de la UNT (CIUNT).
Resumen
El objetivo de este trabajo fue establecer valores de referencia (VR) para cinco marcadores tumorales de gran utilidad en clínica oncológica y comparar los valores establecidos con los recomendados por los fabricantes, así como determinar la influencia de la edad y del estado menstrual sobre los mismos. En el suero de 335 mujeres sanas (edad media de 38,20 ± 11,0 años con rango de 15 a 65 años) fueron determinados los niveles de CA 15.3, CA 125, ferritina (Ferr), antígeno carcinoembrionario (CEA) y prolactina (PRL). Las determinaciones fueron efectuadas con un sistema automatizado (Roche) que emplea técnicas de enzimoinmunoensayo con anticuerpos monoclonales. Los valores de referencia, definidos sobre la base del percentilo 95, fueron los siguientes en las mujeres premenopáusicas: CA 15.3 = 20 U/mL; CA 125 = 24 U/mL; CEA = 3 ng/mL; PRL = 25 ng/mL. En las mujeres sanas postmenopáusicas los valores de referencia calculados fueron los siguientes: CA 15.3 = 24 U/mL; CA 125 = 19 U/mL; CEA = 4 ng/mL; PRL = 19 ng/mL. Los VR sugeridos para Ferr sérica son: 138 ng/mL, 171 ng/mL, 286 ng/mL para mujeres menores de 40 años, entre 41 y 50 años y mayores de 51 años respectivamente. Los VR encontrados no fueron concordantes con los recomendados por los fabricantes, lo cual indica la importancia de la aplicación de los mismos en la clínica oncológica de acuerdo a la edad o al estado menopáusico de la mujer.
Palabras clave: valores de referencia * marcador tumoral * CA 15.3 * CA 125 * antígeno carcinoembrionario * ferritina * prolactina * menopausia
Summary
Reference values for tumor serum markers dosed by immunoassay
The aim of this work was to determine the reference values (RV) for five tumor markers of great usefulness in oncologic medicine. The stated values were compared to the ones recommended by the manufacturers and the influence of the menstrual state over them was also studied. The levels of CA 15.3, CA 125, ferritin (Ferr), carcinoembryonic antigen (CEA) and prolactin (PRL) were determined in the serum of 335 healthy women (aged 15 to 65 years old). The RV based on percentile 95 were as follows: CA 15.3 = 20 U/mL; CA 125 = 24 U/mL; CEA = 3 ng/mL; PRL = 25 ng/mL, in premenopausic women. In healthy postmenopausic donors the RV were as follows: CA 15.3 = 24 U/mL; CA 125 = 19 U/mL; CEA = 4 ng/mL; PRL = 19 ng/mL. The RV of Ferr were as follows: 138 ng/mL, 171 ng/mL, 286 ng/mL for women donors less than 40 years old, 41-50 and over 51 years old, respectively. The observed reference values were not concordant with those recommended by the manufacturers, suggesting the importance of women's age or menopausal stage in serum marker levels.
Key words: reference values * tumor marker * CA 15.3 * CA 125 * carcinoembryonic antigen * ferritin * prolactin * menopausic
INTRODUCCIÓN
La oncología clínica es una especialidad multidisciplinaria cuyo campo de acción es el diagnóstico, tratamiento y el cuidado general del paciente portador de cáncer. En este campo, un número cada vez mayor de marcadores tumorales (MT) son estudiados con el propósito de evaluar su aplicación como método de tamizaje, diagnóstico temprano y en el seguimiento de los pacientes con cáncer (1). El antígeno asociado a tumor CA 15.3 es el marcador tumoral de elección para el cáncer de mama, pues se ha demostrado que los niveles séricos del mismo aumentan con el estado avanzado de la enfermedad (2). Asimismo, un valor inicial elevado de este marcador que no disminuye con el tratamiento reflejaría la falta de respuesta al mismo, considerándose un factor pronóstico adverso, y un indicador temprano de enfermedad metastásica, pero los beneficios clínicos de su determinación no fueron establecidos (3). El CA 125 es una mucina glicosilada que se expresa en el epitelio del endometrio, endocervix y trompa de Falopio (4)(5). Es el mejor marcador tumoral sérico disponible para el cáncer de ovario epitelial, aunque no es suficientemente sensible y específico para ser utilizado como método de tamizaje o diagnóstico en la población general (6), pero sí es recomendable su uso en mujeres de alto riesgo por su historia familiar de cáncer de ovario (7). Este marcador se encuentra elevado en el 90% de las mujeres con cáncer de ovario avanzado (8); sin embargo, numerosas patologías benignas cursan con elevación del mismo, tales como peritonitis, endometriosis, diverticulitis y está elevado en condiciones fisiológicas como embarazo y menstruación (9). Fue demostrado que las pacientes portadoras de lesiones escamosas intraepiteliales no menopáusicas presentaron niveles elevados de este marcador (10). La ferritina (Ferr) es una proteína almacenadora de hierro importante no sólo en enfermedades que involucran el transporte, captación y almacenamiento de hierro sino también en enfermedades inflamatorias, infecciones, injuria y reparación en las que se incluyen lesiones malignas y pacientes con cáncer (11). Es así que se ha demostrado un incremento de la Ferr total, como así también, aumento en la producción de Ferr ácida en el suero de pacientes con distintos tipos de cáncer (12). Ulbich y col. demostraron que la Ferr sérica estaba significativamente elevada en las pacientes con cáncer de mama y que estos niveles podrían predecir la presencia de nódulos linfáticos afectados (13). El antígeno carcinoembrionario (CEA) es el MT sérico más útil para el cáncer colorrectal. Sin embargo, no se recomienda la determinación de este marcador para los programas de tamizaje ni para el diagnóstico temprano de esta patología por su falta de sensibilidad y especificidad. La Sociedad Americana de Oncología Clínica (ASCO) aconseja determinar los niveles séricos del CEA antes de la cirugía porque los resultados podrían complementar la estadificación del tumor y planificar el tratamiento quirúrgico. Asimismo, niveles preoperatorios elevados de CEA están asociados a un riesgo elevado de recurrencia, sin embargo, la importancia del CEA en la detección temprana de la misma es controvertida. Se recomienda su determinación para monitorear los pacientes con cáncer colorrectal avanzado y para el control de la respuesta al tratamiento y se sugiere el dosaje de este marcador con un intervalo de dos o tres meses durante los dos años posteriores al diagnóstico inicial (14)(15). El CEA sérico también se usa en pacientes con cáncer de mama, pero no es lo suficientemente sensible ni específico para detectar esta patología en estadíos tempranos. Los niveles de este MT son directamente dependientes del tamaño del tumor primario y de la metástasis tumoral (16)(17). La prolactina (PRL) es una hormona pituitaria cuyo órgano blanco más importante es la glándula mamaria. La PRL es también sintetizada en sitios extrapituitarios donde actuaría como factor autócrino/parácrino (18). El tejido normal mamario y maligno es una fuente significativa de PRL extrapituitaria y ésta podría ejercer una acción proliferativa lo que ha llevado a sugerir un posible rol en la génesis del cáncer de mama (19). La sensibilidad de la determinación de PRL sérica no es satisfactoria para el diagnóstico de cáncer de mama pero podría ser utilizada como método complementario en el seguimiento de las pacientes con esta patología (20)(21).
Los problemas de sensibilidad y especificidad asociados a la mayoría de los MT y particularmente a los aquí descriptos, determinan que no puedan ser utilizados como método de tamizaje y/o diagnóstico temprano del cáncer. La frecuencia de resultados falsos positivos está relacionada a los valores de referencia (VR) utilizados, que generalmente son los recomendados por los fabricantes y que varían según los tipos de técnicas realizadas en los laboratorios. La mayoría de estos inmunoensayos son estandarizados en el país de origen, estableciéndose el límite superior normal en una población que probablemente tenga características diferentes de la región donde se realizan los ensayos. Es por ello que el objetivo de este trabajo fue establecer los VR de MT útiles en ginecología oncológica tales como CA 15.3, CA 125, Ferr, CEA y PRL a partir de la determinación de los mismos en mujeres sanas y analizar cómo la edad y el estado menopáusico pueden modificar los niveles séricos de estos marcadores.
MATERIALES Y MÉTODOS
El Programa LAPAM de Prevención del Cáncer ha realizado estudios para la detección precoz poblacional del cáncer ginecológico en Tucumán (Argentina). Para ello las mujeres fueron encuestadas para conocer los factores de riesgo y luego de una selección fueron convocadas a participar voluntariamente 4.967 mujeres asintomáticas. A partir de este estudio se seleccionaron 335 mujeres sanas, quienes no presentaron patologías ginecológicas, ni fiebre o infecciones y reunían los criterios para ser dadoras en banco de sangre al tiempo de la toma de muestra. La edad promedio de las mujeres fue 38,20 ± 11,0 años con un rango de 15 a 65 años. A estas mujeres se les extrajeron muestras de sangre por punción venosa las que se dejaron coagular espontáneamente 30 minutos a 37 ºC. El suero fue separado por centrifugación y se conservó a –20 ºC hasta su uso. Una batería de cinco MT fueron determinados (CA 15.3, CA 125, Ferr, CEA y PRL) utilizando un sistema automatizado, mediante una técnica de ELISA con tecnología de estreptavidina que emplea anticuerpos monoclonales (Roche), siguiendo las indicaciones de los fabricantes. De acuerdo a la edad, a las mujeres se las clasificó en 4 grupos: A = 86 mujeres con edades igual o menor a 30 años. B = 107 mujeres con edades comprendidas entre 31 y 40 años. C = 72 mujeres con edades entre 41 y 50 años y el grupo D = 70 mujeres con edades igual o mayor a 51 años. Según el estado menstrual se las dividió en mujeres premenopáusicas (PM), las cuales tenían ciclos menstruales regulares (n = 238, media ± DE = 34,62 ± 8,5 años, rango 15-48 años) y mujeres postmenopáusicas (M) las cuales tenían una amenorrea que superaba un año (n = 59, media ± DE = 52,22 ± 8,3 años, rango 38-65 años).
El análisis estadístico se efectuó mediante la aplicación del test "t" de Student, considerándose un valor "p" menor a 0,05 como estadísticamente significativo.
RESULTADOS
En la Tabla I se muestran los resultados estadísticos básicos para cada marcador tumoral sérico dosado sin discriminar edad ni estado menopáusico. Los VR calculados definidos sobre la base del percentilo 95 fueron menores que los valores de referencia recomendados por el fabricante (VRF).
Los VR del MT CA 15.3 discriminado en los diferentes grupos etarios pueden observarse en la Figura 1 encontrándose niveles superiores en el grupo de mujeres ≥ 51 años (C = 10,7 ± 5,9 U/mL vs. D = 13,3 ± 5,5 U/mL, p = 0,01).
Tabla I. Resultados estadísticos básicos del grupo total (n = 335).
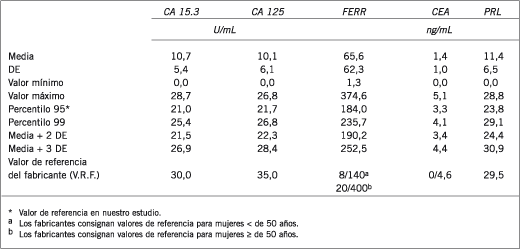
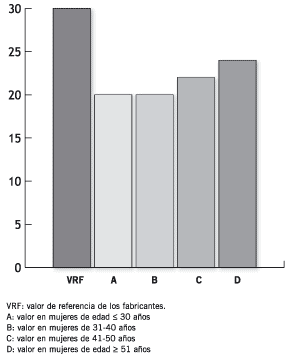
Figura 1. Niveles séricos de CA 15.3 (U/mL).
En la Figura 2 se ilustran los VR calculados para el MT CA 125 no habiéndose observado diferencias significativas para los diferentes grupos etarios analizados salvo en el grupo de mujeres de mayor edad. Los VR de Ferr sérica se muestran en la Figura 3; cuando se comparan los distintos grupos puede notarse que los VR aumentan con cada década siendo estas diferencias estadísticamente significativas entre los grupos B vs. C (p = 0,01) y C vs. D (p = 6,6 x 10-6). Los VR del CEA no se modificaron con la edad de las mujeres estudiadas (Figura 4).
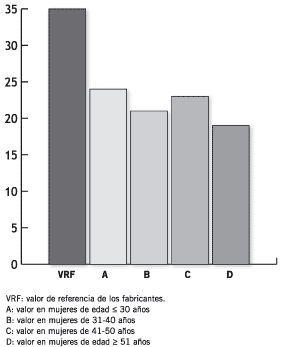
Figura 2. Niveles séricos de CA 125 (U/mL).

Figura 3. Niveles séricos de Ferritina (ng/mL).
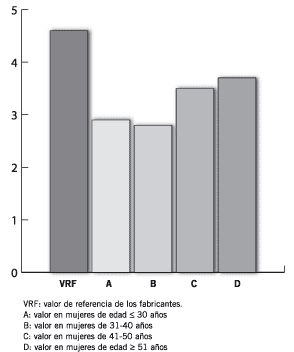
Figura 4. Niveles séricos de CEA (ng/mL).
En la Figura 5 puede observarse que los VR de la PRL sérica disminuyen a medida que aumenta la edad de las mujeres a las que se les ha dosado este marcador siendo esta diferencia estadísticamente significativa cuando se comparan los grupos C vs. D (p = 6,6 x10-3).
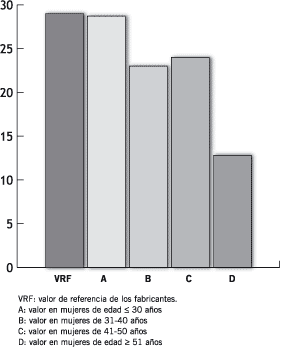
Figura 5. Niveles séricos de PRL (ng/mL).
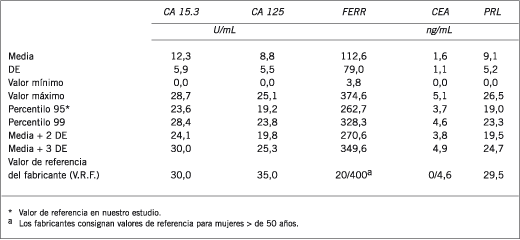
En las Tablas II y III se muestran los resultados estadísticos básicos para el grupo de mujeres PM y M, respectivamente. Cuando se analizaron los MT estudiados según el estado menopáusico, se observó que los VR del CA 15.3, Ferr y CEA aumentan significativamente y el CA 125 y la PRL sérica disminuyen significativamente en las mujeres menopáusicas (Figura 6).
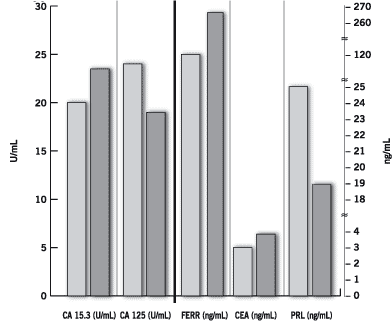
Figura 6. Niveles séricos de CA 15.3 - CA 125 - FERR - CEA y PRL en mujeres premenopáusicas y posmenopáusicas.
Tabla II. Resultados estadísticos básicos del grupo premenopáusico (n = 241).
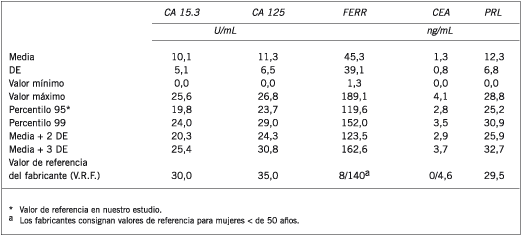
Tabla III. Resultados estadísticos básicos del grupo postmenopáusico (n = 94).
DISCUSIÓN Y CONCLUSIONES
La utilidad clínica de los MT depende de la sensibilidad y especificidad para detectar pacientes con cáncer en estadíos iniciales y mejor aún si tienen la capacidad de poder identificar lesiones precursoras. La sensibilidad y especificidad se encuentran inversamente relacionadas y ambas dependen de los VR aplicados para el MT estudiado. Este VR se calcula dosando el MT en estudio en una población sana y a partir de allí se obtiene el percentilo 95. Es por ello que en este trabajo se analizaron los niveles séricos de cinco MT usados comúnmente en ginecología oncológica como lo son el CA 15.3, CA 125, Ferr, CEA, PRL y se relacionó su comportamiento en los distintos grupos etarios y según el estado menopáusico de las mujeres estudiadas. Los VR definidos sobre la base del percentilo 95 obtenidos en este trabajo son menores que los VR recomendados por los fabricantes (Tabla I) probablemente porque estos VR fueron calculados en una población diferente a la definida en este estudio.
Cuando se analizan los VR calculados para el MT CA 15.3 en los diferentes grupos etarios puede observarse un incremento en las mujeres mayores de 51 años (Figura 1) que coincide con el estudio de este marcador en mujeres PM y M, por lo que se podría sugerir que los VR se ven influenciados principalmente por el estado menopáusico de las mujeres (Figura 6). Si bien los VR encontrados no están de acuerdo con los VRF, estos fueron similares a los encontrados por Gion y col. (22). Asimismo, fue demostrado que otros factores, como el uso prolongado de terapia hormonal de reemplazo, provocaría un aumento gradual de la concentración de CA 15.3 en mujeres sanas (23).
Los VR del antígeno asociado a tumor CA 125, como puede observarse en la Figura 2, disminuyeron significativamente en las mujeres de mayor edad, notándose que el estado menopáusico estaría modificando el valor máximo normal encontrado en este estudio (Figura 6). Estos resultados están de acuerdo con los encontrados por otros autores (24)(25). Asimismo, otras situaciones podrían influir en el cambio de los niveles séricos de CA 125 en mujeres M, tales como la histerectomía, el consumo de cafeína o tabaco, no habiéndose encontrado cambios con el uso de anticonceptivos orales o terapia hormonal de reemplazo (25).
La anemia que se observa en pacientes con enfermedades agudas y crónicas está relacionada con los procesos de inflamación (26). La Ferr sérica es una proteína almacenadora de hierro que se encuentra aumentada en procesos malignos tales como el cáncer de mama, cáncer de pulmón, cáncer oral y otros (13)(27)(28). La Ferr es usada en el laboratorio de rutina para el diagnóstico de anemias producidas por déficit de hierro, pero se dificulta su interpretación porque este MT es un reactante de fase aguda. Como consecuencia, los VR tomados de la literatura o los recomendados por los fabricantes están comprendidos en un amplio rango. Como se observa en la Figura 3, los VR calculados se modifican en cada década de vida y según el estado menopáusico de la mujer (Figura 6). La consideración de estos VR podría facilitar la interpretación de los resultados obtenidos en las pacientes con patologías en donde se observa modificación de los niveles séricos de Ferr.
Los VR del CEA sérico calculados son dependientes del estado menopáusico, observándose un aumento significativo en las mujeres menopáusicas (Figura 6) no habiéndose encontrado cambios de este marcador relacionados con la edad (Figura 4). La influencia de distintos factores sobre los niveles séricos del CEA fue documentada previamente (29). Otros trabajos demostraron la importancia de la determinación de este marcador y del cálculo de los VR locales, ya que se observó que la concentración sérica del CEA fue diferente en personas sanas de Kuwait cuando se la compara con personas que no son de este lugar (30). Asimismo, los valores de CEA son mayores en personas de sexo masculino y en aquellos que consumen tabaco (31). Numerosos factores podrían influir en las mujeres M para que tengan VR de CEA mayores: obesidad, terapia hormonal de reemplazo, edad de la menarca, edad de la menopausia y otros.
De los resultados obtenidos al efectuar el dosaje de PRL sérica en las mujeres sanas se calcularon los VR en los distintos grupos etarios, observándose una disminución significativa en las pacientes de mayor edad (Figura 5) lo que se manifiesta marcadamente al separar a las mujeres según el estado menopáusico (Figura 6). La disminución marcada de los VR en las mujeres M podría estar relacionada con el cese de la función ovárica y la consecuente caída de las hormonas esteroides sexuales, ya que fue demostrado el sinergismo de acción entre la PRL y estas hormonas (32).
De los datos obtenidos se podrían sugerir los siguientes VR para mujeres PM: CA 15.3 = 20 U/mL; CA 125 = 24 U/mL; CEA = 3 ng/mL; PRL = 25 ng/mL. En las mujeres M los valores que corresponden son: CA 15.3 = 24 U/mL; CA 125 = 19 U/mL; CEA = 4 ng/mL; PRL = 19 ng/mL. Los VR sugeridos para Ferr sérica son: 138 ng/mL, 171 ng/mL, 286 ng/mL para mujeres menores de 40 años, entre 41 y 50 años y mayores de 51 años, respectivamente.
Los resultados presentados en este trabajo ponen de manifiesto la importancia de la determinación de los VR y su aplicación en la clínica oncológica lo que facilitaría una correcta evaluación de la sensibilidad y especificidad de cada marcador estudiado.
Agradecimientos
Los autores agradecen al Sr. Miguel A. Martínez por la preparación del trabajo y el diseño gráfico de las figuras.
Correspondencia
DRA. ANALÍA SORIA DE GONZÁLEZ
Santiago 1316
(4000)SAN MIGUEL DE TUCUMÁN, Tucumán
República Argentina.
E-mail: gonzalez_stojan@uolsinectis.com.ar
Referencias bibliográficas
1. Navarro Romero M, Guindeo Casasús MC, Domínguez Cabrera C. Marcadores Tumorales. Biocancer 2004; 1: 1-9.
2. Gion M, Mione R, Leon AE, Dittadi R. Comparison of the diagnostic accuracy of CA 27.29 and CA 15.3 in primary breast cancer. Clin Chem 1999; 45: 630-7.
3. Basuyau JP, Blanc-Vincent MP, Bidart JM, Daver A, Deneux L, Eche N, et al. Clinical practice guidelines: Standards, Options and Recommendations (SOR) for tumor markers in breast cancer. Bull Cancer 2004; 91: 609-20.
4. Mylonas I, Makovitzky J, Richter DV, Yeschke U, Briese V, Friese K. Immuno histochemical expression of the tumor marker CA 125 in normal, hiperplastic and malignant endometrial tissue. Anticancer Res 2003; 23: 1075-80.
5. Bischof P. What do we know about the origin of CA 125? Eur J Obstet Gynecol Reprod Biol 1993; 49: 93-8.
6. Holubec Jr, Finek J, Topolcan O, Bouda J, Rokyta Z. Clinical relevance of tumor markers in epithelial ovarian cancer. Ceska Gynekol 2004; 69: 225-8.
7. Menon U, Jacobs IJ. Recent developments in ovarian cancer screening. Curr Opin Obstet Gynecol 2000; 12: 39-42.
8. Tuxen MK, Soletormos G, Dombernowsky P. Tumor markers in the management of patients with ovarian cancer. Cancer Treat Rev 1995; 21: 215-45.
9. Sjövall K, Nilsson B, Einhorn N. The significance of serum CA 125 elevation in malignant and non malignant diseases. Gynecol Oncol 2002; 85: 175-8.
10. Soria GAS, Rios HM, López S, Martínez MF, Guber RS, Frascarolo MJ, et al. Utilidad diagnóstica del marcador tumoral CA 125 en las patologías cervicouterinas. Acta Bioquím Clin Latinoam 2003; 37: 39-46.
11. Wu CG, Groenink M, Bosma A, Reitsma PH, Van Deventer SJH, Chamuleau RAFM. Rat ferritin – H: c DNA cloning, differential expression and localization during hepatocarcinogenesis. Carcinogenesis 1997; 18: 47-52.
12. Hazard JT, Drysdale JW. Ferritinemia in cancer. Nature 1977; 265: 755-6.
13. Ulbrich EJ, Lebrecht A, Schneider I, Ludwing E, Koelbl H, Hefler LA. Serum parameters of iron metabolism in patients with breast cancer. Anticancer Res 2003; 23: 5107-9.
14. Sturgeon C. Practice Guidelines for Tumor Markers use in the clinic. Clin Chem 2002; 48: 1151-9.
15. Bast RC, Ravdin P, Hayes DF, Bates S, Fritsche H, Jessup JM, et al. 2000 update of recommendations for the use of tumor markers in breast and colorrectal cancer: Clinical Practice Guidelines of the American Society of Clinical Oncology Clin Oncol 2001; 19: 1865-78.
16. Mujagic Z, Mujagic H, Prnjavorac B. The relationship between circulating carcinoembryonic antigen (CEA) levels and parameters of primary tumor and metastases in breast cancer patients. Med Arh 2004; 58: 23-6.
17. Clinton SR, Beason KL, Bryant S, Johnson JT, Wilson C, Holifield, et al. A comparative study of four serological tumor markers for the detection of breast cancer. Biomed Sci Instrum 2003; 39: 408-14.
18. Yamauchi T, Yamauchi N, Ucki K, Sufigama T, Waki H, Miki H, et al. Constitutive tyrosine phosphorylation of Erb B-2 vía Jak 2 by autocrine secretion of prolactin in human breast cancer. J Biol Chem 2000; 275: 33937-44.
19. Ben-Jonathan N, Mershon JL, Allen DL, Steinmetz RW. Extrapituitary prolactin: distribution, regulation, functions and clinical aspects. Endocr Rev 1996; 17: 639-69.
20. Arslan N, Serdar M, Deveci S, Ozturk B, Narin Y, Ilgan S, et al. Use of CA 15-3, CEA and prolactin for the primary diagnosis of breast cancer and correlation with the prognostic factors at the time of initial diagnosis. Ann Nucl Med 2000; 14: 395-9.
21. Guber RS, Soria GA, Stisman E, Ruiz MN. Niveles de Prolactina circulante en patologías mamarias. Acta Bioquím Clin Latinoam 2003; 37: 137-43.
22. Gion M, Mione R, Leon AE, Luftner D, Molina R, Possinger K, et al. CA 27.29: a valuable marker for breast cancer management. A confirmatory multicentric study on 603 cases. Eur J Cancer 2001; 37: 355-63.
23. Kochanska-Dziurowicz AA, Szostek-Gawel V, Bijak A, Wroblewska-Adamek I, Widala E, Bieniec M, et al. Assessment of selected neoplastic markers in women receiving hormone replacement therapy. Wiad Lek 2003; 56: 407-11.
24. Crump C, Mc Intosh MW, Urban N, Anderson G, Karlan BY. Ovarian Cancer Tumor Marker behavior in asymptomatic healthy women: implicatios for screening. Cancer Epidemiol Biomarkers Prev 2000; 9: 1107-11.
25. Pauler DK, Menon V, Meintosh M, Symecko HL, Skates SJ, Jacobs IJ. Factors influencing serum CA 125 II levels in healthy postmenopausal women. Cancer Epidemiol Biomarkers Prev 2001; 10: 489-93.
26. Wiel Avandi. Anemia in critically ill patients. Eur J Intern Med 2004; 15: 481-6.
27. Koc M, Taysi S, Sezen O, Bakan N. Levels of some acute-phase proteins in the serun of patients with cancer during radiotherapy. Biol Pharm Bull 2003; 26: 1494-7.
28. Colella G, Cozzolino A, Santagata M, Vicidomini A, Itro A. Circulating biomarkers association in the follow-up of patients with oral cancer. Minerva Stomatol 2001; 50: 151-6.
29. Herbeth B, Bagrel A. A study of factors influencing plasma CEA levels in an unselected population. Oncodev Biol Med 1980; 1: 191-8.
30. al-Sayer N, al-Bader A, Hussein T, Mathew A, Behbehani A, Dashti H, et al. A profile of tumor markers in the population of Kuwait. Anticancer Res 1999; 19: 2369-72.
31. Behbehani AI, Mathew A, Farghaly M, Van Dalen A. Reference levels of the tumor markers carcino-embryonic antigen, the carbohydrate antigens 19-9 and 72-4, and cytokeratin fragment 19 using the Elecsys Relecsys 1010 analyzer in a normal population in Kuwait. The importance of the determination of local reference levels. Int J Biol Markers 2002; 17: 67-70.
32. Freeman ME, Kanyicska B, Lerant A, Nagy G. Prolactin: Structure, function and regulation of secretion. Physiol Rev 2000; 1523-631. [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ]
Aceptado para su publicación el 29 de junio de 2005














