Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. v.39 n.4 La Plata sept./dic. 2005
TEMAS DE INTERÉS
Reseña sobre vigilancia y prevención de la influenza aviar y rol zoonótico
Oscar Roberto Linzitto1, Cora Espinoza2, Celso Alberto Rodríguez3, Marcelo Pecoraro4
1. Bacteriólogo. Profesor Titular Cátedra de Microbiología Especial. Carrera de Microbiología Clínica e Industrial. Profesor Adjunto de Microbiología. Facultad de Ciencias Veterinarias. Universidad Nacional de La Plata. Calle 60 y 118. 1900 La Plata.
2. Médico veterinario. Servicio Nacional de Sanidad y Calidad Agroalimentaria.
3. Médico veterinario. Miembro Consultor de OPS/OMS en Argentina.
4. Dr. en Medicina Veterinaria. Phd. Profesor Adjunto. Cátedra de Virología. Carrera de Microbiología Clínica e Industrial. Facultad de Ciencias Veterinarias. Universidad Nacional de La Plata. Calle 60 y 118. 1900 La Plata.
INFLUENZA AVIAR
El virus de influenza tipo A, infecta a un gran número de especies animales que incluyen mamíferos marinos, cerdos, equinos, diversos tipos de aves y también al hombre. La enfermedad infecto-contagiosa, producida por el virus influenza tipo A y algunos de los subtipos en aves se denomina Peste Aviar, Influenza Aviar o Gripe Aviar. Existen fuertes evidencias sobre el rol zoonótico de alguno de los subtipos del virus A de Influenza Aviar (IA). Mediante investigaciones filogenéticas y ecológicas, estos virus han sido detectados en aves acuáticas que actúan como reservorios naturales y de propagación para otras especies de animales (1). La Influenza Aviar es una enfermedad exótica para la República Argentina (2). Existen subtipos del virus de la Influenza Aviar debidos a las diferencias antigénicas en base a la hemoaglutinina (H) y a la neuraminidasa (N) presentes en su estructura. Para el virus influenza A hay 16 diferentes antígenos HA (H1 al H16) y 9 diferentes antígenos NA (N1 al N9). Hasta hace poco tiempo se reconocían 15 subtipos HA, pero un nuevo tipo (H16) fue aislado en 1999 y reportado en 2005 en Suiza y Holanda (3). Exhiben una gran multiplicidad antigénica y capacidad de mutación, así como un amplio espectro de virulencia. Los virus de la influenza aislados de pájaros pertenecen, sin excepción, al tipo A y contienen todos los subtipos hasta ahora conocidos en las más variadas combinaciones. Los subtipos que afectan a las aves son específicos de éstas y las infecciones en las aves domésticas, incluidos pavos, pollos, gallinas de Guinea, perdices, codornices, faisanes, gansos y patos varían desde infecciones respiratorias leves y subclínicas, hasta la presentación aguda y generalizada con severa disminución de la producción y la muerte de parvadas enteras. Se pueden presentar como virus de baja patogenicidad y después por mutación en su hemoaglutinina, se transforman en virus de alta patogenicidad (2).
Es una enfermedad altamente contagiosa, que tiene como principales huéspedes a gallinas y pavos, aunque es probable que todas las especies aviares sean susceptibles a la infección. En algunos casos, la enfermedad se presenta con pocos de estos síntomas o bien en forma fulminante, matando a las aves, sin que se observen síntomas previos. Las tasas de morbilidad y mortalidad también son muy variables. Lo que más frecuentemente se observa es una alta morbilidad y baja mortalidad; sin embargo, en el caso de virus altamente patógenos, la morbilidad y la mortalidad pueden alcanzar al 100% (2).
ROL ZOONÓTICO DEL VIRUS DE LA PESTE AVIARIA
Las pandemias de los años 1918, 1957 y 1968 de influenza en humanos, se han producido por modificaciones genéticas a partir del virus influenza A proveniente de animales. Existen fuertes evidencias concluyentes sobre el riesgo zoonótico de las infecciones por virus influenza A de animales que han pasado a humanos. Desde 1996 se han producido brotes de Influenza Aviaria a las variedades A/H7N7, A/H9N2 y A/H5N1 que han sido transmitidas a humanos no se han diseminado en la población humana en general, pudiendo dar lugar a una posible pandemia de la enfermedad (4).
Por estos casos y por el anuncio hecho por científicos chinos al comprobar la presencia del virus H5N1 de los pollos en cerdos, y en personas en China, en Taiwán, en Tailandia y en Vietnam, todas las autoridades sanitarias de Asia y de otros países y la Organización Mundial de la Salud (OMS), la OIE, la FAO, etc., se han puesto en alerta roja para evitar una pandemia, que de no controlarse podrá dejar cifras importantes de muertes humanas (5)(6).
En la Tabla I se consignan los aislamientos realizados desde los años 1959 a 1991 y desde 1992 a 2003 a los efectos de ilustrar acerca de lo hallado en los brotes ocurridos durante estos períodos, las especies de aves afectadas, el lugar u origen de los casos, año de ocurrencia y variedad o subtipo viral actuante.
Tabla I. Aislamientos desde 1959 del virus de la Gripe Aviar a partir de aves.

De la tabla se infiere que durante 32 años ocurrieron 10 brotes de IA y en los últimos años se presentaron 11, incrementando la frecuencia de ocurrencia.
El virus A/H5N1 ha estado incriminado en una epidemia de IA en aves domésticas y silvestres en varios países de Asia, con una alta patogenicidad, con consecuencias económicas y sanitarias importantes. Estos brotes ocurridos en el año 2003 produjeron el contagio a personas con un 33% de mortandad. Estos casos provocaron un alerta internacional ante la posibilidad de la presencia de una pandemia de IA en humanos causada por esta variedad de virus (A/H5N1)
Brotes por A/H5N1 en aves migratorias se han dado en China, Rusia, Kazajstán y Mongolia; algunas de esas aves tienen rango migratorio intercontinental (Europa, Asia y Oceanía), habiéndose extendido la epidemia hacia países de la región este de Europa (Rumania y Turquía) (5).
En la Tabla II se detallan los lugares y fechas de aislamiento del virus de Influenza Aviaria correspondiente al subtipo AH5N1 durante el año 2004.
De la Tabla II se infiere la detección de 11 brotes en un año de IA, con distintas variedades del virus de la IA y en distintos lugares del mundo.
Tabla II. Aislamiento de virus de la IA a partir de aves durante el año 2004.
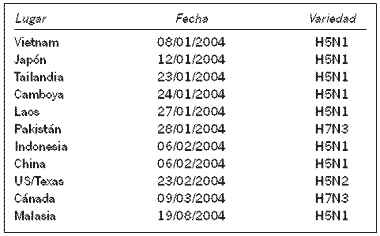
Tabla III. Aislamientos de virus IA en 2005.

Durante 1997 y 2001 hubo notificación de casos de IA de alta patogenicidad en el hemisferio occidental y en el Pacifico. En Australia en 1997 hubo un brote de IA en pollos y en emúes causado por un virus del tipo N7H4 de baja patogenicidad. Los episodios estuvieron relacionados con pollos y aves silvestres. En el área americana, Canadá notificó brotes en pollos producidos por virus influenza de los tipos H1, H6, H7 y H10 y de los tipos H3 y H13 en aves importadas y silvestres. En México se detectó el virus de influenza del tipo H5N2 de baja patogenicidad y de alta patogenicidad aislado a partir de pollos comerciales desde 1997 al 2001. En otros países de América han ocurrido brotes de IA de alta y baja patogenicidad. Periódicamente, a su vez, se han hallado en aves acuáticas silvestres que actúan como reservorio natural. La mayoría de los tipos de virus que se han aislado corresponden al virus influenza tipo A. Esto configura un factor de riesgo permanente para avicultura y la salud humana de la región. Paralelamente, dada la forma agresiva del virus H5N1, existe riesgo de diseminación de esta variante y se teme que pueda alcanzar nuestro continente a través de las aves migratorias o por el comercio ilegal de aves (5).
Durante el año 2005 han ocurrido numerosos brotes de IA en Asia y Europa, lo que dio lugar a reafirmar la posibilidad de una pandemia de la enfermedad a nivel humano. En la Tabla III se consignan los lugares y fechas de hallazgo del virus AH5N1
Los subtipos de virus influenza que han sido confimados en humanos productores de pandemia, son: el H1N1, causando la Gripe Española, el H2N2 la gripe asiática y el H3N2 causando la gripe de Hong Kong. Los subtipos H5N1, H7N7, H9N2, H7N2, H7N3. han sido asociados últimamente con infección de gripe aviaria en humanos.
Turquía registra sus primeros casos mortales humanos del virus de la IA, al 6 de enero del 2006. En Asia se han producido 142 casos en humanos, de los que habían muerto 74 (4 en Camboya, 14 en Tailandia, 22 en Vietnam, 11 en Indonesia y 3 en China).
UBICACIÓN Y CARACTERÍSTICAS DE LOS VIRUS INFLUENZA
Los virus influenza (VI) son virus a ARN pertenecientes a la familia Orthomyxoviridae, segmentados y capsulados. Se han descrito 3 tipos de virus influenza: A, B y C, clasificados de acuerdo a la capacidad de reacción serológica de sus proteínas internas. Los virus B y C causan enfermedad sólo en el hombre, mientras que influenza A, además, infecta a una amplia variedad de aves y animales. Los virus de influenza son clasificados como miembros de la familia Orthomyxoviridae (del griego orthos, 'standard, correcto', y myxo, 'mucus') por su habilidad de unirse al mucus. Estos virus tienen un genoma de ARN segmentado y de polaridad negativa. La replicación es nuclear. Los viriones son envueltos por una cubierta lipídica proveniente de la célula huésped. Son esféricos pero también pueden observarse formas filamentosas al microscopio electrónico. Los esféricos son de 50-120 nm en diámetro, los filamentosos de 20 nm de diámetro y unos 200-300 nm de largo. En la envoltura poseen distintas proyecciones con forma de espícula (cerca de 500 que sobresalen unos 10-14 nm) uniformemente extendidas en toda la superficie. Tienen simetría helicoidal. Richard Shope en 1931 aisló por primera vez el virus de la influenza porcina Tipo A. En 1940 se aisló e identificó un nuevo agente, el que presentó marcadas diferencias antigénicas con los precedentes, denominándoselo virus Influenza Tipo B y en el año 1949 se identificó el Tipo C, con lo que se completó el grupo de estos organismos conocidos hasta el presente. Son virus con cubierta externa, cuyo genoma es ARN segmentado en 8 segmentos, lo que facilita la recombinación viral y los fenómenos de reactivación. El segmento 1 (2341 bases) denominado PB2, con actividad de polimerasa, se une al Cap 1 en 5´ del ARN mensajero celular (ARNmc). Migra al núcleo. El segmento 2 (2341 bases) denominado PB1, con actividad de polimerasa, produce la elongación del ARN viral (ARNv) naciente y también actúa en la síntesis de ARNv. Tiene localización nuclear. El segmento 3 (2.233 bases) denominado PA, tiene actividad de polimerasa aunque se le atribuye también actividad de proteasa y timidinquinasa. Su localización es nuclear. El segmento 4 (1.778 bases) codifica una proteína denominada hemoaglutinina (HA), que es una glicoproteína de envoltura, el mayor antígeno responsable de la unión del virión al receptor celular previo clivaje (HA0 en HA1 y HA2). El segmento 5 (1.565 bases) codifica la nucleoproteína (NP) que se une al ARN, parte del complejo de polimerasas y actúa en el transporte del ARNv entre citoplasma y núcleo. El segmento 6 (1.413 bases) corresponde al gen de la neuraminidasa (NA), glicoproteína de envoltura y segundo mayor antígeno. Actúa en la liberación del virus por medio del clivaje de la terminal de ácido siálico de la glicoproteína receptora. El segmento 7 (1.027 bases) codifica la proteína M1, proteína de matriz que es el mayor componente del virión y la M2, proteína integral de membrana- canal iónico. El segmento 8 (890 bases) codifica la proteína NS1, no estructural, con localización nuclear y efecto sobre el transporte celular de ARN, splicing y traducción. El mismo segmento codifica la NS2, no estructural: nuclear-citoplásmica, la cual parece modular la síntesis de NS (1) (2).
Los estudios sobre la estructura y función de estos virus han logrado identificar distintos componentes antigénicos del virión, cuya identidad química y funcional es característica. Los métodos serológicos permitieron identificar las proteínas de la superficie en forma de espículas. La HA es la glicoproteína principal, la cual es altamente inmunogénica y está intercalada irregularmente con la NA. La relación entre HA/ NA es de 4-5 a 1. La nucleocápside (NC) está incluida dentro de la membrana lipoproteica; las nucleoproteínas (NP) son de diverso tamaño y su arreglo dentro del virión es incierto. Los virus de influenza se dividen en distintos tipos (A, B, C) en base a diferencias antigénicas en la nucleoproteína y en la proteína de matriz (M1). Los virus de Influenza tipo A son además subtipificados en base a las diferencias antigénicas de sus glicoproteínas de superficie, la HA y la NA. Actualmente en los virus de Influenza tipo A han sido identificadas 16 HA y 9 NA.
Los antígenos de superficie son, a su vez, los que experimentan en forma independiente variaciones genéticas. Es así que se describen dos tipos fundamentales de cambios genéticos: a) "Drift o deriva antigénica" (modificaciones menores del genoma que ocurren muy gradualmente en los miembros de un mismo subtipo) y, b) "Shift antigénico" (cambios mayores del genoma por recombinación de alta frecuencia o intercambio completo de segmentos). Estos, por lo general, son de brusca aparición y caracterizan a las cepas pandémicas.
Los virus de Influenza Tipo A provocan infecciones naturales en humanos, cerdos, equinos, aves, mamíferos acuáticos y primates. El Tipo C también infecta a cerdos pero el Tipo B, hasta el presente, sólo ha sido comprobado en humanos (6)(7).
REPLICACIÓN
La expresión y replicación del virus de influenza han sido ampliamente detalladas por Krug y col. Según estos autores, una partícula de virus de influenza se une a la célula por interacción entre la HA viral y una molécula de ácido siálico de una glicoproteína receptora en la superficie de la célula. A continuación, el virión es endocitado y encerrado en una vesícula endocítica. El bajo pH de la misma produce un cambio conformacional en la molécula de HA que facilita la fusión de la membrana viral y de la vesícula endocítica, permitiéndole al virión liberar su contenido en el citoplasma celular. La nucleocápside (NC) migra al núcleo y la polimerasa que lleva asociada comienza la trascripción primaria del ARN mensajero viral. Estos transcriptos son usados para la traducción de proteínas virales tempranas NP y NS1.
La traducción de ARN mensajero del huésped es bloqueada. El acúmulo de NP produce un cambio en el genoma celular infectado disparando la síntesis de ARN viral. Este es encapsidado por la NP en el núcleo y funciona como molde para la trascripción secundaria de ARN mensajero. Tardíamente, los principales productos de la traducción son las proteínas M1, HA y NA. Estas dos últimas son procesadas y transportadas a la superficie donde se integran a la membrana celular. El ensamble de las nuevas partículas es en el citoplasma. La NC es encerrada por una cubierta de M1 y brota fuera de la célula usando la membrana celular como parte de su envoltura junto con las glicoproteínas de superficie. La actividad de la NA produce la liberación de los viriones de la célula hospedadora (6)(7).
Los virus de la influenza A tiene hospederos naturales muy variados y los subtipos del grupo han sido detectados en diferentes especies animales. En la Tabla IV se detallan las especies animales y los subtipos hallados (3).
Tabla IV. Ecología del virus Influenza tipo A.

PATOGÉNISIS
La patogenicidad de los virus de IA sigue el patrón de los Ortomixoviradae, es extremadamente variable y se basa en las características del subtipo del virus (hemoaglutinina). A menudo se ha observado que un virus patógeno para una especie avícola no necesariamente lo es para otra. La característica de los virus de IA es su capacidad de mutación, de manera que subtipos no patógenos pueden convertirse en patógenos. De aquí surge la recomendación de la Oficina Internacional de Epizootias en cuanto a incluir en la Lista A de enfermedades a la "Influenza Aviar Altamente Patógena" y no a todos los casos en los que se detecte el virus de otros subtipos (2).
La Patogenicidad de algunas cepas de los virus de IA, radica en la Hemoaglutinina de superficie o Proteína de fusión. Cuando en la misma existe una cadena de aminoácidos básicos, que son fácilmente "reconocidos" por las proteasas celulares, el virus puede penetrar en cualquier tipo de células, invadiendo diferentes tejidos y órganos provocando un cuadro clínico prácticamente mortal. Cuando no existe esta cadena de aminoácidos básicos, la hemoaglutinina de superficie, solamente es "reconocida" por la tripsina, proteína que se encuentra en el tracto respiratorio y digestivo de las células del huésped, de manera que el virus solamente invade estos tejidos, dando un cuadro semejante a una gripe sin gravedad para las aves.
La infección por el virus de influenza es adquirida por un mecanismo que involucra la transferencia de secreciones respiratorias que contienen partículas virales de un individuo infectado a otro susceptible. Gran cantidad de virus está presente en las secreciones del individuo infectado y disponible para ser diseminado a través de pequeñas gotitas (< 10 µm) por medio de estornudos y tos. Además, la naturaleza explosiva e inicio simultáneo de la enfermedad en distintos individuos sugiere que un solo individuo infectado es capaz de transmitir virus a un gran número de individuos susceptibles. Una vez que el virus es depositado en el epitelio del tracto respiratorio este puede adherirse y penetrarlo. Luego de la adsorción y penetración del virus a las células comienza la replicación viral (6)(7).
CUADRO CLÍNICO
El período de incubación de la Influenza Aviar Altamente Patógena es de 21 días. Los signos y síntomas son muy variables. Las aves enfermas pueden reflejar alteraciones en los sistemas respiratorio, digestivo, reproductor y nervioso. Los signos más frecuentes son: disminución de la actividad locomotriz, reducción del consumo de alimentos, emaciación, problemas respiratorios que incluyen tos, estornudo, estertores, plumaje erizado, edema de la cabeza y cara, cresta y barbillas cianóticas y, en ocasiones, necróticas, desórdenes nerviosos, diarrea, y en gallinas, disminución de la postura. Las lesiones pueden ser muy variadas, desde la enfermedad hiperaguda con ausencia casi total de signos o lesiones, pero altamente mortal, hasta las epizootias caracterizadas por una enfermedad leve con baja mortalidad.
En gallinas:
• Congestión grave de la musculatura
• Deshidratación
• Edema subcutáneo de la cabeza y del cuello
• Secreciones nasal y oral
• Congestión grave de la conjuntiva, a veces con petequias
• Exudación mucosa excesiva en el lumen de la tráquea o traqueitis hemorrágica grave
• Petequias en el interior del esternón, en la grasa serosa y abdominal, en las superficies serosas y en la cavidad corporal
• Congestión renal severa, a veces con depósitos de urato en los túbulos
• Hemorragias y degeneración de los ovarios y exudación en el oviducto
• Hemorragias en la superficie de la mucosa del proventrículo, particularmente en la unión con la molleja
• Hemorragias y erosiones de la mucosa de la molleja
• Focos hemorrágicos en los tejidos linfoides de la mucosa intestinal
En los pavos: Las lesiones son similares a las de las gallinas, pero pueden ser menos marcadas. Los patos infectados por HPAI y que excretan el virus pueden no presentar ningún síntoma clínico ni lesión (2).
Reservorios de virus
Los virus de la influenza están difundidos en el ámbito mundial en muchas especies de pájaros silvestres sin provocar en ellos enfermedades. Corresponde particular importancia a las aves acuáticas silvestres y, muy en especial, a los patos, en cuyo tracto digestivo se multiplican estos virus, para ser expulsados con las heces y difundirse ampliamente. La elevada densidad de población de aves existente en los establecimientos de incubación de la producción avícola industrial, favorece la circulación y desviación antigénica, así como la recombinación genética de los virus.
Con la eclosión de los polluelos se produce la diseminación de las nuevas combinaciones También los patos domésticos pueden estar infectados en forma inaparente con virus de la influenza y contagiar a otras especies de aves domésticas (2).
Transmisión
La principal fuente de contagio es el animal infectado que elimina el virus con las heces, pero también con otras excreciones y secreciones. El contagio requiere el contacto directo de los animales, o bien se produce de manera inmediata a través de vectores (personas, pájaros silvestres) y vehículos (pienso, medios de transporte, jaulas).
Apenas tiene importancia el contagio vertical. En los primeros brotes es difícil descubrir cuál fue la fuente de contagio; es frecuente responsabilizar entonces de ello a pájaros silvestres. Por lo común, los virus de la influenza aviar muy virulentos manifiestan una contagiosidad y capacidad de difusión menores que los escasamente virulentos (2).
Población hospedadora
Gallinas y pavos son las especies más sensibles, por lo que en ellas provocan los virus de la influenza muy virulentos cifras de morbilidad y mortalidad muy elevadas. Con menor frecuencia e intensidad enferman los patos. También son susceptibles otras especies de aves domésticas, como codornices, faisanes y pintadas; menos, gansos y palomas. El mismo virus puede transmitirse desde una especie de ave a otra, pero sólo rara vez provoca en ambas enfermedad de la misma gravedad. En muchas especies de pájaros silvestres circulan virus de la influenza, pero sólo se conoce un único brote de epizootia.
Los conocimientos sobre la inmunidad en la peste aviar clásica son escasos, pues los animales suelen morir o ser sacrificados. Cepas de virus poco virulentas y virus inactivados generan una inmunidad que, sin embargo, protege sólo contra el mismo subtipo.
También hay indicios de que ciertos animales excretan el virus todavía algunas semanas después de superar la enfermedad. Los frecuentes brotes de influenza registrados en los pavos de Estados Unidos no permiten, sin embargo, deducir la existencia de una situación enzoótica, ya que con frecuencia son identificados otros subtipos de virus.
Si las aves se crían en alojamientos abiertos y la zona es rica en lagos, resulta posible el contacto con patos salvajes, y con ello la infección de los efectivos (2).
DIAGNÓSTICO CLÍNICO
Debido a la variabilidad de los síntomas clínicos, el diagnóstico clínico sólo puede ser considerado presuntivo. El diagnóstico definitivo debe ser realizado en el laboratorio con métodos virológicos y serológicos siendo positivo cuando se realiza el aislamiento viral.
Los siguientes signos clínicos ayudan al diagnóstico:
• Depresión severa, inapetencia
• Marcada disminución de la producción de huevos
• Edema facial con crestas y barbillas tumefactas y cianóticas
• Hemorragias petequiales en las superficies de las membranas internas
• Muerte súbita (la mortalidad puede alcanzar el 100%)
• Aislamiento del virus necesario para un diagnóstico definitivo (2)
DIAGNÓSTICO DE LABORATORIO
El diagnóstico de laboratorio se basa en el aislamiento viral de las secreciones respiratorias en la fase aguda de la enfermedad. Las muestras son inoculadas en huevos embrionados o células de línea. Para el diagnóstico rápido se usa la inmunofluorescencia directa, el ELISA y la reacción en cadena de la polimerasa (PCR). Las pruebas serológicas como la IHA comparan sueros de la fase aguda y convaleciente, denominados muestras pareadas, obtenidas con un intervalo de 15 ó 20 días entre sí, y confirman el diagnóstico de infección cuando como mínimo existe una diferencia de cuatro diluciones entre la primera y la segunda muestra.
Pasos esenciales en el diagnóstico virológico
• Aislamiento viral: inoculación en huevos embrionados
• Titulación antigénica: test de hemaglutinación
• Identificación antigénica: test de inhibición de hemaglutinación
• Test de inhibición de neuraminidasa
• Caracterización viral: Índice Patogenicidad Intracerebral e Índice Patogenicidad Intravenosa.
• Serología: inmunodifusión en agar gel (AGIP), ELISA Test y ELISA Directigen
Secuencia de pasos en el diagnóstico de laboratorio
• Muestra
• Inoculación en huevos embrionados SPF
• Test de HI - identificación viral
• Diagnóstico diferencial con otros Paramixovirus aviares- Newcastle
• Influenza Aviar - H1 a H16
• Test de Inhibición de neuraminidasa N1 al N9
PREVENCIÓN Y PROFILAXIS
Las medidas de prevención se centran en los cuidados y medidas de bioseguridad tendientes a evitar la introducción de la infección y su diseminación. Las aves silvestres son causa potencial de posibles infecciones para las aves domésticas.
Cuando la infección es producida por virus de baja patogenicidad, los esfuerzos deben estar orientados a contener el problema en su forma original, para evitar la conversión a formas más patógenas del virus. En este sentido, las granjas o zonas en cuarentena son esenciales para evitar la diseminación del virus y así no dar lugar a la conversión. En los países en los cuales la IA nunca ha sido detectada, la aparición de formas no patógenas debe ser evaluada, en cuanto la misma es potencialmente una posibilidad de aparición de las formas muy patógenas. Si el problema es causado por virus de alta patogenicidad, el enfoque debe ser hacia la erradicación, por medio del sacrificio, la despoblación, desinfección y limpieza de las instalaciones y el control epidemiológico con personal calificado de la zona afectada. Las vacunas monovalentes y polivalentes tienen la capacidad de proteger contra la mortalidad, morbilidad y baja de postura. Estas vacunas reducen la severidad de la enfermedad y la diseminación del virus, pero el virus no se eliminará de la población avícola.
La prevención y el control de esta enfermedad en los animales en el mundo se realizan por medio de la inmunización con vacunas inactivadas, las que previenen la gripe en proporción considerable (reducción de la frecuencia de hasta el 70%).
Según datos de la Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO) el continente americano produce el 46,9% del total de las toneladas de aves producidas y exporta el 58,3% al resto del mundo. Los antecedentes disponibles hacen predecir que la llegada de la infección a la región implicará un impacto imprevisible para la avicultura continental y una verdadera catástrofe para los países afectados donde esta actividad es importante para la economía, sin mencionar el hecho de que la avicultura satisface las necesidades básicas nutricionales, suministrando proteína animal con un bajo costo a la mayoría de la población.
• La Organización Mundial de la Salud (OMS) en el ámbito mundial y su oficina regional para las Américas, Organización Panamericana de la Salud (OPS-OMS), son responsables por el programa global de vigilancia de la Influenza Humana, así como también por el desarrollo e implantación del plano de preparación frente a pandemias.
• Junto con la OMS, la Organización de Salud Animal (OIE) y la Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO) están trabajando con los países en el control de la Influenza Aviar de Alta Patogenicidad en Asia.
• El Programa de Salud Pública Veterinaria de la OPS a través del Centro Panamericano de Fiebre Aftosa (PANAFTOSA-OPS/OMS) está desarrollando un programa de cooperación técnica para la vigilancia, prevención y control de la IA en el continente.
• Este trabajo se enmarca en los programas intersectoriales de salud-agricultura en enfermedades zoonóticas, con base en los mandatos de acciones de los Cuerpos Directivos de la OPS y de la Reunión Interamericana de Nivel Ministerial en Salud y Agricultura (RIMSA).
• El plan estará dentro de las directrices del programa global de vigilancia de influenza humana y el plan global de preparación para pandemias de influenza humana de OMS, así como de la seguridad alimentaría e inocuidad de alimentos.
DECLARACIÓN DE BRASILIA. Conferencia hemisférica de vigilancia y prevención de la influenza aviar, Brasilia, Brasil, 2 de diciembre de 2005
Los ministros y los representantes de ministros de agricultura y de salud, los presidentes y representantes de asociaciones de productores, industria y otras entidades representativas de la cadena productiva de la avicultura y los representantes de organismos internacionales presentes en la Conferencia Hemisférica sobre Influenza Aviar, CONSIDERANDO:
1. El riesgo que constituye para el Continente Americano, la ocurrencia de la Influenza Aviar de Alta Patogenicidad (IAAP) en Asia y otras regiones, sea por los ciclos migratorios de las aves procedentes de esas regiones, o por la posibilidad del tránsito internacional de aves o productos de riesgo;
2. La posibilidad de que ocurra una pandemia humana de influenza derivada de modificaciones o adaptación del virus de la Influenza Aviar que permita la transmisión directa entre personas, por sus características zoonóticas;
3. La importancia que la avicultura representa para el Continente Americano, sus beneficios sociales como la generación de empleo e ingresos y la pérdida de competitividad que se daría con la imposición de barreras sanitarias a las exportaciones, en caso de que ocurra la IAAP;
4. Que la ocurrencia de un brote de IAAP en una explotación avícola de cualquier país del Continente representaría un riesgo para todos, lo que afectaría severamente la economía e incidiría de forma negativa en los niveles de consumo de proteínas de alta calidad y económicamente accesibles para las poblaciones;
5. Las experiencias adquiridas por los países del Continente en la prevención, control y erradicación de la IAAP y otras enfermedades transfronterizas como Fiebre Aftosa, Peste Porcina Clásica, Peste Porcina Africana, Encefalopatía Espongiforme Bovina, Rabia y Gusano Barrenador cuando ocurrieron focos en el pasado;
7. La necesidad de fortalecer los servicios veterinarios de los países, así como establecer en el Continente un sistema estratégico y armónico en relación con la Influenza Aviar, basado en acciones de vigilancia, prevención y eventual control; así como aumentar la capacidad de la investigación básica y aplicada de la enfermedad
7. La importancia de actualizar y armonizar normas y procedimientos para la prevención de la Influenza Aviar, teniendo como referencia las recomendaciones contenidas en los Planes Globales de la OMS, de la FAO - OIE, incluyendo los Estándares de la OIE y el Reglamento Sanitario Internacional;
8. La necesidad de identificar y coordinar los recursos presupuestarios y fuentes de financiamiento de origen nacional, bilateral y multilateral además de fondos privados para consolidar los planes de acción (9); la necesidad que los países cumplan con la obligación de notificar de acuerdo a las normas de la OIE, la detección de Influenza Aviar Notificable, y que la respuesta de los demás países esté dentro de las disposiciones de la OIE y la OMC, evitando restricciones al comercio sin base científica, así como las obligaciones derivadas del Reglamento Sanitario Internacional.
ACUERDAN APOYAR:
1. El compromiso político, técnico, presupuestario y financiero para emprender acciones nacionales, regionales y continentales, con vistas a dar respuesta a esta situación actual de riesgo zoosanitario y de salud pública que representa la Influenza Aviar, así como la identificación de necesidades y las fuentes de financiamiento;
2. La constitución de un Grupo de Trabajo, en el contexto de la iniciativa GFTADs (Programa Global para el Control Progresivo de las Enfermedades Transfronterizas de los Animales), con la participación del CISA (Comité Interamericano de Sanidad Avícola), representantes del sector privado y oficial, salud, agricultura y organismos de cooperación técnica y financiera internacional (OPS, IICA, OIRSA, CVP, CAN, CARICOM, BID, BM y otros), académicas y centros de investigación, con el objetivo de desarrollar las líneas estratégicas y componentes esenciales para los planes de acciones continentales, regionales y nacionales. Es importante incorporar al Grupo las organizaciones nacionales y ONG's comprometidas con la protección y conservación de animales silvestres;
3. Las líneas estratégicas, con la agricultura y la salud actuando de forma intersectorial, con cooperación técnica y financiera internacional y entre países, de acuerdo con los Planes Globales de la OMS, de la FAO-OIE, que incluyan, entre otros, los siguientes componentes:
• Fortalecimiento y acreditación de la estructura de los servicios veterinarios
• Vigilancia epidemiológica
• Diagnóstico de laboratorio, producción de antígenos, movimiento de muestras,
• Laboratorio de referencia
• Prevención y bioseguridad
• Planes de control y contingencia
• Conocimiento y control del tránsito de aves y sus productos
• Comunicación de riesgo
• Educación sanitaria
• Investigación, comunicación y transferencia de resultados
• Plan de capacitación
• Participación pública-privada
• Coordinación de la salud, de la agricultura y de otros sectores públicos y privados
• Promoción de mecanismos de transparencia
• Mecanismos de compensación
• Auditorias
• Simulacros
• Estudios de impactos económicos
4. El establecimiento y la ejecución de planes integrados nacionales y en el contexto continental para la vigilancia y prevención de la influenza aviar en coordinación del sector de agricultura con el sector de salud y el sector productivo avícola, mejorando la capacidad de vigilancia y respuesta en sus dimensiones humanas y animal.
5. A los países para que informen oportunamente a la OIE, la detección de la Influenza Aviar de Notificación Obligatoria, y adecuen las respuestas de los demás países a los marcos regulatorios del Acuerdo de Medidas Sanitarias y Fitosanitarias de la OMC y de las recomendaciones de la OIE para evitar restricciones innecesarias al comercio, así como las disposiciones derivadas del Reglamento Sanitario Internacional;
6. Que la Secretaría del GFTADs presente a los países, en el plazo de 90 días, la propuesta elaborada por el Grupo de Trabajo para su aprobación.
7. Que los organismos internacionales de cooperación técnica y financiera coordinen adecuadamente sus esfuerzos a nivel de los países (9).
Referencias bibliográficas
1. La respuesta de la FAO durante la crisis de la peste aviar. Disponible en: http://www.fao.org/waicent/faoinfo/agricult/AGAInfo/.../ai/AIbrief_Sept2005es.pdf. (Citado el 25 de septiembre de 2005).
2. Espinoza C, De La Sota M. Manual de procedimientos Influenza Aviar Altamente Patógena. Buenos Aires: SENASA; 2003.
3. Fouchier RAM, Munster VJ, Wallensten A, Bestebroer TM, Herfst S, Smith DJ, et al. Characterization of a novel Influenza A virus hemagglutinin subtype (H16) obtained from black-headed gulls. J Virol 2005 Apr; 79 (5): 2814-22.
4. Rivero García O. Influenza aviar: ¿De los cerdos al hombre? Revista Virtual Visión Veterinaria. Disponible en: http:// www.visionveterinaria.com (Citado el 6 de noviembre de 2004).
5. Bosch GV. Eradications strategies against Avian Influenza. Conferencia Hemisférica sobre Influenza Aviar. Brasilia, Brasil. 1 de diciembre de 2005. Disponible en: http://www. panaftosa.org.br/Aviar/aviar.html (Citado el 28 de diciembre de 2005).
6. Lamb RA, Krug RM. Orthomyxoviridae: the viruses and their replication. In: Fields Virology (Fields BN, Knipe DM, Howley PM, eds.). Philadelphia: Lippincott- Raven; 1996. 1353-445.
7. Shope RE. Swine influenza. III. Filtration experiments and aetiology. J Exp Med 1931; 54: 373-80.
8. Uyeki TM, Chong YH, Katz JM, Lim W, Ho YY, Wang SS, et al. Lack of Evidence for human-to-human transmission of Avian Influenza A (H9N2) viruses in Hong Kong, China. Emerg Infect Dis 2002; 8 (2): 154-9.
9. Declaración de Brasilia. Conferencia Hemisférica de Vigilancia y Prevención de la Influenza Aviar Brasilia, Brasil, 2 de diciembre de 2005. Disponible en: http://www.panaftosa.org.br/Aviar/DECLARA%C7%C3O_%20BRASILIA_ESP.pdf (Citado el 27 de diciembre de 2005)














