Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. v.40 n.1 La Plata ene./mar. 2006
MICOLOGÍA
Evaluación de la calidad del diagnóstico micológico*
Amadeo Javier Bava1, María Fernanda Zuiani2
1. Doctor en Medicina.
2. Bioquímica. * Subprograma Micología. Programa de Evaluación Externa de Calidad. Fundación Bioquímica Argentina. Calle 6 Nº 1344. La Plata. Buenos Aires. Argentina.
Cátedra de Micología y Parasitología. Facultad de Ciencias Exactas. Universidad Nacional de La Plata. Calle 1 y 47. La Plata. Buenos Aires. Argentina.
Resumen
Para evaluar la capacidad de identificación de especies fúngicas y el tipo y número de prácticas micológicas realizadas por los laboratorios participantes del Subprograma Micología del Programa de Evaluación Externa de Calidad (PEEC) de la Fundación Bioquímica Argentina, se llevó a cabo entre ellos una encuesta anónima y no obligatoria. Ciento treinta y cinco laboratorios (34%) respondieron a la totalidad de las preguntas; de ellos cerca del 75% procesaba entre 1 y 10 estudios micológicos mensuales y alrededor del 10% hacía lo propio con más de 50. Alrededor del 35% de los participantes refirió capacidad para determinar el género de hongo dermatofito aislado y otro 35%, de establecer, además, la especie. Cifras similares correspondieron a la identificación de levaduras del género Candida, mientras que con los aislamientos de Aspergillus, Mucorales e Histoplasma capsulatum, entre 20 y 40% de los laboratorios refirieron incapacidad para reconocerlos. El 22% de los laboratorios refirió identificar a Pneumocystis jiroveci en secreciones respiratorias, empleando para ello el 87%, la coloración de Giemsa. Más del 95% de los laboratorios respondió no determinar la susceptibilidad antifúngica in vitro de los aislamientos ni la presencia de anticuerpos específicos, así como tampoco realizar pruebas cutáneas de lectura retardada con antígenos fúngicos. La mayor parte de los laboratorios participantes pueden clasificarse como de "baja complejidad" y muchos deberán esforzarse para mejorar su capacidad de identificación de las especies fúngicas de importancia médica.
Palabras clave: control de calidad * micología * diagnóstico micológico
Summary
Quality evaluation of the mycological diagnosis
An anonymous and not compulsory inquiry among participant laboratories in the Mycology Sub-Program of the Quality Assurance System (QAS) from Fundación Bioquímica Argentina was carried out in order to evaluate their capacity for identification of fungal species and the type and number of mycological practices performed by them. One hundred and thirty five laboratories (34%) answered the formulated questions whom Nearly 75% of them processed monthly 1-10 mycologycal studies and nearly 10% did the same with ≥ 50. About 35% of the participants referred to their ability to determine the genus of the isolated dermatophytes and other 35% stated they were also able to identify the species. Similar values corresponded to the identification of yeasts of the genus Candida, while 20-40% of the laboratories said they were unable to recognize the isolates of Aspergillus, Mucorales and Histoplasma capsulatum. Twenty two per cent of the laboratories admitted being able to identify Pneumocystis jiroveci in respiratory samples, 87% of them using the Giemsa stain. More than 95% of the laboratories answered that they determine neither the antifungal susceptibility in vitro of the isolated strains nor the presence of specific antibodies, or the delayed skin tests with fungal antigens. Most participant laboratories can be classified as "low complexity" and most of them should have to make an effort to improve their capacity of identification of medically important fungal species.
Keywords: quality control * mycology * mycological diagnosis
INTRODUCCIÓN
El Subprograma Micología forma parte del Programa de Evaluación Externa de Calidad (PEEC) de la Fundación Bioquímica Argentina. Su actividad dio comienzo en septiembre de 2001, cuando realizó la primera de sus entregas, las cuales se han repetido ininterrumpidamente en forma cuatrimestral hasta la actualidad, totalizando al mes de diciembre de 2004 un número de once.
Los objetivos del Subprograma Micología son evaluar, entre los participantes del mismo, la calidad del diagnóstico micológico y proporcionar conocimientos y actualización en esta materia.
Con el propósito de establecer la capacidad de identificación de las especies fúngicas, en particular de aquellas de importancia médica, y el tipo y número de prácticas micológicas ejecutadas por los laboratorios participantes del Sub Programa, se realizó una encuesta anónima y no obligatoria dirigida a todos los inscriptos en el mismo.
MATERIALES Y MÉTODOS
Fueron evaluadas las respuestas enviadas en forma completa por 135 laboratorios a una encuesta dirigida a todos aquellos laboratorios participantes a diciembre de 2004, del Subprograma Micología del Programa de Evaluación Externa de Calidad.
En la misma fueron requeridos datos acerca del número aproximado de estudios micológicos realizados mensualmente y el nivel de identificación de los hongos patógenos humanos más frecuentemente recuperados en la práctica diaria, tales como dermatofitos, especies del género Candida, Aspergillus y Mucorales e Histoplasma capsulatum (como ejemplo de agente causal de la micosis sistémica endémica).
En el caso particular del género Candida se requirió de los participantes información sobre la metodología empleada para la identificación de las especies de importancia médica, en particular de C. albicans.
Para evaluar la capacidad de identificación de las especies fueron establecidos diferentes niveles de complejidad basados en los siguientes criterios: nivel 0, el laboratorio no se encontraba capacitado para realizar la identificación; nivel 1: sólo identificaba la presencia del hongo en los materiales clínicos por su micromorfología; nivel 2: sumaba a la capacidad del nivel 1, el aislamiento del hongo por cultivo; nivel 3: agregaba a las capacidades de los niveles 1 y 2 la identificación de género y, finalmente nivel 4: adicionaba a los 3 niveles anteriores la identificación del hongo al nivel especie.
Igualmente, los participantes fueron consultados acerca de prácticas menos frecuentes en laboratorios de baja complejidad, tales como el diagnóstico de la neumocistosis pulmonar y los métodos empleados para ello, la realización de pruebas de susceptibilidad antifúngica in vitro, pruebas serológicas e intradermorreacciones con antígenos fúngicos.
RESULTADOS
De los 389 laboratorios inscriptos a diciembre de 2004 en el Subprograma Micología del PEEC, 135 (34%) respondieron en forma completa a las preguntas formuladas. Los resultados obtenidos se detallan en las Tablas I a V.
Tabla I. Procesamiento de muestras para estudios micológicos por parte de 135 laboratorios participantes del Subprograma Micología del PEEC que respondieron en forma completa a la encuesta realizada en diciembre de 2004.

Tabla II. Nivel de identificación de los agentes fúngicos presentes mayoritariamente en muestras clínicas
por 135 laboratorios encuestados por el Subprograma Micología del PEEC en diciembre de 2004.
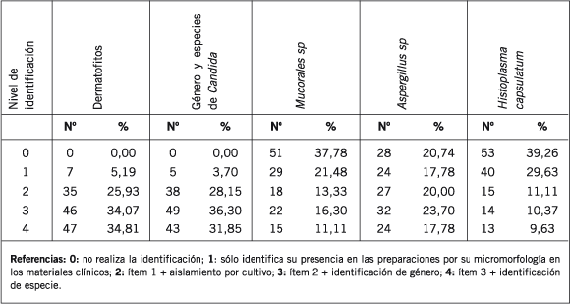
Tabla III. Número y porcentaje de laboratorios que emplean 4 pruebas diferentes para la identificación de las especies de Candida entre 135 laboratorios participantes del Subprograma Micología del PEEC que respondieron en forma completa a la encuesta realizada en diciembre de 2004.

Tabla IV. Número y porcentaje de laboratorios que realizan diagnóstico de neumocistosis pulmonar y que emplean 4 diferentes métodos de diagnóstico, entre 135 laboratorios participantes del Subprograma Micología del PEEC que respondieron a la encuesta realizada en diciembre de 2004.
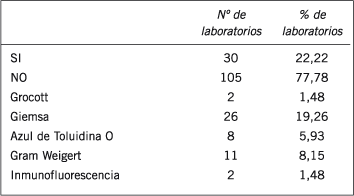
Tabla V. Número y porcentaje de laboratorios que realizan diagnóstico indirecto de las micosis y pruebas de susceptibilidad in vitro, entre 135 laboratorios participantes del Subprograma Micología del PEEC que respondieron a la encuesta realizada en diciembre de 2004.

Número de muestras procesadas
La mayor parte de los laboratorios evaluados (> 70%) refirieron el procesamiento de 10 o menos muestras para estudios micológicos, sólo menos de 5 hicieron lo propio con 100 o más muestras y el 25% restante admitió procesar 20 - 50 muestras por mes.
Identificación de hongos
Si bien todos los participantes refirieron el reconocimiento de los hongos dermatofitos en la microscopia de los materiales, el 35% de ellos respondió que determinaba sólo el género aislado y otro 35% dijo estar en condiciones de establecer, además, la especie. Cifras bastante similares pudieron adjudicarse a la identificación de levaduras del género Candida, entre las cuales C. albicans fue identificada mayoritariamente (32%) mediante el empleo de medios cromogénicos y en menor medida por la producción de tubos germinativos (13%) y clamidoconidios (18%).
En el caso del diagnóstico de las micosis provocadas por Aspergillus, Mucorales e Histoplasma capsulatum, el 20% de los laboratorios dieron a conocer su incapacidad para reconocer al primero y el 40% a los dos últimos. Estas cifras aumentaron cuando la identificación de los dos primeros debió hacerse a nivel de género y/o especie.
Identificación de Pneumocystis jiroveci
Sólo el 22% de los laboratorios refirió efectuar la identificación de Pneumocystis jiroveci en secreciones respiratorias, utilizando la mayor parte de ellos (87%) la coloración de Giemsa con ese propósito.
Pruebas de susceptibilidad antifúngica in vitro, serología y pruebas cutáneas
Más del 95% de los laboratorios encuestados comunicó no practicar pruebas para determinar la susceptibilidad antifúngica in vitro de los aislamientos, la presencia de anticuerpos específicos por serología así como pruebas cutáneas de lectura retardada con antígenos fúngicos.
DISCUSIÓN Y CONCLUSIONES
De acuerdo al análisis de los resultados obtenidos de esta encuesta, la mayor parte de los laboratorios participantes podría encuadrarse dentro de la categoría "baja complejidad", respecto a su capacidad para el procesamiento de muestras para estudios micológicos.
Esto es comprensible, ya que la mayoría de ellos procesan, desde el punto de vista micológico estricto, sólo muestras obtenidas de lesiones presuntamente diagnosticadas como micosis superficiales (dermatofitosis, candidiasis y pitiriasis versicolor) y en un número no mayor a 10 por mes.
Probablemente, la cantidad de diagnósticos micológicos de estos laboratorios pueda aumentar ante la detección de hongos, por microscopia y/o cultivos, en muestras tales como orinas, secreciones respiratorias, flujos vaginales, hemocultivos, etc., procesadas con otros fines no micológicos (fundamentalmente bacteriológicos).
A partir de los datos obtenidos, los autores creen que un número importante de laboratorios deberá realizar en los próximos años esfuerzos tendientes a mejorar la identificación de los hongos levaduriformes, fundamentalmente las especies de Candida, así como de los géneros de hongos miceliales.
Son escasos, comparativamente, los laboratorios que emplean las pruebas de filamentización (tubos germinativos) y producción de clamidoconidias para la identificación de Candida albicans (1). Esta última especie, a pesar de los cambios ocurridos en las últimas décadas respecto a la etiología de las candidiasis, sigue siendo aquella que se recupera con mayor frecuencia de los materiales clínicos, sobre todo los pertenecientes a pacientes ambulatorios. Sin negar las bondades de los medios cromogénicos (2), los autores consideran que ambas pruebas podrían ser empleadas por todos los laboratorios, en vista de su bajo costo y de la fácil realización e interpretación de sus resultados.
Sería deseable que todo laboratorio que procese muestras provenientes de pacientes internados incorpore en el futuro las pruebas de susceptibilidad antifúngica in vitro para los hongos levaduriformes. Esto último se vería favorecido por la introducción en el mercado de equipos comerciales para estos fines, correctamente estandarizados y de fácil interpretación. Estas determinaciones hoy son sólo ejecutadas en laboratorios de elevada complejidad o Centros de Referencia, pero adquieren gran relevancia ante la eclosión de cepas y especies resistentes, sobre todo en el ámbito intrahospitalario (3).
A partir de los resultados obtenidos en esta encuesta, este Subprograma se verá en la necesidad de implementar cursos de capacitación para la identificación de Mucorales, especies de Aspergillus y de los agentes causales de las micosis sistémicas endémicas (en la encuesta ejemplificado por Histoplasma capsulatum). Estos últimos se sumarán al material didáctico que permanentemente se encuentra volcado en la página Web del Subprograma Micología.
La disponibilidad de Manuales para el reconocimientos de estas y otras especies fúngicas de importancia médica puede facilitar la identificación de aislamientos a través de su macro y micromorfología, así como el aprendizaje de los procedimientos a emplear para la tipificación (4).
La incorporación en los últimos años de Pneumocystis jiroveci (antes Pneumocystis carinii) al Reino Fungi abre una nueva perspectiva de diagnóstico, basada principalmente en el reconocimiento del microorganismo por microscopia en fresco y por la aplicación de diversas técnicas de coloración a extendidos de las secreciones respiratorias (5). La presente encuesta revela que quienes refieren realizar el diagnóstico de la neumocistosis emplean en su mayoría la coloración de Giemsa para la identificación del P. jiroveci. Sin embargo, la misma posee una sensibilidad menor que otros métodos (6), aunque cuenta con las ventajas de su fácil accesibilidad a laboratorios de baja complejidad y de permitir la visualización de múltiples especies fúngicas. Los autores prefieren una modificación rápida de la técnica de Grocott, la cual si bien no tiene una gran sensibilidad es sumamente específica, adaptable a laboratorios de baja complejidad y permite reconocer a la casi totalidad de patógenos fúngicos (7).
Pocos laboratorios han comunicado el empleo de inmunofluorescencia directa con anticuepos monoclonales para el diagnóstico de la neumocistosis pulmonar, el único equipo de este tipo disponible comercialmente en el campo de la micología (8). El mismo, si bien posee elevada sensibilidad, es costoso y requiere de un microscopio de fluorescencia. Cada una de las técnicas empleadas para el diagnóstico de la neumocistosis pulmonar tiene ventajas y desventajas, las que deberán ser evaluadas oportunamente por cada profesional.
Debido a que se trata de un microorganismo recientemente reconocido como hongo, probablemente muchos de los profesionales deban recibir entrenamiento para el reconocimiento del mismo en los materiales clínicos.
Respecto de los estudios serológicos, así como de la ejecución de pruebas cutáneas de lectura retardada, los autores opinan que los mismos deben quedar por el momento reservados para Centros de Referencia o Laboratorios de mayor complejidad, por lo general correspondientes a Hospitales Públicos.
A diferencia de lo acontecido décadas atrás, la identificación precisa de las especies fúngicas y la ejecución de otras prácticas complementarias de diagnóstico micológico, constituyen en muchos casos, sobre todo en pacientes gravemente enfermos, una necesidad ineludible de los laboratorios que practican exámenes micológicos. Para ello, es prioritario mantener un nivel adecuado de capacitación de los profesionales en el campo de la Micología, sólo posible a través del continuo entrenamiento y actualización en el tema. La evaluación permanente de la calidad de los procedimientos empleados en el diagnóstico micológico constituye una herramienta eficaz para el logro de los objetivos antes mencionados.
Agradecimientos
A la Dra. Marcela Witt por su revisión del idioma inglés en el resumen.
Correspondencia
Dr. Amadeo Javier Bava
Darregueyra 2470. 7º "C".
1425 Ciudad autónoma de buenos aires. Argentina
E-mail: javibava@biol.unlp.edu.ar
Referencias bibliográficas
1. Freidiere AM, Guinet R, Boiron P. Yeast identification in the clinical microbiology laboratory: phenotypical methods. Med Mycol 2001; 39: 9-33.
2. García-Martos P, García-Agudo R, Hernández-Molina JM, Marín P, Tallero E, Mira J. Identificación de levaduras de interés clínico en el medio de cultivo CHROMagar Candida. Rev Iberoam Micol 1998; 15: 131-5.
3. Pfaller MA, Diekema DJ. Rare and emerging opportunistic fungal pathogens: concern for resistance beyond Candida albicans and Aspergillus fumigatus. J Clin Microbiol 2004; 42: 4419-31.
4. Larone DH. Medically important fungi. A guide to identification. 3rd. ed. Washington DC: ASM Press; 1995.
5. Hughes WT, Gigliotti F. Nomenclature for Pneumocystis carinii. J Infect Dis 1988; 157: 432-3.
6. Procop GW, Hadad S, Quinn J, Wilson ML, Henshaw NG, Reller LB, Artymyshyn RL, et al. Detection of Pneumocystis jiroveci in respiratory specimens by four staining methods. J Clin Microbiol 2004; 42: 3333-5.
7. Bava AJ. Coloración rápida para la identificación de quistes de Pneumocystis carinii en materiales respiratorios. Acta Bioquím Clín Latinoam 2003; 37: 189-92.
8. Homer KS, Wiley EL, Smith AL, McCollough L, Clark D, Nightingale SD, et al. Monoclonal antibody to Pneumocystis carinii: comparison with silver stain in bronchial lavage specimens. Am J Clin Pathol 1992; 97: 619-24. [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ]
Aceptado para su publicación el 20 de octubre de 2005














