Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. v.40 n.2 La Plata abr./jun. 2006
BIOQUÍMICA CLÍNICA
Hipertrigliceridemia: influencia sobre parámetros que estiman el transporte reverso del colesterol*
Hipertriglyceridemia: influence on testing parameters which estimate the reverse cholesterol transport
Omar Raúl Espondaburu1
1. Licenciado en Ciencias Bioquímicas.
* Hospital Interzonal General de Agudos "Pedro Fiorito". Belgrano 851. Avellaneda, Bs. As., Argentina.
Resumen
El transporte reverso del colesterol puede evaluarse mediante dos parámetros que cuantifican indirectamente a las HDL: a través de la Apo AI, su proteína mayoritaria, o por su contenido de colesterol (C-HDL). El objetivo del presente trabajo fue analizar cómo el aumento de triglicéridos (TG) modifica los niveles de Apo AI, C-HDL y la relación C-HDL/Apo AI. Para ello se analizaron 200 muestras con colesterol inferior a 240 mg/dL, provenientes de pacientes de ambos sexos y con edades comprendidas entre 20 y 60 años; de ellas la mitad presentaban TG < 150 mg/dL y el resto correspondían a TG entre 150-400 mg/dL. Los TG se dosaron por colorimetría de punto final, C-HDL por la técnica enzimática directa y Apo AI por inmunoturbidimetría, utilizando reactivos Roche Diagnostics en un autoanalizador Hitachi 912. Al analizar los valores medios de Apo AI, C-HDL y C-HDL/Apo AI de las dos poblaciones se encontraron valores inferiores para el rango de TG entre 150-400 mg/dL en un 5,15%, 20,34% y 12,28% respectivamente, siendo estas diferencias significativas para un nivel de 0,05. La correlación entre C-HDL y Apo AI fue buena: r = 0,869 (P < 0,0001) con una recta de regresión C-HDL = 0,55 Apo AI – 15,8 para TG < 150 mg/dL; y r = 0,862 (P < 0,0001) con una recta C-HDL = 0,48 Apo AI – 15,1 para las muestras de TG en el rango 150-400 mg/dL, resultando una disminución en el C-HDL en las muestras hipertrigliceridémicas de 0,07 Apo AI – 0,7. La gráfica C-HDL/Apo AI vs. TG mostró una caída de la relación C-HDL/Apo AI por encima de 150 mg/dL de TG, indicando la presencia de HDL empobrecidas en colesterol, de manera que el cociente C-HDL/Apo AI constituye un buen índice de riesgo aterogénico asociado a la eficiencia del transporte reverso del colesterol.
Palabras clave: hipertrigliceridemia * transporte reverso del colesterol * apolipoproteína AI * colesterol en lipoproteínas de alta densidad * relación colesterol en lipoproteínas de alta densidad/apolipoproteína AI
Summary
The reverse cholesterol transport can be assessed by means of two parameters which indirectly quantify HDL: through the Apo AI, its majority protein, or by its cholesterol content (C-HDL). The aim of the project has been to analyse how the triglyceride rise (TG) modifies the Apo AI, C-HDL levels and the C-HDL/Apo AI relation. For this reason, 200 samples from patients from both sexes, aged between 20 and 60 years old, with cholesterol inferior to 240 mg/dL were analysed; out of them, half presented TG < 150 mg/dL and the rest corresponded to TG = 150-400 mg/dL. The TG were dosed by final stage colorimetry, C-HDL by direct enzymatic technique and Apo AI by immunoturbidimetric assay, using Roche Diagnostics reactives in a Hitachi 912 autoanalyzer. When analysing the samples' average Apo AI, C-HDL and C-HDL/Apo AI, inferior values were found for the TG range 150-400 mg/dL: a 5.15%, 20.34% and 12.28% respectively, being these differences significative for a 0.05 level. The correlation between C-HDL and Apo AI was good: r = 0.869 (P < 0.0001) with a line regression C-HDL = 0.55 Apo AI - 15.8 for TG < 150 mg/dL; and r = 0.862 (P < 0.0001) with a straight line C-HDL = 0.48 Apo AI - 15.1 for samples with the TG range 150-400 mg/dL; resulting a decrease in the C-HDL in the hypertriglyceridemic samples of: 0.07 Apo AI - 0.7. The C-HDL/Apo AI vs. TG graphic has shown a decrease in the C-HDL/Apo AI relation over the TG = 150 mg/dL, showing the presence of HDL low in cholesterol, so that C-HDL/Apo AI quotient makes up a good index of atherogenic risk associated to the efficiency of reverse cholesterol transport.
Key words: hypertriglyceridemia * reverse cholesterol transport * apolipoprotein AI * high-density lipoprotein cholesterol * high-density lipoprotein cholesterol/apolipoprotein AI relation
INTRODUCCIÓN
Dentro del metabolismo lipídico, el transporte reverso del colesterol es la vía metabólica protectora de la aterogénesis, ya que se encarga de conducir el colesterol remanente desde los distintos tejidos, incluida la pared arterial, hacia el hígado para su posterior reutilización o eliminación a través de la bilis, evitando su acumulación a nivel tisular (1-3).
Básicamente el transporte reverso del colesterol puede dividirse en cuatro etapas bien diferenciadas (Fig. 1):
1. Eflujo del colesterol libre hacia el espacio extracelular donde es tomado por aceptores primarios como la prebeta1-HDL, una partícula lipoproteica de forma discoidal, constituida fundamentalmente por fosfolípidos y Apo AI (4-6).
2. Esterificación del colesterol libre presente en los aceptores primarios por acción de la enzima lecitina colesterol aciltransferasa (LCAT), dando como resultado la formación de HDL3, que posteriormente se transformará en HDL2a al recibir apolipoproteínas, colesterol libre y fosfolípidos liberados, por acción de la lipoproteína lipasa, durante el catabolismo de los quilomicrones y las lipoproteínas de muy baja densidad (7-9).
3. Transferencia del colesterol esterificado hacia lipoproteínas que contienen Apo B por acción de la proteína transportadora de colesterol esterificado (CETP) que intercambia colesterol esterificado por triglicéridos (TG) en relación mol a mol, generando HDL2b (7)(9-12).
4. Captación hepática del colesterol esterificado en forma directa de las HDL2b por acción de la lipasa hepática regenerándose HDL3, o en forma indirecta a través de la lipoproteínas con Apo B que se han enriquecido en colesterol esterificado por acción de la CETP (10)(13)(14).
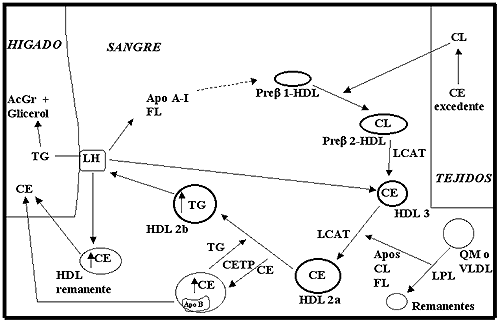
Fig. 1. Esquema del transporte reverso del colesterol.
FL=fosfolípidos, CL=colesterol libre, CE=colesterol esterificado, TG=triglicéridos, Ac Gr=ácido graso, LH=lipasa hepática, LPL=lipoproteínalipasa, CETP=proteína transportadora de colesterol esterificado, LCAT=lecitina colesterol aciltransferasa.
La eficiencia de esta importante vía metabólica anti-aterogénica puede evaluarse en el laboratorio mediante dos parámetros que cuantifican indirectamente a las HDL: por un lado la Apo AI que es su proteína mayoritaria, y por otro lado, su contenido de colesterol (C-HDL) (15).
La hipertrigliceridemia resulta ser, en la mayoría de los casos, el factor primario causante de alteraciones en la cantidad y calidad de las HDL (16)(17). La hipertrigliceridemia más frecuente es la moderada, con niveles de TG comprendidos entre 150 y 400 mg/dL; se produce por un aumento de la síntesis y/o un catabolismo ineficaz de las lipoproteínas ricas en TG como son los quilomicrones, las lipoproteínas de muy baja densidad o las lipoproteínas de densidad intermedia, determinando un aumento de la concentración y de la vida media de estas partículas en el plasma (7).
El aumento de los TG afecta las distintas etapas del transporte reverso del colesterol, observándose en los datos de laboratorio una disminución en los niveles de Apo AI y de C-HDL (7)(18)(19).
El objetivo del presente trabajo fue evaluar la magnitud de la disminución de los parámetros de laboratorio que evalúan indirectamente la eficiencia del transporte reverso del colesterol, como son la Apo AI, el C-HDL y la relación C-HDL/Apo AI, por influencia de la hipertrigliceridemia moderada.
MATERIALES Y MÉTODOS
Para el estudio se seleccionaron retrospectivamente los resultados obtenidos a partir de 200 muestras de suero provenientes de pacientes ambulatorios del Hospital Interzonal General de Agudos Pedro Fiorito de la ciudad de Avellaneda. Dicha selección se efectuó de manera tal que la mitad de las muestras presentaba niveles de TG < 150 mg/dL y la otra mitad correspondía a TG entre 150-400 mg/dL (Tabla I). Se excluyeron pacientes con colesterol > 240 y TG > 400 mg/dL, además de los que recibían algún tipo de medicación que pudiese alterar el metabolismo lipídico así como los pacientes definidos como coronarios.
Las muestras fueron obtenidas por punción venosa del pliegue del codo, estando el paciente con un ayuno de 12-14 horas y sin dieta previa, salvo la restricción en el consumo de bebidas alcohólicas durante las 24 horas previas al estudio (20). Las muestras de sangre fueron recogidas en tubos plásticos descartables con acelerador de coagulación y centrifugadas dentro de las 2 horas de efectuada la extracción.
Los sueros así obtenidos, se procesaron en el día utilizando un autoanalizador Hitachi 912 (Roche, Basilea, Suiza); se determinaron TG por el método enzimático colorimétrico de punto final, C-HDL por la técnica enzimática directa (enzimas modificadas con polietilenglicol y alfa-ciclodextrina) y Apo AI por inmunoturbidimetría usando anticuerpos policlonales anti-Apo humana de origen ovino y calibrando frente al estándar de referencia SP3-07 de la OMS/IFCC (Organización Mundial de la Salud/Federación Internacional de Química Clínica) (21). En todos los casos se emplearon reactivos comerciales de Roche Diagnostics (Mannhein, Alemania) de acuerdo a las condiciones de reacción establecidas por el fabricante, realizando controles de calidad con Precinorm L (Roche Diagnostics, Mannhein, Alemania) para TG y Apo AI, y con Preciphat HDL/LDL (Roche Diagnostics, Mannhein, Alemania) para C-HDL.
A fin de determinar los coeficientes de variación intraensayo correspondientes a las metodologías analíticas utilizadas, se procesó un pool de sueros 20 veces dentro de una misma tanda de análisis; los valores obtenidos fueron: 2,81% para TG, 3,73% para C-HDL y 4,03% para Apo AI. Ese mismo pool también fue procesado a lo largo de 20 días a fin de establecer los coeficientes de variación interensayo; los valores hallados fueron: 3,28% para TG, 4,08% para C-HDL y 4,63% para Apo AI.
Con los resultados obtenidos de TG, C-HDL y Apo AI se calcularon las variables estadísticas media y desvío estándar (DE) de los distintos analitos en la población con TG < 150 mg/dL y en la correspondiente a 150 mg/dL < TG < 400 mg/dL; se analizó la diferencia de los valores medios de Apo AI, de C-HDL y de la relación C–HDL/Apo AI entre los dos grupos de muestras utilizando el test de Student con un nivel de significación de 0,05 para dos colas; se graficó C-HDL vs. Apo AI determinándose, para cada caso, las rectas de regresión y el coeficiente de correlación por el método de Pearson; finalmente se estudió la relación del índice C–HDL/Apo AI en función de la concentración de TG.
Tabla I. Características de los pacientes incluidos en el estudio.

RESULTADOS
Los valores medios, el DE y los rangos de concentraciones que abarcó el estudio de los distintos analitos se muestran en la Tabla II, conjuntamente con los valores calculados para la relación C-HDL/Apo AI.
Al analizar la diferencia de valores medios correspondientes a la Apo AI, el C-HDL y la relación C-HDL/ Apo AI entre las muestras con TG < 150 mg/dL y las que presentaban 150 mg/dL < TG < 400 mg/dL se observó una diferencia significativa para un nivel de significación de 0,05.
Tabla II. Valor medio, desvío estándar y rango de valores que comprendió el estudio en cada grupo de muestras.

A partir de las concentraciones de C-HDL y Apo AI correspondientes a las muestras con TG < 150 mg/dL se graficó C-HDL vs. Apo AI, obteniéndose una recta de regresión de pendiente 0,55 y ordenada al origen de -15,8 mg/dL, con un coeficiente de correlación r = 0,869 (P < 0,0001) (Fig. 2). Se procedió de igual forma con las muestras comprendidas en el rango 150 mg/ dL < TG < 400 mg/dL y resultó una recta de regresión de pendiente 0,48 y ordenada al origen de –15,1 mg/dL, con un r = 0,862 (P < 0,0001) (Fig. 3).
La Figura 4 muestra ambas rectas de regresión representadas en un mismo gráfico, observándose una diferencia en las concentraciones de C-HDL entre los dos grupos de sueros definida por la ecuación:
C-HDLTG < 150 mg/dL – C-HDL400 < TG > 150 mg/dL = 0,07 Apo AI – 0,7
Finalmente, se analizó la variación de la relación
C-HDL/Apo AI en función de la concentración de TG, graficando C-HDL/Apo AI vs. TG (Fig. 5).

Fig. 2. C-HDL vs. Apo AI para valores de TG < 150 mg/dL.

Fig. 3. C-HDL vs. Apo AI para valores de 150 mg/dL < TG < 400 mg/dL.

Fig. 4. Rectas de regresión de C-HDL vs. Apo AI para ambos grupos de muestras.

Fig. 5. C-HDL/Apo AI vs. TG.
DISCUSIÓN
Al comparar los valores medios de la Apo AI de las muestras con TG inferiores a 150 mg/dL con los presentados por aquellas cuyo nivel de TG estaba comprendido entre 150 y 400 mg/dL, se encontró que estas últimas presentaban un valor medio inferior (129 mg/dL) respecto de las anteriores (136 mg/dL), siendo esta diferencia del 5,15%. La diferencia fue mayor cuando se compararon las concentraciones medias de C-HDL entre ambos grupos (59 y 47 mg/dL respectivamente), siendo un 20,34% más bajas en las muestras con hipertrigliceridemia moderada. Estos resultados confirman que el aumento de TG conduce a una disminución en los niveles de C-HDL y de Apo AI, y muestran que el efecto se hace más notorio en la concentración de C-HDL.
Esto se debe, fundamentalmente, a que las lipoproteínas que contienen Apo B ricas en TG que permanecen más tiempo en circulación permiten un mayor intercambio de colesterol esterificado por TG, a través de la CETP, lo que genera HDL ricas en TG; estas HDL resultan, entonces, un buen sustrato para la lipasa hepática que hidroliza los TG produciendo HDL remanentes de menor tamaño, pobres en colesterol esterificado y generando Apo AI libre, cuyo mayor clearence renal disminuye su pool intravascular (7)(22-25) (Fig. 6).
Un comportamiento análogo se halló al comparar los valores medios de la relación C-HDL/Apo AI (0,43 y 0,36, respectivamente), resultando un 12,28% inferiores en las muestras con TG comprendidos en el rango de 150-400 mg/dL.

Fig. 6. Efecto de las lipoproteínas ricas en TG sobre el transporte reverso del colesterol.CL=colesterol libre, CE=colesterol esterificado, TG=triglicéridos, Ac Gr=ácido graso, LH=lipasa hepática, LPL=lipoproteína lipasa, CETP=proteína transportadora de colesterol esterificado, LCAT=lecitina colesterol aciltransferasa.
En el análisis anterior, al estudiar sujetos normo e hipertrigliceridémicos, todas las diferencias encontradas fueron significativas para un nivel de 0,05 y resultaron ligeramente superiores a las halladas por Coniglio R y cols. (4,55%, 16,33% y 10,81%, respectivamente) cuando compararon un grupo de sujetos sanos con enfermos coronarios que tenían otros factores de riesgo además de la hipertrigliceridemia, lo que revela la importancia de los altos niveles de TG como factor de riesgo aterogénico (26).
Las rectas C-HDL vs. Apo AI mostraron una buena correlación entre los niveles de C-HDL y Apo AI en ambos grupos de muestras, observándose una ordenada al origen del mismo orden en ambos casos, pero una pendiente menor en la hipertrigliceridemia moderada, indicando un menor contenido de colesterol esterificado en las HDL respecto de las muestras normotrigliceridémicas.
Al analizar gráficamente la variación de la relación C-HDL/Apo AI por los niveles de TG se observa que a media que se produce un aumento en la concentración sérica de TG, la relación disminuye principalmente por encima de los 150 mg/dL debido, fundamentalmente, a la caída en el nivel de C-HDL, si bien ese descenso no es muy pronunciado ya que se compensa, en parte, por la disminución de la Apo AI.
La caída de la relación C-HDL/Apo AI indica la presencia de partículas de HDL empobrecidas en colesterol esterificado resultantes de un transporte reverso de colesterol menos eficiente, lo cual se traduce en un mayor riesgo aterogénico. De esta manera el cociente C-HDL/Apo AI constituye un buen índice de riesgo aterogénico al evaluar indirectamente la eficiencia de la vía metabólica encargada de depurar el colesterol remanente de los tejidos.
CONCLUSIONES
Los TG constituyen un importante factor de riesgo aterogénico, ya que entre otros mecanismos producen alteraciones en distintos niveles del transporte reverso del colesterol, haciéndolo menos eficiente. Este efecto se traduce en los parámetros de laboratorio, fundamentalmente, en una disminución del colesterol transportado por las HDL (C-HDL) y, en menor grado, en una disminución en la concentración de Apo AI.
Respecto de la relación C-HDL/Apo AI, resulta ser un importante índice de riesgo aterogénico ya que valores disminuidos permiten inferir la presencia de un transporte reveso de colesterol ineficiente.
Correspondencia
DR. OMAR R. ESPONDABURU
Calle 51 "A" N° 5.950
1885 Plátanos
Prov. de Bs. As., Argentina
E-mail: oespondaburu@yahoo.com.ar
Referencias bibliográficas
1. Von Eckardstein A, Nofer J, Assmann G. High density lipoproteins and arteriosclerosis. Role of cholesterol efflux and reverse cholesterol transport. Arterioscler Thromb Vasc Biol 2001; 21: 13-27.
2. Toth P. High-density lipoprotein and cardiovascular risk. Circulation 2004; 109: 1809-12.
3. Idzior-Walus B, Walus M, Foltyn A. High density lipoproteins and atherosclerosis. Przegl Lek 2004; 61: 1433-5.
4. Castro G, Fieldig C. Early incorporation of cell-derived cholesterol into pre-beta-migrating high-density lipoprotein. Biochem 1988; 27: 25-9.
5. Tall A. Role of ABCA1 in cellular cholesterol efflux and reverse cholesterol transport. Arterioescler Throm Vasc Biol 2003; 23: 710-1.
6. Lee J, Parks J. ATP-binding cassette transporter AI and its role in HDL formation. Curr Opin Lipidol 2005; 16: 19-25.
7. Caballero E. Perfil aterogénico: ¿Qué es y qué implica? Rev Argent Med 1999; 1: 707-17.
8. Nakamura Y, Kotite L, Gan Y, Spencer T, Fielding C, Fielding P. Molecular mechanism of reverse cholesterol transport: reaction of pre-beta-migratin high-density lipoprotein with plasma lecithin/cholesterol acyltransferase. Biochem 2004; 43: 14811-20.
9. Huesca-Gómez C, Carreón-Torres E, Nepomuceno-Mejía T, Sánchez-Solorio M, Galicia-Hidalgo M, Mejía A, et al. Contribution of cholesteryl ester transfer protein and lecithin cholesterol acyltranferase to HDL size distribution. Endocr Res 2004; 30: 403-15.
10. Cuevas A, Alvarez V, Acosta A, Altayó M, Montero J, Rigotti A. Mecanismo de hipo e hiperalfalipoproteinemia en individuos adultos chilenos. Rev Med Chil 2004; 132: 421-8.
11. Ruggeri R. Cholesteryl ester transferprotein: pharmacological inhibition for the modulation of plasma cholesterol levels and promising target for the prevention of atherosclerosis. Curr Top Med Chem 2005; 5: 257-64.
12. De Grooth G, Klerkx A, Stroes E, Stalenhoef A, Kastelein J, Kuivenhoven J. A review of CETP and its relation to atherosclerosis. J Lipid Res 2004; 45: 1967-74.
13. Quintao E. Is reverse cholesterol transport a misnomer for suggesting its role in the prevention of atheroma formation? Atherosclerosis 1995; 116: 1-14.
14. Marques-Vidal P, Azéma C, Collet X, Vieu C, Chap H, Bertrand P. Hepatic lipase promotes the uptake of HDL esterified cholesterol by the perfused rat liver: A study using reconstituted HDL particles of defined phospholipid composition. J Lipid Res 1994, 35: 373-84.
15. Assmann G, Gotto A. HDL cholesterol and protective factors in atherosclerosis. Circulation 2004; 109 (23 Suppl I): III8-4.
16. Deckelbaum R, Granot E, Oschchry Y, Rose L, Eisenberg S. Plasma triglyceride determines structure-composition in low and high density lipoproteins. Arteriosclerosis 1984; 4: 225-31.
17. Eisenberg S. Lipoprotein abnormalities in hipertrigliceridemia: significance in atherosclerosis. Am Heart J 1987; 133: 555-61.
18. Brites F. Influencia de la hipertrigliceridemia en el transporte reverso del colesterol. Acta Bioquím Clín Latinoam 1997; 31: 253-74.
19. Saku K, Gartside P, Hynd B, Mendoza S, Kashyap M. Apolipoprotein AI and AII metabolism in patients with primary high-density lipoprotein deficiency associated with familial hypertriglyceridemia. Metab Clin 1985; 34: 754-64.
20. Schreier L, Berg G, Brites F, López G, Sanguinetti S, Aisemberg L, et al. Diagnóstico bioquímico de las dislipemias en el adulto. Acta Bioquím. Clín Latinoam 2001; 35: 225-36.
21. Marcovina S, Albers J, Henderson L, Hannon W. International Federation of Clinical Chemistry: standardization proyect for measurement of apolipoproteíns A-I and B. III.Comparability of apolipoprotein A-I values by use of international reference material. Clin Chem 1993; 39: 773-81.
22. Mann C, Yen F, Grant A, Bihain B. Mechanism of plasma cholesteryl ester transfer in hypertriglyceridemia. J Clin Invest 1991; 88: 2059-66.
23. Murakami T, Michelagnoli S, Longhi R, Gianfranceschi G, Pazzucconi F, Calabresi L, et al. Triglycerides are major determinants of cholesterol esterification/transfer and HDL remodeling in human plasma. Arterioescler Thromb Vasc Biol 1995; 15: 1819-28.
24. Brinton E, Eisenberg S, Breslow. Human HDL cholesterol levels are determined by Apo AI fractional catabolic rate, which correlates inversely with estimates of HDL particle size. Effects of gender, hepatic and lipoprotein lipases, triglyceride and insulin levels, and body fat distribution. Arterioscler Thromb 1994; 14: 707-20.
25. Horowitz B, Goldberg I, Merab J, Vanni T, Ramakrishnan R, Ginberg H. Increased plasma and renal clearence of an exchangeable pool of apolipoprotein AI in subjects with low levels of high density lipoprotein cholesterol. J Clin Invest 1993; 91: 1743-52.
26. Coniglio R, Colombo O, Vasquez L, Salgueiro A, Otero J, Dahinten E, et al. Ateroscleosis coronaria: evaluación de parámetros biomédicos para la detección de individuos de alto riesgo. Acta Bioquím Clín Latinoam 1993; 27: 181-95. [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ]
Aceptado para su publicación el 1 de diciembre de 2005














