Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. v.40 n.2 La Plata abr./jun. 2006
HEMATOLOGÍA
Utilización estratégica de CD45 en la identificación de células blásticas por citometría de flujo
CD45 gating for the identification of blastic cells by flow cytometry
César Juan Gerardo Collino1*, Cecilia Rodríguez2**, Darío Sastre3**, Viviana Heller4***, Enrique Fernández4***
1. Licenciado en Bioquímica.
2. Bioquímica, Especialista en Hematología.
3. Bioquímico.
4. Médico cirujano.
* Departamento de Bioquímica Clínica, CEQUIMAP (Centro de Química Aplicada), Facultad de Ciencias Químicas, Universidad Nacional de Córdoba, Argentina.
** Laboratorio de Oncohematología, Servicio de Oncología, Hospital Nacional de Clínicas, Universidad Nacional de Córdoba, Argentina.
*** Especialista en Clínica Médica, Especialista en Oncología; Servicio de Oncología, Hospital Nacional de Clínicas, Universidad Nacional de Córdoba, Argentina.
Resumen
La implementación de la citometría de flujo (CF) en los laboratorios de análisis clínicos como herramienta indispensable para la tipificación de desórdenes hematológicos ha crecido sustancialmente en los últimos años. En este trabajo se aplicó la CF para lograr una identificación exacta y posterior correlación del porcentaje de células blásticas en médula ósea (MO) y sangre periférica (SP). Se utilizó la estrategia de marcación-análisis en CD45/Side Scatter (EM-A CD45/RT-SC) en 29 pacientes con diferentes neoplasias hematológicas. Los resultados se compararon con la estrategia de marcación-análisis convencional en FW-SC/RT-SC, como también con el porcentaje de blastos obtenido por recuento manual a partir de extendidos teñidos de la manera convencional con May-Grünwald Giemsa (MGG). El porcentaje de blastos definidos por la EM-A CD45/RT-SC tuvo mejor correlación con los valores determinados por el análisis convencional citomorfológico (r=0,967 y r=0,985, para MO y SP, respectivamente), respecto al porcentaje de blastos obtenidos a partir de la estrategia de marcación-análisis convencional en FW-SC/RT-SC (r=0,862 y r=0,961, para MO y SP, respectivamente). Estos hallazgos no son sorpresivos debido a que la intensidad de expresión diferencial de CD45 es generalmente menor en células blasticas respecto a aquellas poblaciones celulares residuales (principalmente linfocitos y monocitos) en muestras de SP y MO, mientras que en las características de FW-SC/RT-SC generalmente existe una superposición de las poblaciones celulares antes mencionadas. En este trabajo se demuestra que la EM-A CD45/RT-SC, utilizando este anticuerpo conjugado con PC5, mejora notablemente la determinación fenotípica de las células blasticas. Además, esta estrategia de estudio permite principalmente en MO el estudio específico de diferentes linajes celulares presentes, contribuyendo de esta manera con los análisis morfológicos convencionales.
Palabras clave: antígeno CD45 * citometría de flujo * inmunofenotipo
Summary
Flow cytometry (FC) in clinical laboratories is a useful tool for the characterization of hematological disorders. In this work, FC was used for the identification of blastic cells in bone marrow (BM) and peripheral blood (PB) by CD45/Side Scatter gating procedure (CD45 gating) in 29 patients with different hematological malignancies. The percentage of blast cells obtained with this procedure was correlated with FW-SC/RT-SC gating and May – Grünwald Giemsa staining smears (MGG) procedure. Correlation values (r) of CD45 gating procedure compared with MGG and FW-SC/RT-SC were 0.967 (BM) and 0.985 (PB), and 0.862 and 0.961 (PB), respectively. The better correlation observed with CD45 gating versus MGG respect to CD45 gating versus FW-SC/RT-SC procedures could be explained by the different expression of CD45 intensity (generally lower) on blastic cells respect to residuals normal cells (mainly lymphocyte and monocytes) in PB and BM samples. In addition in the FW-SC/RT-SC procedure there is generally overlapping in population cells gating including blastic and normal cells. In conclusion, it was demonstrated that the CD45 gating strategy proposed enables the improvement of phenotypic identification of blastic cells as well as the specific study of different cellular linages present mainly in BM, which constitutes an important help for the conventional morphological analysis of hematological malignancies.
Key words: antigen CD45 * flow cytometry * immunophenotype
INTRODUCCIÓN
La citometría de flujo (CF) es una metodología de trabajo multiparamétrica que se utiliza como estudio de rutina en la evaluación del componente celular, en medula ósea (MO) y en sangre periférica (SP). Es imprescindible la exactitud del recuento de células blásticas en MO para el establecimiento del diagnóstico de leucemia aguda (LA). Las diferentes estrategias de estudio han permitido aumentar el poder discriminatorio entre células blásticas leucémicas y el componente celular normal, presentes de manera concomitante, excluyendo este último en el análisis fenotípico, erradicando así fenómenos de contaminación y clasificación celular errónea. La EM-A CD45/RT-SC permite evidenciar una expresión heterogénea del antígeno CD45 en las diferentes poblaciones celulares de diversos desórdenes hematológicos. A su vez, este tipo de inmunofenotipificación posibilita una discriminación eficiente entre los diferentes linajes celulares presentes en una matriz compleja como la SP y más aún MO, favoreciendo la caracterización de pequeñas poblaciones celulares (1).
La CF proporciona información de manera rápida y sensible sobre diferentes características físicas y químicas de células en suspensión, siendo esta información de tipo cuali-cuantitativo e individual. Las propiedades físicas celulares como tamaño (FW-SC) y complejidad interna (RT-SC) pueden resolver la presencia de ciertas subpoblaciones celulares. Por otro lado, a través de las propiedades químicas celulares y la utilización de anticuerpos monoclonales conjugados con determinados fluorocromos, a través de esta tecnología se logra identificar específicamente proteínas dispuestas en la membrana celular, a nivel citoplasmático, como también de disposición intranuclear.
Existen diversas recomendaciones respecto al análisis inmunofenotípico en LA, demostrándose una mejor discriminación de células blásticas empleando la EM-A CD45/RT-SC respecto a la manera convencional de análisis FW-SC/RT-SC (1-7); sin embargo, sigue siendo hoy motivo de desacuerdos la estrategia de análisis a utilizar para desarrollar dichos estudios (3)(8)(9). Cuando la MO presenta un alto grado de infiltración blástica, generalmente no hay dificultad en establecer el fenotipo de estas células utilizando los parámetros físicos celulares FW-SC/RT-SC como estrategia de marcación-análisis. Sin embargo, cuando coexisten blastos leucémicos con células normales residuales resulta difícil la separación de la población neoplásica para su posterior inmunofenotipicación basada en esta estrategia.
La utilidad en la tipificación celular a través del antígeno CD45 se basa en que es una proteína expresada de manera constitutiva en todas las células hematopoyéticas, que incrementa su densidad en los estadíos finales de la hematopoyesis en los diferentes linajes celulares leucocitarios y permanece de manera estable en células maduras. Pertenece a una familia compleja de glicoproteínas de alto peso molecular (180 - 220 kDa) compuesta por cinco isoformas y posee actividad tirosín-fosfatasa jugando un rol importante en la regulación de la diferenciación celular (8)(10). Por otro lado, las células eritroides y las plaquetas pierden la expresión de este antígeno a lo largo de la diferenciación.
Se sabe que la intensidad de expresión de CD45 no es la misma en todos los glóbulos blancos normales, lo mismo que en las diferentes neoplasias hematológicas (10), situación que contribuye a la distinción entre los diferentes tipos celulares presentes y a la identificación de pequeñas poblaciones de células. El estudio de la expresión de este antígeno de superficie por CF es de particular importancia ya que permite distinguir el linaje celular y también inferir el estadío de maduración de la mayoría de las células hematopoyéticas (3). La combinación de la expresión de este marcador inmunológico con características físicas celulares como el RT-SC, permite la identificación y separación de células linfoides, mieloides, monocíticas y eritroides, como así también dilucidar el estadío de maduración de dichas células luego de la fenotipificación celular complementaria utilizando diversos anticuerpos monoclonales específicos contra diferentes antígenos celulares.
El procedimiento de estudio desarrollado en este trabajo permitió la identificación de células blásticas, ya que ocupan una región caracterizada por una intensidad de expresión baja o intermedia de CD45 y un bajo RT-SC (2)(4). Por lo tanto, la EM-A CD45/RT-SC contribuyó a una mejor separación de las células inmaduras (blastos) para su posterior inmunotipificación con respecto a la estrategia de marcación-análisis convencional, logrando también una mejor aproximación a la semicuantificación de células blásticas respecto al estudio citomorfológico (May-Grünwald Giemsa) (11).
Los objetivos del presente trabajo fueron correlacionar estadísticamente el porcentaje de blastos obtenido a partir de CF, utilizando dos estrategias de marcación-análisis: una basada en la intensidad de expresión del CD45/RT-SC, y la otra basada en parámetros celulares no fluorométricos FW-SC y RT-SC así como evaluar la correlación de este resultado con los valores de células blásticas hallados en el estudio citomorfológico del frotis. Esta metodología fue aplicada y evaluada en una serie de casos de LA y otros desórdenes hematológicos y se demostró la superioridad en términos analíticos respecto a la estrategia de marcación-análisis convencional, principalmente cuando las células blásticas leucémicas comparten la matriz medular con células hematopoyéticas medulares normales.
MATERIALES Y MÉTODOS
Pacientes - Muestras
Los casos estudiados fueron seleccionados a partir de pacientes que arribaron al laboratorio de Oncohematología del servicio de Oncología del Hospital Nacional de Clínicas. El trabajo incluyó treinta y cinco muestras de MO y SP (17 mujeres y 18 varones), provenientes de pacientes con edades comprendidas entre 8 y 72 años, los que fueron estudiados en un período de 14 meses. El diagnóstico presuntivo de estas patologías fue establecido según los criterios citomorfológicos de acuerdo a la clasificación FAB (11) y se establecieron los siguientes grupos; 14 casos de leucemia mieloblástica aguda (LMA) con los siguientes sub-tipos: 2 casos de M1(2), M2(4), M3v(1), M4(2), M5(1) y 4 casos clasificados como LMA(4); 18 casos de leucemia linfoblástica aguda (LLA); 8 casos clasificados como LLA-T, y 10 casos como LLA-B; 3 casos de síndromes mielodisplásicos (SMD-3).
Análisis Hemocitométricos
Se realizó el recuento automatizado de las distintas células hemáticas a partir de muestras de SP anticoaguladas con EDTA-Na2 en un autoanalizador hematológico Coulter T-660 (Coulter Electronic Inc., Hialeah, Florida, USA); esta cuantificación fue realizada dentro de las 2 horas posteriores a la extracción. Para el examen citomorfológico de SP y MO se llevó a cabo una coloración con May–Grünwald Giemsa convencional. El diagnóstico de LA fue establecido en todos los casos a través de la observación citomorfológica de 500-1.000 elementos sobre tinciones con May-Grünwald Giemsa de frotis medulares, estableciéndose de esta manera los porcentajes celulares correspondientes a las distintas poblaciones leucocitarias presentes. En todos los casos evaluados se realizaron las determinaciones citoquímicas pertinentes y en conjunto con el inmunofenotipo contribuyeron al establecimiento confiable del diagnóstico.
Reacciones Citoquímicas
Como segundo paso en el estudio secuencial de las muestras se realizaron técnicas de reacciones citoquímicas según Grignaschi (12), que a continuación se detallan: peroxidasa granulocítica, Sudán Black B, ácido periódico-Shiff (PAS), a-naftil-aceto esterasa (ANAE) y fosfatasa ácida leucocitaria (FAL). Estas reacciones citoquímicas fueron realizadas sobre extensiones de MO y también SP y se realizó un recuento mínimo de 100 elementos en cada reacción.
Tipificación Fluorescente Celular
Se colectaron las punciones aspirativas de MO (1-3 mL) en tubos con EDTA-Na2 como anticoagulante y se procesaron dentro de las 2-5 horas pos-aspiración. La tipificación de células blásticas se realizó sobre muestras de MO y SP, tomando 100 µL como fracción de ensayo (o volumen final equivalente de dilución) con una concentración celular final entre 5x105 y 1x106 células/mL. Se realizó una reacción de inmunofluorescencia directa de 3 colores incubando las muestras entre 30-60 minutos con cada uno de los anticuerpos monoclonales conjugados con sus respectivos fluorocromos (Tabla I). El estudio de la expresión del antígeno CD45 se realizó mediante la utilización de un anticuerpo monoclonal anti-CD45 conjugado con PC5 (Phycoerythrin- Cyanine5), siendo el clon utilizado el J33-Immunotech que une todas las isoformas de CD45 presentes en leucocitos humanos (13-17). Se utilizaron diferentes combinaciones de los anticuerpos monoclonales expuestos en la Tabla I a fin de optimizar las diferencias entre las subpoblaciones celulares presentes para la identificación inequívoca de las mismas. En el panel de anticuerpos monoclonales siempre estuvo presente el CD45-PC5 en la triple marcación realizada. Las células fueron posteriormente lavadas con solución salina tamponada (PBS 1%) y finalmente se lisaron los glóbulos rojos con solución de ClNH4 según Febbar Cotter (18). La elección del ClNH4 como estrategia de lisis radica en sus diferentes ventajas, como conservación de la topografía celular de la muestra ensayada, posibilidad de evidenciar diferentes antígenos mieloides maduros como control interno de la reacción y el hecho de no adicionar más variables que puedan modificar de manera divergente el recuento citomorfológico de los diferentes elementos que componen la muestra ensayada. Posteriormente, las células se fijaron con p-formaldehído en un rango de concentración de 0,5-2% hasta el momento de su adquisición. En cada una de las muestras ensayadas se utilizó el control de isotípo de subclases de inmunoglobulinas y también el característico control de autofluorescencia.
Tabla I. Anticuerpos monoclonales utilizados en este trabajo.

Análisis por citometría de flujo
La adquisición de los datos fue realizada en un citómetro de flujo Cytoron Absolute Count-Ortho Diagnostic Systems Ltd. (Johnson & Johnson Company, Raritan, New Jersey, USA, software de adquisición Immunocount II). Se abarcó un rango de 10.000 a 65.500 eventos colectados en cada tubo. Se colectaron y almacenaron datos simultáneamente de cinco parámetros; tamaño y complejidad interna celular en escala lineal y las tres fluorescencias con sus respectivas escalas logarítmicas, logFITC, logPE y logPC5. Se realizaron 3 - 4 zonas lógicas de interés (gates) en los dot-plots de CD45/RT-SC: gate Gn.: granulocitos, Bl.: blastos, Lin.: linfocitos, Mn.: monocitos (Fig. 1). La compensación de las fluorescencias fue realizada con la marcación pertinente sobre subpoblaciones linfocitarias en SP de individuos clínicamente normales, utilizando triple marcación CD8-FITC/CD4-PE/CD45-PC5; este control fue realizado periódicamente (19).
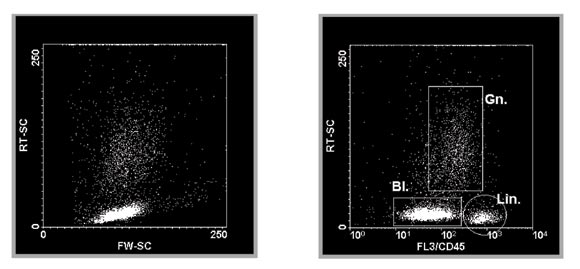
Figura 1. Médula ósea perteneciente a un paciente con LMA-M1. Parámetros no fluorométricos, tamaño vs. complejidad interna celular (izquierda); marcación con CD45 PC5-FL3 vs. complejidad interna celular (derecha). Obsérvese en el gráfico de la izquierda la clara superposición poblacional de las células existentes, lo cual es claramente diferenciado a partir de la estrategia de evaluación basada en CD45/RT-SC (derecha).
La ubicación respecto a coordenadas en CD45/RT-SC de la población blástica fue heterogénea en las diferentes muestras analizadas, inclusive realizando discriminación de linaje, independientemente de la presencia del componente celular residual normal (Fig. 2). El porcentaje de positividad en cada caso fue determinado por referencia a los controles isotípicos y de autofluorescencia utilizados. El análisis de los datos, como el soporte estadístico de los mismos, se realizó con dos softwares independientes, Immunocount II y WinMD I2.8 (copyright© 1993-1998 por Joseph Trotter); ambos softwares poseen un desarrollo estadístico y gráfico suficiente para realizar un análisis exhaustivo sobre cada población de eventos adquiridos. En todas las muestras analizadas se adquirieron al menos 5.000 eventos en el gate de interés.
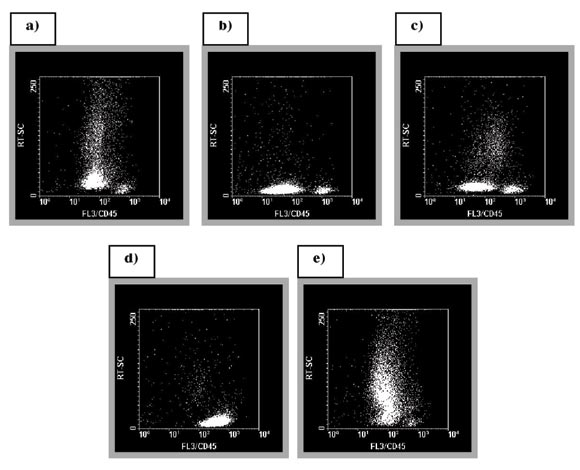
Figura 2. a) LMA-M1; b) LLA-B; c) LMA-M0; d) LLA-T; e) LMA-M2. En esta figura se demuestra la heterogeneidad de expresión del antígeno CD45 en los diferentes casos de LA evaluados, con los diversos MIF. Además, se observa la diferencia de la complejidad interna celular respecto a este antígeno en los diferentes tipos de LA analizados. En todos los Dot-Plots (salvo en "d" se evidencia la población linfocitaria normal remanente).
Tests Estadísticos
Para la evaluación de los resultados obtenidos y la correlación de las variables cuantitativas se empleó la prueba de regresión lineal con ajuste de cuadrados mínimos. El objetivo de este test de comparación de métodos es estimar el promedio de los bias sistemáticos y sus intervalos de confianza (20). Se utilizó el software GraphPad InStat versión 3.01 para realizar el estudio de correlación del porcentaje de blastos obtenido a partir de la EM-A CD45/RT-SC, con los respectivos porcentajes encontrados a partir de la evaluación del frotis de MO y/o SP y a través de la estrategia de marcación-análisis convencional FW-SC/RT-SC.
RESULTADOS
La Figura 1 muestra la importancia de esta estrategia de EM-A CD45/RT-SC, utilizando el CD45 en tercer canal de fluorescencia para la posterior discriminación celular específica, respecto a los parámetros físicos convencionales. En esta figura se demuestra la clara ventaja de aplicar esta forma de estudio, respecto a la estrategia de marcación-análisis convencional (FW-SC/RT-SC), estando esta ultima forma de análisis supeditada a la permanente contaminación y superposición poblacional de diferentes tipos celulares como linfocitos, plaquetas, glóbulos rojos nucleados, restos celulares (debris) y en algunos casos monocitos, lo cual implica confusión y subestimación de las células de interés.
Se determinó en todos los casos el valor MIF (intensidad de fluorescencia media), salvo en un caso diagnosticado como LLA-T, donde los elementos blásticos fueron negativos para la expresión de CD45(-); además, se confrontó en cada muestra evaluada el valor de MIF de las células de interés con el valor de MIF definido por la población linfocitaria normal remanente. Esta población linfocitaria fue mayoritariamente de predominio T (CD3+) y en menor cuantía B (CD19+). El valor de MIF varió significativamente entre los diferentes casos de LLA evaluados, evidenciado un comportamiento heterogéneo, siendo esta dispersión mayor entre los casos de LLA-T respecto a los casos de LLA-B (Fig. 2). A su vez, la heterogeneidad en los valores de MIF fue menor en los casos de LMA y SMD (datos no mostrados). Por otro lado, se observó una clara disminución del patrón de RT-SC en los diferentes casos evaluados de LLA respecto a aquellos de LMA (Fig. 2).
Además, diferentes mezclas de anticuerpos monoclonales conjugados con FITC o PE (Tabla I) fueron utilizadas en los diferentes tubos de reacción, identificando la expresión antigénica precisa en las células de interés a través de la utilización de la distribución repetitiva obtenida de CD45-PC5/RT-SC en los diferentes tubos evaluados por muestra.
Es necesario destacar que la caracterización celular realizada según Borowitz y col. (2), a partir de la utilización de la mezcla CD71/CD33/CD45 ha permitido en el presente trabajo una caracterización fehaciente y certera de cada una de las poblaciones celulares presentes, observándose diferencias respecto al estudio citomorfológico atribuibles a divergencias técnicas debidas principalmente al tratamiento recibido por las células para la evaluación por CF (como, por ejemplo, destrucción y por ende subestimación de eritroblastos); y por otro lado esta metodología ofrece una mayor sensibilidad y menor límite de detección que la citomorfología convencional, siendo esta última una técnica sujeta a diferentes subjetividades dependientes del operador.
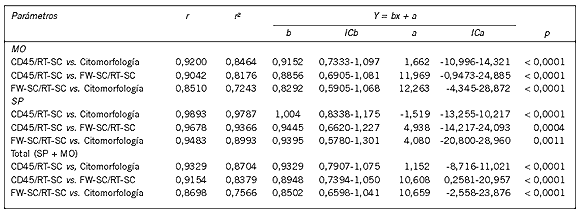
Sin embargo (Fig. 3), el porcentaje de células encontrado por CF empleando la estrategia de CD45/RT-SC se correlacionó fuertemente con el valor hallado de estas células por la citomorfología convencional (r=0,9200; P < 0,0001), observándose una menor asociación entre la metodología de CD45/RT-SC vs. FW-SC/ RT-SC y citomorfología vs. FW-SC/RT-SC (r=0,9042; P < 0,0001; r=0,8510; P < 0,0001; respectivamente) (Tabla II). Es importante mencionar que en algunos casos de LMA (principalmente en aquellos diagnosticados como M4-M5) no fue simple la discriminación y tipificación de células blásticas leucémicas respecto a células normales residuales.
Por otro lado, la fuerte correlación hallada entre la CF y la citomorfología al realizar la tipificación celular en una matriz más simple como SP, demuestra la especificidad de esta metodología. La EM-A CD45/RT-SC permite, además, excluir la contaminación de células pertinentes a SP del análisis antigénico de células blásticas en MO.
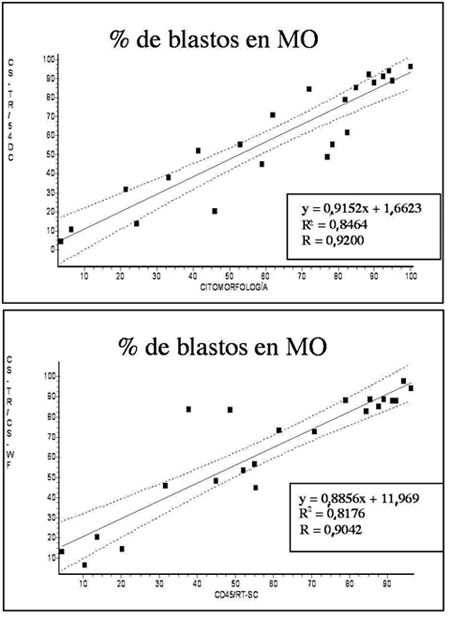
Figura 3. Correlación entre el porcentaje de blastos en MO obtenido mediante la citomorfología manual convencional y las estrategias de CD45/RT-SC y FW-SC/RT-SC por Citometría de Flujo.
Tabla II. Índices de correlación obtenidos entre las diferentes metodologías de estudio.
DISCUSIÓN Y CONCLUSIONES
La clasificación certera, como también el pronóstico de diversas neoplasias hematológicas depende, entre otros factores, de un recuento exacto de células blásticas. Se comprobó estadísticamente que la zona lógica de interés basada en la EM-A CD45/RT-SC se correlaciona significativamente mejor con el recuento morfológico del frotis (método convencional) que mediante los parámetros no fluorométricos (FW-SC/ RT-SC). Además, se evidenció una mejor correlación en SP que en MO.
La utilización de CD45 podría colaborar en la detección de pequeñas poblaciones de células hematopoyéticas anormales, sin evidencia presente de alteraciones morfológicas de las mismas, exacerbando las poblaciones celulares presentes en menor cuantía lo cual ayudaría a entender la etiología de algunas citopenias de origen incierto (10).
Si bien la metodología convencional de recuento morfológico celular en frotis es suficiente en un número importante de situaciones clínicas, no es despreciable la cantidad de casos en la cual esta metodología resulta insuficiente en términos absolutos de sensibilidad y límite de detección, siendo además una metodología ambigua y discrepante entre diferentes operadores. Por otro lado, esta metodología presenta algunas desventajas como una tinción deficiente de células, la presencia de núcleos sueltos, ausencia de espículas, contaminación con sangre periférica, así como distribución celular heterogénea en el frotis. Por otro lado, el recuento de estas células también se ve afectado por la procedencia del material, siendo usualmente de mayor representatividad el recuento realizado sobre material de impronta ósea y no sobre la punción aspirativa convencional (21). Además, el número limitado de células posibles de contabilizar mediante la citomorfología convencional introduce un sesgo importante en este tipo de cuantificación.
En el presente trabajo se encontró la mayor diferencia entre las tres metodologías evaluadas, en aquellas leucemias de estirpe mieloide respecto a aquellas de estirpe linfoide. Además, la CF presenta también desventajas en el sentido de que algunas células blasticas no expresan CD45 (LLA-T), sin embargo, en este tipo de casos evaluados en nuestra serie (datos no mostrados) la evaluación completa del perfil inmunofenotípico permitió en todos los casos arribar a resultados concluyentes.
Como conclusión se puede decir que la mejor información volcada en un histograma para el análisis individual de cada antígeno proviene de un gate realizado en CD45/RT-SC como tercer color de fluorescencia empleado. A la vez, esto eliminaría el riesgo de esgrimir valores pronósticos erróneos debido a la inclusión de células normales dentro del gate leucémico.
Es necesario mencionar que a partir de esta metodología (CF) se ha mejorado de manera notable el monitoreo de enfermedad mínima residual en este tipo de pacientes; sin embargo, esta estrategia (CD45/RT-SC) no es capaz por sí misma de diferenciar entre precursores celulares normales y células malignas, debido al similar comportamiento de las mismas en cuanto a CD45/RT-SC, empleándose para ello paneles extensos de marcación celular.
Agradecimientos
Los autores agradecen la asistencia experta de la Dra. Silvia Barzón en la interpretación y comprensión de los tests estadísticos empleados.
Correspondencia
LIC. BQCO. CÉSAR JUAN G. COLLINO
CEQUIMAP, Departamento de Bioquímica Clínica
Facultad de Ciencias Químicas, U. N. C.
Haya de la Torre esquina Medina Allende – Ciudad Universitaria
(5000) CÓRDOBA – Argentina
E-mail: ccollino@bioclin.fcq.unc.edu.ar
Referencias bibliográficas
1. Lacombe F, Durrieu F, Briais A, Dumain P, Belloc F, Bascans E, et al. Flow cytometry CD45 gating for immunophenotyping of acute myeloid leukemia. Leuk 1997; 11: 1878-86.
2. Borowitz MJ, Guenther KL, Shults KE, Stelzer GT. Immunophenotyping of acute leukemia by flow cytometry analysis. Use of CD45 and right-angle light scatter to gate on leukemic blast in three-colour analysis. Am J Clin Pathol 1993; 100: 534-40.
3. Shah VO, Civin CI, Loken MR. Flow cytometric analysis of human bone marrow: IV. Differential quantitative expression of T-200 common leukocyte antigen during normal hematopoiesis. J Immunol 1988; 140: 1861-7.
4. Stelzer G, Shults KE, Loken MR. CD45 gating for routine flow cytometric analysis of human bone marrow specimen. Ann NY Acad Sci 1993; 677: 265-80.
5. Rainer RO, Hodges L, Seltzer GT. CD45 gating correlates with bone marrow differential. Cytometry 1995; 22: 139-45.
6. Terstappen LW, Konemann S, Safford M, Loken MR, Zurlutter K, Buchner T, et al. Flow cytometric characterization of acute myeloid leukemia. Part I. Significance of light scattering properties. Leuk 1991; 5: 315-21.
7. Terstappen LW, Safford M, Konemann S, Loken MR, Zurlutter K, Buchner T, et al. Flow cytometric characterization of acute myeloid leukemia. Part II. Phenotypic heterogeneity at diagnosis. Leuk 1992; 6: 70-80.
8. Hendrickx A, Bossuyt X. Quantification of the leukocyte common antigen (CD45) in mature B-cell malignancies. Cytometry (Communications in Clinical Cytometry) 2001; 46: 336-9.
9. Givan Alice. Flow Cytometry – First principles. 2nd ed. New York: Wiley-Liss; 2001.
10. Tytherleigh L, Taparia M, Leahy MF. Detection of hairy cell leukaemia in blood and bone marrow using multidimensional flow cytometry with CD45-PECy5 and SS gating. Clin Lab Haem 2001; 23: 385-90.
11. Bennett JM, Catovsky D, Daniel MT, Flandrin G, Galton DA, Gralnick HR, et al. Porposals for the classification of acute leukaemias. French-American-British (FAB) Cooperative Group. Br J Haematol 1976; 33: 451-8.
12. Grignaschi. Diagnóstico de las hemopatías. Madrid: Editorial Panamericana; 1991.
13. Behm F, Raimondi SC, Schell MJ, Look AT, Rivera GK, Pui CH. Lack of CD45 antigen on blast cells in childhood acute lymphoblastic leukemia is associated with chromosomal hyperdiploidy on other favorable prognostic features. Blood 1992; 79: 1011-6.
14. Jennings CD, Foon KA. Recents advances in flow cytometry: Application to the diagnosis of hematologic malignancy. Blood 1997; 90: 2863-92.
15. Borowitz M, Shuster J, Carroll AJ, Nash M, Look AT, Camitta B, et al. Prognostic significance or fluorescence intensity of surface marker expression in childhood B-precursor acute lymphoblastic leukemia. A Pediatric Oncology Group Study. Blood 1997; 89: 3960-6.
16. Nakamura A, Tsurusawa M, Kato A, Taga T, Hatae Y, Miyake M, et al. Children's cancer and leukemia study group. Prognostic impact of CD45 antigen expression in high-risk, childhood B-cell precursor acute lymphoblastic leukemia. Leuk Lymph 2001; 42: 393-8.
17. Tabernero MD, Bortoluci AM, Alaejos I, Lopez-Berges MC, Rasillo A, Garcia-Sanz R, et al. Adults precursor B-ALL with BCR/ABL gene rearrangements display a unique immunophenotype based on the pattern of CD10, CD34, CD13 and CD38 expression. Leuk 2001; 15: 406-14.
18. Febbar Cotter. Molecular Diagnostic of Cancer. Totowa (New Jersey): Human Press; 1996.
19. Stewart CC, Stewart SJ. Multiparameter analysis of leukocytes by flow cytometry. Meth Cell Biol 1994; 41: 61-79.
20. Martin RF. General deming T-regression for estimating systematic bias and its confidence interval in method-comparison studies. Clin Chem 2000; 46: 100-4.
21. Aboul-Nasr R, Estey EH, Kantarjian HM, Freireich EJ, Andreeff M, Johnson BJ, et al. Comparison of touch imprints with aspirate smears for evaluating bone marrow specimens. Am J Clin Pathol 1999; 111: 753-8. [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ]
Aceptado para su publicación el 3 de febrero de 2006














