Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. v.40 n.2 La Plata abr./jun. 2006
BIOQUÍMICA CLÍNICA
Intervalos de referencia para troponina I, creatina quinasa fracción mb masa y mioglobina*
Reference intervals for troponin I, creatine kinase fraction MB mass and myoglobin
Silvia Marcela Balconi1, Gladys Beatriz Posse2, Silvia Hentschel3
1. Bioquímica y Farmacéutica.
2. Bioquímica.
3. Licenciada en Estadística.
* Hospital Nacional "Prof. Dr. Alejandro Posadas", Marconi y Presidente Illia 999, El Palomar, Morón, Buenos Aires, Argentina.
Resumen
La inclusión de determinaciones nuevas como troponina I (cTnI), creatina quinasa fracción MB masa (CK-MB masa) y mioglobina hace que cada laboratorio deba verificar los intervalos de referencia (IR) dados por el fabricante. Cuando esto no ocurre dicho intervalo deberá ser creado a los efectos de una correcta interpretación de los resultados emitidos para su comparación frente a un intervalo de referencia confiable. Para ello se procesaron 247 muestras de suero de donantes de sangre y se hizo el cálculo de los percentilos 0,5 y 99,5 para la obtención del IR del 99% de cTnI y 2,5 y 97,5 para obtención del IR del 95% de mioglobina y CK-MB masa (método no paramétrico). En cTnI el IR fue verificado; en los otros dos marcadores (CK-MB masa y mioglobina) los IR debieron ser creados. Para CK-MB masa el IR obtenido fue de 0,5-4,4 ng/mL (IR reportado por el fabricante de 0,6-6,3 ng/mL). En mioglobina, el IR obtenido para mujeres fue de 8,3-40,3 ng/mL (IR reportado por el fabricante 14,3-65,8 ng/mL), para hombres fue de 11,5-56,5 ng/mL (reportado por el fabricante de 17,4-105,7 ng/mL). Cada laboratorio deberá establecer sus propios IR para garantizar la representación adecuada de poblaciones específicas y tipos de muestra.
Palabras clave: troponina I * creatina quinasa fracción MB masa * mioglobina * intervalo de referencia * verificación
Summary
The inclusion of new assays to be made: troponin I, creatine kinase fraction MB mass (CK-MB mass) and myoglobin, leads a laboratory to verify the reference intervals (RI) provided by the manufacturer. Otherwise, these intervals must be created for an accurate interpretation of the results, so that they can be compared with a reliable reference interval. On account of this hypothesis, 247 serum samples of blood-donors were taken in order to make the estimates of percentiles 0.5 and 99.5 to obtain the RI of the 99% of troponin; and 2.5 and 97.5 to obtain the RI of the 95% of myoglobin and CK-MB mass (non parametric method). The RI was verified in troponin; the other two intervals (CK-MB mass and myoglobin) had to be created. In CK-MB mass, the obtained RI was 0.5-4.4 ng/mL, (RI reported by manufacturer: 0.6 -6.3 ng/mL). In myoglobin, the obtained RI for women was 8.3-40.3 ng/mL (RI reported by manufacturer: 14.3-65.8 ng/mL); for men it was 11.5-56.5 ng/mL (RI reported by manufacturer: 17.4-105.7 ng/mL). Each laboratory must set up its own RI to guarantee the appropriate representation of specific groups of people and types of samples.
Key words: troponin I * creatine kinase fraction MB mass * myoglobin * reference interval * verification
INTRODUCCIÓN
El infarto agudo del miocardio (IAM) es una de las causas más comunes de muerte en este país. Por ello es importante un diagnóstico temprano y exacto para minimizar los daños celulares miocárdicos e instaurar el tratamiento adecuado.
La European Society of Cardiology (ESC) y el American College of Cardiology (ACC) (1)(2) consideran que se produce un IAM cuando en el desarrollo de una isquemia aguda, los niveles de marcadores sensibles y específicos, tales como troponina y creatina quinasa fracción MB masa (CK-MB masa) están alterados.
La Nacional Academy of Clinical Biochemistry (NACB) y la International Federation of Clinical Chemistry and Laboratory Medicine (IFCC) establecieron recomendaciones sobre el empleo de los parámetros bioquímicos en la enfermedad coronaria (3)(4). Consideran un marcador bioquímico (troponina T o I) con suficiente especificidad diagnóstica para indicar daño miocárdico. En este caso es necesario determinar un valor discriminante bajo para la población sana. Tanto la NACB como la IFCC recomiendan el uso de dos marcadores (uno temprano y uno tardío) para el diagnóstico de IAM. Como temprano recomiendan la determinación de mioglobina, que aumenta dentro de las 2 horas del dolor de pecho y la concentración de la CK-MB masa que incrementa su valor dentro de las 6 horas de producido el evento. Si bien la mioglobina posee pobre especificidad diagnóstica, tiene alto valor predictivo negativo. Y como diagnóstico definitivo de IAM, la troponina (T o I) que permanece elevada durante 4 a 10 días.
En función de estas recomendaciones se incluyen en el perfil cardíaco del laboratorio estas tres determinaciones.
Cada vez que se introducen nuevos analitos, se deberá verificar si los intervalos de referencia (IR) del fabricante coinciden con la población con la cual se trabaja. Esto permitirá que los resultados emitidos sean comparados con un IR confiable, al momento de decidir frente a un valor determinado si se está en presencia o no de enfermedad.
Cada laboratorio deberá establecer sus propios IR para garantizar la representación adecuada de poblaciones especificas y tipos de muestra (5).
Para que estos parámetros bioquímicos puedan ser usados en el diagnóstico de una enfermedad coronaria, el laboratorio deberá emitir un informe en un tiempo de respuesta igual a 1 hora (3). Además, la determinación deberá tener un coeficiente de variación menor de 10%, tanto en los valores discriminantes bajos como en el punto de corte del IAM. Si bien se recomienda el uso de plasma como espécimen ideal, este trabajo se realizó con muestras de suero por no disponerse en ese momento de tubos con heparina de litio.
MATERIALES Y MÉTODOS
Las muestras se obtuvieron de donantes voluntarios de sangre (6). Las mismas se recolectaron en tubos secos, sin acelerador de la coagulación. Fueron sometidas a centrifugación después de una incubación de 30 min a 37 °C en baño termostatizado, a fin de asegurar la inexistencia de fibrina y la separación posterior del suero, el cual fue procesado en el día. Para establecer los IR se siguieron las recomendaciones de la IFCC (7-11).
Se obtuvieron 251 muestras de donantes clínicamente sanos (125 hombres y 126 mujeres), con edades comprendidas entre 19 y 50 años en las mujeres y entre 18 y 64 años en los hombres y con una mediana de 32 y 36 años, respectivamente, como se muestra en la Tabla I.
A la población se le realizó serología para hepatitis A, B y C, VDRL y Chagas, HIV, HTLV, Ag P24 y reacción de Huddlesson por rutina de banco. Además, se realizaron determinaciones químicas de urea, glucosa, TGO, TGP, bilirrubina total y directa, creatinina, CK, LDH y proteína C reactiva (PCR).
Fueron tomados como criterios de exclusión donantes con serología positiva o con parámetros alterados para alguna de las pruebas antes mencionadas, descartando de este modo aquellos con alteraciones renales, diabéticos, cardíacos o con procesos infecciosos. Todos los pacientes contestaron un cuestionario de antecedentes de salud, lo que permitió excluir a los que presentaban alguna enfermedad.
Se determinó CK-MB masa, cTnI y mioglobina en un autoanalizador Access Immunoassay System (Beckmann Coulter Inc, Brea, California, USA) mediante un inmunoensayo quimioluminiscente. Se utilizaron como controles de calidad internos en el Sistema Access tres niveles Liquicheck Cardiac Markers Control LT (Bio-Rad).
Las determinaciones químicas se realizaron con un autoanalizador Hitachi 912 (Roche Diagnostics Corporation, Indiana, USA), en tanto que las determinaciones serológicas fueron realizadas de la siguiente forma: las automatizadas en un autoanalizador Axsym (Abbott Park, Illinois, USA) y las manuales por medio de técnicas de ELISA y aglutinación de partículas.
Se realizó el cálculo de los percentilos 0,5 y 99,5 para la obtención del IR del 99% de cTnI y del 2,5 y 97,5 para obtención del IR del 95% de mioglobina y CK-MB masa. Un análisis no paramétrico fue usado para determinar los percentilos 99 (cTnI) y 95 (mioglobina y CK-MB masa) para todas las muestras por sexo y edad, según las normas de la IFCC (7).
El análisis estadístico de los datos se realizó con el programa S-Plus 2000.
La verificación de los IR proporcionados por el fabricante fue realizada por simple conteo y cálculo de porcentajes. Para la determinación de nuevos IR locales, se testeó normalidad de la distribución de cada una de las variables mediante el test Kolmogorov-Smirnov (Lilliefors). Se consideraron apartamientos significativos aquellos con valores de p < 0,1. En los casos en los que no se pudo verificar normalidad, los intervalos de referencia se establecieron mediante el procedimiento no paramétrico: cálculo de percentilos 2,5 y 97,5.
Para evaluar si hubo diferencias significativas según sexo y edad se usó el test de Wilcoxon, suma de rangos (o Mann-Witney).
Tabla I. Descripción de la edad de la población.

RESULTADOS
De las 251 muestras de suero obtenidas se descartaron 4 (dos mujeres y dos hombres) una con serología positiva para Chagas, dos por alteraciones en las transaminasas hepáticas y una por un proceso infeccioso evidenciado por una PCR muy aumentada (IR < 0,5 mg/dL).
No se encontraron diferencias significativas según sexo (p > 0,05) para cTnI. Mioglobina y CK-MB masa presentaron diferencias estadísticamente significativas (p < 0,001), aunque para CK-MB masa esto no representó significancia clínica.
El test utilizado en todos los casos fue el de Wilcoxon, suma de rangos (o Mann-Witney) porque la distribución de los datos se aparta de la normalidad.
De las 247 muestras procesadas para cTnI sólo dos resultaron fuera del IR aportado por el fabricante (< 0,04 ng/mL), constituyendo un 0,8% sobre el límite superior.
En cuanto a la CK-MB masa, 19 muestras (7,7%) estuvieron fuera del IR (0,6-6,3 ng/mL), 17 de las mismas (6,9%) bajo el límite inferior y 2 sobre el límite superior (0,8%) lo que hizo un total de 8,5% de muestras fuera del IR. Con respecto a mioglobina, 44 muestras femeninas (35,5%) y 33 masculinas (26,8%) estuvieron bajo el límite inferior, en tanto que ninguna sobrepasó el límite superior (IR mujeres 14,3-65,8 ng/mL, hombres 17,4-105,7 ng/mL). Los datos se muestran en la Tabla II.
La distribución de las variables estudiadas se apartó de la normalidad con un p < 0,001. Como no se verificó normalidad en ninguna de las variables estudiadas, los intervalos se determinaron mediante el método no paramétrico (Fig. 1) (Fig. 2) (Fig. 3).
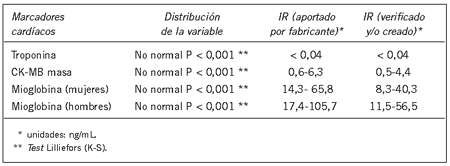
Al comparar los IR aportados por el fabricante con los obtenidos para troponina I se verificó el intervalo de referencia (percentilo 99 ≤ 0,04 ng/mL) porque solamente un 0,8% de los datos estuvieron fuera del IR. Para CK-MB masa y mioglobina los intervalos de referencia no fueron verificados (percentilo 95). En CK-MB masa un 7,7% de los datos estaban fuera del IR y en el caso de mioglobina tanto mujeres como hombres presentaban un 35,5% y 26,8%, respectivamente, fuera del IR, por lo cual fue necesario crear IR propios. En mioglobina el IR obtenido para mujeres fue de 8,3-40,3 ng/mL (IR aportado por el fabricante 14.3-65,8 ng/mL), para hombres fue de 11,5-56,5 ng/mL (reportado por el fabricante de 17,4-105,7 ng/mL). Para CK-MB masa el IR obtenido fue de 0,5-4,4 ng/mL (IR aportado por el fabricante de 0,6-6,3 ng/mL) (Tabla III).
Tabla II. IR provisto por fabricante y cantidad de muestras que estuvieron por debajo del límite inferior o sobre el límite superior del IR y porcentaje de muestras totales fuera del IR.
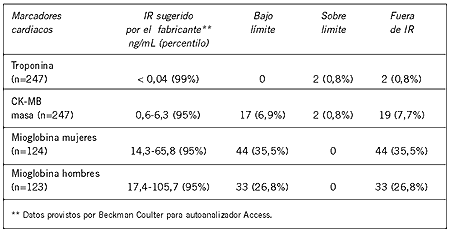

Figura 1. Troponina I.
A: Histograma de la distribución de los pacientes. B: Comprobación de la normalidad mediante el test de Kolmogorov-Smirnov.

Figura 2. CK-MB masa.
A: Histograma de la distribución de los pacientes. B: Comprobación de la normalidad mediante el test de Kolmogorov-Smirnov.

Figura 3. Mioglobina.
A: Diagrama de la distribución de los pacientes según sexo.
B: Distribución de los pacientes para sexo femenino.
C: Comprobación de la normalidad mediante el test de Kolmogorov-Smirnov, sexo femenino.
D: Distribución de los pacientes, sexo masculino.
E: Comprobación de la normalidad mediante el test de Kolmogorov-Smirnov, sexo masculino.
Tabla III. IR verificado para cTnI y creados para CK-MB masa y mioglobina.
DISCUSIÓN Y CONCLUSIONES
Para determinar un intervalo de referencia confiable se deberán tener en cuenta las siguientes variables: una población seleccionada adecuadamente, una recolección de las muestras en forma estandarizada y un buen método estadístico que permita analizar las variables analíticas que intervienen en el proceso. Para ello se seleccionó una población compuesta por donantes de banco de sangre que concurrieron al Servicio de Hemoterapia del Hospital Nacional "Prof. Dr. A. Posadas" (El Palomar). Los mismos contestaron un cuestionario de antecedentes de salud que permitió descartar a priori aquellos que presentaban alguna enfermedad o que estaban bajo un tratamiento farmacológico. Además, fueron excluidos los pacientes con alguna serología positiva y aquellos con alteraciones de parámetros que evidenciaran patología renal (urea, creatinina), diabética (glucosa), cardiaca (CK, LDH), hepática (bilirrubina, TGO, TGP) o cualquier proceso infeccioso (PCR). Todo esto se hizo a fin de minimizar las interferencias que cualquiera de estas situaciones pudiera causar en las determinaciones a ensayar.
Los intervalos de referencia para cada determinación fueron definidos sobre la base de las recomendaciones de la IFCC. Se usaron los percentilos 0,5 y 99,5% para la obtención del intervalo de referencia de troponina I, lo que implica que contiene el 99% de los datos de la distribución de referencia y los percentilos 2,5 y 97,5 para obtención de intervalos de referencia para mioglobina y CK-MB masa, es decir, un intervalo que contiene el 95% central de los datos. La utilización de estos percentilos es el método más común para establecer rangos de referencia ya que permite calcularlos de manera independiente a la distribución que presentan las variables estudiadas, en este caso aplicando métodos no paramétricos, ya que las variables presentan una distribución distinta a la normal. Además, el Panel de Expertos sobre Teoría de los Valores de Referencia de la IFCC recomienda trabajar sobre una población mínima compuesta por cuarenta datos pero como sugieren que la aproximación de los percentilos será más confiable cuanto mayor sea el número de determinaciones sujetas a análisis es que se aumentó el tamaño muestral a 247.
Un IR del 99% admite hasta un 1% de datos fuera del mismo, mientras que el de 95% permite un 5% de datos fuera de intervalo. De este modo, para troponina I se verificó el intervalo de referencia (percentilo 99, menor o igual a 0,04 ng/mL) porque solamente un 0,8% de los datos estuvieron fuera del IR.
En cuanto a los otros dos marcadores (CK-MB masa y mioglobina) los intervalos de referencia no fueron verificados (percentilo 95%), porque para CK-MB masa un 7,7% de los datos estaban fuera del IR y en el caso de mioglobina tanto mujeres como hombres presentaban un 35,5% y 26,8%, respectivamente, fuera del IR por lo cual fue necesario crear IR propios. Como no se verificó normalidad en ninguna de las variables estudiadas, se determinaron los intervalos mediante el método no paramétrico.
En mioglobina el IR obtenido para mujeres fue de 8,3-40,3 ng/mL (IR aportado por el fabricante 14,3-65,8 ng/mL), para hombres fue de 11,5-56,5 ng/mL (reportado por el fabricante de 17,4-105,7 ng/mL). Para CK-MB masa el IR obtenido fue de 0,5-4,4 ng/mL (IR aportado por el fabricante de 0,6-6,3 ng/mL) (Tabla III).
Estas diferencias podrían deberse a que los IR aportados por el fabricante fueron creados en una población con contextura física de características distintas a la del presente estudio, por ello cada laboratorio deberá establecer sus propios IR para garantizar la representación adecuada de poblaciones especificas y tipos de muestra.
Correspondencia
DRA. SILVIA BALCONI
Mariano Echenagucía 1131
1408 CIUDAD AUTÓNOMA DE BUENOS AIRES, Argentina
E-mail: balconis@uolsinectis.com.ar
Referencias bibliográficas
1. Alpert JS, Thygesen K, Antman E, Bassand JP. Myocardial infarction redefined a consensus document of the Joint European Society of Cardiology/American College of Cardiology Committee for the Redefinition of Myocardial Infarction. J Am Coll Cardiol 2000; 36 (3): 959-69.
2. Joint European Society of Cardiology/American College of Cardiology Committee for the Redefinition of Myocardial Infarction. Eur Heart J 2000; 21: 1502-13
3. Wu AHB, Apple FS, Gilbler WB, Jesse RL, Warshaw MM, Valdfes R Jr. National Academy of Clinical Biochemistry Standards of Laboratory Practice: recomendations for the use of cardiac markers in coronary artery diseases. Clin Chem 1999; 45: 1104-21.
4. Panteghini M, Apple FS, Christenson RH, Dati F, Mair J, Wu AH. Use of biochemical markers in acute coronary syndromes: IFCC Scientific Division, Committee on Standardization of Markers of Cardiac Damage. Clin Chem Lab Med 1999; 37: 687-93
5. Ventimiglia F, Fink N. Intervalos de referencia: metodología para su creación y verificación. Acta Bioquím Clín Latinoam 2002; 36: 223-33.
6. Macy EM, Hayes TE, Tracy RP. Variability in the measurement of C-reactive protein in healthy subjects: implications for reference intervals and epidemiological applications. Clin Chem 1997; 43 (1): 52-8.
7. Solberg HE. A guide to IFCC recommendations on reference values. JIFCC 1993; 5: 160-4.
8. Solberg HE. Approved Recommendation (1986) on the Theory of the Reference Values: Part 1. The concept of reference values. J Clin Chem Clin Biochem 1987; 25: 337-42.
9. Petitclec C, Solberg HE. Approved Recommendation (1987) on the Theory of the Reference Values: Part 2. Selection of individuals for the production of reference values. J Clin Chem Clin Biochem 1987; 25: 639-44.
10. Solberg HE, Petitclec C. Approved Recommendation (1988) on the Theory of the Reference Values: Part 3. Preparation of individuals and collection of specimens for the production of reference values. J Clin Chem Clin Biochem 1988; 26: 593-8.
11. Solberg HE. Approved Recommendation (1987) on the Theory of the Reference Values: Part 5. Statistical treatment of collected reference values: Determination of the reference limits. J Clin Chem Clin Biochem 1987; 25: 645-56. [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ]
Aceptado para su publicación el 3 de febrero de 2006














