Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. v.40 n.3 La Plata jul./sep. 2006
HEMOSTASIA Y TROMBOSIS
Importancia de la determinación de homocisteinemia y metilentetrahidrofolato reductasa C677T*
Importance of the determination of homocysteine and C667T polimorphism of methylenetetrahydrofolate reductase*
María Mercedes Castañon1, Ana María Lauricella2, Valeria Genoud3, Irene Luisa Quintana4
1. Licenciada en Ciencias Químicas.
2. Doctora de la Universidad de Buenos Aires. Área Ciencias Químicas.
3. Licenciada en Ciencias Biológicas.
4. Doctora de la Universidad de Buenos Aires. Área Ciencias Químicas.
* Laboratorio de Hemostasia y Trombosis.
Dpto. Química Biológica, Facultad de Ciencias Exactas y Naturales. Universidad de Buenos Aires. Argentina.
Resumen
La hiperhomocisteinemia (HHcy) constituye un factor de riesgo independiente para las enfermedades aterotrombóticas. En el metabolismo de la homocisteína (Hcy) intervienen el ácido fólico, la vitamina B12 y la metilentetrahidrofolato reductasa (MTHFR). El objetivo del presente estudio fue evaluar la importancia clínica de la determinación de homocisteinemia y del polimorfismo C677T de la MTHFR. En 112 individuos sanos se determinaron: Hcy (ELISA), ácido fólico y B12 (quimioluminiscencia) y el polimorfismo C677T-MTHFR (PCR-RFLP). El 25% de la población presentó hiperhomocisteinemia (Hcy >15 µM). Los niveles de Hcy en los sujetos con déficit de folatos o de vitamina B12 superaron significativamente a los hallados en los no deficitarios (media: 15,8 µM y 15,6 µM vs. 12,5 µM). Los individuos homocigotas (TT) presentaron valores de Hcy mayores que los heterocigotas y los normales (14,5 µM, 13,3 µM y 12,5 µM, respectivamente). Resultaron hiperhomocisteinémicos el 40% de los deficitarios de vitamina B12, el 54% de los deficitarios de ácido fólico, el 43% de los individuos MTHFR-TT y el 100% de MTHFR-TT con deficiencia de vitamina B12. En conclusión, la determinación de homocisteinemia advierte acerca de la presencia de un factor de riesgo aterotrombótico y probables deficiencias vitamínicas. Además, el estudio del polimorfismo de la MTHFR permite detectar un importante condicionante genético de HHcy.
Palabras clave: hiperhomocisteinemia * ácido fólico * vitamina B12 * metilentetrahidrofolato reductasa
Summary
Hyperhomocysteinemia (HHcy) is an independent risk factor for atherothrombotic diseases. Folic acid, vitamin B12 and the enzyme methylene-tetrahydrofolate reductase (MTHFR) are some of the components involved in homocysteine (Hcy) metabolism. The aim of the present study was to evaluate the clinical usefulness of homocysteinemia determination and the C677T polymorphism analysis of the MTHFR. Homocysteine (ELISA); folic acid and vitamin B12 levels (chemiluminescence) and C677T polymorphism of the MTHFR (PCR-RFLP) were evaluated in 112 healthy subjects. Twenty-five per cent of the population showed hyperhomocysteinemia (Hcy > 15 µM). Hcy levels in subjects with folate or B12 deficiency were significantly higher than those found in non deficient individuals (mean: 15.8 µM or 15.6 µM vs 12.5 µM). Homozygote subjects (TT) showed higher Hcy levels than heterozygote and normal individuals (14.5 µM, 13.3 µM and 12.5 µM, respectively). Forty per cent of the B12 deficient subjects, fifty-four per cent of the folate deficient individuals, forty-three per cent of the MTHFR-TT subjects and a hundred per cent of the MTHFR-TT individuals with B12 deficiency turned out to be hyperhomocysteinemic. Therefore, homocysteinemia determination could evidence the presence of an atherothrombotic risk factor and likely vitamin deficiencies. Moreover, MTHFR polymorphism determination makes it possible to detect an important genetic factor of hyperhomocysteinemia.
Key words: hyperhomocysteinemia * folic acid * vitamin B12 * methylenetetrahydrofolate reductase
INTRODUCCIÓN
Una de las principales causas de morbi-mortalidad en el mundo moderno la constituyen las enfermedades vasculares oclusivas, tales como la aterosclerosis y la trombosis. Actualmente la enfermedad vascular es considerada una patología multicausal resultante del efecto de factores genéticos y/o adquiridos que interactúan entre sí. Si bien aún no puede explicarse la patogénesis del episodio aterotrombótico, se describieron factores predisponentes tales como dislipidemias, hipertensión, diabetes, tabaquismo, obesidad, estrés, alteraciones en los sistemas de coagulación y fibrinolítico, etc. En los últimos años se ha postulado que la presencia de una concentración elevada de homocisteína (Hcy) en circulación (hiperhomocisteinemia: HHcy) constituye un factor de riesgo independiente para el desarrollo de la enfermedad cardiovascular, cerebrovascular y del tromboembolismo venoso (1). Si bien los mecanismos involucrados en la acción perjudicial de la Hcy aún no están completamente esclarecidos, se ha postulado que la HHcy podría incrementar el estrés oxidativo, limitar la biodisponibilidad de óxido nítrico, estimular la proliferación de células de músculo liso, alterar las propiedades elásticas de la pared vascular, etc (2). Estos hallazgos sugieren que los niveles elevados de Hcy provocarían disfunción endotelial con la consecuente activación plaquetaria y del sistema de coagulación generando un estado protrombótico. Recientemente se ha reportado que la HHcy induciría la formación de redes de fibrina más compactas y ramificadas asociadas a una fibrinolisis defectuosa (3).
La Hcy es un aminoácido con un grupo sulfhidrilo o tiol en su molécula. Este aminoácido es uno de los productos intermedios en el metabolismo de la metionina, fuente principal de radicales metilos en los mamíferos. Por una serie de reacciones químicas la metionina de origen dietario o endógeno, es convertida a Hcy (4). Ésta, a su vez, puede ser metabolizada por la vía de la transulfuración o por la remetilación. La transulfuración (vía irreversible) es el camino catabólico de la Hcy y tiene lugar fundamentalmente en hígado y riñón. Mediante la remetilación, la Hcy es convertida a metionina por ganancia de un grupo metilo. Este proceso puede ocurrir a través de dos rutas alternativas: (a) la que utiliza 5-metiltetrahidrofolato como donante del metilo, metionin-sintetasa (MS) y vitamina B12 ; y (b) la que ocurre cuando el metilo es cedido por la betaína, por acción de la betain-homocistein-metiltransferasa (BHMT). Que ocurra una u otra vía de remetilación dependerá de la disponibilidad enzimática. La MS se distribuye en todas las células mientras que la BHMT se encuentra principalmente en el hígado. Por lo tanto, la conversión de Hcy a metionina catalizada por la MS constituye la vía de remetilación predominante y además, representa la intersección del metabolismo de la Hcy con el de la vitamina B12 y el ciclo de los folatos. Cuando la concentración intracelular de Hcy alcanza niveles potencialmente tóxicos, el aminoácido es exportado fuera de la célula y pasa a circulación. Por lo tanto, la concentración de Hcy en sangre refleja el nivel intracelular del aminoácido y la integridad de los pasos metabólicos involucrados.
Los niveles de homocisteinemia están determinados por factores genéticos y/o adquiridos. El efecto directo de uno o varios de estos determinantes o la interacción entre los mismos puede provocar HHcy.
Entre las causas genéticas que elevan los niveles plasmáticos de Hcy se han descripto algunas alteraciones moleculares en las enzimas involucradas en el metabolismo del aminoácido, fundamentalmente en el gen de la cistationin b-sintetasa (CbS) y de la metilen-tetrahidrofolato reductasa (MTHFR) (5). En esta última se ha demostrado que la sustitución de citosina por timina en el nucleótido 677 da como resultado una variante termolábil, que conduciría a una actividad enzimática disminuida (6). Los principales factores adquiridos que regulan la homocisteinemia son el nivel vitamínico (ácido fólico, vitamina B12, B6 y B2), la presencia de algunas patologías (falla renal, enfermedades gastrointestinales, neoplasias, psoriasis, etc), uso de ciertas drogas (metotrexate, fenitoína, teofilina) y hábitos de vida tales como el consumo de cigarrillos, alcohol, café, etc. (7). Clásicamente el rango de referencia para la concentración plasmática de Hcy oscila entre 5 y 15 µmol/L (8)(9).
Es indudable la relación entre los niveles plasmáticos elevados de Hcy y los episodios aterotrombóticos; sin embargo, algunos investigadores plantean que la HHcy no sería el agente responsable de la enfermedad vascular sino sólo un marcador de otro factor asociado a dicho riesgo (10).
En la medida que se conozca el verdadero rol de la HHcy se justificará la implementación de su diagnóstico y tratamiento. El objetivo del presente trabajo es evaluar la importancia de la determinación de homocisteinemia y el polimorfismo C677T en el gen de la MTHFR, en el laboratorio clínico.
MATERIALES Y MÉTODOS
Población: Se estudiaron 112 individuos sin relación de parentesco (47 hombres / 65 mujeres), aleatoriamente seleccionados entre estudiantes y empleados de la Universidad de Buenos Aires. La edad expresada como media y rango fue 52 (30-71) años.
Se incluyeron individuos aparentemente sanos, con parámetros hematológicos dentro de los rangos de referencia y función renal normal.
Se excluyeron del estudio a los individuos que declararon el uso de drogas que afectan los niveles de Hcy y a los portadores de enfermedad vascular sintomática y de otras patologías asociadas a HHcy.
En todos los casos se obtuvo el consentimiento de cada participante del estudio.
Muestras: De cada individuo se extrajo sangre en ayunas y se obtuvieron tres tipos de muestras: plasma en K3EDTA, suero y sangre entera anticoagulada con K3EDTA. Los plasmas obtenidos se separaron inmediatamente del paquete celular por centrifugación a 2.000 x g durante 15 min. Todas las muestras se congelaron a -70 ºC hasta el momento de su procesamiento.
Métodos: La concentración de Hcy plasmática se determinó por enzimoinmunoensayo (EIA, Axis Biochemicals, Oslo, Noruega). Este método, validado por nuestro grupo de investigación, es accesible para el laboratorio clínico y provee datos reproducibles y confiables (11).
Los niveles séricos de ácido fólico y vitamina B12 fueron determinados por un sistema combinado de inmunoensayo competitivo y quimioluminiscencia (Access-Sanofi-Pasteur; Access Beckman Coulter, Chaska, EE.UU.).
A partir de las muestras de sangre entera se extrajo ADN y se determinó el polimorfismo C677T de la MTHFR, por técnicas de biología molecular: amplificación por reacción en cadena de la polimerasa de un fragmento de 198 pares de bases y digestión posterior con la enzima de restricción Hinf I (PCR-RFLP) (12). Para los tres genotipos posibles se utilizó la siguiente denominación: Normal (individuo homocigota CC), Heterocigota (individuo heterocigota CT) y Homocigota (individuo homocigota TT).
Métodos estadísticos: Los datos fueron analizados utilizando el programa estadístico "Statistix for Windows 2.1". Las diferencias entre las medias de los distintos grupos fueron comparadas utilizando el test de Student considerando diferencias significativas para p < 0,05.
RESULTADOS
Se evaluaron los niveles de Hcy, vitamina B12, ácido fólico y el polimorfismo MTHFR C677T en todos los individuos de la población seleccionada. La concentración de Hcy en relación a los niveles vitamínicos se muestra en la Tabla I. La prevalencia del déficit de vitamina B12 (< 180 pg/mL) y de ácido fólico (< 3 ng/mL) resultó 11% y 12%, respectivamente. Ningún individuo presentó las dos deficiencias vitamínicas simultáneamente. Los niveles de Hcy registrados en los individuos con déficit vitamínico fueron significativamente superiores a los hallados en los sujetos no deficitarios. La distribución etaria resultó similar en los diferentes grupos.
Tabla I. Niveles de Hcy (µM) en función del nivel vitamínico.

En la Tabla II se muestran los niveles de Hcy en relación al genotipo de la MTHFR para el polimorfismo estudiado. La distribución genotípica resultó: CC 45%, CT 41% y TT 14%. Puede observarse que los individuos homocigotas presentaron valores de Hcy significativamente mayores que los heterocigotas y los normales, respectivamente.
Tabla II. Estudio del polimorfismo MTHFR C677T. Niveles de Hcy (µM) en función de la distribución genotípica.

En la población evaluada la proporción de sujetos hiperhomocisteinémicos (Hcy > 15 µM) resultó 25%. Al analizar las variables estudiadas en este grupo de individuos, el 14% presentó déficit de vitamina B12, el 25% déficit de ácido fólico, el 21% resultó MTHFR TT y el 7% mostró conjuntamente deficiencia de B12 y MTHFR TT. Con estas determinaciones se explicaría el 67% de los casos de hiperhomocisteinemia hallados (Fig. 1).
Del análisis inverso se determinó que la proporción de individuos hiperhomocistenémicos fue 40% en los deficitarios de B12, 54% en los deficitarios de ácido fólico, 43% en individuos MTHFR-TT y 100% en los que presentaron conjuntamente deficiencia de B12 y MTHFR-TT.
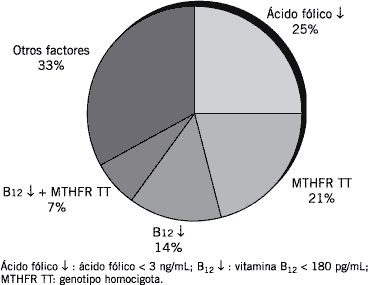
Figura 1. Factores asociados a hiperhomocisteinemia en la población estudiada.
DISCUSIÓN Y CONCLUSIONES
A medida que aumenta la expectativa de vida del hombre, mayor es la responsabilidad de los eventos vasculares oclusivos en causar su muerte o discapacitarlo. Por lo tanto, es necesario implementar medidas de prevención adecuadas, métodos de diagnóstico y una terapéutica eficiente. Surge entonces la importancia de establecer los factores de riesgo asociados a la enfermedad aterotrombótica. Actualmente la hiperhomocisteinemia es considerada un factor de riesgo para la enfermedad cardio y cerebrovascular, como así también para la trombosis venosa (13).
El análisis de la Tabla I muestra que los valores de Hcy en los individuos deficitarios de vitamina B12 y en los de ácido fólico, resultaron significativamente mayores que en aquellos sujetos con niveles vitamínicos óptimos. Por otro lado, se encontró que el 40% de los deficitarios de vitamina B12 y el 54% de los de ácido fólico mostraron HHcy. Estos resultados avalan el hecho de que los niveles disminuidos de vitamina B12 y ácido fólico constituyen los principales factores nutricionales condicionantes de HHcy (7). Se descartó que las diferencias encontradas estuvieran asociadas a la edad, ya que la distribución etaria en los distintos grupos resultó similar.
El estudio del polimorfismo MTHFR-C677T mostró una distribución genotípica similar a la de la población general de Argentina (14). En la Tabla II se indican los niveles de Hcy en función del genotipo estudiado, observándose que los individuos homocigotas presentaron valores de Hcy significativamente más altos que los heterocigotas y los normales. Se encontró HHcy en el 43% de los homocigotas y en el 100% de los homocigotas que además presentaban deficiencia vitamínica. Trabajos internacionales han reportado que la homocigocidad para este polimorfismo sería el determinante genético más común de HHcy (5).
En el presente trabajo se encontraron niveles de Hcy mayores de 15 µM en el 25% de la población estudiada. Este porcentaje, sorprendentemente elevado considerando los criterios de inclusión descriptos, podría explicarse por la presencia de deficiencias vitamínicas y la alta proporción de la variante termolábil de la MTHFR presente en la población evaluada (heterocigotas 41% y homocigotas 14%). El déficit vitamínico presente en algunos de los individuos estudiados probablemente se asocia a los hábitos alimentarios de esta población, caracterizados por un alto consumo de proteínas de origen animal y baja ingesta de alimentos ricos en folatos.
Algunos de los métodos de rutina para la determinación de vitamina B12 y ácido fólico presentan baja exactitud y precisión y alto costo (15), limitando el valor diagnóstico de los mismos. Teniendo en cuenta este inconveniente y considerando los resultados del presente estudio, puede concluirse que el dosaje de Hcy sería una práctica complementaria en la detección de deficiencias, aún subclínicas, de ácido fólico y/o vitamina B12. La determinación de homocisteinemia resultaría especialmente útil en la población anciana, que con frecuencia presenta deficiencias vitamínicas asociadas a alteraciones de la absorción (16). Además, esta determinación permite alertar acerca de la presencia de un factor de riesgo para la enfermedad vascular oclusiva y tomar las medidas de prevención y tratamiento adecuadas. Por lo tanto, el dosaje de Hcy, sería recomendable ante la presencia de antecedentes individuales y/o familiares de trombosis, o cuando existan otros factores de riesgo conocidos que incrementarían la probabilidad de complicaciones aterotrombóticas (17).
En conclusión, la determinación de niveles plasmáticos de Hcy es importante ya que el hallazgo de hiperhomocisteinemia alerta no sólo acerca de un factor de riesgo aterotrombótico, sino también sobre probables deficiencias de ácido fólico y/o vitamina B12. Además, el estudio del polimorfismo MTHFR-C677T es especialmente recomendable en los individuos que presentan hiperhomocisteinemia.
Correspondencia
DRA. IRENE LUISA QUINTANA
Int. Güiraldes 2160
Pabellón II. Piso 4. Ciudad Universitaria
C1428EHA CIUDAD AUTÓNOMA DE BUENOS AIRES. Argentina
Tel.: 54 11 4576 3342
E-mail: lht@qb.fcen.uba.ar
Referencias bibliográficas
1. Homocysteine Studies Collaboration. Homocysteine and risk of ischemic heart disease and stroke: a meta-analysis. JAMA 2002; 288: 2015-22.
2. Lentz SR. Mechanisms of homocysteine-induced atherothrombosis. J Thromb Haemost 2005; 3: 1646-54.
3. Lauricella AM, Quintana IL, Castañon MM, Sassetti B, Kordich LC. Influence of homocysteine on fibrin networks lysis. Blood Coagul Fibrinolysis. Artículo en prensa.
4. Finkelstein JD. Pathways and regulation of homocysteine metabolism in mammals. Semin Thromb Hemost 2000; 26 (3): 219-25.
5. Rozen R. Genetic modulation of homocysteinemia. Semin Thromb Hemost 2000; 26 (3): 255-61.
6. Engbersen AMT, Franken DG, Boers GHJ, Stevens EM, Trijbels FJ, Blom HJ. Thermolabile 5,10-methylenetetrahydrofolate reductase as a cause of mild hyperhomocysteinemia. Am J Hum Genet 1995; 56 (1): 142-50.
7. Schneede J, Refsum H, Ueland PM. Biological and environmental determinants of plasma homocysteine. Semin Thromb Hemost 2000; 26 (23): 263-79.
8. Ueland PM, Refsum H, Stabler S, Malinow MR, Andersson A, Allen RH. Total homocysteine in plasma or serum: Methods and clinical applications. Clin Chem 1993; 39: 1764-79.
9. Undas A, Brozek J, Szczeklik A. Homocysteine and thrombosis: from basic science to clinical evidence. Thromb Hemost 2005; 94: 907-15.
10. Selhub J, Jacques PF, Rosemberg IH, Rogers G, Bowman BA, Gunte EW, et al. Serum total homocysteine concentrations in the Third National Health and Nutrition Examination Survey (1991-1994): Population reference ranges and contribution of vitamin status to high serum concentration. Ann Intern Med 1999; 131: 331-9
11. Quintana I, Freeman D, Galarza C, Murúa A, Spence J, Kordich L. Validation of an enzyme immunoassay for the determination of total homocysteine in plasma. Blood Coagul Fibrinolysis 2000; 11: 235-8.
12. Frosst P, Blom H, Milos R, Goyette P, Sheppard CA, Matthews RG, et al. A candidate genetic risk factor for vascular disease: a common mutation in methylenetetrahydrofolate reductase. Nat Genet 1995; 10: 111-3.
13. Den Heijer M, Lewington S, Clarke R. Homocysteine, MTHFR and risk of venous thrombosis: a meta-analysis of published epidemiological studies. J Thromb Haemost 2005, 3: 292-9.
14. Genoud V, Castañon M, Annichino-Bizzacchi J, Korin J, Kordich L. Prevalence of three prothrombotic polymorphisms: Factor V G1691A, Factor II G20210A and Methylenetetrahydrofolate reductase (MTHFR) C677T in Argentina. Thromb Res 2000; 100: 127-31.
15. Klee G. Cobalamin and folate evaluation: measurement of methylmalonic acid and homocysteine vs. vitamin B12 and folate. Clin Chem 2000; 46 (8): 1277-83.
16. Janson JJ, Galarza CR, Murúa A, Quintana IL, Przygoda PA, Waisman G, et al. Prevalence of hyperhomocysteinemia in elderly population. Am J Hypertens 2002; 15: 394-7.
17. Refsum H, Smith AD, Ueland PM, Nexo E, Clarke R, McPartlin J, et al. Facts and recommendations about total homocysteine determinations: an expert opinion. Clin Chem 2004; 50: 3-32. [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ]
Aceptado para su publicación el 13 de junio de 2006














