Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. v.41 n.1 La Plata ene./mar. 2007
MICROBIOLOGÍA
Desarrollo y evaluación de una muestra para control de calidad en Microbiología
Development and assessment of a sample for quality control in Microbiology
Mariela Soledad Zárate1*, Jesica Dadamio2**, Susana Alí3**, Alberto Giordanelli4**, Jorgelina Smayevsky5*, Marta Torres6**
1. Bioquímica. Laboratorio de Bacteriología, Micología y Parasitología de CEMIC. Güemes 3066 1º Dpto. 4. CP 1425. Capital Federal.
2. Bioquímica. Programa Buenos Aires de Control de Calidad Externo en Análisis Clínicos. Instituto Universitario CEMIC
3. Técnica. Programa Buenos Aires de Control de Calidad Externo en Análisis Clínicos. Instituto Universitario CEMIC
4. Bioquímico Farmacéutico. Asesor en producción del Programa Buenos Aires de Control de Calidad Externo en Análisis Clínicos. Instituto Universitario CEMIC
5. Bioquímica. Especialista en Microbiología. Jefe del Laboratorio de Bacteriología, Micología y Parasitología de CEMIC.
6. Lic. en Química. Directora del Programa Buenos Aires de Control de Calidad Externo en Análisis Clínicos. Instituto Universitario CEMIC
* Laboratorio de Bacteriología, Micología y Parasitología
** Programa Buenos Aires de Control de Calidad Externo en Análisis Clínicos del Centro de Educación Médica e Investigaciones Clínicas "Norberto Quirno" (CEMIC). Instituto Universitario CEMIC, IUC. Galván 4102 (C1431FWO) - Buenos Aires. Argentina
Resumen
El laboratorio de microbiología clínica requiere, en cada una de las etapas del procesamiento de las muestras, un adecuado control de calidad. Debido a que no se encuentran disponibles localmente esquemas interlaboratorio que evalúen etapas iniciales del análisis microbiológico, el objetivo del trabajo fue desarrollar y evaluar mediante una "prueba piloto" la utilización de una muestra liofilizada como material de control de aislamiento e identificación de microorganismos. Para la elaboración de la muestra se utilizó un líquido de diálisis peritoneal inoculado con bacilos gram negativos (BGN) y cocos gram positivos (CGP) aislados de muestras clínicas. Las muestras se fraccionaron por 2 mL y se liofilizaron según el protocolo provisto por el ProgBA. Treinta y cuatro laboratorios recibieron un vial de la muestra y una planilla con las instrucciones para su manejo e informe del resultado. La tasa de respuesta fue del 44%. El porcentaje de aciertos en la evaluación microscópica fue 100% y 79% para BGN y CGP respectivamente. El 70% de los laboratorios recuperó e identificó correctamente ambos microorganismos, el 100% recuperó los BGN. Considerando un valor mayor del 80% de concordancia en la recuperación de microorganismos, los resultados obtenidos fueron aceptables para BGN. Este protocolo podría ser utilizado para la preparación de un esquema interlaboratorio a mayor escala.
Palabras clave: control de calidad * microbiología
Summary
The microbiology laboratory requires an appropriate quality control in each stage of the sample procedure. To date, interlaboratory studies that evaluate the initial stages of microbiologic analysis procedures have not been reported. The development of a lyophilized sample for isolation control and identification of microorganisms (mo) was performed with that purpose. For the sample's elaboration a peritoneal dialysis liquid was inoculated with gram negative bacilli (GNB) and gram positive cocci (GPC). The samples were divided into 2 mL vials and lyophilized according to the protocol provided by ProgBA. Thirty four laboratories received the sample with instructions for its handling and results report. The rate of response was of 44%. The percentage of success in microscopic evaluation was 100% and 79% for BGN and CGP respectively. Seventy per cent of the laboratories succeeded in isolating and identifying both microorganisms correctly; 100% of them identified the GNB. Considering an 80% of agreement in mo recovery a validity criterion, the results obtained were acceptable for GNB. This protocol could be used for the preparation of an interlaboratory quality control scheme on a greater scale.
Key words: control quality * microbiology
INTRODUCCIÓN
El laboratorio de microbiología clínica requiere para su correcto funcionamiento de un adecuado y constante control de calidad sobre todas las etapas del procesamiento de las muestras clínicas, desde la toma de la muestra hasta la elaboración del informe escrito.
El aseguramiento de calidad dentro del laboratorio de análisis clínicos tiene como finalidad identificar, monitorear, evaluar y aprobar metodologías relativas al cuidado del paciente. En este contexto el control de calidad en Microbiología comprende el monitoreo de los medios de cultivo, reactivos, instrumentos, procedimientos y el personal involucrado en la generación de información de utilidad clínica, con el objetivo de que ésta resulte confiable.
Un programa de aseguramiento de calidad debe incluir un Manual de Procedimientos para la validación de metodologías y equipos, el desarrollo de cursos de educación continua, elementos de bioseguridad, una supervisión sobre los reportes generados (1-3) y la participación en programas de evaluación externa de la calidad que permiten evaluar el desempeño de los laboratorios.
Dado que en el país solamente se dispone de esquemas de control de calidad externo que evalúan las pruebas de identificación y sensibilidad frente a los antimicrobianos, los servicios de Microbiología y el Programa de Aseguramiento Externo de la Calidad "Buenos Aires" (ProgBA) de CEMIC decidieron trabajar en conjunto con el objetivo de desarrollar una muestra que permita evaluar las etapas de aislamiento e identificación de microorganismos en muestras biológicas. Para llevar a cabo dicho objetivo se planificó:
1. Desarrollar, a partir de muestras biológicas, una muestra que pueda ser utilizada como control de calidad en las etapas de aislamiento e identificación de microorganismos.
2. Evaluar si el proceso de liofilización de la muestra no afecta la recuperación de los microorganismos y su correcta clasificación morfológica en la tinción de Gram.
3. Elaborar una planilla para el informe de los resultados que resulte apta para el propósito de recolectar datos para un Programa de Control Externo.
4. Realizar un relevamiento por medio de una "prueba piloto" de los medios de cultivo utilizados en la siembra de la muestra por los laboratorios participantes.
MATERIALES Y MÉTODOS
Para la elaboración de la muestra problema se utilizó un líquido de diálisis peritoneal proveniente de la Unidad de Diálisis Peritoneal de CEMIC. El material presentaba un recuento inicial de células inflamatorias del orden de 10.000 /mL (Cell-dyn 4000, Abbott - Illinois, USA) y 0,1 g/L de proteínas totales (Aeroset, Abbott -Illinois, EE.UU.)
Una alícuota de 100 mL fue inoculada con 2 UFC/mL de bacilos gram negativos (BGN) (Escherichia coli) y 6 UFC/mL de cocos gram positivos (CGP) (Streptococcus agalactiae) e incubada por un período de 18 horas a 35 ºC hasta alcanzar fase exponencial de crecimiento. El inóculo se ajustó hasta alcanzar una concentración equivalente a 0,5 en la escala de Mc Farland. (1 Mc Farland = 1,5 x 108 UFC/mL (Unidades formadoras de colonias/mL)).
La muestra fue fraccionada en viales de vidrio por 2 mL y liofilizada en un Liofilizador Génesis G12 (VIRTIS® - New York, EE.UU.), según el protocolo de liofilización del ProgBA (2).
El producto obtenido fue reconstituido con 2 mL de agua destilada estéril. Sobre él se realizó coloración de Gram y subcultivos en agar tripticasa sangre (AS), agar chocolate (ACH), medio CLDE y caldo cerebro corazón (BHI). Las muestras se incubaron bajo las condiciones de rutina del laboratorio.
Se observaron formas compatibles con BGN y CGP en la coloración de Gram y en todos los medios de cultivo se obtuvieron recuentos mayores de 105 (UFC/mL) de ambos microorganismos.
Al producto liofilizado se le realizaron pruebas de estabilidad bajo diversas condiciones de almacenamiento, incluido un simulacro de transporte en sobre cerrado. Se obtuvieron recuentos mayores de 105 UFC/mL y morfología compatible con cocos y bacilos en la coloración de Gram.
El protocolo de preparación fue aprobado internamente y para completar la evaluación de la muestra se realizó una encuesta por medio de correo electrónico a los 71 laboratorios integrantes del grupo ALAC (Asociación de Laboratorios de Alta Complejidad), invitándolos a participar en una prueba piloto de un control de calidad para el área de microbiología.
Aquellos laboratorios que aceptaron participar recibieron un vial de la muestra liofilizada y a través de correo electrónico, una planilla con las instrucciones para el manejo de la muestra e informe de los resultados (Fig. 1). El envío se realizó por correo siguiendo normas nacionales de transporte de material infeccioso (IRAM) (4-6).
Se consideró un valor mayor del 80% de concordancia en la recuperación de microorganismos como criterio de validez de la muestra. Los datos fueron procesados con el programa Statistix. El análisis estadístico de los datos se realizó con el test de chi2 (chi cuadrado) para datos binarios (7).
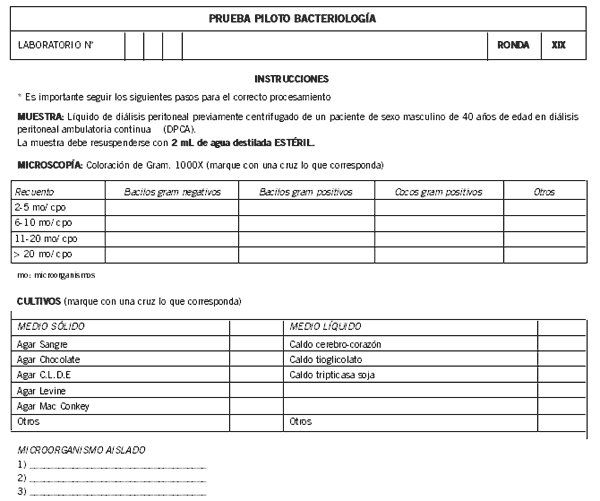
Figura 1. Planilla de informe.
RESULTADOS
La tasa de respuesta de las muestras enviadas a aquellos laboratorios que aceptaron participar (n=32), fue del 44% (n=14).
Los medios de cultivo utilizados por los participantes se muestran en las Figuras 2 y 3. La mayoría de los laboratorios utilizaron dos medios de cultivo sólido y uno líquido. Aquellos laboratorios que no utilizaron siembra en medios líquidos (5/14) en algunos casos (2/5), no obtuvieron recuperación de cocos positivos en cadena.
El porcentaje de aciertos en la evaluación microscópica por tinción de Gram se muestra en la Tabla I, observándose diferencia estadísticamente significativa (p < 0,01) respecto a la visualización de bacilos gram negativos y cocos gram positivos. El porcentaje de acierto en la identificación de microorganismos se muestra en la Tabla II.
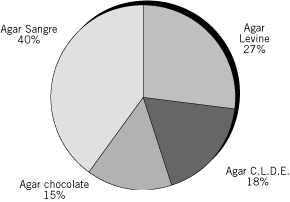
Figura 2. Distribución de medios sólidos utilizados por los participantes (%).
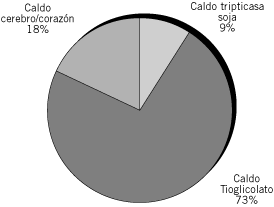
Figura 3. Distribución de medios líquidos utilizados por los participantes (%).
Tabla I. Porcentaje de aciertos en la evaluación microscópica.
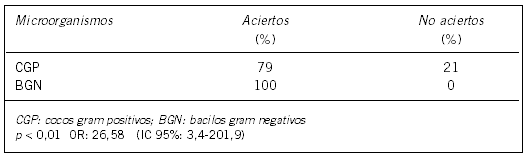
Tabla II. Porcentaje de aciertos en la identificación de los microorganismos.

DISCUSIÓN Y CONCLUSIONES
Dada la necesidad de los laboratorios de análisis clínicos de poseer un control de calidad en el área de microbiología que evalúe las etapas de aislamiento e identificación de microorganismos en muestras biológicas, se desarrolló un protocolo cuyo objetivo principal fue obtener una muestra que pudiera ser utilizada para tal fin.
El proceso de liofilización empleado no alteró la morfología y viabilidad de los microorganismos utilizados en la preparación de la muestra. La muestra liofilizada permitió la recuperación de microorganismos en los medios de cultivo habituales y una correcta clasificación morfológica en la tinción de Gram. La planilla de informe resultó adecuada para el propósito establecido. Los participantes no encontraron dificultad en su uso y la información recogida permitió la evaluación de los resultados. Los porcentajes de concordancia obtenidos ponen de manifiesto la importancia de una correcta observación de los extendidos y el empleo de medios de cultivo líquidos en la etapa inicial del procesamiento.
Debido al bajo número de respuestas recibidas, el relevamiento de los medios de cultivo primario utilizados en el paso de recuperación en esta prueba puede no ser representativo de la práctica habitual en los laboratorios de microbiología clínica.
El desarrollo de este protocolo de preparación permite la elaboración de muestras para ser utilizadas y distribuidas en un esquema de control de calidad interlaboratorio.
Este grupo de trabajo propone realizar ensayos a mayor escala para obtener conclusiones valederas respecto al desempeño de los laboratorios en relación con la recuperación de los distintos microorganismos en las muestras problema.
Agradecimientos
Los autores agradecen a la Srta. Patricia Jolly por la realización de los medios de cultivo, la Srta. Daiana Giretti por su colaboración en la realización de la planilla de informes y al Dr. Diego Cecchini por la lectura crítica del manuscrito.
Correspondencia
DRA. MARIELA S. ZáRATE
Laboratorio de Bacteriología,
Micología y Parasitología
de CEMIC
Güemes 3066, 1º P, Dpto. 4
1425 CIUDAD AUTÓNOMA DE BUENOS AIRES, Argentina
E-mail: sole_z@hotmail.com
Referencias bibliográficas
1. Eqalm.org [homepage on the Internet]. Europen Committee for External Quality Assurance Programs in Laboratory Medicine [updated 2006 Sept 7; cited 2006 Oct 2]. Available from. http://www.eqalm.org/
2. Torres M, Porta M, Dadamio J. Manual de Calidad ProgBa (IT 4.09.03.03 v4 - Preparación de muestras). Buenos Aires: CEMIC; 2006.
3. Blazevic DJ, Hall CT, Wilson ME. Procedimientos prácticos de Control de Calidad para Laboratorios de Microbiología Clínica. Buenos Aires: Britania; 1976.
4. Torres M, Porta M, Dadamio J. Manual de Calidad ProgBa (IT 4.09.03.04 v2 - Empaque y envío de muestras). Buenos Aires: CEMIC; 2006.
5. IATA.org [homepage on the Internet]. IATA: International Air Transport Association. Infectious Substances Shipping Guidelines. Effective 1 January 2006, The Complete Reference Guide for Pharmaceutical & Health Professionals [updated 2006 Sep 28; cited 2006 Oct 2]. Available from: http://www.iata.org/NR/rdonlyres/88834D9F-8EA2-42A0-8DA6-2BED8CD2E744/0/SAMPLEISSG7THED.pdf#search="Infectious Substances shipping guidelines, january 2006, iata%2.
6. Instituto Argentino de Normalización y Certificación. Norma IRAM 80058-1. Bioseguridad, Especímenes para diagnóstico y Transporte terrestre. Buenos Aires: IRAM; 2002.
7. Paz J. Manual de Bioestadística. Buenos Aires: CEMIC; 2002. [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ]
Aceptado para su publicación el 13 de octubre de 2006














