Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. v.41 n.1 La Plata ene./mar. 2007
TEMAS DE INTERÉS
Guía de consenso para el diagnóstico y seguimiento de la enfermedad tiroidea* - Parte III
Editores
Liliana M. Bergoglio. Bioquímica. Endocrinóloga.
Jorge H. Mestman. Médico. Endocrinólogo.
* Reproducido con permiso de la National Academy of Clinical Biochemistry, Washington, D.C.
ÍNDICE
Presentación de la edición en idioma español
Prefacio
Traducción de la edición en idioma inglés
Sección 1. Prólogo e Introducción
Sección 2. Factores pre-analíticos
Sección 3. Ensayos tiroideos para el bioquímico y el médico
A. Tiroxina Total (T4T) y Triyodotironina Total (T3T)
B. Tiroxina Libre (T4L) y Triyodotironina Libre (T3L)
C. Tirotrofina (TSH)
D. Anticuerpos Antitiroideos:
. Anticuerpos anti-Peroxidasa Tiroidea (TPOAb)
. Anticuerpos anti-Tiroglobulina (TgAb)
. Anticuerpos anti-Receptor de TSH (TRAb)
E. Tiroglobulina (Tg)
F. Calcitonina (CT) y Proto-oncogen RET
G. Yodo urinario
H. Punción Aspirativa con Aguja Fina (PAaF) y Citología Tiroidea
I. Screening de Hipotiroidismo Congénito
Sección 4. Importancia del contacto entre el Laboratorio y los Médicos
Apéndices y Glosario
Referencia
D. Autoanticuerpos antitiroideos (TPOAB, TGAB Y TRAB)
La enfermedad tiroidea autoinmune (AITD) causa daño celular y altera la función tiroidea por mecanismos humorales y celulares. Se produce daño celular cuando los linfocitos-T sensibilizados o los autoanticuerpos se fijan a las membranas celulares tiroideas provocando lisis celular y reacciones inflamatorias. Las alteraciones en la función tiroidea se producen por acción de los autoanticuerpos estimulantes o bloqueantes sobre los receptores de membrana de las células. Tres autoantígenos principales participan en la AITD: Tiroperoxidasa (TPO), Tiroglobulina (Tg) y Receptor de TSH. También se han descripto otros autoantígenos, como el co-transportador Na+/I-(NIS), pero todavía no tienen un rol diagnóstico en la enfermedad tiroidea autoinmune (248). Los anticuerpos anti-receptor de TSH (TRAb) son heterogéneos y pueden simular la acción de TSH y causar hipertiroidismo, como se observa en la enfermedad de Graves, o pueden antagonizar la acción de TSH y causar hipotiroidismo. Esta segunda posibilidad se produce en el neonato como resultado del pasaje trasplacentario de los anticuerpos de la madre con AITD. Los anticuerpos anti TPO (TPOAb) parecen participar en los procesos tisulares destructivos asociados con el hipotiroidismo que se observan en la tiroiditis de Hashimoto y en la tiroiditis atrófica. La aparición de TPOAb generalmente precede al desarrollo de disfunción tiroidea. Algunos estudios sugieren que los TPOAb pueden ser citotóxicos para la tiroides (249)(250). El rol patológico de los TgAb no está aún del todo claro. En áreas suficientes de yodo, los TgAb se determinan principalmente como ensayo adjunto a la determinación de Tg sérica, porque la presencia de estos anticuerpos puede interferir con los métodos de Tg [Sección-3 E6]. En áreas deficientes de yodo, las determinaciones de TgAb pueden resultar útiles para la detección de enfermedad tiroidea autoinmune en pacientes con bocio nodular y para el control del tratamiento con yodo en el bocio endémico.
Los métodos de laboratorio que determinan los procesos autoinmunes mediados por células no están disponibles por el momento. Sin embargo, en la mayoría de los laboratorios clínicos se dispone de ensayos para evaluar la respuesta humoral, por ejemplo los anticuerpos antitiroideos. Lamentablemente, el uso diagnóstico y pronóstico de las determinaciones de anticuerpos antitiroideos está afectado por los problemas técnicos que se discutirán. Si bien los ensayos de autoanticuerpos tienen utilidad clínica en una serie de patologías, se los debe emplear selectivamente.
1. Significado clínico de los autoanticuerpos antitiroideos
Los TPOAb y/o TgAb están presentes frecuentemente en el suero de pacientes con AITD (251). Sin embargo, a veces los pacientes con AIDT tienen anticuerpos negativos. Los TRAb están presentes en la mayoría de los pacientes con enfermedad de Graves pasada o presente. Durante el embarazo, la presencia de TRAb es un factor de riesgo de disfunción tiroidea fetal o neonatal a causa del pasaje trasplacentario de los mismos (252)(253). La prevalencia de autoanticuerpos tiroideos aumenta cuando los pacientes tienen enfermedades autoinmunes no tiroideas, como diabetes tipo 1 y anemia perniciosa (254). El envejecimiento también se asocia con la aparición de anticuerpos antitiroideos y con un aumento en la prevalencia de AITD (255). El significado de los valores bajos de anticuerpos antitiroideos en individuos clínicamente eutiroideos no se conoce (256). Sin embargo, estudios longitudinales sugieren que los TPOAb pueden ser un factor de riesgo de futura disfunción tiroidea incluyendo tiroiditis post parto (TPP) y complicaciones autoinmunes después del tratamiento con algunos agentes terapéuticos (50)(257)(258). Estos incluyen amiodarona para las cardiopatías, interferón-alfa para la hepatitis C crónica, y litio para los trastornos psiquiátricos (75)(259-262). Generalmente no se recomienda el uso de los anticuerpos antitiroideos para el control del tratamiento de la AIDT (263), ya que éste se dirige a la consecuencia (disfunción tiroidea) y no a la causa (autoinmunidad) de la enfermedad. Sin embargo, en las concentraciones de los autoanticuerpos reflejan con frecuencia una modificación en la actividad de la enfermedad.
2. Nomenclatura de los ensayos de anticuerpos antitiroideos
La nomenclatura utilizada para los autoanticuerpos antitiroideos ha sido muy variada, en particular en el caso de los anticuerpos anti-receptor de TSH (LATS, TSI, TBII, TSH-R y TRAb). Los términos incluidos en esta monografía, TgAb, TPOAb y TRAb son los recomendados internacionalmente. Estos términos corresponden a las entidades moleculares (inmunoglobulinas) que reaccionan con los autoantígenos específicos reconocidos por la prueba de laboratorio. Las diferencias entre métodos pueden sesgar la medición de estas entidades moleculares; por ejemplo: los métodos pueden detectar sólo IgG o IgG más IgM; TPOAb o anticuerpos dirigidos contra TPO y otros autoantígenos de membrana; TRAb inhibidores de la unión de TSH y/o estimulantes del receptor de TSH.
3. Especificidad de los ensayos de anticuerpos antitiroideos
Ciertos problemas específicos han obstaculizado el uso de los ensayos para anticuerpos antitiroideos. Los estudios muestran que los resultados varían ampliamente dependiendo del método utilizado. Esto se debe a diferencias tanto en la sensibilidad como en la especificidad, y a la ausencia de una estandarización adecuada. En los últimos años, los estudios a nivel molecular han demostrado que los autoanticuerpos reaccionan con sus autoantígenos blanco, uniéndose a dominios o epitopes "conformacionales". El término "conformacional" se refiere al requisito de una estructura tridimensional específica para cada epitope reconocido por los autoanticuerpos. En consecuencia, los resultados de los ensayos dependen fundamentalmente de la estructura molecular del antígeno utilizado en el mismo. Los pequeños cambios en la estructura de un determinado epitope pueden resultar en una disminución o pérdida de reconocimiento del autoantígeno por parte del anticuerpo dirigido hacia ese epitope. Últimamente, se ha demostrado la especificidad doble de los anticuerpos TGPO, que reconocen tanto Tg como TPO en el suero de pacientes con AITD (264).
Recomendación Nº 29. Diferencias de sensibilidad y especificidad entre métodos para determinación de anticuerpos antitiroideos
. Conocer que los resultados de los anticuerpos anti tiroideos son dependientes del método.
. Los anticuerpos antitiroideos presentes en suero son heterogéneos (reconocen diferentes epitopes antigénicos), y diferentes métodos reconocen diferentes poblaciones de anticuerpos.
. Las diferencias entre ensayos de anticuerpos antitiroideos reflejan diferentes preparaciones de receptores (ensayos de radiorreceptor) o de células (bioensayos) usadas en el ensayo.
. Las diferencias entre ensayos pueden ser el resultado de contaminación del reactivo que contiene el antígeno con otros autoantígenos.
. Las diferencias entre ensayos pueden provenir del diseño del ensayo (por ejemplo, inmunoensayo competitivo versus no-competitivo) así como de la señal utilizada.
. Las diferencias entre ensayos pueden ser el resultado del uso de diferentes estándares secundarios.
Se conoce desde hace mucho tiempo que los autoanticuerpos están dirigidos contra unos pocos epitopes en comparación con los anticuerpos heterólogos. Los métodos actuales presentan amplias diferencias en cuanto al reconocimiento de epitopes. Específicamente, que pueden provenir de un reconocimiento erróneo de un epitope que introduce un sesgo en la población de autoanticuerpos analizada. Esto genera intervalos de referencia muy diferentes, incluso cuando los métodos están estandarizados contra la misma preparación de referencia internacional. Cualquiera sea el autoantígeno, los anticuerpos antitiroideos claramente no son entidades moleculares únicas sino más bien mezclas de inmunoglobulinas que solamente tienen en común su capacidad de interactuar con Tg, TPO o el receptor de TSH.
Las diferencias en la sensibilidad de los métodos para autoanticuerpos pueden derivar del diseño del ensayo (por ejemplo RIA (competitivo) versus IMA de dos sitios (no competitivo), como del tipo de señal (por ejemplo radioisotópica versus quimioluminiscente). Las diferencias en especificidad pueden ocurrir como resultado de la contaminación de la preparación del autoantígeno con otros autoantígenos (por ejemplo, microsomas tiroideos versus TPO purificada). Además, el error en el reconocimiento de un epitope puede llevar a la subestimación de la cantidad total de autoanticuerpos circulantes presentes, y a una disminución en la sensibilidad.
Recomendación Nº 30. Sensibilidad funcional de los ensayos de anticuerpos antitiroideos
La sensibilidad funcional de los ensayos de autoanticuerpos antitiroideos debería:
. Determinarse con mezclas de suero humano que contengan una concentración baja de autoanticuerpos.
. Determinarse utilizando el mismo protocolo descripto para TSH (Recomendación Nº 20) pero analizando la precisión entre ensayos durante un lapso entre 6 a 12 meses que represente una adecuada frecuencia clínica de evaluación.
La sensibilidad funcional se debería determinar con mezclas de suero humano que contengan una concentración baja de autoanticuerpos. El protocolo para la sensibilidad funcional debería ser el mismo que se describió para TSH (Recomendación Nº 20). La precisión inter-ensayo de los ensayos de TgAb utilizados para el seguimiento de los pacientes con CDT y TgAb positivos se debería evaluar durante un lapso más prolongado (entre 6 y 12 meses) acorde con la frecuencia con que se los solicita para el control seriado en la práctica clínica.
4. Estandarización de los ensayos de anticuerpos antitiroideos
La estandarización de los ensayos de anticuerpos antitiroideos no ha alcanzado todavía un nivel óptimo. Se dispone de las Preparaciones Internacionales de Referencia MRC 65/93 para TgAb, y MRC 66/387 para TPOAb) del National Council for Biological Standards and Control en Londres, Reino Unido (www.mrc.ac.uk). Estos Estándares de Referencia se prepararon y se liofilizaron a partir de una mezcla de suero de pacientes con enfermedad tiroidea autoinmune ¡hace 40 años!
Recomendación Nº 31. Para la estandarización de los Ensayos de Anticuerpos Antitiroideos por los fabricantes.
. Los ensayos se deberían estandarizar contra las Preparaciones Internacionales de Referencia MRC.
. MRC 65/93 para TgAb, MRC 66/387 para TPOAb y MRC 90/672 para TRAb
. Se deberían elaborar nuevas Preparaciones Internacionales de Referencia para TgAb y TPOAb.
. Los estándares secundarios se deberían caracterizar completamente para evitar el desvío entre diferentes métodos.
. Cuando fuera posible se deberían utilizar preparaciones de referencia o preparaciones con antígeno recombinante.
Se sabe que los anticuerpos liofilizados tienden a degradarse con el tiempo. Esta degradación puede introducir un sesgo en la capacidad de unión de estas preparaciones de referencia hacia anticuerpos más estables, de importancia clínica desconocida. Debido a la escasez de estas preparaciones, sólo se las utiliza como estándares primarios para calibrar los métodos de ensayo. Los equipos comerciales contienen estándares secundarios que difieren para cada método. Con las calibraciones actuales, los ensayos varían según las condiciones experimentales y la preparación antigénica usada por el fabricante. Esto puede introducir un sesgo adicional en la detección de anticuerpos heterogéneos presentes en las muestras de pacientes. En el caso de los TRAb, la preparación de referencia MRC 90/672 es más reciente (1990) pero actualmente es usada por unos pocos fabricantes.
5. Determinaciones de TPOAb
La Peroxidasa tiroidea (TPO), de 110 kD es una hemoglucoproteína unida a membrana, con un gran dominio extracelular, un dominio transmembrana y un dominio intracelular corto. La TPO participa de la síntesis de hormonas tiroideas en el polo apical de la célula folicular. Se han descripto varias isoformas relacionadas con empalmes alternativos del mRNA de TPO. Las moléculas de TPO también pueden diferir en su estructura tridimensional, grado de glucosilación y unión a grupos hemo. La mayoría de las moléculas de TPO no alcanzan la membrana apical y son degradadas intracelularmente.
Los anticuerpos anti TPO se describieron inicialmente como autoanticuerpos anti-microsomales (AMA) ya que se encontró que reaccionaban con preparaciones crudas de membranas de células tiroideas. Más tarde, el antígeno microsomal se identificó como TPO (265). Los antiguos métodos inmunofluorescentes para AMA así como los métodos de aglutinación pasiva con glóbulos rojos tanados, o micropartículas de gel sensibilizadas, todavía se utilizan en la actualidad, además de los nuevos inmunoensayos de TPOAb, más sensibles, tanto competitivos como no competitivos. Estos nuevos inmunoensayos para TPOAb han venido reemplazando en gran medida a los antiguos métodos de aglutinación para AMA porque son cuantitativos, más sensibles y se los puede automatizar con facilidad. Sin embargo, su variabilidad en cuanto a sensibilidad y especificidad es muy amplia. Parte de esta variabilidad proviene de las diferencias en las preparaciones de TPO utilizadas en los diversos equipos de reactivos. Cuando se extrae la TPO de tejido tiroideo humano, se puede usar como preparación de membrana cruda o puede ser purificada por diferentes métodos. La especificidad de los ensayos también puede diferir debido a la contaminación con otros antígenos tiroideos, en especial Tg y/o por variaciones en la estructura tridimensional de la TPO. El uso de TPO humana recombinante (rhTPO), elimina el riesgo de contaminación pero no soluciona el problema de las diferencias en la estructura de la TPO que dependen de la técnica utilizada para aislarla. La mayoría de los ensayos actuales para TPOAb se cuantifican en unidades internacionales usando la preparación de referencia MRC 66/387. Lamentablemente, el uso de este estándar primario no disminuye las variaciones entre métodos, como resulta evidente al observar la amplia variabilidad en los límites de sensibilidad que declaran los diferentes fabricantes de reactivos (rango < 0,3 a < 20 kUI/L), como así también las diferencias en los intervalos de referencia.
Recomendación Nº 32: Metodología que se prefiere para TPOAb
. Los inmunoensayos de TPOAb sensibles y específicos, que utilizan como antígeno preparaciones adecuadas de TPO humana nativa o recombinante altamente purificada deberían reemplazar a los antiguos métodos de aglutinación, insensibles y semicuantitativos, para determinar anticuerpos anti-microsomales (AMA).
(Nivel de consenso 90%)
. El significado clínico de las concentraciones bajas de TPOAb requiere más estudio.
(a) Prevalencia e intervalos de referencia de los TPOAb
La estimación de la prevalencia de los TPOAb depende de la sensibilidad y especificidad del método utilizado. El reciente estudio NHANES III en EE.UU de ~17,000 individuos sin enfermedad tiroidea aparente, informó niveles detectables de TPOAb en el 12% de los individuos utilizando un inmunoensayo competitivo (18). Aún no está claro si los valores bajos de TPOAb detectados en individuos sanos o en pacientes con enfermedades autoinmunes no tiroideas reflejan la fisiología normal, preceden a la enfermedad tiroidea autoinmune o son un problema de especificidad del ensayo.
Los valores de referencia para los ensayos de TPOAb son altamente variables y a menudo se establecen arbitrariamente, de modo se obtengan resultados positivos en una amplia mayoría de pacientes con AITD y negativos en la mayoría de individuos sin evidencia clínica de AIDT. El límite inferior normal parece estar relacionado con factores técnicos. Específicamente, los ensayos que tienen un límite de detección bajo (< 10 kUI/L) informan valores no detectables de TPOAb en individuos normales estrictamente seleccionados. Estos métodos sugieren que la presencia de TPOAb es un hallazgo patológico. Por el contrario, los ensayos de TPOAb que reportan límites de detección más altos (> 10kUI/L) citan un "rango normal de referencia". Como estos últimos, no parecen tener una mayor sensibilidad para detectar AITD, estos valores del "rango normal" pueden representar "ruido" inespecífico del ensayo y es posible que no tengan significado patológico.
El estudio de seguimiento de la cohorte de Whickham realizado durante 20 años informó que la presencia de títulos detectables de TPOAb (medidos como AMA) no sólo era un factor de riesgo para hipotiroidismo sino que la detección de AMA precedía el desarrollo de un aumento en la TSH (Figura 5) (35). Esto sugiere que TPOAb detectables constituyen un factor de riesgo para AITD (Recomendación Nº 34). Sin embargo, individuos con niveles bajos de TPOAb hubieran tenido AMA no detectables con los métodos más antiguos utilizados en este estudio (35). De hecho, los individuos AMA negativos con valores de TSH > 2 mUI/L tuvieron un aumento en el riesgo a largo plazo de hipotiroidismo, lo que sugiere que niveles bajos de TPOAb pueden ser clínicamente significativos (35). En consecuencia, todavía sigue debatiéndose si los individuos con niveles bajos de TPOAb y/o TgAb debieran considerarse normales hasta que estudios de seguimiento a largo plazo de estos individuos demuestren que no tienen un riesgo incrementado de desarrollar disfunción tiroidea.
Recientes estudios sugieren que un número significativo de individuos con TSH entre 2,6 y 4,0 mUI/mL tienen un perfil hipoecoico al ultrasonido, sugestivo de infiltración linfocítica (Figura 5) (496)(497), por lo cual el examen morfológico de la tiroides por ultrasonido es actualmente el modo más sensible de determinar de manera temprana AIDT (496)(497). Sin embargo, el TPOAb es el marcador de riesgo de AIDT más fácilmente accesible, aunque la especificidad y sensibilidad de los inmunoensayos actuales sean aún subóptimas para detectar enfermedad temprana en individuos con hipoecogenicidad (497).
Recomendación Nº 33. Intervalos de Referencia para Ensayos de Anticuerpos Antitiroideos
Los intervalos de referencia para los ensayos de anticuerpos antitiroideos se deberían establecer a partir de 120 individuos "normales" sin antecedentes de enfermedad tiroidea: La selección de los individuos debería minimizar la inclusión de personas con predisposición a enfermedad tiroidea autoinmune. Los individuos normales deberían ser:
. Varones
. Jóvenes (< 30 años de edad)
. Tener niveles de TSH sérica entre 0,5 y 2,0 mUI/L
. Sin bocio
. Sin antecedentes personales ni familiares de enfermedad tiroidea
. Sin enfermedad autoinmune no tiroidea (por ejemplo: lupus o diabetes)
El criterio empleado para seleccionar sujetos para la cohorte normal utilizada para establecer el rango de referencia para autoanticuerpos es crítico. Dicha cohorte debería estar constituida por varones jóvenes, bioquímicamente eutiroideos (TSH 0,5 a 2,0 mUI/L) sin bocio ni antecedentes familiares de AITD. Este riguroso proceso de selección tendría mínimas probabilidades de incluir individuos con predisposición a enfermedad tiroidea autoinmune.
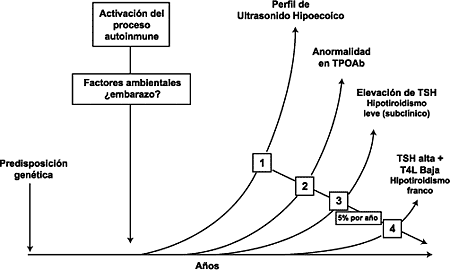
Figura 5. Etapas del desarrollo de la disfunción tiroidea autoinmune.
(b) Usos clínicos de las determinaciones de TPOAb
La determinación de TPOAb es el método más sensible para la detección de enfermedad tiroidea autoinmune (266). Como se muestra en la figura 5, los TPOAb habitualmente son la primera anomalía bioquímica que aparece en la evolución del desarrollo de hipotiroidismo secundario a la tiroiditis de Hashimoto. De hecho, cuando se determinan los TPOAb mediante un inmunoensayo sensible, más del 95% de los individuos con tiroiditis de Hashimoto tienen valores detectables de TPOAb. Estos métodos también detectan TPOAb en la mayoría de los pacientes con enfermedad de Graves (~85%) (254). Las pacientes con TPOAb detectados a comienzos del embarazo presentan riesgo de desarrollar tiroiditis post parto (50). Los pacientes con síndrome de Down tienen un mayor riesgo de desarrollar disfunción tiroidea debido a enfermedad tiroidea autoinmune y es importante que se sometan a una evaluación anual de TSH y TPOAb (267)(268).
Informes recientes sugieren que puede existir compromiso del coeficiente intelectual en niños nacidos de madres con TSH alta o TPOAb detectables durante el embarazo (63)(65). Este hallazgo ha llevado a la recomendación de que todas las embarazadas se realicen TSH y TPOAb en el primer trimestre. [Sección-2 A3 y Recomendación Nº 4]. Además, los TPOAb pueden jugar un rol en la infertilidad, ya que su presencia se ha asociado con el aumento de riesgo de aborto espontáneo y de la dificultad para concebir mediante fertilización (269).
Recomendación Nº 34. Usos Recomendados para las determinaciones de TPOAb
. Diagnóstico de Enfermedad Tiroidea Autoinmune
. Como Factor de riesgo de Enfermedad Tiroidea Autoinmune
. Como Factor de riesgo de hipotiroidismo durante el tratamiento con Interferón alfa, Interleuquina 2 o Litio
. Como Factor de riesgo de disfunción tiroidea durante el tratamiento con amiodarona (ver Recomendación Nº 5)
. Como Factor de riesgo de hipotiroidismo en pacientes con síndrome de Down
. Como Factor de riesgo de aborto espontáneo y fracaso de la fertilización in vitro
. Factor de riesgo de disfunción tiroidea durante el embarazo y de tiroiditis post parto
La presencia de TPOAb está sólidamente establecida como factor de riesgo para la disfunción tiroidea cuando los pacientes están en tratamiento con litio, amiodarona, interleuquina 2 o interferón alfa (75)(259)(260) (261)(270). Durante el tratamiento con interferón alfa, una enfermedad tiroidea autoinmune preexistente o TPOAb detectables, son factores predisponentes para el desarrollo de enfermedad tiroidea (262). No obstante, parece no haber aumento en la frecuencia de disfunción tiroidea en el tratamiento con interferón beta (271). La presencia de TPOAb previa al tratamiento presenta una sensibilidad del 20%, una especificidad del 95% y un valor predictivo positivo del 66,6% para el desarrollo de disfunción tiroidea (272).
6. Determinaciones de anticuerpos anti tiroglobulina (TgAb)
La tiroglobulina (Tg), globulina protiroidea, es una glucoproteína soluble de alto peso molecular (660 kDA) constituida por dos subunidades idénticas. Está presente con un alto grado de heterogeneidad debido a diferencias en las modificaciones post-translacionales (glucosilación, yodinación, sulfatación, etc.). Durante el proceso de síntesis y liberación de la hormona tiroidea, se produce polimerización y degradación de la Tg. En consecuencia, la estructura inmunológica de la Tg es extremadamente compleja. Las características de las preparaciones de Tg pueden variar ampliamente en función del tejido tiroideo humano inicial y del proceso de purificación utilizado. Esta es la primera clave para explicar el motivo por el cual los ensayos de TgAb, al igual que los de Tg [Sección-3 E2] sean tan difíciles de estandarizar.
(a) Metodología para TgAb
Al igual que con los métodos de TPOAb, el diseño de los ensayos de TgAb ha evolucionado desde los ensayos por inmunofluorescencia de secciones de tejido tiroideo, a los métodos de aglutinación pasiva de eritrocitos tanados, y en la actualidad a los inmunoensayos competitivos y no competitivos. Esta evolución técnica ha mejorado tanto la sensibilidad como la especificidad de las determinaciones de TgAb. No obstante, debido a que los métodos más antiguos y los más nuevos todavía se utilizan simultáneamente en los laboratorios clínicos, la sensibilidad y especificidad de los métodos disponibles puede variar considerablemente en función del laboratorio en donde se realicen. Los ensayos están calibrados contra preparaciones purificadas o crudas de TgAb que se obtienen de una mezcla de sueros de pacientes o de preparaciones de inmunoglobulinas de donantes de sangre. Esta diversidad de estándares secundarios a menudo, pero no siempre, se calibra contra el estándar primario (MRC 65/93). Sin embargo, la estandarización con MRC 65/93 no garantiza que los diferentes métodos guarden similitud cuantitativa ni cualitativa. Otras razones para las diferencias entre los métodos pueden estar relacionadas con la heterogeneidad de los TgAb en sí mismos. Esta heterogeneidad es restringida en pacientes con AITD comparada con otras enfermedades tiroideas como el carcinoma diferenciado (CDT) en que aparece como menos restringida (273). Este hecho refleja diferencias en la expresión de los diferentes autoanticuerpos que normalmente pueden estar presentes en niveles muy bajos en individuos sanos (274). La variabilidad inter-método en los TgAb también puede reflejar diferencias cualitativas en la afinidad y en la especificidad de epitopes de estos anticuerpos en suero de pacientes con diferentes patologías tiroideas e inmunológicas subyacentes. Otra razón para las diferencias inter-métodos es que algunos diseños de ensayos son susceptibles a interferencias por altos niveles de antígeno circulante (Tg), como ocurre generalmente en la enfermedad de Graves y en el CDT metastático (275).
Recomendación Nº 35. Para los Fabricantes que desarrollan Métodos para TgAb
. La especificidad de epitopes de los métodos para TgAb debería ser amplia y no restringida, ya que puede ser más amplia para los pacientes con TgAb positivos con CDT en comparación con los pacientes con enfermedad tiroidea autoinmune.
(b) Prevalencia e intervalos de referencia de los TgAb
Al igual que con los anticuerpos anti TPO, la prevalencia y los valores de corte para la normalidad de los anticuerpos anti tiroglobulina depende de la sensibilidad y especificidad del método de ensayo (276). El estudio NHANES III mostró una prevalencia de TgAb del ~10% para la población en general, determinada con un inmunoensayo competitivo (18). La prevalencia de los TgAb en pacientes con CDT parece ser dos veces mayor que para la población normal (~20 versus 10%, respectivamente) (276). Al igual que con los TPOAb, aún no se ha esclarecido la importancia clínica de los niveles bajos de TgAb, que no serían detectables mediante los antiguos métodos de aglutinación. Se ha sugerido que los niveles bajos pueden representar anticuerpos "naturales" en individuos normales o una respuesta de anticuerpos "rescatadores" frente a la liberación de antígeno posterior a una cirugía tiroidea o al tratamiento con yodo radioactivo. Otra alternativa, es que los niveles bajos representen AIDT silenciosa subyacente (256). Diferentes métodos de TgAb informan diferentes líneas de corte de positividad, igual que para TPOAb [Sección 3D5(a)].
Específicamente, algunos métodos informan que individuos normales deberían tener valores por debajo del límite de detección del ensayo, mientras que otros informan un "rango normal". Cuando se usan las determinaciones de TgAb junto con la Tg sérica, la importancia de los valores bajos de TgAb se relaciona menos con la fisiopatología que con el potencial de interferir con el método de Tg sérica.
Recomendación Nº 36. Determinación de TgAb en patologías no-neoplásicas
. En áreas suficientes en yodo, en general no es necesario ni costo-efectivo solicitar ambas determinaciones, TPOAb y TgAb, porque los pacientes con TPOAb negativos y TgAb detectables rara vez presentan disfunción tiroidea.
. En las áreas con deficiencia de yodo, las determinaciones de TgAb séricos pueden ser útiles para la detección de enfermedad tiroidea autoinmune cuando los pacientes tienen bocio nodular.
. Para control del tratamiento con yodo en casos de bocio endémico.
(c) Sensibilidad y precisión de las determinaciones de TgAb
Las determinaciones cuantitativas de TgAb por un método sensible constituyen un ensayo complementario esencial para la determinación de Tg sérica. Los métodos cualitativos de aglutinación no son lo suficientemente sensibles para detectar concentraciones bajas de TgAb que pueden interferir con las mediciones de Tg sérica (276). Al igual que con los ensayos de TPOAb [Sección-3 D5(a)], la amplia variabilidad en los valores absolutos informados por los diferentes inmunoensayos de TgAb excluye el uso de ensayos realizados con equipos de diferentes fabricantes para el control seriado de pacientes con CDT. Existen dos clases de inmunoensayos para la determinación de TgAb. Una clase se caracteriza por sus bajos límites de detección (< 10 kUI/L) y un valor normal de referencia no detectable. Estos métodos sugieren que la presencia de TgAb es un hallazgo patológico. La otra clase de ensayos reporta límites de detección más elevados (> 10kUI/L) y citan un "rango normal de referencia" para los TgAb. Estos valores detectables del "rango normal" probablemente representen "ruido" no específico del ensayo provocado por la insensibilidad del mismo o por problemas de especificidad ya que estos valores bajos del "rango normal" no muestran evidencia de interferencia con las determinaciones de Tg sérica [Sección-3 E6].
Recomendación Nº 37. Determinación de TgAb en el Carcinoma diferenciado de tiroides (CDT)
La concentración de TgAb debería determinarse en los sueros de TODOS los pacientes antes del análisis de Tg ya que los niveles bajos de TgAb pueden interferir con las determinaciones de Tg sérica produciendo valores ya sea falsamente bajos o no detectables, o falsamente elevados según el método utilizado.
. Los TgAb se deberían medir en cada muestra sérica enviada al laboratorio para evaluación de Tg.
. Las determinaciones seriadas de TgAb se deberían realizar en todos los pacientes con resultados positivos de TgAb con CDT utilizando un método del mismo fabricante, porque los valores seriados de TgAb tienen significado pronóstico para el control de la respuesta al tratamiento del CDT.
. Se deberían utilizar inmunoensayos y no métodos de aglutinación para determinar TgAb ya que los niveles bajos de TgAb no detectados por aglutinación pueden interferir con las determinaciones de Tg realizadas por la mayoría de los métodos, y las determinaciones seriadas deben ser cuantitativas y no cualitativas.
. Los ensayos de recuperación de Tg sérica no detectan en forma confiable la presencia de TgAb y no se debería recomendar su uso. (Recomendación Nº 46).
. Antes de cambiar el método de determinación de TgAb, el laboratorio debería informar al médico solicitante, y los pacientes deberían volver a tener establecidos sus niveles basales con el método nuevo. Valores absolutos obtenidos con diferentes métodos no pueden ser usados para el control seriado de pacientes con CDT y TgAb positivos.
(d) Usos clínicos de las determinaciones de TgAb
Todavía se debate sobre la utilidad clínica de las determinaciones de TgAb para evaluar la presencia de autoinmunidad tiroidea. El estudio NHANES III en EE.UU. informó que el 3% de los individuos sin factores de riesgo de enfermedad tiroidea tenían TgAb detectables sin presencia asociada de TPOAb (18). Debido a que esta cohorte no presentaba un aumento asociado de TSH, las determinaciones de TgAb no parecieran ser ensayos diagnósticos útiles para AITD en áreas suficientes en yodo (256)(279). En áreas con deficiencia de yodo, sin embargo, se cree que la determinación de TgAb es útil para detectar AITD, en especial para pacientes con bocio nodular. Las determinaciones de TgAb también son útiles para el control del tratamiento con yodo para el bocio endémico, ya que las moléculas yodadas de Tg son más inmunogénicas.
Los ensayos de TgAb se solicitan fundamentalmente junto con las determinaciones de Tg sérica. La utilidad clínica de los TgAb en los pacientes con CDT es doble. En primer lugar, la búsqueda de TgAb, por métodos sensibles y específicos en estos pacientes con cáncer es necesaria porque incluso bajas concentraciones de anticuerpos pueden interferir con las mediciones de Tg realizadas por la mayoría de los métodos [ver Sección-3 E6] (275)(276). En segundo lugar, las determinaciones de TgAb en sí pueden servir como marcadores tumorales sustitutos para los pacientes TgAb positivos en los que no se pueda confiar en la determinación de Tg (276). Específicamente, los pacientes TgAb positivos considerados libres de enfermedad típicamente se convierten en TgAb negativos entre 1 y 4 años (276- 278). Por el contrario, los pacientes con enfermedad persistente después del tratamiento mantienen concentraciones detectables de TgAb. De hecho, un aumento en la concentración de TgAb es a menudo el primer indicio de recidiva en esos pacientes (276).
7. Autoanticuerpos anti-receptor de TSH (TRAb)
El receptor de TSH integra la superfamilia de receptores con siete dominios transmembrana unidos a las proteínas G. El gen del receptor de TSH (peso molecular 60 kb) ubicado en el brazo largo del cromosoma 14q31 ha sido clonado y secuenciado (272). Los exones 1 a 9 codifican para el dominio extracelular del receptor (397 aminoácidos) y el exón 10 codifica para la región transmembrana (206 aminoácidos). La activación de las proteínas G por el complejo hormona receptor resulta en la estimulación de la producción de AMPc por la adenilato ciclasa y en el recambio de fosfato de inositol por las fosfolipasas (280). La mutagénesis sitio-dirigida ha demostrado que la estructura tridimensional del receptor es importante para la interacción con la TSH y/o los TRAb. Existen tres tipos generales de TRAb determinados por bioensayos o ensayos de radiorreceptor (Tabla VI). Los ensayos de radiorreceptor, o ensayos de inmunoglubulinas inhibidoras de la unión de TSH (TBII) no miden actividad biológica directamente sino que determinan si la muestra contiene inmunoglobulinas que puedan bloquear la unión de TSH a una preparación in vitro del receptor. Los anticuerpos estimulantes de TSH (TSAb) parecen fijarse a la porción N terminal del dominio extracelular y mimetizar las acciones de TSH induciendo la transducción de la señal post receptor y la estimulación celular. En contraste, la región C terminal es más importante para los anticuerpos bloqueantes del receptor de TSH (TBAb o TSBAb) que impiden la estimulación por TSAb o TSH, provocando hipotiroidismo (281). Con respecto a esto, las inmunoglubinas estimulantes del crecimiento tiroideo (TGI), están menos caracterizadas.
Se ha demostrado que la falta de correlación entre las concentraciones de TRAb y el estado clínico de los pacientes se debe principalmente a la heterogeneidad de los TRAb circulantes. El hecho de que esta heterogeneidad pueda coexistir dentro de un mismo paciente y cambiar con el tiempo, es una de las razones por las que ha sido difícil desarrollar métodos diagnósticos eficientes para los TRAb (282)(283). De hecho, el cuadro clínico de los pacientes con enfermedad de Graves que presentan tanto TSAb como TBAb/TSBAb depende de la concentración relativa y de la afinidad del anticuerpo predominante. El pasaje de TRAb estimulantes a TRAb bloqueantes podría explicar la remisión espontánea de la enfermedad de Graves durante el embarazo al igual que la inducción de hipotiroidismo transitorio por yodo radiactivo (281)(284). Es importante observar que los bioensayos que utilizan preparaciones celulares para medir los efectos biológicos de los TRAb (estimulación o inhibición de la actividad de TSH o del crecimiento celular) pueden detectar cambios funcionales en la heterogeneidad de los TRAb. Por el contrario, el ensayo de radiorreceptor, o el de inmunoglobulinas inhibidoras de la unión de TSH (TBII), utilizados por la mayoría de los laboratorios clínicos, simplemente miden la capacidad del suero o de una preparación de IgG de bloquear la unión de TSH al receptor, y no miden la respuesta biológica (Tabla VI). Esta diferencia fundamental en el diseño del ensayo explica por qué los bioensayos y los ensayos de radiorreceptor normalmente presentan una correlación débil (r = 0,31-0,65) (283)(285).
Tabla VI. Métodos para Anticuerpos del Receptor de TSH (TRAb).

(a) Metodología para TRAb
En 1956 se publicó el primer trabajo referente a la existencia de un estimulador tiroideo diferente de la TSH cuya vida media era más larga (Estimulante tiroideo de acción prolongada o LATS), utilizando un bioensayo in vivo (286). El LATS se identificó más tarde como una inmunoglobulina. Al igual que la TSH, los TRAb estimulan tanto el AMPc como las vías del fosfato de inositol de la célula folicular tiroidea y, en consecuencia, estimulan y bloquean la síntesis de la hormona tiroidea y el crecimiento de la glándula (283). Los tipos de métodos desarrollados para determinar TRAb se clasifican en relación con su actividad funcional, según se muestra en la Tabla VI. Los estudios en ratones y líneas celulares FRTL-5 al igual que en humanos, muestran que una elevada concentración de gonadotrofina coriónica humana (hCG) también es un agonista débil de los TRAb y puede estimular el cAMP, el transporte de yodo y el crecimiento celular (56). Las elevaciones marcadas de hCG secundarias a coriocarcinoma pueden en casos raros causar un falso resultado positivo de TRAb. Sin embargo, el aumento de la hCG habitualmente observado en el embarazo normal o en pacientes con mola hidatiforme tratados no es lo suficientemente alto como para provocar un falso resultado positivo.
(b) Bioensayos (TSAb, TBAb/TSBAb y TGI)
La mayoría de los ensayos actuales se basan en la activación por el receptor de TSH de la producción del segundo mensajero (AMPc) a partir de una línea celular (FRTL-5/ CHO TSH-R) expuesta a una muestra de suero que contiene los anticuerpos o a una preparación de IgG (287-289). El reciente clonado del receptor de TSH ha beneficiado los bioensayos facilitando el desarrollo de líneas celulares transfectadas del receptor de TSH (290)(291). Aunque estos bioensayos están disponibles en muchos laboratorios comerciales en los Estados Unidos y Asia, están menos disponibles en Europa por las regulaciones que afectan el uso de organismos genéticamente alterados, y no lo están aún en Latinoamérica. Lamentablemente, la correlación entre los resultados de los TRAb y el cuadro clínico es aún deficiente. Por ejemplo, la sensibilidad diagnóstica de los bioensayos para TRAbs en la enfermedad de Graves presenta un rango entre 62,5 y 81% (283). Es posible que los nuevos métodos que emplean moléculas quiméricas puedan detectar los locus de los epitopes de los TRAb y los sitios de unión de la TSH, y en consecuencia mejorar la correlación entre la respuesta del ensayo y el resultado clínico (281)(284) (292-294).
(c) Ensayos de radiorreceptor (TBII)
Los ensayos de inmunoglobulinas inhibidoras de la unión de TSH al receptor (TBII) se encuentran comercialmente disponibles y se los utiliza en muchos laboratorios. Estos métodos cuantifican la inhibición de la unión de TSH marcada con 125I a receptores porcinos solubilizados o, más recientemente, a receptores de TSH humana recombinante (295-297). Este tipo de método no distingue entre TRAb estimulantes y bloqueantes. La actividad de TBII es cuantificada a partir de un suero TRAb positivo calibrado contra un estándar de referencia sérico. El calibrador más frecuentemente utilizado ha sido el suero de referencia MRC, LATS-B. También se dispone del estándar de la OMS (MRC 90/672). La heterogeneidad de los TRAb en el suero de pacientes y el origen del receptor utilizado (porcino versus humano recombinante) son causas probables de la amplia variabilidad observada entre los métodos de TBII, a pesar del uso del mismo estándar (283)(298). Aunque en la actualidad los métodos TBII basados en el receptor de la TSH humana recombinante pueden tener una mayor sensibilidad diagnóstica para la enfermedad de Graves, no parecen ofrecer mayor especificidad ni sensibilidad para predecir la respuesta al tratamiento con medicamentos antitiroideos (297)(299).
Recomendación Nº 38. Ensayos para anticuerpos antirreceptor de TSH (TRAb)
Ensayos de TRAbs en el laboratorio clínico:
- Ensayos de Radiorreceptor o de Inhibición de la unión de TSH (TBII) que no miden actividad estimulante directamente sino que detectan inmunoglobulinas en el suero que bloquean la unión de TSH marcada a una preparación in vitro del receptor de TSH. Estos ensayos son los que se utilizan con mayor frecuencia para determinar TRAb en los laboratorios clínicos.
- Bioensayos del receptor de TSH (TSAb) que utilizan células (células FRTL-5, o más recientemente CHO transfectadas con el receptor de TSH humana) para la detección de inmunoglobulinas estimulantes de tiroides (TSAb) que estimulan la producción de cAMP o la captación de yodo. Estos ensayos no están disponibles de manera rutinaria en todos los países.
- En general, la correlación entre los resultados de los TSAb y los TBII (60-75%) es pobre. Los ensayos TSAb declaran dar resultados positivos entre el 80 y el 100% de los pacientes hipertiroideos por Graves no tratados, mientras los ensayos TBII lo son entre el 70 y el 90%. Ninguno de los dos ensayos tiene una alta especificidad ni sensibilidad para predecir remisión.
- Se sabe que tanto la producción normal de hCG, como la producción anormal en el coriocarcinoma interactúan con el receptor de TSH lo que podría resultar en falsos valores positivos. Esto se podría observar en casos poco frecuentes de coriocarcinoma pero no en embarazos normales o en la mola hidatiforme tratada, en la que el nivel de hCG no es lo suficientemente alto para causar un falso resultado positivo.
(d) Intervalos de referencia de los TRAb
A pesar de la adopción de una nueva preparación internacional de referencia MRC 90/672, los valores de TRAb todavía dependen del método, y los intervalos de referencia dependen de la población "normal" seleccionada para determinar el nivel de corte para un resultado positivo. Este corte se define en general como dos desviaciones estándar por encima de la media de los individuos normales.
8. Usos clínicos de las determinaciones de TRAb
El uso clínico de las determinaciones de TRAb para el diagnóstico y seguimiento de la enfermedad tiroidea autoinmune sigue siendo controvertido y difiere mucho de un país a otro. El diagnóstico diferencial de hipertiroidismo se puede resolver en la mayoría de los pacientes sin recurrir a los TRAb. De todos modos, la presencia de TRAb puede establecer una diferencia entre la enfermedad de Graves y la tirotoxicosis ficticia y otras manifestaciones de hipertiroidismo como la tiroiditis subaguda o post parto y el bocio nodular tóxico.
También se ha sugerido que las determinaciones de TRAb son útiles para predecir la evolución de la enfermedad de Graves. A menudo se observa una disminución en el nivel de TRAb en pacientes hipertiroideos en remisión clínica luego del tratamiento con fármacos antitiroideos (ATD). Después de la suspensión de los mismos el aumento de TRAb correlaciona bastante bien con la recidiva rápida, pero esta situación involucra a muy pocos pacientes. Por el contrario, un número significativo de pacientes con niveles no detectables o bajos de TRAb va a recidivar. Un metanálisis de la relación entre los niveles de TRAb y el riesgo de recidiva ha demostrado que un 25% de pacientes son mal categorizados a partir de los ensayos de TRAb (263). Esto sugiere que después del tratamiento con ATD, se necesita un seguimiento de los pacientes independientemente del valor de los TRAb al momento de la suspensión del fármaco, y para este propósito la determinación de TRAb no resulta costo-efectiva (263).
Hay acuerdo general en que las determinaciones de TRAb pueden ser usadas para predecir disfunción fetal y/o neonatal en embarazadas con antecedentes de AITD (8)(252). Valores altos de TRAb en la madre durante el tercer trimestre de embarazo sugieren riesgo de disfunción tiroidea en el bebé (8)(282). Entre el 2 y el 10% de embarazadas con TRAb muy elevados dan a luz recién nacidos con hipertiroidismo (8). El riesgo de hipertiroidismo neonatal es insignificante luego del tratamiento satisfactorio con antitiroideos, pero puede desarrollarse después del tratamiento con radioyodo si los niveles de TRAb permanecen elevados (8) Las embarazadas eutiroideas (con o sin tratamiento con L-T4) que han recibido tratamiento previo con yodo radioactivo para la enfermedad de Graves deberían realizarse determinaciones de TRAb a comienzos del embarazo, cuando un valor alto es un factor de riesgo significativo para el hipertiroidismo fetal, y también durante el tercer trimestre para evaluar el riesgo de hipertiroidismo neonatal (8). Las embarazadas que reciben ATD para la enfermedad de Graves, deberían realizarse determinación de TRAb en el tercer trimestre. Valores altos TRAb en estas pacientes deberían instar a una evaluación clínica y bioquímica exhaustiva de hipertiroidismo en el neonato, al momento del nacimiento (sangre del cordón) y entre los 4 y 7 días, después que los efectos del pasaje transplacentario de los ATD hayan desaparecido (300). Cabe destacar que los ensayos de radiorreceptor TBII frecuentemente se usan con este propósito, ya que detectan tanto anticuerpos estimulantes (TSAb), como en casos poco frecuentes, anticuerpos bloqueantes (TBAb/TSBAb) que provocan hipotiroidismo transitorio en 1:180.000 recién nacidos (301). También se sugiere realizar la determinación de ambos anticuerpos estimulantes y bloqueantes porque la expresión de disfunción tiroidea puede ser diferente en la madre y en el infante (253).
Recomendación 39. Usos clínicos de las determinaciones de TRAb
- Para investigar la etiología del hipertiroidismo cuando el diagnóstico no es clínicamente evidente.
- La disminución en la concentración de TRAb durante el tratamiento con drogas antitiroideas a largo plazo sugiere remisión. No obstante, las determinaciones de TRAb pueden dar resultados confusos en el 25% de estos pacientes.
- Las determinaciones de TRAb son útiles para diagnosticar enfermedad de Graves y para relacionar los valores de TRAb con un algoritmo de tratamiento.
- Para evaluar pacientes con sospecha de "oftalmopatía eutiroidea de Graves". No obstante, no se debe descartar la patología en caso de TRAb no detectables.
- Aunque los ensayos de TSAb presentan ventajas teóricas, algunos sostienen que los TBII que detectan tanto anticuerpos estimulantes (TSAb) como los casos poco frecuentes de anticuerpos bloqueantes (TBAb/TSBAb), son igualmente útiles.
- Para mujeres embarazadas con antecedentes o enfermedad de Graves actual. Nota: Las embarazadas eutiroideas después de la administración de drogas antitiroideas (ATD) para la enfermedad de Graves tienen un riesgo insignificante de hipertiroidismo fetal o neonatal.
- Los TRAb en las embarazadas eutiroideas (con o sin tratamiento con L-T4) que han recibido tratamiento previo con yodo radioactivo para la enfermedad de Graves se deberían determinar a comienzos del embarazo, cuando un aumento en el valor es un factor de riesgo para el hipertiroidismo fetal (2-10%) y durante el tercer trimestre para evaluar riesgo de hipertiroidismo neonatal.
- Se debería realizar una determinación de TRAb en el tercer trimestre a las embarazadas que son tratadas con ATD por enfermedad de Graves para mantener el estado eutiroideo durante el embarazo. Un valor alto de TBII debería instar a una evaluación clínica y bioquímica de hipertiroidismo en el neonato, tanto al nacimiento (sangre del cordón) como entre los 4 y 7 días, después de que los efectos del pasaje transplacentario de los ATD hayan desaparecido.
- La evaluación del riesgo de disfunción tiroidea fetal o neonatal requiere la detección de TRAb bloqueantes o estimulantes cuando las madres no tienen la tiroides intacta luego de un tratamiento previo para el hipertiroidismo de Graves.
- Para identificar neonatos con hipotiroidismo transitorio debido a anticuerpos bloqueantes del receptor de TSH.
Recomendación Nº 40. Mejoras necesarias en los ensayos de anticuerpos antitiroideos
- Los ensayos de anticuerpos antitiroideos actuales deberían someterse a estudios comparativos de sus comportamientos analíticos y clínicos.
- Un estudio comparativo de las preparaciones antigénicas que se usan en la actualidad, facilitaría la identificación de el o los métodos para anticuerpos antitiroideos más convenientes para su utilización clínica.
- Se deberían establecer las características de las preparaciones antigénicas utilizadas en el ensayo para todos los métodos de autoanticuerpos tiroideos.
- Debería poder disponerse de las preparaciones de referencia de antígenos.
Todavía se desconoce el papel de los TRAb en la oftalmopatía asociada a tiroides (TAO) (302). Esta patología parece ser exacerbada por el tratamiento con yodo radioactivo (303). Además, los niveles de TRAb y de otros anticuerpos antitiroideos aumentan significativamente después de este tipo de tratamiento (304-306). Esto sugiere que las determinaciones de TRAb previas al tratamiento con radioyodo podrían ser útiles para predecir el riesgo de TAO aunque aún ningún estudio prospectivo ha documentado esta observación.
9. Tendencias futuras
Es importante realizar un estudio comparativo bien estructurado de los ensayos de autoanticuerpos tiroideos comercialmente disponibles. Esto aportaría evidencia irrefutable de que existen diferencias en el desempeño de los métodos de ensayos actuales (296). Además ayudaría a persuadir a los profesionales de los laboratorios clínicos para que eviten el uso de ensayos con deficiencias en el comportamiento clínico, e instaría a los fabricantes a mejorar sus productos o a retirarlos del mercado.
Recomendación Nº 41. Para los fabricantes que desarrollan ensayos de anticuerpos antitiroideos
- Los métodos absolutos o "estándares de referencia" son un objetivo para el futuro.
- El folleto dentro de la caja del equipo de reactivos debería documentar el método utilizado para obtener el antígeno, el diseño del ensayo, y todas las condiciones experimentales que afecten las interacciones antígeno-anticuerpo.
- La especificidad de los estándares secundarios debería seleccionarse de acuerdo a las interacciones entre los autoanticuerpos en el suero del paciente y su antígeno específico.
- Se debería controlar los efectos "gancho" de los TPOAb y de los TgAb IMA utilizando ~20 muestras con concentraciones de anticuerpos > 1.000 kUI/L y ~20 muestras con valores superiores a 10.000 kUI/L.
- Se deberían controlar los efectos de altas concentraciones de antígeno (Tg) en los métodos de TgAb agregando a varios sueros con concentraciones bajas de TgAb, otros con niveles de Tg >10.000 µg/L (ng/mL) y >100.000 µg/L (ng/mL).
E. Tiroglobulina (Tg)
La tiroglobulina (Tg), proteína precursora de la síntesis de las hormonas tiroideas se puede detectar en el suero de la mayoría de los individuos normales si se utiliza un método sensible. El nivel de Tg sérica está influido por tres factores principales: (i) la masa de tejido tiroideo diferenciado presente; (ii) cualquier inflamación o lesión de la glándula tiroides que provoque liberación de Tg; y (iii) el grado de estimulación del receptor de TSH (por TSH, hCG o TRAb). Una concentración elevada de Tg sérica es un indicador no específico de disfunción tiroidea. La mayoría de los pacientes con Tg sérica elevada presentan alteraciones tiroideas benignas. La Tg sérica se utiliza como marcador tumoral en los pacientes con diagnóstico de cáncer diferenciado de tiroides (CDT). Aproximadamente dos tercios de estos pacientes presentan un nivel pre-quirúrgico elevado de Tg sérica que confirma la capacidad del tumor de secretar Tg y valida su uso como marcador tumoral post-quirúrgico (307). Por el contrario, cuando la concentración pre-quirúrgica de Tg sérica no supera los valores normales, no existe evidencia de que el tumor secrete Tg, y un valor post-quirúrgico indetectable es menos tranquilizador. En esos pacientes una concentración post-quirúrgica detectable de Tg sérica podría reflejar la presencia de una importante masa tumoral. De hecho, en general, los cambios post-quirúrgicos representan cambios en la masa tumoral, siempre que se mantenga un nivel constante de TSH mediante terapia con L-T4.
La Tg sérica medida durante el estímulo de TSH (TSH endógena o TSH recombinante humana, rhTSH), es más sensible para la detección del CDT residual o metastásico que una determinación de Tg basal realizada durante el tratamiento con L-T4 (Figura 6) (308). La magnitud del aumento de la Tg sérica en respuesta a la TSH es un indicador de la sensibilidad del tumor a la TSH. Los tumores bien diferenciados típicamente muestran una respuesta estimulada a TSH elevada equivalente a ~10 veces el valor basal de Tg (309). Los tumores escasamente diferenciados que no concentran yoduro pueden presentar una respuesta disminuida al estímulo con TSH (310).

Fig 6. Respuestas de Tg sérica a la administración de rhTSH o a la suspensión de T3. Datos de la ref. 308.
1. Estado actual de los métodos de determinación de Tg
Generalmente, la tiroglobulina se mide en suero, pero también es posible realizar las determinaciones en líquido de quistes tiroideos y/o en material obtenido por punción con aguja fina de masas cervicales no tiroideas (311). La determinación de Tg sérica es técnicamente difícil. En la actualidad, los ensayos inmunométricos (IMA), están superando en popularidad a los métodos por radioinmunoensayo (RIA). La tendencia se debe a que los métodos IMA ofrecen la ventaja práctica de un menor tiempo de incubación, un rango dinámico más amplio y una mayor estabilidad del anticuerpo marcado, y en consecuencia una menor susceptibilidad al daño por marcación que los RIA (312). Hoy los laboratorios pueden escoger entre una serie de métodos IMA tanto isotópicos (inmunorradiométricos, IRMA) como no isotópicos (fundamentalmente quimioluminiscencia, ICMA). No obstante, los métodos IMA suelen ser más susceptibles a interferencias por autoanticuerpos antitiroglobulina (TgAb), que provocan una subestimación de los niveles de Tg sérica. En consecuencia, algunos laboratorios han escogido los métodos RIA para determinarla en pacientes TgAb positivos y restringir el uso de los métodos IMA a los pacientes TgAb negativos. Sin embargo, ningún método puede alegar estar totalmente libre de la interferencia por TgAb, la cual puede provocar resultados inapropiados de Tg. Además de los problemas con la interferencia de TgAb, los actuales métodos IMA tienen diferencias en la estandarización y en la especificidad, deficiencias en la sensibilidad, precisión interensayo por debajo del nivel óptimo, y potencial predisposición a sufrir efecto hook (gancho) a concentraciones elevadas (312).
(a) Estandarización
Las concentraciones de Tg sérica determinadas por métodos RIA o IMA presentan marcadas diferencias (312)(313). Un reciente esfuerzo en colaboración patrocinado por el Community Bureau of Reference of the Commission of the European Communities ha desarrollado una nueva Preparación de Referencia Internacional para Tg, CRM-457 (298)(314). Este material se puede solicitar al Dr. Christos Profilis, BCR, Rue de la Loi 200, B 1049 Bruselas, Bélgica.
Recomendación Nº 42. Para los fabricantes que desarrollan métodos para la determinación de Tg
. Sería ideal que el diluyente utilizado para los estándares fuese suero humano libre de Tg y TgAb. Se deberían seleccionar matrices no séricas para producir una señal (cuentas radioactivas, unidades relativas de luz, etc.) que sean idénticas al suero humano libre de Tg y TgAb para evitar desvíos (bias) relacionados con las matrices.
El desvío entre los diferentes métodos de determinación de Tg puede provenir de las diferencias entre las matrices libres de Tg utilizadas para la dilución de los estándares y el suero de pacientes, o diferencias en el reconocimiento de los epitopes por parte de los distintos anticuerpos de Tg usados por los diversos fabricantes. Sería ideal que el diluyente utilizado para los estándares fuese suero humano libre de Tg y TgAb o, como alternativa, una matriz no sérica que hubiera sido seleccionada para producir una señal (cuentas radiactivas, unidades relativas de luz, etc.) que fuese idéntica a la del suero humano libre de Tg y TgAb. Es fundamental que se informe a los médicos antes de que el laboratorio cambie su método para Tg para que puedan realizar una nueva determinación de valores basales en los pacientes con CDT.
La adopción generalizada del estándar CRM-457 se proyectó para reducir, aunque no eliminar la significativa variabilidad inter-método que existe entre los inmunoensayos de Tg de los distintos fabricantes. Se esperaba que la estandarización internacional facilitara un mayor acuerdo entre los diversos estudios publicados y mejorara el uso clínico del seguimiento seriado con Tg en los pacientes con CDT, que a veces tienen determinaciones realizadas en distintos laboratorios. Lamentablemente, el uso del estándar CRM-457 no ha eliminado los problemas de variabilidad entre métodos como se esperaba. En la actualidad, los niveles de Tg sérica determinados por métodos que utilizan la estandarización CRM-457 pueden presentar diferencias de más de cuatro veces en sus resultados (Figura 7). Estas diferencias inter-métodos son mayores que la máxima imprecisión aceptada durante el seguimiento de los pacientes individuales (Tabla V) y excluye el intercambio de diferentes métodos de Tg para el seguimiento a largo plazo de los pacientes con cáncer de tiroides.

Fig 7. Valores de la media ± 2 DE para la medición de 20 sueros normales TgAb-negativos mediante 10 métodos diferentes de Tg. Método Nº1= Diagnostic Systems Laboratories, Webster, TX, EE.UU.; Método Nº2=University of Southern California RIA, Los Angeles, CA, EE.UU.; RIA Nº3= Kronus RIA, Boise ID, EE.UU.; Método Nº4= Endocrine Sciences RIA, Calabasas, CA, EE.UU.; Método Nº5=Nichols Institute Diagnostics ICMA, San Juan Capistrano, CA, EE.UU.; Método Nº6= Endocrine Sciences ICMA, Calabasas, CA, EE.UU; Método Nº7=Sanofi Pasteur IRMA, Marnes-La-Coquette, Francia; Método Nº8=Kronus OptiQuant IRMA, Boise ID, EE.UU.; Método Nº9=Brahms DynoTest TgS IRMA, Berlín, Alemania; Método Nº10=Diagnostic Products Immulite ICMA, Los Angeles, CA, EE.UU. El asterisco señala los ensayos que declaran estandarización CRM-457.
Recomendación Nº 43. Para los laboratorios que consideran cambiar su método de determinación de Tg
Seleccionar un método para Tg en función de las características de su comportamiento analítico y no de su costo o conveniencia. Antes de cambiar el método para Tg el laboratorio debería consultar a los médicos que utilizan su método y comparar los resultados entre el método antiguo y el nuevo propuesto utilizando muestras de pacientes TgAb negativos y positivos.
. Pacientes TgAb negativos: Si el desvío entre los resultados del método antiguo y el nuevo es > 10%, se debería informar a los médicos y brindarles tiempo suficiente para volver a determinar los valores basales de los pacientes en estado crítico.
. Pacientes TgAb positivos: El laboratorio debería advertir a los médicos acerca de la probable dirección de la interferencia en presencia de TgAb.
. Si se informan los valores de Tg sérica para las muestras TgAb positivas, se debería incluir una advertencia en cada informe de laboratorio:
. PARA LOS MÉTODOS IMA:
Los métodos IMA pueden dar valores de Tg sérica inadecuadamente bajos o indetectables en presencia de TgAb. Los resultados indetectables de Tg sérica no se pueden utilizar como indicadores de ausencia de tumor en un paciente TgAb positivo. Un valor detectable de Tg indica presencia de Tg, pero las concentraciones pueden ser subestimadas.
. PARA LOS MÉTODOS RIA:
Los métodos RIA (aunque menos susceptibles a la interferencia) también pueden dar resultados inapropiados de Tg sérica en presencia de TgAb (dependiendo del método).
(b) Sensibilidad
Algunos métodos de Tg carecen de sensibilidad para detectar el límite inferior de referencia eutiroideo que, dependiendo del ensayo, se sitúa aproximadamente en 1-3 µg/L (ng/mL). Los métodos que no están en condiciones de detectar Tg en todos los sueros normales son insensibles para la búsqueda de recidivas en los pacientes con CDT. Al igual que para TSH, la sensibilidad funcional del ensayo de Tg se determina con el 20% del CV inter-ensayo. El protocolo utilizado para determinar la sensibilidad funcional del ensayo de Tg es el mismo que se describió para TSH (Recomendación Nº 20) con las tres cláusulas descriptas en la Recomendación Nº 44.
(c) Precisión
La precisión intra- e inter-ensayo, expresada como porcentaje del coeficiente de variación (%CV) es un parámetro importante para la validación del comportamiento analítico de un ensayo de Tg. La precisión se debería determinar utilizando mezclas de sueros TgAb negativos con tres niveles diferentes de Tg (ver Recomendación Nº 44).
La precisión intra-ensayo en los inmunoensayos es mejor que la inter-ensayo, como cabría de esperar. Esto se debe a que las mediciones realizadas dentro de una misma corrida no están sujetas a la variabilidad introducida por el uso de lotes diferentes de reactivos ni por distintas calibraciones de los instrumentos. La precisión intra-ensayo puede ser el parámetro más significativo cuando se evalúa la respuesta de Tg sérica al estímulo con rhTSH (308). En esta prueba, se extrae una muestra basal y una muestra estimulada con rhTSH con 3 a 5 días de intervalo entre sí, y generalmente se determina la Tg de ambas muestras en la misma corrida (Figura 6) (308)(309). En contraste, cuando se utiliza la determinación de Tg para el control seriado, cuanto más prolongado es el intervalo entre corridas mayor la variabilidad y peor la precisión inter-ensayo. Las matrices no humanas utilizadas para determinar la precisión en la zona baja pueden producir una sensibilidad funcional irreal en comparación con las mediciones realizadas con suero humano libre de TgAb como matriz. Es importante que se establezca la sensibilidad funcional y la precisión inter-ensayo con determinaciones distribuidas durante un período entre 6 y 12 meses, ya que éste es el intervalo clínico característico utilizado para el control de los pacientes con CDT.
La máxima imprecisión de las determinaciones de Tg sérica sugerida para el seguimiento de pacientes debe ser < 5% (Tabla V). Es poco probable que los ensayos actuales de Tg puedan mantener una precisión tan estricta a lo largo del intervalo clínicamente relevante entre 6 y 12 meses, típicamente utilizado para el control de los pacientes con CDT. Este problema con la precisión se puede superar repitiendo la determinación en muestras previas almacenadas del paciente en la misma corrida que la muestra actual (9).
Recomendación Nº 44. Sensibilidad funcional y precisión inter-ensayo para los ensayos de Tg
La sensibilidad funcional y la precisión inter-ensayo se deberían establecer utilizando el mismo protocolo que para TSH (Recomendación Nº 20) con tres consideraciones importantes:
. Utilización de mezclas de suero humano que no contengan TgAb, determinados por un inmunoensayo sensible.
. Se recomiendan valores óptimos para mezclas de valores bajos, medios y altos:
Mezcla de valor bajo (utilizada para determinar la sensibilidad funcional) debería tener un valor de Tg sérica que sea entre 30 y 50% más elevado que el valor esperado de sensibilidad funcional (SF).
[Si SF = 1,0 µg/L (ng/mL) el valor de la mezcla baja debiera ser 1,3 a 1,5 µg/L (ng/mL)]
Mezcla de valor medio = ~10 µg/L (ng/mL) es decir, cercano al rango medio normal.
Mezcla de valor alto = ~90% del límite superior que informa el fabricante.
. El período utilizado para evaluar la precisión inter-ensayo debiera ser por lo menos de 6 meses. Este lapso es más representativo del intervalo clínico utilizado para el control de los pacientes con CDT que el intervalo entre 6 y 8 semanas sugerido para TSH en la Recomendación Nº 20.
(d) Efecto hook a valores elevados
Los métodos IMA se ven afectados por el efecto hook a valores elevados. Los valores falsamente bajos debido a este "efecto gancho" son particularmente problemáticos en los ensayos de marcadores tumorales como la Tg, en donde es frecuente encontrar valores muy elevados cuando los pacientes presentan metástasis avanzada (307)(310)(315). Se produce efecto hook cuando un exceso de antígeno satura la capacidad de unión del anticuerpo de captura. Esto provoca una señal inadecuadamente baja que se traduce en un resultado bajo o paradójicamente normal para un paciente con una concentración excesivamente elevada de Tg sérica (>1000 µg/L (ng/mL) (312). Los fabricantes de métodos IMA intentan solucionar el problema del efecto hook mediante uno de estos dos procedimientos:
. Diseños de ensayo de dos pasos. Se realiza una primera incubación de la muestra sérica con el anticuerpo de captura antes de que los constituyentes no ligados se eliminen por lavado y se introduzca el anticuerpo marcado, seguido de una segunda incubación.
. Se realizan dos determinaciones (generalmente sin diluir y con dilución 1/10) para cada muestra.
Existe sospecha de efecto hook cuando el tubo con la dilución presenta un resultado más alto que la muestra sin diluir. Se realizan más diluciones hasta que el resultado en el tubo con la dilución disminuya y las concentraciones de Tg séricas de dos diluciones consecutivas concuerden.
Recomendación Nº 45. Detección de efecto hook
. Se recomienda un diseño de ensayo en dos pasos para minimizar los problemas hook. Los ensayos "en un paso" que son más propensos al efecto hook deberían medir cada muestra en dos concentraciones (sin diluir y 1:10) para ver si hay discrepancias entre ambos resultados.
. Se debería validar el efecto hook en todos los métodos (de dos pasos o de un paso) antes de su comercialización.
. Para verificar el efecto hook, efectuar diluciones 1/10 seriadas de ~ 20 muestras TgAb negativas con concentraciones de Tg sérica superiores a 10.000 µg/L (ng/mL) y ~ 20 muestras TgAb negativas con concentraciones de Tg sérica superiores a 100.000 µg/L (ng/mL) hasta que se demuestre linealidad.
(e) Interferencia por autoanticuerpos
anti tiroglobulina (TgAb)
Los autoanticuerpos anti tiroglobulina (TgAb) se detectan con mayor frecuencia en los pacientes con CDT que en la población general (~20 versus ~10%, respectivamente) (276). Las determinaciones seriadas de los TgAb séricos pueden ser indicadores pronósticos independientes de la eficacia del tratamiento o de la recidiva del CDT en los pacientes TgAb positivos (276-278)(316). Cualquier TgAb presente en la muestra tiene el potencial de interferir con un método de Tg (317)(318). Debido a que los TgAb son heterogéneos, ni la medición de la concentración de estos anticuerpos ni un ensayo de recuperación con Tg exógena permiten predecir si los TgAb causarán interferencia (276)(317)(318). Probablemente el signo característico más confiable de la interferencia por TgAb sea la presencia de discordancia entre los RIA y los IMA. La Tg determinada por RIA se caracteriza por valores más elevados que la Tg determinada mediante IMA si la muestra contiene TgAb que provoquen interferencia (276)(309). En la actualidad se ha logrado consenso acerca de que los ensayos de recuperación de Tg no son un método confiable para la detección de TgAb y se los debería eliminar (276)(318). Los primeros estudios que informaron recuperaciones bajas en ausencia de TgAb en algunos sueros tenían el problema de la insensibilidad de los métodos iniciales para medir TgAb. Cuando se utilizan inmunoensayos cuantitativos con sensibilidad adecuada, los TgAb deberían detectarse siempre cuando la recuperación es baja.
Los métodos inmunométricos no competitivos (IMA) parecen ser más susceptibles a la interferencia producida por TgAb que los RIA, lo que se evidencia por el hallazgo de valores indetectables de Tg en individuos con enfermedad de Graves (318)(319). Aparentemente, en algunos casos los IMA no pueden cuantificar la Tg acomplejada con los TgAb y esta omisión puede provocar subestimación de la concentración de Tg total. Por el contrario los métodos RIA parecen capaces de cuantificar las fracciones de Tg de la muestra tanto libre como ligada a TgAb y característicamente producen valores más altos que los métodos IMA en presencia de TgAb (276)(309). Existe gran variabilidad en la sensibilidad y especificidad de los diferentes ensayos de TgAb [Sección-3 D6(b)]. Es esencial que la medición de TgAb sea realizada por el laboratorio que determinará la Tg porque ese laboratorio es responsable de seleccionar el método de TgAb más apropiado para detectar interferencia por TgAb en el método para Tg que utilice.
Cuando se determina Tg en suero que contiene TgAb con métodos RIA e IMA, con frecuencia se observa una discordancia RIA: IMA equivalente a [Tg RIA Z 2 µg/L (ng/mL): Tg IMA = indetectable]. Esta discordancia parece caracterizar la interferencia por TgAb en una o ambas clases de métodos. Como el umbral actual para una respuesta de Tg positiva estimulada por rhTSH equivale a 2 µg/L (ng/mL), el grado de discordancia tiene el potencial de influir en la toma de decisiones clínicas (308). Algunos profesionales creen que las mediciones con RIA producen resultados de Tg sérica con mayor validez clínica para los pacientes TgAb positivos que las mediciones con IMA, según se infiere por las correlaciones con el estado clínico y el paralelismo con determinaciones seriadas de TgAb (276)(320). No obstante, cabe destacar que ningún método RIA es inmune a la interferencia por TgAb en todos los sueros TgAb positivos y que la influencia de estos anticuerpos en los diferentes métodos RIA es bastante variable y se relaciona con los componentes del ensayo y las condiciones de incubación. Específicamente, la calidad del trazador I125 de la Tg, junto con la especificidad del anticuerpo policlonal para Tg determinan la predisposición del método a la interferencia por TgAb (275)(321)(322).
Recomendación Nº 46. Interferencia por TGAb y ensayos de recuperación
. Los ensayos de recuperación no son confiables para la detección de TgAb y se los debería eliminar. Estudios previos que informaron recuperaciones bajas en ausencia de TgAb estaban influenciados por la baja sensibilidad de los métodos iniciales para medir TgAb. Cuando se utilizan inmunoensayos ultrasensibles, siempre es posible detectar TgAb cuando la recuperación es baja.
. La discordancia entre las mediciones de Tg realizadas con IMA y RIA en una muestra TgAb positiva sugiere interferencia por TgAb (si los valores habitualmente concuerdan en las muestras TgAb negativas).
. Los laboratorios no deberían informar valores indetectables de Tg sérica por método IMA en pacientes TgAb positivos.
Aunque no existe garantía de que ningún método actual de Tg esté libre de interferencia por TgAb, la subestimación que se produce con la metodología IMA es la dirección de interferencia más grave, ya que este error tiene el potencial de enmascarar la enfermedad metastásica. En consecuencia, los laboratorios no deberían informar valores indetectables de Tg sérica para pacientes TgAb positivos.
Recomendación Nº 47. Para los fabricantes y los laboratorios
El folleto con el procedimiento técnico incluido en la caja de reactivos para Tg debería informar sobre las características reales de comportamiento analítico del método (es decir, un comportamiento reproducible en una serie de laboratorios clínicos).
. Se deberían estandarizar los ensayos contra la preparación de referencia CRM-457. Los ensayos que no estén estandarizados contra el CRM-457 deberían proveer un factor de corrección.
. El valor medio de Tg y los límites de 2 DE del rango de referencia para los individuos normales eutiroideos TgAb negativos (establecidos utilizando la Recomendación Nº48) se deberían citar en todas las publicaciones para permitir la comparación de los valores absolutos.
. Los ensayos que no pueden detectar Tg en todos los sueros normales presentan una sensibilidad subóptima para el control de los pacientes con CDT.
. Se debería verificar el desvío de la matriz utilizada para la dilución de los estándares (Recomendación Nº 42).
. La sensibilidad funcional y la precisión intra- e inter-ensayo se deberían establecer utilizando los protocolos descriptos en la Recomendación N° 44.
. La interferencia por TgAb se debería evaluar comprobando las discordancias RIA: IMA en los sueros TgAb positivos [en valores de TgAb de 100 a > 1000 kUI/L (UI/mL)].
. Se deberían usar inmunoensayos de sensibilidad adecuada de TgAb, y no ensayos de recuperación con Tg exógena para detectar interferencia por TgAb (ver Recomendación Nº 46).
. Los valores de Tg sérica para muestras TgAb positivas no se deberían informar si el método da valores inapropiadamente indetectables en pacientes con CDT con enfermedad documentada.
2. Determinación de ARN mensajero (ARNm) para Tg
Se ha utilizado la amplificación de ARNm específico de tejido con la reacción en cadena de la polimerasa con transcriptasa reversa (RT-PCR) para detectar células cancerígenas circulantes en sangre periférica de los pacientes con melanoma, cáncer de próstata y de mama (326-328). La disponibilidad de cebadores (primers) específicos de Tg permitió la aplicación de esta técnica a la detección de transcriptos de ARNm Tg en sangre. El uso de RT-PCR para detectar recidiva de cáncer tiroideo se informó por primera vez en 1996 (329). A partir de entonces, se ha aplicado la técnica a material de punción de metástasis de ganglios cervicales y se ha visto que es más sensible que la determinación de Tg en el aspirado (330).
Todavía tiene que establecerse el valor clínico de la determinación de ARNm Tg en sangre periférica. Antes de que se pueda utilizar este método para la toma de decisiones terapéuticas en el CDT, es necesario resolver ciertas cuestiones sobre la sensibilidad y especificidad tisular del ARNm Tg en sangre periférica (323-325).
Varios grupos han desarrollado métodos cuantitativos de RT-PCR para la detección de transcriptos de ARNm Tg en sangre (323-325)(331-333). Estos estudios generalmente encuentran ARNm Tg detectable en todos los individuos normales pero presentan una correlación pobre con la Tg sérica determinada por inmunoensayo (331)(332). También hay diferencias en la correlación entre ARNm Tg y masa tumoral. Algunos estudios han informado que la cantidad de ARNm Tg se correlaciona con la presencia o ausencia de metástasis mientras que otros no informan dicha correlación (324)(331)(333). Es probable que estas discrepancias reflejen diferencias (a) en la sensibilidad y en la especificidad de los primers de Tg y los sistemas RT-PCR, (b) en la sensibilidad de las técnicas de imágenes y de los inmunoensayos de Tg utilizados y (c) en el nivel de TSH del paciente. Los problemas de especificidad (resultados falsos positivos) constituyen una conocida limitación de la metodología RT-PCR (328)(334). Se necesitan estudios adicionales para determinar si los niveles detectables de ARNm Tg informados para los pacientes atiróticos sin metástasis conocida reflejan enfermedad clínicamente oculta, artefactos del ensayo o transcripción ilegítima.
Es necesario demostrar la correlación entre los resultados de los ensayos de ARNm Tg y la recidiva clínica, en especial en pacientes ARNm Tg positivos con valores indetectables de Tg sérica antes de que se generalice la adopción del ensayo de ARNm Tg en la práctica clínica. Como este método es más costoso que la determinación de Tg sérica, es probable que si se demuestra que las mediciones de ARNm Tg son útiles para la clínica, se reserven para los pacientes de alto riesgo o TgAb positivos en quienes las determinaciones de Tg sérica no son diagnósticamente confiables.
3. Valores de referencia de Tg sérica (a) Individuos eutiroideos normales
Las concentraciones de Tg sérica presentan una distribución normal logarítmica en los individuos eutiroideos. Los valores suelen ser ligeramente más elevados en las mujeres, pero no es necesario establecer rangos de referencia en relación con el género (335). El hábito de fumar es un factor asociado con bocio y valores elevados de Tg sérica (336). Los rangos de referencia de Tg varían según la zona geográfica, ya que reflejan la disponibilidad e ingesta de yoduro (337)(338). La selección de individuos para la cohorte normal para determinar el rango de referencia de Tg debería respetar los siguientes criterios de exclusión:
Bocio
Consumo de cigarrillos
Antecedentes personales o familiares de enfermedad tiroidea
Presencia de autoanticuerpos tiroideos (TgAb o TPOAb)
TSH sérica < 0.5 mUI/L o > 2.0 mUI/L
Embarazo
(b) Valores de Tg sérica después de la cirugía tiroidea
Como se indica en la Recomendación Nº 48, el intervalo de referencia para Tg citado en los informes de laboratorio no corresponde para los pacientes que han sido sometidos a cirugía tiroidea. Durante las primeras semanas después de la cirugía, la Tg sérica estará determinada por la extensión de la intervención, el grado de liberación de Tg debida al daño quirúrgico, y, lo más importante, si el paciente está o no bajo tratamiento con hormona tiroidea. De hecho, la concentración de TSH sérica es un modulador tan potente del nivel de Tg sérica que siempre es necesario conocer el nivel de TSH del paciente antes de establecer el significado de cualquier determinación de Tg sérica.
En las primeras semanas posteriores a la tiroidectomía, se produce una típica disminución de las concentraciones de Tg con una vida media aproximada entre 2 y 4 días, cuando la administración de hormona tiroidea evita el aumento de la TSH (340)(341). En este contexto, la relación entre los valores pre-y post-quirúrgicos (entre 6 y 8 semanas) de Tg puede aportar información que podría influir en el esquema de tratamiento. Durante el seguimiento a largo plazo, las concentraciones de Tg sérica medidas con y sin tratamiento de L-T4 (con TSH suprimida o desenfrenada, respectivamente) proporcionan diferente información. La curva de los valores de Tg sérica (con tratamiento con L-T4) es un indicador más específico de un cambio en la masa tumoral que cualquier valor aislado de Tg sérica (122). La concentración de Tg sérica durante el tratamiento con L-T4 es un indicador más estable de masa tumoral que la Tg sérica determinada cuando la TSH está elevada (suspensión de L-T4 o administración de rhTSH) anterior a un rastreo corporal con yodo radioactivo (RAI). Esto se debe a que la magnitud del aumento de Tg sérica estimulada por TSH está influida por el grado y la cronicidad de la elevación de TSH que puede variar de un rastreo a otro. Sin embargo, según lo muestra la Figura 6, como la TSH normalmente estimula más de 10 veces la Tg sérica, las determinaciones de Tg sérica estimuladas por TSH son más sensibles para detectar enfermedad restringida al cuello, que los niveles de Tg sérica determinados durante la supresión de TSH (308)(309). La magnitud de la respuesta de la Tg sérica estimulada por TSH es un indicador de la sensibilidad del tumor a la TSH. Los tumores metastásicos poco diferenciados que son rastreo corporal con yodo radioactivo negativos presentan respuestas disminuidas de Tg estimulada por TSH (310).
Recomendación Nº 48. Intervalos de referencia para Tg sérica
. Los rangos de referencia para Tg se deberían determinarse localmente porque las concentraciones de Tg sérica están influenciadas por la ingesta de yoduro:
. Países con ingesta adecuada de yoduro: El intervalo de referencia para Tg sérica para la población eutiroidea TgAb negativa según los estándares CRM-457 se aproxima a los 3 a 40 µg/L (ng/mL).
. Países con yododeficiencia: Es posible que se registre un aumento en la media de Tg de la población y del límite superior del rango de referencia relacionado con el grado de carencia de yodo.
. Los laboratorios deberían validar su intervalo de referencia para Tg independientemente de los fabricantes.
. Se deberían establecer rangos de referencia a partir de los valores logarítmicamente transformados de 120 individuos normales, no fumadores, eutiroideos (TSH 0,5 a 2,0 mUI/L) menores de 40 años sin antecedentes personales ni familiares de enfermedad tiroidea y sin evidencia de TgAb o TPOAb.
. Es engañoso citar el rango de referencia normal eutiroideo al informar valores de Tg sérica para los pacientes con CTD tiroidectomizados. Los valores de referencia deberían relacionarse con los límites de referencia eutiroideos para el método, la masa tiroidea y el nivel de TSH.
Como ejemplo, los rangos de referencia a continuación serían apropiados para un método de Tg con un rango de referencia eutiroideo de 3-40 µg/L (ng/mL):

4. Usos clínicos de las determinaciones de Tg sérica
La concentración de Tg sérica refleja la masa tiroidea, el daño tiroideo y el estímulo del receptor de TSH (122). En consecuencia, un aumento en la Tg sérica es un hallazgo inespecífico no asociado virtualmente con ninguna patología tiroidea.
(a) Patologías no Neoplásicas
Se produce un aumento de la Tg sérica cuando los pacientes tienen bocio y en la mayoría de las patologías hipertiroideas. La concentración baja de Tg sérica puede ser un parámetro útil para la confirmación del diagnóstico de tirotoxicosis facticia o para la investigación de la etiología de hipotiroidismo congénito (342)(343).
Recomendación Nº 49. Determinación de Tg sérica para patologías no neoplásicas
Concentraciones anormalmente altas de Tg resultan de anormalidades en la masa tiroidea, excesiva estimulación tiroidea, daño físico a la tiroides secundario a cirugía, PAaF o tiroiditis. Las determinaciones de Tg sérica son útiles para:
. Diagnosticar tirotoxicosis facticia caracterizada por Tg sérica baja.
. Investigar la etiología del hipotiroidismo congénito detectado en el screening neonatal.
. Evaluar la actividad de la tiroiditis inflamatoria, por ejemplo: tiroiditis subaguda o inducida por amiodarona.
La concentración de Tg a veces también es útil para confirmar la historia pasada de tiroiditis, en la cual la concentración de Tg es habitualmente el último parámetro bioquímico que se normaliza (hasta los 2 años) (344). Estudios recientes sugieren la determinación de Tg sérica como un parámetro para reflejar el estado de yodosuficiencia en una población determinada (337)(338).
(b) Carcinoma diferenciado de tiroides (CDT)
En el contexto del CDT, la concentración de Tg sérica refleja masa tiroidea (tumor o remanente normal), lesión tiroidea (cirugía o PAaF) y estimulación del receptor de TSH (endógena o con rhTSH) (122). Debido a que la TSH es el principal regulador de la concentración de Tg sérica, es difícil interpretar los valores de Tg sin conocer el nivel de TSH del paciente. Aunque no hay un "rango normal de referencia para Tg" para los pacientes con CDT tratados, la relación normal entre la masa tiroidea y la Tg sérica provee un punto de referencia importante. Concretamente, un gramo de tejido tiroideo normal libera ~1 µg/L (ng/mL) de Tg en la circulación cuando la TSH sérica es normal y ~0,5 µg/L (ng/mL) cuando se la suprime por debajo de 0,1 mUI/L.
Recomendación Nº 50. Determinación de Tg sérica para el carcinoma diferenciado de tiroides (CDT)
Pacientes TgAb negativos:
. Los valores séricos pre-quirúrgicos (extracción antes o más de 2 semanas después de la PAaF) son útiles para la determinación de la capacidad secretante de Tg del tumor.
. La disminución aguda post-quirúrgica de Tg sérica refleja la extensión de la cirugía con una vida media de la Tg entre 3 y 4 días. (Si se administra hormona tiroidea para evitar el aumento de TSH).
. No existe "rango normal" para un paciente tiroidectomizado. Los pacientes completamente atireóticos no deben presentar Tg detectable en suero, incluso si la TSH está elevada.
. Parámetro útil de referencia: un gramo de tejido tiroideo normal libera ~1 µg/L (ng/mL) de Tg en suero cuando la TSH es normal y ~0,5 µg/L (ng/mL) cuando la TSH está suprimida a < 0,1 mUI/L.
. Cuando la Tg sérica es detectable durante el tratamiento con L-T4 (TSH estable) se pueden seguir los cambios en la masa tumoral con determinaciones seriadas de Tg sérica sin interrupción de la hormona tiroidea ni rhTSH.
. Cuando la Tg sérica es indetectable bajo tratamiento con L-T4 (y ausencia de TgAb) la Tg sérica estimulada por TSH es más sensible para la detección de enfermedad localizada en el cuello.
. Habitualmente se produce un aumento > 5 veces en la Tg sérica con respecto a los valores bajo supresión con LT4 luego del estímulo con TSH (endógena o rhTSH). Estudios comparativos muestran que las respuestas de la Tg estimulada con rhTSH son aproximadamente la mitad que las observadas con TSH endógena siguiendo a la suspensión de la hormona tiroidea.
Pacientes TgAb positivos:
. Habitualmente presentan respuestas disminuidas o ausentes de Tg sérica estimulada con TSH.
. Las determinaciones seriadas de TgAb (por inmunoensayos) son valiosas como marcadores tumorales sustitutos.
i) Tg sérica pre-quirúrgica
Algunos tumores tiroideos carecen de capacidad para secretar tiroglobulina. En 2/3 de los pacientes con CDT se observa un aumento en el valor pre-quirúrgico de Tg sérica, lo que indica que sus tumores tienen la capacidad de secretar Tg, y por lo tanto el seguimiento post-quirúrgico con Tg puede ser de utilidad clínica en ellos (307). Esta información es fundamental para la interpretación de los resultados post-quirúrgicos de la Tg sérica. Si el nivel pre-quirúrgico está dentro de los límites normales, un valor post-quirúrgico indetectable de Tg sérica es menos tranquilizador porque el tumor pudo ser originariamente no secretor de Tg. La sensibilidad del control post-quirúrgico con Tg sérica para la detección de recidiva será mayor cuando el tumor sea relativamente pequeño (< 2 cm de diámetro) y el valor pre-quirúrgico de Tg sea elevado. (Nota: las muestras pre-quirúrgicas se deberían extraer antes de la PAaF, o después de 2 semanas de la misma).
ii) Determinación de Tg sérica entre 1 y 2 meses después de la cirugía tiroidea
Después de la cirugía tiroidea, las concentraciones de Tg sérica disminuyen rápidamente con una vida media entre ~2 y 4 días (340). La Tg liberada por daño durante la manipulación quirúrgica se debería resolver en gran parte dentro de los primeros dos meses posteriores a la cirugía. Durante este lapso la TSH tendrá una influencia dominante en el nivel de Tg sérica. Si se inicia el tratamiento con hormona tiroidea inmediatamente después de la cirugía para evitar el aumento de TSH, la concentración de Tg sérica declinará a un valor que refleje el tamaño del remanente tiroideo normal más cualquier residuo o metástasis tumoral. Como el remanente tiroideo después de una tiroidectomía casi total habitualmente se aproxima a 2 gramos de tejido, se espera una concentración de Tg sérica equivalente a < 2 µg/L (ng/mL) cuando la cirugía ha sido exitosa y el nivel de TSH se mantiene por debajo de 0,1 mUI/L.
iii) Determinación de Tg sérica durante el seguimiento a largo plazo bajo tratamiento con L-T4.
Cuando el nivel de TSH es estable durante el tratamiento con L-T4, cualquier cambio en el nivel de Tg sérica reflejará un cambio en la masa tumoral. La recidiva clínica en tumores considerados "secretores deficientes de Tg" (valor pre-quirúrgico de Tg en el rango normal) se puede asociar con valores post-quirúrgicos bajos o indetectables de Tg sérica. Por el contrario, la recidiva de tumores considerados "buenos secretores de Tg" (valores pre-quirúrgicos elevados de Tg) se asocia normalmente con un aumento progresivo en Tg sérica (122). El perfil de las determinaciones seriadas de Tg sérica, establecido cuando el paciente tiene TSH estable, es más útil clínicamente que un valor aislado de Tg. Sin embargo, es posible interpretar el significado de un valor aislado de Tg conociendo el rango de referencia del ensayo de Tg, la extensión de la cirugía tiroidea y la concentración de TSH (en un estado estable), según lo muestra la Figura 8.
Condiciones asumidas
Sin lesión tiroidea reciente (cirugía o PAaF)
Usando la Recomendación N° 48, la media normal de Tg = 13,5, rango 3-40 (2DE) µg/L (ng/mL)
Masa de tejido tiroideo normal = 10-15 gramos
Un gramo de tejido tiroideo normal produce ~1 µg/L (ng/mL) Tg en suero si la TSH es normal
Un gramo de tejido tiroideo normal produce ~0,5 µg/L (ng/mL) Tg si la TSH es < 0.1 mUI/L

Figura 8. Valores esperados de Tg sérica relativos a la masa tiroidea y al valor de TSH (Para los métodos con un rango de referencia diferente al que se muestra en la Figura 8 ajustar los valores absolutos aplicando un factor de corrección basado en el valor normal medio del metodo, por ejemplo, para los métodos con un valor normal medio de 6,2 ug/L (ng/mL) corregir los valores que se muestran en un 50%).
(iv) Respuesta de Tg Sérica al estímulo con TSH
La magnitud de la respuesta de la Tg sérica a la TSH endógena (suspensión de la hormona tiroidea) o a la administración de rhTSH es un indicador de la sensibilidad del tumor a la TSH (308)(309). Habitualmente, el estímulo con TSH de los remanentes tiroideos normales o de un tumor bien diferenciado produce un aumento > 3 veces de Tg sérica por sobre el nivel basal (con TSH suprimida) en los pacientes TgAb negativos (Figura 6). La respuesta de la Tg sérica a un aumento en la TSH endógena es habitualmente dos veces mayor que con rhTSH (308)(345). Además, los tumores pobremente diferenciados, presentan una respuesta disminuida (< 3 veces) de la Tg sérica al estímulo con TSH (310). Cabe observar que los pacientes TgAb positivos habitualmente presentan una respuesta disminuida o ausente de la Tg al estímulo con rhTSH determinada por la mayoría de los ensayos, incluso cuando la concentración basal de Tg es detectable.
F. Calcitonina y proto-oncogen RET
El carcinoma medular de tiroides (CMT) se produce por una transformación maligna de las células C parafoliculares tiroideas y representa aproximadamente entre el 5 y el 8% de todos los casos de cáncer de tiroides. Aproximadamente el 75% es de presentación esporádica, en tanto el 25% restante es hereditario (9)(11)(347). Según un estudio de patología nodular la prevalencia de CMT es de 0,57% (348). El comportamiento y el manejo del CMT medular difiere del que se observa en el carcinoma de tiroides bien diferenciado de origen folicular (346). Las formas hereditarias de CMT se presentan asociadas a síndromes poliglandulares denominados neoplasias endócrinas múltiples (NEM) tipos 2A y 2B que son, heredados de manera autosómica dominante, con penetrancia asociada a la edad, y expresión variable. Existe la denominada variante familiar del CMT (CMTF), que se caracteriza por la aparición de CMT sin endocrinopatía asociada. En 1993 se describieron mutaciones responsables de estos trastornos en el proto-oncogen RET (349)(350), que se localiza en el cromosoma 10 sub-banda 10q11.2. Las expresiones fenotípicas de la NEM hereditaria se resumen en la Tabla VII.
Tabla Vll. Fenotipos de Neoplasia Endócrina Múltiple (NEM).

1. Detección de CMT mediante la determinación de calcitonina sérica (CT)
(a) Biosíntesis de calcitonina
El gen CALC-1 que codifica para la CT humana se ubica en el extremo del brazo corto del cromosoma 11 (11p15.3-15.5). Si bien las células C parafoliculares tiroideas son la fuente principal de CT circulante, muchas otras categorías de células neuroendócrinas, normalmente contienen y segregan CT. La calcitonina madura es un polipéptido de 32 aminoácidos (Aa) con un puente disulfuro y una amida prolínica carboxiterminal que juega un rol funcional importante. Como se muestra en la Figura 9, la CT madura es el resultado de una modificación postraduccional de un precursor de más de 141 Aa (preprocalcitonina) dentro de las células C parafoliculares. La preprocalcitonina primero sufre el clivaje de su péptido señal para formar procalcitonina (proCT), una prohormona que consiste en 116 residuos de Aa. En el extremo aminoterminal de proCT hay un péptido de 57 Aa, denominado aminoprocalcitonina (aminoproCT o PAS-57), y en el extremo carboxiterminal, un péptido de 21 Aa conocido como péptido-1 carboxiterminal de calcitonina (CCP-1 o Katacalcina). Los 33 Aa de la porción central de la molécula de proCT constituyen la molécula de CT inmadura. La CT madura activa de 32 aminoácidos (que incluye una prolina amidada en su extremo carboxiterminal) se produce a partir de CT inmadura por acción de la enzima monoxidasa amidante de peptidilglicina (PAM).

Figura 9. Maduración Postraduccional de Calcitonina.
(b) Métodos de determinación de CT
Hasta 1988, los métodos de ensayo para la determinación de CT se basaban principalmente en el radioinmunoensayo y utilizaban anticuerpos policlonales que reconocían tanto el monómero de CT madura como otras formas circulantes (precursores y productos de degradación). Estos primeros ensayos carecían de especificidad y sensibilidad. Desde 1988, las mejoras con las nuevas técnicas inmunométricas basadas en el uso de anticuerpos monoclonales (uno capaz de identificar la región N-terminal y el otro, la región C-terminal) han permitido desarrollar ensayos más específicos y sensibles para la CT madura monomérica de 32 Aa. Actualmente los ensayos inmunométricos de dos sitios detectan CT en plasma en ayunas en el 83% y 46% de hombres y mujeres sanos, respectivamente (351-353). Los valores de CT pueden diferir según el método utilizado, lo que dificulta la interpretación de los resultados. Es importante que los médicos conozcan que las diferencias entre métodos existen y pueden afectar la interpretación y el uso adecuado de la CT en el diagnóstico y el manejo del CMT.
(c) Valores basales de calcitonina
En 1968 se estableció que los valores basales de calcitonina eran un marcador útil para el diagnóstico de CMT (354). En la actualidad los IMA de dos sitios, específicos para CT madura, típicamente informan niveles de CT por debajo de 10 ng/L (pg/mL) para los controles normales sanos y para el 90% de los pacientes con otra disfunción tiroidea que no sea CMT. (348)(355-357).
Recomendación Nº 51. Ensayos para CT
. La CT madura (de 32 aminoácidos) es el principal marcador tumoral en el CMT.
. Las determinaciones de CT aplicadas al diagnóstico y seguimiento del CMT deberían realizarse mediante ensayos inmunométricos de dos sitios, específicos para el monómero maduro de CT de 32 aminoácidos.
. Actualmente, los valores basales de CT inferiores a 10 pg/mL (ng/L) son considerados como normales.
. A medida que se disponga de nuevos ensayos más sensibles, dicho umbral debería redefinirse.
Los pacientes con formas micro o macro de CMT (variantes esporádicas o familiares) poseen valores elevados de CT que correlacionan con la masa tumoral (358). La hiperplasia de células C (HCC) es el hallazgo histológico más temprano, previo al desarrollo de un microcarcinoma, en los pacientes con NEM2. La HCC se presenta pronto luego del nacimiento, y en esta etapa de la enfermedad la CT basal puede ser normal. Por lo tanto un resultado basal normal de CT no descarta patología de células C en las etapas más tempranas.
(d) Pruebas de estimulación de calcitonina para el diagnóstico de CMT
Para detectar de manera temprana las anormalidades en las células C, se han usado pruebas de estimulación con secretagogos conocidos de la CT como el calcio y un análogo de la gastrina (pentagastrina, Pg y cuando la Pg no está disponible, el omeprazol) ya sea en forma separada o combinada, que provocan un aumento en la CT en todos los estadios del CMT (359-364). Una ventaja de estas pruebas es que pueden detectar hiperplasia de células C antes de confirmarse el CMT. En los países, en los que la utilización de técnicas de genética molecular es accesible, la cirugía para los portadores se basa exclusivamente en la prueba genética, y las pruebas de estimulación se usan raramente. Lo mismo sucede en países en donde la pentagastrina es difícil de obtener. Las pruebas de estimulación se usan habitualmente:
Para confirmar el diagnóstico de CMT antes de la cirugía cuando los niveles basales de CT están sólo moderadamente elevados (menos de 100 pg/mL).
Para detectar enfermedad de células C en portadores RET positivos.
Para el control prequirúrgico de niños RET positivos.
Para el control postoperatorio de recurrencia de tumores.
Cuando la prueba genética no está fácilmente disponible.
Recomendación Nº 52. Utilidad clínica de la determinación de CT para diagnóstico de CMT
. Los ensayos de CT son método-dependientes lo cual puede tener un impacto en la interpretación de los resultados de CT.
. En pacientes con enfermedades tiroideas autoinmunes (tiroiditis de Hashimoto o enfermedad de Graves) pueden observarse valores elevados de CT.
. El primer hallazgo histológico previo al desarrollo de un microcarcinoma es la hiperplasia de células C (HCC), la cual puede no estar acompañada de una CT elevada en los primeros estadios de un CMT.
. Un aumento en los valores basales de CT por encima de 10 pg/mL (ng/L) sugiere un CMT en la etapa de microcarcinoma.
. Generalmente existe una correlación positiva entre valores de CT y masa tumoral.
(i) Prueba de estimulación con pentagastrina
La prueba de estimulación con Pg se ha utilizado ampliamente en el diagnóstico de CMT pero en muchos países no es muy accesible (359)(365). La misma consiste en una infusión endovenosa de Pg (0,5 µg/kg/peso corporal) efectuada durante unos 5 segundos. Esta administración "lenta" de Pg reduce los efectos secundarios transitorios (náuseas, vómitos, compresión subesternal, rubor, y hormigueo en las extremidades) y mejora la tolerancia del paciente a la prueba. Se toman muestras basales, y 1, 2, 5, y a veces 10 minutos después de iniciada la infusión.
La Tabla VIII muestra los resultados y la interpretación de los valores de CT estimulada con Pg. El pico de estimulación normalmente es inferior a 10 ng/L (pg/mL) en el 80% de adultos voluntarios sanos, e inferior a 30 ng/L (pg/mL) en el 95% de la población general. Los varones normales tienen valores más altos que las mujeres. Una prueba positiva [pico de CT superior a 100 ng/L (pg/mL)] sugiere CMT. En los pacientes que tienen la mutación familiar responsable de la NEM2, un pico entre 30 y 100 ng/L (pg/mL) es típicamente revelador de una HCC o de un microcarcionoma. Aunque se ha observado que un pico de CT inferior a 100 ng/L (pg/mL) puede darse en adultos con otras enfermedades tiroideas que no sean CMT (ver la Tabla IX), nunca se han observado tales resultados en niños menores de 12 años que no sean portadores de mutación RET (366). La ausencia de CT elevada en individuos jóvenes con mutación del RET no excluye la posibilidad de que el CMT se desarrolle posteriormente.
No se ha establecido la mejor edad para realizar la prueba de Pg en niños portadores de la mutación del RET para NEM2 ya que esta varía con el tipo de mutación y el tipo de NEM2 presentes en sus familias (367)(368). Por lo tanto, los portadores de la mutación con valores basales normales de CT deberían someterse a pruebas genéticas o de estimulación lo más pronto posible después del nacimiento para NEM2B, y a los 2 años de edad para NEM2A. Sin embargo, debería destacarse que normalmente se observan valores altos de CT en neonatos, seguidos de un descenso asociado a la edad, desde el nacimiento hasta el año, y aún no se dispone de datos sobre pruebas de estimulación para este grupo de edad (369). Esta prueba debería repetirse una vez al año como mínimo, hasta que de positiva, momento en el cual debería realizarse una tiroidectomía total. Pero dado el pronóstico del CMT, la baja tolerancia a la prueba con Pg, y las repercusiones psicológicas para la familia, algunos médicos prefieren no seguir este procedimiento y optan (como se prefiere actualmente) por realizar una tiroidectomía a todos los portadores de la mutación del RET entre los 4 y 5 años de edad.
Tabla VIII. Interpretación de la Prueba de Pentagastrina.

Tabla IX. Enfermedades que no son CMT con Niveles Elevados de Calcitonina.
(ii) Prueba de estimulación con calcio
Esta prueba consiste en administrar por vía endovenosa, durante 30 segundos, 2,5 mg/kg de gluconato de calcio. Se toman muestras para CT basal, y a 1, 2 y 5 minutos después de la inyección. Se sospecha hiperplasia de células C si la CT es mayor a 100 ng/L. En esta prueba no se han observado efectos adversos importantes, a excepción de una moderada y transitoria sensación de calor generalizado. Se ha informado que la prueba de estimulación con calcio es menos sensible que la de Pg para el diagnóstico de CMT (370-372). Además, esta prueba no ha sido evaluada usando un ensayo inmunométrico específico para el monómero maduro de CT y, por lo tanto, debe ser reevaluada con los ensayos actuales. Se ha demostrado que la prueba de estimulación con Calcio combinado con Pg potencia la sensibilidad de la prueba con Pg sola (359), resultando así en el ensayo más sensible para medir la existencia de tejido de células C.
(e) CT basal y post estimulación en el seguimiento de pacientes después de la cirugía
Luego de la tiroidectomía, la CT sérica es el marcador tumoral aceptado para la detección de tejido tiroideo residual o de metástasis. Un valor de CT detectable, basal o post estimulación, indica la presencia de tejido tumoral (373)(374).
Recomendación Nº 53. Seguimiento Postoperatorio del CMT
. La CT y el CEA deberían determinarse inmediatamente antes y 6 meses después de la cirugía del CMT. En algunos pacientes los niveles de CT disminuyen lentamente. La primera determinación de CT postoperatoria no debería realizarse antes de las 2 semanas.
. La presencia de tejido residual o la recurrencia del CMT sólo pueden descartarse si ambos niveles de CT, basal y post estímulo son indetectables.
Teniendo en cuenta las variaciones en la velocidad de desaparición de la CT sérica, la primera muestra control postoperatoria no debería tomarse, antes de las 2 semanas después de la cirugía (375). Cabe destacar que el antígeno carcinoembrionario (CEA) que se determina junto con la CT para detectar recurrencia, parece ser un marcador útil de desdiferenciación en el CMT y es indicativo de pobre pronóstico en el seguimiento.
(f) Niveles elevados de calcitonina en otras patologías además de CMT
Como se muestra en la Tabla IX, se han observado niveles elevados de calcitonina en otras patologías, además del CMT y de los tumores neuroendócrinos. En enfermedades tiroideas autoinmunes (tiroiditis de Hashimoto y enfermedad de Graves) se suele observar una mayor liberación de CT (376-378). Entre las enfermedades no tiroideas con elevado nivel de CT se incluyen insuficiencia renal severa, hipercalcemia e hipergastrinemia, enfermedades inflamatorias agudas de pulmón y otras formas locales o generales de sepsis (enfermedad de Biermer, trastornos iatrogénicos, etc.) (379-381).
Como en algunos casos los niveles elevados de CT fueron detectados por RIA policlonal, estos informes requieren confirmación con los ensayos actuales basados en anticuerpos monoclonales que son más específicos para CT madura. Estudios que utilizaron un antisuero específico contra ProCT, CT y CCP-1, junto con HPLC y filtración con gel, demostraron que los pacientes con un elevado nivel de CT asociado a enfermedad no tiroidea mostraban un notable aumento en sus niveles séricos de ProCT intacta y, en menor grado, de la forma no escindida, CT-CCP-1. Por lo general, dichos pacientes presentan niveles normales o ligeramente elevados de CT madura. Usando antisuero específico de epitopes y técnicas de aislamiento se ha podido demostrar que otros tumores que no son CMT pueden segregar grandes cantidades de CT madura y diversos precursores (382). Esto puede observarse en varios tumores neuroendócrinos, especialmente en el cáncer de pulmón de células pequeñas y en el carcinoide bronquial. Sin embargo, en estos pacientes, se observa sólo un ligero incremento, o ninguno, en los niveles de CT, después de la prueba de estimulación con Pg (383). La hiperplasia de células C se presenta en la tiroiditis linfocítica y en algunos pacientes con cáncer diferenciado de tiroides (384-386). Esta HCC puede ser responsable de valores ligeramente elevados de CT madura y de la respuesta aumentada de CT con la prueba de estimulación combinada o con de PG solamente.
2. Detección de cáncer medular de tiroides mediante la determinación de mutaciones en el proto-oncogen RET
Hasta 1987 el único método disponible para detectar sujetos de riesgo de CMT era realizar repetidas determinaciones de CT estimulada en el grupo familiar de los pacientes afectados. La subsiguiente identificación del locus 10q11.2 responsable de la NEM2 en el cromosoma 10 hizo posible la detección de sujetos portadores a través del screening genético (378). Se ha establecido que diversos tipos de mutaciones en el cromosoma 10 pueden activar el Proto-oncogen RET responsable de la NEM2 (349)(350). Esto permite realizar un estudio sistemático del problema antes de que aparezcan los primeros signos biológicos. Actualmente, en muchos países desarrollados, los estudios genéticos constituyen la primera estrategia diagnóstica. Sin embargo, para una predicción efectiva de la enfermedad, es necesario que los resultados positivos del screening genético se complementen con un exhaustivo estudio de los miembros sanos y enfermos de la familia.
El RET es un gen de 21 exones que codifica para un receptor de membrana del tipo tirosina quinasa. Este receptor se caracteriza por una región cadherina simil en el dominio extracelular, una región rica en cisteína inmediatamente externa a la membrana y un dominio intracelular de tirosina quinasa. Como se muestra en la Figura 10, las mutaciones descriptas hasta ahora en la NEM2 se hallan en los exones 8, 10, 11, 13, 14, 15 y 16 (368) (387-391).

Figura 10. Mutaciones más frecuentes del proto-oncogen RET.
(a) Screening genético para el diagnóstico de NEM2
La NEM2 es una enfermedad familiar autosómica dominante, causada por la activación de mutaciones en el proto-oncogen RET (349). Aproximadamente un 75% de todos los CMT son de origen esporádico y único. El 44% de dichos tumores presenta una mutación somática en el codón 918 (392). Se les debe realizar screening a todos los miembros colaterales de la familia, ancestros y descendientes del caso índice, así como a todos los descendientes de los miembros afectados El screening se basa en la identificación de la mutación genómica del proto-oncogen RET usando análisis de secuencia de DNA genómico del caso índice y en la búsqueda sistemática de esta mutación en todos los miembros de la familia potencialmente afectados (Figura 11) (393)(394).
Hasta ahora, cinco mutaciones de gen RET están presentes en el 97% de los casos de NEM2 (Figura 10). Las mutaciones responsables de la variedad NEM2A afectan principalmente al dominio extracelular rico en cisteína, resultando que cada una de estas mutaciones transforma una cisteína en otro aminoácido. Las principales mutaciones encontradas se ubican en los codones 609, 611, 618 y 620 del exón 10 y en el codón 634 del exon 11(368)(378). El carcinoma medular de tiroides familiar (CMTF) está generalmente asociado a mutaciones en los codones descriptos del exón 10, así como en los codones 768 y 804 de los exones 13 y 14 (368). La mayoría (87%) de las mutaciones en el codón 634 del exón 11 están asociadas a las manifestaciones en múltiples órganos de NEM2A (CMT, feocromocitoma e hiperparatiroidismo) (9)(378).
Los tumores asociados a NEM2B son causados por mutaciones en el dominio intracelular de tirosina quinasa 2 (TK2). La mayoría (97%) de los casos de NEM 2B involucran al codón 918 en el exón 16, que provoca el cambio de una metionina por treonina, la cual se presenta con frecuencia en forma de nuevas mutaciones (de novo) de la línea germinal (395). El menor porcentaje (5%) de mutaciones de MEN2B afecta al codón 883 del exón 15 ó 922 del exón 16 (378)(394). Una correlación entre fenotipo y genotipo sugiere que en pacientes afectados por CMTF con mutaciones del RET que no afectan a las cisteínas, la enfermedad de células C aparece más tardíamente que en aquellos pacientes que padecen las mutaciones del RET clásicas del exón 10 (368)(396).

Figura 11. Algoritmo para el diagnóstico y tratamiento del CMT.
Recomendación Nº 54. Riesgo genético de carcinoma medular de tiroides
. En NEM2, el porcentaje de miembros de la familia potencialmente afectados por la enfermedad es del 50%.
. Casi todos los pacientes portadores de mutaciones del RET desarrollarán CMT. (Nota: las mutaciones inactivantes del gen RET también causan la enfermedad de Hirschsprung.)
. Se encontró que el 5-10% de los CMT presenta mutaciones del RET de la línea germinal. Por lo tanto, el análisis del RET se justifica en todos los pacientes con CMT aparentemente esporádico.
Una vez identificada una mutación en una familia, se puede tener la certeza de que los miembros de dicha familia y sus descendientes que no presentan esa mutación se encuentran libres de la patología. Por el contrario, los sujetos portadores de la mutación padecen la patología y requerirán tratamiento quirúrgico para manejar o prevenir el desarrollo de la enfermedad (Figura 11). Si se identifica una mutación no genómica en el caso índice, como sucede en menos del 3% de las NEM2A y en el 5% de los CMTF, se puede predecir el nivel de riesgo para los miembros de la familia mediante el análisis de ligadura. Si la genealogía familiar no permite efectuar predicciones de este tipo, la enfermedad deberá detectarse repitiendo estudios clínicos y pruebas biológicas específicas a intervalos apropiados.
Referencias bibliográficas
248. Marcocci C, Chiovato L. 2000. Thyroid -directed antibodies. In: BL. URD, editor. Thyroid. Philadelphia: Lippincott Williams and Wilkins; 2000, p. 414-31.
249. Chiovato L, Bassi P, Santini F, Mammoli C, Lapi P, Carayon P, et al. Antibodies producing complement-mediated thyroid cytotoxicity in patients with atrophic or goitrous autoimmune thyroiditis. J Clin Endocrinol Metab 1993; 77: 1700-5.
250. Guo J, Jaume JC, Rapoport B, McLachlan SM. Recombinant thyroid peroxidase-specific Fab converted to immunoglobulin G (IgG)molecules: evidence for thyroid cell damage by IgG1, but not IgG4, autoantibodies. J Clin Endocrinol Metab 1997; 82: 925-31.
251. Doullay F, Ruf J, Codaccioni JL, Carayon P. Prevalence of autoantibodies to thyroperoxidase in patients with various thyroid and autoimmune diseases. Autoimmunity 1991; 9: 237-44.
252. Radetti G, Persani L, Moroder W, Cortelazzi D, Gentili L, Beck-Peccoz P. Transplacental passage of anti-thyroid autoantibodies in a pregnant woman with auto-immune thyroid disease. Prenatal Diagnosis 1999; 19: 468-71.
253. Heithorn R, Hauffa BP, Reinwein D. Thyroid antibodies in children of mothers with autoimmune thyroid disorders. Eur J Pediatr 1999; 158: 24-8.
254. Feldt-Rasmussen U. Anti-thyroid peroxidase antibodies in thyroid disorders and non thyroid autoimmune diseases. Autoimmunity 1991; 9: 245-51.
255. Mariotti S, Chiovato L, Franceschi C, Pinchera A. Thyroid autoimmunity and aging. Exp Gerontol 1999; 33: 535-41.
256. Ericsson UB, Christensen SB, Thorell JI. A high prevalence of thyroglobulin autoantibodies in adults with and without thyroid disease as measured with a sensitive solid-phase immunosorbent radioassay. Clin Immunol Immunopathol 1985; 37: 154-62.
257. Feldt-Rasmussen U, Hoier-Madsen M, Rasmussen NG, Hegedus L, Hornnes P. Anti-thyroid peroxidase antibodies during pregnancy and postpartum. Relation to postpartum thyroiditis. Autoimmunity 1990; 6: 211-4.
258. Premawardhana LD, Parkes AB, Ammari F, John R, Darke C, Adams H, et al. Postpartum thyroiditis and long-term thyroid status: prognostic influence of Thyroid Peroxidase Antibodies and ultrasound echogenicity. J Clin Endocrinol Metab 2000; 85: 71-5.
259. Johnston AM, Eagles JM. Lithium-associated clinical hypothyroidism. Prevalence and risk factors. Br J Psychiatry 1999; 175: 336-9.
260. Bell TM, Bansal AS, Shorthouse C, Sandford N, Powell EE. Low titre autoantibodies predict autoimmune disease during interferon alpha treatment of chronic hepatitis C. J Gastroenterol Hepatol 1999; 14: 419-22.
261. Ward DL, Bing-You RG. Autoimmune thyroid dysfunction induced by interferon-alfa treatment for chronic hepatitis C: screening and monitoring recommendations. Endocrinol Pract 2001; 7: 52-8.
262. Carella C, Mazziotti G, Morisco F, Manganella G, Rotondi M, Tuccillo C, et al. Long-term outcome of interferon-alpha-induced thyroid autoimmunity and prognostic influence of thyroid autoantibody pattern at the end of treatment. J Clin Endocrinol Metab 2001; 86: 1925-9.
263. Feldt-Rasmussen U, Schleusener H, Carayon P. Meta-analysis evaluation of the impact of thyrotropin receptor antibodies on long term remission after medical therapy of Graves' disease. J Clin Endocrinol Metab 1994; 78: 98-103.
264. Estienne V, Duthoit C, Di Costanzo, Lejeune PJ, Rotondi M, Kornfeld S et al. Multicenter study on TGPO autoantibodies prevalence in various thyroid and non-thyroid diseases: relationships with thyroglobulin and thyroperoxidase autoantibody parameters. Eur J Endocrinol 1999; 14: 563-9.
265. Czarnocka B, Ruf J, Ferrand M, Carayon P, Lissitzky S, et al. Purification of the human thyroid peroxidase and its identification as the microsomal antigen involved in autoimmune thyroid diseases. FEBS Lett 1985; 190: 147-52.
266. Mariotti S, Caturegli P, Piccolo P, Barbesino G, Pinchera A. Antithyroid peroxidase autoantibodies in thyroid diseases. J Clin Endocrinol Metab 1990; 71: 661-9.
267. Rubello D, Pozzan GB, Casara D, Girelli ME, Boccato s, Rigon F, et al. Natural course of subclinical hypothyroidism in Down's syndrome: prospective study results and therapeutic considerations. J Endocrinol Invest 1995; 18: 35-40.
268. Karlsson B, Gustafsson J, Hedov G, Ivarsson SA, Anneren G. Thyroid dysfunction in Down's syndrome: relation to age and thyroid autoimmunity. Arch Dis Child 1998; 79: 242-5.
269. Bussen S, Steck T, Dietl J. Increased prevalence of thyroid antibodies in euthyroid women with a history of recurrent in-vitro fertilization failure. Hum Reprod 2000; 15: 545-8.
270. Phan GQ, Attia P, Steinberg SM, White DE, Rosenberg SA. Factors associated with response to high-dose interleukin-2 in patients with metastatic melanoma. J Clin Oncol 2001; 19: 3477-82.
271. Durelli L, Ferrero B, Oggero A, Verdun E, Ghezzi A, Montanari E, et al. Thyroid function and autoimmunity during interferon-Beta-1b Treatment: a Multicenter Prospective Study. J Clin Endocrinol Metab 2001; 86: 3525-32.
272. Roti E, Minelli R, Giuberti T, Marchelli C, Schianchi C, Gardini E, et al. Multiple changes in thyroid function in patients with chronic active HCV hepatitis treated with recombinant interferon-alpha. Am J Med 1996; 101: 482-7.
273. Ruf J, Carayon P, Lissitzky S. Various expression of a unique anti-human thyroglobulin antibody repertoire in normal state and autoimmune disease. Eur J Immunol 1985; 15: 268-72.
274. Ruf J, Toubert ME, Czarnocka B, Durand-Gorde JM, Ferrand M, Carayon P. Relationship between immunological structure and biochemical properties of human thyroid peroxidase. Endocrinol 1989; 125: 1211-8.
275. Feldt-Rasmussen U, Rasmussen AK. Serum thyroglobulin (Tg) in presence of thyroglobulin autoantibodies (TgAb). Clinical and methodological relevance of the interaction between Tg and TgAb in vivo and in vitro. J Endocrinol Invest 1985; 8: 571-6.
276. Spencer CA, Wang C, Fatemi S, Guttler RB, Takeuchi M, Kazarosyan M. Serum Thyroglobulin Autoantibodies: Prevalence, influence on serum thyroglobulin measurement and prognostic significance in patients with differentiated thyroid carcinoma. J Clin Endocrinol Metab 1998; 83: 1121-7.
277. Pacini F, Mariotti S, Formica N, Elisei R. Thyroid autoantibodies in thyroid cancer: Incidence and relationship with tumor outcome. Acta Endocrinol 1988; 119: 373-80.
278. Rubello D, Casara D, Girelli ME, Piccolo M, Busnardo B. Clinical meaning of circulating antithyroglobulin antibodies in differentiated thyroid cancer: a prospective study. J Nucl Med 1992; 33: 1478-80.
279. Nordyke RA, Gilbert FI, Miyamoto LA, Fleury KA. The superiority of antimicrosomal over antithyroglobulin antibodies for detecting Hashimoto's thyroiditis. Arch Intern Med 1993; 153: 862-5.
280. Di Cerbo A, Di Paoloa R, Menzaghi C, De Filippis V, Tahara K, Corda D, et al. Graves' immunoglobulins activate phospholipase A2 by recognizing specific epitopes on the thyrotropin receptor. J Clin Endocrinol Metab 1999; 84: 3283-92.
281. Kung AWC, Lau KS, Kohn LD. Epitope mapping of TSH Receptor-blocking antibodies in Graves' disease that appear during pregnancy. J Clin Endocrinol Metab 2001; 86: 3647-53.
282. Ueta Y, Fukui H, Murakami M, Yamanouchi Y, Yamamoto R, Murao A, et al. Development of primary hypothyroidism with the appearance of blocking-type antibody to thyrotropin receptor in Graves' disease in late pregnancy. Thyroid 1999; 9: 179-82.
283. Gupta MK. Thyrotropin-receptor antibodies in thyroid diseases: advances in detection techniques and clinical application. Clin Chim Acta 2000; 293: 1-29.
284. Kung AW, Lau KS, Kohn LD. Characterization of thyroid-stimulating blocking antibodies that appeared during transient hypothyroidism after radioactive iodine therapy. Thyroid 2000; 10: 909-17.
285. Filetti S, Foti D, Costante G and Rapoport B. Recombinant human thyrotropin (TSH) receptor in a radioreceptor assay for the measurement of TSH receptor antibodies. J Clin Endocrinol Metab 1991; 72: 1096-101.
286. Adams DD, Purves HD. Abnormal responses in the assay of thyrotropin. Proc Univ Otago Med Sch 1956; 34: 11-2.
287. Morgenthaler NG. New assay systems for thyrotropin receptor antibodies. Current Opinion Endocrinol Diabetes 1998; 6: 251-60.
288. Kamijo K, Nagata A, Sato Y. Clinical significance of a sensitive assay for thyroid-stimulating antibodies in Graves' disease using polyethylene glycol at high concentration and porcine thyroid cells. Endocrinol J 1999; 46: 397-403.
289. Takasu N, Yamashiro K, Ochi Y, Sato Y, Nagata A, Komiya I, et al. TSBAb (TSH-Stimulation Blocking Antibody) and TSAb (Thyroid Stimulating Antibody) in TSBAb-positive patients with hypothyroidism and Graves' patients with hyperthyroidism. Horm Metab Res 2001; 33: 232-7.
290. Costagliola S, Swillens S, Niccoli P, Dumont JE, Vassart G, Ludgate M. Binding assay for thyrotropin receptor autoantibodies using the recombinant receptor protein. J Clin Endocrinol Metab 1992; 75: 1540-4.
291. Morgenthaler NG, Hodak K, Seissler J, Steinbrenner H, Pampel I, Gupta M, et al. Direct binding of thyrotropin receptor autoantibody to in vitro translated thyrotropin receptor: a comparison to radioreceptor assay and thyroid stimulating bioassay. Thyroid 1999; 9: 466-75.
292. Akamizu T, Inoue D, Kosugi S, Kohn LD, Mori T. Further studies of amino acids (268-304) in thyrotropin (TSH)-lutropin/chorionic gonadotropin (LH/CG) receptor chimeras: Cysteine-301 is important in TSH binding and receptor tertiary structure. Thyroid 1994; 4: 43-8.
293. Grasso YZ, Kim MR, Faiman C, Kohn LD, Tahara K, Gupta MK. Epitope heterogeneity of thyrotropin-blocking antibodies in Graves' patients as detected with wild-type versus chimeric thyrotropin receptors. Thyroid 1999; 9: 521-37.
294. Kim WB, Chung HK, Lee HK, Kohn LD, Tahara K, Cho BY. Changes in epitopes for thyroid stimulation antibodies in Graves' disease sera during treatment of hyperthyroidism: Therapeutic implications. J Clin Endocrinol Metab 1997; 82: 1953-9.
295. Shewring G, Smith BR. An improved radioreceptor assay for TSH receptor. Methods Enzymol 1982; 17: 409-17.
296. Costagliola S, Morganthaler NG, Hoermann R, Badenhoop K, Struck J, Freitag D, et al. Second generation assay for thyrotropin receptor antibodies has superior diagnostic sensitivity for Graves' disease. J Clin Endocrinol Metab 1999; 84: 90-7.
297. Schott M, Feldkamp J, Bathan C, Fritzen R, Scherbaum WA, Seissler J. Detecting TSH-Receptor antibodies with the recombinant TBII assay: Technical and Clinical evaluation 2000; 429-35.
298. Feldt-Rasmussen U. Analytical and clinical performance goals for testing autoantibodies to thyroperoxidase, thyroglobulin and thyrotropin receptor. Clin Chem 1996; 42: 160-3.
299. Giovanella L, Ceriani L, Garancini S. Clinical applications of the 2nd. generation assay for anti-TSH receptor antibodies in Graves' disease. Evaluation in patients with negative 1st. generation test. Clin Chem Lab Med 2001; 39: 25-8.
300. Momotani N, Noh JY, Ishikawa N, Ito K. Effects of propylthiouracil and methimazole on fetal thyroid status in mothers with Graves' hyperthyroidism. J Clin Endocrinol Metab 1997; 82: 3633-6.
301. Brown RS, Bellisario RL, Botero D, Fournier L, Abrams CA, Cower ML et al. Incidence of transient congenital hypothyroidism due to maternal thyrotropin receptor-blocking antibodies in over one million babies. J Clin Endocrinol Metab 1996; 81: 1147-51.
302. Gerding MN, van der Meer Jolanda WC, Broenink M, Bakker O, W. WM and Prummel MF. Association of thyrotropin receptor antibodies with the clinical features of Graves' opthalmopathy. Clin Endocrinol 2000; 52: 267-71.
303. Bartelena L, Marcocci C, Bogazzi F, Manetti L, Tanda ML, Dell'Unto E, et al. Relation between therapy for hyperthyroidism and the course of Graves' disease. N Engl J Med 1998; 338: 73-8.
304. Bech K. Immunological aspects of Graves' disease and importance of thyroid stimulating immunoglobulins. Acta Endocrinol (Copenh) Suppl 1983; 103: 5-38.
305. Feldt-Rasmussen U. Serum thyroglobulin and thyroglobulin autoantibodies in thyroid diseases. Pathogenic and diagnostic aspects. Allergy 1983; 38: 369-87.
306. NygAard B, Metcalfe RA, Phipps J, Weetman AP, Hegedus L. Graves' disease and thyroid-associated opthalopathy triggered by 131I treatment of non-toxic goitre. J Endocrinol Invest 1999; 22: 481-5.
307. Ericsson UB, Tegler L, Lennquist S, Christensen SB, Stahl E and Thorell JI. Serum thyroglobulin in differentiated thyroid carcinoma. Acta Chir Scand 1984; 150: 367-75.
308. Haugen BR, Pacini F, Reiners C, Schlumberger M, Ladenson PW, Sherman SI, et al. A comparison of recombinant human thyrotropin and thyroid hormone withdrawal for the detection of thyroid remnant or cancer. J Clin Endocrinol Metab 1999; 84: 3877-85.
309. Spencer CA, LoPresti JS, Fatemi S, Nicoloff JT. Detection of residual and recurrent differentiated thyroid carcinoma by serum Thyroglobulin measurement. Thyroid 1999; 9: 435-41.
310. Schlumberger M, C. P., Fragu P, Lumbroso J, Parmentier C, Tubiana M. Circulating thyrotropin and thyroid hormones in patients with metastases of differentiated thyroid carcinoma: relationship to serum thyrotropin levels. J Clin Endocrinol Metab 1980; 51: 513-9.
311. Pacini F, Fugazzola L, Lippi F, Ceccarelli C, Centoni R, Miccoli P, et al. Detection of thyroglobulin in fine needle aspirates of nonthyroidal neck masses: a clue to the diagnosis of metastatic differentiated thyroid cancer. J Clin Endocrinol Metab 1992; 74: 1401-4.
312. Spencer CA, Takeuchi M, Kazarosyan M. Current Status and Performance Goals for Serum Thyroglobulin Assays. Clin Chem 1996; 42: 164-73.
313. Feldt-Rasmussen U, Schlumberger M. European interlaboratory comparison of serum thyroglobulin measurement. J Endocrinol Invest 1988; 11: 175-81.
314. Feldt-Rasmussen U, Profilis C, Colinet E, Black E, Bornet H, Bourdoux P et al. Human thyroglobulin reference material (CRM 457) 2nd part: Physicochemical characterization and certification. Ann Biol Clin 1996; 54: 343-8.
315. Schlumberger M J. Papillary and Follicular Thyroid Carcinoma. New Engl J Med 1998; 338: 297-306.
316. Hjiyiannakis P, Mundy J, Harmer C. Thyroglobulin antibodies in differentiated thyroid cancer. Clin Oncol 1999; 11: 240-4.
317. Spencer CA. Recoveries cannot be used to authenticate thyroglobulin (Tg) measurements when sera contain Tg autoantibodies. Clin Chem 1996; 42: 661-3.
318. Massart C, Maugendre D. Importance of the detection method for thyroglobulin antibodies for the validity of thyroglobulin measurements in sera from patients with Graves' disease. Clin Chem 2002; 48: 102-7.
319. Mariotti S, Barbesino G, Caturegli P, Marino M, Manetti L, Pacini F, et al. Assay of thyroglobulin in serum with thyroglobulin autoantibodies: an unobtainable goal? J Clin Endocrinol Metab 1995; 80: 468-72.
320. Black EG, Hoffenberg R. Should one measure serum thyroglobulin in the presence of anti-thyroglobulin antibodies? Clin Endocrinol 1983; 19: 597-601.
321. Schneider AB, Pervos R. Radioimmunoassay of human thyroglobulin: effect of antithyroglobulin autoantibodies. J Clin Endocrinol Metab 1978; 47: 126-37.
322. Spencer CA, Platler BW, Nicoloff JT. The effect of 125-I thyroglobulin tracer heterogeneity on serum Tg RIA measurement. Clin Chim Acta 1985; 153: 105-15.
323. Bugalho MJ, Domingues RS, Pinto AC, Garrao A, Catarino AL, Ferreira T, et al. Detection of thyroglobulin mRNA transcripts in peripheral blood of individuals with and without thyroid glands: evidence for thyroglobulin expression by blood cells. Eur J Endocrinol 2001; 145: 409-13.
324. Bellantone R, Lombardi CP, Bossola M, Ferrante A, Princi P, Boscherini M, et al. Validity of thyroglobulin mRNA assay in peripheral blood of postoperative thyroid carcinoma patients in predicting tumor recurrence varies according to the histologic type: results of a prospective study. Cancer 2001; 92: 2273-9.
325. Bojunga J, Roddiger S, Stanisch M, Kusterer K, Kurek R, Renneberg H, et al. Molecular detection of thyroglobulin mRNA transcripts in peripheral blood of patients with thyroid disease by RT-PCR. Br J Cancer 2000; 82: 1650-5.
326. Smith B, Selby P, Southgate J, Pittman K, Bradley C, Blair GE. Detection of melanoma cells in peripheral blood by means of reverse transcriptase and polymerase chain reaction. Lancet 1991; 338: 1227-9.
327. Luppi M, Morselli M, Bandieri E, Federico M, Marasca R, Barozzi P, et al. Sensitive detection of circulating breast cancer cells by reverse-transcriptase polymerase chain reaction of maspin gene. Ann Oncol 1996; 7: 619-24.
328. Ghossein RA, Bhattacharya S. Molecular detection and characterisation of circulating tumour cells and micrometastases in solid tumours. Eur J Cancer 2000; 36: 1681-94.
329. Ditkoff BA, Marvin MR, Yemul S, Shi YJ, Chabot J, Feind C, et al. Detection of circulating thyroid cells in peripheral blood. Surgery 1996; 120: 959-65.
330. Arturi F, Russo D, Giuffrida D, Ippolito A, Perrotti N, Vigneri R, et al. Early diagnosis by genetic analysis of differentiated thyroid cancer metastases in small lymph nodes. J Clin Endocrinol Metab 1997; 82: 1638-41.
331. Ringel MD, Balducci-Silano PL, Anderson JS, Spencer CA, Silverman J, Sparling YH, et al. Quantitative reverse transcription-polymerase chain reaction of circulating thyroglobulin messenger ribonucleic acid for monitoring patients with thyroid carcinoma. J Clin Endocrinol Metab 1998; 84: 4037-42.
332. Biscolla RP, Cerutti JM and Maciel RM. Detection of recurrent thyroid cancer by sensitive nested reverse transcription-polymerase chain reaction of thyroglobulin and sodium/iodide symporter messenger ribonucleic acid transcripts in peripheral blood. J Clin Endocrinol Metab 2000; 85: 3623-7.
333. Takano T, Miyauchi A, Yoshida H, Hasegawa Y, Kuma K and Amino N. Quantitative measurement of thyroglobulin mRNA in peripheral blood of patients after total thyroidectomy. Br J Cancer 2001; 85: 102-6.
334. Chelly J, Concordet JP, Kaplan JC, Kahn A. Illegitimate transcription: transcription of any gene in any cell type. Proc Natl Acad Sci USA 1989; 86: 2617-21.
335. Premawardhana LDKE, Phillips DW, Prentice LM, Smith BR. Variability of serum thyroglobulin levels is determined by a major gene. Clin Endocrinol 1994; 41: 725-9.
336. Bertelsen JB, Hegedus L. Cigarette smoking and the thyroid. Thyroid 1994; 4: 327-31.
337. Knudsen N, Bulow I, Jorgensen T, Perrild H, Oversen L, Laurberg P. Serum Tg - a sensitive marker of thyroid abnormalities and iodine deficiency in epidemiological studies. J Clin Endocrinol Metab 2001; 86: 3599-603.
338. Van den Briel T, West CE, Hautvast JG, Vulsma T, de Vijlder JJ, Ategbo EA. Serum thyroglobulin and urinary iodine concentration are the most appropriate indicators of iodine status and thyroid function under conditions of increasing iodine supply in schoolchildren in Benin. J Nutr 2001; 131: 2701-6.
339. Gardner DF, Rothman J, Utiger RD. Serum thyroglobulin in normal subjects and patients with hyperthyroidism due to Graves' disease: effects of T3, iodide, 131I and antithyroid drugs. Clin Endocrinol 1979; 11: 585-94.
340. Feldt-Rasmussen U, Petersen PH, Date J, Madsen CM. Serum thyroglobulin in patients undergoing subtotal thyroidectomy for toxic and nontoxic goiter. J Endocrinol Invest 1982; 5: 161-4.
341. Hocevar M, Auersperg M, Stanovnik L. The dynamics of serum thyroglobulin elimination from the body after thyroid surgery. Endocrine Rev 1997; 23: 208-10.
342. Cohen JH, Ingbar SH, Braverman LE. Thyrotoxicosis due to ingestion of excess thyroid hormone. Endocrine Rev 1989; 10: 113-24.
343. Mitchell ML, Hermos RJ. Measurement of thyroglobulin in newborn screening specimens from normal and hypothyroid infants. Clin Endocrinol 1995; 42: 523-7.
344. Smallridge RC, De Keyser FM, Van Herle AJ, Butkus NE, Wartofsky L. Thyroid iodine content and serum thyroglobulin: clues to the natural history of destruction-induced thyroiditis. J Clin Endocrinol Metab 1986; 62: 1213-9.
345. Pacini F, Molinaro E, Lippi F, Castagna MG, Agate L, Ceccarelli C, et al. Prediction of disease status by recombinant human TSH-stimulated serum Tg in the postsurgical follow-up of differentiated thyroid carcinoma. J Clin Endocrinol Metab 2001; 86: 5686-90.
346. Cobin RH. Medullary carcinoma of the thyroid. In: S. D. Cobin RH, editor. Malignant tumors of the thyroid: clinical concepts and controversies. New York: Springer-Verlag; 1992. p. 112-41.
347. Dunn JT. When is a thyroid nodule a sporadic medullary carcinoma? J Clin Endocrinol Metab 1994; 78: 824-5.
348. Pacini F, Fontanelli M, Fugazzola L, Elisei R, Romei C, Di Coscio G, et. al. Routine measurement of serum calcitonin in nodular thyroid diseases allows the preoperative diagnosis of unsuspected sporadic medullary thyroid carcinoma. J Clin Endocrinol Metab 1994; 78: 826-9.
349. Mulligan LM, Kwok JB, Healey CS, Elsdon MJ, Eng C, Gardner E et al. Germ-line mutations of the RET proto-oncogene in multiple endocrine neoplasia type 2A. Nature 1993; 363: 458-60.
350. Hofstra RM, Landvaster RM, Ceccherini I, Stulp RP, Stelwagen T, Luo Y, et al. A mutation in the RET proto-oncogene associated with multiple endocrine neoplasia type 2B and sporadic medullary thyroid carcinoma. Nature 1994; 367: 375-6.
351. Heyningen van V. One gene-four syndromes. Nature 1994; 367: 319-20.
352. Becker KL, Nylen ES, Cohen R, Snider RH. Calcitonin: structure, molecular biology and actions. In: J.P. Beleziakian, L.E. Raisz, G.A. Rodan eds. Principle of bone biology, San Diego: Academic Press; 1996. p. 471-4.
353. Motte P, Vauzelle P, Gardet P, Ghillani P, Caillou B, Parmentier C, et al. Construction and clinical validation of a sensitive and specific assay for mature calcitonin using monoclonal anti-peptide antibodies. Clin Chim Acta 1988; 174: 35-54.
354. Zink A, Blind E, Raue F. Determination of serum calcitonin by immunometric two-site assays in normal subjects and patients with medullary thyroid carcinoma. Eur J Clin Chem Biochem 1992; 30: 831-5.
355. Engelbach M, Gorges R, Forst T, Pfutzner A, Dawood R, Heerdt S, et al. Improved diagnostic methods in the follow-up of medullary thyroid carcinoma by highly specific calcitonin measurements. J Clin Endocrinol Metab 2000; 85: 1890-4.
356. Milhaud G, Tubiana M, Parmentier C and Coutris G. Epithelioma de la thyroide secretant de la thyrocalcitonine. C.R. Acad. Sci (serie D), Paris 1968; 266: 608-10.
357. Guilloteau D, Perdrisot D, Calmettes C, Baulieu JL, Lecomte P, Kaphan G, et. al. Diagnosis of medullary carcinoma of the thyroid by calcitonin assay using monoclonal antibodies. J Clin Endocrinol Metab 1990; 71: 1064-7.
358. Niccoli P, Wion-Barbot N, Caron P, Henry JF, de Micco C, Saint Andre, JP, et.al. Interest of routine measurement of serum calcitonin (CT): study in a large series of thyroidectomized patients. J Clin Endocrinol Metab 1997; 82: 338-41.
359. Wells SA, Baylin SB, Linehan W, Farrell RE, Cox EB, Cooper CW. Provocative agents and the diagnosis of medullary carcinoma of the thyroid gland. Ann Surg 1978; 188: 139-41.
360. Gagel RF. The abnormal pentagastrin test. Clin Endocrinol 1996; 44: 221-2.
361. Wion-Barbot N, Schuffenecker I, Niccoli P, Conte-Devolx B, Lecomte P, et al. Results of the calcitonin stimulation test in normal volunteers compared with genetically unaffected members of MEN 2A and familial medullary thyroid carcinoma families. Ann Endocrinol 1997; 58: 302-8.
362. Barbot N, Calmettes C, Schuffenecker I, Saint-Andre JP, Franc B, Rohmer V, et al. Pentagastrin stimulation test and early diagnosis of medullary carcinoma using an immunoradiometric assay of calcitonin: comparison with genetic screening in hereditary medullary thyroid carcinoma. J Clin Endocrinol Metab 1994; 78: 114-20.
363. Erdogan MF, Gullu S, Baskal N, Uysal AR, Kamel N, Erdogan G. Omeprazole: calcitonin stimulation test for the diagnosis follow-up and family screening in medullary carcinoma of the thyroid gland. Ann Surg 1997; 188: 139-41.
364. Vieira AEF, Mello MP, Elias LLK. Molecular and biochemical screening for the diagnosis and management of medullary thyroid carcinoma in multiple endocrine neoplasia Type 2A. Horm Metab Res 2002; 34: 202-6.
365. Wells SA, Chi DD, Toshima K, Dehner LP, Coffin CM, Dowton SB, et al. Predictive DNA testing and prophylactic thyroidectomy in patients at risk for multiple endocrine neoplasia type 2A. Ann Surg 1994; 220: 237-50.
366. Telander RL, Moir CR. Medullary thyroid carcinoma in children. Semin Pediatr Surg 1994; 3: 188-93.
367. Niccoli-Sire P, Murat A, Baudin E, Henry JF, Proye C, Bigorgne JC, et al. Early or prophylactic thyroidectomy in MEN2/FMTC gene carriers: results in 71 thyroidectomized patients. Eur J Endocrinol 1999; 141: 468-74.
368. Niccoli-Sire P, Murat A, Rohmer V, Franc S, Chabrier G, Baldet L. Familial medullary thyroid carcinoma (FMTC) with non-cysteine RET mutations: phenotype-genotype relationship in large series of patients. J Clin Endocrinol Metab 2001; 86: 3756-53.
369. Body JJ, Chanoine JP, Dumon JC, Delange F. Circulating calcitonin levels in healthy children and subjects with congenital hypothyroidism from birth to adolescence. J Clin Endocrinol Metab 1993; 77: 565-7.
370. Gharib H, Kao PC, Heath H. Determination of silica-purified plasma calcitonin for the detection and management of medullary thyroid carcinoma: comparison of two provocative tests. Mayo Clin Proc 1987; 62: 373-8.
371. Telander R, Zimmerman D, Sizemore GW, van Heerden JA, Grant CS. Medullary carcinoma in children. Results of early detection and surgery. Arch Surg 1989; 124: 841-3.
372. Calmettes C, Ponder BA, Fisher JA, Raue F. Early diagnosis of multiple endocrine neoplasia type 2 syndrome: consensus statement. European community concerted action: medullary thyroid carcinoma. Eur J Clin Invest 1992; 22: 755-60.
373. Modigliani E, Cohen R, Campos JM, Conte-Devolx B, Maes B, Boneu A, et al. Prognostic factors for survival and biochemical cure in medullary thyroid carcinoma: results in 899 patients. Clin Endocrinol 1998; 48: 265-73.
374. Machens A, Gimm O, Ukkat J, Hinze L, Schneyer U, Dralle H, et al. Improved prediction of calcitonin normalization in medullary thyroid carcinoma patients by quantitative lymph node analysis. Cancer 2000; 88: 1909-15.
375. Fugazzola L, Pinchera A, Lucchetti F, Iacconi P, Miccoli P, Puccini M, et al. Disappearence rate of serum calcitonin after total thyroidectomy for medullary thyroid carcinoma. Internat J Biolog Markers 1994; 9: 21-4.
376. Vierhapper H, Raber W, Bieglmayer C, Kasever K, Weinhausl A, Niederli B, et.al. Routine measurement of plasma calcitonin in nodular thyroid diseases. J Clin Endocrinol Metab 1997; 82: 1589-93.
377. Fereira-Valbuena H, Fernandez de Arguello E, Campos G, Ryder E, Avellaneda A. Serum concentration of calcium and calcitonin in hyperthyroidism caused by Graves' disease. Invest Clin 1991; 32: 109-14.
378. Lips CJM, Hoppener JWM, Thijssen JHH. Medullary thyroid carcinoma: role of genetic testing and calcitonin measurement. Ann Clin Biochem 2001; 38: 168-79.
379. Niccoli P, Brunet Ph, Roubicek C, Roux F, Baudin E, Lejeune PJ, et al. Abnormal calcitonin basal levels and pentagastrin response in patients with chronic renal failure on maintenance hemodialysis. Eur J Endocrinol 1995; 132: 75-81.
380. Snider RH, Nylen ES, Becker KL. Procalcitonin and its component peptides in systemic inflammation: immunochemical characterization. J Invest Med 1997; 47: 552-60.
381. Russwurn S, Wiederhold M, Oberhoffer M, Stonans I, Zipfel PF, Reinhart K. Molecular aspects and natural source of Procalcitonin. Clin Chem Lab Med 1999; 37: 789-97.
382. Niccoli P, Conte-Devolx B, Lejeune PJ, Carayon P, Henry JF, Roux F, et al. Hypercalcitoninemia in conditions other than medullary cancers of the thyroid. Ann Endocrinol 1996; 57: 15-21.
383. Baudin E, Bidart JM, Rougier P, Lazar V, Ruffie P, Ropers J, et al. Screening for multiple endocrine neoplasia type 1 and hormonal production in apparently sporadic neuroendocrine tumors. J Clin Endocrinol Metab 1999; 84: 69-75.
384. DeLellis RA. C-Cell hyperplasia. In: Rosai J., Carangiu M.L., DeLellis R.A. eds: Atlas of Tumor Pathology, 3rd. series, Fasc 5: tumors of the thyroid gland. Washington DC, Armed Forces Institute of Pathology; 1992. p. 247-58.
385. Guyetant S, Wion-Barbot N, Rousselet MC. C-cell hyperplasia associated with chronic lymphocytic thyroiditis: a retrospective study of 112 cases. Hum Pathol 1994; 25: 514-21.
386. Albores-SAavedra J, Monforte H, Nadji M, Morales AR. C-Cell hyperplasia in thyroid tissue adjacent to follicular cell tumor. Hum Pathol 1988; 19: 795-9.
387. Mulligan LM, Marsh DJ, Robinson BG, Schuffenecker I, Zedenius J, Lips CJ, et al. Genotype-phenotype correlation in multiple endocrine neoplasia type 2: report of the international RET mutation consortium. J Intern Med 1995; 238: 243-6.
388. Eng C, Clayton D, Schuffenecker I, Lenoir G, Cote G, Gagel RF, et al. The relationship between specific RET proto-oncogene mutations and disease phenotype in multiple endocrine neoplasia type 2. International RET mutation consortium analysis. JAMA 1996; 276: 1575-9.
389. Ito S, Iwashita T, Asai N, Murakami H, Iwata Y, Sobue G, et al. Biological properties of RET with cysteine mutations correlate with multiple endocrine neoplasia type 2A, familial medullary thyroid carcinoma and Hirschsprung's disease phenotype. Cancer Res 1997; 57: 2870-2.
390. Heshmati HM, Gharib H, Khosla S, Abu-Lebdeh HS, Lindor NM, et al. Genetic testing in medullary thyroid carcinoma syndromes: mutation types and clinical significance. Mayo Clin Proc 1997; 72: 430-6.
391. Berndt I, Reuter M, Saller B, Frank-Rane K, Groth P, Grussendorf M, et al. A new hot spot for mutations in the RET proto-oncogene causing familial medullary thyroid carcinoma and multiple endocrine neoplasia type 2A. J Clin Endocrinol Metab 1998; 83: 770-4.
392. Komminoth P, Roth J, Muletta-Feurer S, Saremaslani P, Seelentag WKF, Heitz PU. RET proto-oncogene point mutations in sporadic neuroendocrine tumors. J Clin Endocrinol Metab 1996; 81: 2041-6.
393. Conte-Devolx B, Schuffenecker I, Niccoli P, Maes B, Boneu A, Barbot N, et al. Multiple Endocrine Neoplasia Type 2: Management of patients and subjects at risk. Horm Res 1997; 47: 221-6.
394. Smith DP, Houghton C, Ponder BA. Germline mutation of RET codon 883 in two cases of de novo MEN2B. Oncogene 1997; 15: 1213-7.
395. Carlson KM, Bracamontes J, Jackson CE, Clark R, Lacroix A, Wells SA Jr., et al. Parent-of-origin effects in multiple endocrine neoplasia type 2B. J Hum Genet 1994; 55: 1076-82.
396. Moers AMJ, Landsvater RM, SchAap C, van Veen JM, de Valk IAJ, Blijham GH, et al. Familial medullary thyroid carcinoma: not a distinct entity/ Genotype-phenotype correlation in a large family: familial medullary thyroid carcinoma revisited. Am J Med 1996; 101: 634-41.














