Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Acta bioquímica clínica latinoamericana
Print version ISSN 0325-2957On-line version ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.41 no.2 La Plata Apr./June 2007
INMUNOLOGÍA
La modulación del sistema inmune de mucosas con polisacáridos
Bases para una atractiva alternativa en terapia
Modulation of the mucosal immune system with polysaccharides
Basis for an attractive therapeutic alternative
Carina Porporatto1*, Ismael Darío Bianco2**, Silvia Graciela Correa1*
1. Doctora en Ciencias Químicas
2. Doctor en Ciencias Químicas
* Centro de Investigaciones en Bioquímica Clínica e Inmunología (CIBICI-CONICET), Departamento de Bioquímica Clínica, Facultad de Ciencias Químicas, Universidad Nacional de Córdoba, Córdoba, Argentina.
** Centro de Excelencia en Productos y Procesos de la Provincia de Córdoba (CEPROCOR), Agencia Córdoba Ciencia SE, CONICET, Córdoba, Argentina.
Premio Bienal FABA 2006
Resumen
El sistema inmune de mucosas del intestino presenta propiedades únicas: está expuesto a una gran variedad y cantidad de antígenos, desarrolla una actividad inmunológica permanente y mantiene un microambiente fisiológicamente desviado hacia respuestas anti-inflamatorias. Es capaz de distinguir y neutralizar agentes nocivos y reconocer antígenos inocuos, generando entonces un estado de no respuesta llamado tolerancia oral. Este fenómeno natural representa una forma fisiológica, segura e inocua de manipular las respuestas inmunes, para el tratamiento de enfermedades autoinmunes, inflamatorias o alérgicas. Aquellos compuestos que presenten la habilidad de favorecer la tolerancia permitirían optimizar el desarrollo de nuevos protocolos de inmunointervención. Quitosano (Q) es un polisacárido que abunda en la naturaleza con características fisicoquímicas y biológicas particulares: carece de toxicidad y alergenicidad, es biocompatible y biodegradable, presenta propiedades mucoadhesivas que favorecen el transporte y la absorción de proteínas a través del epitelio. Tiene actividad adyuvante, aumentando los niveles de IgA en la mucosa. Estas características lo convierten en un candidato ideal para la inmunointervención a nivel de mucosas. En este trabajo se describe el mecanismo de acción del Q luego de la administración oral, demostrando por primera vez que Q contribuye a mantener la homeostasis intestinal y a modular a nivel local y sistémico las respuestas inmunes hacia un antígeno proteico. Esta caracterización ayuda a comprender cómo participa un polisacárido en la fina regulación de las respuestas de mucosa y sugiere alternativas de manipulación que permitirán el desarrollo de terapias que requieran de microambientes anti-inflamatorios.
Palabras clave: Quitosano; Mucosa; Tolerancia oral; Artritis
Summary
The mucosal immune system exhibits distinctive traits: it is permanently exposed to an overwhelming amount and variety of antigens; it maintains a continuous immune activity and it sustains a physiological environment biased to anti-inflammatory responses. Although it mounts efficient responses against pathogens, it reacts to innocuous antigens developing the oral tolerance state. Oral tolerance is a natural process that can be safely applied for the treatment of autoimmune, inflammatory or allergic diseases. Compounds able to promote the tolerance phenomenon can be used to optimize the development of alternative therapies. Chitosan (Q) is a natural and abundant polysaccharide with singular biological and physico-chemical properties that make it a good candidate to modulate the mucosal immunity: non toxic, biocompatible and biodegradable, strongly mucoadhesive favoring the transepithelial absorption of proteins and adjuvant, enhancing the levels of IgA to co-administered antigens. This work describes the Q activity mechanism early after its oral administration, for the first time showing, Q´s contribution to the intestinal homeostasis and also its modulation of the immune response to a protein antigen at local and systemic level. These studies will help understand how the intestinal regulatory activity occurs, and develop new therapeutic approaches to stimulate anti-inflammatory environments at mucosal level.
Key words: Chitosan; Mucosal; Oral tolerance; Arthritis
INTRODUCCIÓN
Inmunidad de Mucosas y Tolerancia Oral:
Las superficies mucosas del organismo son la principal barrera contra la permanente carga antigénica del medio ambiente (1)(2). A pesar de esta continua estimulación, el tejido linfoide asociado a mucosas ha desarrollado la sorprendente habilidad de distinguir entre agentes nocivos, a los que neutraliza mediante eficientes mecanismos protectivos, y antígenos inocuos, contra los que no genera respuestas (3)(4). Así por ejemplo, en el tejido linfoide asociado a intestino (GALT) tiene lugar continuamente un evento natural de importancia inmunológica única que es el desarrollo de tolerancia contra una gran variedad y cantidad de antígenos extraños. Como resultado de múltiples procesos, se previene, suprime o desvía una respuesta potencialmente perjudicial hacia una no dañina estableciéndose el estado de tolerancia oral que resulta clave en el mantenimiento de la homeostasis intestinal (5-11).
¿Qué factores condicionan esta capacidad dual de la mucosa? En el tejido linfoide asociado al intestino (GALT) se distinguen sitios inductivos, más estructurados y localizados, en donde los antígenos son procesados y presentados para iniciar la respuesta inmune, tales como placas de Peyer (PP), nódulos linfoides mesentéricos (NLM), apéndice y nódulos linfoides solitarios (2)(12)(13); y sitios efectores, de organización más difusa, en los cuales se localizan las células previamente activadas y diferenciadas que cumplen las funciones efectoras (12) (Fig. 1). La actividad conjunta de los sitios inductivos y efectores genera a nivel de mucosa y suero una respuesta rica en inmunoglobulina A (IgA) y una robusta inmunidad celular con funciones citotóxicas, regulatorias y de memoria (2)(3)(13).
Las proteínas son los principales antígenos que llegan al GALT y son asimiladas por acción gástrica, pancreática o por proteasas del ribete en cepillo, resultando en una mezcla de aminoácidos libres u oligopéptidos cortos que son absorbidos por las células epiteliales intestinales (14). Ciertos productos de proteólisis, o proteínas intactas que escapan de la digestión, alcanzan los sitios inductivos a través de tres vías no excluyentes:
a) El epitelio que tiene, además, una activa participación en la regulación del estado inmunológico de la mucosa intestinal, ya que responde a estímulos provenientes de distintos antígenos expresando genes para quimioquinas y citoquinas (15). Como consecuencia, se reclutan poblaciones celulares que transportan antígenos a los sitios inductivos (1)(16)(17).
b) La célula M, que forma parte de un epitelio intestinal especializado que separa al tejido linfoide del lumen. Esta vía es especialmente eficiente para antígenos particulados (1), ya que las células M endocitan macromoléculas y partículas, incluyendo microorganismos intactos, los transportan en vesículas a la membrana basolateral y los exocitan al espacio intercelular. Desde allí, células presentadoras de antígeno migrarían a los sitios inductivos.
c) Las células dendríticas (CD) de la lámina propia (LP) que son capaces de intercalarse entre el epitelio, abrir las uniones estrechas que se encuentran entre células adyacentes y enviar dendritas hacia afuera como periscopios para captar antígenos directamente desde el lumen intestinal preservando la integridad de la barrera epitelial (18).

Figura 1. Sistema inmune de mucosa.
Los NLM son los mayores del organismo y los primeros en desarrollarse embriológicamente. Se ha determinado que a pocas horas de la administración oral de un antígeno, éste se localiza en los NLM (19). La contribución de estos tejidos linfoides a la tolerancia oral es indiscutida y se ha demostrado que puede inducirse tolerancia sin PP pero no en ausencia de NLM (20).
Luego del contacto inicial con el antígeno en los sitios inductivos, los linfocitos T y B se activan, proliferan y diferencian para migrar a distintos sitios efectores como LP, o el epitelio intestinal, en el que se sitúa una población única de linfocitos intraepiteliales. En estos sitios del GALT se localiza el 80% de las células B activadas del organismo, y un 80 a 90% de éstas se diferencia a células plasmáticas productoras de IgA (21). Aquí, los linfocitos T son predominantemente células con fenotipo de memoria e incrementada expresión de marcadores de activación, indicando que han tenido un contacto previo con el antígeno (22)(23). Las células T CD8+ de LP presentan una potente actividad citotóxica (24) mientras que las células T CD4+ mayoritariamente cumplen funciones regulatorias manteniendo la tolerancia local hacia los antígenos ambientales (25). En la LP se encuentra también un abundante número de CD y macrófagos, que además de participar en la captación y presentación de antígenos, contribuyen a la homeostasis intestinal y al control de respuestas inflamatorias locales (26-28).
Además de esta dinámica organización del GALT en estructuras con funciones claramente delimitadas, muchos otros factores contribuyen a la capacidad de discriminar entre respuestas a patógenos y tolerancia, y la manipulación de éstos es clave en el desarrollo de nuevas estrategias de inmunointervención en la mucosa (3)(7)(29). La inducción de tolerancia oral depende de distintos factores: de la naturaleza del antígeno, resultando muy favorable con antígenos proteicos, lo que refleja la base fisiológica del fenómeno (30); la dosis y frecuencia de incorporación del antígeno (31-33); la cinética de captación, ya que el tiempo de permanencia del antígeno relevante en contacto con el sistema inmune es clave en la inducción de tolerancia (6)(34); la base genética y edad del huésped, ya que existe distinta susceptibilidad dependiendo de la edad y de la madurez del sistema inmune. Esto se correlaciona con el hecho de que las alergias alimentarias se dan en mayor medida en niños en la primera infancia (35)(36) y el microambiente intestinal que en condiciones fisiológicas es particularmente rico en citoquinas anti-inflamatorias como IL-10 y TGF-b esenciales para la diferenciación a células regulatorias y la producción de IgA (37). La liberación de factores inflamatorios como IL-18, IL-12 e IL-1 que acompaña a los procesos infecciosos bloquea la inducción de tolerancia (36)(37).
Recientemente se ha demostrado que además de las propiedades intrínsecas del antígeno o de la inmunocompetencia del huésped, otros elementos estrictamente aportados por el medio ambiente son esenciales en la inducción de la tolerancia y por lo tanto en la homeostasis intestinal. La flora comensal contribuye a la tolerancia a través de la liberación de factores inmunomoduladores, como componentes bacterianos de naturaleza polisacarídica que participan en la maduración del sistema inmune de mucosas (38), o que, como el polisacárido PSA del Bacteroides fragilis, regulan el balance de citoquinas inflamatorias/anti-inflamatorias (39). Los receptores de la inmunidad innata como los receptores tipo TOLL (TLR) expresados en epitelio y células inmunes, reconocen una multiplicidad de ligandos presentes en el lumen (40) y en condiciones fisiológicas esta señalización protege a la barrera intestinal y confiere tolerancia a la flora comensal (41). Alteraciones en las señales vía TLR favorecen respuestas inflamatorias exacerbadas que llevarían a procesos patológicos a nivel intestinal como la enfermedad de Bowel (40).
Los mecanismos de tolerancia no son mutuamente excluyentes y coexisten (2)(5-8)(34)(42): puede estar mediada por Deleción de células T, que ocurre luego de la administración de altas dosis del antígeno, y lleva a la eliminación clonal de células T CD4+ por apoptosis (43). Cuando los antígenos se presentan a los linfocitos T en ausencia de señales coestimulatorias (44) se produce la Anergia de células T. Las células anérgicas pueden retener otras funciones como la producción de citoquinas, incluyendo IL-4 e IL-10 (8)(45) y podrían a su vez actuar como células regulatorias (46)(47). Con bajas dosis del antígeno se induce la llamada Supresión activa que está mediada por células regulatorias que suprimen la actividad de células T específicas para el antígeno relevante. Este mecanismo también puede operar de manera bystander con efectos no específicos, suprimiendo otras células presentes en el entorno independientemente de su especificidad (42). Las células regulatorias que son centrales en el estado de tolerancia oral pueden tener distintas características fenotípicas y funcionales, y en el GALT se han descripto las células regulatorias naturales CD4+CD25+ de origen tímico, y las células regulatorias Th3 y TR1, inducidas luego del contacto con antígenos exógenos (7)(8)(48-50).
La inmunidad de mucosas puede ser modulada por distintos elementos exógenos que favorecen el desarrollo de respuestas, como ocurre con vacunas orales o en la inducción de la tolerancia oral. La administración de IL-4/IL-10 o lipopolisacáridos junto a un antígeno o la incorporación del mismo usando múltiples sistemas de transportes, como liposomas o ácido poli-láctico-glicólico pueden incrementar la tolerancia oral (37)(51)(52). Por otro lado, adyuvantes de mucosa como la toxina colérica favorecen respuestas de tipo inflamatorias bloqueando el desarrollo de tolerancia (53).
El polisacárido Quitosano
Un candidato interesante para la inmunomodulación de las respuestas de mucosas es el polisacárido Quitosano (Q). Deriva de la quitina, el biopolímero más abundante en la naturaleza después de la celulosa, y forma parte del exoesqueleto de crustáceos e insectos (54) y de la pared celular de algunos microorganismos como levaduras y hongos (55). Por deacetilación alcalina de quitina se obtienen polímeros de N-acetil-D-glucosamina de distintos pesos moleculares y diferente grado de deacetilación lo que le confiere propiedades particulares. Debido a que carece de toxicidad y alergenicidad posee numerosas aplicaciones en farmacia, medicina y veterinaria (56-58).
Este polímero es ampliamente utilizado en investigación bioquímica como sistema de transporte de drogas, péptidos, proteínas, vacunas y ADN debido a sus propiedades mucoadhesivas naturales (59-61). A nivel de mucosa, Q interactúa con el epitelio intestinal incrementando el transporte paracelular y aumentando la captación de antígenos del lumen (55)(62-64). El mayor ingreso de antígenos favorece el contacto con el sistema inmune lo que aumenta la respuesta inmune local y sistémica: antígenos co-administrados o encapsulados con Q inducen mayores niveles de anticuerpos aunque el mecanismo involucrado no ha sido descripto (65-68). Este polisacárido también se ha utilizado como fibra dietaria produciendo cambios en la flora intestinal y en el microambiente de la mucosa (69)(70). Como componente de la pared de hongos y parásitos, Q puede actuar como ligando de los receptores de la inmunidad innata aportando señales que participen de la homeostasis intestinal o a través de la activación de macrófagos de la inmunidad innata (71) lo que explicaría su acción adyuvante (72)(73). A pesar de todas estas propiedades que lo convierten en un candidato natural para la inmunomodulación de las respuestas de mucosas, el mecanismo de la actividad de Q es poco conocido y resulta relevante conocer cómo un polisacárido abundante en la naturaleza puede participar en la homeostasis intestinal. En este trabajo se estudió la actividad biológica del Q sobre el sistema inmune intestinal utilizando distintas estrategias.
Actividad local y sistémica de Q en tejidos linfoides luego de la administración oral
Los procesos inmunes que tienen lugar en los tejidos mucosos son distintos a los mecanismos convencionales de la inmunidad innata y específica (1). Como ya se mencionó, las superficies mucosas están continuamente expuestas al medio externo y a una gran diversidad de antígenos de la flora comensal, alimentos y patógenos (2)(3)(7). A pesar de ello, en estos tejidos ocurre el desvío de las respuestas inmunes hacia respuestas regulatorias o anti-inflamatorias (1)(9). Se ha observado que en forma temprana, Q contacta con células del epitelio intestinal estimulando un incremento en quimioquinas y citoquinas, las cuales determinan el reclutamiento de células presentadoras de antígeno principalmente células dendríticas CD11b/c+ y CD103+ a los sitios inductivos, como PP y NLM (74). Estas células captarían el polisacárido a través del receptor de manosa y sufrirían una activación no inflamatoria. En efecto, en estas condiciones experimentales, se pudo observar que Q es un potente inductor de la vía de activación alternativa de macrófagos, caracterizada por la expresión de la enzima arginasa (75), y de la producción de citoquinas anti-inflamatorias que regulan y limitan los procesos inflamatorios durante la injuria y las infecciones (76)(77).
Las CD que han captado el Q presentan el típico fenotipo inmaduro de las células residentes aunque incrementan los niveles de antígenos del complejo mayor de histocompatibilidad tipo II pero sin cambios en la expresión de moléculas coestimulatorias como las CD80 y CD86 (74). La llegada de Q a la mucosa intestinal induce mayoritariamente el incremento de citoquinas inmunoreguladoras/supresoras como IL-4, IL-10 y TGF-b, disminuyendo los niveles de otras citoquinas inflamatorias (74). Estos eventos que condicionan el microambiente se acompañan de la activación transitoria de células T que aumentan la producción de IL-10, una de las señales regulatorias más potentes de las respuestas de mucosas. Por lo tanto, este polisacárido consistentemente incrementa los fenómenos naturales que ocurren a nivel de la mucosa, potenciando un microambiente con características tolerogénicas.
Actividad local y sistémica del Q co-administrado con antígenos proteicos
En la inducción de la tolerancia oral, los eventos tempranos son cruciales (6), ya que dentro de las 24 h de administrado, el antígeno atraviesa el epitelio intestinal, es procesado por células presentadoras e inicia la anergia y la deleción de las células específicas (78). Se ha observado que Q reduce la digestión por enzimas digestivas de proteínas muy utilizadas en protocolos de tolerancia oral como colágeno tipo II (CII). Esta protección sería ventajosa en la inducción de tolerancia oral a antígenos de interés ya que favorecería la presentación del antígeno conservado al sistema inmune luego del paso por el tracto digestivo (79). Durante el contacto inicial con el sistema inmune, luego de 16 horas de la co-administración de Q y CII se observó que células de PP emigran posiblemente hacia NLM, el sitio más importante en la inducción de tolerancia oral (20). En paralelo, a nivel sistémico se observa un incremento en la población de células T CD3+ a nivel de bazo (79). Estas células que llegan presentan un fenotipo activado y producen niveles reducidos de IL-2 en respuesta a estímulación antigénica, rasgos característicos del estado de anergia que suele preceder a la diferenciación en una célula regulatoria. Además, la administración de CII:Q incrementa la expresión y liberación de citoquinas inmunosupresoras como IL-4, IL-10 y TGF-b en el momento en que el antígeno está siendo presentado a los linfocitos. Este efecto se incrementa notablemente si se condiciona previamente la mucosa con la administración repetida del polisacárido durante varios días. En estas condiciones se evidencia un aumento de poblaciones celulares con características de regulatorias como linfocitos T CD3+IL-10+ y linfocitos T CD4+ CD25+ CTLA4+, a nivel local y sistémico. En base a estos hallazgos se concluyó que Q modula el contacto inicial del antígeno con la mucosa intestinal, promueve la migración de células a nivel sistémico, regula el microambiente de la mucosa intestinal y favorece respuestas inmunosupresoras ricas en citoquinas anti-inflamatorias. Estas citoquinas estimulan el aumento y diferenciación de células con características regulatorias a nivel local y sistémico (Fig. 2).
Efecto de la co-administración de CII:
Q en la inducción de tolerancia oral en un modelo de artritis inducida por CII
La tolerancia oral antígeno-específica puede ser efectiva en enfermedades autoinmunes aún cuando se desconozca el autoantígeno involucrado debido a la supresión bystander mediada por citoquinas supresoras (7)(8) y este mecanismo ha sido demostrado en varios modelos experimentales de enfermedades autoinmunes (80-83). Debido a las propiedades tolerogénicas de Q per se y a los efectos observados tempranamente luego de la co-administración con CII, se intentó modular el curso de artritis inducida por CII en animales de experimentación mediante la ingesta de CII:Q. El tratamiento produjo cambios sistémicos propios de los estados de tolerancia, con una significativa disminución de las manifestaciones clínicas y de los niveles de IgG2a anti CII, un anticuerpo fijador de complemento que suele considerarse un marcador de la severidad de la enfermedad. Estas mejorías podrían estar mediadas en parte, por la mayor proporción de células CD3+IL-10+ que se encuentran en nódulos linfáticos sistémicos y bazo de animales tratados con CII:Q.
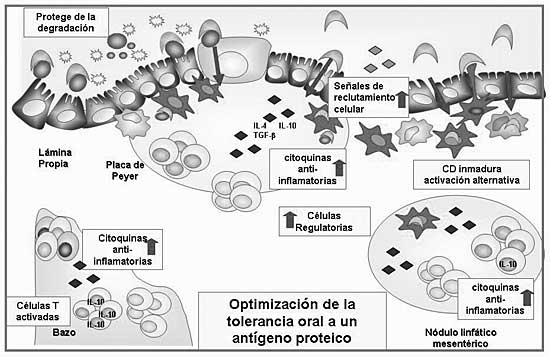
Figura 2. Modelo teórico propuesto.
CONCLUSIONES
El sistema inmune de mucosas es único: tiene una exposición continua a una gran variedad y cantidad de antígenos, desarrolla una elevada actividad inmunológica y mantiene una fina regulación que repercute tanto a nivel local como sistémico. Estas propiedades particulares se desarrollaron bajo una gran presión evolutiva. Si bien se han descripto señales que desencadenan respuestas inflamatorias en la mucosa intestinal, las señales naturales que podrían contribuir a la homeostasis no han sido caracterizadas completamente (84). Los resultados obtenidos en este trabajo de investigación podrían contribuir a definir estas señales. La ingesta de Q contribuye eficientemente a mantener la homeostasis intestinal, y a modular las respuestas inmunes hacia un antígeno relevante. A pesar de que los compuestos quitinosos no son producidos por mamíferos, en macrófagos se expresan quitinasas con capacidad para degradarlos, cuya función fisiológica no se ha determinado aún (85). Las quitinasas de células del GALT podrían ser relevantes en la generación de señales que contribuyen al mantenimiento de un microambiente fuertemente desviado a citoquinas anti-inflamatorias. Así por ejemplo, en procesos alérgicos de tipo asmáticos, en los que el sistema inmune de mucosas está desregulado, se observa un incremento significativo de quitinasas en pacientes y modelos experimentales (86). Organismos menos desarrollados como el Vibrio cholerae, utilizan la asociación a compuestos quitinosos como mecanismo para resistir la degradación en el medio ácido estomacal, adquirir la resistencia a ciertos antibióticos y regular las respuestas inflamatorias generadas en su contra, permitiéndole la colonización del epitelio intestinal (87)(88).
Una gran cantidad de estudios se ha centrado en la inducción de tolerancia oral luego del hallazgo de que la administración de autoantígenos previno o suprimió la actividad patogénica en modelos animales de artritis y esclerosis múltiple (80)(89-91). El tratamiento de estas enfermedades es dificultoso debido a que la etiología es generalmente desconocida y los tratamientos actuales producen un control parcial de la enfermedad, no previenen la destrucción tisular y presentan efectos colaterales no deseados, lo cual limita su uso en el tiempo (92-94). Además, la tolerancia oral también ha mostrado efectos beneficiosos en varias patologías no-autoinmunes de naturaleza inflamatoria o alérgica (5)(7)(8).
Los resultados favorables obtenidos en modelos experimentales estimularon la implementación de la tolerancia oral como alternativa, aunque los ensayos clínicos han mostrado resultados variados (95-98). Si bien la tolerancia oral representa un estado fisiológico de regulación de las respuestas inmunes, y constituiría una terapia segura, inocua y de bajo costo para enfermedades autoinmunes, sus alcances no han sido siempre satisfactorios. Las diferencias obtenidas podrían atribuirse a varios factores, como una escasa llegada de antígeno, el uso de medicación durante el tratamiento y las particularidades del sistema inmune de mucosas de roedores y de los humanos (9)(93). Es por ello que el estudio de nuevos compuestos como moduladores de la tolerancia podría contribuir a la optimización de esta estrategia de inmunoterapia.
La caracterización de los eventos moleculares que ocurren en la mucosa luego del contacto con un polisacárido de amplia distribución, ayudará a definir las señales que desde el lumen participan en la maduración, diferenciación y mantenimiento del sistema inmune de mucosas. Comprender cómo se lleva a cabo esta compleja regulación permitirá el desarrollo de posibles terapias que requieran de microambientes desviados hacia perfiles de respuesta anti-inflamatoria/regulatoria.
Correspondencia
DRA. CARINA PORPORATTO
Inmunología, CIBICI (CONICET)
Departamento de Bioquímica Clínica
Facultad de Ciencias Químicas.
Universidad Nacional de Córdoba
Ciudad Universitaria. 5000 CÓRDOBA, Argentina
Fax: 54 351 4333048.
E-mail: cporporatto@bioclin.fcq.unc.edu.ar.
Referencias bibliográficas
1. Neutra MR, Mantis NJ, Kraehenbuhl JP. Collaboration of epithelial cells with organized mucosal lymphoid tissues. Nat Immunol 2001; 2 (11): 1004-9.
2. Mowat AM. Anatomical basics of tolerance and immunity to intestinal antigens. Nat Rev Immunol 2003; 3 (4): 331-41.
3. Mayer L. Mucosal Immunity. Pediatrics 2003; 111 (6 Pt 3): 1595-600.
4. MacDonald TT, Monteleone G. Immunity, inflammation and allergy in the gut. Science 2005; 25; 307 (5717): 1920-5.
5. Weiner HL. Oral tolerance: immune mechanisms and treatment of autoimmune diseases. Immunol. Today 1997; 18 (7): 335-43.
6. Strobel S, Mowat AM. Immune response to dietary antigens: oral tolerance. Immunol Today 1998; 19 (4): 173-81.
7. Mayer L, Shao L. Therapeutic potential of oral tolerance. Nat Rev Immunol 2004, 4 (6): 407-19.
8. Faria AM, Weiner HL. Oral tolerance. Immunol Rev 2005; 206: 232-59.
9. MacDonald TT, Monteleone G. IL-12 and Th1 immune responses in human Peyer's patches. Trends Immunol 2001; 22 (5): 244-7.
10. Weiner HL. The mucosal milieu creates tolerogenic dendritic cells and T(R)1 and T(H)3 regulatory cells. Nat Immunol 2001; 2 (8): 671-2.
11. Weiner HL. Current issues in the treatment of human diseases by mucosal tolerance. Ann NY Acad Sci 2004; 1029: 211-24.
12. Kelsall B, Strober W. Gut-associated lymphoid Tissue. Antigen handling and T-lymphocyte responses. In: Ogra P (Eds). Mucosal Immunology. San Diego: Academic Press; 1999.
13. McGhee JR. The Mucosal Immune System. In: Fundamental Immunology. Paul WE (Ed). 4th edition, Philadelphia: Lippincott Williams & Wilkins; 1999.
14. Erickson RH, Kim YS. Digestion and absorption of dietary protein. Annu Rev Med 1990; 41: 33-9.
15. Nagler-Anderson C. Man the barrier! Strategic defenses in the intestinal mucosa. Nat Rev Immunol 2001; 1 (1): 59-67.
16. Clayburgh DR, Shen L, Turner JR. A porous defense: the leaky epithelial barrier in intestinal disease. Lab Invest 2004; 84 (3): 282-91.
17. Otte JM, Cario E, Podolsky DK. Mechanisms of cross hyporesponsiveness to toll like-receptor bacterial ligands in intestinal epithelial cells. Gastroenterology 2004; 126 (4): 1054-70.
18. Rescigno M, Urbano M, Valzasina B, Francolini M, Rotta G, Bonasio R, et al. Dendritic cells express tight juntions proteins and penetrate gut epithelial monolayer to sample bacteria. Nat Immunol 2001; 2 (4): 361-7.
19. Williamson E, O'Malley JM, Viney JL. Visualizing the T-cell responses elicited by oral administration of soluble protein antigens. Immunology 1999; 97 (4): 565-72.
20. Spahn TW, Weiner HL, Rennert PD, Lugering N, Fontana A, Domschke W, et al. Mesenteric lymph nodes are critical for the induction of high dose oral tolerance in the absence of Peyer´s patches. Eur J Immunol 2002; 32 (4): 1109-13.
21. Brandtzaeg P, Baekkevold ES, Morton HC. From B to A the mucosal way. Nat Immunol 2001; 2 (12): 1093-4.
22. James SP. Mucosal T-cell function. Gastroenterol Clin North Am 1991; 20 (3): 597-612.
23. Zeitz M, Ullrich R, Schneider T, Schieferdecker HL, Riecken EO. Cell differentiation and proliferation in the gastrointestinal tract with respect to the local immune system. Ann NY Acad Sci 1994; 733: 75-86.
24. James SP, Kiyono H. Gastrointestinal lamina propria T cells. In: P. Ogra (Ed), Mucosal Immunoly, San Diego: Academic Press; 1999.
25. Khoo UY, Proctor IE, Macpherson AJ. CD4+ T cell down-regulation in human intestinal mucosa: evidence for intestinal tolerance to luminal bacterial antigens. J Immunol 1997; 158 (8): 3626-34.
26. Smith PD, Ochsenbauer-Jambor C, Smythies LE. Intestinal macrophages: unique effector cells of the innate immune system. Immunol Rev 2005; 206: 149-59.
27. Smythies LE, Sellers M, Clements RH, Mosteller-Barnum M, Meng G, Benjamin WH, et al. Human intestinal macrophages display profound inflammatory anergy despite avid phagocytic and bacteriocidal activity. J Clin Invest 2005; 115 (1): 66-75.
28. Chirdo FG, Millington OR, Beacock-Sharp H, Mowat AM. Immunomodulatory dendritic cells in intestinal lamina propria. Eur J Immunol 2005; 35 (6): 1831-40.
29. Weiner HL. Oral tolerance, an active immunologic process mediated by multiple mechanisms. J Clin Invest 2000; 106 (8):935-7.
30. Peng HJ, Chang ZN, Han SH, Won MH, Huang BT. Chemical denaturation of ovalbumin abrogates the induction of oral tolerance of specific IgG antibody and DTH responses in mice. Scand J Immunol 1995; 42 (3): 297-304.
31. Mowat AM, Strobel S, Drummond HE, Ferguson A. Immunological response to fed protein antigens in mice. Immunology 1982; 45 (1): 105-13.
32. Friedman A, Weiner HL. Induction of anergy or active suppression following oral tolerance is determined by antigen dosage. Proc Natl Acad Sci USA 1994; 91 (14): 6688-92.
33. Meyer AL, Benson JM, Gienapp IE, Cox KL, Whitacre CC. Supression of murine chronic relapsing autoimmune encephalomyelitis by oral administration of myelin basis protein. J Immunol 1996; 157 (9): 4230-8.
34. Mowat AM, Weiner HL. Oral tolerance: Physiological basics and clinical applications. In: Ogra P (Ed). Mucosal Immunology. San Diego: Academic Press; 1999.
35. Miller A, Lider O, Abramsky O, Weiner HL. Orally administered myelin basics protein in neonates primes for immune responses and enhances experimental autoimmune encephalomyelitis in adult animals. Eur J Immunol 1994; 24 (5): 1026-32.
36. Williamson E, Westrich GM, Viney JL. Modulating dendritic cells to optimize mucosal immunization protocols. J Immunol 1999b; 163 (7): 3668-75.
37. Slavin AJ, Maron R, Weiner HL. Mucosal administration of IL-10 enhances oral tolerance in autoimmune encephalomyelitis and diabetes. Int Immunol 2001; 13 (6): 825-33.
38. Dubois B, Goubier A, Joubert G, Kaiserlian D. Oral tolerance and regulation of mucosal immunity. Cell Mol Life Sci 2005; 62 (12): 1322-32.
39. Mazmanian SK, Liu CH, Tzianabos AO, Kasper DL. An immunomodulatory molecule of symbiotic bacteria directs maturation of the host immune system. Cell 2005; 122 (1): 107-18.
40. Cario E. Bacterial interactions with cells of the intestinal mucosa: Toll-like receptors and NOD2. Gut 2005; 54 (8): 1182-93.
41. Abreu MT, Fukata M, Arditi M. TLR signaling in the gut in health and disease. J Immunol 2005; 174 (8): 4453-60.
42. Garside P, Mowat AM. Oral tolerance. Semin Immunol 2001; 13 (3): 177-85.
43. Chen Y, Inobe J, Marks R, Gonnella P, Kuchroo VK, Weiner HL. Peripheral deletion of antigen-reactive T cells in oral tolerance. Nature 1995; 376 (6536): 177-80.
44. Whitacre CC, Gienapp IE, Orosz CG, Bitar DM. Oral tolerance in experimental autoimmune encephalomyelitis. III. Evidence for clonal anergy. J Immunol 1991; 147 (7): 2155-63.
45. Ryan KR, Evavold BD. Persistence of peptide-induced CD4+ T cell anergy in vitro. J Exp Med 1998; 187 (1): 89-96.
46. Lombardi G, Arnold K, Uren J, Marelli-Berg F, Hargreaves R, Imami N, et al. Antigen presentation by interferon-gamma-treated thyroid follicular cells inhibits interleukin-2 (IL-2) and supports IL-4 production by B7-dependent human T cells. Eur J Immunol 1997; 27 (1): 62-71.
47. Thornton AM, Shevach EM. CD4 + CD25 + immunoregulatory T cells suppress polyclonal T cell activation in vitro by inhibiting interleukin 2 production. J Exp Med 1998; 188 (2): 287-96.
48. Shevach EM. CD4+ CD25+ suppressor T cells: more questions than answers. Nat Rev Immunol 2002; 2 (6): 389-400.
49. Bluestone JA, Abbas AK. Natural versus adaptive regulatory T cells. Nat Rev Immunol 2003; 3 (3): 253-7.
50. von Herrath MG, Harrison LC. Antigen-induced regulatory T cells in autoimmunity. Nat Rev Immunol 2003; 3 (3): 223-32.
51. Masuda K, Horie K, Suzuki R, Yoshikawa T, Hirano K. Oral delivery of antigens in liposomes with some lipid compositions modulates oral tolerance to the antigens. Microbiol Immunol 2002; 46 (1): 55-8.
52. Kim WU, Lee WK, Kim SH, Kim J, Youn J, Min SY, et al. Suppression of collagen-induced arthritis by single administration of poly(lactic-co-glycolic acid) nanoparticles entrapping type II collagen. Arthritis Rheum 2002; 46 (4): 1109-20.
53. Holmgren J, Czerkinsky C, Eriksson K, Mharandi A. Mucosal immunisation and adjuvants: a brief overview of recent advances and challenges. Vaccine 2003; 21 Suppl 2: S89-95.
54. Muzzarelli RA, Mattioli-Belmonte M, Pugnaloni A, Biagini G. Biochemistry, histology and clinical uses of chitins and chitosans in wound healing. EXS 1999; 87: 251-64
55. Illum L, Jabbal-Gill I, Hinchcliffe M, Fisher AN, Davis SS. Chitosan as a novel nasal delivery system for vaccines. Adv Drug Deliv Rev 2001; 51 (1-3): 81-96.
56. Illum L. Chitosan and its use as a pharmaceutical excipient. Pharm Res 1998; 15 (9): 1326-31.
57. Paul W, Sharma CP. Chitosan, a drug carrier for the 21st century: a review. STP Pharma Sci 2000; 10: 5-22.
58. Suh JK, Matthew HW. Application of chitosan-based polysaccharide biomaterials in cartilage tissue engineering: a review. Biomaterials 2000; 21 (24): 2589-9.
59. Thanou M, Verhoef JC, Junginger HE. Oral drug absorption enhancement by chitosan and its derivatives. Adv Drug Deliv Rev 2001; 52 (2): 117-26.
60. Bacon A, Makin J, Sizer PJ, Jabbal-Gill I, Hinchcliffe M, Illum L, et al. Carbohydrate biopolymers enhance antibody responses to mucosally delivered vaccine antigens. Infect Immunol 2000; 68 (10): 5764-70.
61. Senel S, McClure SJ. Potential applications of chitosan in veterinary medicine. Adv Drug Deliv Rev 2004; 56 (10): 1467-80.
62. Artursson P, Lindmark T, Davis SS, Illum L. Effect of chitosan on the permeability of monolayers of intestinal epithelial cell (Caco-2). Pharm Res 1994; 11(9): 1358-61.
63. Borchard G. Chitosans for gene delivery. Adv Drug Deliv Rev 2001; 52 (2): 145-50.
64. Dodane V, Khan AM, Merwin JR. Effect of chitosan on epithelial permeability and structure. Int J Pharm 1999; 182 (1): 21-32.
65. van der Lubben IM, Verhoef JC, Borchard G, Junginger HE. Chitosan for mucosal vaccination. Adv Drug Deliv Rev 2001; 52 (2): 139-44.
66. van der Lubben IM, Verhoef JC, Borchard G, Junginger HE. Chitosan and its derivatives in mucosal drug and vaccine delivery. Eur J Pharm Sci 2001; 14 (3): 201-7.
67. Jabbal-Gill I, Fisher AN, Rappuoli R, Davis SS, Illum L. Stimulation of mucosal and systemic antibody responses against Bordetella pertussis filamentous haemagglutinin and recombinant pertussis toxin after nasal administration with chitosan in mice. Vaccine 1998; 16 (20): 2039-46.
68. Moschos S, Bramwell V, Somavarapu S, Alpar H. Adjuvant synergy: The effects of nasal coadministration of adjuvants. Immunol Cell Biol 2004; 82 (6): 628-37.
69. Sugano M, Watanabe S, Kishi A, Izume M, Ohtakara A. Hypocholesterolemic action of chitosans with different viscosity in rats. Lipids 1988; 23 (3):187-91.
70. Lim BO, Yamada K, Nonaka M, Kuramoto Y, Hung P, Sugano M. Dietary fibers modulate indices of intestinal immune function in rats. J Nutr 1997; 127 (5): 663-7.
71. Peluso G, Petillo O, Ranieri M, Santin M, Ambrosio L, Calabro D, et al. Chitosan-mediated stimulation of macrophage function. Biomaterials 1994; 15 (15): 1215-20.
72. Nishimura K, Nishimura S, Nishi N, Saiki I, Tokura S, Azuma I. Immunological activity of chitin and its derivatives. Vaccine 1984; 2 (1): 93-9.
73. Johnson AG. Molecular adjuvants and immunomodulators: new approaches to immunization. Clin Microbiol Rev 1994; 7 (3): 277-89.
74. Porporatto C, Bianco ID, Correa SG. Local and systemic activity of the polysaccharide chitosan at lymphoid tissues after oral administration. J Leuk Biol 2005; 78 (1): 62-9.
75. Porporatto C, Bianco ID, Riera CM, Correa SG. Chitosan induces differents L-arginine metabolic pathways in resting and inflammatory macrophages. Bioch Bioph Res Com 2003; 304 (2): 266-72.
76. Gordon S. Alternative activation of macrophages. Nature Rev Immunol 2003; 3 (1): 23-35.
77. Bronte V, Zanovello P. Regulation of immune responses by L-arginine metabolism. Nat Rev Immunol 2005; 5 (8): 641-54.
78. Benson JM, Campbell KA, Guan Z, Gienapp IE, Stuckman SS, Forsthuber T, et al. T-cell activation and receptor down-modulation precede deletion induced by mucosally administered antigen. J Clin Invest 2000; 106 (8): 1031-8.
79. Porporatto C, Bianco ID, Cabanillas AM, Correa SG. Early events associated to the oral coadministration of type II collagen and chitosan: induction of anti-inflammatory cytokines. Int Immunol 2004; 16 (3): 433-41.
80. Zhang ZY, Lee CS, Lider O, Weiner HL. Suppression of adjuvant arthritis in Lewis rats by oral administration of type II collagen. J Immunol 1990; 145 (8): 2489-93.
81. Miller A, Al-Sabbagh A, Santos LM, Das MP, Weiner HL. Epitopes of myelin basic protein that trigger TGF-a release following oral tolerization are distinct from encephalito-genic epitopes and mediate epitope driven bystander suppression. J Immunol 1993; 151(12): 7307-15.
82. Yoshino S. Antigen-induced arthritis in rats is suppressed by the inducing antigen administered orally before, but not after immunization. Cell Immunol 1995; 163 (1): 55-8.
83. von Herrath MG, Dyrberg T, Oldstone MB. Oral insulin treatment suppresses virus-induced antigen-specific destruction of beta cells and prevents autoimmune diabetes in transgenic mice. J Clin Invest 1996; 98 (6): 1324-31.
84. Wills-Karp M, Karp CL. Chitin checking: novel insights into asthma. N Engl J Med 2004; 351 (14): 1455-7.
85. Boot RG, Blommaart EF, Swart E, Ghauharali-van der Vlugt K, Bijl N, Moe C, et al. Identification of a novel acidic mammalian chitinase distinct from chitotriosidase. J Biol Chem 2001; 276 (9): 6770-8.
86. Zhu Z, Zheng T, Homer RJ, Kim YK, Chen NY, Cohn L, et al. Acidic mammalian chitinase in asthmatic Th2 inflammation and Il-13 pathway activation. Science 2004; 304 (5677): 1678-82.
87. Meibom KL, Li XB, Nielsen AT, Wu CY, Roseman S, Schoolnik GK. The Vibrio cholerae chitin utilization program. Proc Natl Acad Sci USA 2004; 101 (8): 2524-9.
88. Bartlett DH, Azam F. Microbiology. Chitin, cholera, and competence. Science 2005; 310 (5755): 1775-7.
89. Courtenay JS, Dallman MJ, Dayan AD, Martín A, Mosedale B. Immunization against heterologous type II collagen induces arthritis in mice. Nature 1980; 283 (5748): 666-8.
90. Thompson HS, Staines NA. Gastric administration of type II collagen delays the onset and severity of collagen-induced arthritis in rats. Clin Exp Immunol 1986; 64 (3): 581-6.
91. Nagler-Anderson C, Bober LA, Robinson ME, Siskind GW, Thorbecke JG. Suppression of type II collagen-induced arthritis by intragastric administration of soluble type II collagen. Proc Natl Acad Sci USA 1986; 83 (19): 7443-6.
92. Diamond B, Bluestone J, Wofsy D. The immune tolerance network and rheumatic disease. Arthritis Rheum 2001; 44 (8): 1730-5.
93. Postlethwaite AE. Can we induce tolerance in rheumatoid arthritis? Curr Rheumatol Rep 2001; 3 (1): 64-9.
94. Toussirot EA. Oral tolerance in the treatment of Rheumatoid Arthritis. Curr Drug Targets Inflamm Allergy 2002; 1 (1): 45-52.
95. Barnett ML, Combitchi D, Trentham DE. A pilot trial of oral type II collagen in the treatment of juvenile rheumatoid arthritis. Arthritis Rheum 1996; 39 (4): 623-8.
96. Trentham DE, Dynesius-Trentham RA, Orav EJ, Combitchi D, Lorenzo C, Sewell KL, et al. Effects of oral administration of type II collagen on rheumatoid arthritis. Science 1993; 261 (5129): 1727-30.
97. Ausar SF, Beltramo DM, Castagna LF, Quintana S, Silvera E, Kalayan G, et al. Treatment of rheumatoid arthritis by oral administration of bovine tracheal type II collagen. Rheumatol Int 2001b; 20 (4): 138-44.
98. Myers LK, Higgins GC, Finkel TH, Reed AM, Thompson JW, Walton RC, et al. Juvenile arthritis and autoimmunity to type II collagen. Arthritis Rheum 2001; 44 (8): 1775-81. [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ]
Aceptado para su publicación el 15 de mayo de 2007














