Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. v.41 n.2 La Plata abr./jun. 2007
HEMOSTASIA Y TROMBOSIS
Evaluación de inhibidores fisiológicos de la coagulación en pacientes diabéticos tipo 2
Evaluation about coagulation physiological inhibitors in type 2 diabetic patients
Ana Lena1*, Stella Raymondo2**
1. Doctora Química Farmacéutica.
2. Doctora Química Farmacéutica.
* Hospital Central de las Fuerzas Armadas. Avda. Centenario 3050. 11600 Montevideo, Uruguay.
** Hospital Maciel. 25 de Mayo 174. 91.000 Montevideo, Uruguay.
Resumen
La diabetes mellitus está asociada a disturbios en la hemostasis que pueden contribuir al desarrollo de enfermedad vascular diabética. El objetivo de este trabajo fue estudiar la coagulación en una población diabética de Uruguay y compararla con una población de referencia normal. Se trabajó con 100 pacientes diabéticos tipo 2, de ambos sexos (49 mujeres y 51 hombres), con edades comprendidas entre 42 y 79 años, y una población control representada por 130 individuos aparentemente sanos (73 mujeres y 57 hombres) cuyas edades oscilaron entre 37 y 78 años, los que fueron tomados como referencia. Se realizaron las determinaciones de tiempo de protrombina (TP), fibrinógeno (Fib), proteína C (PC), proteína S (PS), antitrombina III (ATIII) e inhibidor del activador de plasminógeno (PAI) en plasma citratado. El TP y el Fib se realizaron por nefelometría, la PC, ATIII y PAI se midieron cromogénicamente y la PS se determinó por coagulometría. Se encontró que los inhibidores fisiológicos de la coagulación PS y ATIII son significativamente menores en la población diabética, en tanto que los factores procoagulantes Fib y PAI son significativamente mayores, comparados con la población de referencia. De los hallazgos precedentes se confirma una tendencia a un disbalance hemostático que contribuiría al estado protrombótico que acompaña a un alto porcentaje de la población diabética.
Palabras clave: Diabetes; Estado protrombótico; Hipercoagulabilidad; Enfermedad vascular
Summary
Diabetes mellitus is associated with disturbances in hemostasis, which may contribute to the development of diabetic vascular disease. Coagulation tests were performed both in diabetic patients and healthy individuals in Uruguay. The results obtained were compared. Diabetic patients were 100, with ages between 42 and 79 years, 49 females and 51 males. Reference population were
130 healthy individuals between 37 and 78 years, 73 females and 57 males.
Prothrombin time (PT), fibrinogen( Fib), protein C (PC), protein S (PS), antithrombin III (ATIII) and plasminogen activator inhibitor (PAI) were measured on citrated plasma. PT and Fib were determined nephelometrically, PC, ATIII y PAI were measured cromogenically and PS was determined by coagulometry. Coagulation physiological inhibitors outcomes such as PS and ATIII showed significantly lower levels in the diabetic patient than in the healthy person, and at the same time, Fib and PAI, which are procoagulant factors, have significantly higher concentrations in the diabetic patient than in the healthy person. These findings permit to assess that an impaired haemostatic balance is present in the diabetic population, which may contribute to the hypercoagulability that accompanies a high percentage of these patients.
Key words: Diabetes; Procoagulant state; Hypercoagulability; Vascular disease
INTRODUCCIÓN
Es conocida la existencia de complicaciones vasculares en pacientes diabéticos (1-5). Existen diversas hipótesis que pretenden explicar esta situación y la de la glucosilación no enzimática (glicación) de las proteínas es la que más se adecua, por brindar la explicación mejor fundada a los cambios procoagulantes en la superficie de las células endoteliales.
Aunque varios desarreglos hemodinámicos y metabólicos inducidos por la hiperglicemia se han considerado partícipes en la tendencia trombogénica, es probable que los productos de glicación avanzada (AGE - Advanced Glycation Endproducts), que son macroproteínas envejecidas, puedan jugar un papel central en las anormalidades trombogénicas en los pacientes con diabetes (6).
Esta primera etapa de glicación se potenciaría con los procesos oxidativos, acompañándose de una mayor permeabilidad endotelial, depleción de óxido nítrico, e incremento de la secreción de factor de crecimiento derivado de las plaquetas (7-9).
Estos estados protrombóticos pueden verse favorecidos por la disminución de los inhibidores fisiológicos de la coagulación o por el aumento de los factores de la coagulación o de los inhibidores fisiológicos de la fibrinolisis.
Cuando se evalúa el riesgo trombótico se estudian habitualmente los inhibidores fisiológicos de la coagulación como: a) PS, b) ATIII, c) PC; los inhibidores fisiológicos de la fibrinolisis como: d) PAI y los factores de la coagulación, algunos de los cuales pueden valorarse globalmente por medio de: e) TP o individualmente, como f) Fib, que está directamente implicado como precursor en la formación del coágulo de fibrina (10).
El objetivo de este trabajo fue valorar la repercusión de la diabetes en los mecanismos de coagulación y fibrinolisis a través de la medida de parámetros de laboratorio que informan acerca de la actividad global de los factores de la coagulación (TP) y la individual (Fib), como así también de la inhibición fisiológica de la coagulación (PC, PS y ATIII) y de la fibrinolisis (PAI), relacionándolos entre sí y considerando su posible asociación con complicaciones clínicas de los pacientes.
MATERIALES Y MÉTODOS
Población
Se trabajó con una población de pacientes diabéticos tipo 2, provenientes de la Policlínica de Endocrinología constituida por 49 mujeres (P50: 63 años; P2,5- P97,5: 42 - 72 años) y 51 hombres (P50: 60 años; P2,5 - P97,5 : 45 -77 años), algunos de los cuales estaban en tratamiento con dieta, hipoglicemiantes orales y/o antiagregantes plaquetarios, algunos con microangiopatía y/o macroangiopatía.
También se realizaron estas determinaciones en una población control constituida por 130 individuos, 73 mujeres (P50: 57 años; P2,5 - P97,5: 40 - 75 años) y 57 hombres (P50: 62 años; P2,5- P97,5: 42 -77 años).
Muestras
Las muestras para determinar TP, Fib, PC, PS, ATIII y PAI fueron de plasma citratado, provenientes de sangre venosa, extraída en las primeras horas de la mañana, con un mínimo de cuatro horas de ayuno.
El plasma citratado se obtuvo centrifugando sangre recién extraída sobre citrato de sodio 3,8 g/dL en proporción sangre/anticoagulante de 9/1 a 3000 r.p.m. durante 5 minutos. Las muestras obtenidas con extracción dificultosa fueron descartadas para evitar plasmas donde los factores procoagulantes pudieran haberse activado.
MÉTODOS
Las medidas de TP, Fib, PS, PC y ATIII fueron calibradas utilizando un plasma calibrador (Instrumentation Laboratory, IL) y la del PAI, con un plasma calibrador contenido en el mismo equipo diagnóstico (Coatest PAI Chromogenix).
TP y Fib fueron determinados por nefelometría, con Test PT-Fibrinógeno HS PLUS/ ACL (Instrumentation Laboratory, IL) midiendo la dispersión de luz en la muestra de plasma, antes, durante y después de la formación del coágulo. El incremento de intensidad óptica al principio del coágulo está relacionado con el TP y el delta final de intensidad óptica estabilizada se relaciona con la concentración de fibrina, y por tanto, con el fibrinógeno (CV-TP: 5%; CV-Fib: 8%). Se utilizó una tromboplastina cálcica de alta sensibilidad, proveniente de un extracto liofilizado de cerebro de conejo con una concentración óptima de iones calcio.
La PC se midió cromogénicamente con reactivos Proteína C Chromogenix / equipo Biosystem. La PC fue activada durante un período dado en presencia de un exceso de activador (fracción purificada de veneno de serpiente Agkistrodon contortrix). La determinación de la concentración de la PC se hizo en base a la velocidad de hidrólisis de un sustrato cromogénico específico, la que fue directamente proporcional a la cantidad de sustrato hidrolizado durante el tiempo de medición (CV 6%).
La PS se determinó con un equipo Coagulation IL Test Protein S/ ACL (Instrumentation Laboratory, IL), y midió el tiempo de coagulación en un sistema que incluyó tromboplastina bovina, PC activada y calcio. La PC activada fue generada in vitro por activación de plasma deficiente en proteína S con veneno de serpiente Agkistrodom contortrix (CV 8%).
La ATIII se determinó cromogénicamente con reactivo IL Test Antithrombin III/ ACL (Instrumentation Laboratory, IL), incubando la muestra con un exceso de trombina en presencia de heparina y luego midiendo la actividad residual de trombina con un sustrato cromogénico sintético. El color desarrollado fue inversamente proporcional a la concentración de ATIII (CV 5%).
El PAI se midió cromogénicamente con reactivos Coatest PAI Chromogenix/colorímetro Biosystem agregando un exceso de activador tisular de plasminógeno al plasma del paciente, convirtiéndose una parte en un complejo inactivo con el inhibidor de activador de plasminógeno presente en el plasma. El activador residual activó plasminógeno a plasmina que se midió cromogénicamente, siendo el desarrollo de color inversamente proporcional al inhibidor de activador de plasminógeno presente en el plasma (CV 9%).
Como las variables de interés consideradas en el presente estudio no tenían una distribución normal, los métodos estadísticos empleados fueron no paramétricos (Test de Kruskal Wallis).
Se estudió si existía diferencia significativa entre los valores obtenidos para los distintos analitos con la población diabética y la de referencia, y a su vez entre los valores obtenidos para los distintos analitos en los pacientes diabéticos en presencia y ausencia de microangiopatía o macroangiopatía.
RESULTADOS
Los estudios estadísticos demostraron que los inhibidores fisiológicos de la coagulación PS, ATIII y TP%, eran significativamente menores en la población diabética que en la de referencia y el factor procoagulante Fib, así como el inhibidor fisiológico de la fibrinolisis, PAI, eran significativamente mayores. No se hallaron diferencias estadísticamente significativas entre ambas poblaciones en relación a la PC (Tabla I)(Tabla II) (Tabla III)
El 22% de los pacientes presentó complicaciones macroangiopáticas y al 28% microangiopatías.
El inhibidor fisiológico de la coagulación ATIII estaba disminuido en forma estadísticamente significativa en los pacientes diabéticos que presentaron microangiopatías o macroangiopatías (Tabla IV)(Tabla V).
El factor procoagulante Fib estaba aumentado en forma estadísticamente significativa en los pacientes diabéticos con microangiopatía (Tabla IV). Los demás analitos no presentaron variación estadísticamente significativa entre ambas poblaciones.
Tabla I. Medidas de tendencia central y de dispersión en población diabética.
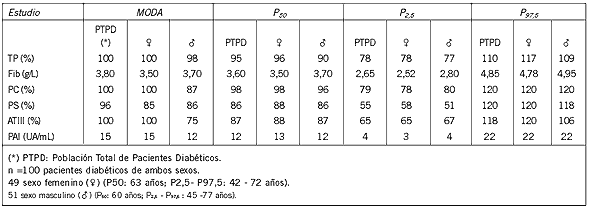
Tabla II. Medidas de tendencia central y de dispersión en la población de referencia.

Tabla III. Medidas de tendencia central en la población diabética y en la población de referencia.

Tabla IV. Medidas de tendencia central en la población diabética con y sin microangiopatía.

Tabla V. Medidas de tendencia central en la población diabética con y sin macroangiopatía.

DISCUSIÓN Y CONCLUSIONES
De las investigaciones realizadas se concluye que los inhibidores fisiológicos de la coagulación PS y ATIII son significativamente menores en la población diabética que en la de referencia y que el factor procoagulante Fib, así como el inhibidor fisiológico de la fibrinolisis, PAI, determinado en este estudio, son significativamente mayores, por lo que se confirma la tendencia al estado protrombótico en los pacientes diabéticos. Esto concuerda con lo encontrado por otros autores que sostienen que el disbalance hemostático en diabetes puede causar hipercoagulabilidad y contribuir al incremento de la mortalidad por enfermedad cardiovascular (3)(4)(11).
El descenso de ATIII podría adjudicarse a la disminución de la actividad de la misma como consecuencia de la glicación que sufren las proteínas en la diabetes. La ATIII glicada vería disminuida su capacidad de unión a la heparina, por lo cual los tests funcionales, que utilizan la capacidad de la heparina de potenciar la unión de la ATIII a la trombina y al factor X activado darían disminuidos.
En relación al TP %, los datos obtenidos muestran una disminución estadísticamente significativa, con respecto a la población de referencia. Se ha descrito aumento en el TP %, concomitantemente con un aumento significativo del fibrinógeno en pacientes diabéticos, especialmente en aquellos que cursan la enfermedad desde hace más tiempo y que presentaron posteriormente complicaciones crónicas (12).
Se piensa que pueda influir en los resultados obtenidos de TP el hecho de que la población diabética estudiada está en muchos casos medicada con hipoglicemiantes orales. Este tipo de tratamiento, además reduce los procesos de glicación de lipoproteínas revirtiendo efectos tales como el aumento de lipoproteínas de baja densidad (LDL) (13). El inhibidor de la vía del factor tisular circula unido a LDL, por lo cual si las LDL están disminuidas, aumentaría el inhibidor libre que es el activo, que inhibiría la vía del factor tisular provocando la disminución del TP %. Otra posible explicación es que la medicación, ya sea hipoglicemiante o normolipemiante, utilizada en muchos pacientes puede afectar al hígado, órgano de síntesis de factores de la coagulación. De todas formas cabe resaltar que la disminución de TP % encontrada no es clínicamente significativa.
En cambio, en lo que respecta a ATIII cuando se produce un evento trombótico hay consumo de la misma de aproximadamente un 30% de su valor, tiene mayor repercusión el hecho de partir de valores con tendencia a la disminución con respecto a la normalidad, como sucede en la población diabética, pues frente a un episodio trombótico descendería aún más.
Se encontró que tanto la actividad coagulante como la fibrinolítica varían en forma estadísticamente significativa al comparar la población diabética con la de referencia. Vinculado a este aspecto, algunos autores han demostrado que las alteraciones del sector fibrinolítico tienen una mayor asociación con la presencia de macroangiopatía, que es otra afección muy frecuente en la diabetes (14). También otros autores han realizado aportes que señalan que el factor tisular estaría incrementado en pacientes diabéticos lo que tendría un efecto activador procoagulante sobre el factor VII de la coagulación (15)(16).
Estudios recientes conducidos por investigadores japoneses han encontrado una asociación significativa entre los niveles de PAI y Fib y los de productos de glicación avanzada (17).
Se ha postulado que la hiperglicemia en los pacientes no controlados o controlados deficientemente provoca la glicación de una gran variedad de proteínas que pueden incluir a los inhibidores fisiológicos de la coagulación como la ATIII, PC y PS, alterando su estructura y función. Este mecanismo podría explicar los bajos niveles encontrados en algunos estudios de estos inhibidores, esenciales en el proceso de anticoagulación fisiológica, y la tendencia trombótica en esta enfermedad (18).
En el presente trabajo, los estudios realizados han permitido demostrar en la población diabética seleccionada, que las vías fibrinolítica y coagulante varían a favor de incrementar el estado de hipercoagulabilidad que caracteriza a esta enfermedad. Esto sería la resultante de una asociación inversa, estadísticamente significativa, entre el inhibidor fisiológico de la coagulación ATIII que disminuye y el factor procoagulante Fib que aumenta cuando se hace presente la micro o macroangiopatía, tomando como referencia a una población diabética sin angiopatía.
Agradecimientos
A la Dra Dinorah Lanata (Jefe del Servicio de Endocrinología del Hospital Central de las FF.AA.) quien seleccionó los pacientes a los requerimientos de este trabajo, al Dr. Jorge Pouso (Jefe del Área de Investigación del Hospital Central de las FF.AA.) quien apoyó en el tratamiento estadístico de los resultados haciendo posible la obtención de las conclusiones presentadas, a los Licenciados de Laboratorio Miguel Luján y Paola de Lorenzi, quienes colaboraron en forma entusiasta, en el procesamiento de las muestras para diferentes determinaciones de Laboratorio y finalmente a la firma IZASA que apoyó con reactivos para realizar las determinaciones de este trabajo.
Correspondencia
Q.F. ANA LENA
Hospital Central de las Fuerzas Armadas
Avda. Centenario 3050
11600 MONTEVIDEO, Uruguay
E-mail: analena@adinet.com.uy
DRA. Q.F. STELLA RAYMONDO
Hospital Maciel. 25 de Mayo 174
91.000 MONTEVIDEO, Uruguay
E-mail: stelaray@fq.edu.uy
Referencias bibliográficas
1. Doshi SN, McDowell IF, Moat SJ, Payne N, Durrant HJ, Lewis MJ, et al. Folic acid improves endothelial function in coronary artery disease via mechanism largely independent of homocysteine lowering. Circulation 2002; 105: 22-6.
2. Marcucci R, Bertini L. Thrombophilic risk factors in patients with central retinal vein occlusion. Thromb Haemost 2001; 86 (3): 772-6.
3. Vinik A, Flemmer M. Diabetes and macrovascular disease. J Diabetes Complications 2002; 16 (3): 235-45.
4. Vinik A, Vinik E. Prevention of the complications of diabetes. Am J Manag Care 2003; 9 (3): 63-80.
5. Almagro D. Estados de hipercoagulabilidad. Rev Cubana Hematol Inmunol Hemoter 1997;13 (2): 90-108.
6. Moreno P, Fuster V. New aspects in the pathogenesis of diabetic atherothrombosis. J Am Coll Cardiol 2004; 44 (12): 2293-300.
7. Schwartz C, Valente A, Sprague E, Kelley J, Cayatte A, Rozek M, et al. Pathogenesis of the atherosclerotic lesion: Implications for diabetes mellitus. Diabetes Care 1992; 15: 1156-67.
8. Bierman E. Atherogenesis in diabetes. J Atheroscler Thromb 1992; 12: 647-56.
9. Sowers J, Epstein M. Diabetes mellitus and associated hypertension, vascular disease and nephropathy. An update. Hypertension 1995; 26: 869-79.
10. Kordich L, Sánchez J, Vidal H, De Campos C. Manual de Hemostasia y Trombosis (Grupo CLAHT). 2ª Ed. Buenos Aires: Fundación Bioquímica Argentina; 1990.
11. Morishita E, Asakura H, Jokaji H, Saito M, Uotani C, Kumabashiri I, et al. Hypercoagulability and high lipoprotein (a) levels in patients with type II diabetes mellitus. Atherosclerosis 1996; 120 (1-2): 7-14
12. Acang N, Jalil F. Hipercoagulación y diabetes mellitus. Southeast Asian J Trop Med Public Health 1993; 24 (Suppl 1): 263-6.
13. Cuchel M, Rader D. The role of high density lipoproteins in thrombosis. Scientific World Journal 2002; 2: 89-95.
14. Udarvy M, Posan E. Diabetes mellitus and fibrinolisis. Orv Hetil 1994; 135: 2025-7.
15. Magari Y, Mizunaga S, Ito M, Shibata T, Ito H. Rinsho Byori 1994; 42: 22-33.
16. Koyama T, Nishida K, Sawada M, Ohdama S, Murakami N, Hirosawa S, et al. Determination of plasma tissue factor antigen and its clinical significance. Br J Haematol 1994; 87: 343-7.
17. Enomoto M, Adachi H, Yamagishi S, Takeutchi M, Furuki K, Hino A, et al. Positive association of serum levels of advanced glycation end products with thrombogenic markers in humans. Metabolism 2006; 912-7.
18. Caunedo P. Alteraciones de la hemostasia en la diabetes mellitus. Rev Cubana Hematol Inmunol Hemoter 2005; 21 (1): 7-14. [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ]
Aceptado para su publicación el 19 de marzo de 2007














