Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. v.41 n.2 La Plata abr./jun. 2007
INMUNOLOGÍA
Antígeno excreción-secreción de Fasciola hepatica: ultrafiltración y aplicación en inmunodiagnóstico
Fasciola hepatica excretion-secretion antigen: ultrafiltration and application in immunodiagnosis
Cecilia Colmenares1*,***, Liber Méndez2***, Zoraida Díaz-Bello3**, Belkisyolé Alarcón de Noya4*
1. Licenciada en Bioanálisis y Biología.
2. Magister en Parasitología.
3. Magister en Inmunología.
4. Doctora en Parasitología.
*** Escuela de Medicina "Luis Razzetti" e Instituto de Medicina Tropical
*** Instituto de Medicina Tropical.
*** Postgrado Nacional de Parasitología, Facultad de Medicina, Universidad Central de Venezuela.
Lugar de realización del trabajo: Sección de Inmunología, Instituto de Medicina Tropical, Facultad de Medicina, Universidad Central de Venezuela.
Resumen
La baja sensibilidad de la coprología en el diagnóstico de la fasciolosis humana ha motivado el desarrollo del inmunodiagnóstico. El antígeno de excreción-secreción de adultos de Fasciola hepatica (AFhES) en ELISA es adecuado para el screening, aunque sobrestima la prevalencia; cuando se utiliza en Western blot (WB) no muestra un buen reconocimiento de sus componentes. Para lograr una mejor preparación, se ultrafiltró el antígeno a través de membranas YM de 10, 30 y 50 kDa. Los retenidos (R) se usaron en ELISA y WB. La mayor discriminación entre positivos y negativos en ELISA y la mejor resolución en el reconocimiento al antígeno en WB, se logró con la fracción R50. Se destacan las moléculas de 9, 14, 65 kDa y la región alrededor de 27 kDa, detectadas con alta sensibilidad (90 al 100% de los sueros positivos) y especificidad (por ningún negativo). Al ensayar 29 sueros con otras parasitosis, sólo el de una persona con Paragonimus sp. reaccionó a la molécula de 65 kDa. ELISA-AFhES con todas las fracciones filtradas fue útil, facilitando el screening de la infección, aunque con R50 se obtuvieron los mejores resultados. La comprobación de los casos positivos se logra eficientemente utilizando la fracción R50 del AFhES en WB.
Palabras clave: Fasciolosis; Antígeno; Ultrafiltración; Inmunodiagnóstico; ELISA; Western blot
Summary
Low sensitivity in the coprologic diagnosis of human fasciolosis has motivated the development of immunodiagnosis. The excretion-secretion antigen from Fasciola hepatica adult worms (ESAFh) with ELISA is suitable for screening, although it overestimates its prevalence. However, when tested by Western blot (WB) it does not show any optimal recognition of its components. In order to obtain a better preparation, the antigen was ultrafiltered by YM 10, 30 and 50 kDa membranes. Retentates (R) were used by ELISA and WB. A higher discrimination between positives and negatives by ELISA and a better resolution in the antigen recognition in WB was achieved with the R50 fraction. Molecules of 9, 14, 65 kDa, and region about 27 kDa were detected with high sensitivity (90 to 100% of positive sera) and specificity (none of the negative sera). Among the 29 sera with other parasitic diseases, only one with Paragonimus sp. reacted to the 65 kDa molecule. ELISA-ESAFh with all filtrated fractions was useful, facilitating the infection screening even though the best results were obtained with R50. The verification of positive cases is efficiently achieved using the R50 of the ESAFh fraction by WB.
Key words: Fasciolosis; Antigen; Ultrafiltration; Immunodiagnosis; ELISA; Western blot
INTRODUCCIÓN
La fasciolosis es una enfermedad parasitaria causada principalmente por el helminto Fasciola hepatica, que afecta animales mamíferos herbívoros y eventualmente al hombre (1). La enfermedad está ampliamente distribuida a nivel mundial y en algunos países constituye un verdadero problema de salud pública como es el caso del altiplano boliviano donde cursa con alta endemicidad en humanos (2).
En Venezuela se han reportado prevalencias variables del 18 al 76% en bovinos (3-5). Hasta 2002 se publicaron 8 casos en humanos, los cuales fueron diagnosticados por hallazgos parasitológicos fortuitos (6), mientras que en los últimos tres años se han detectado 9 casos a partir del screening por ELISA y confirmación por Western blot (WB)(5-7).
La utilización de métodos inmunológicos para establecer el diagnóstico de la fasciolosis se justifica por la baja sensibilidad de los exámenes coprológicos. El ensayo inmunoenzimático (ELISA) es una de las pruebas más ampliamente usada pero su sensibilidad y especificidad dependen fundamentalmente de la calidad de los antígenos empleados (8) (9). Los productos de excreción-secreción (ES) de vermes adultos de F. hepatica son considerados potentes inductores de la respuesta inmune humoral, superando a los antígenos somáticos en el inmunodiagnóstico (1) (10). Sin embargo, cuando los antígenos de ES se utilizan en ELISA se han observado falsos positivos hasta de un 30% (11).
Los productos de ES de F. hepatica están compuestos por algunas moléculas de naturaleza glicoproteica, según lo demuestran las determinaciones de proteínas e hidratos de carbono (12), que cuando son usados como antígenos en las pruebas diagnósticas reaccionan inespecificamente con sueros humanos sin fasciolosis, dando falsos positivos. Esto puede ser debido a reacciones cruzadas con otros helmintos o consecuencia de posibles infecciones pasadas, tratadas o autolimitadas (13).
Las moléculas de 8, 10, 11, 14, 17, 23-30 kDa de los productos de ES del verme adulto de F. hepatica reaccionan con los sueros positivos con buena sensibilidad y especificidad (70-100%) por WB (10) (14-16). Entre los componentes de ES se destacan las cisteínas proteinasas, con 25 y 26 kDa, las cuales forman parte del arco de precipitación Fharc2 usado para serología en humanos y en el ganado (17). La catepsina L1 (cystein proteinasa) obtenida como recombinante, se ha propuesto como antígeno en ELISA, que combinado con la detección de anticuerpos IgG4, resulta en una prueba con buena sensibilidad y especificidad (18). De igual manera, la catepsina L1 de Fasciola gigantica, muestra 100% de sensibilidad y 98% de especificidad en el diagnóstico de fasciolosis humana, obteniéndose como un recombinante y en suficiente cantidad para su uso como antígeno en las pruebas de inmunodiagnóstico (19). Además de la detección de anticuerpos, se han logrado avances en la detección de antígenos en suero y heces de hombres y animales infectados usando el monoclonal ES78 (10) (14) (20).
Si bien el antígeno de excreción-secreción de adultos de F. hepatica discrimina personas con fasciolosis por ELISA (5), en WB el reconocimiento de los componentes antigénicos no tiene una resolución adecuada. El objetivo del presente trabajo es evaluar tres fracciones de los productos de ES de F. hepatica obtenidas por filtración molecular con dispositivos micro-concentradores con membranas YM de celulosa regenerada de límites 10, 30 y 50 kDa, con el fin de seleccionar una preparación antigénica que permita resultados nítidos y confiables, para el diagnóstico inmunológico de la fasciolosis humana, entidad parasitaria emergente en Venezuela.
MATERIALES Y MÉTODOS
Sueros humanos
Las muestras de sangre fueron obtenidas bajo completo consentimiento informado de los participantes. Se utilizaron 10 sueros de personas con fasciolosis demostrada por serología y coprología, 14 sueros de personas sanas negativas por todas las pruebas a la infección y 29 sueros de personas con otras parasitosis distribuidas de la siguiente manera: con Paragonimus sp. 2, Schistosoma mansoni 3, Taenia sp. 3, cisticercosis 3, hidatidosis 3, Hymenolepis nana 2, Anquilostomideos 3, Strongyloides stercolaris 3, Ascaris lumbricoides 3, Toxocara sp. 2, Trichuris trichiura 2.
Obtención de antígenos de excreción-secreción de F. hepatica (AFhES)
Los ejemplares adultos de Fasciola hepatica se extrajeron de los conductos biliares de bovinos infectados y fueron lavados con solución salina estéril. De 10 a 15 vermes se colocaron en 20 mL de medio RPMI + penicilina-estreptomicina, en viales de cultivo Falcon®. Se incubaron en cámara de CO2 a temperatura ambiente por 6 horas, luego de lo cual se descartó el medio sustituyéndolo por medio nuevo y se dejó por 12 horas más. Una vez retirados los vermes, se añadió al medio una mezcla de inhibidores de proteasas fenil metil sulfonil fluoruro (PMSF) y EDTA, 2mM y 1mM respectivamente, se centrifugó a 3.376 g, a - 4 ºC por 30 min, el sobrenadante se congeló a -70 ºC y luego se liofilizó por 10 horas continuas (12) (21). Posteriormente, se resuspendió con PBS 0,15 M y se determinaron proteínas por el método de Bradford (22). A esta preparación se la denominó AFhES.
Ultrafiltración molecular del AFhES
Se ultrafiltraron porciones de aproximadamente 2 mL del AFhES, en distintos dispositivos de filtración por centrifugación con membranas YM de celulosa regenerada (CENTRICON®), cada una con poros de tamaño diferente, con límites de 3, 10, 30 y 50 kDa. El dispositivo con membrana YM de 3 kDa se centrifugó a 5.000 g por 45 min; los demás con membranas YM 10, 30 y 50 se centrifugaron a la misma velocidad por 30 min. Luego de la centrifugación, el preparado resultante se distribuyó en dos fracciones, una que contenía un concentrado con moléculas mayores que el poro de la membrana, denominada retenidos (R), y otra que contenía los filtrados (F), con moléculas de menor tamaño que el poro utilizado. Los retenidos se indican como R3, R10, R30 y R50 (según membrana utilizada) y los filtrados como F3, F10, F30 y F50, según el caso (Fig. 1). Se determinó la concentración proteica en cada fracción obtenida y seguidamente se almacenaron a -70 ºC.

Figura 1. Esquema de ultrafiltración molecular del antígeno de excreción-secreción de adultos de Fasciola hepatica (AFhES) con dispositivos micro-concentradores (CENTRICON®).
Inmunoensayo enzimático con las fracciones obtenidas del AFhES
Se siguió la técnica descrita por Voller et al. (23) con algunas modificaciones. Con los retenidos (R3-R50) del AFhES se sensibilizaron micro-placas de ELISA (Maxi Sorp, NUNC®), con 50 µL/pozo de cada fracción a una concentración de 10 µg/mL. Luego de 18 h a 4 ºC, las placas se lavaron dos veces con buffer salino fosfato (PBS) con 0,05% de Tween 20. Para el bloqueo se colocaron 150 µL/pozo de solución de leche descremada al 5% en PBS-Tween 20 al 0,05% por 1 h.
Los sueros se diluyeron 1/200 en la misma solución de bloqueo, colocando 50 µL/pozo por 1 h a 37 ºC. Las placas se lavaron 3 veces con PBS-Tween 20 al 0,05% y se expusieron a 50 µL/pozo de solución de anti IgG-humana conjugada a fosfatasa alcalina (1/2000) en la misma solución de bloqueo. Se revelaron las placas usando 50 µL/pozo de p-nitrofenilfosfato (PNPP) a una concentración de 1 mg/mL como sustrato de la enzima. Luego se detuvo la reacción con 50 µL/pozo de una solución de NaOH 3M. El punto de corte se estableció en base al promedio más tres desviaciones estándar de la densidad óptica de 40 sueros negativos.
Electroforesis y Western blot con las fracciones del AFhES (>3 a >50 kDa)
Se realizó electroforesis con aproximadamente 72 µg de cada fracción de AFhES, diluidos en 300 µL de buffer de muestra, en gel de poliacrilamida al 12,5%, bajo condiciones disociantes y no reductoras, luego se transfirió a papel de nitrocelulosa (NC) (24)(25). A continuación, las membranas de NC se bloquearon con leche descremada al 5% en PBS-Tween 20 al 0,05%, al término de lo cual se secaron y guardaron a -20 ºC hasta su uso.
El papel de NC se cortó en tiras de 2 mm, las cuales se expusieron a 800 µL de suero humano diluido 1/200 en solución de bloqueo, por 90 min, en constante agitación a temperatura ambiente. Luego se realizaron 4 lavados de 15 min cada uno con PBS-Tween 20 al 0,05%. Seguidamente las tiras se colocaron en una solución de anti-IgG humana conjugada a peroxidasa (1/15.000) en solución de bloqueo por 90 min, en agitación constante. Se repitieron los lavados y se procedió a exponer las tiras al sustrato quimio-luminiscente (SuperSignal®) por 1 min. La reacción se evidenció por revelado usando placas fotográficas (HiperfilmTM, Amersham®).
RESULTADOS
Inicialmente se ensayaron por ELISA-AFhES>3kDa (R3) los sueros de las personas positivas (C+) y negativas (C-) utilizados como controles, apreciándose buena sensibilidad pero baja especificidad. En el WB con el antígeno R3 se evidenciaron las moléculas específicas (9, 10, 13, 18, 81, 92, 101 kDa), las cuales se observaron con dificultad y adicionalmente, los sueros negativos reconocieron varias moléculas de este preparado. En consecuencia, se procedió a mejorar este antígeno filtrándolo a través de membranas YM de 10, 30 y 50 kDa. La determinación de los contenidos proteicos de todos los retenidos y filtrados fue la siguiente: [R10]=1,49 mg/mL; [F10]=0,054 mg/mL; [R30]= 1,99 mg/mL; [F30]=0,056 mg/mL; [R50]=1,34 mg/mL; [F50]=0,050 mg/mL.
En ELISA, los puntos de corte determinados para las fracciones R3 a R50, presentaron una densidad óptica que fluctuó entre 0,244 y 0,285. Se observó una mejor discriminación entre positivos y negativos con la fracción R50.
Los retenidos se ensayaron por WB siguiendo el esquema que se describe en la Figura 1. Los resultados obtenidos por esta técnica con las diferentes fracciones se presentan en las Figuras 2, 3 y 4. Los sueros positivos enfrentados a los antígenos R10 y R30 reaccionaron con moléculas entre 9 a 137 kDa, siendo reconocidas con baja resolución 5 moléculas específicas (Fig. 2) (Fig. 3). Con R50 se encontró una mayor resolución e intensidad, con una buena separación de los componentes de bajo peso molecular, importantes por su mayor especificidad. Aparece una molécula de 8 kDa y desaparece otra de 11 kDa, apreciándose bien las moléculas de mediano y alto peso molecular (Fig. 4). Se destaca la reactividad a los componentes de 9, 14, la región alrededor de 27 y la de 65 kDa. Todas estas moléculas son reconocidas por el 90 al 100% de los sueros positivos y ninguno de los negativos (Fig. 4). La molécula de 75 kDa a pesar de ser detectada por algunos negativos, también presenta una alta sensibilidad al reaccionar con el 100% de los sueros positivos. Los filtrados no fueron ensayados por WB, debido a su baja concentración de proteínas.

Figura 2. Western blot con R10 (AFhES>10 kDa). a) Patrón de reactividad por sueros de personas positivas (C+) y negativas (C-), b) Frecuencias de reconocimiento a las moléculas del antígeno.

Figura 3. Western blot con R30 (AFhES>30kDa). a) Patrón de reactividad por sueros de personas positivas (C+) y negativas (C-). b) Frecuencias de reconocimiento a las moléculas del antígeno.

Figura 4. Western blot con R50 (AFhES>50kDa). a) Patrón de reactividad por sueros de personas positivas (C+) y negativas (C-). b) Frecuencias de reconocimiento a las moléculas del antígeno.
Los resultados de la reacción entre el antígeno R50 y los sueros de personas con otras parasitosis muestran que las moléculas de 9, 14 y 27 kDa no son reconocidas por ninguno de los sueros ensayados; solamente en la parte inferior de la región de 27 kDa hay una leve señal de reacción con el suero de una persona con Paragonimus sp., al igual que ocurre con la molécula de 65 kDa la cual reaccionó solamente con este suero. La molécula de 75 kDa fue reconocida por el 50% de los sueros de personas con paragonimiasis, 67% con hidatidosis, 33% con anquilostomiasis y 33% con ascaridiasis (Fig. 5).
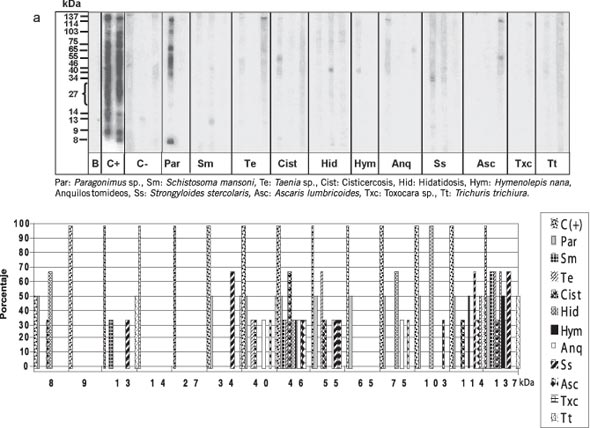
Figura 5. Western blot con R50 (AFhES>50kDa). a) Patrón de reactividad por sueros de personas con otras parasitosis. b) Frecuencias de reconocimiento a las moléculas del antígeno.
DISCUSIÓN Y CONCLUSIONES
La electroforesis de los antígenos se realizó en geles al 12,5% con el propósito de lograr en WB mayor resolución de las moléculas de bajo peso molecular reportadas en la literatura (10) (14-16) como las más sensibles y específicas para el diagnóstico de la fasciolosis.
El análisis de los resultados obtenidos demuestra que R50 constituye la mejor preparación entre las tres ensayadas, tanto por ELISA como por WB. Se presume que la composición de R50 (AFhES>50kDa) sea de moléculas mayores de 50 kDa, retenidas cuando son ultrafiltradas con la membrana YM-50. La electroforesis y transferencia con R50 permitió detectar por WB moléculas de 9, 14, 27, 65 y 75 kDa, las cuales fueron reconocidas con alta sensibilidad y especificidad por los sueros ensayados (90 al 100% de los sueros positivos y por ningún negativo) a excepción de la molécula de 75 kDa, evidenciada por algunos negativos (Fig. 4). El reconocimiento de estas 5 moléculas constituye un patrón marcador de positividad en los casos de fasciolosis.
Las proteínas específicas con pesos moleculares aproximados a 9, 14, 27 y 65 kDa han sido reportadas por otros autores como relevantes para el diagnóstico (10) (14-16). La determinación de anticuerpos permite diagnosticar personas positivas tres semanas luego de la infección y antes de la llegada del parásito a su ubicación definitiva. Si bien es cierto que existen técnicas de detección de antígenos de F. hepatica en heces y sueros que tienen alta sensibilidad y especificidad, éstas son de uso limitado pues requieren de un anticuerpo monoclonal.
Algunas moléculas mayores de 34 kDa con excepción de la de 65 kDa, fueron reconocidas por sueros de personas con otras parasitosis, siendo las causantes de la reactividad cruzada al antígeno de excreción-secreción de F. hepatica. La molécula de 75 kDa reaccionó con sueros de personas con otras parasitosis, lo cual afecta su valor para el diagnóstico de fasciolosis.
En general, hubo mayor reactividad cruzada con las especies más cercanas entre sí, siendo notable el suero de la persona con Paragonimus sp., el cual rconoció casi todos los componentes del R50 y la molécula de 65 kDa, pero no las otras moléculas específicas. Se esperaba la reacción del suero de la persona con Paragonimus sp. a los componentes de este antígeno, debido a la proximidad filogenética entre Fasciola hepatica y este trematode. En Venezuela, sólo se ha confirmado un caso de paragonimiasis y no se solapan las áreas bajo riesgo de infección de estas parasitosis, razón por la cual no se consideró disminuir la importancia diagnóstica de la molécula de 65 kDa.
ELISA-AFhES-R50 presentó la mejor discriminación entre positivos y negativos, sin embago, con todas las fracciones esta técnica fue valiosa como prueba de screen-ing en personas con diagnóstico probable de fasciolosis. WB con R50 mostró mayor resolución y también diferenció mejor los positivos de los negativos. Se propone utilizar ELISA preferiblemente con la fracción R50 del AFhES como método de detección de positivos en poblaciones bajo riesgo de infección, como primer tamizaje de diagnóstico y posteriormente usar WB como prueba confirmatoria, buscando el reconocimiento específico a las moléculas de 9, 14, 27 y 65 kDa, las cuales presentaron una sensibilidad del 90 al 100% y una especificidad de 97-100%.
Agradecimientos
Proyectos FONACIT - ECOS NORD (PI-2005000771) y FONACIT - F-2005000199.
Correspondencia
LIC. CECILIA COLMENARES
Sección de Inmunología, Instituto de Medicina Tropical
Universidad Central de Venezuela, Ciudad Universitaria,
Los Chaguaramos Apartado Postal 47623,
Caracas 1041-A, Venezuela.
Tel.: 0058-212-6053589. Tel.-fax: 0058-212-6053551.
E-mail: ccolmenares@cantv.net, colmenareschechi@gmail.com, belkisyole@yahoo.com.mx
Referencias bibliográficas
1. Fredes F. La Fasciolosis animal y humana. Mon Electr Patol Vet 2004; 1: 38-67.
2. Mas-Coma S, Funatsu IR, Bargues MD. Fasciola hepatica and lymnaeid snails occurring at very high altitude in South America. Parasitology 2001; 123: S115-27.
3. Chavez K, Surumay Q, Olivares R, Montiel N. Prevalencia de la distomatosis hepática en fincas del Distrito Mara, del Estado Zulia. Vet Trop 1979; 4: 52-63.
4. Castellano A, Colmenares C, Bruces AC, Alarcón de Noya B. Inmunodiagnóstico de fasciolosis bovina en Venezuela. J Brasileiro Patol 2001; 37: 40.
5. Colmenares C, Castellano A, Méndez L, Bruces AC, Garcia F, Alarcón de Noya B. Inmunodiagnóstico de Fasciolosis bovina y humana en Venezuela. Acta Cient Venezol 2003; 54 (S1): 221.
6. Alarcón de Noya B, Sosa V L, Colmenares C, Beker B, Contreras R, Meo P M. Localización pancreática de Fasciola hepatica en un caso humano autóctono proveniente del Edo. Bolívar, Venezuela. Rev Soc Venezol Gastro 2006; 60: 134-7.
7. Rojas E, Alarcón de Noya B, Colmenares C, Morales C, Contreras R, Kay S, et al. Fasciolosis humana en los Andes de Venezuela. Parasitol Latinoam 2005; 60: 294.
8. Carnevale S, Rodriguez MI, Santillan G, Labbe JH, Cabrera MG, Bellegarde EJ, et al. Immunodiagnosis of human fascioliasis by ELISA and a micro-ELISA. Clin Diagn Lab Immunol 2001; 8: 174-7.
9. Espino AM, Duménigo BE, Fernandez R, Finlay CM. Immunodiagnosis of human fasciolosis by enzyme-linked immunosorbent assay using excretory-secretory products. Am J Trop Med Hyg 1987; 37: 605-8.
10. Diaz A, Li-Elias O, Otero O, Garcia C, Espino AM. Identificación, mediante Western blot, de inmunógenos de F. hepatica, reconocidos por los sueros de ratas infectadas experimentalmente. Rev Cubana Med Trop 1998; 50: 12-7.
11. Espino AM, Diaz A, Perez A, Finlay CM. Dynamics of antigenemia and coproantigens during a human Fasciola hepatica outbreak. J Clin Microb 1998; 36: 2723-6.
12. Espino AM, Duménigo BE, Huesca N, Finlay CM. Mantenimiento in vitro de adultos de Fasciola hepatica: Obtención de antígenos de excreción-secreción. Rev Salud Anim 1988; 10: 287-93.
13. Alarcón de Noya B, Colmenares C, Lanz H, Caracciolo MA, Losada S, Noya O. Schistosoma mansoni: immuno- diagnosis is improved by sodium metaperiodate which reduces cross-reactivity due to glycosylated epitopes of soluble egg antigen. Exp Parasitol 2000; 95: 106-12.
14. Espino AM, Borges A, Duménigo BE. Coproantígenos de Fasciola hepatica de posible utilidad en el diagnóstico de la fasciolosis. Rev Panam Salud Pública 2000; 7: 225-31.
15. Kim K, Yang HJ, Chung YB. Usefulness of 8 kDa protein of Fasciola hepatica in diagnosis of fascioliasis. Korean J Parasitol 2003; 41: 121-3.
16. Silva M, Gorman T, Alcaíno H. Inmunodiagnóstico de fasciolosis humana y ovina empleando una fracción de 24-29 kDa de F. hepatica obtenida mediante inmunoadsorción. Parasitol Latinoam 2005; 60: 38-42.
17. Córdova M, Reategui L, Espinoza JR. Immunodiagnosis of human fasciolosis with Fasciola hepatica cystein proteinasas. Trans Roy Soc Trop Med Hyg 1999; 93: 54-7.
18. O'Neill SM, Parkinson M, Dowd AJ, Strauss W, Angles R, Dalton JP. Short report: Immunodiagnosis of human fascioliasis using recombinant F. hepatica cathepsin L1 cystein proeinase. Am J Trop Med Hyg 1999; 60: 749-51.
19. Tantrawatpan C, Maleewong W, Wongkham C, Wong-kham S, Intapan PM, Nakashima K. Serodiagnosis of human fascioliasis by a cystatin capture enzyme-linked immunosorbent assay with recombinant Fasciola gigantica cathepsin L antigen. Am J Trop Med Hyg 2005; 72: 82-6.
20. Duménigo BE, Mezo M. Monoclonal antibody sandwich immunoassay detection of coproantigen to evaluate the efficacy of treatment in natural ovine fasciolosis. Res Vet Science 1999; 66: 165-7.
21. Cesari IM, Alarcón de Noya B. Esquistosomiasis mansoni. Diagnóstico y Control. Manual de campo y laboratorio. CEG. Caracas, Venezuela: Instituto Venezolano de Investigaciones Científicas (IVIC); 1987. p. 198.
22. Bradford MM. A rapid and sensitive method for the cuantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem 1976; 72: 248-54.
23. Voller A, Bartlett A, Bidwell DE. Enzyme immunoassays for parasitic diseases. Tras Roy Soc Trop Med Hyg 1976; 70: 98-106.
24. Cleveland DW, Fischer SG, Kirschner MW, Laemmli UK. Peptide mapping by limited proteolysis in sodium dodecyl sulfate and analysis by gel electrophoresis. J Biol Chem 1977; 252: 1102-6.
25. Towbin H, Staehelin T, Gordon J. Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. Proc Natl Acad Sci USA 1979; 76: 4350-4. [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ]
Aceptado para su publicación el 15 de mayo de 2007














