Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. v.41 n.4 La Plata oct./dic. 2007
BIOQUÍMICA CLÍNICA
Factores circulantes de injuria endotelial y procesos subendoteliales en mujeres postmenopáusicas sanas*
Endothelial injuring factors and subendothelial events in healthy postmenopausal women
Gabriela Berg1, Fernando Brites2, María Luz Muzzio3, Valeria Zago4, Graciela López5, María Belén Benitez6, Leonardo Gomez Rosso7, Verónica Miksztowicz8, Leonardo Cacciagiú9, Ana Inés González4, Laura Aisemberg5, Laura Schreier10, Regina Wikinski11
1. Dra. de la Universidad de Buenos Aires. Profesora Adjunta de la Cátedra Análisis Clínicos 1. Facultad de Farmacia y Bioquímica. Universidad de Buenos Aires.
2. Dr. de la Universidad de Buenos Aires. Profesor Adjunto de la Cátedra Laboratorio Avanzado en Bioquímica Clínica. Facultad de Farmacia y Bioquímica. Universidad de Buenos Aires. Investigador Adjunto de CONICET.
3 Bioquímica, Docente y Becaria Doctoral de la Universidad de Buenos Aires.
4 Bioquímica, Docente de la Universidad de Buenos Aires.
5. Bioquímica, Docente de la Universidad de Buenos Aires. Especialista en Bioquímica Clínica.
6. Bioquímica, Docente de la Universidad de Buenos Aires. Becaria de la Agencia Nacional de Promoción Científica y Tecnológica.
7. Bioquímico, Becario Ramón Carrillo-Arturo Oñativia. Ministerio de Salud de la Nación.
8. Estudiante de Bioquímica de la Universidad de Buenos Aires. Becaria CEDIQUIFA.
9. Estudiante de Bioquímica y Becario Estímulo de la Universidad de Buenos Aires.
10. Dra. en Bioquímica. Profesora Asociada de la Cátedra Laboratorio Avanzado en Bioquímica Clínica. Facultad de Farmacia y Bioquímica. Universidad de Buenos Aires.
11. Dra. en Farmacia y Bioquímica. Profesora Titular Emérita del Departamento de Bioquímica Clínica, Facultad de Farmacia y Bioquímica. Universidad de Buenos Aires.
* Laboratorio de Lípidos y Lipoproteínas. Departamento de Bioquímica Clínica. Facultad de Farmacia y Bioquímica. Universidad de Buenos Aires. Argentina.
Resumen
La concentración elevada de lipoproteínas aterogénicas con apo B en mujeres posmenopáusicas (MPM), es un componente importante del mecanismo multifactorial causante de la enfermedad coronaria. En MPM sanas (n=30) en comparación con premenopáusicas (MpreM) (n=28), se evaluó el perfil lipoproteico incluyendo apoproteínas A-I y B, LDL pequeña y densa, composición y oxidabilidad de LDL, proteína transportadora de colesterol esterificado y lipasa hepática. Se determinaron los siguientes factores emergentes: homocisteína, fosfolipasa A2, ferritina, PCR-hs (alta sensibilidad) y fibronectina proveniente de la matriz extracelular. La insulino-resistencia fue evaluada por la circunferencia de cintura, el índice HOMA y el índice triglicéridos/colesterol-HDL. El índice de riesgo apo B/apoA-I fue significativamente mayor en MPM (p<0,0001). MPM presentaron mayor proporción de LDL pequeña y densa, la cual correlacionó con el aumento de actividad de lipasa hepática (p<0,005), y con marcadores de insulino-resistencia (p<0,05). Fosfolipasa A2 (p<0,05), homocisteína (p<0,005), ferritina (p<0,0001), PCR-hs (p<0,005) y fibronectina (p<0,05)) fueron mayores en MPM. La oxidabilidad de LDL no mostró diferencias significativas pero correlacionó positivamente con LDL pequeña y densa (p<0,01), fosfolipasa A2 (p<0,05), homocisteína (p<0,05), PCR-hs (p<0,04), fibronectina (p<0,05) y cintura (p<0,02). Luego de ajustar por la condición menopáusica, edad y cintura, la oxidabilidad de LDL permaneció asociada con LDL pequeña y densa (b:0,36, p=0,027), homocisteína (b:0,36, p<0,038), fibronectina (b:0,41 p=0,05) y cintura (b:0,35, p=0,047). En este estudio, la interacción de factores de riesgo aterogénico clásicos y no tradicionales sugiere una secuencia de eventos que comienzan con la injuria endotelial causada por homocisteína y LDL pequeña y densa, que penetra en subendotelio donde su oxidación es favorecida por la homocisteína. Se produciría un proceso inflamatorio, que cursa con aumento de PCR y ferritina. La fosfolipasa A2, proveniente de macrófagos, atravesaría el endotelio unida a la LDL modificada, y promueve la liberación de fibronectina desde la matriz extracelular. La estrecha interacción entre la injuria endotelial, inflamación e insulino-resistencia se observaría desde estadíos subclínicos de aterosclerosis en MPM sanas.
Palabras clave: Menopausia; Oxidabilidad de lipoproteína de baja densidad; Fibronectina; Fosfolipasa A2; Homocisteína; Lipasa hepática
Summary
In postmenopausal women (PMW), high concentrations of atherogenic apoB lipoproteins is an important component of the multifactorial mechanism underlying a higher risk of coronary artery disease, as compared with premenopausal women (PreMW). Lipoprotein pattern, including apopoproteins A-I and B, LDL chemical composition and small dense LDL (sdLDL), hepatic lipase activity, circulating cholesterol transfer protein and LDL oxidability were assessed in PMW (n=30) in comparison to PreMW (n=28). The following endothelial injuring factors were measured: homocysteine, lipoprotein binding phospholipase A2 (LpPLA2), ferritin, hs-CRP and fibronectin coming from extracellular vascular matrix. Insulin-resistance was evaluated by waist circumference, HOMA and triglyceride/HDL-cholesterol. PMW showed higher apoB/apoA-I (p<0.0001) and a higher proportion of sdLDL which showed significant correlations with the increase in hepatic lipase activity (p<0.005) and insulin-resistance markers (p<0.05). LpPLA2 (p<0.05), homocysteine (p<0.005), hs-CRP (p<0.005), fibronectin (p<0.05) and ferritin (p<0.0001) were elevated in PMW. LDL oxidability showed no differences between groups, but was positively correlated with waist (p<0.02), homocysteine (p<0.05), fibronectin (p<0.05), hs-CRP (p<0.04), LpPLA2 (p<0.05) and sdLDL (p<0.01). After adjusting by age, menopausal condition and waist, LDL oxidability remained associated with homocysteine (b: 0,36) p<0,038), sdLDL (b: 0.36, p=0.027), waist (b: 0.35, p=0.047) and fibronectin (b: 0,41 p=0.05). In this study, the interaction of classic and emerging atherogenic risk factors would suggest a sequence of events starting with endothelial damage caused by homocysteine and sdLDL, promoting its passage into the subendothelial space where it is oxidatively modified, enhanced by homocysteine. The above mentioned inflammatory process takes place with an increase in circulating hs-CRP and ferritin. LpPLA2, coming from macrophages, passes through the endothelium bound to modified LDL, promoting a release of fibronectin from the subendothelial extracellular matrix. Results suggest that the close interaction among endothelial injury, inflammation and insulin resistance can be observed since subclinical atherosclerosis states in healthy PMW.
Key words: Menopause; Low density lipoprotein oxidability; Fibronectin; Phospholipase A2; Homocysteine; Hepatic lipase
INTRODUCCIÓN
Es ampliamente aceptado que el riesgo de enfermedad coronaria se incrementa progresivamente en mujeres en la perimenopausia (1) y más aún después de la menopausia. La elevada incidencia de aterosclerosis y de enfermedad cardiovascular en este periodo, están principalmente asociadas a la reducción de estrógenos circulantes y al incremento plasmático de los niveles de colesterol-LDL (2). En mujeres posmenopáusicas (MPM) ha sido descrito un patrón lipoproteico alterado, a pesar de que los niveles de colesterol de HDL tiendan a mantenerse o se reduzcan levemente (3)(4).
La lipasa hepática es una enzima clave involucrada en la hidrólisis de triglicéridos y fosfolípidos de las partículas de LDL y HDL, y en cooperación con la proteína transportadora de colesterol esterificado (CETP), contribuyen a la remodelación lipoproteica. Previamente se ha reportado un aumento de la actividad de lipasa hepática en la menopausia (5) posiblemente asociado a la disminución de estrógenos endógenos. Como consecuencia del aumento de la actividad de lipasa hepática aumentaría la proporción de la subfracción de LDL pequeña densa, ya descripta en MPM (6)(7). Las partículas de LDL pequeña densa per se son potencialmente más aterogénicas que las partículas de LDL de otras subclases (8). Su aumento es característico de un estado de insulino-resistencia el cual está estrechamente asociado con la condición menopáusica (9).
Teniendo en cuenta que los estrógenos son considerados potentes antioxidantes, en la menopausia se podría esperar un aumento de especies reactivas del oxígeno y de peroxidación lipídica. El aumento del estrés oxidativo podría influenciar sobre la injuria endotelial. La oxidabilidad de LDL depende, tanto de factores provenientes del plasma como de factores propios de la lipoproteína. Factores relacionados con la oxidación de LDL que podrían estar alterados en la condición posmenopáusica, aun en mujeres aparentemente sanas, podrían contribuir a explicar el proceso aterogénico subclínico.
La homocisteína plasmática, considerada un factor de riesgo cardiovascular, posee la capacidad de aumentar la auto-oxidación de LDL (10). Sin embargo, los resultados de distintos estudios sobre los efectos de la homocisteína plasmática en la menopausia son controversiales (11). Otro factor es la fosfolipasa A2 asociada a lipoproteínas (LpPLA2) cuyo rol pro- o antiaterogénico no ha sido totalmente dilucidado, especialmente en la posmenopausia (12). Componentes de la matriz extracelular, como fibronectina, pueden ser liberados a la circulación en caso de injuria endotelial y por lo tanto podrían actuar como marcadores del fenómeno aterogénico (13). Es bien sabido que se produce un proceso inflamatorio concomitante y por lo tanto, la PCR-hs podría también estar aumentada (14). Por otra parte, después del cese del sangrado menstrual la ferritina aumenta y podría promover la oxidación de LDL por el hierro que contiene (15).
Algunos estudios prospectivos y experimentales realizados en MPM han demostrado que la administración de estrógenos retarda el desarrollo de la aterosclerosis (16)(17). Sin embargo, los ensayos clínicos controlados y randomizados no han podido hasta ahora demostrar una disminución en la incidencia de eventos cardiovasculares (18)(19) y por el contrario, el estudio WHI en su rama estrógenos-progestágenos desaconseja fuertemente su utilización asociándolos a trombosis venosa (19). Por lo tanto, las investigaciones de los mecanismos promotores del alto riesgo aterogénico observado en MPM sanas siguen siendo relevantes. El objetivo de este trabajo fue evaluar la interacción entre los factores de riesgo circulantes mejor conocidos, involucrados en la injuria endotelial y la respuesta subendotelial en relación con las características de LDL, más allá de la concentración de colesterol- LDL y el aumento en la incidencia de resistencia a la insulina.
MATERIALES Y MÉTODOS
Pacientes y controles
Se estudiaron un total de 58 mujeres sanas, de las cuales 30 eran posmenopáusicas, seleccionadas consecutivamente y evaluadas clínicamente en la División Ginecología del Hospital Durand, Ciudad de Buenos Aires, Argentina. Sus edades estaban comprendidas entre 43 y 60 años (promedio 53 años), con al menos 1 año de menopausia natural y no más de 10 años de amenorrea. En todos los casos, los niveles séricos de hormona folículo-estimulante (FSH)>40 UI/L, confirmaron el estado menopáusico de las mujeres. El grupo control incluyó 28 mujeres en edad reproductiva (23 a 44 años, promedio 33 años) con examen físico y bioquímico normal. Fueron consecutivamente reclutadas entre las pacientes que fueron atendidas en el mismo centro para un control de rutina.
Se excluyeron mujeres que presentaron historia o síntomas de diabetes y de enfermedad cardiovascular, con historia de hipotiroidismo, neoplasia y desórdenes renales como así también aquellas que cursaban procesos inflamatorios o infecciosos, que recibían tratamiento hormonal, hipolipemiante, o con otras drogas que modifiquen el metabolismo lipídico. También fueron excluidas mujeres que recibían suplemento antioxidante. Las mujeres cuyo peso hubiera variado más de 5% en los últimos 6 meses fueron también excluidas. Cuatro MPM y 5 mujeres preM consumían de 2 a 6 cigarrillos por día, mientras que las restantes no fueron fumadoras en los últimos 10 años.
En ningún caso el consumo de alcohol superaba los 10 g/día. Las MPM y las MpreM no se encontraban bajo ningún tipo de entrenamiento físico regular. Ambos grupos consumían dietas similares cuya distribución fue de 20% de proteínas, hasta 30% de grasas con menos de 10% de grasas saturadas y por lo menos 50% de hidratos de carbono. Las calorías consumidas variaron de acuerdo con el peso corporal de cada una de las mujeres.
Se midió el peso con ropas livianas, la altura de cada paciente sin calzado y se calculó el índice de masa corporal (IMC) como peso (kg) /altura (m2) para evaluar el grado de obesidad. Se midió la circunferencia de la cintura entre la costilla del margen lateral inferior y la cresta ilíaca superior anterior, en posición vertical, procedimiento siempre realizado por el mismo investigador.
Se obtuvo el consentimiento informado de cada mujer, y el protocolo fue aprobado por el Comité de Ética de la Facultad de Farmacia y Bioquímica de la Universidad de Buenos Aires.
Muestras
Luego de 12 horas de ayuno se obtuvieron las muestras de sangre de la vena antecubital en tubos con EDTA (2,7 mmol /L) y en tubos secos con gel procoagulante. En el grupo de las MpreM la muestra fue tomada en la fase folicular del ciclo menstrual (días 3-7). Las muestras fueron centrifugadas a 1.500 x g a 4 °C durante 5 min. El suero se conservó a -20 °C cuando fue necesario. El plasma se conservó a 4 °C y fue usado dentro de las 24 h para el aislamiento de las lipoproteínas o almacenado a -70 °C para la posterior determinación de insulina, PCR-hs, homocisteína, Lp-PLA2, CETP y ferritina.
Luego de la toma de la muestra, se administró heparina intravenosa (60 UI por kg de peso) para determinar la actividad de la lipasa hepática. Diez minutos después se obtuvo sangre por punción venosa del brazo contralateral y se recogió en tubos sumergidos en hielo. El plasma post- heparínico se separó por centrifugación a 1.500 x g y 4 °C por 10 min y fue guardado a -70 °C hasta su procesamiento dentro de los 30 días.
Para la medida de PCR-hs se realizaron dos extracciones independientes, separadas por un intervalo de dos semanas y luego se promediaron los resultados. Valores mayores a 10 mg/L fueron confirmados.
Procedimientos analíticos
Colesterol, triglicéridos y glucosa fueron medidos en suero, utilizando equipos enzimáticos comerciales (Roche Diagnostics, Mannheim, Germany) en un autoanalizador HITACHI 727 (Bielefeld, Germany). Colesterol de HDL y LDL fueron determinados por métodos de precipitación selectiva (20)(21) (Roche Diagnostics, Manheim, Germany y Wiener, Rosario, Argentina, respectivamente). El CV de las determinaciones fue menor de 3%. Apo A-I y Apo B séricos fueron determinadas por inmunoturbidimetría (Roche Diagnostics, Mannheim, Germany). El control de calidad externo de los parámetros anteriores es trazable al Laboratorio del Dr Warnick a través del Programa RIQAS (Irlanda).
Homocisteína se determinó por inmunoensayo de polarización fluorescente (FPIA), insulina y ferritina por enzimoinmunoensayo de micropartículas (MEIA) y PCR-hs por inmunoturbidimetría (Roche Diagnostics, Mannheim, Germany). Tanto MEIA como FPIA se realizaron con un Sistema IMX en un Analizador IMX (Abbot Park, IL 60064, EEUU).
Para estimar la insulino-resistencia, se calcularon los siguientes índices: HOMA (homeostasis model assessment) calculado como: insulina en ayunas (umol/mL) x glucosa en ayunas (mmol/L)/22,5 y la relación triglicéridos/colesterol-HDL.
Actividad de CETP
La actividad de CETP se determinó en muestras de suero, de acuerdo con el procedimiento general previamente descrito (22). Brevemente, se evaluó la capacidad del suero para promover la transferencia de los ésteres de colesterol tritiado desde HDL3 biosintéticamente marcada (3H-CE-HDL3) (NEN Life Science Products, Boston, EE.UU.) hacia lipoproteínas con apo B. Las muestras fueron incubadas con 3H-CE-HDL3 (50 µmol/L de colesterol) y 1,5 mmol/L de iodoacetato a 37 °C durante 3 h. Una vez finalizada la incubación, las lipoproteínas fueron separadas por ultracentrifugación (densidad = 1.070 g/mL) a 250.000 x g y 4 °C durante 18 h. Se midió la radiactividad, tanto en el sobrenadante que contenía VLDL+IDL+LDL, como así también en el que contenía la fracción de HDL, utilizando Líquido Analizador de Centelleo (Packard 210TR; Packard Instruments, Meridian, CT). Los resultados se expresaron como el porcentaje de ésteres de colesterol marcados con tritio, transferidos desde HDL3 a las lipoproteínas con apo B por mL por hora. Todas las muestras fueron procesadas por duplicado dentro del mismo ensayo. El CV intraensayo fue de 4.9%.
Actividad de Lp-PLA2
La actividad de LpPLA2 se determinó siguiendo un ensayo radiométrico descrito por Blank et al (23) con algunas modificaciones. Brevemente, el acetato radioactivo liberado se separó del sustrato lipídico mediante una extracción entre fases y posteriormente se midió la radioactividad de la fase acuosa. A cada mezcla de incubación se le agregó suero diluido y 10 umol/L de 1-hexadecil-2-[3H]acetil-glicero-3-fosfocolina (actividad específica=25 µCi umol/L) en buffer PBS (pH=7,4). El sustrato tritiado (13,5 Ci mmol/L) se obtuvo de New England Nucleotides y el no tritiado, se obtuvo de Cayman Chemical. Una vez que se mezclan los sustratos, se evapora el solvente utilizando una corriente de nitrógeno y se redisuelve en PBS. La radioactividad de cada muestra y del blanco se determina con un analizador de centelleo liquido (Packard 210TR; Packard Instruments, Meridian, CT, EE.UU.). De igual manera se determina la radioactividad del buffer sustrato. Los resultados se expresan como µmol/mL.h. Todas las muestras fueron procesadas en el mismo ensayo. El CV intra ensayo fue de 5,1%.
Actividad de Lipasa Hepática
La actividad de la lipasa hepática en plasma posheparínico se determinó midiendo el ácido oleico producido por la hidrólisis, catalizada por la enzima, de una emulsión que contiene [3H]-trioleína (Amersham TRA 191; Amersham, Buckinghamshire, UK) (24). La trioleína marcada y no marcada (Sigma T-7140)
(1,3 µmoles/mL de trioleato de glicerol con una actividad específica de 10 x 106 cpm/µmol) se mezcló con 0,11 µmoles/mL de L-a-lisofosfatidilcolina (Sigma L-4129), 0,2% albúmina bovina sérica (Sigma A-6003), en buffer Tris-HCl 0,2M, pH 8,8 con NaCl 0,15M. Esta mezcla se incubó con plasma postheparínico en solución salina 1:10 en NaCl 1M durante 30 min a 30 °C. Al finalizar la incubación la reacción se frenó y los ácidos grasos liberados se separaron por medio de una extracción con un buffer de carbonato-borato pH=10,5. El ácido oleico-[3H] fue cuantificado utilizando un analizador de centelleo líquido. Los resultados se expresan como µmol de ácidos grasos libres por mL de plasma postheparínico, por hora. Todas las muestras fueron procesadas en el mismo ensayo por triplicado. El CV intra-ensayo fue de 4% y el CV inter-ensayo 9%.
Aislamiento de Lipoproteinas y análisis de LDL
Las lipoproteínas fueron aisladas por ultracentrifugación secuencial preparativa. La LDL total (densidad = 1.019-1.063 g/mL) y la LDL densa (densidad = 1.048-1.063 g/mL) se procesaron simultáneamente a partir de 2 alícuotas de plasma en una ultracentrifuga XL-90 Beckman con un rotor 90 Ti.
Cada centrifugación fue realizada a 105.500 x g a 15 °C durante 18 h. Las fracciones de lipoproteínas, cuya pureza se controló mediante una electroforesis en gel de agarosa, se almacenaron a -70 °C para su posterior análisis.
En cada fracción de LDL total aislada por ultracentrifugación se determinó colesterol, triglicéridos (por el método previamente mencionado), fosfolípidos (25) y proteínas totales (26) y se calculó la composición química porcentual. En la fracción de LDL densa se midió el colesterol y esta fracción fue expresada como un porcentaje del colesterol- LDL total (7).
Susceptibilidad de la LDL a la oxidación
La susceptibilidad de la LDL aislada a la oxidación fue realizada de la manera descrita previamente (27). La fracción de lipoproteína fue filtrada por cromatografía en gel en columnas PD-10 (Amersham Pharmacia Biotech, Uppsala, Sweeden) para remover EDTA y antioxidantes de bajo peso molecular. Luego se provocó la oxidación de la LDL (10 mg de proteina/dL de fracción) en 0,16 mol/L NaCl (pH=7,4), a 37 °C mediante el agregado de una solución preparada de CuCl2, quedando una concentración final de 10 µmol/L. El blanco de oxidación fue incubado sin el agregado del cobre.
Los productos de oxidación fueron determinados mediante la medición de la concentración de sustancias reactivas al ácido tiobarbitúrico (TBARS) y la cinética de formación de dienos conjugados. Para la medida de TBARS, las muestras de LDL aisladas fueron incubadas con cobre durante 120 min, para frenar la oxidación de LDL. Se agregó 2 mmol/L de EDTA (concentración final) y se determinó la concentración de TBARS como fue descrita previamente (27). La cinética de formación de los dienos conjugados fue continuamente monitoreada mediante el aumento de absorbancia a 234 nm (28) en un espectrofotómetro HITACHI U-1100 (Tokyo, Japan). El tiempo lag se calculó como intersección de la recta tangente al punto de inflexión de la curva con el eje de las X y fue expresado en minutos. El tiempo lag es un indicador de la resistencia a la oxidación.
Niveles séricos de fibronectina
Se determinó la fibronectina por un método enzimático desarrollado en fase sólida (EIA) usando Microtiter plates (Polysorp, Invitrogen Life Technologies). Las microplacas fueron cubiertas con 100 µL de anticuerpo IgM monoclonal murino diluido 1/100 (SC 18826, Santa Cruz Biotechnology Inc) obtenido contra fibronectina, péptido Cs-1 de origen humano, en buffer fosfato (PBS) (pH=7,4) durante 2 h a 37 °C y luego bloqueada con albúmina sérica bovina 1.5% P/V (ASB) en PBS.
En las muestras diluidas 1/10 y en estándar de fibronectina (F-2006, Sigma-Aldrich) se realizaron lavados con PBS y con PBS 1/10. La incubación se llevó a cabo durante toda la noche a 37 °C. Se utilizó como segundo anticuerpo uno policlonal de conejo contra fibronectina humana (100 µL diluido 1/1.500) (F-3648, Sigma Aldrich). La captura del ligando se detectó por agregado de anticuerpo IgG de conejo conjugado con peroxidasa (1/1.500) (A-0545, Sigma Aldrich). La unión del anticuerpo se comprobó por el agregado de 2% V/V de O-fenilen- diamina en 30% de buffer de fosfato / citrato (pH=5) con H2O2. La reacción se finalizó por el agregado de 3 mol/L de ácido sulfúrico. Luego se midió la absorbancia a 492 nm utilizando un lector para microplaca. El CV intraensayo fue de 7,5 % y el CV interensayo 8,1%.
Análisis estadístico
Los resultados fueron expresados como media ± DE para aquellos datos con distribución normal y como mediana y rango para los datos no paramétricos. La diferencia entre grupos fue evaluada utilizando el test t de Student y Mann-Whitney U-test, respectivamente. Las correlaciones entre variables se determinaron utilizando los tests de Pearson o Spearman dependiendo de las distribución de los parámetros. Se desarrolló un modelo de regresión multivariado para establecer la relación entre las lipoproteínas modificadas y otros factores de riesgo estudiados. Las diferencias se consideraron significativas con un p menor a 5%.
RESULTADOS
En la Tabla I se muestran las características generales de todas las mujeres. Las MPM presentan mayor índice de masa corporal (IMC), circunferencia de cintura, triglicéridos, colesterol total, colesterol-LDL y apo B en comparación con las MpreM (p<0,001).
Tabla I. Características de los sujetos y concentración plasmática de lípidos y lipoproteínas.
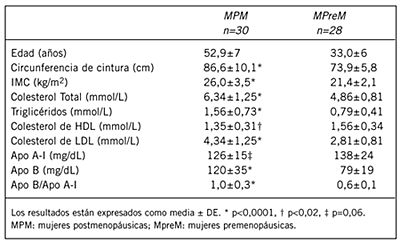
Por otro lado, el grupo de las MPM mostró un descenso en el colesterol de HDL (p<0,02) y una tendencia a bajos valores de apo A-I (p=0,06) a lo cual se suma el índice de riesgo apo B/apo A-I que fue significativamente mayor en MPM (p<0,0001).
Los marcadores de insulino-resistencia (Tabla II) como niveles de insulina y HOMA, fueron mayores en MPM (p<0,005). La relación triglicéridos/colesterol-HDL, considerada un estimador de insulino-resistencia y de LDL pequeña y densa fue significativamente mayor en MPM (p<0,0005). La Figura 1 A muestra la mayor proporción de LDL pequeña y densa en este grupo de mujeres versus controles premenopáusicos (p<0,05).
En el grupo de las MPM la composición química porcentual de la LDL muestra un enriquecimiento en triglicéridos (9,7±0,6% vs 7,4±0,3%, p<0,05).
Tabla II. Comparación de marcadores de insulino-resistencia entre MPM y MpreM.

Con respecto a los factores enzimáticos y de remodelación que intervienen en el metabolismo de las lipoproteínas, la Figura 1 B revela un aumento en la actividad de la lipasa hepática en las MPM (p<0,005) mientras que en la Figura 1 C se puede observar una tendencia no significativa a valores aumentados de CETP en este grupo (p=0,08).

Figura 1. Proporción de LDL pequeña y densa (Panel A), actividad de Lipasa Hepática (Panel B) y CETP (Panel C) en mujeres pre-menopáusicas (MpreM) y en mujeres posmenopáusicas (MPM). Los resultados están expresados como media±DE. * p<0,037, †p<0,005, ns: no significativo.
En la Tabla III se muestran los factores emergentes marcadores de injuria endotelial e inflamación estudiados en ambos grupos. No se observaron diferencias significativas entre grupos en la susceptibilidad a la oxidación de LDL. Sin embargo, los parámetros relacionados, homocisteína, Lp-PLA2, ferritina, PCR-hs y fibronectina fueron mayores en el grupo de MPM.
Las asociaciones entre los factores de riesgo estudiados se realizaron mediante el análisis de regresión lineal. La Tabla IV revela las correlaciones significativas entre oxidación de LDL y/o proporción de LDL densa con los otros factores estudiados. Los resultados muestran que la oxidabilidad de LDL expresada como tiempo lag correlacionó positivamente con homocisteína, fibronectina, PCR-hs, y con el contenido de triglicéridos de la LDL.
Tabla III. Factores emergentes de injuria endotelial e inflamación en mujeres pre y posmenopáusicas.
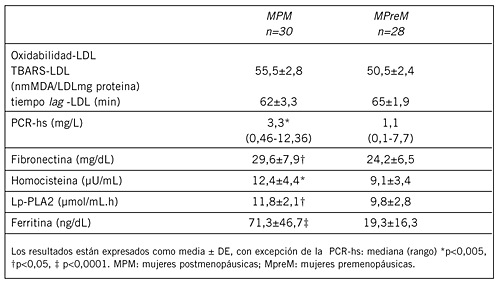
Tabla IV. Correlaciones significativas entre parámetros.

Los TBARS-LDL medidos luego de promover la oxidación de LDL correlacionaron positivamente con cintura, fibronectina y LDL pequeña y densa. Esta última, a su vez, correlacionó con marcadores de insulino-resistencia y con la actividad de lipasa hepática pero no con la actividad de CETP (r=0,11, p=0,47). Además, la LDL pequeña y densa se asoció con un aumento de PCR-hs.
La ferritina no correlacionó con oxidabilidad de LDL, ni con los otros parámetros, con excepción de la PCR-hs (r=0,63, p<0,00005). La Lp-PLA2 mostró una asociación significativa con colesterol de LDL (r=0,49, p<0,001), pero no con colesterol de HDL (r=0,12, p=0,24), indicando que la LDL es su principal transportador. Por otro lado, se encontró una correlación entre esta enzima y la oxidabilidad de LDL medida como TBARS de LDL (r=0,28, p=0,05).
Cabe destacar la correlación significativa encontrada entre PCR-hs con parámetros relacionados con resistencia a la insulina como cintura (r=0,52, p<0,0006) y triglicéridos/colesterol-HDL (r=0,41, p<0,004).
Luego de aplicar la regresión lineal ajustando por la condición menopáusica, edad y cintura, los TBARS-LDL permanecieron asociados con cintura (b: 0,35, p=0,047) y LDL pequeña y densa (b: 0,36, p=0,027), mientras que no se mantuvo la correlación significativa con fibronectina. Sin embargo, el tiempo lag de LDL mantuvo la asociación inversa significativa con homocisteína (b:-0,36, p<0,038) y fibronectina (b:-0,41 p=0,05).
Se perdió la correlación entre tiempo lag de LDL y PCR-hs. Cuando se agregó la lipasa hepática a este modelo se mantuvo la correlación significativa entre ésta y la LDL pequeña y densa, mientras que la asociación entre esta subfracción de LDL y los otros parámetros como los marcadores de insulino-resistencia, perdieron significación. Otra observación importante que surge del análisis de regresión múltiple fue la correlación significativa entre Lp-PLA2 y colesterol de LDL (b: 0,58, p=0,01), lo cual indica que esta asociación deriva de la unión de la enzima a LDL y es independiente de la edad, de la condición menopáusica y de la cintura. Cabe destacar que la PCR-hs permaneció asociada con la circunferencia de la cintura luego de realizar el ajuste (b: 0,39, p=0,05).
DISCUSIÓN Y CONCLUSIONES
En este estudio se evaluó la relación entre factores de riesgo cardiovascular circulantes, clásicos y emergentes, que reflejan la inflamación endotelial y subendotelial y el proceso aterogénico subclínico en el hipoestrogenismo. Las MPM, aún asintomáticas, muestran un perfil de lipoproteínas aterogénicas, un aumento de marcadores de injuria endotelial e inflamación y de fibronectina circulante que proviene del espacio subendotelial, en comparación con las MpreM. Además, se observó una correlación entre los parámetros mencionados con la elevada actividad de lipasa hepática, la alta proporción de LDL pequeña y densa, el grado de oxidación de LDL y el aumento de la circunferencia de cintura que implica mayor incidencia de resistencia a la insulina.
El presente estudio se focalizó en MPM sanas de acuerdo con los criterios de inclusión y exclusión previamente establecidos. Es importante tener en cuenta que las alteraciones en el perfil lipídico-lipoproteico comienzan en la perimenopausia (1)(29), con el lento proceso de evolución de la placa aterogénica que no invade el lumen vascular, lo cual justifica el estado preclínico, pero promueve la necesidad de encontrar marcadores precoces que permitan avanzar en el conocimiento de los mecanismos que relacionan los procesos inflamatorios, la injuria endotelial y la aterogénesis para diagnosticarlos y prevenirlos. Inevitablemente, existe una diferencia estadística de edad entre ambos grupos de mujeres, debido a que es difícil diseñar estudios que puedan diferenciar los efectos producidos por la edad y los que derivan de la menopausia. Por lo tanto, se realizaron ajustes estadísticos por edad para poder evaluar las asociaciones entre las diferentes variables.
Como era de esperar, el perfil de lipoproteínas plasmáticas mostró un aumento en el colesterol de LDL y en la concentración de triglicéridos. Es bien sabido que el colesterol de HDL no varia significativamente en la condición postmenopáusica (5)(6)(30)(31). Sin embargo, en los grupos estudiados las MPM poseen valores menores en comparación con las MpreM. Mas aún, como fue descrito previamente en MPM, la capacidad de la HDL para proteger a la LDL de la oxidación se encuentra disminuida, quizás porque posee menor resistencia a la oxidación (31), todo lo cual afecta al transporte reverso del colesterol. Por lo tanto, es factible que el rol ateroprotector de la HDL sea menos eficaz.
La Apo B y el índice Apo B/Apo A-I fueron mayores en las MPM. Este último es considerado un marcador de riesgo útil por su alto valor predictivo (32). Cada partícula de IDL y LDL, que se miden en conjunto en el laboratorio clínico, contiene sólo una copia de ApoB (32). Por otro lado, Apo A-I es la lipoproteína estructural de HDL, responsable de sus efectos antiaterogénicos y antioxidantes. De manera que el índice Apo B/Apo A-I refleja el balance entre lipoproteínas pro- y antiaterogénicas, demostrándose que es un fuerte predictor de infarto agudo de miocardio en hombres y mujeres. Actualmente no hay un valor de corte aceptable para el índice Apo B /Apo A-I, pero el estudio AMORIS revela que un índice de 1,0 en mujeres como el que se encontró, corresponde a un Odds ratio de 2,6 (IC: 2,2-3,8) (33).
Las MPM asintomáticas muestran un alto grado de resistencia a la insulina, evaluada por una mayor incidencia de circunferencia de cintura por encima de 88 cm, alto índice HOMA y un índice triglicéridos/colesterol-HDL, recientemente reconocido como un útil estimador (34). La fuerte asociación entre insulino-resistencia y la menopausia fue previamente descripta (1)(35). Mas aún, ha sido reportado que un aumento en el grado de obesidad abdominal correlacionó con un descenso en los niveles de estrógenos (29).
En cuanto a las subfracciones de LDL, se encontró aumento de LDL rica en TG. El origen de esta subfracción es el pasaje de TG de VLDL a LDL, mediado por CETP. Aunque la actividad de CETP no difiere entre grupos, las MPM presentan mayor concentración plasmática de TG, condición indispensable para que en LDL aumente su contenido. Se debe aclarar que la actividad de CETP se midió a través del transporte de colesterol tritiado desde HDL a LDL, porque se admite que el intercambio de TG por colesterol esterificado depende de CETP. El pasaje de TG de HDL a LDL no se midió, pero se encontró que la LDL de las pacientes contenía un significativo aumento de TG en comparación con las LDL típicas de las controles. Por lo tanto, no hay que esperar que la actividad de CETP, tal como se midió, tenga que ver con la formación de LDL rica en TG, que es la precursora de LDL pequeña y densa, un paso metabólico mediado por la actividad de LH que se encontró aumentada, de acuerdo con publicaciones anteriores (5). Cabe destacar que la LDL rica en triglicéridos es también reconocida como una lipoproteína modificada con potencial aterogénico (8).
Por efecto de la mayor actividad de la lipasa hepática, regulada por el descenso en la secreción de estrógenos y el aumento de insulina, se produce una notable correlación positiva entre el porcentaje de LDL pequeña y densa y la actividad de la enzima, aún luego del análisis de regresión múltiple, indicando que un aumento de lipasa hepática promueve la formación de LDL pequeña y densa (36) a partir de LDL rica en TG. Otros autores también encontraron asociación entre la condición menopáusica y la LDL pequeña y densa (6). La alta proporción de esta subfracción aterogénica conduce a injuria endotelial y a un aumento del pasaje de estas partículas a través del endotelio vascular, permitiendo su unión a los proteoglicanos, dado que la LDL pequeña y densa tiene más afinidad por estos que la subfracción de LDL liviana (8). Resultados de estudios llevados a cabo en mujeres con enfermedades cardiovasculares clínicas y subclínicas muestran que la LDL pequeña y densa y el gran número de estas partículas está relacionado con el aumento de incidencia de enfermedad coronaria en mujeres de edad avanzada (37).
El alto porcentaje de LDL pequeña y densa forma parte del perfil aterogénico característico asociado a un estado de insulino-resistencia. De hecho, en este estudio se observaron correlaciones entre LDL pequeña y densa y marcadores sustitutos como cintura, HOMA y el índice triglicéridos/colesterol-HDL.
En concordancia con publicaciones previas, los ensayos de susceptibilidad a la oxidación de LDL in vitro no mostraron diferencias significativas entre grupos (17). Sin embargo, se obtuvieron novedosas asociaciones con la oxidabilidad de LDL, aún luego del análisis de regresión múltiple, las cuales indican que a mayor proporción de LDL pequeña y densa mayor susceptibilidad de la LDL a la oxidación y a mayor obesidad abdominal determinada como la circunferencia de la cintura, mayor es la oxidabilidad de la LDL. Por lo tanto, mujeres con alto grado de insulino-resistencia presentarían aumento de la proporción de LDL pequeña y densa y una mayor susceptibilidad de LDL a la oxidación.
La homocisteinemia aumenta con la edad y promueve la disfunción endotelial lo cual se asocia con una disminución en la biodisponibilidad del óxido nítrico del endotelio. A esto se le suma el descenso de oxido nítrico característico del hipoestrogenismo (17). En concordancia con los hallazgos de otros autores, en este estudio las MPM mostraron un aumento de homocisteína (11)(38). Es importante remarcar que la asociación entre homocisteína y la oxidabilidad de LDL permaneció significativa luego del ajuste multivariado, sosteniendo la acción prooxidante ya descripta de la homocisteína. Los factores circulantes ya mencionados y la resistencia a la insulina produjeron una injuria en el endotelio que permitió el pasaje al subendotelio de LDL pequeñas y densas y su oxidación. La presencia de Lp-PLA2 revela que la injuria es una brecha que permite el regreso de lipoproteínas modificadas a la circulación. En el presente estudio la actividad de Lp-PLA2 fue mayor en MPM que en MpreM. La correlación positiva independiente de Lp-PLA2 con colesterol LDL y no con colesterol HDL sugiere que la Lp-PLA2 se encuentra estrechamente asociada con el contenido de Apo B en las lipoproteínas. Este hallazgo concuerda con resultados previos encontrados en pacientes hipertrigliceridémicos (39). La Lp-PLA2 unida a la LDL proviene de los macrófagos del subendotelio y su presencia en el lumen vascular podría ser un biomarcador de enfermedad cardiovascular (40). Hasta el momento, no ha sido descrito el mecanismo exacto que explique el aumento de la actividad Lp-PLA2 en MPM, sin embargo, podría explicarse por los altos niveles de LDL mínimamente oxidadas que constituyen el transportador principal de Lp-PLA2.
Como era de esperar, la concentración plasmática de ferritina fue mayor en MPM. Sin embargo, al igual que otros autores, no se encontró asociación con la susceptibilidad in vitro de la oxidación de LDL (41)(42). La alta concentración de ferritina no es sólo considerada un marcador de reservas de hierro, sino también una proteína de fase aguda. En un estudio de cohorte relevante (43) se reportó que el aumento de hierro como ferritina circulante es un factor de riesgo mayor de accidentes cerebrovasculares en la condición menopáusica. La estrecha correlación obtenida entre ferritina y PCR-hs sostiene que ambas pertenecen al grupo de las proteínas proinflamatorias presentes en la condición menopáusica.
PCR-hs medida con el método de alta sensibilidad también fue mayor en las MPM. Esta proteína es un marcador validado de inflamación endotelial y ha sido propuesto como un factor injuriante perteneciente al gran número de proteínas de fase aguda (44). Su relevancia en relación con este trabajo se reafirma en el Women Health Study, donde se demostró que la PCR-hs es mejor predictor de enfermedad cardiovascular que el colesterol de LDL. En el presente estudio los valores de la mediana fueron superiores a 3.0 mg/L, el cual corresponde al valor de corte actualmente considerado para un riesgo elevado (45). El aumento de los valores de PCR-hs en MPM se asoció con la oxidabilidad de LDL, la LDL pequeña y densa y la circunferencia de la cintura. Este último fue el único parámetro que permaneció ligado luego del ajuste multivariado, lo cual es consistente con la condición inflamatoria subclínica previamente descripta (46).
Se observó un aumento en la fibronectina circulante en las MPM, el cual se asoció con la oxidabilidad de LDL aún después del análisis de regresión múltiple. Una posible interpretación podría ser que la LDL oxidada produce daño endotelial, promoviendo la liberación de componentes de la matriz extracelular como fibronectina y metaloproteasas entre otros, colocándola en una lista de marcadores del proceso aterogénico preclínico y del daño endotelial en la menopausia.
Con respecto a los parámetros circulantes determinados, se podría proponer una secuencia de eventos que comienzan por el daño endotelial probablemente causado por la homocisteína y la LDL pequeña y densa. Por su menor tamaño y mayor carga positiva superficial, la LDL pequeña y densa atravesaría fácilmente la barrera endotelial hacia la íntima, donde su oxidación es favorecida por homocisteína. Se produce de esta manera un marcado proceso inflamatorio evidenciado por el aumento de PCR y ferritina. La LDL podría retornar a circulación unida a la Lp-PLA2 proveniente de los macrófagos que coincide con un desprendimiento de fibronectina desde la matriz subendotelial (Figura 2).
Actualmente se encuentran pocas publicaciones sobre la interacción entre lipoproteínas modificadas, inflamación, marcadores de estrés oxidativo e insulino-resistencia y componentes de la matriz extracelular en mujeres postmenopausicas aparentemente sanas. En resumen, las alteraciones observadas en este estudio evidenciarían un proceso activo de aterogénesis en MPM.

Figura 2. Esquema de relación entre factores circulantes de injuria endotelial.
Correspondencia
DRA. LAURA SCHREIER
Junín 956
1113 CIUDAD AUTÓNOMA DE BUENOS AIRES
Argentina
Tel.: (54) (11) 4964-8297
E-mail: lipids@ffyb.uba.ar
Agradecimientos
Los autores agradecen el valioso aporte de la Dra. Rosa Rotemberg en el desarrollo del método de fibronectina, al Dr. Francisco Basilio por la evaluación clínica y selección de los pacientes y a la Dra. Halina Grossman por las determinaciones de ferritina. Este estudio fue subsidiado con parte de los subsidios UBACyT B069 y ANPCyT, PICT 14299.
Referencias bibliográficas
1. Berg G, Mesch V, Boero L, Sayegh F, Prada M, Royer M, et al. Lipid and lipoprotein profile in menopausal transition. Effects of hormones, age and fat distribution. Horm Metab Res 2004; 36 (4): 215-20.
2. Arca M, Vega GL, Grundy S. Hypercholesterolemia in postmenopausal women. JAMA 1997; 271: 453-9.
3. Kannel WB. Metabolic risk factors for coronary artery disease in women: prospective from the Framingham study. Am Heart J 1987; 114: 413-9.
4. Wakatsuki A, Sagara Y. Lipoprotein metabolism in postmenopausal and oophorectomized women. Obstet Gynecol 1995; 85: 523- 8.
5. Berg G, Siseles N, González AI, Contreras Ortiz O, Tempone A, Wikinski R. Higher values of hepatic lipase activity in postmenopause: relationship with atherogenic intermediate density and low density lipoproteins. Menopause 2001; 8 (1): 51-7.
6. Carr M, Kim KH, Zambon A, Mitchell ES, Woods NF, Casazza CP, et al. Changes in LDL density across the menopausal transition. J Investig Med 2000; 48 (4): 245-50.
7. Berg G, Muzzio ML, Wikinski R, Schreier L. A new approach to the quantitative measurement of dense LDL subfractions. Nutr Metab Cardiovasc Dis 2004; 14: 73-80.
8. Berneis KK, Krauss RM. Metabolic origins and clinical significance of LDL heterogeneity. J Lipid Res 2002; 43 (9):1363-79.
9. Ayyobi AF, Brunzell JD. Lipoprotein distribution in the metabolic syndrome, type 2 diabetes mellitus, and familial combined hyperlipidemia. Am J Cardiol 2003; 92 (4A): 27-33.
10. Olszewski AJ, McCully KS. Homocysteine metabolism and the oxidative modification of proteins and lipids. Free Radic Biol Med 1993; 14 (6):683-93.
11. Hak AE, Polderman KH, Westendorp IC, Jakobs C, Hofman A, Witteman JC, et al. Increased plasma homocysteine after menopause. Atherosclerosis. 2000; 149 (1): 163-8.
12. Blake GJ, Dada N, Fox JC, Manson JE, Ridker PM. A prospective evaluation of lipoprotein-associated phospholipase A(2) levels and the risk of future cardiovascular events in women. J Am Coll Cardiol 2001; 38 (5): 1302-6.
13. Orem C, Durmus I, Kilinc K, Baykan M, Gokce M, Orem A, et al. Plasma fibronectin level and its association with coronary artery disease and carotid intima-media thickness. Coron Artery Dis 2003; 14 (3): 219-24.
14. Ridker PM. Clinical application of C-reactive protein for cardiovascular disease detection and prevention. Circulation 2003; 107: 363-9.
15. Berge LN, Bonaa KH, Nordoy A. Serum ferritin, sex hormones, and cardiovascular risk factors in healthy women. Arterioscler Thromb 1994; 14 (6): 857-61.
16. Abbey M, Owen A, Suzakawa M, Roach P, Nestel PJ. Effects of menopause and hormone replacement therapy on plasma lipids, lipoproteins and LDL-receptor activity. Maturitas 1999; 33 (3): 259-69.
17. Subbiah MT. Estrogen replacement therapy and cardioprotection: mechanisms and controversies. Braz J Med Biol Res 2002; 35 (3): 271-6.
18. Hulley S, Grady D, Bush, Furberg C, Herrington D, Riggs B, et al. Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women. Heart and Estrogen/Progestin Replacement Study (HERS) Research Group. JAMA 1998; 280: 605-13.
19. Rossouw JE, Anderson GL, Prentice Rl, LaCroix AZ, Kooperberg C, Stefanick ML, et al. Writing Group for the Women's Health Initiative Investigators. Risks and benefits of estrogen plus progestin in healthy postmenopausal women: principal results from the Women's Health Initiative randomized controlled trial. JAMA 2002; 288: 321-33.
20. Assman G, Schriewer H Schmitz G, Hägele EO. Quantification of high density lipoprotein cholesterol by precipitation with phosphotungstic acid-MgCl2. Clin Chem 1983; 29: 2026-30.
21. Assman G, Jabs H, Kohnert U, Nolte W, Schriewer H. LDL (low density lipoprotein) cholesterol determination in blood serum following precipitation of LDL with poly(vinyl sulphate). Clin Chim Acta 1984; 140: 77-83.
22. Lagrost L, Gandjini H, Athias A, Guyard-Dangremont V, Lallemant C, Gambert A. Influence of plasma cholesteryl ester transfer activity on the LDL and HDL distribution profiles in normolipidemic subjects. Arterioscler Thromb 1993; 13: 815-25.
23. Blank ML, Hall MN, Cress AE, Snider F. Inactivation of 1-alkyl-2-acetyl-sn-glycero-3-phosphocholine by a plasma acetylhydrolase: higher activities in hypertensive rats. Biochem Biophys Res Commun 1983; 113: 666-71.
24. Nilsson-Ehle P, Ekman R. Rapid, simple and specific assays for lipoprotein lipase and hepatic lipase. Artery 1977; 3(3):194-200.
25. Bartlett G. Phosphorus assay in column chromatography. J Biol Chem 1959; 234: 466-8.
26. Markwell MA, Hass SM, Bieber LL, Tolbert NE. A modification of the Lowry procedure to simplify protein determination in membrane and lipoprotein samples. Anal Biochem 1978; 87: 206-10.
27. Schreier LE, Sanguinetti S, Mosso H, Lopez G, Siri L, Wikinski R. Low-density lipoprotein composition and oxidability in atherosclerotic cardiovascular disease. Clin Biochem 1996; 29: 479-87.
28. Esterbauer H, Jurgens G. Mechanistic and genetic aspects of susceptibility of LDL to oxidation. Curr Opin Lipidol 1993; 4: 114-24.
29. Mesch VR, Boero LE, Siseles NO, Royer M, Prada M, Sayeg F, et al. Metabolic syndrome throughout the menopausal transition: influence of age and menopausal status. Climacteric 2006; 9: 40-8.
30. de Aloysio D, Gambacciani M, Meschia M, Pansini F, Bacchi Modena A, Bolis PF, et al. The effect of menopause on blood lipid and lipoprotein levels. The Icarus Study Group. Atherosclerosis 1999; 147 (1):147-53.
31. Zago V, Sanguinetti S, Brites F, Berg G, Verona J, Basilio F, et al. Impaired high density lipoprotein antioxidant activity in healthy postmenopausal women. Atherosclerosis 2004; 177 (1): 203-10.
32. Sniderman AD. How, when, and why to use apolipoprotein B in clinical practice. Am J Cardiol 2002; 90 (8A): 48i-54i.
33. Walldius G, Jungner I. The apoB/apoA-I ratio: a strong, new risk factor for cardiovascular disease and a target for lipid-lowering therapy-a review of the evidence. J Intern Med 2006; 259 (5): 493-519.
34. McLaughlin T, Reaven G, Abbasi F, Lamendola C, Saad M, Waters D, et al. Is there a simple way to identify insulin-resistant individuals at increased risk of cardiovascular disease? Am J Cardiol 2005; 96 (3): 399-404.
35. Christodoulakos G, Lambrinoudaki I, Panoulis C, Sioulas V, Rizos D, Caramalis G, et al. Serum androgen levels and insulin resistance in postmenopausal women: association with hormone therapy, tibolone and raloxifene. Maturitas 2005; 50 (4): 321-30.
36. Zambon A, Bertocco S, Vitturi N, Polentarutti V, Vianello D, Crepaldi G. Relevance of hepatic lipase to the metabolism of triacylglycerol-rich lipoproteins. Biochem Soc Trans 2003; 31 (Pt 5): 1070-4.
37. Kuller L, Arnold A, Tracy R, Otvos J, Burke G, Psaty B, et al. Nuclear magnetic resonance spectroscopy of lipoproteins and risk of coronary heart disease in the cardiovascular health study. Arterioscler Thromb Vasc Biol 2002; 22 (7): 1175-80.
38. Lentz SR, Rodionov RN, Dayal S. Hyperhomo-cysteinemia, endothelial dysfunction, and cardiovascular risk: the potential role of ADMA. Atheroscler (Suppl.) 2003; 4 (4): 61-5.
39. Brites FD, Verona J, Schreier LE, Fruchart JC, Castro GR, Wikinski RL. Paraoxonase 1 and platelet-activating factor acetylhydrolase activities in patients with low HDL-cholesterol levels with or without primary hypertriglyceridemia. Arch Med Res 2004; 35 (3): 235-40.
40. Packard CJ, O'Reilly DS, Caslake MJ, McMahon AD, Ford I, Cooney J, et al. Lipoprotein-associated phospholipase A2 as an independent predictor of coronary heart disease. West of Scotland Coronary Prevention Study Group. N Engl J Med 2000; 343 (16): 1.148-55.
41. Iribarren C, Sempos CT, Eckfeldt JH, Folsom AR. Lack of association between ferritin level and measures of LDL oxidation: the ARIC study. Atherosclerosis Risk in Communities. Atherosclerosis 1998; 139 (1): 189-95.
42. Brouwers A, Langlois M, Delanghe J, Billiet J, De Buyzere M, Vercaemst R, et al. Oxidized low-density lipoprotein, iron stores, and haptoglobin polymorphism. Atherosclerosis 2004; 176 (1): 189-95.
43. Van der A DL, Grobbee DE, Roest M, Marx JJ, Voorbij HA, van der Schouw YT. Serum ferritin is a risk factor for stroke in postmenopausal women. Stroke 2005; 36 (8): 1637-41.
44. Gabay C, Kushner I. Acute-phase proteins and other systemic responses to inflammation. N Engl J Med 1999; 340 (6): 448-54.
45. Albert MA, Glynn RJ, Buring J, Ridker PM. C-reactive protein levels among women of various ethnic groups living in the United States (from the Women's Health Study). Am J Cardiol 2004; 93 (10): 1238-42.
46. Pearson TA, Mensah GA, Alexander RW, Anderson JL, Cannon RO 3rd, Criqui M, et al. Markers of inflammation and cardiovascular disease: application to clinical and public health practice: A statement for healthcare professionals from the Centers for Disease Control and Prevention and the American Heart Association. Circulation 2003; 107(3): 499-511. [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ]
Aceptado para su publicación el 13 de septiembre de 2007














