Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. v.41 n.4 La Plata oct./dic. 2007
BIOQUÍMICA CLÍNICA
Un método simple para la recolección, extracción y medición de catecolaminas en orina de adultos mayores*
A simple method to collect, extract and measure urinary catecholamines in elderly people
Silvia Benavides Varela1, Jaime Fornaguera Trías2
1. Bachiller.
2. PhD en Ciencias Naturales.
* Programa de Investigación en Neurociencias- Frente a la Facultad de Bellas Artes, Ciudad Universitaria Rodrigo Facio, Universidad de Costa Rica. San Pedro de Montes de Oca, San José Costa Rica.
Resumen
La medición de catecolaminas en orina ha sido utilizada tanto para diagnóstico como para la investigación. Este trabajo propone algunas modificaciones y condiciones estandarizadas para llevar a cabo la recolección de muestras de orina y la extracción y cuantificación de las catecolaminas utilizando cromatografía líquida de alto desempeño con detección electroquímica (HPLC-EC). Se probaron distintos métodos de preservación de la muestra durante la recolección, y se encontró que no es necesario utilizar ningún preservante o refrigerante para mantenerla estable. Se utilizó también la extracción en fase sólida (EFS) en la que, al modificar variables como la velocidad de elusión y la cantidad del eluyente final, se obtuvieron porcentajes de recuperación de 85,8% para dopamina, 88% para epinefrina y 96,9% para norepinefrina. En la medición por cromatografía, los coeficientes de variación fueron menores al 10% en la evaluación entre días y entre corridas; el error fue 2,5% en todos los casos. Se probó, además, que el método es lineal (r2Ž0,9882; a<0,001) y que los valores obtenidos son comparables con resultados reportados previamente para adultos mayores, aunque el método y los cambios propuestos podrían ser utilizados también en otros grupos etarios.
Palabras clave: Catecolaminas en orina; Manipulación de muestras; Extracción en fase sólida; Epinefrina; Norepinefrina; Dopamina; Cromatografía líquida de alto desempeño
Summary
Catecholamines in plasma and urine have been widely used for clinical diagnosis and research. The present paper proposes simple changes to collect, extract and quantify catecholamines among elderly people, and to obtain more accurate results using HPLC-EC. Refrigeration and acid were tested as preserving methods during urine collection. A pre-treatment with SPE was used to clean samples, and some variables were changed in order to improve recovery previous to chromatography analysis. No significant differences were found in sample catecholamines concentration using different preservation methods, or even in samples without refrigeration or acid during collection. Recovery obtained after changing some variables in SPE was 88.0% in epinephrine, 85.8% in dopamine and 96.9% in norepinephrine. VC was less than 10% between-days and between-run evaluation in all catecholamines, and error was 2.5%. Calibration curves were linear (r2Ž0.9882; a<0.001) in matrixes employed. Values obtained in test samples were comparable with previous results reported in elderly people. The method and the changes proposed are useful to measure urinary catecholamines in elderly people. However, it is proposed that they could also be useful for other age groups, and not only for research but also for clinical purposes.
Keywords: Urinary catecholamines; Handling; Solid phase extraction; Epinephrine; Norepinephrine; Dopamine; High performance liquid chromatography
INTRODUCIÓN
Las tres principales catecolaminas: epinefrina (E), norepinefrina (NE) y dopamina (DA) son sustancias sintetizadas en el cuerpo a nivel de la médula adrenal, el sistema nervioso simpático y el cerebro. Se consideran de interés clínico y de investigación pues llevan a cabo un número importante de funciones, influencian el funcionamiento de muchos tejidos e interactúan con algunos sistemas hormonales en la regulación de una amplia variedad de procesos fisiológicos.
La medición de los niveles de las catecolaminas y sus metabolitos en plasma y orina, ha sido ampliamente usada en el estudio de gran variedad de padecimientos que van desde la hipertensión, enfermedades cardíacas, hiper- e hipotiroidismo, hasta desórdenes afectivos, distrofias musculares y Parkinson (1-6). La cuantificación de catecolaminas también ha sido utilizada para el diagnóstico de feocromocitoma, un tumor de la médula adrenal que aumenta los niveles de catecolaminas circulantes y en orina. Este aumento provoca en aproximadamente del 80 al 85% de los casos, un aumento de la presión arterial que se hace patente en manifestaciones clínicas tales como cefalea, sudación, tremor y taquicardia, entre otras (7-10).
Más recientemente, la medición basal de catecolaminas ha sido empleada en estudios de interés demográfico, en donde se han incorporado como parte de la batería de marcadores biológicos de desregulación crónica y para la determinación de la carga alostática (11-13); otros estudios longitudinales han permitido correlacionar los niveles de estas hormonas con una disminución funcional e incluso con mortalidad (14).
Si bien las catecolaminas pueden medirse tanto en plasma como en orina (15)(16), para estudios en los que se requiere una medición basal, se prefiere la recolección nocturna de muestras de orina, de manera que las variaciones puedan asociarse con mayor certeza a desórdenes fisiológicos, más que a eventos específicos o esporádicos (12) (17-19).
Debido entre otras cosas, a las bajas concentraciones de estas catecolaminas en fluidos biológicos, es que se han propuesto rigurosos cuidados durante la recolección, almacenamiento y procesamiento de muestras para evitar pérdidas debido a la descomposición y/o contaminación de los especímenes (1)(20)(21).
La búsqueda de las condiciones más efectivas para la recolección, pretratamiento y almacenamiento de las muestras de orina, han sido ya objeto de estudio (22-24). Se han llevado a cabo algunos trabajos para evaluar la estabilidad de las catecolaminas urinarias después de amplios periodos de almacenamiento. Giles y Meggiorini (20) encontraron que a temperatura ambiente las catecolaminas son estables utilizando glutatión y EDTA como preservantes, o incluso en orina no preservada pero almacenada a -30 °C. NE y DA son estables durante 13 meses a -80 °C en orina preservada con EDTA y metabisulfito de sodio (25), e incluso se ha encontrado que si las muestras van a ser analizadas tras un breve almacenamiento, por ejemplo una semana, el mantenimiento a -20 °C sería suficiente (1).
A nivel experimental, la complejidad de las matrices biológicas en las que se encuentran disueltas las catecolaminas y las relativamente bajas concentraciones de estos compuestos, han sido limitantes y han hecho que la medición requiera el uso de técnicas especializadas y sistemas suficientemente sensibles adaptados a los nuevos equipos.
La espectrofotometría y fluorimetría (26) solían emplearse para la determinación de las catecolaminas; actualmente se utilizan también las técnicas de ELISA, RIA (27-29), la cromatografía de gas, espectroscopía de masas (9) o la cromatografía líquida de alto rendimiento-HPLC (1)(16)(28)(30).
Desde el punto de vista práctico, la selección de la técnica para la medición por parte de cada laboratorio, depende no sólo de las demandas de especificidad, sensibilidad, precisión y fácil manejo, sino también de la disponibilidad de los recursos para adquirir los reactivos y aparatos necesarios en cada una de ellas; éstas son, quizá, algunas de las razones por las que los métodos varían entre laboratorios, sin que hasta ahora se haya propuesto uno como estándar aceptado internacionalmente.
Además de las reformas que han sugerido otros autores para mejorar la sensibilidad de la medición de catecolaminas en orina por HPLC (31), en este trabajo se proponen algunas modificaciones y condiciones sencillas en cuanto a las metodologías de recolección, extracción y cuantificación, que simplifican el proceso y que a su vez repercuten positivamente en la obtención de resultados precisos. Una vez estandarizado y adaptado a las condiciones del laboratorio, el método ha sido validado, asegurando con ello resultados confiables al momento de su utilización, tanto para trabajos de interés clínico como para estudios demográficos similares a los que se llevan a cabo actualmente en Costa Rica.
MATERIALES Y MÉTODOS
Materiales
Los reactivos de NE ((-)-norepinefrina(+)-bitartrato. H2O), E ((-)-epinefrina(+)-bitartrato), DA (Dopamina HCl), y DHBA (3,4-dihidroxibenzilamina HBr) empleados en la preparación de los estándares fueron adquiridos en Bioanalytical Systems (Indiana, EE.UU.). Para las pruebas de estandarización se utilizó un pool de orina con muestras de voluntarios sanos con edades comprendidas entre 18 y 45 años. El pool (1 litro en total) se mezcló en un recipiente con 10 mL de HCl 6N y se mantuvo en refrigeración (4 °C) hasta su uso.
El ácido clorhídrico fue adquirido en Aldrich Chemical Co (Milwaukee, EE.UU.) y el hielo en gel (Ice Pack) fue proporcionado por Congel Plus (San José, CR).
Los recipientes plásticos para la recolección de las muestras (TX-1/2G) con capacidad para 1.920 mL fueron adquiridos en Proplax (San José, CR), las hieleras de estereofón empleadas para el mantenimiento del frío durante la recolección, son cilíndricas de 20,5 cm de altura y 21,5 cm de diámetro interno y se adquirieron en Termopor (San José, CR.)
Para el pretratamiento de las muestras se llevó a cabo una extracción en fase sólida (EFS) con columnas de Varian-Bond Elut C18 usando como eluyentes los reactivos del equipo MF-9020 para catecolaminas urinarias de Bioanalytical Systems (BAS-Indiana, EE.UU.). La fase móvil empleada durante la medición (código CF-1102), también fue adquirida en BAS (Indiana, EE.UU.), y estaba incluida en el equipo mencionado.
Equipos
Se utilizó una Bomba 515-Waters (Massachussets, EE.UU.) con un asa de inyección de 50 µL, un detector electroquímico Ag/AgCl 464 Pulsed-Waters (Massachussets, EE.UU.), y un controlador de temperatura LC-22C de la compañía BAS (Indiana, EE.UU.). Los análisis se llevaron a cabo con una columna Unijet LC column ODS de 100 mm x 3 mm y un tamaño de partícula de 3 µm, de BAS (Indiana, EE.UU.).
Para la extracción en fase sólida se empleó una cámara de vacío Vac Elut 20-Varian (California, EE.UU.) y una bomba de generación de vacío modelo DOA-V152-AA Gast (Miami, EE.UU.). Para homogenizar las muestras de orina se empleó un vórtex AP56-Phoenix (New York, EE.UU.), y en la integración de los resultados se utilizó el software Chromatography Station for Windows CSW32-DataApex (Praga, República Checa).
Efecto del preservante sobre la estabilidad de la muestra
Con el objetivo de minimizar al máximo la degradación de la muestra que se recolecta y de procurar con ello las mejores condiciones y fidelidad durante la medición, se probaron distintas metodologías para la preservación.
Debido a las variaciones reportadas previamente en la literatura en relación con el preservante a utilizar para el mantenimiento de las catecolaminas, se llevaron a cabo pruebas para determinar la necesidad y viabilidad de emplear un refrigerante (hielo gel) y/o ácido clorhídrico 6N para el cumplimiento de esta función. Para ello, se recolectaron muestras de cuatro voluntarios (todos mayores de 60 años, dos de ellos varones), quienes recogieron su orina durante 12 horas (desde 6 p.m. hasta 6 a.m. en cada día de análisis) en recipientes de plástico. La recolección de las muestras se realizó por cuatro días, y en cada uno de ellos con diferentes condiciones de preservación: Día 1: sin refrigeración y sin ácido (SRSA), Día 2: solamente con ácido (SRCA), Día 3: solamente refrigerada (CRSA) y Día 4: refrigerada y con ácido (CRCA).
A las muestras que se recolectaron con ácido como preservante, se les adicionó 15 mL de HCl 6N, y las muestras que requerían refrigeración se cubrieron con bolsas de hielo gel y se colocaron dentro de hieleras de estereofón.
Aquellas muestras que se mantuvieron sin ácido durante las 12 horas (SRSA y CRSA), se separaron posteriormente y se trataron diferencialmente antes de su almacenamiento. La mitad del volumen de cada muestra se conservó sin el ácido (tal y como se recolectó) y a la otra mitad se le adicionó HCl 6N, hasta alcanzar pH 2.
Todas las muestras se alicuotaron y se almacenaron en el congelador de -20 °C hasta su análisis.
Extracción en fase sólida (EFS)
Con el objetivo de limpiar la muestra de orina de los contaminantes que podrían interferir con la detección de las catecolaminas, se realizó una EFS previa a la inyección de la muestra en el cromatógrafo.
Los cartuchos o columnas, así como los reactivos para la extracción (Reactivo A: solución de pretratamiento; Reactivo B: solución de lavado-I; Reactivo C: solución de lavado-II; Reactivo D: solución de elusión), están incluidos dentro del equipo de BAS, y las condiciones iniciales de trabajo son las que se describen en el manual de instrucción del mismo.
Antes de iniciar el proceso de extracción, cada muestra de orina se dejó descongelar a temperatura ambiente y se agitó durante 10 s a velocidad 5 con el vórtex.
Inicialmente, las sustancias (tanto los solventes como la muestra) fueron eluídas a través de los materiales de extracción (sílica) a una velocidad de 1 mL/min (aplicando vacío), colectando al final del proceso 2 mL del reactivo de elusión.
Como no se logró una recuperación satisfactoria de las catecolaminas utilizando las condiciones iniciales de extracción sugeridas en el paquete comercial, se probaron algunas modificaciones en la velocidad de elusión de los reactivos (eliminando la aplicación de vacío en prácticamente la totalidad del proceso de EFS, se obtuvo un flujo de 0,1 mL/min en la elusión) y en la cantidad de solvente final colectado (0,5 mL en vez de 2 mL como se proponía inicialmente).
Con las condiciones iniciales de trabajo, así como con las distintas modificaciones que fueron evaluadas, se realizaron pruebas de recuperación de las catecolaminas para lo cual se prepararon diez soluciones acuosas con concentraciones conocidas (soluciones estándar acuosas) que fueron divididas en dos fracciones. Una de estas fracciones fue inyectada directamente para su cuantificación; la segunda se hizo pasar por el proceso de extracción en fase sólida, simulando el tratamiento que se aplicaría para la purificación de las muestras de orina. Con la cuantificación de cada una de las catecolaminas en ambas fracciones, se calculó el porcentaje de recuperación de las catecolaminas de la siguiente manera:

Estabilidad de las muestras con previa EFS
Posteriormente se llevaron a cabo ensayos de estabilidad de las muestras que habían sido extraídas, para lo cual se emplearon 5 estándares acuosos de concentración conocida, así como 5 muestras del pool de orina. Las mediciones de todas las muestras se llevaron a cabo el mismo día de la extracción y también después una semana de almacenamiento en refrigeración (4 °C).
Medición de catecolaminas
La concentración de las catecolaminas libres urinarias se midió utilizando la técnica de cromatografía líquida de alto desempeño con detección electroquímica (HPLC-EC). El flujo utilizado en la medición fue de 1,5 mL/min y la columna analítica se mantuvo a una temperatura de 28 °C. En el detector se aplicó una corriente de 600 mV, y la intensidad de corriente fue de 10 nA para E y NE y de 20 nA para DA. La integración de los resultados se realizó a través de una curva lineal construida con 3 calibradores, con concentraciones de 9,4 ng/mL, 18,8 ng/mL y 37,5 ng/mL de E; 14,1 ng/mL, 28,1 ng/mL y 56,3 ng/mL de NE, y 93,8 ng/mL, 187,5 ng/mL y 375 ng/mL de DA. Las mediciones se hicieron utilizando la altura de los picos y la concentración se calculó con base en un estándar externo (debido a las variaciones en la concentración del estándar interno que fueron detectadas durante el proceso de extracción en fase sólida).
Variación entre días
Para evaluar la variación entre-días de los ensayos, se inyectaron 15 muestras de: 1) la solución estándar acuosa de concentraciones conocidas, 2) la misma solución pero luego de pasar a través de las columnas de extracción en fase sólida, y 3) la mezcla de orina purificada por EFS. Estas inyecciones se realizaron durante tres días consecutivos.
Repetibilidad
Un sistema de medición es repetible si múltiples mediciones de exactamente la misma parte son iguales o muy parecidas. Para evaluar la repetibilidad del ensayo se inyectaron 15 muestras de: 1) una solución estándar acuosa de concentraciones conocidas, 2) la misma solución luego de pasar a través de las columnas de extracción en fase sólida, y 3) la mezcla de orina purificada por EFS.
De las 15 inyecciones se obtuvo el promedio, desviación estándar y coeficiente de variación.
Exactitud
La exactitud se entiende como la capacidad del instrumento de medición para obtener, en promedio, una medida que es igual al valor verdadero.
Para probar si los instrumentos y la técnica utilizada para la medición eran confiables, se realizó una prueba de exactitud en la que se hicieron 15 inyecciones de una muestra de concentraciones conocidas de las catecolaminas.
Linealidad
Se refiere a la consistencia de las mediciones bajo un rango de valores verdaderos. Se evaluó la linealidad alcanzada con: 1) soluciones acuosas de concentraciones conocidas (también llamados calibradores o estándares acuosos), 2) las mismas soluciones pero después del proceso de EFS, y 3) la mezcla de orina purificada por EFS a la que se le adicionaron catecolaminas en concentraciones conocidas (calibradores de orina).
Prueba piloto
Una vez que se estandarizaron y validaron los protocolos de recolección, extracción en fase sólida y medición de catecolaminas, se llevó a cabo una prueba piloto para determinar la precisión del método con 15 individuos, todos mayores de 60 años.
Los individuos participantes firmaron un consentimiento informado; el proyecto y las pruebas aplicadas fueron aprobados por el Comité de Bioética de la Universidad de Costa Rica.
Además de medir catecolaminas, una alícuota de cada muestra de orina fue usada para determinar los niveles de creatinina. La alícuota fue analizada por espectrofotometría (reacción de Jaffé) en el laboratorio de análisis clínicos de la Facultad de Microbiología en la Universidad de Costa Rica. Los resultados fueron utilizados para el reporte de los valores de las catecolaminas en cada uno de los sujetos.
Análisis estadístico
Para las comparaciones entre grupos en todos los casos se llevó a cabo un análisis de varianza, y los valores p<0,05 fueron considerados significativos. En el cálculo de linealidad se utilizó el coeficiente de correlación de Pearson.
RESULTADOS
Efecto del preservante sobre la estabilidad de la muestra
En los resultados obtenidos (Tabla I) no se observan diferencias significativas en la concentración de las muestras analizadas con relación al preservante utilizado durante la recolección (a=0,621 para E; a=0,916 para NE y a=0,935 para DA).
A pesar de que estadísticamente no se mostraron diferencias entre los tratamientos, se encontró que las muestras que fueron colectadas sin refrigerante y sin ácido, y que al llegar el laboratorio se llevaron a pH 2 con HCl (SRSA+HCl), se alteraron de manera tal que se perdió la resolución de los picos y se presentaron mayores irregularidades en la línea de base (Fig. 1).
Tabla I. Promedio de la concentración de las catecolaminas de acuerdo con los tratamientos de preservación de la muestra utilizados durante la colecta.

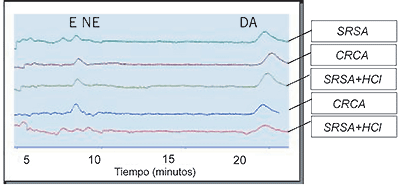
Figura 1. Comparación de la resolución y limpieza de los cromatogramas según el tratamiento de colecta empleado en cada caso. SRSA: Sin refrigeración, sin ácido. CRSA: Refrigerado, sin ácido. CRSA + HCl: Refrigerado, sin ácido (colecta) con adición de ácido previo almacenamiento. CRCA: Refrigerada, con ácido. SRSA + HCl: Sin refrigeración, sin ácido + ácido clorhídrico posterior a la colecta. E: epinefrina, NE: norepinefrina, DA: dopamina.
Recuperación de catecolaminas después de la extracción en fase sólida
Se encontraron notables variaciones en la recuperación de las catecolaminas como consecuencia de las modificaciones en el proceso de extracción. Como se puede observar en la Tabla II, el porcentaje de recuperación de las catecolaminas aumentó considerablemente al variar la velocidad de elusión de los solventes, eliminando la aplicación del vacío en prácticamente todo el proceso de extracción en fase sólida. Si bien esta modificación aumentó significativamente el tiempo para llevar a cabo el procedimiento completo (pasó de 20 minutos a 2 horas en cada bloque de muestras extraídas), los resultados obtenidos con la variante sustentan que la estandarización del protocolo se lleve a cabo de esta manera.
Más aún, al concentrar las sustancias colectadas en sólo 0,5 mL en lugar de 2,0 mL, como lo sugería el protocolo inicial, la recuperación (después de la corrección por el factor de dilución) también se vio aumentada (Fig. 2).
Como se puede observar en la Tabla II, los resultados fueron particularmente satisfactorios para NE, en donde la recuperación superó el 95%; fueron un poco menores los porcentajes para E y todavía menores en DA, en la que se logró una recuperación máxima del 85,8%. A pesar de lo anterior, se observa claramente que el valor relativo de recuperación (comparando entre tratamientos para la misma catecolamina) es mucho mayor si se lleva a cabo la elusión a una velocidad de 0,1 mL/min y también se colectan 0,5 mL de solvente final. Con estas condiciones, el incremento en la recuperación de la DA, fue de más de 25 puntos porcentuales si se compara con el obtenido en las condiciones iniciales.
Tabla II. Recuperación de las catecolaminas urinarias después del proceso de extracción en fase sólida.


Figura 2. Variación en la detección de las catecolaminas en las muestras de orina según la cantidad de eluyente D que se colecta al final del proceso de EFS. E: epinefrina, NE: norepinefrina, DA: dopamina.
Estabilidad de las muestras con previa EFS
Los resultados obtenidos en este caso permiten afirmar que las muestras de soluciones estándar acuosas que han pasado por el proceso de EFS se mantienen estables y sin variaciones significativas en la concentración de las catecolaminas aún después de siete días en refrigeración a 4 °C (datos no mostrados, a=0,356).
Tampoco se encontraron diferencias significativas en la respuesta de las catecolaminas del pool de orina (a=0,410); desde el día de la purificación y hasta una semana después de la extracción la concentración de estas sustancias se mantuvo estable en las muestras.
Medición de catecolaminas
Utilizando las condiciones en las que el método fue estandarizado y adaptado, se obtuvo un tiempo total de corrida de 20 minutos. Los tiempos de retención para las catecolaminas fueron 7,4 m para E; 8,1 m para NE y 18,4 m para DA.
Variación entre días
De las inyecciones realizadas durante los tres días de la medición, se encontró que no existe una diferencia en la medición realizada entre días. Los coeficientes de variación en todos los casos estuvieron por debajo del 10% en la mezcla de orina y en las soluciones acuosas con previa extracción, y fueron inferiores al 4% en las soluciones estándar acuosas.
Repetibilidad
Como puede observarse en la Tabla III, el método muestra variaciones poco significativas, con coeficientes de variación que rondan el 10% en todos los casos. Se presentaron menos variaciones en las muestras de estándar acuosas en relación con las preparaciones de orina. Los coeficientes de variación fueron muy similares en las tres catecolaminas, demostrando que la medición conjugada es factible y repetible.
En la matriz de orina, el método es ligeramente más variable para norepinefrina que para las otras dos catecolaminas, aunque los coeficientes de variación son muy semejantes entre ellas.
Tabla III. Resultados obtenidos en las pruebas de repetibilidad para las distintas sustancias y según la matriz de la muestra (n=15).

Exactitud
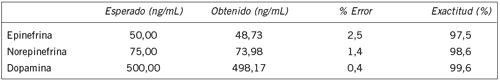
De acuerdo con los resultados que se muestran en la Tabla IV, el método tiene una exactitud igual o superior al 97,5% para todas las catecolaminas, lo que significa que los resultados obtenidos a partir de este método son confiables. En general, los datos del error calculado para el método son muy bajos y el mayor porcentaje de error se registró en la epinefrina, en donde sin embargo, el valor no alcanzó el 5% (Tabla IV).
Tabla IV. Exactitud y porcentaje de error del ensayo en la medición de catecolaminas (n=15).
Linealidad
La inyección y evaluación de los calibradores empleados para el análisis de linealidad, demostró que tanto en los estándares acuosos sin extraer, los que se hicieron pasar por el proceso de EFS, como en los elaborados en una matriz de orina, el ensayo es lineal en rangos que van desde 4,7 ng/mL y 75 ng/mL de E, 7,0 ng/mL y 112,5 ng/mL de NE, y de 46,9 ng/mL y 750 ng/mL de DA (Figura 3).
Además, todos los coeficientes de correlación (r2) obtenidos en esta evaluación estuvieron por encima de 0,9882 (a<0,001).

Figura 3. Linealidad observada en las curvas de calibración de las catecolaminas.
Prueba piloto
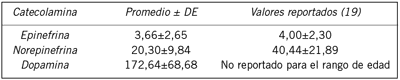
Con los resultados obtenidos en las pruebas piloto, se encontró que el método estandarizado es útil y efectivo para la medición de catecolaminas en orina. Como se puede observar en la Tabla V, el promedio de la concentración medida en 15 sujetos con edades superiores a 60 años, es semejante a la que ha sido reportada previamente en otros estudios en adultos mayores (19). La concentración de epinefrina en todos los individuos fue siempre menor que la de norepinefrina; además, la concentración de dopamina fue mayor que las otras dos catecolaminas (datos no mostrados), de igual manera, los promedios de las concentraciones de catecolaminas expresados en µg/g de creatinina reflejan el mismo comportamiento (Tabla V). No se encontraron reportes de la concentración de DA en otros estudios en los que se realizara una recolección nocturna de orina de adultos mayores, semejante a la que se empleó en este trabajo, razón por la que no se indican los valores referenciales en la tabla correspondiente.
Tabla V. Valores de las concentraciones de catecolaminas en 15 personas mayores de 60 años. Los datos están expresados en µg/g de creatinina.
DISCUSIÓN Y CONCLUSIONES
El desarrollo y estandarización de una técnica para realizar la medición confiable de catecolaminas en orina de adultos mayores, se realizó en este país con el objetivo de aportar herramientas para los estudios que se llevan a cabo, tanto clínicos como de investigación, y específicamente por la necesidad de esta técnica como parte de la batería de pruebas desarrollada en el proyecto de campo denominado "Costa Rica- estudio de longevidad y envejecimiento saludable" (CRELES).
Por las características particulares de la población analizada en el Proyecto CRELES, tales como la distribución geográfica y la edad, así como por la gran variedad de metodologías encontradas en la literatura (1)(18)(20)(23)(31)(32), se hizo necesaria la evaluación de distintas condiciones de preservación de la muestra de orina, con el fin de facilitarle a los participantes la recolección de la misma, sin que esto representara un riesgo para ellos y de manera tal que no afectara la confiabilidad de los datos resultantes.
Para ello fueron empleados dos de los métodos más comunes para preservación de la muestra de orina: el refrigerante, que permite disminuir la actividad enzimática, y el ácido, que al mismo tiempo que evita la contaminación, disminuye la tasa de descomposición de las catecolaminas (debido a que éstas son muy inestables en medios básicos), también disminuye la actividad enzimática y por tanto la velocidad de oxidación de esas sustancias químicas (1).
De acuerdo con los datos obtenidos, no se encontraron diferencias en la concentración de las sustancias si se empleaba ácido clorhídrico 6N como preservante o si usaba para ello hielo gel; incluso, se encontró que tampoco hay diferencias cuando no se emplea ninguno de ellos para conservar la muestra durante el periodo de recolección.
Estos resultados concuerdan con los obtenidos por Miki y Sudo (24) quienes demostraron que muestras con un pH entre 3,0 y 7,0 no requieren refrigeración durante la recolección, y que pueden almacenarse a
4 °C hasta por dos días antes de ser congelados. Se ha probado también que muestras congeladas (-20 °C ó -30 °C) que no contenían ningún preservante durante su recolección pueden almacenarse hasta un mes sin variaciones en la estabilidad o concentración de las sustancias (20)(23).
A pesar de lo anterior, en ninguno de esos estudios se describe si existe alguna variación en la estabilidad de la muestra de orina cuando se recolecta en adultos mayores, población en la que podría cambiar la tasa de degradación no sólo por la condición fisiológica propia de la edad, sino también por el efecto de los medicamentos que son de consumo frecuente durante esta etapa de la vida.
Con este estudio se demuestra que es posible colectar las muestras de orina de los adultos mayores sin usar preservantes ni refrigerantes (cuando la temperatura ambiente está entre 20 °C y 27 °C). Esta condición resulta particularmente útil, ya que implica que no es estrictamente necesario tomar medidas adicionales, como el uso de sustancias peligrosas que podrían representar algún riesgo para los individuos que forman parte del estudio, e incluso para el personal del laboratorio. En proyectos de amplia escala en donde se obtienen muestras de individuos que habitan tanto en las principales ciudades como en las zonas alejadas del país (en donde las condiciones para el trabajo de campo se ven por lo general más limitadas), la practicidad y simplicidad en el proceso de recolección son aún más importantes y se convierten en una ventaja adicional que irá en beneficio de los resultados finales obtenidos.
Por otro lado, es necesario considerar posibles variantes que podrían modificar la concentración original de catecolaminas en la muestra, entre las que se puede mencionar el almacenamiento por amplios periodos de tiempo (meses o años), y el congelamiento y descongelamiento de la muestra varias veces previo al análisis.
Para monitorear y corregir las pérdidas en las que se puede incurrir durante un prolongado tiempo de almacenamiento, se ha utilizado regularmente la adición de un estándar interno (1)(33); a pesar de la utilidad, en el método estandarizado de este estudio no fue incluido el uso del estándar debido a que se probó que el porcentaje de recuperación de esta sustancia (3,4-dihidroxibenzilamina o DHBA) era muy variable y difería considerablemente del obtenido en las catecolaminas después del proceso de extracción en fase sólida que se empleó (datos no mostrados).
En la elección del procedimiento de limpieza y extracción de catecolaminas en fluidos biológicos previo al análisis cromatográfico, se considera principalmente el sistema de detección que se empleará. Han sido utilizadas técnicas que incluyen el uso de óxido de aluminio (alúmina), resinas de intercambio iónico, y solventes orgánicos de extracción (10)(22). En el caso de la detección electroquímica, la especificidad del aislamiento con alúmina a partir de muestras de orina es limitada, y, además, un procedimiento lento y complicado según Peaston y Weinkove (10), razones por las cuales en este estudio se utilizó una técnica alternativa de extracción que se encuentra disponible en el mercado y que además, según indica, puede eliminar con éxito cualquier interferencia potencial de 28 de los precursores, metabolitos y drogas más comunes encontrados generalmente en la orina y que pueden afectar la separación (32).
Otro punto importante que debe considerarse al elegir el método de extracción en fase sólida, es el porcentaje de recuperación, o cantidad de sustancia de interés que logra extraerse en relación con la cantidad total presente en la muestra.
Utilizando resinas de intercambio, en este estudio se lograron alcanzar porcentajes de recuperación total de las catecolaminas de hasta 96,9%, modificando algunas variables del protocolo original (32) como velocidad de elusión (permitiendo una mayor interacción entre las sustancias) y la cantidad de eluyente recolectado.
Inicialmente, la recuperación obtenida con el equipo de trabajo no era muy buena, pues el valor mínimo aceptado para asegurar confiabilidad en el resultado es de 70%, y en este estudio, los bajos porcentajes de recuperación (Tabla II) obligaban a la corrección matemática de los valores generados a partir de los cromatogramas, provocando una mayor probabilidad de error en el dato generado.
El cambio en la velocidad de elusión aumentó la recuperación de NE hasta en un 23%, alrededor de un 17% para la DA y un 4% para la E, demostrando que, a pesar de que regularmente no se reporta dentro de los estudios de este tipo, ésta es una variable crítica que debería evaluarse siempre que se emplee el proceso de extracción en fase sólida para la purificación de las muestras.
Otro de los cambios adaptados para mejorar la detección y minimizar el error en la integración de los picos de las sustancias (que se presenta debido a las bajas concentraciones cuantificables) fue el aumento en la concentración de la muestra inyectada, al reducir el volumen del reactivo de elusión final. La variación lograda en relación con la altura y una mejor definición de los picos fue exitosa (Fig. 2) lo que hizo más confiable la integración, aunque el aumento de la recuperación fue relativamente menor en todas las catecolaminas si se compara con el obtenido al modificar solamente la velocidad de elusión (Tabla II).
En general, los valores finales del porcentaje de recuperación obtenidos se consideran satisfactorios, máxime si se compara con otros estudios en donde se han obtenido porcentajes de recuperación entre 86% y 91% (34), 49% y 54% (35), 60% y 80% (36), entre 70-80% según reportan Macdonald y Lake (38) así como Miki y Sudo (24), y entre 82 y 95% (31), por citar algunos ejemplos.
El método utilizado en este caso, permite que la extracción en fase sólida pueda realizarse a 20 muestras al mismo tiempo; sin embargo, eventualmente no todas ellas podrán analizarse en el HPLC el mismo día de la extracción. La necesidad de mantener estables estas muestras hasta su análisis, condujo a la realización de la prueba de estabilidad. Con los resultados obtenidos se puede asegurar que las muestras acuosas o estándares acuosos, así como las muestras de orina que han sido previamente extraídas pueden utilizarse con confianza para la medición, incluso hasta cuando haya transcurrido una semana desde que se sometieron a extracción en fase sólida y siempre que esas muestras se hayan mantenido desde entonces en refrigeración (4 °C).
Una vez que se establecieron las mejores condiciones para la recolección, pretratamiento y el análisis de las muestras en el laboratorio, se validó al método propuesto, al comprobar que este es repetible (CV era aproximadamente el 10% en todos los casos) y exacto (los porcentajes de error no superan el 2,5% para las tres catecolaminas). La variación entre días tampoco superó el 10% en las muestras evaluadas del pool de orina. Estudios realizados por otros autores reportan resultados semejantes en cuanto a los coeficientes de variación de los métodos, tanto intra-día como inter-días (15)(34)(37-39).
También se comprobó que el método es lineal en rangos amplios, y que es sensible para medir las concentraciones esperadas de las catecolaminas en orina de los adultos mayores. El coeficiente de correlación (r2) fue mayor que 0,995 para E, que 0,988 para NE y que 0,989 para DA.
Con el método definido y validado, se procedió a realizar una prueba piloto en un grupo de 15 individuos con 60 años y más, para comparar los resultados con otros estudios.
En el reporte de la concentración de las catecolaminas en los individuos participantes de la prueba piloto los resultados se expresaron en microgramos de sustancia por gramo de creatinina. Esta conversión en las unidades permite ofrecer un dato corregido según la talla del individuo y el volumen urinario excretado, es decir, un dato más preciso y fácilmente comparable con otros resultados en individuos evaluados de la misma manera. La creatinina se sintetiza en el hígado y el páncreas y se utiliza generalmente para evaluar función renal y filtración glomerular. Regularmente se utiliza el nivel de creatinina en la orina diaria como índice de referencia para repoartar los valores de otras moléculas, en este caso las catecolaminas, puesto que la excreción de creatinina permanece relativamente constante para cada sujeto, mientras que el volumen de excreción urinario puede variar apreciablemente.
Los resultados de la prueba piloto son satisfactorios, y demuestran que el protocolo seleccionado y mejorado es preciso, pues los valores encontrados se encuentran dentro de los rangos que reporta la literatura (Tabla V).
A partir de los datos obtenidos se concluye entonces que el método es sensible y reproducible, de utilidad para la cuantificación de E, NE y DA en orina de adultos mayores, población que se ha convertido en foco de estudio en los últimos años por el interés de procurarles una mejor calidad de vida; sin embargo, la técnica podría ser empleada también en estudios con individuos que se encuentran en otros rangos de edad.
El análisis de la concentración de catecolaminas como NE, DA y E resulta de interés en proyectos en los que, como en CRELES, se pretende calcular la carga alostática. En este cálculo, la concentración de catecolaminas podría dar información acerca de la condición y funcionamiento del sistema nervioso simpático, y del eje hipotálamo-hipofisiario-adrenal así como indicios sobre una posible asociación de dichas catecolaminas con estrés crónico (10)(40-48).
La técnica descrita en este estudio podría utilizarse también para otros análisis en los que se han empleado las catecolaminas urinarias como indicadores, como es el caso de diagnósticos clínicos de feocromocitomas; también podría ser utilizada en la medición de catecolaminas urinarias de otros grupos etarios en los que resulte de interés, por ejemplo en poblaciones infantiles para estudios del déficit de la atención (3).
Agradecimientos
Este trabajo se realizó gracias al apoyo financiero de la Vicerrectoría de Investigación de la Universidad de Costa Rica (Proyecto # 422-A4-024) y de la Wellcome Trust a través del proyecto CRELES.
Correspondencia
DR. JAIME FORNAGUERA TRÍAS
Programa de Investigación en Neurociencias
Frente a la Facultad de Bellas Artes
Ciudad Universitaria Rodrigo Facio
Universidad de Costa Rica. San Pedro de Montes de Oca
SAN JOSÉ COSTA RICA
Tel: (506) 207 4903 Fax: (506) 207 5827
E-mail: jaime.fornaguera@ucr.ac.cr
Referencias bibliográficas
1. Krstulovic A. Investigations of catecholamine metabolism using high performance liquid chromatography. J Chromatogr B Biomed Appl 1982; 229: 1-34.
2. Barbeito L, Lista A, Silveira R, Dajas F. Resting urinary catecholamine excretion in schizophrenics: methodology and interpretation of results. Biol Psych 1984; 10: 1419-25.
3. Delfino A, Dajas F, Bailador P, Rebollo A. Catecolaminas periféricas en el déficit atencional con hiperactividad. Arch Pediatr (Urug) 1987; 58: 207-14.
4. Bailador P, Dajas F. Tests paraclínicos para el diagnóstico del déficit atencional. Rev Psiquiatr (Urug) 2000; 64: 245-54.
5. Seals D, Dinenno F. Collateral damage: cardiovascular consequences of chronic sympathetic activation with human aging. Am J Physiol: Heart Circ Physiol 2004; 287: H1895-H1905.
6. Leenen F, Coletta E, Fourney A, White R. Aging and cardiac responses to epinephrine in humans: role of neuronal uptake. Am J Physiol: Heart Circ Physiol 2005; 228: H2498-H2503.
7. Rosano TG, Swift TA, Hayes LW. Advances in catecholamines and metabolite measurements for diagnosis of pheochromocytoma. Clin Chem 1991; 37: 1854-67.
8. Bravo E. Envolving concepts in the pathophysiology, diagnosis and treatment of pheochromocytoma. Endocrinol Rev 1994; 15: 356-68.
9. Taylor R, Singh RJ. Validation of liquid chromatography-tandem mass spectrometry method for analysis of urinary conjugated metanephrine and normetanephrine for screening of pheochromocytoma. Clin Chem 2002; 48: 533-9.
10. Peaston R, Weinkove C. Measurement of catecholamines and their metabolites. Ann Clin Biochem 2004; 41: 17-38.
11. McEwen, B. Protective and damaging effects of stress mediators. N Eng J Med 1998; 338: 171-9.
12. Seeman T, McEwen B, Rowe J, Singer B. Allostatic load as a marker of cumulative biological risk: McArthur Studies of successful aging. Proc Natl Acad Sci USA 2001; 98: 4770-5.
13. Crimmins E, Johnston M, Hayward M, Seeman T. Age differences in allostatic load: an index of physiological dysregulation. Exp Gerontol 2003; 38: 731-4.
14. Reuben D, Talvi S, Rowe J, Seeman T. High urinary catecholamine excretion predicts mortality and functional decline in high-functioning, community-Dwelling older persons: McArthur Studies of successful aging. J Gerontol 2000; 55A: M618-M624.
15. Foti A, Kimura S, DeQuattro V, Lee D. Liquid-chromatographic measurement of catecholamines and metabolites in plasma and urine. Clin Chem 1987; 33: 2209-13.
16. Musso N, Vergassola C, Pende A, Lotti G. Reversed-phase HPLC separation of plasma norepinephrine, epinephrine, and dopamine, with three-electrode coulometric detection. Clin Chem 1989; 35: 1975-7.
17. White IR, Brunner EJ, Barron JL. A comparison of overnight and 24-hour collect to measure urinary catecholamines. J Clin Epidemiol 1995; 48: 263-7.
18. Ming-Cheng C, Hui-Sheng L, Yi-Li C, Yu-Husan L, Shu-Hui L, I-Wen L, et al. Social Environment and Biomarkers of Aging Study in Taiwan (SEBAS). Center for Population Health Georgetown University. Working paper series 2005-01. Princeton, Taiwan; 2000.
19. Seeman T, Crimmings E, Huang M, Singer B, Bucur A, Gruenewald T, et al. Cumulative biological risk and socioeconomic differences in mortality: McArthur Studies of successful aging. Soc Sci Med 2004; 58: 1985-97.
20. Giles HG, Meggiorini S. Stability of catecholamines in urine (Letter). Clin Chem 1983; 29: 595.
21. Weir TB, Smith CCT, Round JM, Betteridge DJ. Stability of catecholamines in whole blood, plasma, and platelets. Clin Chem 1986; 32:882-3.
22. Anton A, Sayre D. A study of the factors affecting the aluminium oxide-trihydroxyindole procedure for the analysis of catecholamines. Stud Catechol Method 1962; 138: 360-75.
23. Boomsma F, Alberts G, Eijk van L, Man in ´t Veld A, Schalekamp M. Optimal collect and storage conditions for catecholamine measurements in human plasma and urine. Clin Chem 1993; 39: 2503-6.
24. Miki K, Sudo A. Effect of urine pH, storage time, and temperature on stability of catecholamines, cortisol, and creatinine. Clin Chem 1998; 44: 1759-62.
25. Moleman P. Preservation of urine samples for assay of catecholamines and their metabolites (Letter). Clin Chem 1985; 31: 653-5.
26. Oka K, Seklya M, Osada H, Fujita K, Kato T, Nagatsu T. Simultaneous fluorometry of urinary dopamine, norepinephrine, and epinephrine compared with liquid chromatography with electrochemical detection. Clin Chem 1982; 28: 646-9.
27. Wassell J, Reed P, Kane J, Weinkove C. Freedom from drug interference in new immunoassays for urinary catecholamines and metanephrines. Clin Chem 1999; 45: 2216-23.
28. Ricchuti V, Whitford S, Magnuson M, Williams G. Determination of epinephrine and norepinephrine in urine by radioimmunoassay compared with HPLC method (Supplement) Clin Chem 2002; 48: A134.
29. Westermann J, Hubl W, Kaiser N, Salewski L. Simple, rapid and sensitive determination of epinephrine and norepinephrine in urine and plasma by non-competitive enzyme immunoassay, compared with HPLC method. Clin Lab 2002; 48: 61-71.
30. Davidson DF, Fitzpatrick J. A simple, optimised and rapid assay for urinary free catecholamines by HPLC with electrochemical detection. Ann Clin Biochem 1985; 22: 297-303.
31. Panholzer T, Beyer J, Lichtwald K. Coupled-column liquid chromatographic analysis of catecholamines, serotonine, and metabolites in human urine. Clin Chem 1999; 45: 262-8.
32. Bioanalytical Systems. Urinary Catecholamines kit: Instruction Manual. Bioanalytical Systems. West Lafayette, IN, USA. 2001.
33. Stein H, Christman B, Wood A. Determination of catecholamines in sheep plasma by high-performance liquid chromatography with electrochemical detection: comparison of deoxyepinephrine and 3,4-dihydroxybenzylamine as internal standard. J Chromatogr B Biomed Sci Appl 1997; 701: 115-9.
34. Moyer T, Jiang N, Tyce G, Sheps S. Analysis for urinary catecholamines by liquid chromatography with amperometric detection: methodology and clinical interpretation results. Clin Chem 1979; 25: 256-63.
35. BAS. Bionalytical Sistems Inc: Liquid Chromatograph, User´s manual. West Lafayette, IN, USA. 1983.
36. Wu A, Gornet T. Preparation of urine samples for liquid chromatography determination of catecholamines: bonded-phase phenylboronic acid, cation-exchange resin, and alumina adsorbents compared. Clin Chem 1985; 31: 296-302.
37. Jackman G. Differential assay for urinary catecholamines by use of liquid chromatography with fluorescence detection. Clin Chem 1981; 27: 1202-4.
38. Macdonald I, Lake D. An improved technique for extracting catecholamines from body fluids. J Neurosci Methods 1985; 13: 239-48.
39. Moleman P, Dijk J. Determination of urinary norepinephrine and epinephrine by liquid chromatography with fluorescence detection and pre-column derivatization. Clin Chem 1990; 36: 732-6.
40. Chrousus G. The hypothalamic-pituitary-adrenal axis and immune-mediated inflammation. N Eng J Med 1995; 332 (20): 1351-62.
41. Esler M, Kaye D, Thompson J, Jennings G, Cox H, Turner A, et al. Effects of aging on epinephrine secretion and regional release of epinephrine from the human heart. J Clin Endocrinol Metab 1995; 80: 435-42.
42. Chrousus G, Gold P. A healthy body in a healthy mind- and vice versa- the damaging power of "uncontrollable" stress (Editorial). J Clin Endocrinol Metab 1998; 83: 1842-5.
43. Ziegler D, Cass W, Herman J. Excitatory influence of the locus coeruleus in hypotalamic-pituitary-adrenocortical axis response to stress. J Neuroendocrinol 1999; 11: 361-9.
44. Mayer E. The neurobiology of stress and gastrointestinal disease (Review). Gut 2000; 47: 861-9.
45. McEwen B. The neurobiology of stress: from serendipity to clinical relevance. Brain Res 2000; 886: 172-89.
46. Zuckerman-Levin N, Tiosano D, Eisenhofer G, Bornstein S, Hochberg Z. The importance of adrenocortical glucocorticoids for adrenomedullary and physiological response to stress: A study in isolated glucocorticoid deficiency. J Clin Endocrinol Metab 2001; 86: 5920-4.
47. Dean R, Chummun H, Prashad D. Differences in urinary stress hormones in male and female nurses at different ages. J Adv Nurs 2002; 37: 304-10.
48. Esler M, Hastings J, Lambert G, Kaye D, Jennings G, Seals, D. The influence of aging on the human sympathetic nervous system and brain norepinephrine turnover. Am J Physiol Reg Integ Physiol 2002; 282: R909-R916. [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ]
Aceptado para su publicación el 13 de septiembre de 2007














