Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. v.41 n.4 La Plata oct./dic. 2007
BIOQUÍMICA CLÍNICA
Validación post-analítica de la correlación inmunoglobulinas-gammaglobulinas*
Post-analytical validation of the correlation between immunoglobulins-gammaglobulins
Pablo Diego Bresciani1, María Laura Facio1, Leticia Bibiana Madalena1, Mariel Emilce Alejandre1, Susana Fraind1, Marco Pizzolato2
1. Bioquímico.
2. Doctor en Bioquímica. Departamento de Bioquímica Clínica. Facultad de Farmacia y Bioquímica, Hospital de Clínicas "José de San Martín". Universidad de Buenos Aires. Buenos Aires, Argentina.
* Presentado en forma preliminar en el II Congreso Argentino de la Calidad en el Laboratorio Clínico, CALILAB 2002, (11-13 sep 2002), organizado por Fundación Bioquímica Argentina.
Resumen
La electroforesis convencional en gel de agarosa con registro densitométrico (PRE) y la cuantificación de inmunoglobulinas IgG, IgA e IgM (GAM) por inmunoturbidimetría permiten estimar el estado inmunológico humoral. Debido a las diferencias metodológicas, los resultados de GAM y la densitometría de la fracción gamma obtenida ( GAMMAOBT) del PRE, son difíciles de correlacionar. El objetivo del presente estudio fue establecer una forma de validación post-analítica entre ambos métodos. Se seleccionaron 1.057 sueros, 736 no presentaban componentes monoclonales en la electroforesis. Se determinó GAM en un autoanalizador Hitachi 917 (Tina-quant-Roche, EE.UU.). La GAMMAOBT se obtuvo por electroforesis mediante un sistema semiautomático (Hydragel-Protein) seguido de densitometría (Hyrys), SEBIA (París-Francia). Mediante regresión lineal múltiple sobre GAMMAOBT y GAM de los 736 sueros, se predijo el valor esperado de la fracción gamma (GAMMAESP) en g/dL a partir de los resultados de GAM: GAMMAESP=0,84xIgG+0,23xIgA+0,75xIgM (Error estándar: 0,009; 0,041; 0,050, respectivamente; r=0,955; p<0,0001). Para detectar anomalías, como la presencia de componentes monoclonales, se utilizaron los 1.057 sueros, obteniéndose para la diferencia entre la GAMMAESP y la GAMMAOBT, los siguientes valores de corte: -0,21 y +0,18 g/dL, los cuales incluyen la región de menor incidencia de anomalías. Se determinó el cociente de cada inmunoglobulina respecto de su valor normal superior, estableciéndose 1,5 como valor de corte. Combinando ambos procedimientos se obtuvo una sensibilidad y especificidad global de 81,4%, y 76,6%, respectivamente, para la detección de anomalías. En el presente trabajo se expone el algoritmo de decisiones que luego se ha aplicado a otros 307 pacientes encontrándose 68,0% y 83,1% de sensibilidad y especificidad, respectivamente.
Palabras clave: Inmunoglobulinas; Electroforegrama; Validación post analítica; Control de calidad
Summary
Conventional agarose gel electrophoresis (AE) followed by densitometric analysis and quantitation of immunoglobulins IgG, IgA, and IgM (GAM) enable the evaluation of the immunological humoral status. Due to methodological differences, the results of the immunoglobulins quantitation by immunoturbidimetry (GAM), and the ones of the GAMMAAE region by densitometer tracing, are difficult to correlate. The aim of the present study was to establish a method of post-analytical validation between both procedures. One thousand and fifty-seven sera were selected, out of which 736 did not show any monoclonal components in the AE. GAM concentration was determined with a 917 Hitachi autoanalizer (Tina-quant-Roche). The GAMMA region was obtained by AE with a semiautomatic system (Hydragel Protein), followed by densitometer tracing (Hyrys, SEBIA). By means of the least-square multiple linear regression analysis of the GAMMA and GAM determinations of the 736 sera, the percentage fractions of each immunoglobulin corresponding to the GAMMA region were obtained: GAMMAGAM=0,84xIgG+0,23xIgA+0,75xIgM; (r=0.955; p<0.0001). In order to detect abnormalities such as the presence of monoclonal components, the 1057 sera were tested. The cut-off values for the normal difference between the GAMMAGAM and the GAMMAAEAE, were the following: -0.21;+0.18 (g/dL). The ratio of each immunoglobulin with respect to its higher normal value was determined, and the resulting cut-off value was 1.5. For the detection of abnormalities, a global sensitivity and specificity of 81.4%, and 76.6%, respectively was obtained by combining both procedures. In the present study the algorithm of decisions applied is shown.
Key words: Immunoglobulins; Electrophoregramme; Post analytical validation; Quality control
INTRODUCCIÓN
Para el diagnóstico de disinmunoglobulinemias es necesario el estudio cuali y cuantitativo de las inmunoglobulinas. El mismo puede obtenerse a partir de la evaluación del sector gammaglobulínico (GAMMAOBT) en el proteinograma electroforético por densitometría (PRE) y la cuantificación de IgG, IgA e IgM (GAM) por métodos inmuno-cuantitativos, como la inmunoturbidimetría. Ambas metodologías proporcionan generalmente datos concordantes, no obstante, es frecuente encontrar discrepancias, las cuales pueden originarse por distintas causas.
El PRE se evalúa mediante la densitometría de las fracciones proteicas. Una limitación importante a tener en cuenta, es que existe una muy amplia variabilidad en las afinidades de las proteínas al colorante, con lo cual la proporcionalidad no siempre se verifica. Por otra parte, cada fracción del PRE, a excepción de la albúmina, es la superposición de más de una proteína, por lo tanto variaciones de las mismas pueden compensarse mutuamente y no modificar el valor total de la fracción.
Las inmunoglobulinas poseen movilidades desde alfa-2 hasta el sector gammaglobulínico, mientras que por densitometría se cuantifica sólo este último (1). Ésta es una de las razones de la falta de una correspondencia más ajustada entre los resultados de GAMMAOBT y GAM. Otra muy importante puede ser la presencia de un componente monoclonal (CM)(2).
La cuantificación de proteínas por inmunoturbidimetría, se basa en la evaluación cinética de la reacción de inmuno-precipitación con antisueros monoespecíficos. Por tal motivo, es frecuente encontrar cinéticas atípicas frente a inmunoglobulinas de origen monoclonal. Esto también ocurre en presencia de inmuno-complejos y macro-agregados moleculares que involucren inmunoglobulinas (3), tales como las crioglobulinas, polímeros de IgA, IgM, complejos con fibronectina o con fragmentos de fibrinógeno, y otras proteínas (4). Además, los anticuerpos y calibradores que se utilizan, se obtuvieron a partir de una amplia variedad de inmunoglobulinas normales (policlonales), mientras que los componentes monoclonales poseen determinantes antigénicos incompletos o limitados, pudiendo reaccionar en forma incompleta con el antisuero, y tener un comportamiento peculiar comparado con el calibrador. Por lo tanto, la concentración del componente monoclonal es a menudo sub o sobreestimada (5-7).
La sumatoria de las inmunoglobulinas obtenidas por inmunoturbidimetría no coincide exactamente con el valor de la GAMMAOBT, ya que se obtienen mediante técnicas basadas en principios diferentes. Frente a estas desviaciones, surge la necesidad de comprobar la concordancia entre ambas metodologías. El objetivo de este trabajo fue establecer una forma de validación post-analítica entre ambos métodos, que puede ser aplicada a los resultados de los ensayos diarios para detectar anomalías de origen fisiopatológico, metodológico o fortuito, y consecuentemente mejorar su confiabilidad clínica.
MATERIALES Y MÉTODOS
Sobre las muestras de suero de 1.057 pacientes del Hospital de Clínicas "José de San Martín" (período enero-2003 a agosto-2005), se efectuó la determinación de gamma mediante el PRE ( GAMMAOBT) y la cuantificación de IgG, IgA e IgM (GAM) por inmunoturbidimetría, en forma simultánea. Del total, 321 (30,3%) presentaban CM visible en el PRE. Esta frecuencia de presentación de CMs es extremadamente elevada por ser este Servicio un Centro de Referencia.
El PRE se realizó mediante un sistema semiautomático (Hydragel Protein) seguido de densitometría (Hyrys), SEBIA (París, Francia), expresando las fracciones en g/dL.
La inmunoturbidimetría se realizó en un autoanalizador Hitachi 917 (Tina-quant‚-Roche, EE.UU.), consignando los valores hallados en g/dL.
Estadística
Para el cálculo de los parámetros de correlación múltiple (Statistica 5.5, Edición 1999, StatSoft, Inc. EE.UU.), se utilizaron los datos simultáneos de GAMMAOBT y GAM de 736 sueros sin CMs, aplicando el Test de Regresión Múltiple, método estándar con intersección cero, según el siguiente modelo lineal:

siendo y: variable dependiente
x1 , x2 , x3: variables independientes
b1 , b2, b3: coeficientes lineales.
Para obtener los límites de aceptación a los 736 pacientes sin CM se le agregaron 321 pacientes con CM a los efectos de obtener los valores de corte para poder detectarlos como anomalía mediante curvas ROC.
Finalmente, para probar el modelo propuesto, se tomaron 307 pacientes ingresados al Servicio durante el año 2002.
RESULTADOS
1) Correlación
Sobre los 736 pacientes evaluables (sin CM) se obtuvieron los coeficientes de correlación lineal múltiple entre GAMMAOBT (variable dependiente) y los valores individuales de GAM (3 variables independientes: IgG, IgA e IgM en g/dL) e intersección cero. De modo que la gamma esperable (GAMMAESP), a partir de los datos de GAM se calcula aplicando el modelo:
![]()
r=0,955 (p<0,0001), con un error estándar para los coeficientes de 0,009; 0,041 y 0,050, respectivamente.
2) Valores de corte
Se calculó GAMMAESP para todos los pacientes (n=1.057) y a continuación, la diferencia (d) con las respectivas GAMMAOBT.

Los d pueden adquirir valores inferiores a cero (d(-)) hasta valores superiores a cero (d(+)). Para obtener sus correspondientes valores de corte, D(-) (valor de corte inferior) y D(+) (valor de corte superior), se realizaron las curvas ROC para las d(-) y para las d(+), por separado, relacionándolos con la presencia o ausencia de CM evidenciable en el PRE. Se buscaron los máximos de sensibilidad y especificidad para cada región, corregida por el número de pacientes acumulados. Los valores de corte obtenidos fueron (en g/dL) para los d(-): d(-) = -0,21 y para los d(+): d(+) = +0,18 g/dL.
Todos los valores d fuera de los extremos antes indicados se consideraron en situación de "Alerta" (detección de anomalías).
Para los valores de d comprendidos entre ambos extremos se buscó un parámetro adicional que permita detectar más anomalías. Para ello se calcularon los índices rG, rA y rM, dividiendo respectivamente los valores individuales de GAM de cada muestra por los valores de referencia superiores normales de IgG, IgA y IgM (1,60; 0,40 y 0,23 g/dL). Se seleccionó para cada paciente sólo aquel r que resultó mayor. Se construyeron nuevamente las curvas ROC pasando a variar r, en relación con la presencia o ausencia de CM evidenciable en el PRE. lo cual permitió obtener el valor de corte para r: (R), el cual resultó igual a 1,5. Valores de r mayores de 1,5 se consideraron también en estado de "Alerta".
La sensibilidad alcanzada combinando consecutivamente ambas evaluaciones (diferencia d e índice r), fue del 81,4%, en tanto que la especificidad fue del 76,6%. Para una mejor comprensión de los pasos que se aplicaron, se presenta en la Fig. 1 el correspondiente diagrama de flujo.
3) Prueba del modelo
Aplicando el diagrama de flujo de la Fig. 1, se validaron los resultados de 307 pacientes que ingresaron al Servicio en el año 2002, dando una sensibilidad del 68,0% y especificidad del 83,1% (p<0,0001).
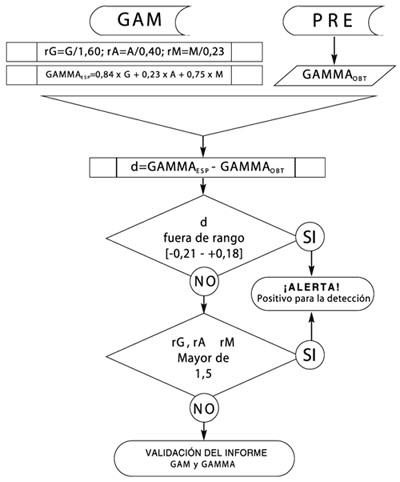
Figura 1. Caracterización de las LDL aisladas por electroforesis en acetato de celulosa.
Suero normal (A), LDL fraccionadas por UC (B) y por PS (C). Las muestras se tiñeron con Coomassie Blue.
DISCUSIÓN Y CONCLUSIONES
En la actualidad, el PRE sigue siendo una práctica muy útil para la caracterización de los distintos tipos de disproteinemias, y en especial para la detección de CMs. Mientras que la GAM, si bien proporciona información más específica en forma aislada, no resulta suficiente en lo que respecta a la tipificación y cuantificación de los CMs. Por tal motivo, siempre que se solicite GAM debe realizarse, al menos cualitativamente, el PRE. Por diversas causas, no siempre existe una razonable correlación entre ambas prácticas, y esto puede ser debido a fallas de orden técnico tales como: burbujas, aspiración incompleta, descarga de reactivos que no se incorporan en su totalidad, siembra imperfecta, etc. Influyen también, las anomalías propias de los CMs, como características de movilidad, afinidad al antisuero, al colorante, los cuales frecuentemente se apartan del habitual comportamiento policlonal. Por lo tanto sería de gran utilidad poder contar con "sensores" adicionales a los corrientes, a fin de impedir la emisión de informes que sean incompatibles entre sí, o con la situación clínica real.
En este trabajo se propone una herramienta de validación post-analítica con el objetivo de que aquellos CMs que se encuentran enmascarados con fracciones normales o que son de baja concentración, y que por tal razón pueden ser fácilmente inadvertidos, puedan ser detectados con este procedimiento y sean sometidos a una confirmación de las mediciones realizadas, ya sea por la vía de la revisión integral de los datos, la repetición del ensayo sobre la muestra original o sobre una nueva muestra, o la realización de estudios complementarios, según se justifique. La evaluación del modelo propuesto fue realizada sobre 307 pacientes presentando una sensibilidad y especificidad adecuadas.
Las inmunoglobulinas revisten un importante interés clínico debido a las implicancias diagnóstica y pronóstica en Clínica Médica, que derivan de su evaluación. Esta herramienta integral que se propone, cumpliría el papel de control post-analítico. El mismo puede ser fácilmente realizado por el sistema informático del laboratorio, permitiendo detectar anomalías tales como la presencia de un componente monoclonal, la existencia de complejos inmunes, hiperviscosidad, turbidez o alguna falla técnica en la muestra, no como sustituto de los métodos habituales, sino como complemento.
Los controles post-analíticos presentados en este trabajo son un aporte, no sólo a la mayor confiabilidad de los resultados, sino también a la correcta interpretación para la realización del correspondiente informe narrativo.
Correspondencia
DR. PABLO DIEGO BRESCIANI
Departamento de Bioquímica Clínica
Facultad de Farmacia y Bioquímica
Junín 956
1113 CIUDAD AUTÓNOMA DE BUENOS AIRES,
Argentina
E-mail: pdbresciani@yahoo.com.ar
Referencias bibliográficas
1. Schreiber WE, Chiang E, Tse SS. Electrophoresis underestimates the concentration of polyclonal immunoglobulins in serum. Am J Clin Pathol 1992;97 (5): 610-3.
2. Morita K, Okamoto Y. The discrepancy between electrophoretic and nephelometric determinations of serum gamma-globulin level. Clin Lab 2004; 50 (7-8): 415-8.
3. Takatani T, Morita K, Takaoka N, Tatsumi M, Okuno Y, Masutani T, et al. Gamma heavy chain disease screening showing a discrepancy between electrophoretic and nephelometric determinations of serum gamma globulin concentration. Ann Clin Biochem 2002; 39 (Pt 5): 531-3.
4. Ritchie RF. Serum Proteins in Clinical Medicine. Maine (EE.UU.): Foundation for Blood Research; 1996.
5. Bush D, Keren DF. Over and underestimation of monoclonal gammopathies by quantification of k- and l- containing immunoglobulins in serum. Clin Chem 1992; 38: 315-6.
6. Keren DF. Procedures for the evaluation of monoclonal immunoglobulins. Arch Pathol Lab Med 1999; 123: 126-32.
7. Attaelmannan M, Levinson S. Understanding and identifying monoclonal gammopathies. Clin Chem 2000; 46: 8(B): 1230-8. [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ]
Aceptado para su publicación el 30 de octubre de 2007














