Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. v.41 n.4 La Plata oct./dic. 2007
TEMAS DE INTERÉS
Guías para la práctica en el laboratorio clínico
Evaluación del riesgo materno-fetal y valores de referencia en el embarazo
Sección V a VII
ÍNDICE
* Preámbulo
* Sección I
Evaluación del riesgo materno-fetal y valores de referencia en el embarazo.
* Sección II
Vacunación durante el embarazo
* Sección III
Screening prenatal del tercer trimestre y evaluación diagnóstica.
* Sección IV
Screening prenatal del segundo trimestre: resultados de un amplio programa de Screening.
* Sección V
Evaluación diagnóstica de seguimiento en el embarazo de riesgo.
* Sección VI
Guías para la práctica en el laboratorio clínico en la evaluación del embarazo de alto riesgo.
* Sección VII
Prácticas actuales y guías para la evaluación del recién nacido.
* Sección VIII
Screening metabólico del recién nacido.
* Sección IX
Avances en el Screening del recién nacido usando MS/MS.
* Sección X
Recomendaciones para la medición de ácidos orgánicos urinarios.
* Referencias
* Agradecimientos
* Apéndice A
* Apéndice B
* Apéndice C
COMITÉ DE LAS GUÍAS
EDITOR
John E. Sherwin, PhD, DABCC, FACB
Chief, Genetic Disease Laboratory, Department of Health Services of California, Richmond, CA
COMITÉ
Gillian Lockitch, MD, MBChB, FRCPC
Professor, Pathology & Laboratory Medicine, University of British Columbia; Director of Laboratories, and
Head, Department of Pathology and Laboratory Medicine, Children's and Women's Health Centre of British
Columbia, Vancouver, BC, Canada
Philip Rosenthal, MD, FAAP, FACH, FACG
Professor of Pediatrics and Surgery, University of California, San Francisco, CA
Stephanie Rhone, MD, RDMS, FRCSC
Clinical Assistant Professor, Department of Obstetrics and Gynecology and Centre for Healthcare Innovation and Improvement, University of British Columbia and the Children's and Women's Health Centre of British
Columbia, Vancouver, BC, Canada
Laura A. Magee, MD
Internist (Medical Disorders of Pregnancy), Children's and Women's Health Centre of BC, Vancouver, BC,
Canada
Edward R. Ashwood, MD, FACB
Professor of Pathology, University of Utah, Director of Laboratories and Chief Medical Officer, ARUP
Laboratories, Inc., Salt Lake City, UT
Barbara M. Goldsmith, PhD, FACB
Director, Laboratory Services, Caritas St. Elizabeth's Medical Center, Boston, MA
Carol R. Lee, MS (ret.)
Beckman Coulter, Inc., Chaska, MN
Sharon Geaghan, MD
Clinical Laboratory, Lucile Packard Children's Hospital, Palo Alto, CA
David Millington, PhD
Duke University Medical Center, Pediatrics, Medical Genetics, Research Triangle Park, NC
Michael Bennett, PhD, FACB
Department of Pathology, Children's Medical Center of Dallas, Dallas, TX
OTRAS CONTRIBUCIONES
Peter von Dadelszen, PhD, MBChB, FRCSC, MRCOG
Perinatologist, Children's and Women's Health Centre of BC, Vancouver, BC, Canada
Bob Currier, PhD; George Helmer, PhD; and Fred Lorey, PhD
Genetic Disease Laboratory, State of California, Richmond, CA
Esta publicación se realiza con la ayuda de los siguientes Comités de la NACB:
COMITÉ DE PUBLICACIONES DE LA NACB
Kiang-Teck Yeo, PhD, DABCC, FACB (Chair)
Dartmouth-Hitchcock Medical Center and Dartmouth Medical School, Lebanon, NH
Charlie Hawker, PhD, DABCC, FACB
ARUP Laboratories, Inc., Salt Lake City, UT
Stanley Lo, PhD, DABCC, FACB
Children's Hospital of Wisconsin, Wauwatosa, WI
James Ritchie, PhD, FACB
Emory University Hospital, Atlanta, GA
Sayed Sadrzadeh, PhD, FACB
University of Washington School of Medicine, Seattle, WA
COMITÉ DE ASUNTOS EDUCATIVOS Y CIENTÍFICOS DE LA NACB
Catherine Hammett-Stabler, PhD, DABCC, FACB (Chair)
University of North Carolina, Chapel Hill, NC
Michael Bennett, PhD, FACB
Children's Hospital of Philadelphia, Philadelphia, PA
D. Robert Dufour, MD, FACB
10316 Gainsborough Rd., Potomac, MD
Shirley Welch, PhD, DABCC, FACB
Kaiser Permanente NW Regional Laboratory, Portland, OR
SECCIÓN V
Evaluación diagnóstica de seguimiento del embarazo de alto riesgo
Los embarazos pueden estar en riesgo por razones maternas, fetales o por ambas. Estas guías se centrarán en dos condiciones médicas de la madre: (1) las alteraciones que produce la hipertensión en el embarazo y la enfermedad tromboembólica. Este enfoque existe por las siguientes razones:
* Estas dos condiciones médicas se encuentran entre las alteraciones más comunes en el embarazo.
* Son las alteraciones más serias ya que son las causas más comunes de muerte materna.
* El manejo de ambas condiciones se centra en las pruebas de laboratorio.
* Ambas condiciones están cada vez más relacionadas en términos de su patogénesis y manejo.
Alteraciones que provoca la hipertensión durante el embarazo (AHE)
Las alteraciones de la presión complican un 5-10% de los embarazos en todo el mundo y siguen siendo una causa importante de mortalidad y morbididad materna y perinatal tanto en países desarrollados como en desarrollo. La literatura revela que hay falta de consenso en relación a cómo se deberían diagnosticar y clasificar estas alteraciones en el embarazo y cómo se las debería manejar. Esto en parte se debe a inconsistencias en terminología en relación tanto a las AHE maternas como a las consecuencias perinatales de interés. La falta de consenso también se debe a la mal definida relación entre las clasificaciones actuales y los resultados maternos y perinatales adversos que quieren evitar tanto los médicos clínicos como las mujeres.
Clasificación de las AHE. La Sociedad de Hipertensión Canadiense (CHS), el Grupo de Trabajo de Hipertensión en el Embarazo del Programa Nacional de Educación sobre Hipertensión de los Estados Unidos y la Sociedad de Australasia para el Estudio de la Hipertensión en el Embarazo (ASSHP), éstas últimas en su mayor parte fusionadas por la Sociedad Internacional para el Estudio de la Hipertensión en el Embarazo (ISSHP), han producido guías similares para el diagnóstico y clasificación de la preeclampsia. Todas estas guías se basan en gran medida en la opinión de expertos y todas tienen sus limitaciones.
En primer lugar, la mayoría de las clasificaciones se basan en la presencia tanto de hipertensión como de proteinuria. En el 40% de las mujeres, esto no ocurre dentro de la semana previa a un ataque de eclampsia. Por lo tanto, en la práctica tiene que considerarse y excluirse un diagnóstico de preeclampsia (por medio de exámenes renales, hepáticos y hematológicos) cuando aparezca hipertensión gestacional no-proteinúrica (presente en el 20% de las mujeres dentro de la semana de su primer ataque eclámptico) o proteinuria gestacional no-hipertensiva (presente en el 10% de las mujeres). Además, en un análisis secundario de la prueba de aspirina para la prevención de preeclampsia, del Instituto Nacional para la Salud y el Desarrollo del Niño (NICHD), las mujeres que desarrollaban hipertensión gestacional severa no-proteinúrica (en oposición a aquellas que desarrollaban preeclampsia moderada) tenían tasas más altas, tanto de parto pretérmino (< 37 semanas) como de recién nacidos pequeños para la edad gestacional. Esto refuerza la importancia de considerar a esta condición distinta de una de hipertensión y proteinuria pura.
En segundo lugar, dicotomizar la preeclampsia en enfermedad moderada o severa presumiblemente diferencie a las mujeres con menor riesgo respecto de aquellas con un riesgo mayor, pero no hay matices de grises en una amplia gama de situaciones clínicas.
En tercer lugar, el hecho de no tener en cuenta cuál es la edad gestacional en cualquiera de los sistemas de clasificación actuales constituye un serio problema. La edad gestacional es el predictor más importante tanto de las consecuencias maternas como de las perinatales. La preeclampsia de comienzo temprano (<32 semanas) se encuentra asociada a un riesgo 20 veces mayor de mortalidad materna en comparación con la preeclampsia que se presenta a término, y es consistente con una alteración en la función de los neutrófilos y en los niveles de citoquinas. Además, la edad gestacional es el determinante más importante de las consecuencias perinatales entre los fetos diploides. Se presenta una probabilidad mayor al 50% de supervivencia fetal intacta en la preeclampsia cuando la edad gestacional al momento del parto es <27+0 semanas con peso al nacer <600 g.
En cuarto lugar, no se sabe cómo los aspectos del síndrome fetal de la preeclampsia, identificados por la CHS como características adversas, pueden predecir el riesgo materno.
La predicción de la preeclampsia. Es obvio que las actuales clasificaciones de la AHE se centran en el diagnóstico de preeclampsia porque es lo más peligroso tanto para la madre como para el bebé. Este es el motivo por el cual una parte tan importante del cuidado prenatal está dedicado a la detección de esta afección, y es una de las principales razones por las que a las mujeres embarazadas se las cita cada cuatro semanas al comienzo del embarazo, cada dos semanas a medida que el embarazo avanza y luego semanalmente durante las últimas cuatro a seis semanas.
La preeclampsia es una alteración multisistémica que tiene sus raíces en una inadecuada placentación (por ejemplo, con base inmunológica) y/o en excesivas demandas fetales (por ejemplo, gestación múltiple). Cuando se genera esta desigualdad, de la circulación útero-placental se libera una "sopa" intravellosa. Esta "sopa" tiene varios mediadores inflamatorios (como citoquinas) y fragmentos de trofoblastos que producen una inflamación sistémica en la madre y la ya conocida disfunción celular endotelial. Se cree que esta última da lugar a la disfunción de múltiples sistemas de órganos, de la preeclampsia. Comúnmente consiste en hipertensión y proteinuria, pero es probable también que solamente se trate de eclampsia o de anomalías de las enzimas hepáticas, por ejemplo. Las guías canadienses son las únicas que intentan dar cuenta de la disfunción de múltiples órganos de la preeclampsia, al incluir "características adversas" dentro de la clasificación de las alteraciones que provoca la hipertensión en el embarazo (AHE).
La proteinuria como componente esencial de la clasificación de las AHE. La proteinuria es clave en la clasificación de las AHE, aunque su diagnóstico resulta problemático. El "estándar de oro" para definir a una proteinuria es una excreción urinaria, en 24 horas, de 0,3 g/d o más de proteínas.
En la evaluación clínica prenatal, se utiliza la prueba de la tira reactiva de orina (las tiras se analizan visualmente) por su bajo costo y eficacia. Se cree que este método no es sensible ni específico, a pesar de que la sensibilidad y la especificidad pueden mejorarse utilizando un instrumento automatizado. De hecho, el valor predictivo negativo (VPN) de una proteinuria negativa o de trazas en la tira de orina es realmente muy bueno en el embarazo y excede el 90%, independientemente del método utilizado.
El problema real se encuentra para proteinuria 1+, con un valor predictivo positivo (VPP) de menos del 50% con una prueba automatizada. De acuerdo con los sistemas de clasificación existentes, la proteinuria 1+ debería hacer que el médico clínico tome una muestra de orina de 24 horas. Hasta que se tenga el resultado, el manejo del embarazo de esa mujer dependerá de cuán preocupado esté ese médico. EL panorama no es mejor cuando la prueba de la tira reactiva revela proteinuria 2+, con un VPP cercano al 50%. El médico puede tener más certeza de la presencia de proteinuria con una proteinuria de 3+ ó 4+.
Dada la incertidumbre que crea la interpretación de la prueba de la tira reactiva de orina, se ha preferido la evaluación de la relación proteína/creatinina urinaria que, comparada con las recolecciones de orina de 24 horas, resulta ser más barata, más fácil de realizar para el paciente y más rápida para el médico que recibe su informe el mismo día. Con un valor de corte > 30 mg/proteína/mmol de creatinina, el VPP es al menos de 90%.
Para complicar más la cuestión, también existen pruebas de que el método de análisis de proteínas urinarias altera la cuantificación de la proteína urinaria cuando se trata de orina de 24 horas, que es el "estándar de oro". Se ha descubierto que el ensayo de cloruro de benzoilo, utilizado comúnmente en los laboratorios hospitalarios y más sensible a mezclas complejas de proteínas, es más sensible también que el ensayo de Bradford, muy usado en los laboratorios científicos y que parece ser más específico. La especificidad del ensayo proteico puede ser importante, ya que la albúmina y la transferrina son los componentes principales de las proteínas en la preeclampsia menos desarrollada.
GUÍA 11. Pruebas de laboratorio recomendadas
* Las pruebas de laboratorio recomendadas para el diagnóstico y evaluación de la preeclampsia representan una integración de amalgamiento de aquellas que recomiendan los grupos de Canadá, Australasia y Estados Unidos, cada cual con sus recomendaciones específicas. Por ejemplo, el Grupo Canadiense recomienda que la prueba de la tira reactiva de la orina se deje de lado, que las pruebas de coagulación no se realicen de rutina (a menos que sea probable que haya una cirugía y/o una coagulación intravascular diseminada (CID)) y que no se determine la albúmina en suero. Sin embargo, en la región de Australasia recomiendan los estudios de coagulación, así como las pruebas de albúmina en suero, dada la relación inversa entre hipoalbuminemia y el riesgo de edema pulmonar.
* Se encuestó a médicos canadienses y se les preguntó acerca de si utilizaban o no las pruebas comúnmente recomendadas, y si la respuesta era afirmativa, se les preguntó con qué frecuencia. La mayoría informó que usaban todas las pruebas de sangre y las pruebas de orina al menos una vez en la semana. La excepción (54) era el uso a diario de la tira reactiva de orina para proteinuria en mujeres con sospecha de preeclampsia.
* Lo que queda por determinar es exactamente cómo los resultados de estas pruebas, de manera individual o combinadas, se relacionan con el riesgo de consecuencias maternas y perinatales adversas. En este sentido se esperan mayores estudios y hasta ese entonces, las pruebas recomendadas se basan en gran medida en la opinión de expertos.
Diagnóstico diferencial de la preeclampsia. El diagnóstico diferencial de la preeclampsia es el de una hipertensión subyacente y/u otras microangiopatías, como el síndrome urémico-hemolítico y la púrpura trombocitopénica, el síndrome del anticuerpo anti-fosfolípido, coagulación intravascular diseminada/sepsis, vasculitis o hipertensión maligna. Además, a la preeclampsia siempre se la debe distinguir del más adverso hígado graso agudo del embarazo, en el que existe una disfunción hepática precoz, caracterizada por un RIN elevado y alta bilirrubina. Por lo tanto, se deben incluir más pruebas para diagnosticar la preeclampsia si la historia y el examen físico aumentan la sospecha de otro proceso de enfermedad. El urianálisis puede ser particularmente útil. En la preeclampsia, la lesión glomerular de la "endoteliosis" no es proliferativa y no debería haber eritrocitos (RBCs) o cilindros (urinarios) asociados; los RBCs deberían hacer que se considere asociada una ruptura de la placenta y/u otra lesión glomerular.
Consideraciones postnatales de una mujer que tuvo preeclampsia. En este caso, hay dos cuestiones que considerar: (1) descartar condiciones subyacentes que pueden haber predispuesto a una mujer a la preeclampsia y que puedan necesitar de, o beneficiarse con el tratamiento (por ejemplo, la diabetes); y (2) identificar otros factores de riesgo cardiovascular, ya que por haber tenido una AHE, la mortalidad y la morbilidad cardiovascular a largo plazo se incrementan.
Factores de riesgo para la preeclampsia. Entre los factores de riesgo para la preeclampsia se encuentran los factores cardiovasculares y la hipertensión. A continuación se analizará cada uno de ellos.
Hipertensión pre-existente. Es necesario hacer un seguimiento después de las seis semanas posparto, reconociendo que la hipertensión de la preeclampsia puede resolverse en unos pocos meses. A la hipertensión persistente se la debería considerar como preexistente, y como una condición que requiere que se realicen análisis de electrolitos, creatinina, orina, de TSH, calcio y la relación renina: aldosterona en plasma. La glucosa en sangre en ayunas detectará una diabetes subyacente y si a través de un seguimiento de la relación proteína/creatinina urinaria (o albúmina/creatinina) o de la proteína urinaria de 24 horas (después de tres meses del parto) se detecta proteinuria persistente, esto sugerirá enfermedad renal subyacente. Si la preeclampsia fue de inicio temprano y severo, en ese caso se recomienda una prueba de trombofilia, cuyos detalles se discutirán más adelante en la sección "Tromboembolismo en el embarazo".
Factores de riesgo cardiovascular. Luego de 6-12 semanas posparto, cuando se han resuelto al menos la mayoría de los cambios fisiológicos del embarazo, es conveniente realizar una prueba de hiperlipidemia, hemoglobina A1C e hiperhomocisteinemia. También conviene realizar una electrocardiografía y una ecocardiografía (para descartar hipertrofia ventricular izquierda). Para estas mujeres, así como para las mujeres con diabetes gestacional, se debe considerar al embarazo como una prueba " de estrés" que dio un mal resultado y que les ha dado la oportunidad de evaluar su mayor riesgo de enfermedad cardiovascular futura y cómo abordarla.
Tromboembolismo en el embarazo
El tromboembolismo surge de la interacción entre factores ambientales y factores del paciente (por ejemplo, la trombofilia). Se sabe bien que los episodios tromboembólicos venosos (por ejemplo, trombosis venosa profunda ([TVP]) están asociados con la trombofilia, sea ésta genética o adquirida. Sin embargo, se ha apreciado más recientemente que la trombofilia podría estar relacionada con los siguientes eventos adversos mediados por la placenta: preeclampsia severa temprana; limitación severa del crecimiento intrauterino (generalmente definida como peso al nacer <5to o 3er centiles); nacimiento de un bebé muerto; o pérdida fetal recurrente (definida como tres o más abortos consecutivos inexplicados). A pesar de que la asociación entre la trombofilia y los eventos adversos de placenta no ha sido totalmente consistente, esto puede relacionarse con las diferentes poblaciones estudiadas (por ejemplo,la caucásica, 5% de la cual lleva la mutación del factor V Leiden) y definiciones variables de resultados. Por lo tanto, es probable que se requiera la realización de una prueba para trombofilia por ejemplo, debido a una TVP materna previa o una historia de nacimiento de un bebé muerto sin causa aparente.
Pruebas de screening para trombofilia. La trombofilia puede ser genética o adquirida. Ha surgido nuevamente el interés por el screening para trombofilia con el advenimiento de pruebas más modernas que son capaces de revelar una anomalía en aproximadamente el 50% de los individuos con tromboembolismo o con historia familiar de ese tipo.
La trombofilia puede surgir por una deficiencia de factores anti-trombóticos (antitrombina, proteína C, proteína S); un aumento en el sustrato (por ejemplo, fibrinógeno); proteínas de coagulación anormales (por ejemplo, mutación de Factor V Leiden); o anomalías bioquímicas (por ejemplo, hiperhomocisteinemia). A pesar de que el inhibidor de la vía del factor tisular es relevante también, hasta el momento no se han descrito los problemas en este sentido durante el embarazo. Además, las alteraciones en el sistema fibrinolítico no han resultado ser operativas en pacientes con enfermedad tromboembólica venosa, embarazadas o no.
Cuando se realiza la prueba de trombofilia durante el embarazo, hay que recordar que el embarazo normal se encuentra asociado con un aumento en los factores procoagulantes (por ejemplo, Factor VIII) y una disminución en algunos factores anticoagulantes (por ejemplo, Proteína S).
Otros factores de riesgo específicos del embarazo: Hay otros factores de riesgo antenatal específicos para el tromboembolismo en el embarazo:
* 35 años de edad o mayor
* alta gravidez
* obesidad
* síndrome nefrótico
* diabetes
* venas varicosas grandes
* infección actual
* reposo en la cama durante más de cuatro días antes del parto
* preeclampsia
El más común de los factores de riesgo en el parto, que se presenta en al menos el 20% de los partos en América del Norte, es la cesárea; en el Reino Unido, se han desarrollado guías para la tromboprofilaxis para mujeres con parto por cesárea. Hay otros factores de riesgo en el "parto" entre los que se incluyen el trauma pélvico, la inmovilidad y la sepsis uterina.
¿Se debería realizar un screening a todas las mujeres embarazadas? El uso del screening no se promueve sólo para el embarazo, del mismo modo que no se lo fomenta antes de la ingesta de píldoras anticonceptivas orales, las cuales están asociadas a un riesgo relativo más alto (RR) de tromboembolismo que el embarazo.
¿Qué se debería hacer con los resultados del screening para la trombofilia? Si la madre tuvo un episodio durante el embarazo o a causa de la píldora, y el screening da negativo, entonces el riesgo de TVP recurrente en el embarazo es aproximadamente del 2% y se puede no autorizar la tromboprofilaxis con heparina. Sin embargo, si existe una historia familiar de coagulación y/o hay una o más anomalías en el screening, entonces se está en favor de la tromboprofilaxis con heparina. El hecho de que esto último sea efectivo para la prevención de TVP recurrente en el embarazo o no lo sea, lo cual puede suceder en hasta un 16% de las mujeres, se basa en la extrapolación de la efectividad que surge de la literatura sobre tromboprofilaxis quirúrgica.
Si existe una historia previa de "problemas en la placenta", en ese caso la presencia de un anticuerpo antifosfolípido y la historia de un aborto recurrente garantizan el tratamiento con bajas dosis de aspirinas (81 mg/d) y heparina en bajas dosis (no fraccionada o de bajo peso molecular). A pesar de que la literatura basada en la observación sugiere que la profilaxis con heparina puede ser efectiva para otras trombofilias y una historia de otros "problemas en la placenta", esto aún tiene que ser probado por medio de las pruebas controladas randomizadas.
En resumen, las alteraciones tromboembólicas son de importancia tanto para la madre como para el feto. No está claro cómo debe ser el manejo de las mujeres con mayor riesgo materno y/o fetal. Los expertos coinciden en realizar profilaxis en los casos de trombofilia sintomática (especialmente las trombofilias múltiples); como "sintomático" se define a un episodio tromboembólico materno. Con respecto a los episodios del embarazo (o de la placenta), las mujeres con trombofilia específica del síndrome del anticuerpo antifosfolípido y con el problema de la placenta de pérdidas fetales recurrentes son las únicas para las cuales existe buena (pero no suficiente) evidencia para recomendar tromboprofilaxis en un embarazo futuro.
SECCIÓN VI
Guías de prácticas del laboratorio clínico para la evaluación del embarazo de alto riesgo
Los médicos comúnmente clasifican a los embarazos como de bajo y de alto riesgo. Hay muchas causas que contribuyen a que se los clasifique como de alto riesgo (Tabla VI-1).
Tabla VI-1. Embarazos de alto riesgo.

A pesar de que muchas condiciones médicas pueden afectar a la paciente con un embarazo de alto riesgo, estas guías del laboratorio clínico revisan dos tópicos del embarazo de alto riesgo: (1) nacimiento antes de término y (2) maduración pulmonar fetal.
Nacimiento antes de término
La gestación humana normal dura aproximadamente 40 semanas. Al "nacimiento antes de término" se lo define como el nacimiento del bebé antes de las 37 semanas de gestación. Los nacimientos anteriores a las 32 semanas de gestación se clasifican como "nacimientos mucho antes de término". Además de estar clasificados por su edad "gestacional", a los recién nacidos se los puede clasificar también por su peso al nacer. A cualquier recién nacido <2.500 g se lo clasifica como "bajo peso al nacer" (LBW), y aquellos <1.500 g son clasificados como con "muy bajo peso al nacer" (VLBW). El nacimiento antes de término y el LBW constituyen lo más común en los embarazos de alto riesgo. A pesar de que la incidencia del nacimiento mucho antes de término en los Estados Unidos se mantuvo constante en un 1,9% desde 1981 a 2000, la incidencia del nacimiento antes de término ha aumentado de 9,4% a 11,6%.
Hay muchas condiciones obstétricas y maternas que preceden al nacimiento antes de término (Tabla VI-2). Algunas de estas condiciones son causales y otras son meramente asociaciones.
Al nacimiento antes de término se lo clasifica como "espontáneo" o "indicado". El nacimiento antes de término espontáneo es más frecuente -representa cerca de tres cuartos de los casos- y se da de manera no planeada. Entre las causas del nacimiento antes de término espontáneo se incluyen el trabajo de parto antes de término, la ruptura prematura antes de término de las membranas, amnionitis y pared cervical incompetente. En un cuarto de los casos de nacimiento antes de término, la madre o el feto presentan una alteración, como por ejemplo preeclampsia o distress fetal, que va a mejorar luego del parto. El médico puede, por lo tanto, elegir realizar un parto temprano en estos casos para mejorar las consecuencias tanto para la madre como para el feto. Estos nacimiento antes de término son por lo tanto, "indicados".
A pesar de que la tasa de nacimientos antes de término ha empeorado, las tasas de morbilidad y mortalidad del recién nacido para el nacimiento antes de término han mejorado. En 1980, la tasa de mortalidad del recién nacido en los Estados Unidos fue de 12,6 por 1.000 nacimientos vivos. Ésta disminuyó a 6,9 por 1.000 nacimientos vivos en 2000. La morbilidad que sigue al nacimiento antes de término incluye al síndrome de distress respiratorio (RDS), displasia broncopulmonar, hemorragia intraventricular, conducto arterial persistente, enterocolitis necrotizante y sepsis. La mayoría de los recién nacidos antes de término permanecen en el hospital por más tiempo.
Tabla VI-2. Condiciones asociadas con el nacimiento antes de término.

Pruebas para predecir el nacimiento antes de término. Se recomienda la realización de varias pruebas para prevenir el nacimiento antes de término, entre las que se incluyen la fibronectina fetal (fFN), la longitud cervical por ecografía, el estriol en la saliva materna (Sal-Est), fosfatasa alcalina, alfa feto-proteína en suero materno, y estimulantes de formación de colonias de granulocitos (Tabla VI-3). Esta sección se refiere específicamente a la fibronectina y al estriol en la saliva materna.
Tabla VI-3. Predictores de nacimiento antes de término < 35 semanas.

Fibronectina fetal (fFN). La fibronectina es una glicoproteína de adhesión que entrecruza al colágeno para ligar las células. La forma fetal tiene un epitope único. El trabajo de parto aumenta la fFN en las secreciones cervical y vaginal. El espécimen se obtiene recogiendo secreciones vaginales en un hisopo de Dacron especialmente diseñado. Cuando está totalmente saturado, el hisopo contiene aproximadamente 150 mL de secreciones. Se utiliza el inmunoensayo para medir la fFN; las concentraciones de fFN en secreciones vaginales <50 ng/mL indican que el parto no es inminente. (El líquido amniótico es rico en fFN por lo que no se puede utilizar esta prueba en mujeres con membranas rotas). La FDA ha aprobado el uso de la fFN para el diagnóstico de parto prematuro inminente en mujeres sintomáticas que se encuentran en la semana 24.0 a 34.9 de gestación. Para las mujeres sintomáticas que estén en la semana 22 a la 30.9 de gestación, la FDA aprueba la fFN para predecir el riesgo de parto prematuro. En este grupo, el valor predictivo positivo es tan bajo como 13%, pero el valor predictivo negativo se encuentra alto, en 99.5%.
La mitad de las madres que se cree que están en trabajo de parto antes de término dan a luz sin tratamiento. Sin la realización de la prueba de fFN, el 20% de las mujeres a las que se las envía nuevamente a su casa dan a luz antes de término. Para predecir el parto dentro de los 7 días, en mujeres sintomáticas, los estudios han determinado que la sensibilidad de la prueba de fFN es del 57-93% y la especificidad es de 73-92% en mujeres en las semanas 24 a 34.9 de gestación. El valor predictivo positivo ha variado de 9 a 29%, mientras que el valor predictivo negativo es mucho más alto, de 97-99.6%.
El uso de la prueba de fFN para descartar la decisión médica de admitir en el hospital a una paciente en trabajo de parto antes de término parece ser costo-efectivo. Se estimaron los costos en mujeres sin el uso de fFN. Si la fFN se usara en mujeres con síntomas moderados de trabajo de parto antes de término, se internaría a más del doble de las mujeres que ingresan al hospital, y los costos casi se duplicarían. Si la fFN se utilizara para rechazar la internación de mujeres con síntomas más claros de trabajo de parto antes de término, los costos disminuirían en un 18% aproximadamente. Por lo tanto, es necesario hacer una utilización adecuada de la fFN para evitar internaciones innecesarias y mayores costos en la atención de la salud.
GUÍA 12: Uso de la fibronectina fetal (fFN)
* El uso de la fFN para vetar la decisión de admitir al hospital a una paciente asintomática que se cree que está en la semana 24.0 a la 34.9 de gestación es costo-efectivo.
* A pesar de que algunos estudios dan cuenta de que la fFN podría ser de utilidad para predecir qué mujeres podrían tener trabajo de parto inducido terapéuticamente, se requiere de más estudios para determinar el costo-beneficio de este uso.
Se ha propuesto el uso de la fFN a término (semana 38 a 42 de gestación) para predecir la probabilidad de que el parto sea inducido. La mayoría de los médicos confían en el score de Bishopo en la dilatación del cuello del útero para realizar esta evaluación.
Estriol en saliva (Sal-Est). El estriol es una hormona esteroide elaborada por la placenta a partir del sulfato de 16 alfa-hidroxi dehidroepiandrosterona. Este intermediario requiere que funcionen el hígado fetal y las glándulas adrenales. El estriol se excreta en miligramos por día y se eleva durante el embarazo. El estriol en saliva refleja estriol en suero no unido y no conjugado y es de aproximadamente 1,00 ng/mL en la semana 30 y 3,00 ng/mL a término. El estriol en saliva irrumpe aproximadamente cinco semanas antes del parto. El estriol en saliva "todavía está en evaluación y no debe utilizarse fuera de los protocolos de investigación".
GUÍA 13: Estriol en saliva
Hay pruebas insuficientes para recomendar el uso de rutina del estriol en saliva durante el embarazo.
Cómo predecir el nacimiento espontáneo antes de término. Se llevó a cabo una gran prueba multicéntrica (75) que se llamó Estudio de Predicción Antes de Término para identificar una población en riesgo de nacimientos antes de término. Se incluyeron veintiocho marcadores biológicos. Las mujeres sujeto de estudio eran asintomáticas y estaban en la semana 23-24 de gestación. Los resultados fueron partos antes de término en la semanas <32 y <35 de gestación.
GUÍA 14: Intervenciones en el nacimiento antes de termino en mujeres asintomáticas
Las intervenciones en el nacimiento antes de término no son efectivas en las mujeres asintomáticas. Por lo tanto, pruebas como la fFN y el estriol en saliva que predicen el nacimiento antes de término en este grupo no son de utilidad fuera del contexto de la investigación.
Maduración pulmonar fetal (MPF)
El Síndrome de distress respiratorio neonatal (RDS) es un trastorno común de los bebés nacidos antes de término y de los recién nacidos con maduración retrasada, como los nacidos de madres diabéticas con controles deficientes. A esta alteración la produce una deficiencia de surfactante. El tratamiento ha mejorado de manera sorprendente y requiere de más oxígeno y ventilación mecánica. El tratamiento del recién nacido con surfactante exógeno al nacer, a menudo puede mejorar los síntomas.
Los pulmones crean surfactantes en la forma de cuerpos lamelares (CL) dentro de los neumocitos Tipo II. Estas estructuras hidrofóbicas tienen 1-5 micrones de diámetro (76) y contienen fosfolípidos reductores de la tensión superficial y tres proteínas específicas, SP-A, B, C y D (77)(78). Los CL se excretan por exocitosis y en el pulmón aireado, se desenredan para cubrir la interfase de superficie del aire. La producción comienza temprano, en la semana 28 de gestación, pero existe una irrupción de la producción cerca de las 36 semanas para la mayoría de los fetos. El pulmón del recién nacido contiene aproximadamente 100 veces más surfactante por volumen pulmonar que un pulmón adulto.
El contenido de fosfolípidos en los CL es mayormente lecitina (fosfatidilcolina (PC), fosfatidilinositol (PI), fosfatidilglicerol (PG) y fosfatidiletanolamina (PE),y esfingomielina (S) en menor cantidad, de hallarse presente. En el líquido amniótico se encuentran presentes bajas concentraciones de PC hasta la semana 36 de gestación, cuando su producción irrumpe. En la mayoría de los embarazos normales, la producción de PG comienza en ese momento (79).
La realización de pruebas para MPF ha disminuido en los últimos 10 años. La terapia de surfactantes y el cumplimiento por parte de los médicos de las guías de obstetricia han hecho que su demanda sea menor. El médico usa los resultados de MPF para evaluar si se logrará una mejor sobrevida del recién nacido en el útero o después de un parto prematuro. El hecho de tener conocimiento de que el pulmón fetal está produciendo adecuados surfactantes hace cambiar el eje de la decisión hacia la realización del parto. El médico puede retrasar el parto por medio de drogas tocolíticas como la ritodrina, o puede acelerar la producción de surfactante fetal administrándole esteroides a la madre, realizando el parto luego de tres días, y también puede intensificar el trabajo de parto y el nacimiento precoz con el uso de la pitocina.
La realización de pruebas de MPF no está indicada en embarazos normales si se sabe con certeza que la edad gestacional es de al menos 36 semanas (80). La mejor evidencia para determinar la maduración del feto es un test de embarazo positivo temprano al menos 36 semanas antes. Latidos cardíacos del feto para 20 semanas, o una evidencia por ecografía de latido fetal para 30 semanas, son también buenos indicadores de un feto que está lo suficientemente crecido como para haber logrado la maduración pulmonar. También sirve la fecha de la ecografía en la semana 6 a 11 de gestación, que respalde un embarazo de al menos 39 semanas, o las mediciones de 12-20 semanas de gestación que confirmen un embarazo de al menos 39 semanas.
La prueba de MPF ideal sería poder realizar un diagnóstico por imagen con un instrumento que esté siempre al lado de la cama de la paciente, aunque hasta ahora esto es imposible. Todas las pruebas válidas requieren que se haga un análisis del líquido amniótico. La mejor manera de obtenerlo es por amniocentesis, inclusive en presencia de membranas rotas. La mayoría de los laboratorios debería contar con ese método, el que no debería estar afectado por sangre o meconio, y cuyos resultados deberían estar disponibles rápidamente y en cualquier momento. Las resultados de maduración falsos tienen consecuencias médicas peores que las que tienen los resultados falsos de inmadurez, debido a que los primeros pueden hacer que la balanza se incline más hacia una decisión de llegar a un parto prematuro.
Pruebas para predecir la maduración pulmonar fetal. Las pruebas disponibles para predecir la maduración pulmonar fetal están detalladas en la Tabla VI-4.
Todas las pruebas de MPF tienen sensibilidad alta (~95%), lo cual da resultados de inmadurez en los casos de RDS. Todas también tienen especificidad mediocre (~65%), dando resultados de maduración en la mayoría de los casos, aunque no en todos, con un desarrollo pulmonar fetal adecuado. Los estudios de resultados clínicos de la relación L/S (83-87), Fpol (83)(88-90), TDx MPFII (91)(92), y RCL (85)(93-103) tienen resultados similares. Los resultados cuantitativos de estas pruebas revelan el grado de maduración pulmonar y son mas útiles para el médico en el pronóstico que las pruebas cualitativas. La prueba de estabilidad de la espuma (104-109) ya no se encuentra disponible comercialmente y pocos laboratorios la utilizan. El tiempo de respuesta para la relación L/S es mucho más largo que en las otras pruebas. Muchos laboratorios han pasado de realizar pruebas de relación L/S a algunas más rápidas. La AmnioStat-MPF(110-114) es una prueba cualitativa que se ofrece en más de 400 laboratorios; pero a fines de 2003, el fabricante ya no pudo proveer los reactivos por lo que la prueba dejó de estar disponible al menos durante cuatro meses.
A pesar de que no hay pruebas controladas que evalúen la costo-efectividad del uso de la prueba de MPF, hay muchos estudios, citados más arriba, sobre su efectividad con respecto a la predicción del estado pulmonar del feto. Aunque su uso está disminuyendo, todavía se hacen muchos pedidos de prueba de MPF.
Tabla VI-4. Uso de Métodos de Prueba de Maduración Pulmonar Fetal (2002)*.

GUÍA 15: Prueba de maduración pulmonar fetal (MPF)
* La realización de la prueba de maduración pulmonar fetal (MPF) debería estar disponible en las maternidades. La prueba de MPF debería hacerse de rutina una vez al día y ante casos urgentes, dentro de la hora de la entrega del espécimen.
* La elección de una prueba rápida depende de la población de pacientes.
- Población de bajo riesgo: PG cualitativo (AmnioStat-MPF), TDx MPF II, RCL o Estabilidad de la Espuma.
- Población de alto riesgo: TDx MPF II, F Pol.
* Si una prueba rápida de MPF está disponible, derivar una solicitud de relación L/S a otro laboratorio es una práctica aceptable.
Valor predictivo. El valor predictivo de un resultado de maduración es muy bueno, se encuentra en aproximadamente el 98%, debido a la alta sensibilidad y baja prevalencia de la RDS. De manera inversa, una baja especificidad y una baja prevalencia producen un valor predictivo bajo de un resultado inmaduro. Por ejemplo, el análisis de 488 casos en la Universidad de Utah desde 1988 a 1993 demostró que 43 de 135 recién nacidos con un L/S inmaduro desarrollaban RDS. Por lo tanto, el valor predictivo de un L/S inmaduro en este contexto es de aproximadamente 32% (nótese que mientras que la sensibilidad y la especificidad pueden aplicarse a diferentes contextos, el valor predictivo no, porque depende de la prevalencia de RDS). Durante el mismo período de tiempo, 7 de 353 recién nacidos con L/S maduro desarrollaron RDS. Por lo tanto, el valor predictivo de un L/S maduro es de 98% en este contexto.
El fabricante de TDx MPF II (Abbot Laboratories) recomienda tres categorías de interpretación: inmadura (39 mg/g), intermedia (40-54 mg/g) y madura (Ž55 mg/g). Los estudios de resultado clínico indican que el límite de maduración superior podría bajarse sin ocasionar inconvenientes (91)(92). Por lo tanto, a diferencia de lo que recomienda el fabricante, un límite de decisión superior de 45 mg/g debería mejorar la especificidad a cerca del 85% al tiempo que mantendría la sensibilidad en >95%.
GUÍA 16: TDx MPF II
El uso de 45 mg/g como el umbral de decisión de maduración para TDx MPF II reduce el número de resultados inmaduros falsos sin incrementar de manera adversa el número de resultados maduros falsos.
Las pruebas de RCL son rápidas, pero los resultados difieren según el instrumento (93). Los umbrales de maduración de RCL varían de manera impresionante (19.000-50.000/µL) dependen de distintos protocolos de centrifugación (115) y distintos analizadores (116).
GUÍA 17: Los laboratorios que utilizan RCL para MPF deberían determinar los valores de referencia del siguiente modo:
(a) realizando un estudio de resultados clínicos.
(b) comparando sus métodos con un método utilizado en un estudio de resultados que utilice especímenes de líquido amniótico parejos y ajustando luego el umbral o transformando los resultados para coincidir con el método primario.
* Los laboratorios que utilizan RCL para la MPF no deberían utilizar la centrifugación para mejorar la precisión.
Contaminación sanguínea. Si se la compara con el líquido amniótico, la sangre contiene una alta concentración de fosfolípidos. Por lo tanto, los resultados de MPF de especímenes de líquido amniótico con sangre se ven alterados. PG es la excepción (117)(118). A pesar de que la contaminación sanguínea altera los resultados de MPF, ésta no produce resultados de madurez falsos (119).
GUÍA 18: Contaminación con sangre
Los especímenes de líquido amniótico con sangre se deberían analizar para MPF. Los resultados que denotan madurez o mucha inmadurez son confiables, mientras que los resultados de inmadurez en el límite podrían ser falsamente bajos o altos.
Contaminación por meconio. La presencia de una fuerte contaminación con meconio (>15 g/dL) interfiere con la mayoría de los resultados de MPF (120). La contaminación moderada con meconio (cerca de 5 g/dL) puede producir valores erróneos de relación L/S, de inmadurez a madurez (121)(122) e interfiere con los métodos de polarización de fluorescencia (TDx MPF II y Fpol) (123), pero no ocasiona resultados de AmnioStat-MPF falsos maduros (117)(118). Los resultados de RCL se incrementan en menos de 5.000 partículas/µL con una leve contaminación (94).
GUÍA 19: Contaminación con meconio
Los especímenes de líquido amniótico contaminados moderadamente con meconio (mayor de 5 g/dL) no deberían ser analizados para MPF excepto mediante el uso de PG.
Diabetes: El control glucémico estricto y los algoritmos de tratamiento han reducido de manera significativa la incidencia de RDS en el embarazo con diabetes (124)(125). Mientras algunos informes señalan más casos de RDS a pesar de los resultados de relación L/S que indican madurez (126), otros no indican ningún riesgo adicional (127) (128). Para la diabetes muy poco controlada, se ha informado que la gestación en la que la relación L/S comienza a elevarse, se presenta tanto retrasada (129) como no retrasada (79) si se la compara con los embarazos no diabéticos. En estudios recientes de diabéticas controladas, se coincide en que el momento de la irrupción de la relación L/S no se ve afectado por la diabetes (79)(130). Varios estudios TDx MPF II han demostrado que estos resultados son confiables cuando se los utiliza en los embarazos de diabéticas (131-133).
Independientemente del grado de control diabético, la detección de PG está retrasada en alrededor de 1.5 semanas (79)(134)(135). A pesar de que muchos médicos confían exclusivamente en PG para el manejo de las pacientes diabéticas, no hay estudios modernos para apoyar esta práctica.
No existen estudios suficientes para evaluar el efecto de la diabetes en el RDS y la estabilidad de la espuma.
GUÍA 20: Efecto de la diabetes sobre los valores de referencia
* En las pacientes diabéticas, no se requieren valores de referencia separados para TDx MPF II, Fpol, relación L/S y PG.
* Existen estudios insuficientes para evaluar el efecto de la diabetes en RDS y la confiabilidad de la prueba de estabilidad de la espuma.
Embarazos de mellizos. El RDS es una complicación frecuente en los embarazos de mellizos y puede ser discordante, especialmente antes de la semana 31 (136).
GUÍA 21: Embarazo de mellizos
Si se realiza la prueba para MPF antes de las 32 semanas de gestación, se deberían tomar muestras de ambos sacos.
SECCIÓN VII
Prácticas y guías actuales para la evaluación del recién nacido
Con los avances de la medicina moderna, el índice de supervivencia de los recién nacidos con un peso <1.000 g subió de un 0,5% en la década del 40, a más del 60% en los 90. Sin embargo, para los recién nacidos más pequeños, aquellos con un peso < 500 g, los índices de supervivencia continúan siendo del 6% (137).
Las causas más frecuentemente asociadas con la mortalidad neonatal incluyen infección, complicaciones pulmonares, daño en el SNC, daño renal y desequilibrio agua/electrolitos.
Las razones predominantes para la internación en la Unidad de Cuidados Intensivos Neonatales (UCIN) son partos pre-término y peso al nacer <1.000 g. Este tipo de recién nacidos generalmente necesita apoyo respiratorio y circulatorio y puede haber sido sometido a cirugías de emergencia importantes.
A medida que el recién nacido realiza la transición de la dependencia total materna y placentaria hacia el metabolismo independiente, muchos marcadores bioquímicos se ajustan de valores similares a los de la circulación materna a valores que reflejan el metabolismo propio del recién nacido (138). En éstos, el contenido de grasa y el de agua difieren de los valores observados en bebés de más edad. El contenido de agua en un bebé nacido a término puede ser un 20% más alto; el contenido de grasa es una función de la edad gestacional, que varía entre un 3,5% en un bebé nacido en la semana 28 a aproximadamente un 15% en un bebé nacido a término. En los recién nacidos prematuros, la función del hígado inmaduro puede causar un ritmo de metabolismo y excreción de drogas más lento, haciendo que dichos recién nacidos sean más susceptibles a la toxicidad de las mismas.
Intervalos de referencia específicos de la edad
El tema de los intervalos de referencia es un desafío para los pediatras en general y para los neonatólogos en particular. Los intervalos de referencia específicos de la edad son fundamentales para la interpretación adecuada de los resultados de las pruebas. Debido a la cantidad creciente de bebés prematuros, es mayor la necesidad de intervalos de referencia gestacionales y postnatales relacionados con la edad. Debido a que no se pueden aplicar los intervalos "normales" a los bebés prematuros; y dado que obtener el consentimiento por escrito para tomar muestras es cada vez más difícil, los laboratorios dependen de los intervalos de referencia publicados y de su mejor validación posible.
Muchos de los intervalos de referencia publicados se definen mediante métodos e instrumentos específicos. Los resultados deben ser interpretados con cuidado en base al método y al instrumento utilizado. Para la correcta interpretación de los mismos, los clínicos deben conocer las circunstancias en las cuales los intervalos de referencia para la edad gestacional no están disponibles o donde se utilizan intervalos de referencia de adultos (Tabla VII-1).
Como se indica en la Sección 1, se deberían usar los intervalos de referencia gestacional y postnatal específicos para la edad a medida que estén disponibles.
La fosfatasa alcalina en recién nacidos es más alta debido a la estructura ósea que se forma rápidamente. La tiroxina tiene un límite superior del intervalo de referencia de 277 nmol/L, que declina rápidamente durante el primer par de horas y cae a los niveles del adulto en los primeros días. La bilirrubina total generalmente es más alta debido a la función del hígado inmaduro. Debido a estas diferencias, es esencial que el laboratorio ofrezca intervalos de referencia adecuados, dado que muchos valores cambian cada hora entre los primeros tres días y el primer mes.
Tabla VII-1. Comparación típica de marcadores comunes en el adulto con aquellos de un recién nacido (a término) (139).

GUÍA 22: Intervalos de referencia neonatales
El laboratorio debería brindar para los recién nacidos los intervalos esperados en relación a los niveles de los adultos.
Problemas preanalíticos
Obtención de las muestras. Mientras que la obtención de las muestras en recién nacidos muy pequeños y enfermos puede ser muy laboriosa, contar con individuos bien capacitados para esta tarea es fundamental para el manejo de los laboratorios en las UCIN.
Enfermedades metabólicas. Los laboratorios pediátricos deberían tener acceso directo a los laboratorios de referencia que poseen el equipo necesario para analizar y monitorear aminoácidos, realizar cromatogramas, analizar ácidos orgánicos y realizar screenings metabólicos.
Consideraciones acerca de la flebotomía. La calidad de los resultados no es mejor que la calidad de los especímenes extraídos. Los sitios más comunes de flebotomía en bebés son la punción del talón y las extracciones de las vías arteriales. En la UCIN, la mayoría de los pacientes poseen vías arteriales y generalmente el residente, el neonatólogo o la enfermera extraen la sangre. Antes de realizar la extracción, los catéteres deben estar libres de solución de irrigación, para evitar la posible dilución y/o contaminación del espécimen.
Consideraciones preanalíticas de la punción en piel. Una vez que se punza la piel, la sangre debería fluir libremente en forma de gotitas en el tubo de extracción y mezclarse en forma adecuada si el tubo contiene anticoagulante. La contaminación con betadina aumenta el potasio, el fósforo, el cloruro, el CO2, y el ácido úrico. La hemólisis generalmente se produce debido a punciones mal realizadas. La hemólisis puede causar una interferencia en el método (según el fabricante) y un cambio en el analito observado debido a su liberación por parte de los glóbulos rojos. La liberación del contenido celular aumenta el potasio, LD, AST, ALT, CK y los triglicéridos. Otros analitos como la fosfatasa alcalina, la amilasa y GGT pueden disminuir debido a la liberación celular de enzimas metabólicas.

La punción del talón. La norma para la práctica de la punción de talón continúa siendo la norma aprobada por la NCCLS (CLSI). Esta Norma brinda un mapa para la colocación correcta de la lanceta con respecto a la configuración del pie del recién nacido.
GUÍA 23: Punciones del talón
Los flebotomistas deberían estar capacitados y respetar el documento de la NCCLS, NCCLS Procedures for the Collection of Diagnostic Blood Specimens by Skin Puncture: Approved Standard 4th ed. (1999), H4-A4 (Procedimientos de Extracción de especímenes de sangre para diagnóstico mediante punción de piel de la NCCLS, Norma aprobada, 4ta edición). Otros puntos clave de esta recomendación incluyen los siguientes:
* La profundidad óptima de la punción: la selección de la lanceta debería indicar una profundidad de punción < 2,4 mm.
* Evitar el masaje o el "ordeñe" del talón es importante porque de esta manera se pueden introducir interferencias importantes de tejidos celulares rotos. Puede haber un margen de error en los resultados entre la punción de la piel y la venipunción, de aproximadamente un 10% más elevado en algunos analitos en la primera.
* La punción frecuente de los talones de recién nacidos en la UCIN puede causar edemas. A su vez, esto puede contaminar el fluido, conduciendo a un aumento de ciertos analitos, particularmente hemoglobina, potasio y lactato dehidrogenasa.
Otros factores preanalíticos que pueden influir en los resultados. Entre estos factores se encuentran los siguientes:
* El llanto prolongado durante la extracción puede estar asociado con glucosa y lactato elevados.
* Se prefiere plasma en vez de suero, ya que ofrece un mejor rendimiento con menor riesgo de hemólisis y lisis de plaquetas.
* El tiempo de evaporación y transporte debería minimizarse tanto como sea posible. Si se necesita centrifugar, los tubos deberían estar tapados, ya que el Na, K, CO2, y Cl pueden aumentar hasta un 30% si se centrifuga sin tapones (140).
Diferencias en sangre capilar. TSH, TBG y T4 son más elevadas en la sangre capilar que en la sangre venosa. La glucosa puede ser de alrededor de 0,5 mmol/L más elevada que en el plasma, y 0,4 mmol/L más elevada que en sangre entera. Debido al metabolismo del tejido, el pH es más elevado en la sangre capilar que en la sangre venosa. El tubo de sangre capilar para los gases sanguíneos debe mezclarse, sellarse y colocarse en agua helada, ya que el pH a temperatura ambiente puede disminuir 0,005 cada 10 minutos. Para lograr el tiempo de respuesta adecuado, el análisis debe realizarse al lado del paciente o en la UCIN.
Las muestras tomadas en papel filtro en los monitoreos de los recién nacidos deberían tener círculos totalmente rellenos, de lo contrario pueden arrojar falsos resultados bajos.
Interferencias dependientes del método. Es importante conocer el grado de interferencia de valores elevados de bilirrubina, hemoglobina y lípidos.. En particular, los lípidos derivados de la nutrición parenteral total (NPT, intralípidos) pueden afectar a una variedad de analitos. La interferencia de la hemólisis en la bilirrubina depende del método. El procedimiento para bilirrubina de Jendrassik-Grof demuestra disminuciones en la concentración debido a la hemólisis. A la inversa, se observa un aumento en la bilirrubina con el detergente 2,5-diclorofenil diazonio.
Etiquetado de los especímenes. Generalmente, resulta difícil poner códigos de barra a los contenedores cortos de extracción de sangre que se utilizan con frecuencia, como a los tubos tipo Eppendorf y los contenedores de micro especímenes. Además, pueden no ser adecuados para algunos dispositivos de automatización, automatización preanalítica o sistemas de automatización total de laboratorio. Dichos especímenes deben manejarse por separado. La gran preponderancia de nacimientos múltiples a veces presenta un problema de identificación en las nurseries, con bebés todavía sin nombre (Ej. Smith - Mellizo A, Smith - Mellizo B). Es importante que el laboratorio y la nursery acuerden una convención para ponerles nombre a los bebés múltiples, compatibles con el sistema de información del laboratorio.
GUÍA 24: Factores preanalíticos
• Los fabricantes deberían ofrecer información sobre el impacto de los factores preanalíticos con respecto a los exámenes específicos.
• Los laboratorios deberían considerar adjuntar esta información a los informes.
Volumen de los especímenes. Es fundamental prestar atención al volumen de sangre extraído de un recién nacido. Los hematocritos en los recién nacidos y neonatos generalmente superan el 60%, dando como resultado menores rendimientos de plasma y/o suero. Se puede calcular el volumen de sangre de los recién nacidos mediante nomogramas según la edad y el tamaño, para ayudar a evaluar cuánta cantidad de sangre se puede extraer con seguridad en un momento dado. Las extracciones de sangre frecuentes en bebés prematuros crean el riesgo de anemia iatrogénica y se estima que el 64% de los bebés con un peso <1.500 g reciben transfusiones debido a extracciones de sangre excesivas.
Esto también pone al recién nacido en riesgo de complicaciones que surjan de las transfusiones de sangre. Muchas nurseries utilizan la siguiente regla general: se puede necesitar transfusión cuando se extrae un volumen de sangre Ž10% en 2-3 días. Esto representa cerca de 80 mL/kg de peso corporal para un bebé nacido a término y 100 mL/kg para un bebé prematuro. En los últimos años, las transfusiones han disminuido debido a un monitoreo más transcutáneo y a nuevos instrumentos que requieren menos sangre. Y con más monitoreos in vivo y pruebas en puntos de atención (point-of-care), se predice que no habrá tanta necesidad de transfusiones y de extracciones de sangre.
Volumen muerto. Se lo define como el volumen de espécimen que no puede ser tomado como muestra del vaso o del contenedor de muestras. En la actualidad, la mayor parte de los proveedores de instrumental pueden conseguir el pipeteo preciso de tamaños de muestras muy pequeñas y ofrecer contenedores apropiados con pequeños volúmenes muertos de entre 40 a 50 µL.
GUÍA 25: Contenedores de muestras
Los laboratorios deberían utilizar contenedores de muestra que puedan alcanzar un volumen muerto de 40-50 µL.
Especímenes de orina. Cuando se necesitan especímenes de orina es preferible utilizar especímenes al azar o juntar muestras por un determinado período (en vez de muestras de 24 horas). Debido a que es extremadamente difícil obtener un espécimen de 24 horas completo de un recién nacido no cateterizado, el espécimen preferido sería el obtenido por cateterismo.
GUÍA 26: Especímenes de orina
El laboratorio debería trabajar con el médico para garantizar un espécimen de orina adecuado, de ser necesario.
Especímenes inmediatos y urgentes: tiempos de respuesta para resultados. El tiempo de respuesta (TAT) se define como el intervalo de tiempo desde la extracción del espécimen hasta la recepción de los resultados. Para la mayoría de los laboratorios pediátricos, no es raro observar requerimientos de tiempos de respuesta inmediatos en 50-60% de los especímenes recibidos, comparado con el 30-40% en adultos. Una prueba que se realiza fuera de su sitio habitual, incluso en un dispositivo que la realiza en 10 minutos, puede tener un TAT tan largo como una prueba que demora 30 minutos cuando se realiza en el laboratorio o al lado del paciente. En recién nacidos gravemente enfermos, analitos como electrolitos, glucosa en sangre y gases sanguíneos deberían tener un TAT de minutos, mientras que el resto debería recibirse lo antes posible (ASAP, por sus siglas en inglés). Las pruebas esenciales deberían poder realizarse las 24 horas del día. Para las pruebas no urgentes, las mediciones diarias deberían ser suficientes.
GUÍA 27: Pruebas inmediatas y tiempo de respuesta
El laboratorio debería trabajar con los médicos para garantizar el TAT adecuado para las solicitudes inmediatas y no inmediatas y definir los parámetros sobre las expectativas del TAT (Ej. extracción a recepción, recepción a verificación de resultados, etc.)
Intervalo analítico. Para evitar las demoras que surgen de diluciones por valores fuera de linealidad, el intervalo de respuesta lineal de ciertos analitos puede tener que ser mayor que el requerido para un adulto. La bilirrubina es un buen ejemplo donde el intervalo lineal debería extenderse a 25 mg/dL (428 µmol/L) sin la necesidad de dilución.
Fluidos y electrolitos en neonatos. Durante la primera semana de vida, pequeños cambios en la ingesta o pérdida de agua y electrolitos pueden producir cambios proporcionalmente grandes en el agua y en el contenido de electrolitos total en el cuerpo. El recién nacido prematuro es mucho más vulnerable a las pérdidas por su piel más permeable. Esto conduce a la deshidratación y a electrolitos elevados anormales. La pérdida de agua extracelular puede conducir a una pérdida de peso de 5-10% en un recién nacido a término y a un máximo de 10-20% en un recién nacido prematuro. Se necesita un monitoreo cuidadoso de los electrolitos. Evitar informar el potasio en especímenes visiblemente hemolizados y confirmar los resultados críticos de electrolitos utilizando un espécimen obtenido de una punción no cutánea, es decir, una venipunción o preferentemente de la extracción de una vía.
GUÍA 28: Monitoreo de electrolitos
* Evitar informar el potasio en especímenes visiblemente hemolizados.
* Confirmar los resultados críticos de electrolitos utilizando un espécimen obtenido de una punción no cutánea, es decir, una venipunción o preferentemente de la extracción de una vía.
Función cardíaca y respiratoria neonatal
La distribución de oxígeno a los tejidos depende de la capacidad de transportar oxígeno y de la saturación de oxígeno de la hemoglobina, así como también de la función cardíaca y respiratoria. La hipoxia está asociada con hipertensión pulmonar, con un flujo sanguíneo pulmonar disminuido, con acidosis y daño de órganos, y puede ser originada por un bajo gasto cardíaco, por cardiopatía congénita, enfermedad pulmonar, anemia o variantes de hemoglobina. La hiperoxia, que puede ocurrir con la administración de oxígeno en un recién nacido prematuro, está asociada a una mayor incidencia de retinopatía del prematuro y a otras formas de toxicidad por oxígeno. El objetivo terapéutico es la adecuada distribución de oxígeno sin una presión indebida en los órganos, como los pulmones y la retina.
Cuando ocurren disfunciones cardíacas y/o respiratorias durante el periodo neonatal se debe monitorear la oxigenación, la ventilación alveolar y el estado ácido-base. Este monitoreo puede realizarse al lado del paciente o en el laboratorio. En el diagnóstico de hipoxia e hiperoxia es necesario medir los gases sanguíneos arteriales (ABG).
El monitoreo continuo no invasivo de la saturación de oxígeno de la hemoglobina mediante oximetría de pulso es una herramienta útil para monitorear el oxígeno en la UCIN. Se deben interpretar los valores de los gases sanguíneos arteriales con cuidado en pacientes con hiperbilirrubinemia, anemia o en aquellos que reciben hiperalimentación, dado que los resultados del ABG pueden no tener correlación con la oximetría de pulso.
La oximetría de pulso mide la saturación de oxígeno (s2 [a]) y los monitores de oxígeno transcutáneo miden la presión parcial del oxígeno arterial (pO2[a]). Aunque cada una tiene sus limitaciones, estas tendencias de monitoreo con dispositivos no invasivos en la oxigenación resultan fáciles de utilizar. La frecuencia de validación de mediciones de ABG cuantitativas depende de la situación clínica del bebé. Los valores de sO2(a) obtenidos a través de una oximetría de pulso deberían validarse mediante oximetría-CO directa desde un catéter arterial estacionario. Las mediciones de gases sanguíneos deberían llevarse a cabo cada seis horas en recién nacidos estables y con más frecuencia en recién nacidos gravemente enfermos. La hemoglobina fetal (HbF) está presente en los recién nacidos aproximadamente durante seis meses; tiene una afinidad más alta por el oxígeno y satura a un a pO2 más baja que la HbA. Para monitorear la saturación de O2, la oximetría de pulso es menos susceptible a este cambio que la oximetría-CO.
Las tecnologías más nuevas para la medición de gases sanguíneos incluyen sistemas de monitoreo in vivo y ex vivo continuos. Los monitoreos in vivo de gases sanguíneos requieren la colocación de un sensor/detector en la arteria radial del paciente, mientras que los monitoreos ex vivo extraen sangre a través de un catéter, realizan mediciones en forma externa y le devuelven la sangre al paciente. Estos sistemas permiten monitoreos continuos o frecuentes sin pérdida de sangre.
Se puede calcular el equilibrio entre la producción metabólica de dióxido de carbono (CO2) y la eliminación ventilatoria de CO2 midiendo la presión parcial del dióxido de carbono (pCO2) en la sangre arterial. Para el manejo de una pCO2 mayor, probablemente haya que disminuir la producción de CO2 (Ej. a través de la sedación o reducción del estrés térmico) o aumentar la ventilación (Ej. aumentando el ritmo del respirador o el volumen corriente, reduciendo la resistencia de la vía aérea, administrando surfactante). La pCO2 directa se puede medir por ABG o mediante monitoreos no invasivos usando CO2 (tcPCO2) transcutáneos o monitoreo del dióxido de carbono del final de la respiración CO2 (PCO2 [ET]). Aunque en recién nacidos prematuros se prefiere el método tcPCO2, cada dispositivo tiene limitaciones que requieren validación mediante mediciones de ABG.
Consideraciones preanalíticas del estado ácido-base
Se obtienen especímenes por punción arterial, punción cutánea (talón o dedo) o de un catéter estacionario ubicado en la aorta a través de la arteria umbilical o de una arteria periférica. La sangre que se obtiene de los catéteres estacionarios ofrece la medición más precisa de la PO2 (a); sin embargo, existen riesgos asociados a trombosis y a infecciones. Los catéteres estacionarios deberían ser enjuagados y descartar unas cuantas gotas de sangre antes de tomar la muestra. La arteria radial es el sitio usual para realizar la punción arterial; sin embargo, esto es doloroso para el bebé y causa llanto, produciendo cambios en la pO2 (a).
Se debe considerar la cantidad y tipo de heparina utilizada para anticoagular la sangre. Por ejemplo, cantidades elevadas de solución de heparina diluyen la sangre y disminuyen artificialmente la pCO2 y el bicarbonato. Los electrolitos medidos en la misma muestra que los ABG pueden arrojar un falso resultado elevado de sodio o potasio, si se utiliza heparina sódica y heparina potásica. Se recomienda heparina de litio seca para evitar efectos de dilución. La punción cutánea o la sangre capilar se obtiene del talón o, con menos frecuencia, del dedo. Surgen resultados confiables si se optimizan las técnicas para obtener el espécimen, se realiza una perfusión adecuada, se evitan burbujas de aire y se diluye el anticoagulante. Las mediciones de pO2 capilar en los bebés enfermos son inestables y no se recomiendan.
El volumen de espécimen requerido para las mediciones de gases sanguíneos varía entre 45 µL y 400 µL, según la cantidad de analitos medidos (Ej. gases sanguíneos, electrolitos, etc.) y el instrumento seleccionado. Aunque se considera que un espécimen es estable durante 15 minutos para realizar las mediciones de gases sanguíneos, el protocolo preferido es un espécimen extraído en una jeringa de plástico, no colocada en hielo, y analizada dentro de los 10 minutos. Deberían informarse los parámetros para el ABG (medido y calculado), incluyendo PO2, PCO2, pH, bicarbonato calculado y el exceso/déficit de bases calculado. La comunicación efectiva entre el laboratorio y la UCIN es esencial para establecer tiempos de respuesta recíprocamente aceptables e intervalos de referencia adecuados según la edad.
Ictericia neonatal. Hasta un 60% de recién nacidos a término y 80% de los recién nacidos prematuros muestran esta condición en la primera semana de vida. La ictericia neonatal es el producto visual de los depósitos de bilirrubina en la piel y las membranas mucosas. La ictericia fisiológica se define como 13 mg/dL, o 222 mmol/L (unidades SI) en la primera semana de vida.
Para el manejo de rutina del recién nacido, la medición de bilirrubina es tan común que a la mayor parte de ellos se la realiza al menos una vez. La bilirrubina total generalmente se utiliza como el indicador inicial de la ictericia. Las mediciones de bilirrubina precisas son vitales para la evaluación y monitoreo terapéutico de la ictericia neonatal y en el diagnóstico diferencial de inmadurez hepática frente a las consecuencias más peligrosas de la ictericia hemolítica inducida por el anticuerpo Rh. La mayoría de los casos de bilirrubina elevada son consecuencia de que la función del hígado inmaduro impacta en la conjugación de la bilirrubina. Las mediciones de bilirrubina total son importantes en la detección de la ictericia hemolítica. Dado que solamente la bilirrubina conjugada cruza la barrera sangre/cerebro, las mediciones de bilirrubina directa o conjugada y el fraccionamiento pueden ser útiles en el diagnóstico de trastornos hepáticos, hemólisis, trastornos hereditarios en el metabolismo de la bilirrubina y en la prevención de daño cerebral o kernicterus y su espasticidad asociada, pérdida de la audición y retardo mental.
Las causas de la sobrecarga de bilirrubina incluyen una mayor producción de bilirrubina, una mayor relación glóbulos rojos/peso corporal comparada con adultos, una vida más corta de los glóbulos rojos, inmadurez hepática que genera conjugación disminuida y depuración hepática disminuida. La toxicidad por bilirrubina en el recién nacido puede ocurrir por una alteración en la unión a la albúmina (o centros de unión insuficientes o niveles de albúmina bajos) que pueden aumentar los niveles de bilirrubina. Tanto la acidosis como las drogas que desplazan la bilirrubina de la albúmina, aumentan la concentración de bilirrubina.. Los estudios recientes en terapia neonatal para bebés positivos para antiinmunoglobulina sugieren que el tratamiento con inmunoglobulina intravenosa es efectivo como terapia alternativa para la ictericia hemolítica isoinmune y puede reducir la necesidad de transfusión de intercambio (141). Sin embargo, es necesario realizar más estudios bien diseñados antes de que el uso de la inmunoglobulina intravenosa pueda recomendarse para el tratamiento de la ictericia hemolítica isoinmune.
GUÍA 29: Pruebas para la función hepática
Debería evaluarse la función hepática utilizando una combinación de prueba de bilirrubina y pruebas enzimáticas.
Glucosa en recién nacidos. Tanto las concentraciones de glucosa altas como bajas pueden ser peligrosas para el recién nacido. Los recién nacidos están en riesgo de hipoglucemia inmediatamente luego del nacimiento debido a la elevada actividad de la enzima glucolítica, siendo el riesgo mayor en recién nacidos prematuros con bajas reservas de glucógeno hepático. La hiperglucemia puede ocurrir luego de la administración de glucosa, particularmente en el recién nacido prematuro, debido a una lenta respuesta a la insulina. La administración de glucosa en los grupos de riesgo es esencial. Para recién nacidos moderadamente prematuros o de crecimiento retardado, la glucosa debe monitorearse con la lactancia materna y con leche de fórmula. Para los bebés con enfermedades agudas, la administración de los fluidos debe ser bastante agresiva y el monitoreo de los niveles de glucosa en sangre es clave. En casos de hipoglucemia inesperada, debería estudiarse al bebé por fallas innatas del metabolismo. El monitoreo frecuente generalmente se realiza utilizando monitoreos de glucosa en puntos de atención (POCT). Debido a los esperados niveles más altos de hematocritos en los recién nacidos en general y en los recién nacidos que reciben terapia de oxígeno en particular, se deben evaluar los dispositivos y las tiras de prueba y correlacionarlas con los métodos de laboratorio para la correcta interpretación de los resultados. Además, la glucosa en sangre en POCT es aproximadamente 11% más elevada que en suero o plasma.
Aunque no hay un acuerdo uniforme sobre el valor límite de la hipoglucemia, el laboratorio debería confirmar los resultados de glucosa críticos (generalmente <40 mg/dL, 2,2 mmol/L) que se obtienen mediante dispositivos POCT. Muchas UCIN tratan de mantener las concentraciones entre 3 mmol/L (>54 mg/dL) y 10 mmol/L (<180 mg/dL) (142)(143).
GUÍA 30: Mediciones de glucosa crítica utilizando dispositivos POCT (pruebas en puntos de atención)
Los laboratorios deberían confirmar las mediciones de glucosa de <2,22 mmol/L que se realizan con dispositivos POCT.
La creatinina, en los primeros días de vida, refleja la función materna. La interpretación de los resultados de creatinina se ve complicada por los cambios rápidos en el volumen extracelular y el caudal de filtración glomerular. Los cambios en la creatinina varían con la edad gestacional y la ausencia de un descenso esperado puede indicar una función renal comprometida.
El lactato puede acumularse en los tejidos, en la sangre y en el líquido cefalorraquídeo (LCR) producto del metabolismo anaeróbico a menudo causado por el llanto. Las mediciones de lactosa indican la adecuación de la distribución de oxígeno reciente o actual a los tejidos y pueden ser esenciales para el diagnóstico de errores innatos del metabolismo. Los pequeños sistemas en el punto de atención para lactato en sangre entera están disponibles en la actualidad para las UCIN o para la atención al lado del paciente.
El calcio y el fósforo se incorporan a la matriz ósea durante el último trimestre. Por lo tanto, el bebé prematuro tiene mayor necesidad de estos dos minerales que aquellos nacidos a término. En las soluciones de nutrición parenteral (NP), la interacción del calcio y del fosfato es compleja y está influenciada por muchos factores. Los requerimientos de calcio y fósforo exceden la solubilidad de estos dos minerales y conducen a precipitación y embolización u oclusión del catéter. La distribución óptima está restringida por el pH de la solución, que a su vez está principalmente determinada por la concentración de aminoácidos en la solución NP. Por lo tanto, los bebés prematuros con NP a largo plazo también están en riesgo de desarrollar osteopenia de prematuros (enfermedad ósea metabólica) y fracturas subsecuentes. Los exámenes de rutina para el monitoreo de calcio, fósforo y fosfatasa alcalina identificarán a aquellos pacientes con mayor riesgo. En la enfermedad ósea metabólica, los niveles de fosfatasa alcalina son elevados; el calcio en el suero puede ser normal a costa de la pérdida ósea y el nivel de fósforo es bajo. El fósforo urinario es bajo debido a la reabsorción tubular renal del fósforo y el calcio urinario es elevado. También pueden medirse los niveles de 25-hidroxivitamina D en suero, aunque las preparaciones multivitamínicas pediátricas proveen las cantidades de vitamina adecuada para mantener los niveles de suero normales y prevenir tanto la toxicidad como la deficiencia. El calcio aumenta durante las primeras horas de vida luego de la respuesta de la hormona paratiroidea y disminuye en las siguientes 24-48 horas. El calcio total subestima el calcio fisiológicamente activo (calcio iónico) si la albúmina en suero y/o el pH son bajos. Por lo tanto, el calcio iónico es la medición que se prefiere cuando se necesita realizar una evaluación precisa, particularmente en la hipocalcemia del bebé prematuro.
GUÍA 31: Prueba de calcio en el recién nacido
El calcio iónico es el método preferido para evaluar el calcio.
Drogas terapéuticas. Aproximadamente 12% de las drogas recetadas en los Estados Unidos son para niños menores de nueve años. Para los recién nacidos prematuros de <1.000 g, la cantidad de drogas suministradas durante la hospitalización promedia las 15-20. Por lo tanto, es necesario el monitoreo agresivo para prevenir la toxicidad en los pacientes más pequeños, dado que la farmacocinética es significativamente diferente en los bebés. La absorción se ve alterada en el periodo neonatal debido al pH gástrico y al tiempo de vaciado. Hay una diferencia en el volumen de distribución (VD) debido a la composición del cuerpo, al contenido de grasa y de agua. La depuración es más lenta en bebés prematuros debido a la función renal y hepática inmadura. Debido a la inmadurez de los caminos enzimáticos y a una menor unión a proteínas, la biotransformación de las drogas en metabolitos y la forma bio-usable es menor.
Pruebas de enfermedad congénita o infecciosa
Estreptococo grupo B. El estreptococo grupo B (EGB) está presente en la vagina y en las zonas gastrointestinales de 10-30% de las mujeres saludables, aunque rara vez causa infección. Cada año se desarrollan infecciones en más de 50.000 embarazos. Estas infecciones pueden estar presentes en el útero, en el líquido amniótico, en el tracto urinario y en los sitios de incisión, por ej. sección cesárea. Durante el parto, el bebé puede infectarse mediante la inhalación o la ingesta de la bacteria. Aproximadamente 8.000 bebés en los Estados Unidos contraen la enfermedad EGB grave cada año, con una tasa de mortalidad de 10%. Hasta un 20% de los bebés que sobreviven a la meningitis relacionada al EGB quedan minusválidos (144).
En los recién nacidos, el EGB es la causa más común de sepsis y meningitis y es una causa frecuente de neumonía neonatal. La enfermedad del EGB es más común que otros problemas neonatales más conocidos, como la rubéola, la sífilis congénita y la espina bífida. Los problemas a largo plazo de aquellos que sobreviven, particularmente aquellos que desarrollaron meningitis, pueden incluir pérdida de la audición o de la vista y varios grados de discapacidades físicas y del aprendizaje, incluyendo parálisis cerebral.
Los recién nacidos infectados pueden tener síntomas a las seis horas o a los dos meses del nacimiento.
El diagnóstico temprano y el inicio de la terapia con antibióticos en el recién nacido generalmente se retrasan debido a signos y síntomas clínicos no específicos, sutiles y a menudo leves. El retraso del tratamiento está asociado con una mortalidad y morbilidad neonatal significativas debido a la rápida progresión y gravedad de la infección en los recién nacidos. El marco de tiempo necesario para una evaluación microbiológica definitiva es demasiado amplio para retener la terapia con antibióticos, además, se pueden requerir cultivos múltiples para una recuperación del patógeno. Los cultivos también pueden estar contaminados, dificultando así la interpretación.
La iniciación de la terapia con antibióticos generalmente se basa en la impresión clínica.
En 1996, el Centro para el Control y la Prevención de Enfermedades, el Colegio de Obstetricia y Ginecología de los Estados Unidos y la Academia Estadounidense de Pediatría del CDC, en colaboración con el Colegio de Obstetras y Ginecólogos de los Estados Unidos y la Academia Estadounidense de Pediatría publicaron guías dinámicas para los screenings prenatales y la prevención de la enfermedad por EGB. Estas guías fueron revisadas en 2002. Los estudios más recientes demostraron que los screenings de rutina del EGB previenen más casos de enfermedad con aparición temprana que el abordaje basado en el riesgo. Estos datos apoyaron la conclusión de que todas las mujeres embarazadas deberían realizarse cultivos vaginales y rectales de EGB para screening a la semana 35-37 de gestación (144). Las recomendaciones aconsejaron a los laboratorios que adopten prácticas óptimas de screening para identificar el EGB y para informar rápidamente los resultados de las pruebas para que la mujer embarazada con EGB pueda recibir antibióticos durante el parto (145).
GUÍA 32: Screening de EGB en mujeres embarazadas
Cumplir con las guías del CDC sobre el screening perinatal del EGB en todas las mujeres embarazas en la semana 35-37 de gestación.
Los esfuerzos para identificar biomarcadores sensibles y confiables frustraron por décadas a los investigadores. Por ejemplo, no hay criterios hematológicos aceptados en forma uniforme que distingan en forma efectiva a los recién nacidos infectados de aquellos no infectados. La búsqueda de un indicador de laboratorio temprano de sepsis neonatal se ve incentivada por el aumento reciente de la resistencia a los antibióticos en bacterias patogénicas asociados con el uso indiscriminado de los mismos, la disrupción del enlace bebé-madre relacionado con el alta hospitalario temprano, recién nacidos sujetos a terapias intravenosas y el impulso por la contención de costos médicos.
Las proteínas de fase aguda (fibrinógeno, alfa-1-antitripsina, haptoglobina, ferroxidasa, proteína C reactiva y alfa 1 glucoproteína ácida) han sido tema de numerosas investigaciones (146)(147). El tiempo de latencia entre la aparición de la infección y la producción de proteínas de fase aguda explica la sensibilidad desalentadora y los valores predictivos positivos para realizar la prueba. Los estudios recientes sugieren que una combinación de pruebas de PCR, interleucina-6 y procalcitonina en el período postnatal temprano puede detectar la infección en un recién nacido de mayor riesgo, asintomático, con una madre infectada (147). Todavía se está desarrollando una vacuna como prevención final.
Pruebas en el punto de atención (POCT)
Los requerimientos de pequeños especímenes y el rápido tiempo de respuesta hacen que las pruebas en el punto de atención sean muy apropiadas para los recién nacidos. Muchos dispositivos de POCT son capaces de dosar analitos múltiples en especímenes de sangre de 100 µL o menos. Esta cantidad es menor a la cantidad requerida de extracción para mandar al laboratorio, mezclar y aspirar en el dispositivo analítico.
Es necesario validar estos dispositivos en el punto de atención en recién nacidos con respecto a las interferencias típicas y al intervalo de concentraciones discrepantes que se observan en adultos (Ej. lipemia de NPT, hematocritos elevados en recién nacidos). Para la glucosa, es importante utilizar un sistema que es confiable en los intervalos de glucosa baja de 2,22 mmol/L o menos. A menudo, para los fabricantes es difícil validar cada circunstancia debido a las dificultades para obtener muestras representativas.
Los monitoreos in vivo y ex vivo de gases sanguíneos y electrolitos están disponibles y son aplicables a la población neonatal. El dispositivo en el punto de atención "ideal" es pequeño, robusto y liviano; utiliza pequeños volúmenes de muestras y se transporta fácilmente. Los dispositivos en el punto de atención se clasifican en dos grupos: dispositivos electrónicos y no electrónicos. Los no electrónicos que se han utilizado durante muchos años e incluyen procedimientos manuales se basan en indicadores y generalmente producen resultados positivos/negativos cualitativos o semi-cuantitativos. Los ejemplos aplicables a los recién nacidos incluyen varilla indicadora y pruebas de embarazo. Los dispositivos electrónicos son portátiles y pueden transportarse de paciente a paciente o permanecer en un solo lugar, como en la UCIN. Los métodos aplicables en el punto de atención incluyen electroquímica, fotometría de reflectancia y métodos basados en la inmunología.
Los ejemplos de analizadores POCT actualmente utilizados en las UCIN incluyen SureStep Probe para la glucosa de LifeScan, Hemocue para la hemoglobina de ITC, Hemochron Junior Signature para TCA (tiempo de coagulación activado), y el I-Stat para gases sanguíneos, electrolitos y creatinina.
Diferencias en los resultados. Los resultados de los dispositivos para medir glucosa en sangre pueden no ser los mismos a los del laboratorio por una cantidad de razones. La glucólisis durante el transporte puede disminuir el resultado del laboratorio (comparado con el resultado tomado al lado del paciente). La glucosa en sangre entera puede ser hasta 11% más elevada que la glucosa en el plasma debido al tiempo de mezclado y contacto con los glóbulos rojos. Ante valores extremos de hematocrito, la glucosa en sangre entera predicha no se corresponde con la verdadera glucosa en sangre entera. Con un dispositivo que lisa las células, éste no es un problema.
Otras diferencias observadas pueden deberse a diferentes esquemas de calibración como también a efectos de la matriz de las muestras. Los dispositivos en el punto de atención pueden ser menos precisos que los dispositivos de los laboratorios. En el laboratorio, los CV (coeficiente de variación) de la glucosa generalmente son < 5%. La aprobación de la FDA generalmente requiere 20%. Los problemas preanalíticos, como el cumplimiento del personal y la competencia en la realización de pruebas en los puntos de atención también pueden contribuir en las diferencias.
Una encuesta reciente de capacidad (Proficiency Survey AAB 2nd Q 2001) comparó diferentes dispositivos para medir glucosa y demostró una amplia gama en valores recuperados por cada muestra (Tabla VII-2).
Las sugerencias para evitar errores potenciales en la utilización de medidores de glucosa en sangre incluyen (143):
* Conocer los límites del glucómetro y de las mediciones con tiras reactivas.
* Saber si las mediciones reflejan plasma (conversión) o sangre entera.
* Entender los cambios en la composición de la sangre en pacientes gravemente enfermos.
* Utilizar cintas de prueba insensibles al O2 en pacientes bajo ventilación de O2.
Tabla VII-2. Comparación de Glucómetros: Valores recuperados.
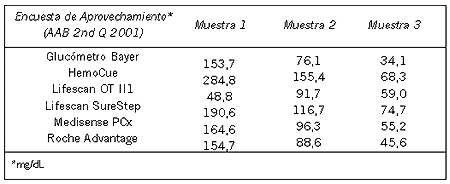
Nuevas tecnologías POCT emergen rápidamente. Con dispositivos de monitoreo continuo in vivo y ex vivo y una cantidad en aumento de dispositivos mínimamente invasivos y no invasivos, muchos se adaptan particularmente bien a la población pediátrica. Aquí se ofrecen algunos ejemplos. Un ejemplo de una aplicación in vivo o monitoreo ex vivo con una guía in vivo es el caso en el cual la sangre de una vía arterial pasa a un monitor ex vivo para la medición de gases sanguíneos y algunos electrolitos (pH, pCO2, pO2, sodio, potasio, hematocrito) y luego vuelve a ingresar a la circulación del recién nacido. Una gran ventaja para esta aplicación de monitoreo continuo es la mínima pérdida de sangre que ofrece. Estudios recientes demuestran buena correlación con los analizadores de laboratorio (148)(149).
El dispositivo para control de bilirrubina en puntos de atención BiliCheck de SpectRx, Inc. es portátil y no invasivo y utiliza el análisis espectral de longitud de onda múltiple para tomar mediciones transcutáneas de la frente del bebé. Un estudio reciente (150) de 490 recién nacidos de diversas razas en el periodo previo o cercano al alta demostró acuerdo con las mediciones de HPLC que son el estándar de oro (r=0,91, intervalo 0,2-18,2). Además, el color de piel no fue una variable significativa y se pudieron identificar antes de darles el alta a los recién nacidos en alto riesgo potencial de desarrollar una hiperbilirrubinemia a las 48 horas.
El Cygnus GlucoWatch de Biographer es un dispositivo mínimamente invasivo para monitorear la glucosa. Se extrae glucosa a través de la piel mediante iontoforesis inversa utilizando una corriente eléctrica aplicada y se detecta mediante un sensor enzimático electroquímico. Se pueden obtener tres mediciones por hora. La espectroscopia de polarización ortogonal (EPO) utiliza imágenes in vivo sublinguales para medir los glóbulos rojos y el análisis de sangre parcial. Una sonda colocada bajo la lengua mide el caudal de sangre a través de los pequeños capilares de la lengua.
GUÍA 33: Pruebas en puntos de atención para recién nacidos
* El laboratorio debería considerar el uso de pruebas en puntos de atención no invasivas como una alternativa a las pruebas de laboratorio para minimizar las extracciones de sangre. Los requerimientos de pequeños especímenes y el rápido tiempo de respuesta hacen que las aplicaciones en el punto de atención sean muy apropiadas para los recién nacidos.
* La sangre neonatal difiere de la del adulto. Por lo tanto, el laboratorio debería validar el efecto de las interferencias (Ej. hematocritos elevados) y la diferencia en los resultados de los análisis de recién nacidos respecto de los adultos, en los mismos dispositivos POCT.
Grupo sanguíneo y prueba de antiglobulina directa (Prueba de Coombs directa)
Estas pruebas son apropiadas en recién nacidos en las siguientes situaciones:
* Cuando la madre tiene grupo sanguíneo O.
* Cuando la madre tiene grupo sanguíneo Rh negativo.
* Cuando un screening de anticuerpos indica que la madre tiene un anticuerpo que pudiera dañar al bebé.
* Cuando el bebé tiene síntomas clínicos que podrían explicarse mediante los resultados de estas pruebas.
Existen dos razones principales para llevar a cabo pruebas de grupo sanguíneo en un recién nacido. La primera es para determinar si la madre es candidata a recibir inmunoglobulina Rh post-parto, para poder prevenir el desarrollo de anticuerpos Rh maternos que pudieran dañar el feto en embarazos futuros. Solamente las mujeres Rh negativas, madres de bebés Rh positivos deberían recibir el tratamiento. La segunda razón es para identificar a los recién nacidos en riesgo de desarrollar anemia hemolítica. En ese caso, los bebés con grupo sanguíneo A o B pueden reaccionar a los anticuerpos producidos por las madres con grupo sanguíneo O. La prueba directa de antiglobulina puede determinar si los anticuerpos maternos reaccionan con los glóbulos del bebé. Una prueba positiva significa que el bebé está en riesgo de desarrollar anemia hemolítica y una prueba negativa indica que los anticuerpos de la madre no están reaccionando con la sangre del bebé, entonces generalmente el bebé no está en riesgo. Muchas reacciones a los anticuerpos maternos se corrigen automáticamente y producen solamente síntomas leves. Una prueba de hemoglobina en el bebé puede medir la extensión de la anemia.
La limitación principal de la prueba directa de antiglobulina son los falsos negativos. La presencia de los anticuerpos maternos en la sangre del bebé puede estar debajo del umbral de detección. Así, una prueba directa de antiglobuina negativa no descarta la posibilidad de anemia. A la inversa, un resultado positivo no significa necesariamente que el bebé desarrollará esa afección.
GUÍA 34: Pruebas críticas en recién nacidos antes de darles el alta del hospital
Las siguientes pruebas críticas deberían practicarse antes de que el bebé sea dado de alta:
* Inmunidad a la rubéola (sarampión alemán)
* VIH
* Screening para hepatitis B
* Hemoglobina (análisis de sangre completo) y hematocrito
* Monitoreo de anormalidades en la hemoglobina, en base a los antecedentes familiares/médicos
* Prueba de screening neonatal requerida por el organismo de control
* Toxoplasmosis
* Screening de anticuerpos Rh
Referencias bibliográficas
42. CEMACH. Why mothers die, 1997-1999: the confidential enquiries into maternal deaths in the UK. London: RCOG Press, 2001.
43. Rey E, LeLorier J, Burgess E, Lange IR, Leduc L. Report of the Canadian Hypertension Society Consensus Conference: 3. Pharmacologic treatment of hypertensive disorders in pregnancy. CMAJ 1997; 157 (9): 1.245-54.
44. Report of the National High Blood Pressure Education Program Working Group on high blood pressure in pregnancy. Am J Obstet Gynecol 2000; 183 (1): S1-S22.
45. Brown MA, Hague WM, Higgins J, Lowe S, McCowan L, Oats J, et al. The detection, investigation, and management of hypertension in pregnancy: executive summary. Aust N Z J Obstet Gynaecol 2000; 40 (2): 133-8.
46. Douglas KA, Redman CWG. Eclampsia in the United Kingdom-Reply. Br Med J 1995; 310 (6987): 1.138.
47. Caritis S, Sibai B, Hauth J, Lindheimer MD, Klebanoff M, Thom E, et al. Low-dose aspirin to prevent preeclampsia in women at high risk. New Engl J Med 1998; 338 (11): 701-5.
48. Mackay AP, Berg CJ, Atrash HK. Pregnancy-related mortality from preeclampsia and eclampsia. Obstet Gynecol 2001; 97 (4): 533-8.
49. Stevenson DK, Wright LL, Lemons JA, Oh W, Korones SB, Papile LA, et al. Very low birth weight outcomes of the National Institute of Child Health and Human Development Neonatal Research Network, January 1993 through December 1994. Am J Obstet Gynecol 1998; 179: 1.632-9.
50. von Dadelszen , Magee LA, Lee SK, Stewart SD, Simone C, Koren G, et al. Activated protein C in normal human pregnancy and pregnancies complicated by severe preeclampsia: a therapeutic opportunity? Crit Care Med 2002; 30 (8): 1.883-92.
51. Saudan PJ, Brown MA, Farrell T, Shaw L. Improved methods of assessing proteinuria in hypertensive pregnancy. Brit J Obstet Gynaec 1997; 104 (10): 1.159-64.
52. Saudan PJ, Brown MA, Farrell T. Spot urine protein-to-creatinine ratio for assessing proteinuria in hypertensive pregnancies. Kidney Int 1997; 51 (4): 1306.
53. Waugh J, Bell SC, Kilby M, Lambert P, Shennan A, Halligan A. Effect of concentration and biochemical assay on the accuracy of urine dipsticks in hypertensive pregnancies. Hypertens Preg 2001; 20 (2): 205-17.
54. Caetano M, Ornstein M, von Dadelszen P, Hannah ME, Logan AG, Gruslin A, et al. A survey of Canadian practitioners regarding the diagnosis and evaluation of the hypertensive disorders of pregnancy. Hypertens Preg (MS#2002-70, in press).
55. Irgens HU, Reisaeter L, Irgens LM, Lie RT. Long-term mortality of mothers and fathers after preeclampsia: populationbased cohort study. Br Med J 2001; 323 (7323): 1.213-6.
56. Greer IA. Thrombosis in pregnancy: maternal and fetal issues. Lancet 1999; 353(9160): 1258-65.
57. Macklon NS, Greer IA. Venous thromboembolic disease in obstetrics and gynaecology: the Scottish experience. Scott Med J 1996; 41 (3): 83-6.
58. Report of the RCOG working party on prophylaxis against thromboembolism in gynaecology and obstetrics. London: Royal College of Obstetricians and Gynaecologists; 1995.
59. Laffan M, Tuddenham E. Science, medicine, and the future-assessing thrombotic risk. Br Med J 1998; 317 (7157): 520-3.
60. Brill-Edwards P, Ginsberg JS, Gent M, Hirsh J, Burrows R, Kearon C, et al. Safety of withholding heparin in pregnant women with a history of venous thromboembolism. New Engl J Med 2000; 343 (20): 1.439-44.
61. Rai R, Cohen H, Dave M, Regan L. Randomised controlled trial of aspirin and aspirin plus heparin in pregnant women with recurrent miscarriage associated with phospholipid antibodies (or antiphospholipid antibodies). Br Med J 1997; 314 (7076): 253-7.
62. Martin JA, Hamilton BE, Ventura SJ, Menacker F, Park MM. Births: final data for 2000. National vital statistics reports 5. Hyattsville, MD: National Center for Health Statistics, 2002; 50 (5).
63. Miniño AM, Arias E, Kochanek KD, Murphy SL, Smith BL. Deaths: final data for 2000. National vital statistics reports. Hyattsville, MD: National Center for Health Statistics, 2002; 50 (15).
64. Goldenberg RL, Mercer BM, Iams JD, Moawad AH, Meis PJ, Das A, et al. The preterm prediction study: patterns of cervicovaginal fetal fibronectin as predictors of spontaneous preterm delivery. National Institute of Child Health and Human Development Maternal-Fetal Medicine Units Network. Am J Obstet Gynecol 1997; 177 (1): 8-12.
65. Joffe GM, Jacques D, Bemis-Heys R, Burton R, Skram B, Shelburne P. Impact of the fetal fibronectin assay on admissions for preterm labor. Am J Obstet Gynecol 1999; 180 (3 Pt 1): 581-6.
66. Iams JD, Casal D, McGregor JA, Goodwin TM, Kreaden US, Lowensohn R, et al. Fetal fibronectin improves the accuracy of diagnosis of preterm labor. Am J Obstet Gynecol 1995; 173 (1): 141-5.
67. Peaceman AM, Andrews WW, Thorp JM, Cliver SP, Lukes A, Iams JD, et al. Fetal fibronectin as a predictor of preterm birth in patients with symptoms: a multicenter trial. Am J Obstet Gynecol 1997; 177 (1): 13-8.
68. Luzzi V, Hankins K, Gronowski AM. Accuracy of the rapid fetal fibronectin TLi system in predicting preterm delivery. Clin Chem 2003; 49 (3): 501-2.
69. Sullivan A, Hueppchen NA, Satin AJ. Cost effectiveness of bedside fetal fibronectin testing varies according to treatment algorithm. J Matern Fetal Med 2001; 10 (6): 380-4.
70. Kiss H, Ahner R, Hohlagschwandtner M, Leitich H, Husslein P. Fetal fibronectin as a predictor of term labor: a literature review. Acta Obstet Gynecol Scand 2000 Jan; 79 (1): 3-7.
71. Bishop EH. Pelvic scoring for elective induction. Obstet Gynecol 1964; 24: 266-8.
72. Williams MC, Krammer J, O'Brien WF. The value of the cervical score in predicting successful outcome of labor induction. Obstet Gynecol 1997; 90 (5): 784-9.
73. Hedriana HL, Munro CJ, Eby-Wilkens EM, Lasley BL. Changes in rates of salivary estriol increases before parturition at term. Am J Obstet Gynecol 2001; 184 (2): 123-30.
74. Goffinet F, Maillard F, Fulla Y, Cabrol D. Biochemical markers (without markers of infection) of the risk of preterm delivery. Implications for clinical practice. Eur J Obstet Gynecol Reprod Biol 2001; 94 (1): 59-68.
75. Goldenberg RL, Iams JD, Mercer BM, Meis PJ, Moawad A, Das A, et al. The preterm prediction study: toward a multiple-marker test for spontaneous preterm birth. Am J Obstet Gynecol 2001; 185 (3): 643-51.
76. Oulton M, Martin TR, Faulkner GT, Stinson D, Johnson JP. Developmental study of a lamellar body fraction isolated from human amniotic fluid. Pediatr Res 1980; 14: 722-8.
77. Hawgood S, Clements JA. Pulmonary surfactant and its apoproteins. J Clin Invest 1990; 86: 1-6.
78. Persson A, Chang D, Crouch E. Surfactant protein D is a divalent cation-dependent carbohydrate-binding protein. J Biol Chem 1990; 26510: 5.755-60.
79. Moore TR. A comparison of amniotic fluid fetal pulmonary phospholipids in normal and diabetic pregnancy. Am J Obstet Gynecol 2002; 186: 641-50.
80. American College of Obstetricians and Gynecologists, Committee on Educational Bulletins. Assessment of fetal lung maturity. ACOG Educational Bulletin No. 230. Washington, DC: American College of Obstetricians and Gynecologists, 1996.
81. College of American Pathologists. CAP surveys, lung maturity survey, set LM-B. Northfield, IL: College of American Pathologists, 2002.
82. College of American Pathologists. Supplemental questions on lamellar body counts. Surveys 000; LM-C: 4-5.
83. Ashwood ER, Tait JF, Foerder CA, Franklin RW, Benedetti TJ. Improved fluorescence polarization assay for use in evaluating fetal lung maturity. III. Retrospective clinical evaluation and comparison with the lecithin/sphingomyelin ratio. Clin Chem 1986; 32: 260-4.
84. Tsai MY, Shultz EK, Williams PP, Bendel R, Butler J, Farb H, et al. Assay of disaturated phosphatidylcholine in amniotic fluid as a test of fetal lung maturity: experience with 2000 analyses. Clin Chem 1987; 33 (9): 1.648-51.
85. Ashwood ER, Palmer SE, Taylor JS, Pingree SS. Lamellar body counts for rapid fetal lung maturity testing. Obstet Gynecol 1993; 81: 619-24.
86. Bender TM, Stone LR, Amenta JS. Diagnostic power of lecithin/sphingomyelin ratio and fluorescence polarization assays for respiratory distress syndrome compared by relative operating characteristic curves. Clin Chem 1994; 40 (4): 541-5.
87. Wijnberger LD, Huisjes AJ, Voorbij HA, Franx A, Bruinse HW, Mol BW. The accuracy of lamellar body count and lecithin/sphingomyelin ratio in the prediction of neonatal respiratory distress syndrome: a meta-analysis. BJOG 2001; 108 (6): 583-8.
88. Tait JF, Foerder CA, Ashwood ER, Benedetti TJ. Prospective clinical evaluation of an improved fluorescence polarization assay for predicting fetal lung maturity. Clin Chem 1987; 33: 554-8.
89. Chen C, Roby PV, Weiss NS, Wilson JA, Benedetti TJ, Tait JF. Clinical evaluation of the NBD-PC fluorescence polarization assay for prediction of fetal lung maturity. Obstet Gynecol 1992; 80: 688-92.
90. Ruch AT, Lenke RR, Ashwood ER. Assessment of fetal lung maturity by fluorescence polarization in high-risk pregnancies. J Reprod Med 1993; 38: 133-6.
91. Fantz CR, Powell C, Karon B, Parvin CA, Hankins K, Dayal M, et al. Assessment of the diagnostic accuracy of the TDx-FLM II to predict fetal lung maturity. Clin Chem 2002; 48: 761-5.
92. Kesselman EJ, Figueroa R, Garry D, Maulik D. The usefulness of the TDx/TDxFLx fetal lung maturity II assay in the initial evaluation of fetal lung maturity. Am J Obstet Gynecol 2003; 188: 1.220-2.
93. Neerhof MG, Dohnal JC, Ashwood ER, Lee IS, Anceschi MM. Lamellar body counts: a consensus on protocol. Obstet Gynecol 2001; 97 (2): 318-20.
94. Dubin SB: Characterization of amniotic fluid lamellar bodies by resistive-pulse counting: Relationship to measures of fetal lung maturity. Clin Chem 1989; 35: 612-6.
95. Greenspoon JS, Rosen DJ, Roll K, Dubin SB. Evaluation of lamellar body number density as the initial assessment in a fetal lung maturity test cascade. J Reprod Med 1995; 40: 260-6.
96. Bowie LJ, Shammo J, Dohnal JC, Farrell E, Vye MV. Lamellar body number density and the prediction of respiratory distress. Am J Clin Pathol 1991; 95: 781-6.
97. Dalence CR, Bowie LJ, Dohnal JC, Farrell EE, Neerhof MG. Amniotic fluid lamellar body count: a rapid and reliable fetal lung maturity test. Obstet Gynecol 1995; 86: 235-9.
98. Fakhoury G, Daikoku NH, Benser J, Dubin NH. Lamellar body concentrations and the prediction of fetal pulmonary maturity. Am J Obstet Gynecol 1994; 170: 72-6.
99. Lee IS, Cho YK, Kim A, Min WK, Kim KS, Mok JE. Lamellar body count in amniotic fluid as a rapid screening test for fetal lung maturity. J Perinatol 1996; 16: 176-80.
100. Pearlman ES, Baiocchi JM, Lease JA, Gilbert J, Cooper JH. Utility of a rapid lamellar body count in the assessment of fetal maturity. Am J Clin Pathol 1991; 95: 778-80.
101. Dilena BA, Ku F, Doyle I, Whiting MJ. Six alternative methods to the lecithin/sphingomyelin ratio in amniotic fluid for assessing fetal lung maturity. Ann Clin Biochem 1997; 34: 106-8.
102. Neerhof MG, Haney EI, Silver RK, Ashwood ER, Lee IS, Piazze JJ. Lamellar body counts compared with traditional phospholipid analysis as an assay for evaluating fetal lung maturity. Obstet Gynecol 2001; 97: 305-9.
103. Beinlich A, Fischass C, Kaufmann M, Schlosser R, Dericks-Tan JS. Lamellar body counts in amniotic fluid for prediction of fetal lung maturity. Arch Gynecol Obstet 1999; 262: 173-80.
104. Sher G, Statland BE, Freer DE, Kraybill EN. Assessing fetal lung maturation by the foam stability index test. Obstet Gynecol 1978; 52: 673-7.
105. Sher G, Statland BE, Freer DE. Clinical evaluation of the quantitative foam stability index test. Obstet Gynecol 1980; 55: 617-20.
106. Sher G, Statland BE, Knutzen VK. Diagnostic reliability of the lecithin/sphingomyelin ratio assay and the quantitative foam stability index test: results of a comparative study. J Reprod Med 1982; 27: 51-5.
107. Sher G, Statland BE. Assessment of fetal pulmonary maturity by the Lumadex foam stability index test. Obstet Gynecol 1983; 61: 444-9.
108. Lockitch G, Wittmann BK, Snow BE, Campbell DJ. Prediction of fetal lung maturity by use of the Lumadex-FSI test. Clin Chem 1986; 32: 361-3.
109. Lipshitz J, Whybrew WD, Anderson GD. Comparison of the Lumadex-foam stability index test, lecithin: sphingomyelin ratio, and simple shake test for fetal lung maturity. Obstet Gynecol 1984; 63: 349-54.
110. Halvorsen PR, Gross TL. Laboratory and clinical evaluation of a rapid slide agglutination test for phosphatidylglycerol. Am J Obstet Gynecol 1985; 151: 1.061-6.
111. Weinbaum PJ, Richardson D, Schwartz JS, Gabbe SG. Amniostat FLM: a new technique for detection of phosphatidylglycerol in amniotic fluid. Am J Perinatol 1985; 2: 88-92.
112. Lockitch G, Wittmann BK, Mura SM, Hawkley LC. Evaluation of the amniostat-FLM assay for assessment of fetal lung maturity. Clin Chem 1984; 30: 1.233-7.
113. Garite TJ, Yabusaki KK, Moberg LJ, Symons JL, White T, Itano M, et al. A new rapid slide agglutination test for amniotic fluid phosphatidylglycerol: laboratory and clinical correlation. Am J Obstet Gynecol 1983; 147: 681-6.
114. Towers CV, Garite TJ. Uselessness of the phosphatidylglycerol assay for prediction of lung maturity (reply). Am J Obstet Gynecol 1989; 161: 1.419.
115. Dubin SB. Assessment of fetal lung maturity. Practice parameter. Am J Clin Pathol 1998; 110: 723-32.
116. Szallasi A, Gronowski AM, Eby CS. Lamellar body count in amniotic fluid: a comparative study of four different hematology analyzers. Clin Chem 2003; 49: 994-7.
117. Farquharson J, Jamieson EC, Berry E, Buchanan R, Logan RW. Assessment of the amniostat-FLM immunoagglutination test for phosphatidylglycerol in amniotic fluid. Clin Chim Acta 1986; 156: 271-7.
118. Benoit J, Merrill S, Rundell C, Meeker CI. Amniostat-FLM: an initial clinical trial with both vaginal pool and amniocentesis samples. Am J Obstet Gynecol 1986; 154: 65-8.
119. Grenache DG, Parvin CA, Gronowski AM. Preanalytical factors that influence the Abbott TDx Fetal Lung Maturity II assay. Clin Chem 2003; 49: 935-9.
120. Lenke R, Ashwood E. Lung Maturity Testing. In: Quilligan EJ, Zuspan FP, eds. Current therapy in obstetrics and gynecology, 5th ed. Philadelphia: WB Saunders; 2000: 419.
121. Longo SA, Towers CV, Strauss A, Asrat T, Freeman RK. Meconium has no lecithin or sphingomyelin but affects the lecithin/sphingomyelin ratio. Am J Obstet Gynecol 1998; 179: 1.640-2.
122. Weitzner JS, Strassner HT, Rawlins RG, Mack SR, Anderson RA Jr. Objective assessment of meconium content of amniotic fluid. Obstet Gynecol 1990; 76 (6): 1.143-4.
123. Tait JF, Franklin RW, Simpson JB, Ashwood ER. Improved fluorescence polarization assay for use in evaluating fetal lung maturity: I. Development of the assay procedure. Clin Chem 1986; 32: 248-54.
124. Robert MF, Neff RK, Hubbell JP, Taeusch HW, Avery ME. Association between maternal diabetes and the respiratory distress syndrome in the newborn. N Engl J Med 1976; 294: 357-60.
125. Mimouni F, Miodovnik M, Whitsett JA, Holroyde JC, Siddiqi TA, Tsang RC. Respiratory distress syndrome in infants of diabetic mothers in the 1980s: no direct adverse effect of maternal diabetes with modern management. Obstet Gynecol 1987; 69: 191-5.
126. Cruz AC, Buhi WC, Birk SA, Spellacy WN. Respiratory distress syndrome with mature lecithin/sphingomyelin ratios: diabetes mellitus and low Apgar scores. Am J Obstet Gynecol 1978; 126: 78-82.
127. Gabbe SG, Lowensohn RI, Mestman JH, Freeman RK, Goebelsmann U. Lecithin/sphingomyelin ratio in pregnancies complicated by diabetes mellitus. Am J Obstet Gynecol 1977; 128: 757-60.
128. Tabsh KM, Brinkman CR III, Bashore RA. Lecithin:sphingomyelin ratio in pregnancies complicated by insulin-dependent diabetes mellitus. Obstet Gynecol 1982; 59: 353-8.
129. Piper JM, Langer O. Does maternal diabetes delay fetal pulmonary maturity? Am J Obstet Gynecol 1993; 168: 783-6.
130. Berkowitz K, Reyes C, Saadat P, Kjos SL. Fetal lung maturation. Comparison of biochemical indices in gestational diabetic and nondiabetic pregnancies. J Reprod Med 1997; 42: 793-800.
131. Del Valle GO, Adair CD, Ramos EE, Gaudier FL, Sanchez-Ramos L, Morales R. Interpretation of the TDx-FLM fluorescence polarization assay in pregnancies complicated by diabetes mellitus. Am J Perinatol 1997; 14: 241-4.
132. Livingston EG, Herbert WN, Hage ML, Chapman JF, Stubbs TM. Use of the TDx-FLM assay in evaluating fetal lung maturity in an insulin-dependent diabetic population. The Diabetes and Fetal Maturity Study Group. Obstet Gynecol 1995; 86: 826-9.
133. Tanasijevic MJ, Winkelman JW, Wybenga DR, Richardson DK, Greene MF. Prediction of fetal lung maturity in infants of diabetic mothers using the FLM S/A and disaturated phospatidylcholine tests. Am J Clin Pathol 1996; 105: 17-22.
134. Tsai MY, Shultz EK, Nelson JA. Amniotic fluid phosphatidylglycerol in diabetic and control pregnant patients at different gestational lengths. Am J Obstet Gynecol 1984; 149: 388-92.
135. Cunningham MD, McKean HE, Gillispie DH, Greene JW. Improved prediction of fetal lung maturity in diabetic pregnancies: a comparison of chromatographic methods. Am J Obstet Gynecol 1982; 142: 197-204.
136. Whitworth NS, Magann EF, Morrison JC. Evaluation of fetal lung maturity in diamniotic twins. Am J Obstet Gynecol 1999; 180: 1.438-41.
137. Larrson L. Technology and the future of neonatal testing. EduTrak presentation #3405. AACC Annual Meeting, San Francisco, CA, July 26, 2000.
138. Goldsmith BM. Clinical chemistry of the newborn and infant. Lab Med 1997; 28: 659-63.
139. Goldsmith BM. STAT testing in the neonate. Blood Gas News 2002; 11 (1): 4-13.
140. Young DS. Preanalytical issues in neonatology. Blood Gas News 2002; 11 (1): 14-18.
141. Pishva N, Madani A, Homayoon K. Prophylactic intravenous immunoglobulin in neonatal immune hemolytic jaundice. Irn J Med Sci 2000; 25 (3&4): 129-33.
142. Hawdon JM. Glucose and lactate in neonatology (clinical focus). Blood Gas News 2002; 11 (6): 37-40.
143. Tang Z, Kost GJ. Reducing errors in glucose meter measurements. Advance 2000; 9(8): 10-1.
144. Centers for Disease Control and Prevention. Prevention of perinatal Group B streptococcal disease. MMWR 2002; 51(No. RR-11):1-22.
145. Schrag SJ, Zywicki S, Farley MM, Reingold AL, Harrision LH, Lefkowitz LB, et al. Group B streptococcal disease in the era of intrapartum antibiotic prophylaxis. N Engl J Med 2000; 342: 15-20.
146. Chiesa C, Pellegrinin G, Panero A, Osborn J, Signore F, Assumma M, et al. C-reactive protein, interleukin-6, and procalcitonin in the immediate postnatal period. Influence of illness severity, risk status, antenatal, and perinatal complications and infection. Clin Chem 2003; 49 (1): 60-8.
147. Garg SK. The utility of serial C-reactive proteins in the newborn as an indicator for neonatal depsis. Diabetes Care 1999; 22: 1.708-14.
148. Weiss IK, Fink S, Harrison R, Feldman JD, Brill JE. Clinical assessment: continuous arterial blood gas monitoring in the pediatric intensive care unit. Pediatrics 1999; 103: 440-5.
149. Widness JA, Kulhavy JC, Johnson KJ, Cress GA, Kromer IJ, Acarregui MJ, et al. Clinical performance of an in-line point-of-care monitor in neonates. Pediatrics 2000; 106: 497-504.
150. Bhutani VK, Gourley GR, Adler S, Kreamer B, Dalin C, Johnson LH. Noninvasive measurement of total serum bilirubin in a multiracial predischarge newborn population to assess the risk of severe hyperbilirubinemia. Pediatrics 2000; 106: 2-17. [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ] [ Links ]














