Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. v.42 n.1 La Plata ene./mar. 2008
BIOQUÍMICA CLÍNICA
Adiponectina: una adipocitoquina con múltiples funciones protectoras*
Adiponectin: an adipocytokine with multiple protective functions
Natalia Elissondo1, Leonardo Gómez Rosso2, Patricia Maidana3, Fernando Brites4
1. Bioquímica. Especialista en Bioquímica Clínica, Área Endocrinología. Jefa de Trabajos Prácticos de Análisis Clínicos II, Área Endocrinología, Facultad de Farmacia y Bioquímica, UBA.
2. Bioquímico. Becario Ramón Carrillo - Arturo Oñativia, Ministerio de Salud de la Nación. Docente de Laboratorio Avanzado en Bioquímica Clínica, Facultad de Farmacia y Bioquímica, UBA.
3. Bioquímica. Especialista en Bioquímica Clínica, Área Endocrinología. Jefa de Trabajos Prácticos de Análisis Clínicos II, Área Endocrinología, Facultad de Farmacia y Bioquímica, UBA.
4. Bioquímico. Doctor de la Universidad de Buenos Aires. Profesor Adjunto de Laboratorio Avanzado en Bioquímica Clínica, Facultad de Farmacia y Bioquímica, UBA. Investigador Adjunto del CONICET.
* Departamento de Bioquímica Clínica, Facultad de Farmacia y Bioquímica, UBA. Junín 956. Ciudad Autónoma de Buenos Aires (1113).
Resumen
Actualmente, se considera que el tejido adiposo es un órgano dinámico involucrado en muchos procesos fisiológicos y metabólicos. Expresa y secreta una gran variedad de péptidos activos conocidos como adipocitoquinas que actúan en forma local y sistémica. Además, expresa numerosos receptores que le permiten responder a señales aferentes de diferentes órganos endocrinos y del sistema nervioso central. La adiponectina es una hormona de 30 kDa producida exclusivamente por el tejido adiposo. A diferencia de las demás adipocitoquinas conocidas, sus niveles se encuentran disminuídos en estados asociados con resistencia insulínica, tal como obesidad, diabetes tipo 2 y síndrome metabólico. A esta proteína se le ha atribuído un rol antidiabético, antiinflamatorio y antiaterogénico. El objetivo de este trabajo es realizar una revisión acerca de la estructura, las funciones biológicas, el o los posibles mecanismos de acción, las implicancias fisiopatológicas y las posibles aplicaciones de la evaluación de los niveles de esta adipocitoquina a nivel clínico.
Palabras clave: Adiponectina; Tejido adiposo; Adipocitoquinas; Obesidad; Diabetes tipo 2; Resistencia insulínica; Aterosclerosis
Summary
The adipose tissue is considered a dynamic organ, which is involved in a wide range of physiological and metabolic processes. This tissue expresses and secretes a variety of bioactive peptides, known as adipocytokines, which act both at the local and at the systemic levels. The adipose tissue also expresses several receptors that allow it to respond to afferent signals from different endocrine organs, as well as form the central nervous system. Adiponectin is a 30 kDa hormone exclusively secreted by adipocytes. Unlike the other known adipocytokines, its concentration is reduced in conditions associated to insulin resistance, like obesity, type2 diabetes and metabolic syndrome. Several studies suggest that adiponectin has antidiabetic, antiinflammatory and antiatherogenic actions. The aim of this work is to review the new advances in structure, biological functions, mechanisms of action and potential clinical applications of adiponectin evaluation.
Key words: Adiponectin; Adipose tissue; Adipocytokines; Obesity; Type 2 diabetes; Insulin resistance; Atherosclerosis
I) INTRODUCCIÓN
La adiponectina es una hormona de reciente descubrimiento a la cual se le ha atribuido un rol antidiabético, antiinflamatorio y antiaterogénico. La misma es producida exclusivamente por el tejido adiposo.
El tejido adiposo es un tejido conectivo especializado. Es el principal reservorio de lípidos del organismo, fundamentalmente en forma de triglicéridos. En los mamíferos, se pueden encontrar dos tipos de tejido adiposo, que se diferencian por su histología, distribución y función: tejido adiposo marrón o pardo y tejido adiposo blanco (1). El tejido adiposo está formado por adipocitos inmersos en una red de fibras de colágeno junto con otras células como fibroblastos, leucocitos y preadipocitos.
Actualmente, el tejido adiposo es considerado un órgano dinámico involucrado en muchos procesos fisiológicos y metabólicos. Se sabe que expresa y secreta una gran variedad de péptidos activos conocidos como adipocitoquinas, las cuales actúan en forma local (autocrina/paracrina) y sistémica (endocrina) (Tabla I). Además, expresa numerosos receptores que le permiten responder a señales aferentes de distintos órganos endocrinos y del sistema nervioso central (2) (Tabla II).
El rol del tejido adiposo como órgano endocrino también se ha demostrado al estudiar las consecuencias metabólicas adversas de su exceso y su déficit. La obesidad o exceso de tejido adiposo, particularmente de localización visceral, se asocia con resistencia a la insulina, hiperglucemia, dislipemia, hipertensión arterial y con estados proinflamatorios y protrombóticos. La deficiencia de tejido adiposo o lipodistrofia también se asocia con características del síndrome metabólico (2).
El objetivo de este trabajo es realizar una actualización sobre la estructura de la adiponectina, sus funciones biológicas, su o sus posibles mecanismos de acción, las implicancias fisiopatológicas y las posibles aplicaciones de su medida a nivel clínico.
Tabla I. Proteínas derivadas del adipocito con funciones endocrinas.

Tabla II. Receptores expresados por el tejido adiposo y sus ligandos.

II) IDENTIFICACIÓN DE LA ADIPONECTINA
La adiponectina es una hormona proteica producida exclusivamente por el tejido adiposo (3). Fue identificada por cuatro grupos independientes entre 1995 y 1996. Dos de los grupos la clonaron de líneas celulares murinas (4)(5), 3T3-L1 y 3T3F442A, otro grupo la identificó como el transcripto más abundante derivado del tejido adiposo a partir de biopsias de tejido adiposo humano (3) y el último grupo la aisló de plasma humano por cromatografía de afinidad (6). Naturalmente, los cuatro grupos utilizaron diferente nomenclatura:
• Proteína de 30 kDa del adipocito relacionada con el complemento (Acrp30) (4)
• AdipoQ (5)
• Proteína derivada del gen transcripto más abundante del tejido adiposo (apM1) (3)
• Proteína de unión a gelatina de 28 kDa (GBP28) (6)
III) ESTRUCTURA MOLECULAR Y BIOSÍNTESIS DE LA ADIPONECTINA
La adiponectina es una proteína de aproximadamente 30 kDa, compuesta por 247 aminoácidos (3). Está codificada en el brazo largo del cromosoma 3, locus 3q27. Al gen se lo denominó apM1 por ser el transcripto más abundante del adipocito. Este posee una extensión de 17 Kb y está compuesto por 3 exones y 2 intrones (7).
Esta proteína está formada por cuatro dominios (4) (Fig. 1):
• Secuencia señal amino terminal
• Región variable
• Dominio tipo colágeno (cAd)
• Dominio globular carboxilo terminal (gAd)
Teniendo en cuenta su estructura primaria, la adiponectina presenta homología con: la proteína miembro del sistema complemento C1q, el colágeno VIII, el colágeno X y la precerebelina (8)(9). Estudios de cristalografía con rayos X del fragmento globular reflejan una alta homología estructural con el factor de necrosis tumoral (TNF) a (10).
Una vez sintetizada, la adiponectina se somete a una serie de hidroxilaciones y glicosilaciones en el dominio tipo colágeno produciendo 8 isoformas (11). Se han identificado 5 sitios de o-glicosilación, 4 de ellos en las lisinas 68, 71, 80 y 104, y el último sitio en la prolina 94. Kitajima et al. (12) reportaron la presencia de residuos de ácido disiálico en la molécula de adiponectina. Estos residuos parecen ser específicos de los adipocitos ya que su presencia aún no se ha detectado en otro tejido y su función es aún desconocida. Las modificaciones post traduccionales de la adiponectina son esenciales para su actividad biológica (11).
La estructura básica de la adiponectina forma trímeros, lo que refleja su homología con isoformas del colágeno. Los trímeros se forman por asociación de 3 monómeros a través del dominio globular. No se ha detectado en circulación la presencia de monómeros de 30 kDa. Estos parecen confinarse exclusivamente al adipocito (13). La adiponectina también presenta homología estructural con el miembro del sistema complemento C1q y comparte con él la propiedad de formar homomultímeros (14), lo cual se ha comprobado mediante cromatografía por filtración en gel y estudios de gradientes de velocidad (4)(6)(15).
Waki et al. (16) analizaron muestras de suero humano y de ratón por SDS-PAGE en condiciones no desnaturalizantes y no reductoras, y separaron tres especies de adiponectina de diferente peso molecular (aproximadamente 67, 136 y mayor a 300 kDa) (Fig. 2). Estos autores las denominaron Low Molecular Weight (LMW), Middle Molecular Weight (MMW) y High Molecular Weight (HMW), respectivamente. Por medio de diferentes experimentos, Waki et al. (16) llegaron a la conclusión de que las especies LMW, MMW y HMW correspondián respectivamente a trímeros, hexámeros y multímeros mayores, obviamente todos múltiplos de tres. Los autores reportaron el rol de los puentes disulfuro presentes en la región variable de la molécula en la formación de especies de mayor peso molecular (16). Waki et al. también observaron niveles de HMW mayores en mujeres que en hombres, mientras que los niveles de LMW y MMW no variaban con el género. Otros autores (17) ya habían reportado que los niveles plasmáticos de adiponectina total eran mayores en el sexo femenino.
En plasma, se ha detectado la existencia de bajas concentraciones del fragmento globular de la adiponectina (18). Este fragmento de 137 aminoácidos se genera por clivaje proteolítico de la molécula nativa. El fragmento globular se puede trimerizar pero no forma oligómeros de alto peso molecular (16)(19). El fragmento globular presenta actividad biológica. En experimentos llevados a cabo en ratones, se observó que es tan eficiente como la molécula completa para disminuir el nivel sérico de glucosa y ácidos grasos libres (20).
Se debe tener en cuenta que la adiponectina es una hormona que presenta mucha heterogeneidad. No sólo existen variaciones debidas a las glicosilaciones, sino que también forma multímeros de diferente peso molecular y en circulación existe un fragmento derivado de la proteólisis que es biológicamente activo (fragmento globular) (Fig. 2).

Figura 1. Estructura y dominios de la adiponectina. Homología estructural con C1q y generación de fragmento globular por proteólisis. Adaptado de Kadowaki et al. (14).
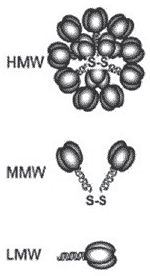
Figura 2. Esquemas de las diferentes especies de adiponectina. HMW, alto peso molecular; MMW, peso molecular medio; LMW, bajo peso molecular. Adaptado de Kadowaki et al. Endocrine Reviews 2005; 26: 439-51 (14).
IV) SECRECIÓN DE LA ADIPONECTINA
Como ya se indicó, la adiponectina es secretada exclusivamente por el tejido adiposo. La adiponectina circula en plasma en concentraciones que oscilan entre 5 y 30 µg/mL y representa aproximadamente el 0,01% del total de las proteínas plasmáticas (17). Su concentración plasmática es aproximadamente 3 veces superior a la mayoría de las hormonas.
La secreción de adiponectina exhibe una pulsatilidad ultradiana y presenta variaciones diurnas, con una disminución a la noche y un pico temprano por la mañana. El ritmo circadiano de la adiponectina es casi idéntico al del cortisol y a la proteína de unión de la leptina, lo cual sugiere un posible rol inhibitorio de la leptina sobre la secreción de la adiponectina (21).
La secreción de la adiponectina está regulada por muchas hormonas. Los primeros estudios reportaron que la insulina era un regulador positivo (4). Sin embargo, recientemente se ha observado que la misma disminuye la expresión de adiponectina tanto en humanos como en ratones (22). Se ha reportado que el factor símil insulina tipo 1 (Insulin-like growth factor-1, IGF-1) aumenta la transcripción de la adiponectina y el tratamiento con TNFa, glucocorticoides, agonistas b adrenérgicos o dibutiril-c-AMP la disminuyen (8)(10)(23)(24). Nilsson et al. (25) reportaron una disminución en la secreción de adiponectina en cultivos celulares en respuesta a la administración de prolactina y somatotrofina. Los ratones transgénicos que sobreexpresan somatotrofina o prolactina presentan menores niveles séricos de adiponectina cuando se los compara con los wild type. Por el contrario, los ratones knock out para el receptor de la hormona de crecimiento presentan altos niveles circulantes de adiponectina (25).
Los niveles séricos de adiponectina total, así como los de las diferentes especies multiméricas, son diferentes en hombres y mujeres (16)(17). Algunos autores señalan un posible rol de los esteroides sexuales en su regulación (8). Hitoshi et al. (26) reportaron que en ratones hembras ovariectomizados no se altera el nivel de adiponectina, mientras que su nivel se eleva al castrar ratones machos. Al administrar testosterona a los ratones machos castrados, el nivel de adiponectina baja. El aumento de adiponectina que se observa en los ratones machos castrados está acompañado de una mejoría en la sensibilidad a la insulina. Estos autores también realizaron experimentos in vitro y observaron una disminución en la secreción de adiponectina por adipocitos en cultivo tratados con testosterona (26).
V) MÉTODOS PARA DETERMINAR LOS NIVELES PLASMÁTICOS DE ADIPONECTINA
Los primeros métodos utilizados para evaluar los niveles plasmáticos de adiponectina fueron cromatográficos. Así, muchos autores realizaban SDS-PAGE, Western blot y una densitometría para el análisis de las bandas. Otros autores realizaban una separación por cromatografía de filtración en gel y analizaban las fracciones eluídas por SDS-PAGE. Rápidamente, se desarrollaron inmunoensayos in house. Arita et al. (17) desarrollaron un ELISA en el cual se basaron muchos de los métodos actualmente disponibles en el mercado. Ellos generaron un anticuerpo monoclonal que reaccionaba específicamente con el monómero de 30 kDa, y que es utilizado como el anticuerpo de captura. Como segundo anticuerpo, utilizaron un suero policlonal marcado con peroxidasa y los estándares fueron realizados con adiponectina recombinante obtenida en bacterias. Los autores observaron que cuando se sometían muestras de suero directamente a un ELISA, la absorbancia obtenida era inferior a la esperada por el análisis por Western blot. Por este motivo, decidieron calentar previamente las muestras agregándoles un buffer con SDS para que de esta forma los multímeros se desnaturalizaran. Al someter las muestras a este proceso, encontraron concordancia entre los niveles dosados por ELISA y los niveles estimados por Western Blot. Utilizando este método, los autores encontraron menores niveles en sujetos obesos que en individuos delgados (3,7±3,2 vs. 8,9±5,7 µg/mL, respectivamente). En ambos grupos, también observaron menores niveles de adiponectina en hombres que en mujeres (17).
Paralelamente, otros autores desarrollaron radioinmunoensayos (RIAs) in house. En su mayoría, éstos utilizaban anticuerpos policlonales que reconocían casi todas las especies de adiponectina. Los autores refieren coeficientes de variación intra y interensayo aceptables (27).
Como era de esperar, los laboratorios rápidamente lanzaron al mercado equipos comerciales para el dosaje de adiponectina, tanto para muestras humanas como para roedores. Uno de los primeros consistió en un RIA (28). Este utiliza un anticuerpo policlonal generado en conejo que detecta todas las especies de adiponectina, salvo el monómero de 30 kDa. Los estándares están compuestos por adiponectina recombinante y el trazador, por adiponectina recombinante marcada con 125I (28).
Posteriormente, la misma empresa lanzó un ELISA que utiliza como anticuerpo de captura un monoclonal que detecta adiponectina nativa, como segundo anticuerpo otro monoclonal marcado con biotina, como estándares adiponectina recombinante humana y como señal utiliza peroxidasa marcada con estreptoavidina. Aún teniendo en cuenta las diferentes especificidades de los anticuerpos utilizados en el RIA y en el ELISA, los fabricantes informan la existencia de muy buena correlación entre ambos métodos (28).
Por lo tanto, los métodos comerciales disponibles para la medición de adiponectina total incluyen RIAs y ELISAs. Los primeros miden por lo general las formas multiméricas de la adiponectina y los ELISAs reconocen la forma monomérica luego de un paso de desnaturalización. Algunos autores refieren que los niveles circulantes de adiponectina medidos con ambos métodos, a pesar de que se esperaría lo contrario, son similares (13)(29).
Recientemente, Ebinuma et al. (30) publicaron un novedoso método de ELISA para determinar los niveles de adiponectina total y cada uno de los diferentes multímeros (LMW, MMW y HMW). Este se basa en la digestión selectiva de los diferentes multímeros utilizando dos proteasas, una de ellas digiere los trímeros y la otra los trímeros y los hexámeros. Por cada muestra, se realizan 3 determinaciones. En la primera, la muestra es tratada con un buffer que contiene SDS con el fin de desnaturalizar los multímeros y obtener principalmente monómeros y dímeros. Esta determinación representa la adiponectina total. Una segunda alícuota es tratada con la proteasa que digiere LMW y MMW, por lo tanto, determina la concentración del multímero de alto peso molecular (HMW). La tercera alícuota se somete al tratamiento con la segunda proteasa que degrada los trímeros, por lo tanto, determina los niveles de MMW y HMW. Luego se obtienen las diferentes fracciones por cálculo. Este método ya ha sido comercializado (31).
Debido a la naturaleza heterogénea de la adiponectina, se debe ser cauteloso al escoger un método para su dosaje y al comparar resultados provenientes de diferente metodología. Se necesita conocer las especificidades de los anticuerpos, la naturaleza de los estándares y, si es un método competitivo, se debe investigar la naturaleza del trazador. Hay que tener en cuenta que si estos dos últimos componentes son recombinantes es importante investigar en qué células se expresó, porque si fue en bacterias carecen de las glicosilaciones características de los mamíferos.
VI) EFECTOS BIOLÓGICOS Y MECANISMO DE ACCIÓN DE LA ADIPONECTINA
1) Receptores de adiponectina
En el año 2003, casi 10 años después de su descubrimiento, Yamauchi et al. (32) lograron clonar un posible candidato a partir de una librería de ADN copia (ADNc) de músculo esquelético. Se analizó el ADNc aislado y se vio que codificaba para una proteína que unía in vitro al fragmento globular de la adiponectina. A esta proteína se la denominó AdipoR1 y se observó que su estructura se conservaba filogenéticamente desde las levaduras al hombre (32).
Como se sospechaba la presencia de otro subtipo del receptor, se buscó algún gen homólogo en bases de datos genéticos. Se encontró un gen con 67% de homología al de AdipoR1 y se lo denominó AdipoR2 (32).
En estudios realizados en tejidos de ratón, se observó que AdipoR1 tenía una expresión ubicua, siendo ésta más abundante en músculo esquelético, y que el AdipoR2 se expresa principalmente en hígado (32).
AdipoR1 y 2 son proteínas integrales de membrana. Poseen 7 dominios transmembrana, pero tienen una característica que las distingue de la familia de receptores acoplados a proteína G, ya que la porción amino terminal es interna y la carboxilo terminal es externa (14).
Ambos subtipos del receptor pueden formar homo y heteromultímeros. El análisis de curvas de Scatchard reveló que AdipoR1 presenta mayor afinidad por el fragmento globular de la adiponectina y AdipoR2 por la molécula intacta (14).
Luego de un ayuno prolongado, se observó un aumento de los niveles de ARNm de ambos subtipos de receptores tanto en músculo esquelético como en el hígado. Luego de la ingestión de alimentos, los niveles de ARNm vuelven a su estado basal (14). Evidencias experimentales sugieren un rol negativo de la insulina en la regulación de la expresión de los receptores (33).
Nilsson et al. (25) observaron que en células en cultivo, la prolactina producía un aumento en la expresión del ARNm del receptor de adiponectina AdipoR1 y la somatotrofina una disminución en los niveles del ARNm de AdipoR2.
2) Mecanismos insulino-sensibilizadores de la adiponectina
a) Evidencias
Desde el descubrimiento de la adiponectina, numerosos grupos han reportado la existencia de una fuerte correlación negativa entre el nivel circulante de adiponectina y la resistencia a la acción de la insulina, tanto en humanos como en animales y en estudios in vivo como in vitro (3)(10)(13)(20)(34-37).
Se observan niveles reducidos de adiponectina en una gran variedad de estados patológicos asociados a resistencia a la insulina, tal como obesidad (17), diabetes tipo 2 (38), enfermedad cardiovascular (38)(39), hipertensión arterial (40) y síndrome metabólico (41). Sin embargo, aún se desconoce si los niveles bajos de adiponectina son la causa o la consecuencia de estas patologías.
En modelos animales de obesidad y diabetes, se observaron bajos niveles de adiponectina, aún en etapas tempranas del desarrollo de la obesidad (5)(36). Algunos estudios se han llevado a cabo administrando adiponectina completa o su fragmento globular a animales de laboratorio y se ha detectado disminución de la glucemia, aumento de la b-oxidación de ácidos grasos, pérdida de peso, y aumento de la sensibilidad a la insulina (20)(34)(35)(42)(43).
Los ratones knock out o transgénicos para el gen de la adiponectina también han proporcionado una herramienta útil para el estudio de los mecanismos insulino-sensibilizadores de esta adipocitoquina. El bloqueo del gen de la adiponectina se asoció con resistencia insulínica, intolerancia a la glucosa, dislipemia, hipertensión arterial, bajos niveles de proteína transportadora de ácidos grasos, aumento de TNFa adipocitario (37)(44), mientras que la sobreexpresión del fragmento globular de adiponectina evidenció mejoramiento de la resistencia a la insulina. Por otro lado, investigaciones efectuadas en humanos con diabetes tipo 2 han sido consistentes en identificar a la adiponectina como un predictor del desarrollo de estas patologías (45-49), atribuyéndole a su vez un mayor valor a la medición del HMW (50). Más aún, la concentración plasmática de adiponectina ha sido sugerida como un biomarcador sensible de síndrome metabólico (51-54), aunque es de notar que su determinación presenta mayor complejidad y costo que la evaluación de los componentes del síndrome metabólico (circunferencia de cintura, presión arterial, glucosa, triglicéridos, y colesterol de la lipoproteína de alta densidad, C-HDL). Por su parte, la obesidad ha sido relacionada con disminución de adiponectina tanto en adultos como en niños de diferentes orígenes (17)(53)(55).
Es sabido que el tratamiento con tiazolidindionas (TZDs), agonistas de los Peroxisome Proliferator-Activated Receptor g PPARg), que mejora la sensibilidad a la insulina, la tolerancia a la glucosa en pacientes y modelos animales de diabetes tipo 2, aumenta además el nivel de adiponectina en humanos con resistencia a la insulina y diabetes tipo 2 (56-63). Esto apoya el rol de la adiponectina como hormona insulino-sensibilizante y como uno de los posibles mecanismos de acción de los agonistas del PPARg.
Finalmente, estudios llevados a cabo en pacientes y en modelos animales con lipodistrofia reportaron la existencia de niveles de adiponectina disminuidos (64). Yamauchi et al. (34) administraron dosis fisiológicas de adiponectina a ratones con lipodistrofia y observaron una disminución significativa de la glucemia y de la insulina plasmática. En pacientes VIH positivos con lipodistrofia, se observó que tanto la expresión en el tejido adiposo, como los niveles séricos de adiponectina, estaban disminuidos (65).
b) Mecanismo de acción
b)1. La adiponectina aumenta la transducción de señales del receptor de insulina
Se ha reportado que el aumento en el contenido tisular de triglicéridos interfiere con la activación de fosfoinositol-3-quinasa (PI-3K) por la insulina y la subsecuente translocación de GLUT4 a la membrana y captación de glucosa (34). Es decir, que los niveles tisulares elevados de triglicéridos producen una disminución en la sensibilidad a la insulina al interferir con los mecanismos de transducción de señales del receptor de insulina.
En músculo esquelético, la adiponectina aumenta la expresión de moléculas involucradas en el trasporte de ácidos grasos (CD36), oxidación de ácidos grasos (acilcoA oxidasa) y disipación de energía a partir de ácidos grasos (Uncoupling protein 2, UP-2). Todo esto llevaría a un aumento en el consumo de ácidos grasos y a una disminución en el contenido de triglicéridos (34). Esta disminución en el contenido muscular de triglicéridos producida por la adiponectina podría contribuir a mejorar la transducción de señales del receptor de insulina.
En ratones lipoatróficos tratados con adiponectina, se observó un aumento en la fosforilación del receptor de la insulina y del sustrato del receptor de insulina-1 (IRS-1). Maeda et al. (44) observaron que el ratón knock out para adiponectina alimentado con una dieta rica en grasas e hidratos de carbono desarrollaba resistencia insulínica y mostraba una alteración en la actividad de IRS-1/PI-3K de músculo esquelético.
Por lo tanto, la adiponectina tendría una acción directa y otra indirecta sobre la transducción de señales del receptor de insulina. La misma regularía directamente la fosforilación del receptor y de los segundos mensajeros y, además, al disminuir el contenido tisular de triglicéridos, mejoraría indirectamente la activación del receptor.
b)2. La adiponectina aumenta la oxidación muscular y hepática de ácidos grasos, disminuye la gluconeogénesis y aumenta la captación de glucosa del músculo esquelético
b)2.1 La adiponectina activa PPARa
El PPARa se expresa en células con alta capacidad para oxidar ácidos grasos tales como: hepatocitos, cardiomiocitos, células de la corteza renal, enterocitos y células del músculo esquelético (56). Hasta el momento, se han descubierto 3 isoformas, a1, a2 y a3. Los ácidos grasos no saturados son ligandos naturales de alta afinidad, mientras que los ácidos grasos saturados presentan menor afinidad por este receptor nuclear. Los fibratos, drogas usadas para tratar las hipertrigliceridemias, son ligandos sintéticos de estos receptores (56).
A nivel hepático, la activación del PPARa induce la expresión de proteínas involucradas en el transporte de ácidos grasos y de enzimas que participan en la b-oxidación de estos sustratos (56). En el intestino delgado, aumenta la expresión de la proteína transportadora de ácidos grasos (56). A nivel del músculo esquelético, aumenta la expresión de la enzima piruvato deshidrogenasa quinasa-4 (PDK-4), la cual, al inactivar a la piruvatoquinasa, produce una disminución en la utilización de glucosa como fuente de energía (56).
Yamauchi et al. (34) administraron adiponectina a ratones lipoatróficos, ratones obesos y a modelos de diabetes tipo 2, y observaron un aumento en la expresión de genes target del PPARa tal como la proteína de transporte de ácidos grasos CD36, la enzima involucrada en la b oxidación acilcoenzima A oxidasa y UP-2. Por lo tanto, estos autores hipotetizaron que la adiponectina podría activar al PPARa. Ellos demostraron que la administración de adiponectina a cultivos celulares producía un aumento de la expresión de PPARa (34). No se ha demostrado si la adiponectina actúa directamente sobre PPARa o sobre otras proteínas que actuarían sobre el PPARa. Algunos autores postulan que la adiponectina activaría al PPARa vía la activación de la AMPK (10).
Estos datos sugieren que la adiponectina aumentaría la oxidación de ácidos grasos y el gasto de energía vía activación del PPARa. Esto llevaría a una disminución en el contenido muscular y hepático de triglicéridos y, por lo tanto, a un incremento en la sensibilidad a la insulina.
b)2.2 La adiponectina activa la vía de la protein quinasa activada por AMP (AMPK/ AMP-Activated Protein Kinasa)
La vía de la AMPK es un sistema involucrado en la regulación del balance energético. La AMPK se activa cuando existe depleción en los niveles de ATP (66). Su activación produce la inhibición de las vías metabólicas que consumen energía y la activación de las que generan ATP. La AMPK es un heterotrímero compuesto por una subunidad catalítica a y dos subunidades regulatorias (b y g). La AMPK es activada alostéricamente por AMP y por fosforilación principalmente de la treonina 172.
Yamauchi et al. (67) reportaron que la administración de adiponectina intacta y del fragmento globular producía, tanto in vivo e in vitro, una activación de la AMPK a nivel muscular y sólo la administración de adiponectina intacta activaba esta vía en hepatocitos (Fig. 3). Al bloquear la actividad de la AMPK no se observa el aumento en la utilización de la glucosa y en la oxidación de ácidos grasos secundario a la administración de adiponectina (67).
La adiponectina actuaría activando a la AMPK a nivel hepático y muscular. Esta activación produciría un aumento en la captación de glucosa por el músculo, aumento de la oxidación de ácidos grasos y una inhibición de la síntesis de glucosa hepática.
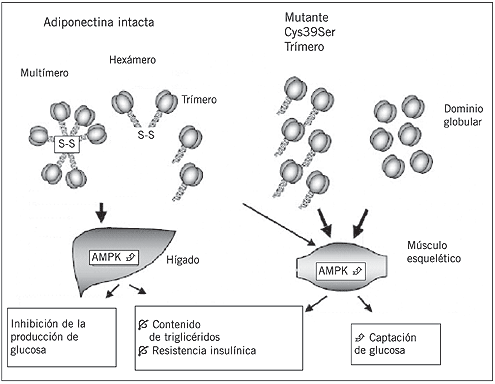
Figura 3. Activación de la AMP quinasa (AMPK) por la adiponectina intacta, el fragmento globular y la mutante C39S. Adaptado de Waki et al. (16).
3) Adiponectina y aterosclerosis
Numerosos autores refieren que la adiponectina tiene acciones antiaterogénicas. Esta adipocitoquina actuaría inhibiendo la formación de la placa ateromatosa en casi todas sus etapas (76).
a) Estudios in vitro
• El tratamiento de células endoteliales con concentraciones fisiológicas de adiponectina inhibe la adhesión de monocitos inducida por TNFa y la expresión endotelial de selectina-E, molécula de adhesión celular vascular-1 (Vascular cell adhesión molecule-1, VCAM-1) y molécula de adhesión intercelular-1 (Intercellular adhesión molecule-1, ICAM-1) (68). Se ha sugerido que el mecanismo a través del cual la adiponectina inhibe la expresión de moléculas de adhesión sería por la inhibición del NF-kB (69).
• Ouchi et al. (70) observaron que la adiponectina inhibía la transformación de macrófagos en células espumosas a través de la inhibición de los receptores scavenger clase A.
• Yokota et al. (71) reportaron un efecto inhibitorio de la adiponectina sobre la proliferación de células de la línea mielomonocítica y en las funciones de macrófagos maduros tal como fagocitosis y síntesis de TNFa.
• Arita et al. (72) observaron que la adiponectina inhibía la migración y proliferación de células del músculo liso inducida por el factor de crecimiento derivado de plaquetas (PDGF-BB).
• Matsuda et al. (73) reportaron que la adiponectina ejercía un efecto inhibitorio sobre la expresión de HB-EGF (Heparin binding epidermal growth factor-like) en células endoteliales tratadas con TNFa y que también inhibía la migración de células de músculo liso activada por bFGF (basic fibroblast growth factor), PDGF, EGF (Epidermal growth factor) y HB-EGF.
• Chen et al. (74) observaron que la adiponectina activaba la síntesis de óxido nítrico en las células endoteliales.
Estos datos experimentales sugieren que la adiponectina tiene efectos directos antiaterogénicos y antiinflamatorios sobre el endotelio. Interviene en todos los pasos de la formación de la placa: modula la respuesta inflamatoria e inhibe la expresión de moléculas de adhesión, la adhesión y la activación de monocitos, la formación de células espumosas y la migración y proliferación de células de músculo liso.
b) Estudios en modelos animales
• Okamoto et al. (75) utilizaron técnicas inmunohistoquímicas y observaron la acumulación de adiponectina en la pared de carótidas de ratas que fueron injuriadas mecánicamente.
• Kubota et al. (37) trabajaron con animales knock out para adiponectina y observaron que la proliferación de la neoíntima en respuesta a una injuria estaba acelerada.
• Matsuda et al. (73) observaron que los ratones knock out para adiponectina presentaban mayor engrosamiento de la neoíntima y mayor proliferación de células de músculo liso al compararlos con controles. La administración de adiponectina, revertía parcialmente el engrosamiento de la neointima.
• Yamauchi et al. (76) cruzaron un ratón transgénico que sobreexpresaba adiponectina globular con un ratón knock out para apolipoproteína E. Este último es un modelo de ateroesclerosis que presenta hipercolesterolemia y desarrollo espontáneo de aterosclerosis severa. Aunque los niveles plasmáticos de colesterol, triglicéridos, glucosa e insulina de la cruza de ambos ratones no difería del knock out para apoliproteína E, los autores encontraron menores lesiones en el arco aórtico y en la aorta. Los autores también reportaron menor expresión de los receptores scavenger clase A en macrófagos y de TNFa en la cruza.
• Okamoto et al. (77) demostraron que la administración de adiponectina a ratones knock out para apoliproteína E reducía significativamente la progresión de las lesiones ateroescleróticas. Mediante inmunohistoquímica observaron que la adiponectina administrada migraba a las células espumosas de las lesiones e inhibía la expresión de VCAM-1, receptor scavenger A (SR-A) y TNF-a por la aorta.
Estos estudios demuestran el rol antiaterogénico de la adiponectina in vivo en modelos animales y sugieren un posible uso terapéutico de la misma.
c) Estudios clínicos
• Jansson et al. (78) reportaron una asociación negativa entre los niveles de adiponectina y la presencia de disfunción endotelial. Los autores postularon a la disminución de adiponectina como un marcador útil para identificar las etapas tempranas de la aterosclerosis.
• Ouchi et al. (68) observaron que los niveles de adiponectina eran significativamente menores en pacientes con enfermedad arterial coronaria al compararlos con controles ajustados por edad e índice de masa corporal.
• Hotta et al. (38) reportaron que los pacientes con diabetes tipo 2 presentaban niveles significativamente menores de adiponectina cuando manifestaban enfermedad arterial coronaria asociada.
• Kumada et al. (39) reportaron que los niveles bajos de adiponectina correlacionaban significativamente y de forma independiente con la presencia de enfermedad arterial coronaria en pacientes masculinos aún luego de ajustar por diferentes factores de riesgo.
• Ouchi et al. (79) observaron que la adiponectina correlacionaba negativamente con los niveles de proteína C reactiva (PCR) en pacientes con enfermedad arterial coronaria.
• Miyazaki et al. (80) estudiaron un grupo de pacientes fumadores con enfermedad arterial coronaria y observaron que el nivel de adiponectina correlacionaba negativamente con el grado de tabaquismo.
• Zoccali et al. (81) trabajaron con un grupo de pacientes con enfermedad renal terminal y observaron que la disminución de los niveles de adiponectina era un predictor independiente de eventos cardiovasculares.
• Adamezak et al. (82) encontraron niveles significativamente más bajos de adiponectina en pacientes con hipertensión esencial al compararlos con sujetos normotensos. En los dos grupos de sujetos, se encontró una correlación negativa entre la adiponectina y las presiones sistólica, diastólica y media.
• Iwashima et al. (83) reportaron que la adiponectina era un marcador independiente de predisposición a hipertensión. Sin embargo, en un estudio llevado a cabo en 180 sujetos asiáticos con obesidad o sobrepeso, no se encontró asociación entre los niveles de adiponectina y la presión arterial (84).
En conjunto, los estudios realizados in vitro e in vivo en modelos animales y en humanos evidencian los múltiples efectos protectores de la adiponectina.
4) Acciones centrales de la adiponectina
La administración periférica de adiponectina produce una disminución en el peso y en los niveles de grasa corporal debido al aumento del gasto de energía y al aumento de la oxidación de ácidos grasos (85). La administración crónica de adiponectina inhibe la ingesta de alimentos en ratas obesas observándose un descenso concomitante del peso corporal, de la glucemia y de los lípidos plasmáticos (85). Se ha reportado la expresión de receptores de adiponectina, ADIPOR1 y R2, en el sistema nervioso central dando evidencias de una posible acción central de la adiponectina (85).
Luego de la inyección intravenosa de adiponectina, aumenta su inmunorreactividad en líquido cefalorraquídeo sugiriendo el transporte de la misma a través de la barrera hematoencefálica. Al contrario de lo que sucede con la leptina, la inyección intraventricular de adiponectina carece de efecto sobre la alimentación (85). La inyección intraventricular de adiponectina intacta, fragmento globular o de una variante incapaz de formar hexámeros produce una disminución de la glucemia y aumento en el gasto energético (85).
Al igual que la leptina, la adiponectina aumenta la síntesis hipotalámica de hormona liberadora de corticotropina (CRH) e induce inmunorreactividad para Fos en el núcleo paraventricular, lo que sugiere la activación de circuitos autonómicos centrales. También, se ha sugerido un rol de los receptores de melanocortina en la acción central de la adiponectina (85).
5) Acciones de la adiponectina sobre el corazón
Como se mencionó anteriormente, muchos de los efectos de la adiponectina estarían mediados por la activación de la AMPK. El rol de la AMPK no se limita sólo a mejorar la sensibilidad a la insulina, sino que su función principal radica en monitorear la disponibilidad de energía del organismo. Se sabe que la obesidad está fuertemente asociada con enfermedad cardíaca. Aunque la base molecular de esta relación no se conoce, muchos reportes sugieren la existencia de una asociación entre los niveles de adiponectina y la presencia de enfermedad cardíaca (86). Pischon et al. (87) reportaron que la presencia de altos niveles de adiponectina estaba asociada con un bajo riesgo de padecer infarto agudo de miocardio. Estos autores también observaron que los niveles de adiponectina descendían rápidamente luego de un infarto. Russell et al. (88) reportaron que la supresión de la actividad de AMPK en el corazón producía un aumento de la injuria cuando se reducía el flujo sanguíneo cardíaco, sugiriendo un rol cardioprotector de la AMPK.
Shibata et al. (89) investigaron el rol de la adiponectina en la injuria cardíaca por isquemia y posterior reperfusión. Los autores observaron que los ratones knock out para adiponectina presentaban un mayor daño tisular luego de la reperfusión, mientras que los ratones transgénicos que sobreexpresaban adiponectina sufrían mínima injuria. Si a los ratones knock out se les administraba adiponectina antes de producir la hipoxia, el daño posterior era menor. En estudios realizados sobre células cardíacas en cultivo, se observó que la adiponectina bloqueaba la apoptosis inducida por la hipoxia, efecto no observado cuando se bloqueaba la activación de AMPK (89).
Shibata et al. (89) postularon que los mecanismos cardipoprotectores de la adiponectina estarían mediados no sólo por la activación de la AMPK, sino que también estaría involucrada la activación de la ciclooxigenasa-2 (COX-2) (89). La COX-2 se induce en el corazón isquémico produciendo prostaglandina E2 (PG-E2) y otros compuestos que presentan actividad cardioprotectora. Shibata et al. (89) observaron un aumento en la expresión de COX-2 y en la síntesis de PG-E2 secundarios a la administración de adiponectina en cardiomiocitos en cultivo. Los autores también observaron que la adiponectina suprimía in vitro la síntesis de TNF-a, efecto que estaría mediado por la PG-E2.
Estos resultados indican que la adiponectina, a través de la activación de la vía de la AMPK y COX-2, tendría un efecto cardioprotector en condiciones de flujo sanguíneo reducido. Se sabe que las prostaglandinas protegen otros tejidos además del cardíaco, por lo tanto, se podría predecir un rol protector en condiciones de isquemia de la adiponectina a nivel de muchos órganos de la economía (86). Xiao et al. (90) observaron que la adiponectina tenía un papel de protección aún si se administraba luego del período isquémico. Por lo tanto, la adiponectina surge como un candidato en la terapia del infarto agudo de miocardio. Kadowaki et al. (14) reportaron la expresión de los receptores de adiponectina, AdipoR1 y AdipoR2, a nivel del corazón. Se desconoce qué isoforma de receptor participa en el rol cardioprotector y qué forma molecular de la adiponectina estaría involucrada en esta acción.
6) Adiponectina e hígado
La fibrosis hepática se caracteriza por inflamación, activación de células que producen colágeno, depósito de tejido conectivo, remodelación de la estructura básica del hígado y regeneración de células epiteliales. Es una consecuencia de la injuria crónica o repetitiva del hígado causada por agentes hepatotóxicos. El hígado graso de etiología no alcohólica también puede producir fibrosis hepática (91). En el parénquima hepático se pueden encontrar células estrelladas, que tienen la capacidad de sintetizar colágeno en respuesta a diferentes estímulos. La activación de las células estrelladas hepáticas inicia y perpetúa la fibrosis hepática (92). Se conocen muchas sustancias que activan a estas células, entre las cuales se pueden nombrar a la insulina y a la leptina. Entre las sustancias que tienen una acción contraria, se destacan los agonistas PPARg y la adiponectina (91). En ratones knock out para adiponectina, se observó mayor desarrollo de fibrosis hepática al tratarlos con sustancias hepatotóxicas. El desarrollo de fibrosis se suprimía si a los ratones se les administraba adiponectina (91). Se ha encontrado expresión de AdipoR1 y R2 en células estrelladas y se postula que la adiponectina actuaría induciendo la apoptosis de las células estrelladas activadas (92).
Mendez Sanchez et al. (93) estudiaron pacientes obesos y con sobrepeso y reportaron que los niveles elevados de adiponectina estaban asociados con un menor riesgo de desarrollar hígado graso.
Sargin et al. (94) estudiaron un grupo de pacientes no diabéticos con esteatosis hepática de etiología no alcohólica y encontraron que los bajos niveles de adiponectina eran predictores de esteatosis hepática sólo en sujetos de sexo masculino.
La adiponectina, al aumentar la oxidación hepática de ácidos grasos, tiene un efecto protector contra el desarrollo de hígado graso. Esta hormona también actuaría sobre las células estrelladas inhibiendo la progresión a fibrosis hepática. Estos datos evidencian el rol hepatoprotector de la adiponectina y un futuro uso terapéutico de esta proteína para prevenir el desarrollo de fibrosis hepática.
7) Adiponectina y hueso
Oshima et al. (95) investigaron el rol de la adiponectina en el metabolismo óseo. Los autores trataron ratones con adenovirus que expresan adiponectina y analizaron la composición ósea por tomografía tridimensional. Los ratones tratados con el adenovirus mostraron mayor masa ósea trabecular, menor número de osteoclastos y menores niveles séricos del marcador de resorción N-telopéptido. Estudios in vitro mostraron que la adiponectina inhibía la diferenciación de macrófagos y monocitos a osteoclastos inducida por factores de crecimiento específicos (M-CSF y RANKL). También, se observó que la administración de adiponectina in vitro suprimía la actividad resortiva de los osteoclastos. Los autores reportaron que la administración de adiponectina a cultivos de osteoblastos aumentaba el nivel de ARNm de fosfatasa alcalina y la capacidad de formación ósea de estas células (95).
Estos resultados indican que la adiponectina inhibiría la generación y actividad de los osteoclastos y aumentaría la actividad de los osteoblastos, lo cual llevaría a un aumento de la masa ósea. También, se plantea un posible uso terapéutico de esta adipocitoquina en osteoporosis.
8) Adiponectina y cáncer
La obesidad no sólo está relacionada con el desarrollo de diabetes y alteraciones cardiovasculares, sino que en algunos casos se la ha relacionado también con el desarrollo de cáncer (96). Como en cualquier tejido, el crecimiento del tejido adiposo debe estar acompañado de angiogénesis. Debe existir un equilibrio entre los factores angiogénicos y los antiangiogénicos (97). Se sabe que el tejido adiposo produce muchos factores de crecimiento y hormonas con actividad angiogénica como TNFa, leptina y VEGF (Vascular endothelial growth factor). Por lo tanto, los adipocitos podrían intervenir en la regulación de la angiogénesis local y de otros tejidos (97). En la obesidad, donde la balanza se inclina hacia la angiogénesis, los niveles de adiponectina descienden (17)(97). Este descenso permite plantear la hipótesis acerca de una posible acción antiangiogénica de la adiponectina. Brakenhielm et al. (97) trabajaron sobre esta hipótesis. Estos autores observaron que la adiponectina inhibía la migración y proliferación de células endoteliales in vitro, y que prevenía la formación de nuevos vasos sanguíneos. Los autores demostraron que estas acciones estaban mediadas por la activación de apoptosis en las células endoteliales, vía la activación de las caspasas 3, 8 y 9. En un modelo animal con alta predisposición al desarrollo de tumores, el tratamiento con adiponectina producía inhibición del desarrollo de tumores primarios (97).
La adiponectina, mediante la inducción de apoptosis de las células endoteliales, tendría un efecto antiangiogénico y, por lo tanto, inhibiría el crecimiento tumoral.
Estudios que evalúan los niveles de adiponectina en diferentes tipos de cáncer apoyan esta teoría. Existen numerosos trabajos que asocian bajos niveles de adiponectina con mayor riesgo de padecer cáncer de endometrio (98)(99), cáncer de mama (100)(101), cáncer de estómago (102), cáncer de próstata (103) y cáncer de colon (104).
El uso terapéutico de la adiponectina en pacientes con cáncer podría esperarse en un futuro.
VII) ESTUDIOS DEL GEN DE ADIPONECTINA
De la misma manera que los estudios in vivo e in vitro, los datos de estudios genéticos apoyan la asociación entre disminución de adiponectina y mayor predisposición a padecer resistencia a la insulina o diabetes tipo 2. Mori et al. (105) realizaron un mapeo completo del genoma de pacientes japoneses con diabetes tipo 2. Este estudio reveló 9 regiones cromosómicas ligadas a diabetes en esta población. Tres de estas regiones (3q, 15q y 20q) también fueron reportadas en estudios similares realizados en Francia y en Estados Unidos (106,107). La región 3q27 es la que contiene al gen de la adiponectina, por lo tanto, modificaciones en el gen de la adiponectina podrían estar ligadas a la susceptibilidad de padecer diabetes tipo 2.
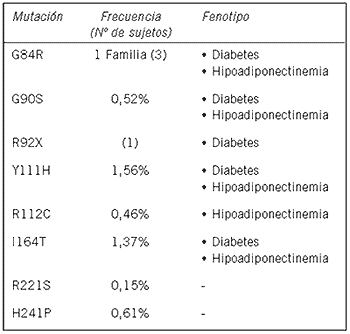
Hara et al. (108) detectaron 10 polimorfismos relativamente frecuentes en el gen de la adiponectina en dos grupos étnicos diferentes, franceses y japoneses. De los 10, sólo 2 polimorfismos de un solo nucleótido (SNPs) en las posiciones 45 y 276 presentaban diferencias estadísticamente significativas entre pacientes con diabetes tipo 2 y controles sanos. Los sujetos con el genotipo G/G en la posición 276 presentaban un mayor riesgo de padecer diabetes tipo 2 al compararlos con los del genotipo T/T (Odds Ratio, OR: 2,16). Los sujetos con el genotipo G/T o G/G en la posición 45 también presentaron mayor riesgo de padecer diabetes tipo 2 al compararlos con los sujetos T/T (OR: 1,41 y 1,70 respectivamente). Luego de ajustar por edad, sexo e índice de masa corporal se encontró asociación significativa entre el SNP276 y el índice de resistencia insulínica calculado mediante la utilización del Homeostasis Model Assessment (HOMA). También se hallaron diferencias individuales entre el HOMA de los 3 genotipos posibles del SNP276 (G/G, G/T y T/T) (108). Más aún, los autores observaron que los sujetos que presentaban el alelo G en la posición 276 tenían menores niveles plasmáticos de adiponectina (108).
Los SNPs del gen de la adiponectina están asociados con resistencia insulínica y con la susceptibilidad a padecer diabetes tipo 2. Los mecanismos pueden estar relacionados con alteraciones en la expresión y la subsecuente disminución en los niveles plasmáticos de adiponectina (108)(109).
Hasta el momento se han reportado 8 mutaciones con pérdida de sentido (misssense) en el gen de adiponectina (16), algunas de ellas están asociadas con la presencia de diabetes e hipoadiponectinemia (Tabla III). Para esclarecerr los mecanismos por los cuales estas mutaciones pueden causar esos fenotipos, Waki et al. (16) estudiaron la formación de multímeros por las mutaciones mediante SDS-PAGE en condiciones no reductoras y no desnaturalizantes. Estos autores observaron una asociación entre las mutaciones que exhibían alteraciones en la multimerización con hipoadiponectinemia y diabetes tipo 2, mientras que las mutaciones que no mostraban alteraciones en la multimerización no presentaban estos fenotipos.
Recientemente, se han publicado trabajos que investigan los genes de los receptores de adiponectina en búsqueda de un posible rol o contribución al riego de padecer diabetes tipo 2. Stefan et al. (110) analizaron 502 sujetos no diabéticos y encontraron dos SNPs en el gen AdipoR1 que estaban asociados con resistencia insulínica y con la presencia de hígado graso. Damcott et al. (111) estudiaron una población Amish y detectaron 5 SNPs para AdipoR1 y 16 para AdipoR2. Sólo 3 SNPs en el gen AdipoR1 presentaban una asociación significativa con diabetes tipo 2. Al analizar los SNPs del AdipoR2, sólo 5 presentaban asociación con diabetes tipo 2 y con intolerancia a la glucosa. Vaxillaire et al. (112) estudiaron 1498 sujetos caucásicos. Los autores investigaron 5 SNPs del gen de AdipoR1 y 12 SNPs del AdipoR2. Sólo un SNP, localizado en el intrón 6 del gen Adipo2, mostró asociación con diabetes tipo 2. Hara et al. (113) realizaron un estudio similar en una población japonesa y ninguno de los SNPs analizados estaba asociado con diabetes tipo 2 ni con resistencia insulínica.
Tabla III. Mutaciones reportadas del gen de la adiponectina.
VIII) PERSPECTIVAS Y CONCLUSIONES
El descubrimiento de la adiponectina remarca aún más el rol del tejido adiposo como órgano endocrino. Su descubrimiento aportó datos sobre la fisiología y funciones del tejido adiposo, especialmente su rol como regulador del metabolismo de hidratos de carbono y lípidos.
En cuanto a la aplicación clínica de la adiponectina, se pueden vislumbrar dos caminos posibles: como marcador biológico de diferentes patologías asociadas a la resistencia insulínica y el uso terapéutico de esta adipocitoquina. Su uso como marcador biológico de diabetes tipo 2, obesidad y síndrome metabólico se ha desarrollado a lo largo de esta revisión.
El uso terapéutico de la adiponectina parece ser muy prometedor, especialmente en el tratamiento de diabetes tipo 2, síndrome metabólico y enfermedad cardiovascular. Hasta ahora la experiencia en animales fue muy satisfactoria (20)(34)(35)(42)(43)(80). Esta se basa en la administración intravenosa de adiponectina o algún vector que la exprese (95)(114). No existe hasta ahora ningún trabajo publicado donde se administre adiponectina a seres humanos. Debido a la naturaleza proteica de esta hormona no se la puede utilizar por vía oral. Hay que tener en cuenta la elección de la especie (fragmento globular, molécula intacta, trímero, etc) y el origen de la adiponectina (recombinante en células eucariotas o procariotas, purificación, etc) que se va a utilizar ya que poseen diferente actividad biológica.
Aunque la administración de adiponectina a humanos todavía no ha sido estudiada, existen otras estrategias para incrementar los niveles plasmáticos de adiponectina. Entre éstas estaría la administración de agonistas de los receptores PPARg. Estos últimos producen un incremento en los niveles de adiponectina en ratones (34), humanos (58)(61-63) y en adipocitos en cultivo (34).
La osmotina es una proteína de defensa que se encuentra en plantas que in vitro produce apoptosis de levaduras. Narasimhan et al. (115) analizaron clones de levaduras sensibles a la acción de la osmotina y encontraron que el receptor de la osmotina es el homólogo en las levaduras de los receptores de adiponectina. La osmotina se expresa en muchas plantas, entre ellas en frutales y vegetales. Es una proteína muy estable y permanece activa aún luego de estar en contacto con la mucosa gástrica y respiratoria (115). Evidentemente, se requieren más estudios in vitro e in vivo para llegar a una conclusión, pero esta molécula, que actuaría activando los receptores de adiponectina, sería un buen candidato para ser usado con finalidades terapeúticas.
Hasta ahora, todo lo expuesto sobre esta adipocitoquina parece muy prometedor, especialmente sus funciones insulino-sensibilizadora, antiaterogénica, cardioprotectora, hepatoprotectora y antiangiogénica.
Correspondencia
DR. FERNANDO BRITES
Departamento de Bioquímica Clínica
Facultad de Farmacia y Bioquímica, UBA
Junín 956. (1113) Ciudad Autónoma de Buenos AIRES
Tel: 4964-8297. Fax: 4508-3645
E-mail: fdbrites@hotmail.com
Referencias bibliográficas
1. Moreno MJ, Martínez JA. Adipose tissue: a storage and secretory organ. An Sist Sanit Navar 2002; 25 Suppl 1: 29-39. [ Links ]
2. Kershaw EE, Flier JS. Adipose tissue as an endocrine organ. J Clin Endocrinol Metab 2004; 89: 2548-56. [ Links ]
3. Maeda K, Okubo K, Shimomura I, Funahashi T, Matsuzawa Y, Matsubara K. cDNA cloning and expression of a novel adipose specific collagen-like factor,apM1 (AdiPose Most abundant Gene transcript 1). Biochem Biophys Res Commun 1996; 221: 286-9. [ Links ]
4. Scherer PE, Williams S, Fogliano M, Baldini G, Lodish HF. A novel serum protein similar to C1q, produced exclusively in adipocytes. J Biol Chem 1995; 270: 26746-9. [ Links ]
5. Hu E, Liang P, Spiegelman BM. AdipoQ is a novel adipose-specific gene dysregulated in obesity. J Biol Chem 1996; 271: 10697-703. [ Links ]
6. Nakano Y, Tobe T, Choi-Miura NH, Mazda T, Tomita M. Isolation and characterization of GBP28, a novel gelatin-binding protein purified from human plasma. J Biochem 1996; 120: 803-12. [ Links ]
7. Takahashi M, Arita Y, Yamagata K, Matsukawa Y, Okutomi K, Horie M, et al. Genomic structure and mutations in adipose-specific gene, adiponectin. Int J Obes Relat Metab Disord 2000; 24: 861-8. [ Links ]
8. Stefan N, Stumvoll M. Adiponectin: Its role in metabolism and beyond. Horm Metab Res 2002; 43: 469-74. [ Links ]
9. Kishore U, Reid KB. C1q: structure, function, and receptors. Immunopharmacology 2000; 49: 15-170. [ Links ]
10. Gil-Campos M, Cañete R, Gil A. Adiponectin, the missing link in insulin resistance and obesity. Clin Nutr 2004; 23: 963-74. [ Links ]
11. Wang Y, Xu A, Knight C, Xu LY, Cooper GL. Hydroxylation and glycosylation of the four conserved lysine residues in the collagenous domain of adiponectin: potential role in the modulation of its insulin-sensitizing activity. J Biol Chem 2002; 277: 19521-9. [ Links ]
12. Sato C, Yasukawa Z, Honda N, Matsuda T, Kitajima K. Identification and adipocyte differentiation-dependent expression of the unique disialic acid residue in an adipose tissue-specific glycoprotein, adipo Q. J Biol Chem 2001; 276: 28849-56. [ Links ]
13. Chandran M, Phillips SA, Ciaraldi T, Henry RR. Adiponectin: more than just another fat cell hormone? Diabetes Care 2003; 26: 2442-50. [ Links ]
14. Kadowaki T, Yamauchi T. Adiponectin and adiponectin receptors. Endocrine Reviews 2005; 26: 439-51. [ Links ]
15. Tsao TS, Murrey HE, Hug C, Lee DH, Lodish HF. Oligomerization state-dependent activation of NF-kappa B signaling pathway byadipocyte complement-related protein of 30 kDa (Acrp30). J Biol Chem 2002; 277: 29359-62. [ Links ]
16. Waki H, Yamauchi T, Kamon J, Ito Y, Uchida S, Kita S, et al. Impaired multimerization of human adiponectin mutants associated with diabetes. Molecular structure and multimer formation of adiponectin. J Biol Chem 2003; 278: 40352-63. [ Links ]
17. Arita Y, Kihara S, Ouchi N, Takahashi M, Maeda K, Miyagawa J, et al. Paradoxical decrease of an adipose-specific protein, adiponectin, in obesity. Biochem Biophys Res Commun 1999; 257: 79-83. [ Links ]
18. Pajvani UB, Du X, Combs TP, Berg AH, Rajala MW, Schulthess T, et al. Structure-function studies of the adipocyte-secreted hormone Acrp30/adiponectin.Implications for metabolic regulation and bioactivity. J Biol Chem 2003; 278: 9073-85. [ Links ]
19. Berg AH, Combs TP, Scherer PE. ACRP30/adiponectin: an adipokine regulating glucose and lipid metabolism. Trends Endocrinol Metab 2002; 13: 84-9. [ Links ]
20. Berg AH, Combs TP, Du X, Brownlee M, Scherer PE. The adipocyte-secreted protein Acrp30 enhances hepatic insulin action. Nat Med 2001; 7: 947-53. [ Links ]
21. Gavrila A, Peng CK, Chan JL, Mietus JE, Goldberger AL, Mantzoros CS. Diurnal and ultradian dynamics of serum adiponectin in healthy men: comparison with leptin, circulating soluble leptin receptor, and cortisol patterns. J Clin Endocrinol Metab 2003; 88: 2838-43. [ Links ]
22. Motoshima H, Wu X, Sinha MK Hardy VE, Rosato EL, Barbot DJ, et al. Differential regulation of adiponectin secretion from cultured human omental and subcutaneous adipocytes: effects of insulin and rosiglitazone. J Clin Endocrinol Metab 2002; 87: 5662-7. [ Links ]
23. Diez JJ, Iglesias P. The role of the novel adipocyte-derived adiponectin in human disease. Eur J Endocrinol 2003; 148: 293-300. [ Links ]
24. Delporte ML, Funahashi T, Takahashi M, Matsuzawa Y, Brichard SM. Pre- and post-translational negative effect of beta-adrenoceptor agonists on adiponectin secretion: in vitro and in vivo studies. Biochem J 2002; 367: 677-85. [ Links ]
25. Nilsson L, Binart N, Bohlooly YM, Bramnert M, Egecioglu E, Kindblom J, et al. Prolactin and growth hormone regulate adiponectin secretion and receptor expression in adipose tissue. Biochem Biophys Res Commun 2005; 331: 1120-6. [ Links ]
26. Nishizawa H, Shimomura I, Kishida K, Maeda N, Kuriyama H, Nageratani H, et al. Androgens decrease plasma adiponectin, an insulin-sensitizing adipocyte-derived protein. Diabetes 2002; 51: 2734-41. [ Links ]
27. Xu A, Wang Y, Keshaw H, Yi Xu L, Lam K, Cooper GJS. The fat-derived hormone adiponectin alleviates alcoholic and nonalcoholic fatty liver diseases in mice. J Clin Invest 2003; 112: 91-100. [ Links ]
28. Millipore. Human Adiponectin RIA. Specifications. 2007. Available in: http://www.millipore.com/catalogue/item/hadp-61hk (accessed June, 2007). [ Links ]
29. Suominen P. Evaluation of an enzyme immunometric assay to measure serum adiponectin concentrations. Clin Chem 2004; 50: 219-21. [ Links ]
30. Ebinuma H, Miyazaki O, Yago H, Hara K, Yamauchi T, Kadowaki T. A novel ELISA system for selective measurement of human adiponectin multimers by using proteases. Clin Chim Acta 2006; 372: 47-53. [ Links ]
31. ALPCO Diagnostics TM. Adiponectin (Multimeric. EIA. 2007. Available in: http://www.alpco.com/pdfs/47/47-ADPH-9755.pdf (accessed June 10, 2007). [ Links ]
32. Yamauchi T, Kamon J, Ito Y, Tsuchida A, Yokomizo T, Kita S, et al. Cloning of adiponectin receptors that mediate antidiabetic metabolic effects. Nature 2003; 423: 762-9. [ Links ]
33. Tsuchida A, Yamauchi T, Ito Y, Hada Y, Maki T, Takekawa S, et al. Insulin/Foxo1 pathway regulates expression levels of adiponectin receptors and adiponectin sensitivity. J Biol Chem 2004; 279: 30817-22. [ Links ]
34. Yamauchi T, Kamon J, Waki H, Terauchi Y, Kubota N, Hara K, et al. The fat-derived hormone adiponectin reverses insulin resistance associated with both lipoatrophy and obesity. Nat Med 2001; 7: 941-6. [ Links ]
35. Combs TP, Berg AH, Obici S, Scherer PE, Rossetti L. Endogenous glucose production is inhibited by adipose-derived protein Acrp30. J Clin Invest 2001; 108: 1875-81. [ Links ]
36. Hotta K, Funashashi T, Bodkin NL, Ortmeyer HK, Arita Y, Hansen BC, et al. Circulating concentrations of the adipocyte protein adiponectin are decreased in parallel with reduced insulin sensitivity during the progression to type 2 diabetes in rhesus monkeys. Diabetes 2001; 50: 1126-31. [ Links ]
37. Kubota N, Terauchi Y, Yamauchi T, Kubota T, Moroi M, Matsui J, et al. Disruption of adiponectin causes insulin resistance and neointimal formation. J Biol Chem 2002; 277: 25863-6. [ Links ]
38. Hotta K, Funahashi T, Arita Y, Takahashi M, Matsuda M, Okamoto Y, et al. Plasma concentrations of a novel, adipose-specific protein, adiponectin, in type 2 diabetic patients. Arterioscler Thromb Vasc Biol 2000; 20: 1595-9. [ Links ]
39. Kumada M, Kihara S, Sumitsuji S, Kawamoto T, Matsumoto S, Ouchi N, et al. Association of hypoadiponectinemia with coronary artery disease in men. Arterioscler Thromb Vasc Biol 2003; 23: 85-9. [ Links ]
40. Ouchi N, Ohishi M, Kihara S, Funahashi T, Nakamura T, Nagaretani H, et al. Association of hypoadiponectinemia with impaired vasoreactivity. Hypertension 2003; 42: 231-4. [ Links ]
41. Trujillo ME, Scherer PE. Adiponectin: journey from an adipocyte secretory protein to biomarker of the metabolic syndrome. J Intern Med 2005; 257: 167-75. [ Links ]
42. Weyer C, Funahashi T, Tanaka S, Hotta K, Matsuzawa Y, Pratley RE, et al. Hypoadiponectinemia in obesity and type 2 diabetes: close association with insulin resistance and hyperinsulinemia. J Clin Endocrinol Metab 2001; 86: 1930-5. [ Links ]
43. Fruebis J, Tsao TS, Javorschi S, Ebbets-Reed D, Erickson MR, Yen FT, et al. Proteolytic cleavage product of 30-kDa adipocyte complement-related protein increases fatty acid oxidation in muscle and causes weight loss in mice. Proc Natl Acad Sci USA 2001; 98: 2005-10. [ Links ]
44. Maeda N, Shimomura I, Kishida K, Nishizawa H, Matsuda M, Nagaretani H, et al. Diet-induced insulin resistance in mice lacking adiponectin/Acrp30. Nat Med 2002; 8: 731-7. [ Links ]
45. Lindsay RS, Funahashi T, Hanson RL, Matsuzawa Y, Tanaka S, Tataranni PA, et al. Adiponectin and development of type 2 diabetes in the Pima Indian population. Lancet 2002; 26: 2015-20. [ Links ]
46. Singhal A, Jamieson N, Fewtrell M, Deanfield J, Lucas A, Sattar N. Adiponectin predicts insulin resistance but not endothelial functions in young, healthy adolescents. J Clin Endocrinol Metab 2005; 90: 4615-21. [ Links ]
47. Daimon M, Oizumi T, Saitoh T, Kameda W, Hirata A, Yamaguchi H, et al. Decreased serum levels of adiponectin are a risk factor for the progression to type 2 diabetes in the Japanese Population: the Funagata study. Diabetes Care 2003; 26: 2015-20. [ Links ]
48. Yamamoto Y, Hirose H, Saito I, Nishikai K, Saruta T. Adiponectin, an adipocyte-derived protein, predicts future insulin resistance: two-year follow-up study in Japanese population. J. Clin Endocrinol Metab 2004; 89: 87-90. [ Links ]
49. Snehalatha C, Mukesh B, Simon M, Viswanathan V, Haffner SM, Ramachandran A. Plasma adiponectin is an independent predictor of type 2 diabetes in Asian Indians. Diabetes Care 2003; 26: 3226-9. [ Links ]
50. Hara K, Horikoshi M, Yamauchi T, Yago H, Miyazaki O, Ebinuma H, et al. Measurement of the high-molecular weight form of adiponectin in plasma is a useful for the prediction of insulin resistance and metabolic syndrome. Diabetes Care 2006; 29: 1357-62. [ Links ]
51. Shand BI, Scott RS, Elder PA, George PM. Plasma adiponectin in overweight, nondiabetic individuals with or without insulin resistance. Diabetes Obes Metab 2003; 5: 349-53. [ Links ]
52. Ryo M, Nakamura T, Kihara S, Kumada M, Shibazaki S, Takahashi M, et al. Adiponectin as a biomarker of the metabolic syndrome. Circ J 2004; 68: 975-9. [ Links ]
53. Ogawa Y, Kikuchi T, Nagasaki K, Hiura M, Tanaka Y, Uchivama M. Usefulness of serum adiponectin levels as a diagnostic marker of metabolic syndrome in obese Japanese children. Hypertens Res 2005; 28: 51-7. [ Links ]
54. Mojiminiyi OA, Abdella NA, Al Arouj M, Ben Nakhi A. Adponectin, insulin resistance an clinical expression of the metabolic syndrome in patients with type 2 diabetes. Int J Obes 2007; 31: 213-20. [ Links ]
55. Stefan N, Bunt JC, Salbe AD, Funashashi T, Matsuzawa Y, Tataranni PA. Plasma adiponectin concentrations in children: relationships with obesity and insulinemia. J Clin Endocrinol Metab 2002; 87: 4652-6. [ Links ]
56. Ferré P. The biology of peroxisome proliferator-activated receptors: relationship with lipid metabolism and insulin sensitivity. Diabetes 2004; 53: S43-S50. [ Links ]
57. Miyazaki Y, Mahankali A, Wajcberg E, Bajaj M, Mandarino LJ, DeFronzo RA. Effect of pioglitazone on circulating adipocytokine levels and insulin sensitivity in type 2 diabetic patients. J Clin Endocrinol Metab 2004; 89: 4312-9. [ Links ]
58. Maeda N, Takahashi M, Funahashi T, Kihara S, Nishizawa H, Kishio K, et al. PPARg ligands increase expression and plasma concentrations of adiponectin, an adipose-derived protein. Diabetes 2001; 50: 2094-9. [ Links ]
59. Das K, Lin Y, Widen E, Zhang Y, Scherer PE. Chromosomal localization, expression pattern and promoter analysis of the mouse gene encoding adipocyte-specific secretory protein Acrp30. Biochem Biophys Res Commun 2001; 280: 1120-9. [ Links ]
60. Combs TP, Wagner JA, Berger J, Doebber T, Wang WJ, Zhang BB, et al. Induction of adipocyte complement-related protein of 30 kilodaltons by gamma agonists: a potential mechanism of insulin sensitization. Endocrinology 2002; 143: 998-1007. [ Links ]
61. Yu JG, Javorschi S, Hevener AL, Kruszynska YT, Norman RA, Sinha M, et al. The effect of thiazolidinediones on plasma adiponectin levels in normal, obese, and type 2 diabetic subjects. Diabetes 2002; 51: 2968-74. [ Links ]
62. Yang WS, Jeng CY, Wu TJ, Tanaka S, Funahashi T, Matsuzawa Y, et al. Synthetic peroxisome proliferator-activated receptor-gamma agonist, rosiglitazone, increases plasma levels of adiponectin in type 2 diabetic patients. Diabetes Care 2002; 25: 376-80. [ Links ]
63. Hirose H, Kawai T, Yamamoto Y, Taniyama M, Tomita M, Matsubara K, et al. Effects of pioglitazone on metabolic parameters, body fat distribution, and serum adiponectin levels in Japanese male patients with type 2 diabetes. Metabolism 2002; 51: 314-7. [ Links ]
64. Haque WA, Shimomura I, Matsuzawa Y, Garg A. Serum adiponectin and leptin levels in patients with lipodystrophies. J Clin Endocrinol Metab 2002; 87: 2395-8. [ Links ]
65. Sutinen J, Korsheninnikova E, Funahashi T, Matsuzawa Y, Nyman T, Yki-Jarvinen H. Circulating concentration of adiponectin and its expression in subcutaneous adipose tissue in patients with highly active antiretroviral therapy-associated lipodystrophy. J Clin Endocrinol Metab 2003; 88: 1907-10. [ Links ]
66. Carling D. AMP-activated protein kinase: balancing the scales. Biochimie 2005; 87: 87-91. [ Links ]
67. Yamauchi T, Kamon J, Minokoshi Y, Ito Y, Waki H, Uchida S, et al. Adiponectin stimulates glucose utilization and fatty-acid oxidation by activating AMP-activated protein kinase. Nat Med 2002; 8: 1288-95. [ Links ]
68. Ouchi N, Kihara S, Arita Y, Maeda K, Kuriyama H, Okamoto Y, et al. Novel modulator for endothelial adhesion molecules: adipocyte-derived plasma protein adiponectin. Circulation 1999; 100: 2473-6. [ Links ]
69. Ouchi N, Kihara S, Arita Y, Okamoto Y, Maeda K, Kuriyama H, et al. Adiponectin, an adipocyte-derived plasma protein, inhibits endothelial NF-kappaB signaling through a cAMP-dependent pathway. Circulation 2000; 102: 1296-301. [ Links ]
70. Ouchi N, Kihara S, Arita Y, Nishida M, Matsuyama A, Okamoto Y, et al. Adipocyte-derived plasma protein, adiponectin, suppresses lipid accumulation and class A scavenger receptor expression in human monocyte-derived macrophages. Circulation 2001; 103: 1057-63. [ Links ]
71. Yokota T, Oritani K, Takahashi I, Ishikawa J, Matsuyama A, Ouchi N, et al. Adiponectin, a new member of the family of soluble defense collagens, negatively regulates the growth of myelomonocytic progenitors and the functions of macrophages. Blood 2000; 96: 1723-32. [ Links ]
72. Arita Y, Kihara S, Ouchi N, Maeda K, Kuriyama H, Okamoto Y, et al. Adipocyte-derived plasma protein adiponectin acts as a platelet-derived growth factor-BB-binding protein and regulates growth factor-induced common postreceptor signal in vascular smooth muscle cell. Circulation 2002; 105: 2893-8. [ Links ]
73. Matsuda M, Shimomura I, Sata M, Arita Y, Nishida M, Maeda N, et al. Role of adiponectin in preventing vascular stenosis. The missing link of adipo-vascular axis. J Biol Chem 2002; 277: 37487-91. [ Links ]
74. Chen H, Montagnani M, Funashashi T, Shimomura I, Quon MJ. Adiponectin stimulates production of nitric oxide in vascular endothelial cells. J Biol Chem 2003; 278: 45021-6. [ Links ]
75. Okamoto Y, Arita Y, Nishida M, Muraguchi M, Ouchi N, Takahashi M, et al. An adipocyte-derived plasma protein, adiponectin, adheres to injured vascular walls. Horm Metab Res 2000; 32: 47-50. [ Links ]
76. Yamauchi T, Kamon J, Waki H, Imai Y, Shimozawa N, Hioki K, et al. Globular adiponectin protected ob/ob mice from diabetes and apoE-deficient mice from atherosclerosis. J Biol Chem 2003; 278: 2461-8. [ Links ]
77. Okamoto Y, Kihara S, Ouchi N, Nishida M, Arita Y, Kumada M, et al. Adiponectin reduces atherosclerosis in apolipoprotein E-deficient mice. Circulation 2002; 106: 2767-70. [ Links ]
78. Jansson PA, Pellme F, Hammarstedt A, Sandqvist M, Brekke H, Caidahl K, et al. A novel cellular marker of insulin resistance and early atherosclerosis in humans is related to impaired fat cell differentiation and low adiponectin. FASEB J 2003; 17: 1434-40. [ Links ]
79. Ouchi N, Kihara S, Funashashi T, Nakamura T, Nishida M, Kumada M, et al. Reciprocal association of C-reactive protein with adiponectin in blood stream and adipose tissue. Circulation 2003; 107: 671-4. [ Links ]
80. Miyazaki T, Shimada K, Mokuno H, Daida H. Adipocyte-derived plasma protein, adiponectin, is associated with smoking status in patients with coronary artery disease. Heart 2003; 89: 663-4. [ Links ]
81. Zoccali C, Mallamaci F, Tripepi G, Benedetto FA, Cutrupi S, Parlongo S, et al. Adiponectin, metabolic risk factors, and cardiovascular events among patients with end-stage renal disease. J Am Soc Nephrol 2002; 13: 134-41. [ Links ]
82. Adamczak M, Wiecek A, Funahashi T, Chudek J, Kokot F, Matsuzawa Y. Decreased plasma adiponectin concentration in patients with essential hypertension. Am J Hypertens 2003; 16: 72-5. [ Links ]
83. Iwashima Y, Katsuya T, Ishikawa K, Ouchi N, Ohishi M, Sugimoto K, et al. Hypoadiponectinemia is an independent risk factor for hypertension. Hypertension 2004; 43: 1318-23. [ Links ]
84. Matsuzawa Y. Adiponectin: Identification, physiology and clinical relevance in metabolic and vascular disease. Atheroscler Suppl 2005; 6: 7-14. [ Links ]
85. Ahima R. Central actions of adipocyte hormones. Trends Endocrinol Metab 2005; 16: 307-13. [ Links ]
86. Yuhki K, Kawabe J, Ushikubi F. Fat, keeping the heart healthy? Nat Med 2005; 11: 1048-9. [ Links ]
87. Pischon T, Girman CJ, Hotamisligil GS, Rifai N, Hu FB, Rimm EB. Plasma adiponectin levels and risk of myocardial infarction in men. JAMA 2004; 291: 1730-7. [ Links ]
88. Russell RR 3rd, Li J, Coven DL, Pypaert M, Zechner C, Palmeri M, Giordano FJ, et al. AMP-activated protein kinase mediates ischemic glucose uptake and prevents postischemic cardiac dysfunction, apoptosis, and injury. J Clin Invest 2004; 114: 495-503. [ Links ]
89. Shibata R, Sato K, Pimentel DR, Takemura Y, Kihara S, Ohashi K, et al. Adiponectin protects against myocardial ischemia-reperfusion injury through AMPK and COX-2 dependent mechanisms. Nat Med 2005; 11: 1096-103. [ Links ]
90. Xiao CY, Yuhki K, Hara A, Fujino T, Kuriyama S, Yamada T, et al. Prostaglandin E2 protects the heart from ischemia-reperfusion injury via its receptor subtype EP4. Circulation 2004; 109: 2462-8. [ Links ]
91. Marra F, Aleffi S, Bertolani C, Petrai I, Vizzutti F. Adipokines and liver fibrosis. Eur Rev Med Pharmacol Sci 2005; 9: 279-84. [ Links ]
92. Ding X, Saxena NK, Lin S, Xu A, Srinivasan S, Anania FA. The roles of leptin and adiponectin: a novel paradigm in adipocytokine regulation of liver fibrosis and stellate cell biology. Am J Pathol 2005; 166: 1655-69. [ Links ]
93. Mendez-Sanchez N, Chavez-Tapia NC, Villa AR, Sanchez LK, Zamora Valdes D, Ramos MH, et al. Adiponectin as a protective factor in hepatic steatosis. World J Gastroenterol 2005; 11: 1737-41. [ Links ]
94. Sargin H, Sargin M, Gozu H, Orcun A, Baloglu G, Ozisik M, et al. Is Adiponectin level a predictor of nonalcoholic fatty liver disease in nondiabetic male patients? World J Gastroenterol 2005; 11: 5874-7. [ Links ]
95. Oshima K, Nampei A, Matsuda M, Iwaki M, Fukuhara A, Hashimoto J, et al. Adiponectin increases bone mass by suppressing osteoclast and activating osteoblast. Biochem Biophys Res Commun 2005; 331: 520-6. [ Links ]
96. Lawrence VJ, Kopelman PG. Medical consequences of obesity. Clin Dermatol 2004; 22: 296-302. [ Links ]
97. Brakenhielm E, Veitonmaki N, Cao R, Kihara S, Matsuzawa Y, Zhivotovsky B, et al. Adiponectin-induced antiangiogenesis and antitumor activity involve caspase-mediated endothelial cell apoptosis. Proc Natl Acad Sci USA 2004; 101: 2476-81. [ Links ]
98. Petridou E, Mantzoros C, Dessypris N, Koukoulomatis P, Addy C, Voulgaris Z, et al. Plasma adiponectin concentrations in relation to endometrial cancer: a case-control study in Greece. J Clin Endocrinol Metab 2003; 88: 993-7. [ Links ]
99. Dal Maso L, Augustin LS, Karalis A, Talamini R, Franceschi S, Trichopoulos D, et al. Circulating adiponectin and endometrial cancer risk. J Clin Endocrinol Metab 2004; 89: 1160-3. [ Links ]
100. Mantzoros C, Petridou E, Dessypris N, Chavelas C, Dalamaga M, Alexe DM, et al. Adiponectin and breast cancer risk. J Clin Endocrinol Metab 2004; 89: 1102-7. [ Links ]
101. Chen DC, Chung YF, Yeh YT, Chaung HC, Kuo FC, Fu OY, et al. Serum adiponectin and leptin levels in Taiwanese breast cancer patients. Cancer Lett 2006; 237: 109-14. [ Links ]
102. Ishikawa M, Kitayama J, Kazama S, Hiramatsu T, Hatano K, Nagawa H. Plasma adiponectin and gastric cancer. Clin Cancer Res 2005; 11: 466-72. [ Links ]
103. Goktas S, Yilmaz MI, Caglar K, Sonmez A, Kilic S, Bedir S. Prostate cancer and adiponectin. Urology 2005; 65: 1168-72. [ Links ]
104. Ogunwobi OO, Beales IL. Adiponectin stimulates proliferation and cytokine secretion in colonic epithelial cells. Regul Pept 2006; 134: 105-13. [ Links ]
105. Mori Y, Otabe S, Dina C, Yasuda K, Populaire C, Lecoeur C, et al. Genome-wide search for type 2 diabetes in Japanese affected sib-pairs confirms susceptibility genes on 3q, 15q, and 20q and identifies two new candidate Loci on 7p and 11p. Diabetes 2002; 51: 1247-55. [ Links ]
106. Vionnet N, Hani EH, Dupont S, Gallina S, Francke S, Dotte S, et al. Genomewide search for type 2 diabetes-susceptibility genes in French whites: evidence for a novel susceptibility locus for early-onset diabetes on chromosome 3q27-qter and independent replication of a type 2-diabetes locus on chromosome 1q21-q24. Am J Hum Genet 2000; 67: 1470-80. [ Links ]
107. Kisserbah AH, Sonnenberg GE, Myklebust J, Goldstein M, Broman K, James RG, et al. Quantitative trait loci on chromosomes 3 and 17 influence phenotypes of the metabolic syndrome. Proc Natl Acad Sci USA 2000; 97: 14478-83. [ Links ]
108. Hara K, Boutin P, Mori Y, Tobe K, Dina C, Yasuda K, et al. Genetic variation in the gene encoding adiponectin is associated with an increased risk of type 2 diabetes in Japanese population. Diabetes 2002; 51: 536-40. [ Links ]
109. Vasseur F, Helbecque N, Dina C, Lobbens S, Delannoy V, Gaget S, et al. Single-nucleotide polymorphism haplotypes in the both proximal promoter and exon 3 of the Apm1 gene modulate adipocyte-secreted adiponectin hormone levels and contribute to the genetic risk for type 2 diabetes in French Caucasians. Hum Mol Genet 2002; 11: 2607-14. [ Links ]
110. Stefan N, Machicao F, Staiger H, Machann J, Schick F, Tschritter O, et al. Polymorphisms in the gene encoding adiponectin receptor 1 are associated with insulin resistance and high liver fat. Diabetologia 2005; 48: 2282-91. [ Links ]
111. Damcott CM, Ott SH, Pollin TI, Reinhart LJ, Wang J, O Connell JR, et al. Genetic variation in adiponectin receptor 1 and adiponectin receptor 2 is associated with type 2 diabetes in the Old Order Amish. Diabetes 2005; 54: 2245-50. [ Links ]
112. Vaxillaire M, Dechaume A, Vasseur DV, Lahmidi S, Vatin V, Leprete F, et al. Genetic analysis of ADIPOR1 and ADIPOR2 candidate polymorphisms for type 2 diabetes in the Caucasian population. Diabetes 2006; 55: 856-61. [ Links ]
113. Hara K, Horikshi M, Kitazato H, Yamauchi T, Ito C, Noda M, et al. Absence of an association between the polymorphisms in the genes encoding adiponectin receptors and type 2 diabetes. Diabetologia 2005; 48: 1307-14. [ Links ]
114. Park JH, Lee M, Kim SW. Non-viral adiponectin gene therapy into obese type 2 diabetic mice ameliorates insulin resistance. J Control Release 2006; 114: 118-25. [ Links ]
115. Narasimhan ML, Coca MA, Jin J, Yamauchi T, Ito Y, Kadowaki T, et al. Osmotin is a homolog of mammalian adiponectin and controls apoptosis in yeast through a homolog mammalian adiponectin receptor. Mol Cell 2005; 17: 171-80. [ Links ]
Aceptado para su publicación el 24 de octubre de 2007














