Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. v.42 n.2 La Plata abr./jun. 2008
Farmacocinética y penetración en líquido tisular de cefepime administrado en conejos hipertérmicos*
Pharmacokinetics and penetration into tissue fluid of cefepime administered to hyperthermic rabbits
Roberto Rule1, Mariangeles Vita2, Hugo Baschar3, Osvaldo Hugo Farina4
1. Doctor en Ciencias Veterinarias. Investigador de la Comisión de Investigaciones Científicas de la Prov. de Buenos Aires.
2. Médica Veterinaria.
3. Médico Veterinario.
4. Doctor en Ciencias Médicas. Profesor Titular de la Cátedra de Farmacología Aplicada. F.C.M. U.N.L.P.
* Comisión de Investigaciones Científicas de la Provincia de Buenos Aires. Farmacología Aplicada. Facultad de Medicina. Universidad Nacional de La Plata. Argentina.
Resumen
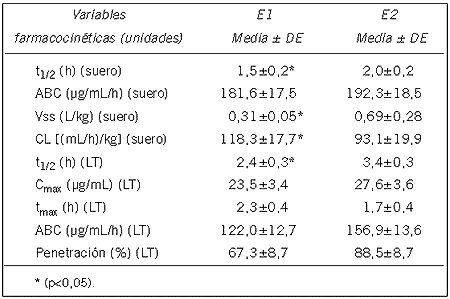
La farmacocinética sérica y tisular de cefepime administrado por vía endovenosa (20 mg/kg de peso) fue determinada en conejos sanos, con hipertermia producida por lipopolisacáridos de E. coli e implantados en tejido subcutáneo con cajas para recolección de líquido tisular. Diez conejos adultos fueron utilizados en dos experiencias (E1 y E2). Las concentraciones de cefepime en suero (S) y líquido tisular (LT) fueron determinadas por método biológico. Para el análisis cinético se utilizó un modelo no compartimental. Los resultados farmacocinéticos (medias ± error estándar) fueron: tiempo medio de eliminación [t1\2 (E1 S)=1,5±0,2 y (E2 S)=2,0±0,2 h] (p<0,05), área bajo la curva [ABC (E1 S)=181,6±17,5 y (E2 S)=192,3±18,5 (µg/mL/h]; Volumen de distribución en estado estacionario [Vss (E1S)=0,31±0,05 y (E2 S)=0,69±0,28 L/kg] (p<0,05); aclaramiento sérico [CL(E1 S)=118,3±17,7 y (E2 S) =93,1±19,9 (mL/h)kg] (p<0,05); Concentración máxima [Cmax (E1 LT)= 23,5±3,4 y (E2 LT)= 27,6±3,6 (µg/mL]; tiempo en el que se logra la Cmax [tmax (E1 LT)=2,3±0,4 y (E2 LT)=1,7±0,4 h)]; t1/2 (E1 LT)= 2,4±0,3 y (E2 LT)=3,4±0,3 h (p<0,05); ABC (E1 LT)=122,0±12,7 y (E2 LT)=156,9±13,6 (µg/mL/h). y penetración [P (E1 LT)=67,3±8,7 y (E2 LT)=88,5±8,7%].
Palabras clave: Cinética; Cefepime; Lipolisacáridos; Líquido tisular; Conejos
Summary
The pharmacokinetic characteristics in serum and tissue of cefepime given intravenously (20 mg/kg body weight) were assessed in healthy rabbits and in rabbits with hyperthermia induced by lipopolysacharide of E. coli, with tissue fluid cages implanted subcutaneously. Ten adult rabbits were used in two trials (E1 and E2). Cefepime concentrations in serum (S) and tissue cage fluid (LT) were determined by biological methods. The kinetic analysis was performed by means of a noncompartmental model. Pharmacokinetic results (means ± standard error): half life of elimination [t1\2 (E1 S)=1.5±0.2 and (E2 S)=2.0±0.2 h] (p<0.05), area under the curve [ABC (E1 S)=181.6±17.5 and (E2 S)= 192.3±18.5 (µg/mL/h]; volume of distribution at steady-state [Vss (E1 S)=0.31±0.05 and (E2 S)=0.69±0.28 L/kg] (p<0.05); total serum clearance [CL (E1 S)=118.3±17.7 and (E2 S)=93.1±19.9 (mL/h)kg] (p<0.05); maximum concentration [Cmax (E1 LT)=23.5±3.4 and (E2 LT)=27.6±3.6 (µg/mL]; time to reach Cmax [tmax (E1 LT) =2.3±0.4 and (E2 LT)=1.7±0.4 h)]; t1\2 (E1 LT)=2.4±0.3 and (E2 LT)=3.4±0.3 h (p<0.05); ABC (E1 LT)=122.0±12.7 and (E2 LT)=156.9±13.6 (µg/mL/h); penetration [P (E1 LT)=67.3±8.7 and (E2 LT)=88.5±8.7%]. In conclusion, the pharmacokinetic changes of cefepime observed in rabbits with hyperthermia induced by lipopolysacharide, could be clinically significant if not taken into account when designing the dosing regimens.
Keywords: Kinetics; Cefepime; Lipopolysacharide; Tissue cage fluid; Rabbits
INTRODUCCIÓN
Cefepime, una cefalosporina de cuarta generación, posee un espectro antibacterial más amplio que la mayoría de las cefalosporinas de tercera generación. Es activa contra varias bacterias gram positivas y negativas, incluyendo a la mayoría de los miembros de la familia Enterobacteriaceae, Pseudomonas aeruginosa y Staphylococcus aureus (1)(2).
El perfil farmacocinético de cefepime fue estudiado tanto en humanos (3-5) como en varias especies animales (6-10). Sin embargo, a pesar de que se sabe que la fiebre puede influir en la farmacocinética de los agentes antimicrobianos (11-15), aún no se han publicado datos acerca del comportamiento farmacocinético de cefepime y su penetración en líquido tisular (LT) al ser administrado por vía endovenosa a conejos. El objetivo de este trabajo fue estudiar la influencia de la hipertermia sobre el comportamiento farmacocinético de cefepime, monitoreando su concentración en suero y líquido tisular obtenido a partir de cajas implantadas subcutáneamente.
MATERIALES Y MÉTODOS
Diez conejos blancos [de la raza/especie Nueva Zelanda] con un peso corporal entre 2800 y 3400 g, a los que se les implantaron cajas para recolectar LT fueron utilizados en dos experiencias (E1 y E2). A cada animal se le implantaron subcutáneamente seis cajas para recolectar LT, tres en la región izquierda y tres en la región derecha. Las cajas consistieron en tubos plásticos de Silastic®, de 50 mm de largo y 15 mm de diámetro interno, cerradas en un extremo y con el 40% de su superficie perforada por agujeros de 2,5 mm. Para este propósito, las áreas laterales y las regiones costales de los animales fueron rasuradas, lavadas y desinfectadas. Los sitios de implante fueron anestesiados y las cajas insertadas en túneles disecados a través de una incisión en la piel, en las áreas mencionadas arriba. El LT y las muestras de sangre/suero (vena safena) fueron recolectados una vez por semana durante cuatro semanas luego del implante. A las muestras se les analizó proteínas totales por el método de Biuret y albúmina por la unión a bromosulfoftaleína, para determinar la reacción al material implantado.
Se utilizó un diseño farmacocinético cruzado.
La Experiencia 1 (E1) se llevó a cabo cuatro semanas luego del implante de las cajas para recolección de LT. A los conejos (n=10) normotérmicos se les administró una monodosis de 20 mg/kg de cefepime (Cefimen K®, KLONAL) por vía endovenosa (vena safena izquierda).
Las muestras de sangre se obtuvieron por venopuntura directa de la vena safena, inmediatamente antes de administrar la medicación y a 0,08; 0,17; 0,25; 0,5; 1,0; 2,0; 4,0; 6,0 y 8,0 horas luego de administrado el antibiótico. Las muestras de LT de las cajas (cada una 0,2 a 0,4 mL) fueron recolectadas siguiendo el mismo esquema, pero empezando a 0,25 horas luego de la administración del fármaco. La temperatura rectal se midió cada 0.25 h. Las muestras de sangre se dejaron coagular y luego se centrifugaron a 3.000 g por 15 min para separar el suero; las muestras se almacenaron en recipientes estériles individuales a -18 °C hasta ser analizadas. El intervalo de lavado entre la E1 y la Experiencia 2 (E2) fue de 2 semanas.
En la E2 los conejos recibieron una monodosis endovenosa (3 µg/kg) de lipopolisacáridos (LPS) de Escherichia coli (serotipo 026:B6, Sigma Chemical Co., St. Louis, Mo.) para producir hipertermia. Quince minutos luego de la infusión del LPS, se administró cefepime en igual dosis y por la misma vía que en E1. El muestreo de sangre y LT, la medición de la temperatura corporal, el análisis y el almacenamiento de las muestras se llevó a cabo de manera similar a la E1.
Las concentraciónes de cefepime en suero y LT se midieron usando un método de ensayo microbiológico modificado (Bacillus stearothermophilus var. calidolactis) (16). Los coeficientes de variación intra e inter ensayos fueron menores al 8% y el límite de cuantificación (LDC) fue 0,2 µg/mL.
Los datos de concentración-tiempo de cefepime en suero y LT fueron analizados mediante métodos no compartimentales (17). Las concentraciones séricas y en LT de cefepime versus tiempo se representaron en escala semilogarítmica.
Se calcularon los siguientes datos: la constante de eliminación (lz) en suero y LT, a través del método de los mínimos cuadrados, utilizando las 4 últimas concentraciones-tiempo. La vida media de eliminación (t1\2sub>) en suero o LT por medio de la ecuación: tl= log 2/lz. La concentración máxima de cefepime observada (Cmax) y el tiempo para alcanzar la Cmax en LT (tmax). El área bajo la curva (ABC) de concentracióntiempo en suero o LT fue calculada por el método trapezoides y extrapolada a infinito. El porcentaje de penetración en LT (de tiempo cero a infinito) se obtuvo mediante la siguiente fórmula: ABC(LT)/ABC(suero). El volumen de distribución en estado estacionario (Vss) se calculó con la ecuación siguiente: Vss= [Dosis (C(0)/(lz2)]/ABC2. La concentración sérica inicial del fármaco [C(0)] fue determinada utilizando la formula: C(0)= Ae-lt, donde A es la intersección de la concentración a tiempo cero, l es la pendiente y t es el tiempo. El aclaramiento corporal total (CL) se calculó a través de la fórmula CL= dosis/ABC. Las variables farmacocinéticas y las proteínas fueron calculadas estadísticamente mediante el análisis de la varianza unifactorial. El nivel de significación fue del 5%.
RESULTADOS
A las 4 y 6 semanas luego de implantar las cajas para la recolección del LT (E1 y E2, respectivamente) el promedio de concentración de proteínas totales en LT fue inferior al obtenido en las muestras de suero (48 y 46%, respectivamente) (p<0,05). A partir de estos datos, todas las cajas implantadas fueron consideradas estables y listas para ser usadas en estudios de farmacocinética y penetración en LT.
La temperatura rectal de los conejos en la E1 fue de 38,5 a 39,0 ºC (rango).
En la E2, luego de la administración del LPS, la temperatura corporal de los conejos se elevó, mostrando los valores máximos a las 3,5 h (40,2 ºC); estos valores fueron superiores (p<0,05) a los obtenidos en animales con temperatura normal (Figura 1).
Las curvas concentración-tiempo de cefepime en suero y LT, en conejos sanos e hipertérmicos, se muestran en la Figura 2.
Las variables farmacocinéticas obtenidas en animales sanos e hipertérmicos se muestran en la Tabla I.

Figura 1. Curva térmica (media) en conejos sanos (E1) y con hipertermia (E2) producida por lipopolisacáridos de E. coli administrados por vía endovenosa (3 µg/kg) en la Experiencia 2.
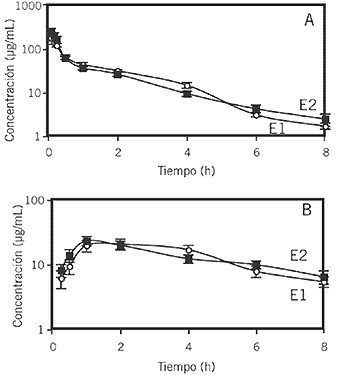
Figura 2. Concentraciones en suero (A) ( E1 y E2) y líquido tisular (B) ( E1 y E2) (medias±EE) luego de la administración endovenosa de cefepime (20 mg/kg) a conejos sanos (E1) e hipertérmicos (E2).
Tabla I. Variables farmacocinéticas de cefepime en suero y líquido tisular (media±EE) luego de su administración endovenosa (20 mg/kg) a conejos sanos (E1) e hipertérmicos (E2).
DISCUSIÓN Y CONCLUSIONES
Tal como fue realizado en el presente trabajo otros autores (4)(5) han descripto el comportamiento cinético de cefepime en suero y tejidos por medio de modelos no compartimentales, aunque también ha sido analizado el cefepime mediante la utilización de modelos abiertos bicompartimentales (7-10).
La alteración cinética más relevante que se observó en los conejos hipertérmicos en comparación con los sanos, fue la vida media de cefepime en suero. Su valor en conejos hipertérmicos fue similar al obtenido en humanos por Barbhaiya et al. (4) y Nye et al. (3) (2,0 y 2,1 h, respectivamente) y en caballos (2,1 h) (7), más alto que aquellos obtenidos en conejos sanos, ratas y monos (0,39 y 1,7 h, respectivamente) (6), perros y potrillos recién nacidos (1,09 y 1,65 h, respectivamente) (8), ovejas (1,76 h) (10) e infantes y niños (1,7 h) (5) y más bajo que los valores encontrados en terneros (2,38 h) (9). Como era de esperar, la vida media en LT también fue más prolongada en animales hipertérmicos, en comparación con animales normotérmicos (3,4 y 2,4 h, respectivamente) (p<0,05).
Cuando Ganzinger y Haslberger (13) administraron las cefalosporinas CPW 86-363, moxalactam y cefotaxime a conejos septicémicos encontraron, en comparación con conejos sanos, áreas bajo la curva en suero menos elevadas y aclaramientos y volúmenes de distribución del compartimiento central al periférico mayores. Estos resultados son coincidentes con trabajos previos en los que se mostró que, debido a cambios en la circulación, la endotoxina altera la difusión de los agentes antimicrobianos hacia el compartimiento periférico (11)(12)(14). Estas alteraciones, junto a las variaciones en el equilibrio ácido-base que pueden afectar el grado de ionización de cefepime, pueden ser las responsables de la mayor distribución así como de la permanencia más prolongada de estos antibióticos en animales hipertérmicos (14).
En este trabajo se observa una mayor área bajo la curva y penetración del antibiótico en el LT de animales hipertérmicos (156,9 µg/mL/h y 88,5%) en comparación con los sanos (122 µg/mL/h y 67,3%, respectivamente) (sin confirmación estadística). En tanto, Ganzinger et al. (14) encontraron, en conejos hipertérmicos y con temperaturas normales que recibieron cefalosporinas, una correlación inversa entre los valores del área bajo la curva en cajas para recolección de LT y el volumen de distribución en el compartimiento periférico.
Un aclaramiento sérico menor y un mayor volumen de distribución en conejos hipertérmicos comparado con el obtenido en animales sanos, llevó a obtener una vida media más prolongada. Sin embargo, no siempre que se administra LPS se pueden esperar estos resultados, debido a que la fiebre puede tener un efecto variable en el aclaramiento corporal total de los fármacos, dependiente de la especie animal, del fármaco en estudio o el agente causal de la fiebre (15).
En ratas y monos a los que se les administró cefepime se encontró un volumen de distribución en estado estacionario de 0,33 y 0,25 L/kg y un aclaramiento corporal total de 10,8 y 0,25 L/kg, respectivamente (6).
En conclusión, la administración de endotoxina a conejos aumentó el volumen de distribución así como la vida media de eliminación de suero y tejidos y disminuyó el aclaramiento, resultados que permiten tener en cuenta una potencial modificación en los regímenes de dosificación de cefepime cuando se lo administra en una situación de hipertermia.
Agradecimientos
Este estudio fue subvencionado mediante un subsidio otorgado por la Comisión de Investigaciones Científicas de la Provincia de Buenos Aires, Argentina.
Correspondencia
Roberto Rule
Calle 63, Nro 216 - 1900 LA PLATA, Argentina
Fax: (54-221) 4236710
E-mail: robertorule@yahoo.com.ar
1. Fuchs PC, Jones RN, Barry AL, Thornsberry C. Evaluation of the in vitro activity of BMY-28142, a new broad-spectrum cephalosporin. Antimicrob Agents Chemother 1985; 27: 679-82. [ Links ]
2. Kessler RE, Bies M, Buck RE, Chisholm DR, Pursiano TA, Tsai YH, et al. Comparison of a new cephalosporin, BMY 28142, with other broad-spectrum beta-lactam antibiotics. Antimicrob Agents Chemother 1985; 27: 207-16. [ Links ]
3. Nye KJ, Shi YG, Andrews JM, Wise R. Pharmacokinetics and tissue penetration of cefepime. J Antimicrob Chemoth 1989; 24: 23-8. [ Links ]
4. Barbhaiya RH, Forgue ST, Gleason CR, Knupp CA, Pittman KA, Weidler DJ, et al. Safety, tolerance, and pharmacokinetic evaluation of cefepime after administration of single intravenous doses. Antimicrob Agents Chemother 1990; 34: 1118-22. [ Links ]
5. Reed MD, Yamashita TS, Knupp CK, Veazey JM, Blumer JL. Pharmacokinetics of intravenously and intramuscularly administered cefepime in infants and children. Antimicrob Agents Chemother 1997; 41: 1783-7. [ Links ]
6. Forgue ST, Shyu WC, Gleason CR, Pittman KA, Barbhaiya RH. Pharmacokinetics of the novel cephalosporin cefepime (BMY-28142) in rats and monkeys. Antimicrob Agents Chemother 1987; 31: 799-804. [ Links ]
7. Guglick MA, MacAllister CG, Clarke CR, Pollet R, Hague C, Clarke JM. Pharmacokinetics of cefepime and comparison with those of ceftiofur in horses. Am J Vet Res 1998; 59: 458-63. [ Links ]
8. Gardner SY, Papich MG. Comparison of cefepime pharmaco-kinetics in neonatal foals and adult dogs. J Vet Pharmacol Ther 2001; 24: 187-92. [ Links ]
9. Ismail MM. Disposition kinetics, bioavailability and renal clearance of cefepime in calves. Vet Res Commun 2005; 29: 69-79. [ Links ]
10. Ismail MM. Pharmacokinetics of cefepime administered by i.v. and i.m. routes to ewes. J Vet Pharmacol Ther 2005; 28: 499-503. [ Links ]
11. Ladefoged O. Pharmacokinetics of trimethoprim (TMP) in normal and febrile rabbits. Acta Pharmacol Tox 1977; 41: 507-14. [ Links ]
12. Riffat S, Nawaz M, Zla-ur-R. Pharmacokineticss of sulphadimidine in normal and febrile dogs. J Vet Pharmacol Ther 1982; 5: 131-5. [ Links ]
13. Ganzinger U, Haslberger A. Pharmacokinetics of cephalosporins in normal and septicemic rabbits. Anti-microb Agents Chemother 1985; 28: 473-7. [ Links ]
14. Ganzinger U, Haslberger A, Schiel H, Omilian-Rosso R, Schutze E. Influence of endotoxin on the distribution of cephalosporins in rabbits. J Antimicrob Chemoth 1986; 17: 785-93. [ Links ]
15. Mackowiak PA. Influence of fever on pharmacokinetics. Rev Infect Dis 1989; 11: 804-7. [ Links ]
16. Herbst DV Indentification and determination of four b-lactam antibiotics in milk. J Food Protect 1982; 45: 450-1. [ Links ]
17. Ritschel, W.A. Handbook of Basic Pharmacokinetics. 3rd. Ed. Hamilton, IL: Drug Intelligence Publications Inc; 1986. [ Links ]
Aceptado para su publicación el 7 de marzo de 2008














