Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. v.42 n.2 La Plata abr./jun. 2008
TOXICOLOGÍA
Determinación de paraquat en orina utilizando un sistema de inyección en flujo continuo*
Determination of paraquat in urine samples by flow-injection analysis
José Rafael Luna1, María Luisa Di Bernardo2, María Ysabel García2, Fernando Ovalles2, Laura Calderón2
1. MSc. en Química Aplicada de la Universidad de Los Andes, Mérida-Venezuela.
2. Dr. en Química Analítica de la Universidad de Los Andes, Mérida-Venezuela.
* Grupo de Investigación en Toxicología Analítica y Estudios Farmacológicos (GITAEF). Facultad de Farmacia y Bioanálisis. Urbanización Campo de Oro, Calle Principal, Edificio Carlos Edmundo Sala. Universidad de Los Andes. Mérida-Venezuela. Apartado postal 5101.
Resumen
El paraguat es un herbicida que pertenece al grupo de los biperidilos. Su determinación cuantitativa en orina es muy importante para diagnosticar la supervivencia de pacientes intoxicados. Muchos centros hospitalarios utilizan pruebas semicuantitativas para la determinación de paraquat en muestras biológicas. Sin embargo, éstas suelen carecer de precisión y exactitud. Por tanto, el desarrollo de métodos alternativos simples, exactos, precisos y accesibles podría resultar muy útil en instituciones hospitalarias. Sobre la base de estas consideraciones, se propone un método de análisis por inyección en flujo y detección espectrofotométrica para la determinación cuantitativa de paraquat en muestras de orina. La determinación se basa en la formación de un producto coloreado (600 nm) posterior a la reducción de paraquat con glucosa en un medio alcalino, mediante un sistema en línea. Bajo las condiciones óptimas de operación, la ley de Beer se cumple en el intervalo 1-50 µg mL-1 de paraquat con un coeficiente de correlación >0,999. La frecuencia de análisis fue de 12 h-1 con una desviación estándar relativa del 2,8% para una solución muestra que contiene 10 µg mL-1 de paraquat (n=3). El estudio de recuperación osciló entre 97,9 y 102,1%. El método analítico fue aplicado satisfactoriamente al análisis de muestras de dos pacientes intoxicados con paraquat.
Palabras clave: Paraquat; Análisis por inyección en flujo; Orina; Glucosa
Summary
Paraguat is a herbicide beloging to the bipyridinium group.The quantitative determination of paraquat in urine of humans is very important to diagnose survival of intoxicated patients. Many hospitals use semi-quantitative tests for determining paraquat in biological samples. However, they often lack precision and accuracy. Therefore, the development of simple, precise, accurate and accessible alternative methods could be very useful in hospital institutions. Based on these considerations, a flow-injection spectrophotometric procedure is proposed for paraquat determination in urine samples. The determination is based on the formation of a coloured product (600 nm) after on-line reduction of paraquat with glucose in alkaline medium. Under optimal conditions of operation, Beer's law is obeyed in a concentration range of 1-50 µg mL-1 of paraquat with a correlation coefficient >0.999. The analytical frequency was 12 h-1 and the relative standard deviation was 2.8% for a sample solution containing 10 µg mL-1 paraquat (n=3). Recovery studies were between 97.9 and 102.1%. The analytical method was satisfactorily applied in the analyses of samples from two intoxicated patients.
Keywords: Paraquat; Flow injection analysis; Urine; Glucose
INTRODUCCIÓN
El paraquat, bicloruro de 1,1-dimetil-4,4'-bipiridilo, es un herbicida que pertenece al grupo de los biperidilos, (C12H14N2Cl2) con peso molecular de 257,2. Es un compuesto muy polar con una solubilidad en agua de 700 g L-1, estable en medio ácido o neutro y rápidamente hidrolizado en soluciones alcalinas.
émico, potencialmente citotóxico (1-4). El uso generalizado de este herbicida, unido a la falta de aplicación de las normas de seguridad para su manipulación, originan la aparición de envenenamientos, tanto accidentales como intencionales. Además, se ha utilizado durante las últimas décadas con fines suicidas en Japón, Taiwán, Malasia y Venezuela (5)(6).
Desde el punto de vista tóxico-cinético, la ruta de absorción más importante es la digestiva, ya que es la más frecuentemente involucrada en casos de intoxicación accidental o suicida. Tiene un volumen de distribución de 2-8 L Kg-1 de peso, con una vida media de distribución de 5 horas. Se elimina vía renal por filtración glomerular y secreción tubular activa, excretándose en un 90% a las 24 horas y en un 96% aproximadamente en 48 horas (7-9).
ádirectamente relacionado a la cantidad ingerida, absorbida y eliminada (10-12). Además, su determinación cuantitativa puede correlacionarse con el pronóstico del paciente, pudiéndose indicar incluso el porcentaje de sobrevida de acuerdo con los niveles de paraquat en sangre y orina. Por ejemplo, pacientes con niveles de paraquat en plasma por debajo de 2 µg mL-1 a las cuatro horas post-ingestión pueden indicar un buen pronostico (4)(13). Asímismo, pacientes con niveles en orina menores a 1 µg mL-1 antes de las 24 horas post-ingestión, tienen un pronóstico a favor de la recuperación del paciente (14-18). Estos resultados han ocasionado que la determinación de paraquat en plasma y orina se convierta en un ensayo importante para el diagnóstico y pronóstico en caso de intoxicación, permitiendo de esta manera estimar un porcentaje de sobrevida (13)(14)(17).
étodos para la determinación de paraquat en agua y matrices biológicas; algunos se fundamentan en la espectrofotometría (18-20), en la cromatografía con detección espectrofotométrica (21) (22) y acoplada a un detector de masas (23)(24), en la cromatografía electrocinética micelar (25) y en la electroforesis capilar (26). El uso de los métodos anteriormente señalados implica costos elevados, no sólo en equipamiento, sino también en infraestructura y entrenamiento del personal, impidiendo que laboratorios hospitalarios dispongan de los mismos como diagnóstico y pronóstico de sobrevida del paciente intoxicado.
étodos espectrofotométricos se fundamentan en la medida del ion paraquat (incoloro) bajo la forma reducida en medio alcalino (azul). El agente reductor más utilizado es el ditionito de sodio, uno de cuyos principales inconvenientes es que el radical libre posee una estabilidad limitada (5-10 min), debido a la oxidación por el oxígeno atmosférico, lo que impide el manejo eficiente para su cuantificación (20)(27)(28).
ón espectrofotométrica originado por la inestabilidad del radical catiónico coloreado, se ha solventado utilizando glucosa, para prolongar la estabilidad hasta cerca de 12 horas; por otra parte, la sensibilidad ha sido mejorada generando el producto coloreado a temperatura elevada (70-100 ºC) (20). Otro reactivo informado como agente reductor del dicatión paraquat es el ácido ascórbico en medio alcalino, el cual también genera un producto coloreado más estable que el ditionito (28).
Actualmente, existe una forma de análisis basada en la inyección del analito en una solución portadora en movimiento continuo y sin segmentación alguna, conocida como Inyección en Flujo Continuo (FIA). Los métodos FIA son una extensión de los procedimientos de flujo segmentado, que se han utilizado ampliamente en los laboratorios clínicos para la determinación rutinaria automática de distintas especies en muestras de sangre y orina (29)(30). Además, el acoplamiento de la inyección en flujo con diferentes técnicas espectroscópicas y electroquímicas ha sido recomendado desde sus comienzos. Uno de los mayores beneficios que aporta esta técnica es la posibilidad de realizar diferentes procesos en línea, tales como: dilución de la muestra, diálisis, intercambio iónico, procesos de oxidación o reducción, extracción líquido-líquido, adición de diferentes reactivos, filtración, pre o co-precipitación, disolución y generación de especies volátiles, con gran flexibilidad, economía de reactivos y muestra (30)(31). Otras de las ventajas del sistema FIA tiene que ver con la frecuencia de análisis, mejores tiempos de residencia del bolo de muestra inyectado en el sistema, tiempo de puesta en marcha y parada de los instrumentos utilizados en el acoplamiento del sistema, muchos más rápidos, sencillos y versátiles, lo que ha originado que los sistemas de flujo segmentado sean reemplazados en gran parte por sistemas de inyección en flujo (30)(32).
La cuantificación de paraquat en muestras biológicas mediante el uso de sistemas FIA ha sido poco explorada. Abundan los trabajos que utilizan la cromatografía líquida de alta resolución (21-23)(30), técnica que no está al alcance de la mayoría de los laboratorios de diagnóstico e implican tiempos de análisis muy largos, trabajo tedioso (33)(34) y mayor gasto de reactivos. Por estas razones, en el presente trabajo se propone el desarrollo de un método alternativo para la cuantificación del paraquat en muestras de orina basado en un sistema FIA simple con detección espectrofotométrica.
MATERIALES Y MÉTODOS
Reactivos
Los reactivos utilizados fueron de grado analítico: NaOH (Merck, Darmstad, Alemania); D(+)-glucosa monohidratada (Merck, Darmstad, Alemania); ácido etilendiamino tetra acético o EDTA (Sigma, San Louis, EE.UU.); vilógeno de metilo (gramoxone, paraquat): bicloruro de 1,1-dimetil-4,4'-bipiridilo (Sigma, San Louis, EE.UU.).
Equipos
Shimadzu UV-1201 (Shimadzu Corporation, Kioto, Japón); bomba peristáltica (Masterflex L/S Cole-Palmer Instrument Co, Vernon Hills, Illinois, EE.UU.); válvula de inyección de 6 puertos y dos posiciones (Rheodyne Cotati, CA, modelo 7000), equipada con un bucle de inyección de 200 µL; tubos de dispersión de Tygon® de 0,8 mm de diámetro interno (Masterflex Cole-Palmer Instrument Co, Vernon Hills, Illinois EE.UU.); portacelda con controlador de temperatura termoeléctrico (TCC 240A, Shimadzu Corporation Kyoto, Japón); microcelda de flujo continuo con ventanas de cuarzo modelo 73.65-Q-10 (Starna Cells, Atascadero, California, EE.UU.).
Procedimiento
El sistema de análisis por inyección en flujo acoplado a un espectrofotómetro se muestra en la Figura 1. Consiste en una bomba peristáltica, un canal para el transporte del agente reductor, una válvula de inyección, un serpentín de reacción, una celda para flujo, un módulo controlador de la temperatura de la celda y el espectrofotómetro. La solución reductora es impulsada por la bomba peristáltica hacia el serpentín de reacción.
Sobre la corriente del reactivo reductor se inyecta la solución que contiene el analito y en el serpentín de reacción se forma el complejo coloreado que posteriormente se monitorea a 600 nm. El agente reductor consiste en una solución que contiene glucosa (0,4%, m/v), hidróxido de sodio (1 M), y EDTA (5%, m/v). El hidróxido de sodio se agrega para garantizar el medio alcalino necesario para la reacción y el EDTA se adiciona para eliminar la posible presencia de iones que precipitan en medio alcalino, tales como calcio, magnesio, hierro y aluminio (20)(28).

Figura 1. Diseño del sistema propuesto de inyección en flujo continuo (FIA) para el análisis cuantitativo de paraquat.
RESULTADOS
Las variables físico-químicas involucradas en el sistema propuesto fueron optimizadas. Para lograr las mejores condiciones de trabajo, la optimización del sistema se realizó evaluando un parámetro a la vez. Los ensayos preliminares fueron realizados utilizando datos previamente publicados por otros autores (35-39) (Tabla I). Adicionalmente se describen las variables utilizadas en el presente estudio.
La Figura 2 muestra el efecto de las variables químicas estudiadas sobre la señal analítica. Bajo las condiciones de trabajo óptimas, la mayor sensibilidad se obtuvo utilizando concentraciones de 0,4% (m/v) y 1,0 M para soluciones de glucosa e hidróxido de sodio, respectivamente.
La Figura 2 también muestra el efecto de la temperatura de la celda de flujo sobre la señal analítica. La sensibilidad guardó una relación directamente proporcional a los incrementos de temperatura.
Las variables físicas, tales como la longitud de la espiral de reacción, el caudal del reactivo reductor y sus respectivos efectos sobre la intensidad de la señal se presentan en la Figura 3. Los resultados demostraron que era necesaria la inclusión de un serpentín de reacción. Sin embargo, la sensibilidad sólo fue directamente dependiente de la longitud del serpentín hasta 50 cm, ya que a longitudes mayores se produjo una disminución de la señal analítica. Por otra parte, los resultados relacionados con el caudal del reactivo reductor (glucosa al 0,5% m/v en NaOH 1,0 M) y su efecto sobre la señal analítica indicaron que éste debía mantenerse al mínimo para lograr una mayor sensibilidad.
Tabla I. Condiciones primarias para iniciar la optimización del sistema FIA y condiciones óptimas alcanzadas.

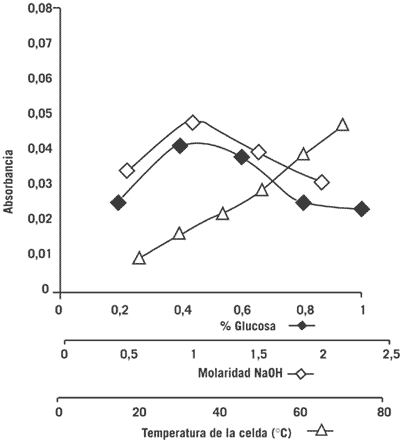
Figura 2. Efecto de la concentración de los reactivos y la temperatura de la celda sobre la señal analítica. [Paraquat] = 10 µg mL-1.
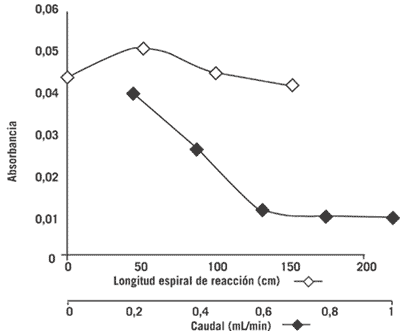
Figura 3. Efecto de la longitud del serpentín de reacción y del caudal del reactivo reductor sobre la señal analítica. [Paraquat] = 10 µg mL-1.
Caracterización analítica del método
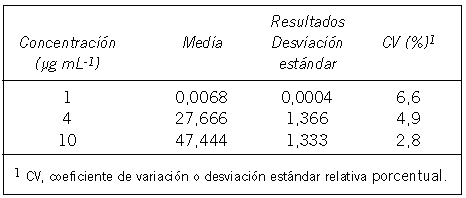
Linealidad y precisión: Para determinar el intervalo y la linealidad se prepararon dos curvas de calibración, una con un intervalo de concentraciones entre 1 y 10 µg mL-1, y otra entre 10 y 50 µg mL-1. Con los resultados obtenidos se calculó la recta de regresión (Tabla II) utilizando el programa Microsoft® Excel 2002, en donde la pendiente representa la respuesta del sistema de medición (sensibilidad) en función del cambio de la concentración del analito. La precisión para el intervalo de trabajo entre 1 y 10 µg mL-1 fue determinada utilizando soluciones de concentración baja, intermedia y elevada (Tabla III).
Tabla II. Características analíticas de la recta de calibración para los dos intervalos estudiados.

Tabla III. Estudios de precisión.
Exactitud: Para evaluar la fidelidad del método propuesto, se prepararon soluciones de trabajo desde 0,0; 1,0; 2,0; 4,0; 6,0; 8,0; hasta 10,0 µg mL-1, a las cuales se les adicionó un volumen constante de una muestra (orina) que contenía una concentración de paraquat equivalente a 5,0 µg mL-1. Con los datos obtenidos se construyó la curva de calibración por el método de adición estándar (Fig. 4) en donde la intersección negativa sobre el eje x corresponde a la concentración de paraquat presente en la muestra. Como se observa en la gráfica, la extrapolación de la curva originó una concentración sólo ligeramente mayor que la esperada.
Posteriormente, para verificar el efecto matriz utilizando orina como matriz biológica, se midió la exactitud mediante el porcentaje de recuperación del paraquat añadido; para ello se prepararon dos muestras de orina adicionándole un volumen de solución estándar de 1 µg mL-1 de paraquat a una y a la otra 2 µg mL-1 para un volumen final de 10 mL; cada muestra fue preparada por triplicado. Una vez aplicado el método, se obtuvo una recuperación de 97,9% para la muestra que contenía 1 µg mL-1 y 102,1% para la muestra que contenía 2 µg mL-1 (Tabla IV).

Figura 4. Curva de calibración por el método de adición de estándar para calcular la exactitud del método propuesto. Y = 0,0028[X] + 0,0147; r2 = 0,998.
Tabla IV. Estudios de recuperación de paraquat en orina.

Límite de detección y de cuantificación: El ruido obtenido fue <0,003 unidades de absorbancia, y la concentración del LD se calculó aplicando la ecuación de la recta (y = mx + b) para el intervalo de trabajo entre 1,0 y 10,0 µg mL-1, resultando un valor de 0,4 µg mL-1. El límite de cuantificación calculado utilizando los datos de la curva de calibración externa fue de 1,0 µg mL-1, con una exactitud y precisión de 97,9% y 6,6%, respectivamente.
Análisis de muestras de dos pacientes: se determinó la concentración de dos muestras reales provenientes de pacientes intoxicados con paraquat, que acudieron a la guardia del Instituto Autónomo Hospital Universitario de Los Andes (IAHULA), Mérida, Venezuela. Las muestras fueron centrifugadas a 3000 rpm x 5 minutos y el sobrenadante posteriormente se analizó por el sistema propuesto (Tabla V).
Tabla V. Análisis de muestras reales.

DISCUSIÓN Y CONCLUSIONES
Es importante destacar que el uso de numerosos reactivos en un sistema FIA origina una mayor complejidad en el diseño de la metodología a utilizar, lo que incide en mayor tiempo y costo de los análisis. Por esta razón, se decide diseñar un sistema de tal forma que los análisis puedan realizarse de una manera más simple y utilizando glucosa como agente reductor. Por otra parte, existen diversas sustancias que se utilizan como agentes reductores; algunas de ellas son el ditionito de sodio, el ácido ascórbico, el borohidruro de sodio y la glucosa, todas en medio alcalino por cuanto el radical catiónico es inestable en medio ácido. En este trabajo se decide utilizar glucosa debido a su capacidad, en solución alcalina, para reducir ciertos reactivos tales como los iones cúpricos (40), metahemoglobina (41), azul de metileno (42) y paraquat (20); además, el uso de glucosa no ha sido reportado en sistemas FIA, siendo solamente utilizada en métodos en serie (20). Tal como se observa en la Figura 3, la concentración a la cual se obtiene la mejor señal analítica es 0,4% de glucosa, cercano al de 0,5% cuando se determina paraquat mediante un método en serie informado por Kesari et al. (20). En la Figura 2, la molaridad del NaOH resulta similar a la utilizada en la determinación de paraquat en agua potable cuando se utiliza ácido ascórbico como agente reductor en un sistema FIA (36). Cuando se ha utilizado glucosa como agente reductor en un sistema en serie para determinar paraquat en plantas, frutas, granos, agua, sangre y orina la molaridad del NaOH fue de 2 (20). Sin embargo, en este caso el valor obtenido es de 1, quizás debido a que se mezcló menor cantidad de reactivos en el serpentin de reacción y se utilizó menor volumen de muestra.
ón al incremento de la absorbancia como consecuencia de la variación de la temperatura, tal como se muestra en la Figura 2, se encontraron resultados similares en el trabajo de Jain et al. (36), quienes informaron un incremento de la señal analítica a medida que se incrementaba la temperatura de la espiral de reacción desde 30 °C hasta 60 °C. Por otra parte, en este trabajo, al aumentar la temperatura de la celda de lectura desde 20 °C hasta 60 °C la absorbancia se incrementó en un 75%, pero se decidió utilizar 60 ºC debido a que el manual del equipo termostatizador indicaba que las mediciones deben hacerse a un máximo de 60 ºC (43), aunque el sistema controlador de temperatura permite lecturas hasta 70 ºC .
Si se toma en cuenta la espiral de reacción, los resultados indican que la mejor absorbancia se produce cuando la muestra reacciona con el agente reductor en la espiral de 50 cm, para luego disminuir a longitudes superiores, quizás debido a una mayor dilución del analito, fijándose 50 cm como parámetro óptimo para la caracterización del sistema FIA. En cuanto al caudal del reactivo reductor y a su efecto en la señal analítica, los resultados indican que un aumento del caudal origina una disminución de la señal. Este fenómeno podría deberse al poco tiempo de reacción entre el analito contenido en la muestra y el reactivo reductor por la rapidez del caudal, lo que impide se forme el radical catiónico coloreado, por lo que se decidió fijar la variable en 0,4 mL min-1.
(44). En la Tabla II se observa que el coeficiente de determinación (r2) para los dos intervalos evaluados es de 0,999, lo que explica en un 99,9% la dependencia de la absorbancia de la concentración del paraquat. Por otra parte, para conocer la variabilidad del método de ensayo debido a errores aleatorios, se mide el grado de concordancia o grado de dispersión entre los valores de una serie repetida de ensayos realizados en las mismas condiciones de medición; la precisión intraensayos o repetibilidad se mide efectuando una serie de análisis sobre la misma muestra, en las mismas condiciones operativas, por un mismo analista, con los mismos aparatos y reactivos, en un mismo laboratorio y en un período de tiempo corto. En este trabajo, tal como se observa en la Tabla III, la mayor dispersión se produce a la concentración de 1 µg mL-1 (6,6%) y la menor a 10 µg mL-1 (2,8%), encontrándose en otros trabajos valores de 5% para concentraciones de 1,0 µg mL-1 en sistemas FIA de mayor complejidad, para la determinación de paraquat en agua (36).
En otros métodos, donde se determina paraquat en plasma, utilizando cromatografía líquida en fase reversa con par iónico, se obtiene una exactitud que va desde 95,0 a 99,5% en concentraciones que van desde 0,05 hasta 3 µg mL-1 (33); y en inyección en flujo continuo con detección espectrofluorométrica para la determinación de paraquat en aguas, se obtiene una exactitud de 76 a 111%, cuando se avalúa paraquat en el orden de los ng mL-1 (39). También, en métodos en serie que determinan paraquat en orina a concentraciones de 1 µg mL-1 concentrando con columnas de intercambio iónico, utilizando ácido ascórbico como agente reductor (28), se obtienen exactitudes de 96% y cuando se utiliza glucosa la exactitud es de un 94% (20). En este trabajo se logra, utilizando el método de adición de estándar, una exactitud del 105%, lo que indica que los errores sistemáticos están en el orden de otros métodos informados y en algunos casos en menor proporción; además, el porcentaje de recuperación cuando se utiliza la matriz orina demuestra una buena selectividad y poca interferencia en el método y además, poca complejidad en la matriz utilizada. Asimismo, el límite de cuantificación establecido (1,0 µg mL-1) permite a través de las determinaciones en orina, según el trabajo de Scherrmann et al. (15), realizar el pronóstico del paciente, ya que aquéllos cuyos niveles estén por encima de 1 µg mL-1 en orina antes de las 24 horas post ingestión tienen una alta probabilidad de muerte, tal como ocurrió en los dos casos presentados en la Tabla V (15)(16).
Por último, en este trabajo se diseñó un método acoplando un sistema FIA a un espectrofotómetro, con la finalidad de cuantificar paraquat en orina, permitiendo un control directo por parte del investigador, poco gasto de reactivos, buena reproducibilidad y un tiempo de análisis de cinco minutos por cada muestra analizada. Por otra parte, el método permite cuantificar paraquat en un nivel igual o superior a 1,0 µg mL-1, lo que constituye una ventaja en los centros hospitalarios, debido a que generalmente se disponen de métodos semicuantitativos, que son de muy poca precisión y exactitud. Además, la posibilidad de disminuir el límite de detección y cuantificación, puede lograrse utilizando resinas de intercambio catiónico como método de preconcentración; sin embargo, la mayor complejidad en el diseño del método FIA adiciona costos y tiempo para el análisis, los cuales generalmente no se disponen en la emergencia toxicológica.
Correspondencia
José Rafael Luna
Grupo de Investigación en Toxicología Analítica y Estudios Farmacológicos (GITAEF)
E-mail: lunajr@ula.ve
1. World Health Organization. Enviromental Health. Criteria, No. 39. Paraquat and Diquat. Geneva: World Health Organization; 1984. [ Links ]
2. Martinez M. Toxicidad de xenobióticos mediada por radicales libres de oxígeno. Ars Pharmaceutica 1998; 39 (1): 5-18. [ Links ]
3. Wesseling C, Hogstedt C, Picado A, Johansson L. Unintentional fatal Paraquat poisoning among agriculture worker in Costa Rica. Am J Ind Med 1997; 32: 433-41. [ Links ]
4. LaDou J. Medicina laboral y ambiental. 2a ed. México, D.F.: Manual Moderno; 1999. [ Links ]
5. Vila R. Intoxicación por paraquat en actuaciones de enfermería. Sociedad Española de Enfermería de Urgencias y Emergencias. Ciber Revista. Septiembre 2003. [citado marzo de 2006]. Disponible en: http://www.enfermeriadeurgencias.com/ciberrevista/2003/septiembre/ paraquat.htm. [ Links ]
6. Rámirez SW, Rivas FP. Intoxicación aguda con paraquat. Un estudio clínico epidemiológico. Instituto Autónomo Hospital Universitario de los Andes. Mérida-Venezuela 1982-1999. Salud de los Trabajadores 2000; 8 (1): 43-9. [ Links ]
7. Descampiaux B, Imbenotte M, Desenclos V, Vermeersh G, Lhermitte M, Erb F. H-1 NMR investigation of toxic effects of lindane and paraquat on HEP 3B and HEP G2 human hematoma cell lines. Chem Res Toxicol 1997; 10 (1): 34-40. [ Links ]
8. Ellenhorn MJ, Barcelow DG. Medical Toxicology. Diagnosis and Treatment of Human Poisoning. New York (NY): Elsevier; 1988. [ Links ]
9. Hayes WJ, Laws ER. Handbook of Pesticide Toxicology. Vol. 3. Classes of Pesticides. New York: Academy Press, Inc.; 1991. [ Links ]
10. Eddleston M, Wilks M, Buckley, N. Prospects for treatment of paraquat-induced lung fibrosis with immunosuppressive drugs and the need for better prediction of outcome: a systematic review. Q J Med 2003; 96: 809-24. [ Links ]
11. Sittipunt C. Paraquat poisoning. Respiratory Care 2005; 50 (3): 383-5. [ Links ]
12. Hong SY, Yang DH, Hwang KY. Association between laboratory parameters and outcome of paraquat poisoning. Toxicol Lett 2000; 118 (1-2): 53-9. [ Links ]
13. Proudfoot AT, Stewart MJ, Levitt T, Widdop B. Paraquat poisoning: significance of plasma paraquat concentrations. Lancet 1979; 2: 330-2. [ Links ]
14. Hart TB, Nevitt A, Whitehead AA. A statistical approach to the prognostic significance of plasma paraquat concentration. Lancet 1984; 2: 1222-3. [ Links ]
15. Scherrmann J, Houze P, Bismuth C, Bourdon R. Prognostic value of plasma and urine paraquat concentration. Hum Toxicol 1987; 6: 91-3. [ Links ]
16. Scherrmann J, Gallito M, Garnier R, Bismuth C. Acute paraquat poisoning: prognostic significance and therapeutical interest of blood assay. Toxicol Eur Res 1983; 5 (3): 141-5. [ Links ]
17. Bismuth C, Garnier R, Dally S, Fournier PE, Scherrmann JM. Prognosis and treatment of paraquat poisoning. A review of 28 cases. J Toxicol Clin Toxicol 1982; 19: 461-74. [ Links ]
18. Knepil J. A short, simple method for the determination of paraquat in plasma. Clin Chim Acta 1977; 79: 387-90. [ Links ]
19. Fell A, Jarvie D, Stewart M. Analysis for paraquat by second - and fourth- derivate spectroscopy. Clin Chem 1981; 27 (2): 286-92. [ Links ]
20. Kesari R, Rai M, Gupta VK. Spectrophotometric method for determination of paraquat in food and biological samples. J AOAC Int 1997; 80 (2): 388-91. [ Links ]
21. Pryde A, Darby FJ. The analysis of paraquat in urine by high-speed liquid chromatography. J Chromatogr 1975; 115: 107-16. [ Links ]
22. Fuke C, Ameno K, Ameno S, Kinoshita H, Ijiri Y. Detection of two metabolites of diquat in urine and serum of poisoned patients after ingestion of combined herbicide of paraquat and diquat. Arch Toxicol 1996; 70: 504-7. [ Links ]
23. Madhu C, Gregus Z, Klaassen C. Simple method for analysis of diquat in biological fluids and tissues by high-perfomance liquid-chromatography. J Chromatogr 1995; 674: 193-6. [ Links ]
24. Grey L, Nguyen B, Yang P. Liquid chromatography-electrospray ionization isotope dilution mass spectrometry analysis of paraquat and diquat using conventional and multilayer solid-phase extraction cartridges. J Chromatogr A 2002; 958 (1-2): 25-33. [ Links ]
25. Nuñez O, Kim JB, Moyano E, Galceran MT, Terabe S. Analysis of the herbicides paraquat, diquat and difenzoquat in drinking water by micellar electrokinetic chromatography using sleeping and cation selective exhaustive injection. J Chromatogr A 2002; 961: 65-75. [ Links ]
26. Nunez O, Moyano E, Galceran MT. Capillary electrophoresis-mass spectrometry for the analysis of quaternary ammonium herbicides. J Chromatogr A 2002; 974(1-2): 243-55. [ Links ]
27. Tompsett SL. Paraquat poisoning. Acta Pharmacol Toxicol 1970; 28: 346-58. [ Links ]
28. Shivhare P, Gupta V. Spectrophotometric method for the determination of paraquat in water, grain and plant materials. Analyst 1991; 116: 391-3. [ Links ]
29. Skoog DA, Leary J. Análisis Instrumental. 4º ed. Madrid: Editorial McGraw-Hill; 1994. [ Links ]
30. Cerdà V. Introducción a los métodos de análisis en flujo. Madrid: SCIWARE; 2006. [ Links ]
31. Matousek de Abel de la Cruz A, Burguera J, Burguera M, Wasin S, Rivas C. Sistema IF-llama-EAA para la determinación de la estequiometría real de cristales pequeños del semiconductor CuInSe2. Memorias del II Congreso Venezolano de Química; 1995; Caracas, Venezuela; p. 224-5. [ Links ]
32. Ruzicka J, Hansen E. Flow injection analysis. I. A news concept of fast continuous flow analysis. Anal Chim Acta 1975; 78: 145-54. [ Links ]
33. Brunetto M, Morales A, Gallignani M, Burguera J, Burguera M. Determination of paraquat in human blood plasma using reversed-phase ion-pair high-perfomance liquid chromatography with direct sample injection. Talanta 2003; 59: 913-21. [ Links ]
34. Guevara J, Iglesias A, Ortega P. Determinación sérica de paraquat por espectrofotometría visible previa clarificación por filtración. Rev Toxicol 2003; 20: 122. [ Links ]
35. Guijarro C, Yanez C, Diez P. Determination of paraquat by flow-injection spectrophotometry. Anal Chim Acta 1987; 199: 203-8. [ Links ]
36. Jain A, Verma K, Townshend A. Determination of paraquat by flow-injection spectrophotometry. Anal Chim Acta 1993; 284: 275-9. [ Links ]
37. Agudo M, Ríos A, Valcárcel M. Automatic continuous-flow determination of paraquat at the subnanogram per millilitre level. Anal Chim Acta 1993; 281: 103-9. [ Links ]
38. Lopez C, Viñas P, Campillo N, Hernández M. Determination of paraquat in water by enzymatic inhib-ition using flow-injection analysis. J Environ Anal Chem 1998; 72(4): 267-74. [ Links ]
39. Pérez T, Martinez C, Tomás V, Fenol J. Spectrofluor-imetric determination of paraquat by manual and flow injection methods. Analyst 1998; 123: 1577-81. [ Links ]
40. Toporek M. Bioquímica. 3a ed. México, D.F.: Inter-americana; 1984. [ Links ]
41. Patty F. Industrial hygiene and toxicology, Vol II. New York: Inter Science Publisher; 1967. [ Links ]
42. Adamcikova L, Pavlikova K, Sevcik P. The methylene blue-D-glucose-O2 system. Oxidation of D-glucose by methylene blue in the presence and the absence of oxygen. Int J Chem Kinet 1999; 31 (6): 463-8. [ Links ]
43. Shimadzu Corporation. Instruction manual TCC-240 thermo-electrically temperature-controlled cell holder. P/N 204-05557-01. Analytical instruments division. Kyoto, Japan. [ Links ]
44. Asociación Española de Farmacéuticos de la Industria. Validación de Métodos Analíticos. AEFI. Comisión de normas de buena fabricación y control de la calidad. Barcelona: AEFI, 1989. [ Links ]
Aceptado para su publicación el 6 de mayo de 2008














