Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. v.42 n.3 La Plata jul./sep. 2008
SECCIÓN PERMANENTE LATINOAMERICANA
Infecciones materno-fetales de origen viral
C. Vauloup-Fellous1
1 Servicio de Virología, Hospital Antoine Béclère, AP-HP, Clamart
Editor: Dr. Camilo Fernández Espina
Colaboración: Dr. Miguel Blasco Vega
Asociación Española de Farmacéuticos Analistas
Modesto Lafuente, 3 - 28010 Madrid
AEFA agradece a Biologiste et Praticien las facilidades y autorización desinteresada para la traducción al español y la inserción de sus artículos en los Cuadernos de Formación. Los autores de los originales no son, en ningún caso, responsables de la absoluta fidelidad en la traducción de los mismos.
1. Citomegalovirus (CMV)
2. Virus de la rubéola
3. Parvovirus B19
4. Virus de la Varicela Zoster (VZV)
5. Virus Herpes Simplex (HSV)
6. Virus de la Inmunodeficiencia Humana (VIH)
7. Virus de la hepatitis B (VHB)
8. Virus de la hepatitis C (VHC)
9. Conclusiones
Resumen
Diferentes virus se pueden transmitir de una mujer embarazada a su hijo y ser el origen de anomalías congénitas, afecciones del recién nacido o de consecuencias posnatales en el niño diferidas algunos meses o años. La respuesta embrio-fetal a una infección vertical varía según el virus en cuestión o según el momento del embarazo en el que aparece la infección. Los principales virus responsables de infecciones adquiridas in utero son: citomegalovirus, virus de la rubéola, parvovirus B19 y el virus de la Varicela Zoster. Otros virus infectan al niño preferentemente en el momento del parto, como los virus Herpes Simplex, VIH, y virus de las hepatitis B y C (Tabla I). Las circunstancias del diagnóstico de infección materna o fetal varían según el agente infeccioso: cribado sistemático obligatorio o recomendado, comprobación de signos clínicos maternos evocadores o de anomalías ecográficas. Las técnicas diagnósticas actuales a disposición del clínico han experimentado desarrollos recientes e importantes. Finalmente, el abordaje de las infecciones virales materno-fetales, a menudo difícil, se basa en la evaluación de los riesgos sufridos por el feto y la debe ser realizada por un equipo pluridisciplinario que tenga la calificación necesaria.
PLAN
1. Citomegalovirus (CMV)
2. Virus de la rubéola
3. Parvovirus B19
4. Virus de la Varicela Zoster (VZV)
5. Virus Herpes Simplex (HSV)
6. Virus de la inmunodeficiencia humana (VIH)
7. Virus de la hepatitis B (VHB)
8. Virus de la hepatitis C (VHC)
Las infecciones materno-fetales más frecuentemente observadas se deben a citomegalovirus, virus de la rubéola, parvovirus B19, virus de la Varicela Zoster, Herpes Simplex, VIH, VHB y VHC. Las Tablas I y II indican las características principales de estas infecciones.
Tabla I. Principales virus responsables de infecciones adquiridas in utero y en el parto.
Tabla II. Características generales de las principales infecciones virales responsables de infecciones adquiridas in utero y en el parto.
1. Citomegalovirus (CMV)
EPIDEMIOLOGÍA Y PATOGENIA
El citomegalovirus (CMV) es un virus con cubierta de ADN, perteneciente a la familia Herpes viridae. Es la principal causa de deficiencias neurosensoriales que siguen a una infección congénita. En efecto, se considera que las infecciones por CMV representan la primera causa de infección congénita y que afectan cada año a cerca de 1.300 recién nacidos (o sea, el 1%) que habría adquirido una infección por CMV in utero.
Globalmente, en Francia, el 50% de las mujeres en edad de procrear están expuestas en primer lugar al riesgo de infección por CMV, pero la prevalencia varía con el nivel socioeconómico, edad, profesión, pareja y origen étnico. Las mujeres más expuestas son las mujeres seronegativas que trabajan en contacto con niños pequeños o tienen un primer niño en una guardería, porque la circulación de este virus es extremadamente frecuente en las colectividades de niños de muy corta edad. La transmisión se efectúa sólo por contactos estrechos de individuo a individuo (a partir de la orina, secreciones orofaríngeas, leche, lágrimas, secreciones genitales...). Por tanto, las mujeres embarazadas seronegativas deben evitar, en lo posible, lo contactos estrechos con niños de corta edad y tomar ciertas precauciones higiénicas que permitirán reducir significativamente el riesgo de infección por CMV en el curso de su embarazo. Las parejas de estas mujeres también deben seguir las mismas recomendaciones (Tabla III).
Tabla III. Consejos de prevención de primoinfección por citomegalovirus en el embarazo (según F. Audibert, Hôpital Antoine Béclère y la opinión del Consejo Superior de Higiene Pública de Francia).
Corrientemente se admite que el riesgo de transmisión materno-fetal de CMV es consecuencia mayoritariamente de una primoinfección materna (Tabla II). La incidencia de la primoinfección durante el embarazo varía entre el 0,5 y 2%.
Del 30 al 50% de estas mujeres transmitirán el virus a su hijo (1) principalmente por vía hemato-placentaria en ocasión de la viremia materna concomitante a la primoinfección. Del mismo modo, pero en menor medida, el feto puede infectarse en respuesta a una reactivación (reaparición de producción viral) o a una posible reinfección de la madre por una nueva cepa. Se considera que del 10 al 30% de las mujeres excretarán el virus en el curso de su embarazo y que cerca del 0,2% de los niños nacidos de madre seropositiva antes de su embarazo serían infectados en el nacimiento (1). Finalmente, el período neonatal es un período de alto riesgo de contagio (por las secreciones cérvico-vaginales, leche materna, contactos próximos), pero no le siguen secuelas neurológicas. Esta infección perinatal es muy frecuente; del 12 al 15% de los recién nacidos con viruria negativa la contraen durante el primer mes de vida.
1.2. CUADRO CLÍNICO
La primoinfección por CMV en la mujer embarazada raramente es sintomática. En menos del 10% de los casos se manifiesta por un síndrome pseudogripal o mononuclear.
Si bien el riesgo de transmisión al feto varía globalmente entre el 30 y 50% en el curso del embarazo, es cada vez mayor con el avance del mismo: 36% el 1er trimestre, 45% el 2º trimestre y 77% el 3er trimestre (Figura 1). Las consecuencias de una infección fetal son variables, pero clásicamente más severas después de una primoinfección materna que después de una reactivación o una reinfección.

Figura 1. Transmisión al feto en caso de primoinfección materna.
El riesgo de secuelas en el feto es máximo (36%) cuando la primoinfección materna sobreviene en el 1er trimestre y menor cuando aparece más tarde: el 25% en el 2º trimestre y el 8% en el 3º (Figura 2) (2). La infección materna durante el último trimestre del embarazo puede, en efecto, ser dañina para el feto, manifestándose como microcefalia, déficits de audición y afecciones neurológicas menores. Sin embargo, es en la primoinfección materna precoz en el curso del embarazo donde se observan las afecciones fetales más graves, que se manifiestan por la enfermedad de las inclusiones citomegálicas (EIC). La EIC es la consecuencia de una replicación viral en los órganos vitales fetales que remite espontáneamente, pero induce daños que pueden persistir y ocasionar secuelas graves a largo plazo. Se observan afecciones severas del sistema nervioso central (SNC), clásicamente imágenes características de calcificaciones intracraneales y anomalías de la mielinización. Si el embarazo llega a término, el niño presentará la mayoría de las veces al nacimiento hipotrofia, hipotonía, hepatoesplenomegalia, y a veces trastornos del ritmo respiratorio y de la hemostasis. Del 10 al 20% de los niños que presentan un cuadro de EIC, fallecerán en las primeras semanas de vida y entre los sobrevivientes, del 80 al 90% desarrollarán secuelas neurosensoriales con retraso psicomotor. En Francia, estas cifras usualmente aparecidas en la literatura sobreestiman la realidad. En efecto, las situaciones en las que subsiste la duda en cuanto al pronóstico de lesiones gravísimas, se presentan raras veces si el embarazo es correctamente seguido y, más particularmente, cuando este control se efectúa en un centro especializado (lo que debería ser siempre el caso, cuando se ha comprobado seroconversión materna o infección fetal por CMV). La mejora de la resolución de la IRM ha permitido disminuir el número de casos, en los que no se podía apreciar la gravedad de la afección neurológica. La flexibilidad en cuanto al plazo de recurso a la interrupción médica del embarazo en Francia también contribuye a disminuir drásticamente el número de recién nacidos afectados la EIC.

Figura 2. Signos clínicos en la transmisión materno-fetal.
Al margen de este cuadro gravísimo y afortunadamente cada vez más raro, se considera que en más del 90% de los casos la infección congénita por CMV es asintomática al nacimiento. En las ecografías se comprueba ocasionalmente un retroceso del crecimiento uterino. Sin embargo, en estos niños es indispensable una vigilancia clínica, ya que del 5 al 10% de los niños con estas formas inicialmente silenciosas desarrollarán secuelas sensoriales, la mayoría de las veces de tipo sordera. Parcial o total, esta sordera puede no manifestarse en el nacimiento y desarrollarse posteriormente en los primeros años de vida.
1.3. DIAGNÓSTICO VIROLÓGICO
"Teniendo en cuenta algunas lagunas sobre la historia natural de la enfermedad (frecuencia de infecciones secundarias en la madre y consecuencias para el feto y el niño, incidencia de secuelas tardías), la ausencia de tratamientos preventivos o curativos en la madre y los riesgos (complicaciones de la amniocentesis, mayor número de peticiones de interrupción del embarazo, ansiedad), en 2004 no se recomienda el cribado sistemático de CMV en las mujeres embarazadas o el tamizado selectivo de CMV en una población de riesgo. A las mujeres embarazadas se les debe informar sobre las medidas universales de higiene" (ANAES, septiembre de 2004).
La mayoría de las veces la infección por CMV es asintomática. El cribado sistemático de la infección durante el embarazo no está recomendado actualmente y sólo se pueden indicar las medidas de higiene (Tabla III) para disminuir la incidencia de las infecciones maternas por CMV. La consecuencia principal del conjunto de estos factores es que las numerosas infecciones por CMV en el curso del embarazo pasan inadvertidas. Sin embargo, se practica a menudo una búsqueda de lgG a principios del embarazo, con el fin de determinar el estado serológico materno. Según las recomendaciones, los medios diagnósticos de infección por CMV se ponen en práctica al constatar anomalías ecográficas. Según el momento del embarazo en el que se sospecha una primoinfección materna o una infección fetal, se pueden indicar diferentes herramientas diagnósticas.
En principio, el diagnóstico se basa en la serología materna (3). La presencia de lgG específicas confirma un contacto con el virus, pero la interpretación aislada de su título no es indicativo, en caso alguno, de la fecha de aparición de la primoinfección materna. En cuanto a la detección de IgM específica, necesariamente no se correlaciona con una infección reciente. En efecto, incluso aunque se evidencien en prácticamente todas las primoinfecciones recientes, la utilización de técnicas cada vez más sensibles, permite igualmente detectar IgM específicas en el curso de infecciones secundarias o en ocasión de otra infección evolutiva, que conlleva una estimulación policlonal del sistema inmunitario. Por tanto, es necesario medir la avidez de las IgG específicas y el estudio comparativo con los sueros anteriores o posteriores, para precisar el carácter eventualmente posconceptional de la infección. A principios de la infección, el índice de avidez de la lgG es bajo y cuanto más se aleje del principio de la infección, más alto es este índice. Sin embargo, el valor del índice de avidez no siempre es fácil de interpretar, ya que no sólo es función de la antigüedad de la infección, sino también de los pacientes estudiados y de las técnicas utilizadas.
Actualmente, es casi imposible establecer el diagnóstico de una reinfección o de una reactivación de CMV en la mujer embarazada. En efecto, si corrientemente se admite que el aumento de las lgG específicas (en presencia o en ausencia de lgM específicas) en una mujer inmunizada antes de su embarazo (o la mayoría de las veces, a principios de embarazo) confirma una infección secundaria, esta situación también se encuentra, y ciertamente con mucha más frecuencia, en las estimulaciones policlonales no específicas del sistema inmunitario. En este caso, la medida de la avidez no es contributiva al estar alta en todos los casos.
La viremia y la viruria maternas no son buenas herramientas para el diagnóstico de primoinfección por CMV, ya que son positivas la mayoría de las veces en las reactivaciones que, salvo en casos muy raros, no causan infecciones congénitas sintomáticas.
El diagnóstico prenatal está indicado en caso de signos ecográficos evocadores de infección por CMV, tales como retraso de crecimiento intrauterino, dilataciones ventriculares con calcificaciones periventriculares, oligoamnios, hidrocefalia o hiperecogenicidad intestinal y si la serología materna es positiva (es decir, presencia de lgG específicas con o sin IgM, porque las IgM específicas pueden haber desaparecido cuando se constatan las anomalías ecográficas). El diagnóstico prenatal se basa en la búsqueda del ADN viral por PCR en el líquido amniótico (LA). La especificidad de esta prueba es próxima al 100% y su sensibilidad superior al 95% si la amniocentesis se hace al menos 6 semanas después de la seroconversión materna y de la 22ª semana de amenorrea, después de haberse asegurado que la mujer ya no está virémica (antigenemia o hemocultivo negativo) con el fin de no contaminar el feto en el curso de la amniocentesis.
La búsqueda del genoma viral es constantemente positiva si el CMV es responsable de las anomalías ecográficas observadas. Sin embargo, aunque la detección del CMV en LA se correlaciona estrechamente con la infección fetal (el valor predictivo positivo del diagnóstico prenatal es casi del 100%), su presencia no prejuzga en absoluto el grado de la afección clínica del feto ni la importancia de las afecciones viscerales. En cambio, al ser muy variable el lapso entre la primoinfección materna y la afección fetal, un resultado negativo no puede excluir una infección fetal y se puede considerar una segunda búsqueda 3 ó 4 semanas más tarde. Es muy difícil actualmente evaluar el riesgo fetal, porque no existen parámetros fiables para hacer la distinción entre un feto infectado y un feto clínicamente afectado. En efecto, la normalidad de los exámenes ecográficos y biodiagnósticos no es suficiente para asegurar la ausencia de fetopatía.
Algunos estudios realizados sobre el valor sintomático de la cuantificación del ADN del CMV en LA de fetos infectados, muestran que la asociación carga viral/evolución sigue siendo una hipótesis muy controvertida y parece difícil de momento fijar un umbral de carga viral más allá del cual la infección fetal sea considerada como severa o por debajo del cual el riesgo fetal de secuelas sea casi nulo. Además, se ha demostrado que la carga viral en el LA estaba influida por más parámetros que el estado clínico del feto y, particularmente, el momento del embarazo o el lapso entre la seroconversión y la punción sin que se pueda establecer una correlación entre la carga viral y estos parámetros (4-6).
La indicación de diagnóstico prenatal, en respuesta a una primoinfección materna sin signos ecográficos, es controvertida en la medida en que están aún en evaluación los tratamientos posibles en caso de resultado positivo en LA y, por ende, de infección fetal, considerando que el riesgo de amniocentesis no es nulo.
La punción de sangre fetal para investigar las IgM o el ADN viral no está recomendada, porque cualquiera que fuere la técnica utilizada no permite detectar la infección por CMV con sensibilidad suficiente.
Al nacimiento, la búsqueda de IgM en sangre del recién nacido es positiva sólo en la mitad de las infecciones congénitas por CMV (1). Más corrientemente, la búsqueda de CMV se efectúa por cultivo o por PCR en la orina. Es un examen de una excelente sensibilidad y especificidad si el muestreo se efectúa en los 10 días que siguen al parto. La toma de muestra de saliva puede revelarse más práctica de realizar, pero la sensibilidad y el momento del muestreo no están definidos, como sucede para el examen urinario. La búsqueda del virus es también posible en el LCR o en diferentes órganos o fluidos según el contexto clínico.
Al ser muy frecuentes las infecciones perinatales, cuando se constatan las anomalías (particularmente, la sordera) varios meses después del nacimiento, ni la serología ni la detección del virus en la orina permiten incriminar a CMV como el agente responsable de estas anomalías. Se ha publicado que una búsqueda del genoma viral en la sangre tomada en el nacimiento sobre la tarjeta de Guthrie permitiría hacer un diagnóstico retrospectivo de infección congénita por CMV. Están en curso estudios complementarios para confirmar estos resultados.
1.4. ABORDAJE
El abordaje de la infección por CMV en la mujer embarazada es un problema complejo, concretamente porque no existe, por el momento, tratamiento eficaz y desprovisto de efectos secundarios que se pueda administrar en el embarazo. Se están haciendo algunos ensayos clínicos que evalúan la eficacia virológica de Valaciclovir(r) y, recientemente, unos autores publicaron un estudio preliminar según el cual la inyección de inmunoglobulinas sería eficaz en la prevención y tratamiento de la infección fetal por CMV (7)(8). Cuando se diagnostica con certeza una primoinfección materna por CMV, el feto debe ser objeto de una vigilancia ecográfica morfológica estrecha y repetida, en un centro especializado en medicina fetal porque este examen es perfecto para detectar las afecciones fetales; además, la evolución de los signos ecográficos tiene un buen valor pronóstico. Finalmente, los niños asintomáticos que excretan el virus en su orina en los primeros días de vida deben ser objeto de una vigilancia clínica atenta (fondo de ojo, exámenes auditivos...) hasta los 6 años.

2. Virus de la rubéola
2.1. EPIDEMIOLOGÍA Y PATOGENIA
El virus de la rubéola es un virus a ARN capsulado cuyo único reservorio conocido es el hombre. El período de contagio se extiende, aproximadamente, desde 8 días anteriores (principio de una viremia detectable) hasta 8 días después de la erupción, efectuándose la transmisión por vía respiratoria en contactos estrechos entre individuos. Las mujeres son las más expuestas al riesgo de rubéola ya que están más en contacto con niños chicos y porque se trata de una enfermedad cosmopolita y endémica, responsable de epidemias en las guarderías infantiles y escuelas. Desde finales de los años 60 una vacuna, muy eficaz y casi desprovista de efectos secundarios, hizo caer de modo importante la incidencia de la rubéola en los países desarrollados que instauraron un programa de vacunación (en Francia, más del 95% de las mujeres en edad de procrear son seropositivas para el virus de la rubéola). En cambio, en ciertos países en vías de desarrollo, el virus continua circulando de modo inquietante. En la India, por ejemplo, según las regiones, hasta el 45% de las mujeres en edad de procrear son seronegativas para el virus de la rubéola, y más próximo a nosotros, el número importante de casos de rubéola congénita en Europa central y en Europa del este debe incitarnos a permanecer alerta. En efecto, a pesar de la vacunación, subsisten en Francia 5% de mujeres susceptibles de hacer una primoinfección rubeólica durante el embarazo. La incidencia de la rubéola varía en relación con la edad, pero igualmente, según la zona geográfica de origen y en particular de su política de vacunación.
El riesgo de infección fetal es variable según el momento del embarazo en el que aparece la primoinfección materna (Tabla II). Es muy elevado cuando la primoinfección rubéolica materna sucede antes de la semana 12 (90%), progresivamente disminuye hasta la semana 25 (25%), luego aumenta de nuevo en el 3er trimestre (100% al final de embarazo) (Figura 1).
El riesgo de anomalías congénitas es muy elevado (70 al 100%) cuando la primoinfección materna aparece antes de la semana 12. Este riesgo disminuye y luego casi se hace nulo cuando la infección materna sobreviene después de la semana 20 (Figura 2). La erupción es contemporánea de la aparición de los anticuerpos y, contrariamente a la infección por CMV, la infección preconcepción (si la concepción se efectuó después de la erupción) no parece ser el origen de rubéola congénita malformativa (9).
Se han descrito casos de rubéola congénita malformativa en respuesta a una reinfección materna, pero su frecuencia, sin duda extremadamente débil, no es conocida.
2.2. CUADRO CLÍNICO
Fuera del contexto del embarazo, la infección rubeólica apenas ocasiona complicaciones y cursa en general, sin secuelas. Los signos clínicos, cuando están presentes (50% de los casos), aparecen generalmente después de un período de incubación de 13 a 20 días y clásicamente, se caracterizan por poliadenopatías (pudiendo durar 3 semanas) asociadas a erupción máculo-papulosa que se presenta en la cara, antes de extenderse rápidamente al resto del cuerpo y de desaparecer en 2 ó 3 días. Sin embargo, en el 50% de las infecciones rubeólicas la erupción está ausente y la erupción rubeoliforme se debe al virus de la rubéola sólo en el 50% de los casos. Artralgias, persistiendo raramente más de algunos días, son la complicación más común de esta infección. Otras complicaciones son mucho más raras: encefalitis (de pronóstico bastante favorable), trombopenia... La inmunidad en respuesta a la primoinfección rubeólica es duradera y eficaz.
Al cuadro clínico benigno de la rubéola que aparece en ausencia de embarazo se opone la primoinfección rubeólica que acaece en el curso del embarazo, que puede engendrar una infección in utero crónica grave y ser responsable de la muerte fetal in utero. Cuando el embarazo prosigue, se observa frecuentemente un retraso intrauterino asociado a grados variables de fetopatía, malformaciones fetales o desórdenes autoinmunes. La fetopatía se caracteriza por hepatoesplenomegalia, púrpura trombopénica, anemia hemolítica, acompañadas a veces por neumopatía intersticial o por encefalitis. En la radiografía, se puede observar una transparencia anormal de los huesos en forma de bandas claras metafisarias. Estos signos pueden retroceder. En cambio, las malformaciones que esencialmente afectan corazón, oído interno, ojo y SNC serán irreversibles. Las malformaciones cardíacas observadas son, la mayoría de las veces, persistencia del canal arterial o hipoplasia de la arteria pulmonar. La afección del oído interno, anomalía más frecuentemente encontrada, comporta sordera uni o bilateral parcial o total, que puede desarrollarse tardíamente tras el nacimiento. Las malformaciones oculares principalmente se manifiestan en forma de catarata, retinopatía y microftalmia (10). Las secuelas psíquicas, por sí mismas, son menos frecuentes que en el curso de las infecciones congénitas por CMV. La manifestación más corriente del desarrollo tardío de un desorden autoinmune, en respuesta a una rubeola congénita, es el desarrollo de una diabetes insulinodependiente de tipo 1. En las epidemias, también se han observado en los niños afectados por rubeola congénita desórdenes tiroideos y desarrollo ulterior de menopausias precoces.
La reinfección materna por virus de la rubeola es raramente peligrosa para el feto; no se ha descrito caso alguno después de la semana 12.
2.3. DIAGNÓSTICO VIROLÓGICO
La búsqueda de IgG específicas del virus de la rubeola está justificada en toda mujer en edad de procrear de la que se ignora su estado inmunitario, con el fin de vacunar a las que fuesen seronegativas. Sea como fuere, la vacuna puede ser administrada en todos los sujetos, cualquiera que sea su estado inmunitario. En ausencia de resultados escritos que prueben que la mujer embarazada está inmunizada, el decreto n°92-143 del 14 de febrero de 1992 estipula que la determinación de anticuerpos específicos del virus de la rubeola debe ser efectuada en la primera consulta prenatal. Es obligatoria una única serología (IgG), que tiene por objeto determinar el estado inmunitario de la paciente.
El diagnóstico de infección rubeólica materna esencialmente se basa en la serología y, consiguientemente, en el conocimiento de la cinética de los anticuerpos (11)(12). Las IgM aparecen en el momento de la erupción (a saber, a unos 15 días luego del contagio), y desaparecen en general en 2 ó 3 meses como máximo. Gracias a las técnicas sensibles que se utilizan hoy día, las IgM específicas prácticamente se detectan siempre en el curso de primoinfecciones recientes (datando menos de 2 meses), pero pueden igualmente ser detectadas en otras circunstancias mucho más frecuentes que en una primoinfección rubeólica verdadera. Las IgM aparecen un poco más tardíamente y alcanzan una meseta en algunas semanas. Un título estable de IgG, no excluye una primoinfección reciente. El título máximo, así como el título residual de IgG varía de un individuo a otro. Un título elevado de IgG no es, por tanto, un marcador de primoinfección reciente. Las IgG, siempre presentes con los signos clínicos, persisten en general más tiempo que las IgM. La ausencia de lgA puede pues ayudar a excluir una primoinfección rubeólica reciente. Sin embargo, en una reinfección, las lgG aumentan y las IgM, así como las IgA, pueden reaparecer. Por consiguiente, es difícil diferenciar primoinfección, reinfección rubeólica y estimulación policlonal del sistema inmunitario, con la sola detección de los anticuerpos. Es entonces cuando está indicada la medida de la avidez de las lgG específicas, practicada en laboratorios cualificados. En efecto, las lgG sintetizadas en el curso de la primoinfección tienen una avidez débil, mientras que las IgG sintetizadas alejadas de esa primoinfección (en general más de 3 meses) tienen una avidez fuerte. Sin embargo, las IgG específicas del virus de la rubeola "maduran" mucho más rápidamente que las lgG específicas de CMV, por ejemplo, y un índice elevado no permite diferenciar categóricamente una infección rubeólica semireciente (2 a 3 meses) de una infección más antigua.
En respuesta a la vacunación la cinética de los anticuerpos está perturbada, ya que las IgM pueden persistir varios años después de la vacunación pero a títulos habitualmente débiles y sobre todo estables, lo que no es el caso que sigue a una primoinfección. Además, después de la vacunación, la avidez "madura" más lentamente que después de infección natural y a menudo se estabiliza a niveles de índice medio.
Tres situaciones deben llevar a investigar una primoinfección rubeólica en una mujer embarazada:
1. En el contagio, hay que obtener una muestra lo más rápidamente posible (en los 10 días siguientes al contagio) en busca de IgG específicas. Si están presentes desde este período, entonces la mujer previamente fue inmunizada contra la rubeola y el riesgo de primoinfección es excluido. En ausencia de lgG en esta primera muestra, se debe analizar una segunda muestra al menos de 3 a 4 semanas después del contagio. Si las lgG no aparecieran, entonces la mujer no ha sido contaminada. Si las IgG aparecen, entonces probablemente se trata de una seroconversión que será confirmada por la búsqueda de IgM específicas y, eventualmente, por la medida del índice de avidez de las IgG. En efecto, una aparente seroconversión puede corresponder a veces a un título débil de lgG (por debajo del umbral de positividad de la técnica utilizada) en la primera muestra, que aumenta en respuesta a reinfección rubeólica o en respuesta a estimulación no específica del sistema inmunitario, relacionada con otra causa infecciosa.
2. En caso de erupción, hay que efectuar una búsqueda de lgG y una búsqueda de IgM, así como, eventualmente, una medida del índice de avidez del lgG.
3. Cuando se detecta, con ocasión de un examen sistemático, una variación significativa del título de anticuerpos, hay que completar este examen con la búsqueda de las IgM específicas y, eventualmente, con la medida del índice de avidez de las lgG.
En el marco del embarazo, la detección sistemática simultánea de lgG e IgM no figura en la nomenclatura de los actos analítico-clínicos por 3 razones:
1. La incidencia muy baja de la infección rubeólica en la mujer embarazada en Francia;
2. El hecho de que la mayoría de estas infecciones se declaran en un contexto clínico evocador (contagio o signos clínicos);
3. La frecuencia de detección de las IgM específicas de la rubeola en ausencia de primoinfección rubeólica.
Se dispone de varios algoritmos de decisión para ayudar a la interpretación de los resultados de las serologías rubeólicas (véase el cuadro "Para recordar") según que se hagan a título sistemático o en respuesta a un contagio (Figura 3) (Figura 4).

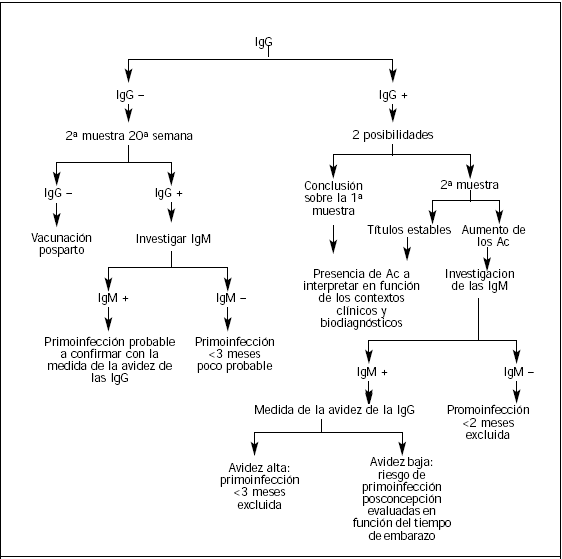
Figura 3. Algoritmo tras la serología sistemática de la rubéola.

Figura 4. Algoritmo en caso de contagio (CMB, rubéola, parvovirus B19, VZV).
El aislamiento del virus o la búsqueda del genoma viral por PCR es posible en muestras de garganta o de orina, pero debido a las dificultades prácticas de estos exámenes y a su carácter aleatorio, no se usan para el diagnóstico de la infección materna. El diagnóstico prenatal de infección rubeólica congénita está indicado sólo cuando la primoinfección materna sobreviene antes de la semana 20, ya que más allá los riesgos de malformaciones en el feto son casi nulos. Las muestras de sangre fetal o de LA se obtienen sólo a partir de la semana 22, y al menos 6 semanas después de la seroconversión materna. El diagnóstico se puede realizar por la detección de las IgM específicas y de las IgM totales en la sangre fetal (acto invasivo y arriesgado), por técnicas de immunocaptura muy sensibles, pero más usualmente hoy día por la búsqueda de ARN viral por PCR en una muestra de LA. La evidencia del genoma del virus de la rubeola es una técnica altamente específica y sensible (13), pero delicada y dependiente de condiciones muy rigurosas de transporte de la muestra (congelación obligatoria a -80 °C en el transcurso de la amniocentesis y transporte en nieve carbónica hasta el laboratorio que efectuará el análisis). La termosensibilidad del virus y la carga viral, a menudo baja en LA, pueden llevar a resultados falsamente negativos. Dada la importancia de las condiciones operatorias y la dificultad de su realización, esta técnica está reservada únicamente para los centros homologados para el diagnóstico prenatal. Es importante tener en cuenta que si la detección de ARN viral confirma una infección fetal, no es en caso alguno sinónimo de afección fetal.
El diagnóstico posnatal de la infección rubeólica congénita se basa en la detección de las IgM específicas en el recién nacido. Esta búsqueda simple, en el caso de la rubeola, es muy fiable hasta los 3 meses. La búsqueda del virus por cultivo o por PCR en las secreciones nasofaríngeas o la orina es posible, y particularmente mucho tiempo después el nacimiento, ya que la excreción del virus persiste durante meses (10). La medida de la avidez de las IgG en el niño no presenta interés. En efecto, justo después del nacimiento, la avidez medida es la de las lgG maternas, y se ha observado que la avidez de las lgG de los niños que tienen rubeola congénita "madura" mucho menos que cuando la infección rubeólica acontece después del nacimiento (14).
2.4. ABORDAJE
Ya sea en el curso del embarazo o al nacimiento, ningún antiviral es activo contra el virus de la rubeola. En Francia se dispone de gammaglobulinas polivalentes, pero su eficacia jamás se ha demostrado.
Cuando la infección materna ocurre antes de la semana 12, los riesgos de infección y de malformaciones fetales son muy importantes, lo que justifica proponer, a veces inmediatamente, una interrupción médica del embarazo. Sin embargo, si se practica un examen ecográfico detallado y una búsqueda de ARN viral en el líquido amniótico y se revelan negativos, el embarazo podrá seguir su curso. Cuando la infección materna sucede entre las semanas 12 y 18, la ayuda del diagnóstico prenatal es importante para evaluar la infección fetal, pero no permite predecir las malformaciones eventuales y congénitas consecutivas a la infección. Por otro lado, aparte de las afecciones cardíacas y a veces oculares, estas anomalías son difícilmente accesibles a la ecografía obstétrica. Además del examen pediátrico al nacimiento, se investigará particularmente la aparición de trastornos de la audición en los primeros años de vida. Pasada la semana 20, el riesgo de infección fetal permanece alto hasta el fin del embarazo, pero el riesgo de rubeola congénita es casi nulo. Pero se investigará la infección fetal al nacimiento. En efecto, en los niños que han contraído la infección rubeólica congénita el virus continúa replicándose y siendo excretado a veces mucho tiempo después el nacimiento y puede pues ser la causa de infecciones en sujetos en contacto con ellos, particularmente otros niños de su entorno que no hayan sido vacunados todavía. La búsqueda de una excreción viral se puede efectuar por cultivo y por PCR en diferentes líquidos biológicos (orina, saliva) y está desaconsejado llevar estos niños a la guardería, mientras la investigación del virus sea positiva.
Sólo la vacunación permitiría disminuir la incidencia de la rubeola y toda mujer seronegativa en edad de procrear debe ser vacunada. La vacunación rubeólica es muy eficaz, prácticamente privada de todo efecto secundario mayor y se administra por vía subcutánea en una sola inyección. Tratándose de una vacuna viva atenuada, no se debe administrar durante el embarazo y es corriente recomendar luego un período de contracepción de 2 meses; bien entendido que no se ha producido caso alguno de rubéola congénita en respuesta a una vacunación accidental durante el embarazo. En cambio, incluso cuando la cepa vacunal se haya detectado en la leche materna, la vacunación justo después del parto no contraindica la lactancia.
3. Parvovirus B19
3.1. EPIDEMIOLOGÍA Y PATOGENIA
El parvovirus B19 es un virus de ADN ubicuo, endémico, pero igualmente responsable de epidemias que sobrevienen cada 2 ó 3 años a finales de invierno y principios de primavera. La transmisión se efectúa por vía respiratoria y a su multiplicación en la rinofaringe le sigue una fuerte viremia. La evolución de la primoinfección es bifásica. A la incubación de 8 días le sigue una viremia importante que dura de 4 a 5 días (transmisible por vía hemática), en el curso de la cual aparecen signos no específicos, tales como fiebre y malestar general.
Luego, hacia el día 17º, sobrevienen eventualmente sarpullido y afecciones articulares.
En Francia se considera que del 40 al 60% de las mujeres en edad de procrear están inmunizadas (Tabla II). El riesgo de infección en caso de contagio es del 6 al 16 %, pero alcanza el 50% en el propio niño de la mujer embarazada (15). En caso de primoinfección, la probabilidad de paso transplacentario del virus es del 10 al 30%. Los riesgos de un anasarca fetoplacentario y de muerte fetal in utero, en caso de primoinfección materna, son respectivamente del 2,9 y 10% (Figura 1 y 2) (16).
3.2. CUADRO CLÍNICO
En el 70% de los casos de infección por parvovirus B19, el sujeto infectado permanece asintomático. Las manifestaciones clínicas, cuando están presentes, son poco específicas, del tipo de erupción, fiebre, sarpullido o artralgias. El retraso medio entre la aparición de los síntomas maternos y la aparición de anomalías fetales es de 6 semanas (puede ser de 1 a 16 semanas). El parvovirus B19 es esencialmente responsable de anemia fetal, que puede acabar en anasarca fetoplacentario y muerte fetal. La anemia fetal es a menudo severa (tasa media de hemoglobina: 5 g/dL) y asociada frecuentemente a trombopenia. La anasarca aparece más frecuentemente en el segundo trimestre del embarazo con un pico en la semana 22. En la ecografía, los signos de anasarca son derrames líquidos que interesan por lo menos dos espacios fetales (ascitis, derrame pleural o pericardíaco, edema subcutáneo) eventualmente asociados con aumento del espesor de la placenta, hidramnios o hepatomegalia (17). La ecografía revela también, a menudo, signos evocadores de una afección cardiaca. La cardiopatía fetal puede evolucionar independientemente, mientras que la anemia fetal es reabsorbida y es probablemente responsable de muertes in utero que sobrevienen cuando la anemia fetal se ha curado. El riesgo de aborto sería del 9% en caso de infección antes de la semana 20, pero más allá de la semana 20 no se ha descrito caso alguno de muerte fetal (9).
El parvovirus B19 no es un virus teratógeno y la gran mayoría de los fetos infectados que sobreviven al anasarca fetoplacentario se curan completamente sin secuelas.
3.3. DIAGNÓSTICO VIROLÓGICO
La infección por parvovirus B19 debe investigarse, en caso de contagio, en presencia de sintomatología evocadora (erupción, artralgias) o en caso de anomalías ecográficas. En caso de contagio en la mujer embarazada, se recomienda una detección serológica inmediata para evaluar su estado serológico (Figura 4, véase parágrafo 4.3). En presencia de lgG específicas la paciente puede estar segura, ya que se puede considerar que está inmunizada y el riesgo para el feto es casi nulo. En ausencia de lgG, una segunda determinación en una muestra obtenida 2 ó 3 semanas después del contagio permitirá observar una eventual seroconversión. En caso de seroconversión materna en el curso de los dos primeros trimestres de embarazo, es deseable que la paciente sea enviada a un centro especializado en diagnóstico prenatal.
En presencia de signos clínicos evocadores de una infección por parvovirus B19 en una mujer embarazada, se debe realizar una búsqueda de lgG e lgM. La ausencia de lgM significa que los signos clínicos no se deben al parvovirus B19.
Cuando se han constatado las anomalías ecográficas, la ausencia de lgM específicas en el suero materno no permite excluir una primoinfección posconcepción porque, incluso con pruebas serológicas sensibles, las IgM maternas devienen indetectables en el momento de la infección fetal en cerca del 25% de los casos (18). La detección del ADN vírico por PCR en la sangre de la madre, puede ayudar al diagnóstico de primoinfección materna. En general, esta detección es positiva en el primer mes que sigue a una primoinfección positiva y permanece positiva en más del 50% de los sujetos en el segundo mes, para luego disminuir progresivamente. El diagnóstico prenatal de la infección por parvovirus B19 debe hacerlo obligatoriamente un analista clínico calificado y se basa en evidenciar el ADN vírico por PCR en sangre fetal o en LA (19). La búsqueda de las IgM en sangre fetal es poco fiable, ya que las IgM específicas son fugaces o incluso indetectables en más de un tercio de los casos.
3.4. ABORDAJE
No tiene sentido el tamizado sistemático de la infección por parvovirus B19 durante el embarazo. En cambio, cuando se diagnostica una primoinfección materna por parvovirus B19 se deberá hacer una vigilancia ecográfica estrecha y semanal al menos durante 8 semanas. En caso de infección, la anemia fetal debe ser evaluada con la medida de la hemoglobina fetal, realizada en una muestra de sangre fetal. Generalmente, está indicada una exsanguinotransfusión cuando la tasa de hemoglobina fetal es inferior a 8 g/dL. El volumen de sangre transfundido (de 10 a 100 mL inyectados directamente en la vena umbilical) varía según el estado del feto y su tiempo de gestación. Se podrían necesitar varias transfusiones fetales. Este tratamiento mejora significativamente el pronóstico vital, ya que en ausencia de tratamiento, el índice de supervivencia varía del 10 al 40%, mientras que después de transfusiones la curación se logra en más del 75% de los casos (9).
Se admite que el riesgo de malformación de la infección por parvovirus B19 es despreciable; por tanto, una contaminación materna no justificaría una interrupción médica de embarazo.
4. Virus de la Varicela Zoster
4.1. EPIDEMIOLOGÍA Y PATOGENIA
VZV es un virus capsulado de ADN que pertenece a la familia Herpes viridae. La inmunidad a VZV se ha adquirido ya en el 90% de las mujeres en edad de procrear. En Francia, el riesgo de varicela en el embarazo es del 0,7 por 1.000 de los embarazos, por lo que se estima que anualmente habría 700 casos de varicela en embarazadas y menos de 5 casos de varicela congénita (Tabla II).
El período de incubación es por término medio de 15 días, durante los cuales aparecen los episodios de viremia que preceden a la erupción. La varicela es muy contagiosa, siendo la tasa de infección secundaria en una familia de aproximadamente el 70%. La transmisión tiene lugar a través de contactos directos entre individuos, desde 2 días antes de la erupción del sujeto contaminante hasta la cicatrización de las lesiones cutáneas. Cuando una persona del entorno padece un zoster, el riesgo infeccioso es inferior al 25%.
4.2. CUADRO CLÍNICO
Se distinguen 2 tipos de afecciones fetales que resultan de la infección congénita en la primera mitad del embarazo de una parte y de la infección perinatal, de otra (20).
La gravedad de la varicela en el embarazo reside en la posible aparición de una neumopatía varicélica severa en la mujer embarazada. Se manifiesta por tos, disnea, fiebre y aparece de 2 a 4 días (hasta 10 días) del principio de la erupción. La evolución clínica es imprevisible y puede progresar rápidamente hacia hipoxia e insuficiencia respiratoria. La radiografía pulmonar típicamente muestra un infiltrado difuso nodular o miliar. En caso de afección pulmonar, la mortalidad materna es aproximadamente del 10% (el nicotinismo es un factor agravante). Si la infección materna acontece antes de la semana 25, el riesgo de transmisión al feto es del 8 al 36% y el riesgo de varicela congénita es del orden del 1 al 3% (Figura 1 y 2). El VZV puede ser responsable de una fetopatía grave caracterizada por lesiones cutáneas, anomalías neurológicas (microcefalia, parálisis frénica o bulbar, vejiga neurológica), afecciones esqueléticas (hipoplasia de un miembro) y anomalías oculares (atrofia del nervio óptico, coriorretinitis). La contaminación fetal por VZV, a veces, puede no tener consecuencia u originar un zoster, la mayoría de las veces sin gravedad durante el primer año de vida.
En caso de varicela materna en los 8 días que preceden al parto, el riesgo de transmisión de VZV al recién nacido es próximo al 25%. El niño presenta entonces una varicela neonatal desde los 10 primeros días de vida, cuya gravedad depende de la fecha de la infección materna. El riesgo es máximo si la erupción materna ocurre entre los 5 días anteriores y los 2 posteriores al parto, porque el niño se contamina por vía hematógena transplacentaria, mientras que el parto precede al paso de los anticuerpos. El índice de mortalidad entonces es el más elevado, alcanzando del 20 al 30% y, de modo general, parece que la varicela del recién nacido sea tanto más severa cuanto más débil sea el título de anticuerpos maternos. En el recién nacido infectado, la varicela se caracteriza por erupción cutáneo-mucosa generalizada y las lesiones observadas son frecuentemente ulcero-necróticas o hemorrágicas. A veces, la erupción se acompaña de un afección pulmonar o visceral.
En caso de zoster materno, los riesgos para el feto son excepcionales en la medida en que la madre sea inmunocompetente.
4.3. DIAGNÓSTICO VIROLÓGICO
En caso de contagio, una serología realizada en los 10 días siguientes permitirá determinar el estado inmunitario de la mujer embarazada (Figura 4).
En presencia de lgG específicas, la paciente puede estar tranquila. En ausencia de lgG, una segunda determinación en una muestra tomada de 2 a 3 semanas más tarde permitirá observar una eventual seroconversión.
La erupción suele ser característica, pero en los casos dudosos se puede verificar con exámenes serológicos. La aparición de los anticuerpos específicos (IgM, luego lgG) se observa a los 2-5 días del principio de la erupción. En el caso de VZV, las técnicas de detección de las IgM son poco fiables.
Cuando se confirma una primoinfección materna antes de la semana 24, se desaconsejan las consultas en el servicio de maternidad, así como todo contacto con otras mujeres embarazadas. Las complicaciones pulmonares maternas se deben detectar por radiografía pulmonar. Se debe aumentar la vigilancia fetal con ecografías mensuales y un examen del cerebro fetal por RMN. Las anomalías ecográficas más a menudo descritas son retraso de crecimiento intrauterino, exceso de líquido amniótico o, más específicamente, hipoplasia de los miembros. Las anomalías subsiguientes a la infección congénita son en general visibles en la ecografía. Por ello, la tendencia actual no recomienda sistemáticamente la búsqueda del ADN viral por PCR en el LA. En caso de hacerla, el diagnóstico prenatal de la contaminación fetal por VZV es factible sólo 6 semanas después de la erupción materna (después de cicatrización de las lesiones y PCR VZV negativo en sangre materna), a partir de la semana 20, y debe hacerse obligatoriamente por un analista clínico calificado. La toma de sangre fetal en busca de las IgM no presenta interés, ya que su presencia es inconstante y no se correlaciona con la severidad de la afección fetal. En cambio, al nacimiento se hará un perfil neonatal completo, serológico, neurológico y oftalmológico.
El diagnóstico posnatal de la infección congénita es esencialmente clínico, ya que se basa en la observación de una erupción que la sugiera. Eventualmente, el examen clínico se podrá completar con la búsqueda de las lgM y la detección del ADN viral por PCR en el cultivo de muestras de las lesiones cutáneas.
4.4. ABORDAJE
Al ser alto el riesgo de contaminación, en caso de contagio por VZV en una mujer seronegativa se contemplará la conveniencia de un tratamiento profiláctico. Hay gammaglobulinas específicas disponibles con autorización temporal de utilización de la AFSSAPS (Varitect"). Provienen de una mezcla de sueros de personas inmunizadas y se deben administrar en las 48 horas que siguen al contagio. También se considerará la administración de antiherpéticos tales como Aciclovir".
En caso de erupción materna antes de la semana 24, se impondrá una vigilancia pneumológica estricta. En caso de complicación de la infección por VZV (neumopatía) en una mujer embarazada, está indicado Aciclovir por vía venosa, cualquiera que sea el tiempo de embarazo. La puesta en marcha precoz del tratamiento es beneficiosa para la madre y posiblemente para el niño, incluso aunque no exista en la actualidad algún argumento epidemiológico, que permita probar que este tratamiento disminuya el riesgo de transmisión materno-fetal o incluso la gravedad posterior de la afección fetal. Posteriormente se harán ecografías mensualmente en busca de signos evocadores de infección fetal.
En caso de erupción en la mujer embarazada próxima al término de su embarazo, se debe considerar un tratamiento antiviral materno, así como el abordaje específico del niño al nacimiento. Este nacimiento será, por otra parte, en la medida de lo posible retrasado con el fin de que no acontezca en los 5 días que siguen a la erupción y para que los anticuerpos maternos puedan ser transmitidos al feto. Se dispone de dos alternativas terapéuticas para el recién nacido: Aciclovir o las inmunoglobulinas anti-VZV, que han demostrado que disminuyen la severidad de la varicela neonatal (21).
Existe una vacuna de virus atenuado para la infección por VZV. Según la opinión del Consejo Superior de Higiene Pública de Francia (marzo de 2004), la vacunación generalizada de los niños a partir de 12 meses no está recomendada. En cambio, se aconseja vacunar a:
- Seronegativos adultos (salvo mujeres embarazadas) en los 3 días siguientes al contagio.
- Estudiantes de primer año de estudios médicos y paramédicos, así como a todo el personal sanitario no inmunizado, es decir, sin antecedentes de varicela y cuya serología sea negativa (lgG negativas).
Para intentar limitar la aparición de varicelas graves congénitas y neonatales se considerará la vacunación, antes de cualquier embarazo, de toda mujer seronegativa en edad de procrear.
5. Virus Herpes Simplex (HSV)
5.1. EPIDEMIOLOGÍA Y PATOGENIA
Aunque raro, el herpes neonatal es temible y representa un riesgo de infección gravísima para el recién nacido. Se debe siempre a herpes genital materno, afección que puede alcanzar al 10% de las mujeres fértiles. La inmensa mayoría de los herpes recurrentes genitales se deben a HSV2, pero los herpes genitales por HSV1 tienden a ser cada vez más frecuentes. El riesgo global de herpes neonatales es de 1/10.000 nacimientos, pero es de 1/1.000 en caso de antecedente de herpes genitales, del 2 al 5% en caso de afección genital por HSV1 o HSV2 en los días que preceden al parto y del 75% en caso de primoinfección materna en el último mes del embarazo (Tabla IV). La transmisión se efectúa la mayoría de las veces durante el parto, en el momento del paso del recién nacido por los genitales. En el 15% de los casos, el niño se infecta in utero o después del parto.
Tabla IV. Situación materna respecto a HSV.
5.2. CUADROS CLÍNICOS
La infección del recién nacido es casi siempre sintomática. Se distinguen 3 formas de herpes neonatales: formas diseminadas, formas localizadas en el SNC y las formas localizadas superficiales (piel, ojo, boca).
Las formas diseminadas se manifiestan en general desde la primera semana de vida por síntomas no específicos (negativa a beber, apnea, letargo...), pero a veces específicos en caso de afección del SNC (50% de formas diseminadas) tal como irritabilidad y convulsiones. El pronóstico, haya o no afectado al SNC, es catastrófico en ausencia de tratamiento: 80% de mortalidad y secuelas graves en más de la mitad de los supervivientes. Con Aciclovir o Vidarabina, el índice de mortalidad cae al 50%, aunque la mitad de los supervivientes sufre secuelas severas.
Las formas localizadas del SNC se manifiestan más tarde (de 11 días a 4 semanas después del nacimiento) por una meningoencefalitis. El pronóstico es también sombrío, ya que hasta con tratamiento, el riesgo de defunción o de secuelas graves es de cerca del 50%.
Las formas localizadas cutáneo-mucosas son las más características, pero raramente se dan aisladas (solamente el 10% de los casos); así, el 70% de los niños infectados comienzan la enfermedad por este tipo de afección, antes de completarla en forma generalizada o localizada al SNC. Bajo tratamiento específico, el 85% de los niños que presentan aisladamente el cuadro de una afección cutáneomucosa curarán sin secuelas. No obstante, el riesgo principal de esta forma localizada son las recidivas, que pueden manifestarse durante varios años.
5.3. DIAGNÓSTICO VIROLÓGICO
En la medida en que los antivirales disponibles limitan la progresión de la infección hacia el SNC y la diseminación, modifican de manera distinta el pronóstico de la infección herpética neonatal. Un diagnóstico rápido permitirá, pues, la instauración precoz del tratamiento.
La técnica más fiable sigue siendo la búsqueda del virus por cultivo o por PCR en muestras de las lesiones genitales de la mujer embarazada. En caso de antecedentes de herpes genitales, se deben tomar muestras de la vulva o del cuello uterino algunos días antes del parto en busca de una excreción viral asintomática. Al ser frágil el virus herpes, conviene obtener las muestras antes de la aplicación de un desinfectante y ponerlas inmediatamente en un medio de transporte adecuado antes de su envío al laboratorio que realizará los análisis.
El biodiagnóstico de meningoencefalitis se realiza investigando por PCR el ADN viral en el LCR del recién nacido. En presencia de lesiones cutáneo-mucosas, el virus puede ser buscado por PCR o por cultivo de las muestras de las serosidades de estas lesiones.
Es posible realizar serologías específicas de tipo, pero las prestaciones de las pruebas utilizadas varían en su sensibilidad y especificidad; por otra parte, el plazo de aparición de los anticuerpos puede variar de 3 semanas a 3 meses. Además, la búsqueda de los anticuerpos específicos no presenta interés para el diagnóstico de las infecciones genitales.
5.4. ABORDAJE
En la primoinfección durante el embarazo, se instaurará un tratamiento a base de Aciclovir o Valaciclovir por vía oral o eventualmente por vía venosa en las formas más severas. Si el parto tiene lugar en las 3 semanas que siguen a la primoinfección, se deberá practicar cesárea. En caso de antecedentes de herpes genitales sin recidivas durante el embarazo, se hará un examen minucioso del cuello y del periné al término de embarazo en busca de lesiones. Si hay riesgo de recidiva durante el embarazo, se puede instaurar un tratamiento para evitar las recidivas próximas al término y tomar muestras "a ciegas" del cuello uterino en busca del virus, para complementar el examen clínico al principio del trabajo. En estos dos casos y en ausencia de lesiones evocadoras, el parto puede efectuarse por vía baja. Si se ha señalado u observado una recurrencia de herpes genitales próximos al término del embarazo, está indicado un tratamiento de la madre por vía oral. La cesárea se recomienda en caso de lesiones en el momento del parto.
El tratamiento de los herpes neonatales declarados se basa en la administración urgente de Adenin-arabinósido (Vira-A) o Aciclovir (Zovirax®) por vía venosa, en dosis de 10 mg/por kg, cada 8 horas durante 10 a 14 días. Aún no se ha evaluado el tratamiento de consolidación con Aciclovir por vía oral, con vistas a disminuir la incidencia de reinfecciones después del tratamiento (Tabla IV).

6. Virus de la inmunodeficiencia humana
Parece que el embarazo no agrava la evolución natural de la infección por VIH en pacientes asintomáticos sin déficit inmunitario franco. Por otro lado, el VIH no aumenta la tasa de malformaciones y sólo la premadurez y la hipotrofia fetal parecen aumentadas en las mujeres seropositivas. No existen signos específicos de infección al nacimiento y a los niños nacidos de madres seropositivas se les hace un estudio virológico precoz, que se practicará en un centro especializado debido a su complejidad. En Francia, la serología VIH se hace sistemáticamente a principios del embarazo. El diagnóstico de infección por VIH puede ser problemático, particularmente si la mujer embarazada está infectada por un virus diferente del VIH-1 clásico. Si el virus está presente en la sangre y fluidos biológicos de toda persona infectada, está particularmente presente en las secreciones vaginales. Los intercambios sanguíneos feto-maternos pueden ser la causa de algunos contagios, la mayoría de las veces en las últimas semanas de embarazo, aunque más de 2/3 de los niños se infectan en el momento del nacimiento, durante el paso por el canal genital. Globalmente, en ausencia de tratamiento el riesgo de transmisión del virus durante el embarazo es del orden del 20%, pero este riesgo está correlacionado estrechamente con la carga viral materna (Tabla II). Bajar la carga viral gracias a asociaciones antirretrovirales disminuye muy significativamente la transmisión materno-fetal del VIH y en los países desarrollados, el tratamiento de las mujeres embarazadas seropositivas por VIH está generalizado (22). En la medida de lo posible, en caso de indicación materna durante el embarazo, el tratamiento antirretroviral (la mayoría de las veces AZT + 3TC + Saquinavir o Nelfinavir) se instaura sólo después de la semana 12. En ausencia de indicación materna (mujer embarazada asintomática con un número de CD4>350), la asociación antirretroviral se puede administrar a partir del 3º trimestre. Bajo tratamiento, la transmisión vertical del VIH actualmente es inferior al 1%. El parto por cesárea no está indicado si la carga viral es indetectable al término del embarazo. La cesárea está recomendada si la carga viral es detectable al final de embarazo o en un tratamiento preventivo por AZT en monoterapia. Durante el parto, un tratamiento poco costoso a base de Nevirapina en monodosis para la madre al principio de la intervención y al nacimiento para el recién nacido disminuye la transmisión del VIH. Finalmente, la lactancia, al ser causa de infecciones tardías, está contraindicada en los países desarrollados.
7. Virus de la hepatitis B
Francia es una zona de baja endemia de infección por el VHB, ya que menos de 20% de la población francesa ha estado en contacto con VHB y hay menos del 2% de portadores crónicos del virus (sujetos portadores crónicos del antígeno HBs) (Tabla II). La infección afecta, la mayoría de las veces, a los adultos jóvenes (influencia de factores étnicos y socioeconómicos) y la incidencia anual de la infección se estima en el adulto en 20.000 infecciones al año, de los que de 1.000 a 2.000 son portadores crónicos. La transmisión madre-hijo es el modo de transmisión por excelencia de infección crónica, ya que más de 80% de los niños infectados al nacimiento desarrollarán una hepatitis B crónica, con riesgo de evolución posterior hacia la cirrosis hepática y carcinoma hepatocelular. En ausencia de medidas preventivas, habría en Francia 1.500 recién nacidos anualmente afectados por infección crónica por VHB. La transmisión in utero es excepcional, mientras que el riesgo de transmisión es elevado en el momento del nacimiento, al igual que en el periodo posnatal. Este riesgo es aún más elevado si la madre es portadora del antígeno HBe, ya que en estos casos la tasa de transmisión es del 70 al 90% de los recién nacidos y el 90% de estos recién nacidos serán portadores crónicos de VHB. Cuando la madre no posee el antígeno HBe, el riesgo de transmisión al niño no es mayor del 10%, de los que del 10 al 15% se harán portadores crónicos del VHB.
El diagnóstico de la infección materna se basa en la serología (Ag HBs, Ac anti-HBc, Ac anti-HBs, Ag HBe, Ac anti-HBe) y eventualmente la búsqueda del genoma viral en el suero. La contaminación del niño se confirma con la detección de Ag HBs o del ADN viral, pero estos 2 parámetros pueden persistir o desaparecer al nacimiento. La interpretación de las serologías del niño nacido de madre portadora crónica del antígeno HBs y serovacunada es a veces delicada, lo que impone un control durante el primer año de vida. Actualmente, en Francia la determinación de Ag HBs es obligatoria en el 6º mes de embarazo, porque existe la posibilidad de prevenir la infección con la administración de inmunoglobulina anti-HBs y de vacuna en las primeras horas que siguen el nacimiento. Esta serovacunación será seguida por una vacunacion"clásica" (en M1 y M6) con el fin de instaurar una protección duradera y prevenir las infecciones crónicas. En caso de carga viral elevada o hepatitis aguda al final del embarazo, se puede considerar un tratamiento por Lamivudina a partir de la semana 34. Este tratamiento no modifica la serovacunación del niño al nacimiento.
8. Virus de la hepatitis C
El tamizado se recomienda únicamente en mujeres embarazadas con riesgo de infección por el virus de la hepatitis C (VHC). En caso de seropositividad, se recomienda practicar una búsqueda cualitativa del VHC por PCR en sangre materna, porque el riesgo de transmisión al feto existe sólo si esta búsqueda es positiva y es tanto más elevado cuanto la carga viral sea más importante. Globalmente, el riesgo de transmisión es del 10% y se produce la mayoría de las veces en el momento del parto (Tabla II). En Francia, habría 500 recién nacidos infectados al año, pero no parece que la infección por el VHC tenga repercusiones en el embarazo o el feto. Tampoco se conoce con certeza el devenir de estos niños, si bien la mitad de ellos parece desarrollar infección crónica. Antes del embarazo, se puede considerar un tratamiento con Interferón y Ribavirina en mujeres con PCR VHC positivo, con el fin de disminuir la carga viral y reducirles el riesgo de transmisión al niño en el curso del embarazo. El tratamiento no está indicado más que conjuntamente a una contracepción, ya que puede causar malformaciones congénitas. No existe ninguna otra prevención específica de la transmisión vertical del VHC. El tratamiento contraceptivo y antiviral se interrumpe cuando la carga viral llega a ser indetectable o cuando se detecta el embarazo.
9. Conclusiones
Las consecuencias de las diferentes infecciones virales materno-fetales son muy variadas en sus manifestaciones, su gravedad, sus consecuencias y, por tanto, en su abordaje. En este abordaje, es evidente que desgraciadamente no hay antivirales eficaces e inofensivos para el feto y su madre. A esto se añaden las dificultades de apreciación del riesgo incurrido por el feto en el momento de la infección materna. En efecto, el biodiagnóstico prenatal ha conseguido ser muy fiable, pero la presencia del virus en el líquido amniótico, sinónimo de infección fetal, no significa sistemáticamente anomalía fetal y, recíprocamente, la ausencia de virus en el líquido amniótico en el momento de obtención de la muestra no significa ausencia de infección fetal. Los resultados analíticos se confrontan con los de imagen que, desgraciadamente, no permiten descubrir todas las anomalías, a todo lo cual se añade la evaluación estadística de los riesgos de aparición de la infección en función del momento del embarazo. El diagnóstico prenatal es pues un procedimiento difícil, reservado sólo a clínicos y analistas clínicos que tengan la calificación necesaria. En cambio, la prevención es un medio eficaz de lucha contra estas infecciones, aunque sigue estando insuficientemente utilizada. Sin embargo, es evidente que se puede, en cierta medida, prevenir la infección por CMV con simples medidas de higiene. El virus de la rubéola continúa circulando en Francia, cuando la infección rubeólica se puede prevenir con una vacuna eficaz e inofensiva. También, el cribado del antígeno HBs en la mujer embarazada y la serovacunación pueden evitar en Francia cerca de 1.000 hepatitis crónicas en el niño. En este ámbito, las perspectivas prioritarias son, por tanto, la búsqueda de factores predictivos de la gravedad de la afección fetal para ayudar mejor al abordaje y al desarrollo de nuevas terapéuticas.







Se agradece a la Dra. Liliana Keros por compartir diariamente su experiencia clínica y biodiagnóstica de las infecciones materno- fetales.
Referencias bibliográficas
1. Naessens A, Casteels A, Decatte L, Foulon W. A serologic strategy for detecting neonates at risk far congenital cytomegalovirus infection. J Pediatrics 2005; 146 (2): 194-7. [ Links ]
2. Pass R, Fowler K. Congenital cytomegalavirus infection following first trimester materna infection: symptoms at birth and outcome. J Clin Virol 2005; 24: 1100-12. [ Links ]
3. Gauarin S. Diagnostic des infections maternofoetales à cytomégalovirus (HCMv). Revue Française des Laboratoires 2003; 353: 33-9. [ Links ]
4. Revella M, Zavattoni M. Quantification of human cytomegalovirus DNA in amniotic fluid of mothers of congenitally infected fetuses. J Clin Microbiol 1999; 37: 3350-2. [ Links ]
5. Guerra B, Lazzarotto T, Quarta S, Lanari M, Bovicelli L, Nicdosi A, et al. Prenatal diagnosis of symptomatic congenital cytomegalovirus infection. Am J Obstet Gynecol 2000; 183: 476-82. [ Links ]
6. Lanari M, Lazzarotto T, Vneturi V, Papa I, Gabrieli L, Guerra B, et al. Neonatal cytomegalavirus blood load and risk of sequelae in symptomatic and asymptomatic congenitally infected newborns. Pediatrics 2006; 117 (4) : 146. [ Links ]
7. Duff P. Immunotherapy for congenital cytomegalovirus infection. N EngI J Med 2005; 353 (13): 1402-3. [ Links ]
8. Nigro G, 5. Adler P, La Torre R, Best AM, CCCG. Passive immunization during pregnancy for congenital cytamegalovirus infection. N EngI J Med 2005; 353 (13): 1350-62. [ Links ]
9. Enders G, Nickerl-Pacher U, Miller E, Cradock-Ratson JE. Outcome of confirmed periconceptional materna rubella". Lancet 1988; 1(8600): 1445-7. [ Links ]
10. Banatvala JE, Brown DWG. Rubella. Lancet 2004; 363: 1127-37. [ Links ]
11. Grangeot-Keros L. Intéret et limites de la sérologie dans les infections virales. Revue Française des Laboratoires 2004; 366: 45-50. [ Links ]
12. Ingrand D. Diagnostic anténatal des infections rubéoliques. Revue Française des Laboratoires 2003; 353: 41-5. [ Links ]
13. Macé, M, Cointe D, Six C, Levy-Bruhl D, Parent du Chatelet I, Ingrand D, et al. Diagnostic value of reverse transcription-PCR of amniotic fluid for prenatal diagnosis of congenital rubella infection in pregnant women with confirmed primary rubella infection. J Clin Microbial 2004: 42 (10):4818-20. [ Links ]
14. Thomas H, Margan-Capner P. Slow maturation of IgG1 avidity and persistence of specific 1gM in congenital rubella: implications far diagnosis and immunopatholagy. J Med Virol 1993: 43:196-200. [ Links ]
15. Harger J, Adler SP, Koch WC, Harger GF. Prospective evaluation of 618 pregnant women exposed to parvovirus B19: risks and symptoms. Obstet Gynecol 1998; 91 (3): 413-20. [ Links ]
16. Miller E, Fairley C, Cohen BJ, Seng C. Immediate and long term outcome oh human parvovirus 819 infection in pregnancy. Br J Obstet Gynaecol 1998: 105 (2): 174-8. [ Links ]
17. Leruez-Ville M. Virus 819 et grossesse. Virologie 2002; 6: 123-31. [ Links ]
18. Searle K, Schalasta G. Development of antibodies to the non-structural protein NS1 of parvovirus 819 during acute symptomatic and subclinical infection in pregnancy: implications for pathogenesis doubtful. J Med Virol 1998: 56 (3): 192-8. [ Links ]
19. Krivine A. Diagnostic anténatal des infections à parvavirus B19. Revue Française des Laboratoires 2003; 353:55-60. [ Links ]
20. Mirlesse Y, Lebon P. La varicelle au cours de la grossesse. Revue Française des Laboratoires 2003: 353: 49-53. [ Links ]
21. Haas H. Place des antiviraux dans la varicelle. Antibiotiques 2005; 7:171-6. [ Links ]
22. Luzuriaga K. Prevention of mother-to-child transmission of HIV infection. Clin. Infect. Dis 2005; 40: 466-7. [ Links ]














