Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. v.43 n.1 La Plata ene./mar. 2009
TOXICOLOGÍA
Optimización de un método para la detección de carbamatos y organofosforados en vegetales
Optimization of a method for the detection of organophosphates and carbamates in vegetables
Karl Schosinsky1, Eugenia María Quintana Guzmán2, Clements Ruepert3
1. PhD., Catedrático, Departamento de Análisis Clínicos, Facultad de Microbiología, Universidad de Costa Rica (UCR), Centro de Investigación en Enfermedades Tropicales (CIET), UCR y Universidad de Ciencias Médicas (UCIMED).
2. Magister Scientiae, Profesora Asociada Departamento de Análisis Clínicos, Facultad de Microbiología, UCR y CIET.
3. M.Sc., Investigador Instituto Regional de Estudios en Sustancias Tóxicas (IRET), Universidad Nacional.
Resumen
Debido al alto grado de contaminación por plaguicidas de productos agrícolas y al alto costo que implica su detección se consideró importante optimizar el método de escrutinio de inhibición de colinesterasas humanas en presencia de extractos vegetales. Se demostró que las suspensiones de glóbulos rojos y plasma son estables al menos por tres meses si se mantienen entre 4 y 8 °C. El reactivo de color es estable por al menos dos años y medio en refrigeración y los sustratos de ambas colinesterasas son estables congelados al menos por dos años. La mezcla del extracto vegetal y los glóbulos rojos o plasma debe incubarse 90 minutos a 37 °C para determinar los porcentajes de inhibición enzimática. Se determinó que los porcentajes de inhibición superiores a 16% en la plasmática y a 21% en la eritrocítica indican presencia de plaguicida en los vegetales. Este método de screening optimizado para detectar la presencia de carbamatos y organofosforados tiene ventaja sobre otros por su bajo costo, facilidad y rapidez de análisis sin requerir de equipo costoso y poco versátil. Esta metodología no cuantifica ni identifica el plaguicida presente pero permite diferenciar entre organofosforados y carbamatos si el periodo de incubación del vegetal con eritrocitos o plasma se prolonga por 24 horas a 20-25 °C.
Palabras clave: Colinesterasa plasmática; Colinesterasa eritrocítica; Plaguicida; Vegetal; Screening; Organofosforados; Carbamatos
Summary
Optimization of the screening method of inhibition of human cholinesterases is considered important because of the high contamination rate of agricultural products with pesticides and its high detection cost. It has been demonstrated that erythrocytes and plasma are stable at least for three months at 4-8 °C. The colour reaction reagent is stable for at least two and a half years at 4-8 °C and the substrate for both cholinesterases is stable when frozen, at least for two years. The solution of vegetable extract and erythrocytes or plasma must be incubated 90 minutes at 37 °C in order to determine the percentages of enzymatic inhibition. It was established that inhibition percentages higher than 16% for the plasmatic solution, and 21% for the erythrocytic solution mean that pesticide is present in vegetables. The advantages of this optimized screening method for the detection of carbamates and organophosphates in vegetables are its low cost and its easy and quick analysis without the need of expensive equipment. This method does not quantify or identify the pesticide, but rather it differentiates organophosphates from carbamates if the incubation time of the vegetable extract with erythrocytes or plasma is maintained at 20- 25 °C for 24 hours.
Key words: Plasmatic cholinesterase; Erythrocytic cholinesterase; Pesticide; Vegetable; Screening; Organophosphates; Carbamates
Introducción
Los plaguicidas han dado un gran aporte a la agricultura al incrementar el rendimiento agropecuario (1). Son utilizados tanto en actividades agrícolas como pecuarias y de salud pública. Son sustancias destinadas a prevenir, destruir o controlar cualquier plaga, incluyendo a los vectores de enfermedades humanas o animales y a las especies no deseadas de plantas o animales que pueden causar perjuicio o interferir en la producción, elaboración, transporte o comercialización de alimentos (2)(3).
Se estima que actualmente el 85% de los plaguicidas empleados en el mundo se dedican al sector agropecuario (4-6). El uso indiscriminado de estas sustancias ha ocasionado contaminación de aguas, suelo y alimentos, teniendo una incidencia negativa sobre la vida silvestre y el hombre (7). La presencia de residuos de plaguicidas en los alimentos que se derivan de su uso durante las diversas fases de la producción, almacenamiento, elaboración, preparación y comercialización, ha despertado gran interés por sus repercusiones en la salud y por ser un factor importante que interviene en las relaciones comerciales internacionales.
La intoxicación por plaguicidas organofosforados y carbamatos produce efectos residuales, sobre todo en el Sistema Nervioso Central y en el Periférico, así como en las funciones neuromusculares (8)(9). Se ha documentado que ciertos plaguicidas están asociados con el desarrollo de cáncer, esterilidad y malformaciones congénitas y se presentan con frecuencia intoxicaciones moderadas y severas (10). El contacto con el plaguicida se da por aplicación directa, arrastre por el viento, por el agua o por tomarlo del suelo contaminado o de otras fuentes del ambiente (11).
Los organofosforados y carbamatos son los insecticidas y helminticidas de mayor importación en Costa Rica (12). La toxicidad que producen se asocia con la inhibición de la acetilcolinesterasa que es la enzima responsable de la degradación e interrupción de la actividad biológica del neurotransmisor acetilcolina, cuya acumulación altera el funcionamiento normal en la transmisión de los impulsos nerviosos (13).
Los problemas causados por los plaguicidas en la salud humana y en el medio ambiente han preocupado a las autoridades de Costa Rica por lo que se han incorporado en el Plan Nacional de Salud desde 1999. La mayor incidencia de intoxicaciones por plaguicidas en Costa Rica se da por Paracuat seguido de carbofuran, metomil, terbufos, fenamifos, glifosfato y propoxur, siendo los últimos seis organofosforados o carbamatos (14). Costa Rica es el país centroamericano que más agroquímicos utiliza calculándose que casi duplica la cantidad per cápita de producto consumido respecto del resto de la región (15).
Los plaguicidas organofosforados y algunos carbamatos son inhibidores de la enzima humana colinesterasa, que cataliza la hidrólisis de ésteres de colina. Hay dos tipos de colinesterasas, la sérica o plasmática y la eritrocítica; ambas enzimas son inhibidas, pero la actividad de la enzima plasmática disminuye más rápido que la eritrocítica, por lo que la determinación de la actividad plasmática es un índice muy sensible para prevenir intoxicación. La determinación de la actividad de la enzima eritrocítica es de importancia en los sistemas de vigilancia para intoxicaciones crónicas ya que permanece disminuida por más tiempo que la plasmática (16).
Es de suma importancia determinar el grado de contaminación por plaguicidas de los productos agrícolas que se consumen, pues estos están expuestos a contaminación por fumigación directa, contaminación de los suelos y aguas de riego, y por lo general son productos que se consumen sin un lavado adecuado y sin cocción.
Sobre la base de la alta contaminación por plaguicidas en vegetales que se obtuvo en una publicación previa mediante la inhibición de colinesterasas humanas (17), se consideró muy importante optimizar este método. Además, es sencillo y de bajo costo para la detección de la presencia y relativo grado de toxicidad del plaguicida en los vegetales.
Materiales y Métodos
Se procesaron en un extractor de jugos 20 g del vegetal para obtener un extracto. Se usó como control de colinesterasa plasmática, una mezcla de plasmas humanos (plasma control) obtenida con EDTA a la que se determinó la actividad de colinesterasa plasmática por un método cinético comercial (Biotec Internacional S.A. San José, Costa Rica).
Como control de colinesterasa eritrocítica, se utilizaron eritrocitos humanos (eritrocitos control) lavados tres veces con solución salina isotónica y resuspendidos con un volumen semejante de esa solución salina al de los glóbulos rojos empacados; se determinó la actividad de colinesterasa eritrocítica por un método cinético comercial (Biotec Internacional S.A. San José, Costa Rica).
La reacción sobre la cual se basó la determinación de la actividad enzimática de las colinesterasas (18) fue la siguiente:
Sustrato + colinesterasa → tiocolina + sal del ácido Tiocolina + ditionitrobenzoato (incoloro) → tionitrobenzoato (amarillo) + disulfuro mixto
La formación de tionitrobenzoato es directamente proporcional a la actividad enzimática.
Sustrato: propioniltiocolina para colinesterasa sérica y acetiltiocolina para la eritrocítica.
Sal del ácido: propionato para colinesterasa plasmática y acetato para la eritrocítica.
Actividad de colinesterasa plasmática en extractos vegetales: se mezclaron 100 μL de plasma control con 100 μL del extracto del producto agrícola y se incubó a 37 °C por 90 min. Se colocaron 10 μL de esta mezcla en 1,0 mL de reactivo de color (ditionitrobenzoato) y 50 μL de sustrato y se obtuvo el dA/min a una longitud de onda de 450 nm estableciendo una fase estacionaria de 15 s y un tiempo de lectura de 30 s. Para calcular el porcentaje de inhibición de la actividad enzimática se analizó un extracto vegetal libre de plaguicidas (control) utilizando la metodología anterior, cuya actividad correspondió al 100%. Para determinar el porcentaje de inhibición se multiplicó el dA/minuto de la muestra por cien y se dividió por el dA/min del extracto control y a este valor se le restó 100.
Actividad de colinesterasa eritrocítica en extractos vegetales: se mezclaron 100 μL de eritrocitos control con 100 μL del extracto del producto agrícola y se incubaron 90 min a 37 °C; se colocaron 5 μL de esta mezcla en 1 μL de reactivo de color (ditionitrobenzoato), se agregaron 50 μL de sustrato y se obtuvo el dA/min a una longitud de onda de 460 nm estableciendo una fase estacionaria de 15 s y un tiempo de lectura de 45 s. Para calcular el porcentaje de inhibición de la actividad se utilizó como control un extracto vegetal libre de plaguicida que se analizó igual que las muestras de los vegetales y cuya actividad enzimática corresponde al 100%. El porcentaje de inhibición se obtuvo multiplicando el dA/min de la muestra por cien y se dividió por el dA/min del extracto control y a este valor se le restó 100.
Cinética de la mezcla de reactivo de color con plasma o glóbulos rojos en ausencia de sustrato a 24 y 30 °C: se determinaron las absorbancias de la reacción de color por un periodo de 30 min a ambas temperaturas.
Estabilidad del sustrato: se estableció analizando ambas colinesterasas cada tres meses por un periodo de dos años y tres meses manteniéndolo a 24 ºC, 4 ºC y -10 °C.
Estabilidad del reactivo de color: se analizó tanto la colinesterasa plasmática como la eritrocítica cada tres meses manteniendo los reactivos a 24 ºC y 4 °C por un período de dos años y seis meses.
Linealidad: se determinó la linealidad aumentando los volúmenes de plasma o suspensión de eritrocitos a volúmenes constantes de extracto vegetal, obteniéndose la ecuación de regresión lineal y el coeficiente de determinación R2.
Imprecisión en una sola corrida: se realizaron 18 análisis de una suspensión de glóbulos rojos lavados y 21 de una muestra de plasma para determinar la actividad de las colinesterasas en una sola corrida. Utilizando la imprecisión del método se obtuvo el límite de detección que a su vez corresponde al punto de corte (cut off). Este límite se estableció utilizando la siguiente ecuación para determinar el porcentaje de inhibición: promedio menos tres desviaciones estándar entre valor promedio por 100 menos 100.
Porcentajes de inhibición con diferentes actividades enzimáticas en presencia de una cantidad constante de plaguicida: se incubó a 37 °C la mezcla de extracto vegetal- oxamil (carbamato) o metilparatión (organofosforado) con diferentes cantidades de glóbulos rojos por 90 min ajustando a un volumen final constante con agua destilada. Se determinaron los porcentajes de inhibición de cada una de estas diluciones utilizando un extracto vegetal libre de plaguicida como control en cada una de las diluciones. Este mismo procedimiento se realizó sustituyendo los glóbulos rojos por plasma, utilizando los plaguicidas oxamil y terbufos (organofosforado).
Tiempo mínimo de incubación a 37 °C de la mezcla extracto vegetal-plaguicida-glóbulos rojos o plasma: se determinaron los porcentajes de inhibición de colinesterasas plasmática y eritrocítica en presencia de oxamil o terbufos cada 15 min por un período de dos horas.
Diferenciación entre organofosforados y carbamatos: se obtuvieron los porcentajes de inhibición a los 90 min, 24 y 48 horas de incubación de extracto vegetal con oxamil y extracto vegetal con metilparatión tanto para glóbulos rojos como para plasma.
Porcentaje de inhibición respecto al tiempo en diferentes vegetales: se obtuvieron los porcentajes de inhibición a los 90 min y 24 horas de incubación en extractos de apio, lechuga y culantro obtenidos comercialmente utilizando ambas colinesterasas.
Comparación con cromatografía líquida de alta resolución (HPLC): a extractos vegetales con diferentes organofosforados (malatión, metilparatión, foratos, terbufos y clorpirifos) se les determinó el porcentaje de inhibición enzimática por ambas colinesterasas y se analizó cada uno de estos extractos mediante HPLC.
Resultados
La imprecisión en una sola corrida para la colinesterasa plasmática y para la eritrocítica se muestra en la Tabla I. En la Tabla II se observa el porcentaje de inhibición de colinesterasas con respecto al tiempo de la mezcla de oxamil o metilparatión con extracto vegetal. La Tabla III presenta el porcentaje de inhibición de ambas colinesterasas con respecto al tiempo de incubación de la mezcla extracto vegetal con eritrocitos o plasma en diferentes productos agrícolas obtenidos comercialmente. La Tabla IV muestra el estudio comparativo entre el porcentaje de inhibición de las colinesterasas y la concentración del plaguicida organofosforado del extracto vegetal por HPLC.
Tabla I. Imprecisión en una sola corrida de la actividad de Colinesterasa Eritrocítica y Plasmática
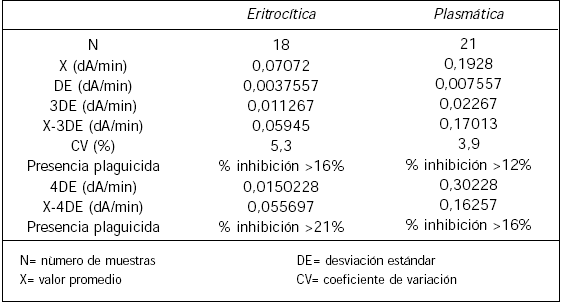
Tabla II. Porcentaje de inhibición con respecto al tiempo
Tabla III. Porcentaje de inhibición con respecto al tiempo en diferentes productos agrícolas
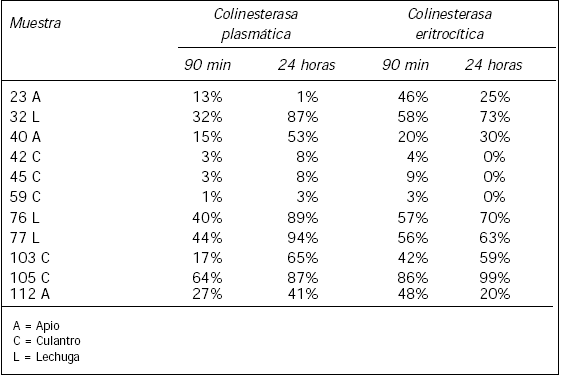
Tabla IV. Estudio comparativo entre porcentajes de inhibición enzimática y concentraciones de plaguicidas organofosforados obtenidas por HPLC

La cinética de la mezcla de la reacción de color-glóbulos rojos en ausencia de sustrato a 30 °C se observa en la Figura 1. Las Figuras 2 y 3 muestran la linealidad de la colinesterasa plasmática y eritrocítica, respectivamente. Las Figuras 4 y 5 exhiben los porcentajes de inhibición de ambas colinesterasas en presencia de concentraciones constantes de oxamil y metilparatión u oxamil y terbufos con diferentes actividades enzimáticas. Las Figuras 6 y 7 muestran los porcentajes de inhibición de colinesterasa plasmática y eritrocítica en presencia de oxamil o terbufos a diferentes tiempos de incubación, respectivamente.
Figura 1. Cinética de la mezcla reactivo color-glóbulos rojos en ausencia de sustrato a 30 °C
Figura 2. Linealidad de la colinesterasa plasmática con diferentes volúmenes de plasma
Figura 3. Linealidad de colinesterasa eritrocítica con diferentes volúmenes de glóbulos rojos
Figura 4. Porcentaje de inhibición con concentraciones constantes de Oxamil y Metilparatión con diferentes actividades de colinesterasa eritrocítica.
Figura 5. Porcentajes de inhibición con concentraciones constantes de terbufos y oxamil con diferentes actividades de colinesterasa plasmática
Figura 6. Porcentaje de inhibición de colinesterasa plasmática y eritrocítica en presencia de oxamil con diferentes tiempos de incubación
Figura 7. Porcentaje de inhibición de colinesterasa plasmática y eritrocítica en presencia de terbufos a diferentes tiempos de incubación.
Discusión y Conclusiones
ESTABILIDAD ENZIMÁTICA A DIFERENTES TEMPERATURAS DE ALMACENAMIENTO
En un estudio previo se evaluó la estabilidad de las colinesterasas plasmática y eritrocítica a temperatura ambiente, 4 y -20 °C, durante un período de tres meses (19). Se estableció que la colinesterasa plasmática es estable en refrigeración y congelación por al menos tres meses. A temperatura ambiente la actividad de esta enzima disminuye significativamente (6% a 11%) en una semana. La colinesterasa eritrocítica es estable únicamente en refrigeración. El proceso de congelamiento y descongelamiento provoca disminución importante en la actividad de esta enzima. En las muestras conservadas por un día a -20 °C, la actividad de la enzima eritrocitaria disminuyó entre un 9 y 20% al relacionarla con la basal y a temperatura ambiente disminuye considerablemente en siete días.
ESTABILIDAD DEL REACTIVO DE COLOR EN PRESENCIA DE ENZIMA
Con el propósito de establecer el efecto que producen la colinesterasa plasmática o eritrocítica en el reactivo de color se determinaron los dA/min en ausencia de sustrato. La Figura 1 muestra aumentos en las absorbancias al utilizar glóbulos rojos. Cuando se determinó la cinética con glóbulos rojos incubados a 30 °C se observó que la absorbancia tiende a estabilizase a los 15 minutos, mientras que a temperatura ambiente la estabilización requiere mayor tiempo, por lo que se recomienda que al determinar la actividad de colinesterasa eritrocítica en los extractos vegetales se debe incubar la mezcla de glóbulos rojos y extracto con reactivo de color a 30 °C por al menos 15 minutos previa adición de sustrato. Este proceso no es necesario cuando se utiliza suero o plasma debido a que no se observan variaciones de absorbancia significativas con respecto al tiempo.
ESTABILIDAD DEL SUSTRATO
Se determinó que la estabilidad del sustrato a -10 °C tanto para colinesterasa eritrocítica como plasmática es de dos años y tres meses. Analizando ambos reactivos cada tres meses se observó que son estables durante este período de almacenamiento, ya que los coeficientes de variación fueron muy semejantes a los obtenidos en una sola corrida. En refrigeración (10 °C) la estabilidad del sustrato se mantiene por dos semanas y a temperatura ambiente por tres días.
ESTABILIDAD DEL REACTIVO DE COLOR A TRAVÉS DEL TIEMPO
La estabilidad del reactivo de color para ambas colinesterasas mantenido en refrigeración (10 °C) es de al menos dos años y medio, ya que los coeficientes de variación fueron muy semejantes a la imprecisión en una misma corrida. No se recomienda mantenerlo a temperatura ambiente (24 °C) ya que adquiere coloración amarillenta después de una semana de almacenamiento, debido a la reducción del mismo.
LINEALIDAD
Al utilizar diferentes volúmenes de plasma manteniendo constante el volumen total de reacción se obtiene una respuesta lineal de 0,1 dA/min a 0,45 dA/min, lo que permite analizar con alta confiabilidad muestras con valores extremos. La ecuación de regresión lineal obtenida es y=0,0368x + 0,0502 con un coeficiente de determinación R2=0,9574 (Fig. 2).
Un comportamiento semejante se observa al utilizar diferentes volúmenes de eritrocitos manteniendo constante el volumen total de reacción, con una respuesta lineal de 0,015 dA/min y al menos hasta 0,06 dA/min. La ecuación de regresión lineal obtenida es y = 0,0028x + 0,0012 con un coeficiente de determinación R2 = 0,9821 (Fig. 3).
LÍMITE DE DETECCIÓN Y PUNTO DE CORTE
La Tabla I muestra las desviaciones estándar y coeficientes de variación al practicar 18 análisis de una muestra de glóbulos rojos lavados y 21 análisis de plasma para determinar la actividad de las colinesterasas en una sola corrida. Con esta información se puede determinar el límite de detección que a su vez corresponde al punto de corte (cut off). El porcentaje de inhibición obtenido por la imprecisión para la colinesterasa eritrocítica fue de 16% considerando tres desviaciones estándar, lo que significa que cualquier valor superior a este porcentaje sugiere presencia de plaguicidas. Sin embargo, si se utiliza el promedio de los dA/minuto menos cuatro desviaciones estándar el punto de corte sería de 21%.
Con la colinesterasa plasmática se obtiene un porcentaje de inhibición del 12% para tres desviaciones estándar, por lo que valores superiores a este porcentaje indicarán presencia de plaguicidas. Si se utiliza el promedio menos cuatro desviaciones estándar, el punto de corte sería del 16%.
Al utilizar el promedio de los dA/minuto menos cuatro desviaciones estándar se aumentaría la sensibilidad diagnóstica disminuyéndose los falsos positivos por lo que disminuiría la especificidad diagnóstica aumentándose los falsos negativos. Queda a juicio del analista elegir el punto de corte que considere conveniente.
Al determinar el efecto de la actividad enzimática plasmática y eritrocítica en los porcentajes de inhibición manteniendo constante la concentración de plaguicida, oxamil, metilparatión o terbufos, se observó que la inhibición es independiente de la actividad enzimática (Figs. 4 y 5). Este comportamiento permite utilizar controles de glóbulos rojos y plasma con actividades diferentes sin necesidad de estandarizar los controles a una determinada actividad.
TIEMPOS DE INCUBACIÓN
Con el propósito de establecer el tiempo mínimo que se debe incubar la mezcla glóbulos rojos-extracto vegetal o plasma-extracto vegetal se incubaron en presencia de oxamil a 37 °C y a diferentes tiempos. La Figura 6 muestra que al aumentar el tiempo de incubación los porcentajes de inhibición aumentan con respecto al tiempo, hasta que se estabilizan aproximadamente a los 45 min manteniéndose constante aún a los 120 min. Utilizando este mismo procedimiento con terbufos se observa un aumento en el porcentaje de inhibición hasta los 90 minutos (Fig. 7). Se recomienda incubar las mezclas extracto vegetal-glóbulos rojos o plasma a 37 °C un mínimo de hora y media para obtener mayor sensibilidad, ya que los organofosforados requieren mayor tiempo de incubación sin que se modifique la inhibición dada por carbamatos.
La Tabla II muestra porcentajes de inhibición que producen el oxamil o metilparatión a diferentes tiempos de incubación de la mezcla extracto vegetal-glóbulos rojos o extracto vegetal-plasma. Es evidente que los porcentajes de inhibición disminuyen a las 24 y 48 horas de incubación en presencia de oxamil para ambas colinesterasas. Por el contrario, en presencia de metilparatión los porcentajes de inhibición aumentan. Para diferenciar si es un organofosforado o un carbamato presente en el vegetal, se deben determinar los porcentajes de inhibición incubándose a 37 C° por 90 minutos y a temperatura ambiente por 24 horas. Lo anterior se explica debido a que los carbamatos y organofosforados se unen al sitio catalítico de la colinesterasa inhibiendo su actividad sobre el sustrato. La inactivación enzimática con organofosforados puede durar varios días o inclusive producir una inhibición irreversible conocida como "envejecimiento". Las enzimas inhibidas por carbamatos se hidrolizan rápidamente regenerando su actividad (20).
Los porcentajes de inhibición obtenidos a los 90 min y a las 24 horas de incubación de extractos vegetales (adquiridos en el comercio) con glóbulos rojos o plasma se muestran en la Tabla III. En términos generales, se podría pensar que la mayoría de los plaguicidas utilizados en estas muestras son organofosforados debido al aumento en el porcentaje de inhibición a las 24 horas, con excepción de la 23 A que disminuyó con ambas enzimas. Las muestras 42 C, 45 C y 50 C que mostraron valores inferiores a los establecidos en el punto de corte a los 90 min no sobrepasaron los niveles superiores aceptados a las 24 horas por lo que se consideran no contaminadas por plaguicidas.
COMPARACIÓN CON UN MÉTODO DE REFERENCIA
La Tabla IV muestra los datos de las concentraciones de diferentes plaguicidas organofosforados analizadas por HPLC con los porcentajes de inhibición para ambas colinesterasas. Se observa que, excepto para clorpirifos, hubo inhibición enzimática superior al límite de corte establecido para ambas colinesterasas, lo que demuestra que los plaguicidas fueron detectados por este método. En el caso del clorpirifos con la colinesterasa eritrocítica el porcentaje de inhibición obtenido es menor al límite de corte, mostrando también menor sensibilidad que la plasmática para este plaguicida. Este último comportamiento se observa con malatión, forato y terbufos, pero con metilparatión la eritrocítica es más sensible que la sérica.
Se recomienda que para detectar la presencia de plaguicidas en vegetales utilizando la inhibición de las colinesterasas, tanto los glóbulos rojos como el reactivo de color deben mantenerse entre 4 ºC y 8 °C y el sustrato en congelación y la mezcla extracto vegetal-eritrocitos o plasma debe incubarse hora y media a 37 °C para asegurarse que el plaguicida inhiba adecuadamente a las colinesterasas. En la determinación de la actividad de colinesterasa eritrocítica debe preincubarse a 30 °C la mezcla reactivo de color-glóbulos rojos por un periodo mínimo de 15 min. Para la colinesterasa sérica no se requiere este periodo de preincubación. Para establecer la cinética de reacción es necesario realizar una fase estacionaria de 15 segundos para ambas colinesterasas y un tiempo de lectura de 30 s para la plasmática y de 45 s para la eritrocítica.
Se concluye que este método de screening optimizado para detectar la presencia de carbamatos y organofosforados en vegetales tiene la ventaja, sobre otros métodos convencionales como cromatografía líquida de alta resolución y los inmunoenzimáticos, de su bajo costo y rapidez de análisis sin que se requiera de equipo costoso y poco versátil. Sin embargo, esta metodología no cuantifica ni identifica el plaguicida presente pero permite diferenciar entre organofosforados y carbamatos.
CORRESPONDENCIA
EUGENIA MARÍA QUINTANA GUZMÁN
Departamento de Análisis Clínicos, Facultad de Microbiología
Universidad de Costa Rica, SAN PEDRO, San José, Costa Rica
Correo electrónico: eugenia.quintana@ucr.ac.cr
1. Barquero M, Constenla M. Determinación de plaguicidas organoclorados en tejido adiposo en Costa Rica. Biol Trop 1986; 34 (1): 7-12. [ Links ]
2. FAO. International Code of Conduct on the Distribution and use of Pesticides. Rome, Food Agriculture Organization of the United Nations; 1986. [ Links ]
3. International Programme of Chemical Safety. The WHO recommended classification of pesticides by hazard and guidelines to classification. 1990-1991. Geneve, IPCS. WHO/IPCS/90. [ Links ]
4. Edwards CA. Agrochemicals as Environmental Pollutants. In: VanHofsten B and Ekstrom G. eds. Control of Pesticide Applications and Residues in Food. A guide and directory 1986. Yppsala, Suecia: Science Press; 1986. p.1-9 . [ Links ]
5. World Bank. World Development Report. New York, USA. World Bank, 1982. [ Links ]
6. Food and Agriculture Organization. Agriculture: toward 2000. Rome, (Italia). FAO; 1981. [ Links ]
7. Carazo E, Fuentes G, Constenla M. Residuos de insecticidas organofosforados en repollo. Turrialba 1976; 26: 321-5. [ Links ]
8. Henao S, Corey G. Plaguicidas inhibidores de las colinesterasas. Centro Panamericano de Ecología Humana y Salud. Metepec, México: ECO/OPSIMS; 1991. [ Links ]
9. Marquardt S. Pesticides, parakeets, and unions in the Costa Rica banana industry, 1938-1962. Lat Amer Res Rev 2002; 37 (2): 3-36. [ Links ]
10. Lobo F. Tumores malignos poco frecuentes en el niño: aspectos clínicos y epidemiológicos. Bol Med Hosp Mex 1985; 42 (11): 670-5. [ Links ]
11. Fernández L. Manejo seguro de plaguicidas. Agroindustria. San José, Costa Rica: Leuper S.A.; 1983. [ Links ]
12. Chaverri E. Situación general del uso de agroquímicos en Costa Rica, su impacto en la salud y el ambiente. Memoria: El uso de plaguicidas y su relación con el desarrollo en Costa Rica. Costa Rica: OPS/OMS; 2001. [ Links ]
13. Zimmermann H, Henry J. Clinical Enzymology. In: Clinical Diagnosis and Management by Laboratory Methods. Philadelphia: WB Saunders Company; 1979, p. 370-2. [ Links ]
14. Aguirre E. Informe de intoxicaciones por plaguicidas Costa Rica 1999-2000. Punto focal nacional PLAG-SALUD, Ministerio de Salud, Costa Rica, 2001. [ Links ]
15. Mora S. Plaguicidas. Balance de un problema. Aportes 1997; 115: 18-21. [ Links ]
16. Moss D, Henderson A, Kachman J. In: C Burtis. e.d. Tietz Textbook of Clinical Chemistry. Philadelphia: W.B. Saunders Company; 1994. p. 877-82. [ Links ]
17. Schosinsky K, Quintana E. Detección de plaguicidas en vegetales de Costa Rica mediante la inhibición de colinesterasas humanas. ALAN 2004; 54 (4): 444-8. [ Links ]
18. Henderson A, Moss D. Enzymes. In: Burtis C A, Ashwood E R, eds. Tietz Fundamentals of Clinical Chemistry. 5 ed. New York: W.B. Saunders Company; 2002. p. 385-7. [ Links ]
19. Jiménez M, Martínez V. Efecto del tiempo y las condiciones de almacenamiento sobre la actividad de las colinesterasas. Rev Med Costa Rica Centroam 2000; 57 (553): 149-54. [ Links ]
20. Hodgson E, Levi P. In: A Textbook of Modern Toxicology. 2nd ed Stamford, Connecticut, USA: Appleton& Lange A Simon & Schuster Company; 1997. p. 496. [ Links ]
Aceptado para su publicación el 12 de septiembre de 2008














