Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. v.43 n.2 La Plata abr./jun. 2009
BIOQUÍMICA CLÍNICA
Marcadores bioquímicos del remodelamiento óseo. Utilidad clínica
Biochemical markers of bone remodelling. Clinical utility
Belen Reynaga Montecinos1, Susana Noemí Zeni2
1. Bioquímica
2. Dra. Ciencias Químicas
Sección Osteopatías Médicas. Hospital de Clínicas. Facultad de Medicina. Universidad de Buenos Aires y CONICET. Buenos Aires. Argentina.
Resumen
El esqueleto se renueva continuamente mediante el proceso de remodelamiento óseo, reemplazando hueso viejo y dañado por hueso nuevo. Este proceso es llevado a cabo en pequeños paquetes celulares denominados "unidades de remodelamiento óseo" (URO) por acción combinada de las células óseas. Los osteocitos iniciarían y la parathormona determina el nivel del proceso. El remodelamiento de todo el esqueleto puede evaluarse mediante los marcadores bioquímicos del remodelamiento óseo. Los marcadores de formación (fosfatasa alcalina ósea, osteocalcina y propéptidos del colágeno tipo I amino y carboxilo terminal) provienen de la actividad de osteoblastos y los de resorción (fosfatasa ácida tartrato resistente 5b, telopéptidos carboxilo y amino terminales, piridinolinas, hidroxiprolina y calciuria) de los osteoclastos. La utilidad clínica de los marcadores consiste en determinar cambios en el remodelamiento óseo ya que al ser más rápida la resorción que la formación, todo aumento llevaría a pérdida de masa ósea. Si bien no sirven para diagnosticar, la identificación de individuos con alto remodelamiento permitiría comenzar con una terapia preventiva que evite la pérdida de hueso. Los más sensibles y específicos pueden determinar el riesgo relativo de fracturas. Para interpretar su valor correctamente se deben considerar las variaciones preanalítica, analítica y biológica del marcador bioquímico utilizado.
Palabras clave: Marcadores bioquímicos óseos; Remodelamiento óseo; Osteoporosis; Marcadores óseos de formación y de resorción; Utilidad clínica
Summary
Bones are continuously undergoing remodeling as a result of the coordinated actions of bone cells. This process occurs in discrete regions or basic multicellular units (BMUs) and ensures the maintenance of skeletal integrity and bone mass. The rate of bone remodelling can be monitored quantitatively by measuring biochemical markers of bone turnover. Bone formation markers (bone alkaline phosphatase, osteocalcin, type I collagen extension propeptides) reflect osteoblast activity and bone resorption markers (pyridinium crosslinks, N-terminal type I collagen C-crosslinking telopeptides, tartrate resistant acid phosphatase 5-b, hydroxyproline and urinary calcium) reflect osteoclast activity. Bone markers are useful to detect changes in bone turnover. As bone resorption is faster than bone formation, the increase in bone turnover markers can be regarded as a risk factor for rapid bone loss. Although bone markers provide little information in osteoporosis diagnosis, they can identify fast bone losers who will benefit from a preventive therapy and thereafter monitor the efficacy of the treatment. The most sensitive and specific markers may predict fractures risk, independently of bone density. For interpreting the results of the bone marker test used, it is necessary to consider the main sources of variability which include preanalytical, analytical and biological conditions.
Key words: Biochemical bone markers; Bone remodelling; Osteoporosis; Bone formation and resorption markers; Clinical utility
Introducción
Remodelamiento óseo
Una correcta salud ósea es indispensable para que el esqueleto pueda cumplir con sus tres funciones fundamentales: mecánica, como soporte del cuerpo; protectora de los órganos internos que delimita y metabólica como reserva de iones, principalmente calcio (Ca) y fósforo (P) (1). Para ello, el esqueleto cuenta con la habilidad de renovarse continuamente mediante el proceso de remodelamiento óseo (del inglés turnover) que comienza tempranamente, en el útero, y continúa hasta la muerte del individuo.
El remodelamiento óseo no es más que el reemplazo periódico de hueso viejo y dañado por hueso nuevo, en el mismo sitio, reparando el daño por fatiga del material que pudiera producirse por la acumulación de mineral. Este proceso es el responsable de la completa regeneración del esqueleto adulto cada 10 años (2).
El recambio óseo comprende dos etapas: resorción y formación ósea que son llevadas a cabo por el esfuerzo colaborativo y secuencial de un grupo de células que se encuentran dentro de una estructura temporaria denominada "unidad de remodelamiento óseo" (URO) (Fig. 1) (3). Es decir, la resorción del hueso viejo y su reemplazo por hueso nuevo es producto de la acción principal de dos tipos celulares diferentes: osteoclastos y osteoblastos que, a pesar de no encontrarse separados, son independientes.
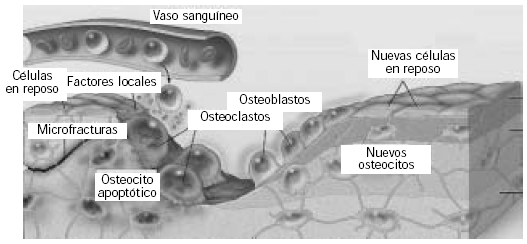
Figura 1. Unidad de remodelamiento óseo.
El remodelamiento es un proceso cíclico que comienza con el hueso en estado de reposo y culmina de igual manera. En todo el esqueleto y en un período de tiempo dado millones de estas UROs se encuentran operando en diferentes estadios del ciclo (4). Cada URO permanece inactiva aproximadamente de 6 a 8 meses aunque continúa acumulándose mineral con lo cual el hueso se endurece y pierde elasticidad. Las alteraciones biomecánicas producidas por este envejecimiento hacen que comiencen a producirse "microfracturas" las que, por una señal no del todo clara, son detectadas por células inmersas en la matriz mineralizada. Estas células liberan factores hacia la superficie ósea desencadenando el inicio del ciclo de remodelamiento en el que se evidencian 4 fases: activación, resorción, reversión y formación (Fig. 2).

Figura 2. Ciclo de remodelamiento óseo (5).
La activación produce la atracción desde la circulación de precursores osteoclásticos mononucleares (provenientes de progenitores hematopoyéticos) cuya diferenciación celular a preosteoclastos multinucleados es realizada por citoquinas provenientes de las células en reposo que tapizan la superficie ósea y otras células del mesénquima. Los preosteoclastos se pegan a la superficie a resorber mediante receptores de integrinas presentes en sus membranas que tienen la particularidad de unirse a determinados péptidos presentes en la matriz extracelular que contienen la secuencia arginina- glicina-aspártico (RGD). Dicha unión delimita un compartimento denominado "laguna de resorción" y desencadena la polarización del osteoclasto que emite prolongaciones citoplasmáticas llamadas "ribete en cepillo" a través de las cuales volcarán sus productos iniciando la siguiente fase denominada de resorción propiamente dicha.
Durante la fase resortiva una bomba de protones (H+) específica y otros canales iónicos presentes en la membrana del ribete en cepillo del osteoclasto producen una disminución considerable del pH en la laguna de resorción. Esta acidificación es acompañada por la secreción de una serie de enzimas lisosomales tales como fosfatasa ácida tartrato resistente (TRAP) y catepsina K, así como metaloproteasas de la matriz (MMP) entre las que se encuentran colagenasas como la MMP-9. La disminución del pH en forma conjunta con la liberación de enzimas que presentan actividad máxima a pH ácidos produce la degradación del cristal de hidroxiapatita y en forma subsiguiente la del colágeno creando cavidades denominadas "lagunas de Howship" en el hueso trabecular y túneles cilíndricos en el hueso cortical (6).
Generalmente se encuentra sólo uno o a lo sumo dos osteoclastos en el mismo sitio resortivo pero, en condiciones de resorción exagerada, es posible encontrar hasta cuatro o cinco células resortivas (7)(8). La resorción es un proceso rápido que dura aproximadamente 10 a 12 días, finaliza con la apoptosis del osteoclasto y es seguida por la fase reversa.
Durante la etapa de reversión la laguna de resorción es reemplazada por monocitos y osteocitos, que fueron liberados de la matriz mineralizada durante la resorción, y por preosteoblastos que fueron reclutados para comenzar a formar nuevo hueso. En esta etapa es donde se producen las señales de acoplamiento más importantes y aunque, hasta el momento, la naturaleza exacta de dichas señales es desconocida existen una serie de hipótesis respecto a ello. Una sugiere que, durante la resorción, los osteoclastos liberarían ciertos factores de crecimiento que habían quedado inmersos en la matriz ósea mineralizada, los que actuarían como factores quimiotácticos osteoblásticos estimulando su proliferación y diferenciación. Alguno de los candidatos potenciales sugeridos son factor de crecimiento tumoral beta (TGFb); factor de crecimiento insulínico I y II (IGF I y II); proteínas morfogenéticas (BMPs); factor de crecimiento y diferenciación plaquetario (PDGF) y factor de crecimiento fibroblástico (FGF). Entre todos ellos el principal candidato es el TGFb, ya que diversos estudios demostraron que prolonga la vida media de los osteoblastos inhibiendo su apoptosis, a la vez que inhibe la producción por dichas células de otros factores que aumentan la resorción (9)(10). Otra de las teorías sugeridas es que el propio osteoclasto jugaría un rol en el acoplamiento (4) donde estarían implicadas señales bidireccionales entre osteoblastos y osteoclastos vía receptores de efrina (11).
En el adulto, y debido al proceso de acoplamiento, los osteoblastos son atraídos al lugar donde se generó previamente la resorción. Esta etapa es la menos conocida de todo el ciclo de remodelamiento, no se observa durante el crecimiento, por ello se denomina de "modelamiento". A diferencia del remodelamiento, el modelamiento no se encuentra acoplado en el sentido de que la formación puede producirse donde previamente no existió resorción, siendo así el responsable del crecimiento en largo y ancho de los huesos.
La formación comprende dos etapas en las que los osteoblastos sintetizan primeramente la matriz del osteoide y luego regulan su mineralización. Los osteoblastos provienen de progenitores mesenquimáticos que pueden proliferar y diferenciarse a precursores osteoblásticos, preosteoblastos y osteoblastos maduros (12). A diferencia del osteoclasto que llega al hueso desde la circulación, los precursores osteoblásticos mayoritariamente lo alcanzan por migración de progenitores desde los tejidos conectivos circundantes (2). Cuando el hueso está inactivo los osteoblastos se encuentran sobre la superficie ósea y se las denomina células en reposo. Estas células presentan una forma alargada, plana que se modifica hacia una forma cúbica cuando existe formación activa. Dentro de la cavidad de resorción los osteoblastos primeramente forman una capa sintetizando proteínas de la matriz, principalmente colágeno tipo I y otras proteínas no colágenas (osteocalcina, osteonectina, factores de crecimiento, citoquinas, etc), todas ellas importantes para el proceso de mineralización. A continuación se incorporan factores locales y citoquinas produciendo la maduración del osteoide. Sobre las fibras de colágeno maduro comienza el proceso de calcificación correspondiente a la incorporación de cristales de hidroxiapatita. Todos estos procesos determinan que, a diferencia de la resorción, la formación sea más lenta (3 meses).
Los osteoblastos gatillan la mineralización liberando pequeñas vesículas pegadas a su membrana denominadas vesículas matriciales, que establecen condiciones óptimas para iniciar la deposición de mineral. Dichas vesículas concentran iones calcio y fosfato y enzimas que degradan a los inhibidores de la mineralización como pirofosfatos y proteoglicanos presentes en la matriz extracelular. A medida que la mineralización continúa, los osteoblastos quedan inmersos en la matriz y cambian su morfología transformándose en osteocitos (4)(13). Es decir, que al cumplir su función, sólo aproximadamente el 20% de los osteoblastos muere por apoptosis, el resto queda inmerso dentro de la matriz mineralizada que ellos mismos produjeron transformándose en osteocitos. Estas células no proliferativas corresponden al último estadio de diferenciación de las células del linaje osteoblástico, son relativamente inertes metabólicamente y como se ubican dentro de lagunas osteocíticas rodeadas de un tejido mineralizado duro pierden su capacidad migratoria.
Los osteocitos han tomado un interés creciente en los últimos años ya que se ha descubierto que participan activamente en la regulación homeostática del remodelamiento óseo. Estas células se caracterizan por tener una morfología estrellada que recuerda la trama dendrítica del sistema nervioso. Son las células más abundantes del hueso (10 osteocitos cada 1 osteoblasto) y se comunican entre sí o con células de la superficie ósea mediante múltiples extensiones de sus membranas citoplasmáticas. Mediante estas proyecciones forman un sincisio celular estratégico de redes de conexión (uniones "gap") que representarían un sistema muy eficiente en la transmisión metabólica de señales a través de enormes distancias (14). Su localización las transforma en excelentes células mecanosensoras capaces de detectar señales de "estrés mecánico" (15), las que traducen en señales químicas (citoquinas), son enviadas a la superficie iniciando así el proceso del remodelado óseo (Fig. 1) (9). El osteocito se polariza en el sentido de que sus prolongaciones son más numerosas hacia la superficie del hueso para conectarse con células en reposo y/o con osteoblastos. Los osteocitos también participan en la finalización del proceso de formación ya que secretan una citoquina denominada esclerostina que tiene la particularidad de suprimir la función osteoblástica (16).
Control del remodelamiento óseo
Para que se inicie el remodelamiento óseo debe existir una correcta comunicación osteoblasto-osteoclasto asociados en tiempo y espacio en la misma URO. Existen tres modelos sugeridos de comunicación celular; uno de ellos determina una comunicación directa entre estas dos células mediante ligandos y receptores unidos a las membranas celulares que interaccionan iniciando señales intracelulares; otro sugiere la existencia de interconexiones tipo uniones "gap" permitiendo el pasaje de pequeñas moléculas entre ambas células, y finalmente el tercero señala que las comunicaciones podrían efectuarse por factores parácrinos difusibles como citoquinas, factores de crecimiento, quimioquinas u otras moléculas.
El remodelamiento óseo se inicia en respuesta a diferentes estímulos entre los que se encuentran: generación de microfracturas con pérdida de carga mecánica, baja concentración del Ca++ en el líquido extracelular (LEC) y alteración en la concentración de hormonas y citoquinas.
La apoptosis del osteocito produce señales regulatorias que desencadenan la diferenciación osteoclástica para iniciar la reparación del hueso dañado. Los osteocitos determinarán qué parte del hueso se degradará ya que censan microfracturas y pérdida de carga mecánica y mediante sus prolongaciones dendríticas envían señales químicas (citoquinas) que se encuentran involucradas en la interacción celular hacia la superficie ósea. En este sentido, dos de las señales osteociticas potenciales involucradas en la iniciación del remodelamiento son el TGF-b y el óxido nítrico (NO), las que inducirían en las células de la progenie osteoblástica la secreción del factor estimulante de colonia de macrófagos (f-SCM), citoquina indispensable para el reclutamiento, diferenciación y sobrevida de células del linaje osteoclástico, ya que controla la migración celular y la reorganización del citoesqueleto.
La homeostasis del Ca++ del LEC está regulada por la parathormona (PTH), principal factor hormonal que determina el nivel del remodelamiento óseo. El rol homeostático de dicha hormona induce un aumento en la resorción del hueso para mantener la concentración de Ca++ constante. Sin embargo, los osteoclastos no presentan receptores para PTH, por lo cual, el reclutamiento, maduración y actividad de estas células por parte de PTH es indirecto. Son los osteoblastos quienes poseen receptores para PTH, por ello son activados por la hormona liberando citoquinas que favorecen la diferenciación y sobrevida, a la vez que inhiben la apoptosis del osteoclasto. Este grupo de citoquinas pertenece al sistema regulador del remodelamiento óseo llamado: Sistema RANK - RANKL - OPG (11) (Fig. 3).

Figura 3. Sistema RANK-RANKL-OPG (19).
La PTH estimula la liberación al medio del ligando del receptor activador del factor nuclear NF-kB (RANKL). Este factor es una proteína sintetizada por osteoblastos, células en reposo y células del estroma que puede encontrarse unida a la membrana plasmática o en forma soluble. En forma soluble también es secretada por los linfocitos T activados. El RANKL se unirá al receptor-activador del factor nuclear NF-kB (RANK) que se encuentra presente en la membrana del preosteoclasto favoreciendo su diferenciación, activación a osteoclasto maduro y sobrevida inhibiendo su apoptosis.
La osteoprotegerina (OPG) es un receptor trampa (decoy) que actúa como antagonista del RANKL. Es una proteína liberada por los osteoblastos en forma soluble para proteger al esqueleto de una excesiva resorción ósea. Al unirse al RANKL lo bloquea para su unión al RANK inhibiendo la diferenciación y activación del precursor osteoclástico y aumentando su apoptosis, por lo cual la relación RANKL/OPG es indicativa de la osteoclastogénesis en una serie de enfermedades del remodelamiento óseo (11)(17) (Fig. 3).
Por otra parte, varias quimioquinas son utilizadas por los osteoblastos para comunicarse con los precursores osteoclásticos. Entre ellas la Proteína Quimiotáctica Monocítica-1 (MCP-1), también conocida como CCL2 es producida por los osteoblastos y es una de las principales candidatas para actuar en el reclutamiento de precursores osteoclásticos. La expresión osteoblástica de MCP-1 es activada por citoquinas proinflamatorias como factor de necrosis tumoral beta (TNF-b) e interleuquina 1 alfa (IL-1a) y por PTH, mientras que la de sus receptores osteoclásticos es activada por RANKL. Asimismo, las células en reposo expresan moléculas de adhesión intercelular-1 (ICAM-1) que podrían predisponer o limpiar la superficie ósea mediante la activación de MMP previo a la resorción osteoclástica (18).
Marcadores bioquímicos del remodelamiento óseo
En un determinado período de tiempo se estima que sólo el 10% de la superficie ósea se encuentra en remodelación, sin embargo los distintos tipos de hueso no poseen la misma actividad remodelatoria. El 80% del esqueleto está formado por hueso cortical y sólo el 20% del volumen óseo por hueso trabecular, siendo este último el metabólicamente más activo y el que aporta el mayor porcentaje al recambio óseo de todo el esqueleto. La frecuencia con que la superficie ósea se activa, o sea la frecuencia de activación, determinará el número de sitios de remodelamiento presentes en el hueso, por lo cual la sumatoria de actividad de todas esas UROs, o sea la actividad remodelatoria de todo el esqueleto, puede evaluarse bioquímicamente a través de la medición de los marcadores bioquímicos del remodelamiento óseo.
Estos marcadores bioquímicos óseos son productos secretados por la actividad de las células óseas que se liberan al torrente sanguíneo y pueden ser determinados en sangre y/o orina (20). Los que provienen de la actividad de los osteoblastos se denominan "marcadores de formación" y todos ellos se evalúan en sangre. Los provenientes de la actividad de los osteoclastos se denominan "marcadores de resorción" y aunque en un principio se determinaban en orina, actualmente es posible evaluarlos en suero (3)(20).
En la Tabla I se enumeran los marcadores bioquímicos del remodelamiento óseo actualmente disponibles en forma comercial.
Tabla I. Marcadores bioquímicos óseos disponibles comercialmente.
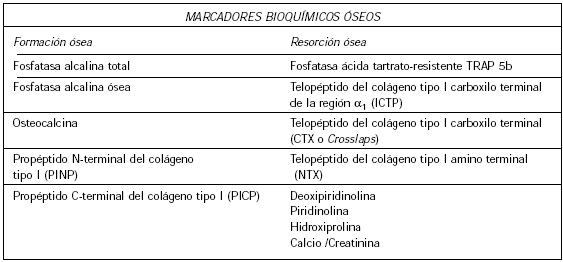
Los marcadores de formación provienen de enzimas propias del osteoblasto y su progenie, de proteínas derivadas del colágeno tipo I y de otras proteínas no-colágenas.
FOSFATASA ALCALINA TOTAL (FAL) Y FOSFATASA ALCALINA ÓSEA (FAO)
La FAL es una glicoproteína tetramérica que pertenece a una gran familia de proteínas unidas a las membranas celulares plasmáticas mediante un grupo glicano-fosfatidil-inositol carboxilo terminal. La FAL tiene una vida media de 1-2 días, lo que contribuye a que su variación diurna sea mínima.
La FAL en suero circula como un dímero con dos sitios activos simétricos y su actividad comprende a la de varias isoformas que se originan en diferentes tejidos (hígado, hueso, intestino, bazo, riñón, placenta o por expresión de tumores) (13)(21) siendo las dos fracciones mayoritarias las fosfatasas ósea (FAO) y hepática. En condiciones normales los niveles sanguíneos de FAO corresponden a sólo el 40% de la FAL total, el resto es fundamentalmente hepático aunque en ciertos casos pueden encontrarse fracciones significativas de naturaleza intestinal o placentaria (4). En niños y adolescentes la isoenzima predominante es la FAO que puede alcanzar un nivel entre 70% y 90% de la FAL (13)(21).
Las isoenzimas hepáticas y ósea son idénticas en su composición aminoacídica pero modificaciones postraslacionales hacen que presenten distinta movilidad electroforética, reactividad frente a la leptina de germen de trigo, susceptibilidad al calor e inhibición química. Estos métodos se utilizan para separarlas (4)(21).
Una vez descartada la falla hepática, los niveles de FAL ofrecen certeza de la actividad osteoblástica (13), sin embargo es un marcador inespecífico de hueso. La actividad poblacional sérica de FAL presenta una variación mayor que la intra-individual, por ello no es posible detectar cambios menores en su concentración. Esto hace que carezca de sensibilidad y especificidad en condiciones en las que el nivel de incremento del remodelamiento óseo es mediano, como en la osteoporosis. Por su fácil realización y bajo costo se continúa utilizando para evaluar cambios en el remodelamiento en sujetos con función hepática normal. Contrariamente, es un muy buen marcador óseo para determinar la actividad y realizar el seguimiento terapéutico de la enfermedad de Paget (21).
La isoforma ósea es sintetizada por los osteoblastos maduros y sus precursores. Aunque su función precisa no ha sido aún bien establecida es sabido que juega un rol importante en la formación e iniciación de la mineralización ósea. Por ello, la medición de su actividad en suero es una medida indirecta del proceso de formación, más sensible y específica que la de FAL.
La determinación sérica de FAO presenta poca variabilidad entre sujetos, baja variabilidad metodológica y biológica (4). En osteoporosis con bajo remodelado no es muy sensible aunque su mayor utilidad radica en detectar el incremento del remodelamiento óseo durante la postmenopausia (21). En la actualidad, la sensibilidad y especificidad clínica de FAO se ha incrementado por la disponibilidad comercial de inmunoensayos con anticuerpos monoclonales específicos.
Osteocalcina
La osteocalcina (OC) es el constituyente proteico no colágeno más importante de la matriz ósea con un porcentaje que ronda el 15%. Corresponde a un pequeño péptido de 49 aminoácidos sintetizado por los osteoblastos en los últimos estadios de la formación ósea como una molécula precursora llamada pro-osteocalcina y bajo el control de la vitamina D. Este propéptido contiene tres residuos de ácido glutámico (glu) en las posiciones 17, 21 y 24 que se carboxilan postraslacionalmente a ácido carboxiglutámico (gla) en una reacción dependiente de vitamina K. La fracción propeptídica se elimina de la molécula al mismo tiempo que la proteína carboxilada se vuelca al espacio extracelular donde se une a la hidroxiapatita vía Ca++ a través de los residuos de gla (Fig. 4).

Figura 4. Metabolismo de la osteocalcina.
Los niveles de OC no carboxilada se encuentran suprimidos en individuos bajo tratamiento con glucocorticoides lo que podría reflejar, en parte, la acción de estos compuestos sobre la expresión del gen de OC (20). Asimismo, recientemente se la ha señalado como una "hormona" del osteoblasto que regularía el metabolismo lipídico y energético (23).
Por otra parte, la medición de OC no carboxilada es considerada un índice de deficiencia de vitamina K y podría jugar un rol, en el futuro, para predecir la masaósea y el riesgo de fracturas (24).
Propéptidos de colágeno tipo I
Los propéptidos de procolágeno derivan del colágeno tipo I, principal proteína extracelular de la matriz ósea. Aunque el colágeno tipo I no es exclusivo del hueso, el que se encuentra en tejido óseo tiene ciertas características propias. Es un heterodímero constituido por dos cadenas a1 (I) y una cadena a2 (I) que presenta una larga cadena media helical y dos regiones cortas no helicoidales propeptídicas a cada extremo de la cadena. Los osteoblastos sintetizan el colágeno tipo I en una fase temprana de su diferenciación en forma de una cadena prepro-alfa. El gen COL1A1 que se encuentra en el cromosoma 17 y el gen COL1A 2 presente en el cromosoma 7 codifican para ambas cadenas. El preprocolágeno en el retículo endoplasmático rugoso pierde la fracción N-terminal y se transforma en procolágeno el cual será modificado post-traslacionalmente por varias enzimas específicas del tejido óseo. Estas modificaciones incluyen la hidroxilación de residuos de lisina y prolina; glicosilación de la hidroxilisina a galactosil-lisina o gluco-galactosil- hidroxilisin y por último, la fosforilación de residuos de serina. Mientras la glicosilación ocurre en la fracción C-terminal, la fosforilación ocurre en el extremo N-terminal de los propéptidos.
Las tres cadenas alfa se ensamblan mediante puentes disulfuro dando el propéptido de colágeno tipo I que se caracteriza por tener largas extensiones terminales propeptídicas amino (N-) y carboxilo (C-) terminal. Mientras el propéptido C-terminal (PICP) es globular, el propéptido N-terminal (PINP) es parte globular y parte helical. El procolágeno tipo I es secretado, vía el complejo de Golgi, al espacio extracelular donde es degradado por endopeptidasas. El PICP es separado en primer lugar por la Proteína Morfogénica 1 (BMP1) (25), mientras el PINP es liberado luego por otras enzimas. El colágeno tipo I se incorpora a la matriz ósea y los propéptidos pasan a la circulación donde pueden evaluarse como marcadores de formación por inmunoensayos específicos (13) (Fig. 5).
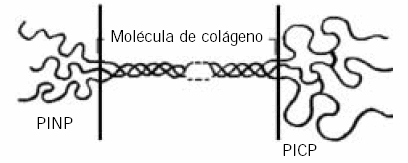
Figura 5. Fracciones propeptídicas del colágeno tipo I.
El colágeno tipo I no es específico del hueso pero, entre aquellos que lo contienen, este tejido es el que presenta mayor remodelamiento por ello sus propéptidos, en concordancia con estudios histomorfométricos, reflejan la actividad total de formación ósea. Distintos estudios avalan este concepto y demuestran que la fracción N-terminal es la de mayor utilidad clínica.
Existen varios ensayos para la medición de PINP, uno de ellos es un ELISA (P1NP) que utiliza anticuerpos policlonales dirigidos contra una secuencia sintética de la cadena proalfa 1 (26) obtenida de liquido amniótico (27); otro es un RIA donde el antígeno se obtiene de cultivos celulares de osteosarcoma (28). En el primer caso la concentración de PINP obtenida es 100 veces mayor que la del PICP, ya que este ensayo mide tanto la fracción intacta como un pequeño fragmento del Col1 que se obtiene por metabolización renal del PINP y que, por lo tanto, se acumula en IRC. El método RIA sólo mide la fracción intacta. Su medición es utilizada en la menopausia para detectar cambios en la remodelación ósea y para el seguimiento en la terapia con estrógenos (21).
El PICP puede medirse por RIA (29) o ELISA. Sin embargo, presenta poca especificidad y falta de respuesta en condiciones de bajo recambio óseo (30).
MARCADORES DE RESORCIÓN
Con excepción de la fosfatasa ácida tartrato resistente 5b (TRAP5b) que es una enzima propia del osteoclasto, la mayoría de los marcadores de resorción ósea son productos de degradación del colágeno óseo tipo I. Otros marcadores de resorción ósea evaluados, pero que hasta el momento no son utilizados clínicamente, son las proteínas no colagenosas como sialoproteína ósea (BSP) que, si bien no es un producto proveniente del osteoclasto, se incorpora a la matriz y se libera durante el proceso de resorción. Recientemente se ha ensayado como marcador de resorción a la catepsina K derivada de la actividad osteoclástica.
Calciuria
El calcio urinario de 24 h proviene del metabolismo general y representa la cantidad filtrada por los glomérulos y no reabsorbida a nivel de los túbulos renales, siendo los valores de referencia de hasta 250 mg/24 h en la mujer y hasta 300 mg/24 h en el hombre. La calciuria de 2 h se mide en la 2º orina de la mañana recogida en ayunas después de ingerir 200 cm3 de agua destilada. Se expresa en mg/mg de creatinina. Ambas muestras son poco específicas y sensibles pero como se trata de un marcador muy económico y accesible a cualquier laboratorio de rutina se lo utiliza actualmente para detectar cambios en el recambio óseo (21).
Hidroxiprolinuria
La hidroxiprolina (OHP) se forma intracelularmente. Es un aminoácido no esencial que proviene de la hidroxilación post-traslacional de prolina y constituye el 10% del contenido de colágeno maduro (Fig. 6).

Figura 6. Molécula de hidroxiprolina.
El 90% de OHP es liberada durante la degradación del colágeno tipo I, pasa a circulación, se metaboliza en el hígado y posteriormente es excretada en la orina donde se encuentra en forma libre sólo en un 10%. El mayor porcentaje corresponde a OHP unida a péptidos por lo cual para su determinación colorimétrica es indispensable una hidrólisis previa. Su excreción es mayor en niños que en adultos y además puede estar influida por el contenido de carne o gelatina de la dieta, por lo que debe realizarse una dieta exenta de productos que la aporten durante las 48 h previas a la recolección de orina (31).
Sólo el 10% de la OHP proviene del colágeno tipo I degradado del hueso ya que otras proteínas la aportan, entre ellas el componente C1q del complemento o bien de colágeno recientemente sintetizado. Parte de este aminoácido se metaboliza y reutiliza para la síntesis de nuevas proteínas lo que determina que sea un marcador inespecífico para determinar la degradación del tejido óseo (4).
La mayoría de los métodos utilizados para su detección son engorrosos lo que aumenta su variabilidad con un coeficiente de variación entre 10 a 12%. Puede determinarse por HPLC (cromatografía de alta presión líquida) (13), aunque dicha metodología no se encuentra disponible para cualquier laboratorio de análisis clínicos.
Como los niveles de OHP urinaria reflejan básicamente la cantidad de este aminoácido proveniente de la resorción ósea de colágeno sintetizado recientemente, esto hizo que su uso primordial haya sido determinar la actividad y seguimiento de la enfermedad de Paget. En osteoporosis presenta baja sensibilidad ya que existe gran sobre-exposición con los valores obtenidos en muestras de sujetos normales (21) y si bien la determinación de HOP urinaria fue el marcador de resorción histórico, con el tiempo ha sido reemplazado por otros más sensibles y específicos de hueso.
Piridinolinas
Cuando el procolágeno tipo I pierde sus fracciones propeptídicas y se transforma en colágeno tipo I se deposita en forma de fibrillas longitudinales sobre la matriz ósea. Éstas se contactan con otras fibrillas dando lugar a una fibra colágena que se estabiliza por medio de puentes de entrecruzamiento entre ellas denominados cross-links. Su formación comienza con la desaminación del grupo ε-amino de la lisina e hidroxilisina presentes en la región telopeptídica de una molécula de colágeno a su aldehído correspondiente. Este compuesto desaminado reacciona con otros residuos de lisina o hidroxilisina localizados en una molécula de colágeno vecina formando estructuras cíclicas llamada piridinolinas.
Los residuos de hidroxilisina son mucho menos abundantes en el tejido óseo respecto de otros tejidos, lo contrario ocurre con los residuos de lisina. Se conocen dos formas de piridinolinas: si el residuo que interactúa dentro de la molécula de colágeno es la hidroxilisina el producto de entrecruzamiento maduro se denomina piridinolina (Pir), mientras que si el residuo es la lisina se denomina deoxipiridinolina (D-Pir) (Fig. 7) (4). Estos productos de entrecruzamiento son importantes ya que determinan las propiedades biomecánicas y estructurales del hueso (32).
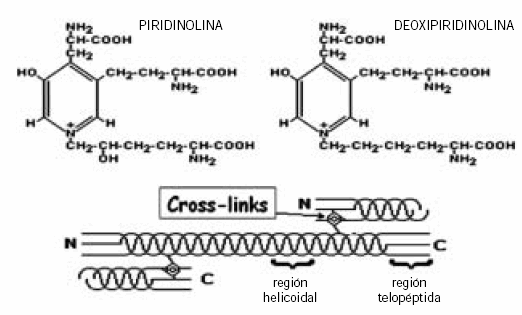
Figura 7. Productos de entrecruzamiento del colágeno tipo I (Pir y D-Pir).
La Pir y la D-Pir, también llamadas Hidroxilisilpiridinolina (HP) y Lisilpiridinolina (LP), estabilizan la molécula de colágeno maduro y constituyen uniones únicas para las moléculas de colágeno y elastina. Cuando el colágeno es degradado por osteoclastos, ambas se vuelcan a la circulación y, a diferencia de la OHP, no sufren metabolización posterior y son excretadas directamente en la orina (21).
Estos cross-links no son exclusivos del hueso: la Pir está presente en el colágeno tipo II del cartílago y otros tejidos conectivos, mientras que D-Pir se ubica casi exclusivamente en hueso y dentina. Por ello la D-Pir urinaria es más específica como marcador de resorción ósea. Como el tejido óseo es el mayor reservorio de colágeno tipo I del cuerpo y se remodela más rápidamente que el resto de los tejidos conectivos se considera que la mayoría de la D-Pir presente en la orina de un adulto será la que provenga de la resorción ósea. La D-Pir se encuentra en orina tanto en forma libre (40%) como unida a péptidos (60%). Una ventaja respecto de la determinación de HOP es que no es necesaria una dieta previa a la toma de muestra (31).
Inicialmente la determinación de Pir se realizaba por HPLC, previa hidrólisis de la muestra de orina, utilizando un detector de fluorescencia; luego se desarrollaron inmunoensayos que miden Pir libre o unida a péptidos en orina (13)(21). En la actualidad existen inmunoensayos que utilizan anticuerpos monoclonales para la detección de D-pir (26) o métodos de electroquimioluminiscencia (EQL) automatizados (33).
Telopéptidos amino y carboxilo terminal del colágeno tipo 1
La degradación de la matriz ósea es esencial para que se produzca el remodelamiento óseo. Dos tipos de enzimas proteolíticas se encuentran involucradas en dicho proceso, la catepsina K lisosomal y las MMPs cuya actividad depende del estado de remodelamiento y del tipo de hueso a ser remodelado (34).
Actualmente se considera que la catepsina K, cuya actividad es máxima a pH ácido, es la principal colagenasa del proceso de resorción ósea. Esta enzima es capaz de degradar al colágeno en varios sitios dando lugar a pequeños péptidos N- y C-terminales, dejando así expuesta a la molécula de colágeno para la acción de otras colagenasas que actúan a pH neutro, entre ellas las MMPs (16).
Se considera en la actualidad que los telopéptidos N- y C-terminal, conocidos como NTX y CTX, respectivamente son los marcadores más sensibles y específicos de la resorción ósea (Fig. 8). Estos fragmentos se forman por la actividad de la catepsina K y aparecen en cantidades significativas, tanto en sangre como en orina, donde pueden medirse por inmunoensayos específicos (4)(35). La medición sérica proporciona una ventaja con respecto al ensayo en orina porque evita el efecto aditivo de la variabilidad biológica de la excreción de creatinina urinaria (36).
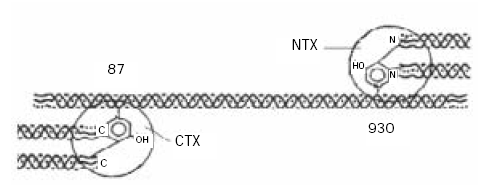
Figura 8. Telopéptidos carboxilo (C-) y amino (N-) terminal del colágeno tipo I.
Existen dos ensayos para el NTX, uno urinario por ELISA y el otro automatizado tanto en suero como en orina por EQL; en ambos casos se utiliza un anticuerpo monoclonal dirigido contra la cadena a2 (I) que no reacciona con la parte lineal de la secuencia peptídica ya que necesita de la existencia de un producto de entrecruzamiento (Pir o D-Pir) entre dos moléculas de colágeno vecinas N-terminal.
El antígeno utilizado para la evaluación del CTX es un octapéptido con la secuencia: Glu-Lys-Ala-His-Asp-Gly-Gly-Arg correspondiente a la región de entrecruzamiento de la fracción a1 (I) de la fracción telopeptídica C-terminal del colágeno tipo I. En dicho octapéptido se encuentra la secuencia Asp-Glu que es capaz de sufrir isomerizaciones espontáneas. En el hueso recién formado el Asp se encuentra en la estructura espacial a y cuando el hueso envejece se transforma espontáneamente en la forma b (37)(38). De ello, el a-CTX corresponde a hueso degradado de menor edad biológica que el b-CTX. Ambas formas pueden evaluarse independientemente por ensayos específicos (Fig. 9).

Figura 9. Cambio conformacional espontáneo de a−CTX → b-CTX.
El b-CTX o crosslaps es uno de los marcadores óseos que presenta mayor sensibilidad y especificidad en este momento y puede evaluarse en suero u orina en forma manual o automatizada. Recientemente se ha desarrollado un método ELISA para evaluar a-CTX en orina.
Para ejemplificar la diferencia entre la medición de las formas isoméricas a y b-CTX, se pueden tomar dos patologías óseas como la enfermedad de Paget y el hiperparatiroidismo primario (HPT 1º). En el primero caso, como el hueso degradado es el recientemente sintetizado, la medición de b-CTX no es útil, mientras que la a-CTX sería la adecuada. En el HPT1º, en cambio, el hueso degradado es más viejo, por ello el a-CTX determina en forma más sensible el aumento en la resorción ósea.
En la región telopeptídica C-terminal se produce por acción enzimática otro telopéptido denominado anteriormente ICTP, en la actualidad CTX-MMP. Este fue el primer marcador de resorción evaluado en suero pero como proviene de la actividad de MMPs, específicamente de la MMP-9, es menos sensible y específico que NTX y CTX para evaluar cambios en el remodelamiento óseo inducido por osteoporosis. Se considera, en cambio, que el CTX-MMP sería útil para medir cambios agudos de la resorción ósea por neoplasias.
El anticuerpo utilizado para el ensayo de ICTP requiere de los entrecruzamientos trivalentes, de Pir o D-pir, y de la fracción telopeptídica rica en fenilalanina que se encuentran presenten en los dominios C-terminal de las dos cadenas a1 del colágeno tipo I (26). Este dominio es destruido por la catepsina K, por ello se ha propuesto recientemente la denominación de CTX-MMP (39).
Fosfatasa ácida tartrato resistente
La fosfatasa ácida (FA) consiste en una familia de isoenzimas que se expresan en diferentes tejidos y células tales como próstata, hueso, hígado, riñón, bazo, plaquetas, eritrocitos, macrófagos y osteoclastos.
En sangre la FA circula como dos fracciones diferenciadas por su sensibilidad al tartrato. Todas las fosfatasas ácidas son inhibidas por L(+)-tartrato, excepto la banda 5 que se denomina fosfatasa ácida tartrato resistente (TRAP). Existen dos subtipos conocidos de TRAP: 5a y 5b que se diferencian en que la 5a contiene ácido siálico y la 5b no. Esta última proviene de los osteoclastos; el origen de TRAP-5a es desconocido, pero podría ser expresada por los macrófagos.
Los niveles de TRAP-5b representan el número y actividad de los osteoclastos más que el nivel de degradación ósea, aún así su actividad en suero aumenta en las condiciones clínicas en que el remodelamiento óseo se encuentra aumentado (4) y un cambio en su concentración sérica se considera un índice específico de alteración aguda de la resorción ósea (35).
La mayoría de los ensayos para la medición de TRAP utilizaban métodos colorimétricos donde no era posible diferenciar ambas isoformas (13). En la actualidad existen inmunoensayos con anticuerpos monoclonales específicos para TRAP-5b.
Catepsina K
La Catepsina K es un miembro de la familia de las cisteínas proteasas que, a diferencia de otras catepsinas, tiene la capacidad única de cortar las regiones helicoidales y telopeptídicas del colágeno tipo I. Su relevancia clínica fue apreciada con el descubrimiento de Pycnodysostosis, una enfermedad autosómica recesiva caracterizada por osteopetrosis, debido a mutaciones en el gen que codifica a la catepsina K. Este fenotipo clínico ha sido confirmado en ratones knock-out en catepsina K, mostrando disfunciones en la digestión de la matriz ósea.
Estudios inmunocitoquímicos demostraron que la catepsina K se encuentra intracelularmente en vesículas, gránulos y vacuolas en el citoplasma de los osteoclastos y es secretada dentro de las lagunas de resorción ósea donde participa de la degradación extracelular del colágeno. Debido al hecho de que la catepsina K es expresada y secretada por osteoclastos durante la resorción ósea activa actualmente es considerada un marcador de la actividad osteoclástica (13).
Utilidad clínica de los marcadores de remodelamiento óseo
La certeza con que un marcador refleje el remodelamiento óseo va a depender, entre otros factores, de su especificidad. Por ello, un marcador óseo ideal para determinar cambios en la velocidad de remodelamiento sería aquel que sólo sea producido por las células óseas.
Se debe recordar que el proceso de resorción es más rápido que el de formación, por ello todo aumento en el ciclo de remodelamiento lleva a una pérdida de masa ósea. El diagnóstico de una baja masa ósea se realiza mediante la medición de la densidad mineral ósea (DMO) que, de acuerdo con el número de desviaciones estándares respecto del valor de DMO en columna y fémur de un sujeto joven normal sano (T-Score), determinará la presencia de osteopenia y distintos grados de osteoporosis (11)(40)(41). En la Tabla II se enumeran las pautas del comité de expertos de la Organización Mundial de la Salud (OMS) para el diagnóstico de osteoporosis en un paciente individual.
Tabla II. Clasificación de osteoporosis/osteopenia según la OMS.

En la Figura 10 se grafican los niveles individuales de CTX urinario obtenidos en un grupo de sujetos con diferentes características (42). Este estudio evidencia que alguno de los valores de CTX urinario obtenido en mujeres postmenopáusicas osteoporóticas presenta sobreexposición con aquellos obtenidos en mujeres postmenopáusicas sanas, premenopáusicas y aun en hombres. Esto hace que aun los marcadores más sensibles y específicos no sirvan para diagnosticar.
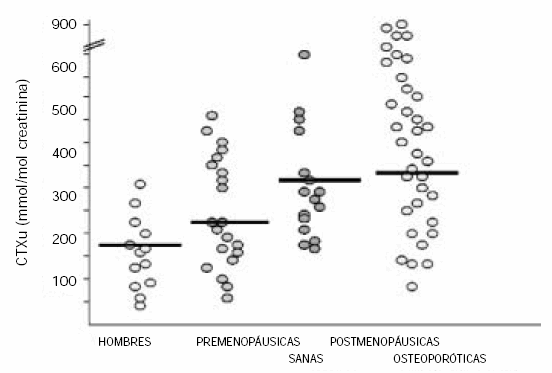
Figura 10. Falta de utilidad diagnóstica de los marcadores óseos (42).
Si bien los marcadores no sirven para el diagnóstico, son útiles para identificar a los sujetos denominados "perdedores rápidos" que se caracterizan por niveles aumentados del remodelamiento óseo. De aquí que la utilidad clínica más importante de los marcadores óseos consista en diferenciar un alto índice de recambio óseo de uno bajo. En este sentido, niveles elevados de marcadores óseos sensibles y específicos indicarían una pérdida acelerada de masa ósea que si continúa en el tiempo puede conducir a osteoporosis e incremento en el riesgo de fracturas. Por ello, identificar individuos con elevado remodelamiento permitiría aplicar en forma preventiva un tratamiento antirresortivo que disminuya el remodelamiento, evitando así la pérdida de hueso (21). La Figura 11 ejemplifica este concepto mediante los resultados obtenidos en un estudio realizado en un grupo de mujeres sanas postmenopáusicas. En dicho estudio en forma basal las mujeres se dividieron en cuartilos de resorción ósea mediante la medición del NTX urinario. De acuerdo con esta división se determinó el cambio en la DMO de columna entre los tiempos finales del estudio (12 meses) y basal, sin que las mujeres hayan recibido algún tipo de tratamiento. Se evidencia que las mujeres que se encontraban en el mayor cuartilo de resorción ósea, presentaron la mayor pérdida de masa ósea al año del estudio.

Figura 11. Porcentaje de cambio en la DMO al año de acuerdo con el cuartilo inicial de NTX en orina (43).
El uso de marcadores óseos en pacientes individuales puede ser apropiado en algunas situaciones, sobre todo en mujeres peri o postmenopáusicas con mediciones de DMO dentro de la normalidad (44). Un aumento en los niveles de marcadores puede sugerir un tratamiento preventivo para evitar, en un futuro, la pérdida de hueso.
La masa ósea, la velocidad de pérdida de hueso y el riesgo de fracturas osteoporóticas se encuentran relacionadas y por lo tanto una baja masa ósea así como un aumento en la pérdida de hueso evaluada por incremento en el remodelamiento óseo, son predictores independientes del riesgo relativo de fracturas de cadera y vertebrales. El valor predictivo es mayor para los marcadores de resorción que para los de formación, es también mayor en las mujeres adultas que en las jóvenes (25)(45) mientras que en hombres los distintos estudios no mostraron resultados concluyentes.
En principio, si el ciclo de remodelamiento óseo se encuentra acoplado, tanto el aumento en un marcador de resorción como en uno de formación podría predecir la futura pérdida de masa ósea. Sin embargo, en la actualidad los marcadores más específicos y sensibles son el NTX y el CTX, ambos de resorción. Asimismo, sus niveles aumentados, tal como lo demuestra el estudio de Garnero et al., independientemente de la DMO son predictores de riesgo de fractura de cadera y vertebral (40)(46). Sujetos con niveles elevados de CTX muestran un riesgo relativo similar a aquellos que presentan una baja DMO. Asimismo, individuos que sumen la baja masa ósea a una resorción elevada medida por CTX duplican el riesgo relativo de fracturas de cadera (Fig. 12) (47).
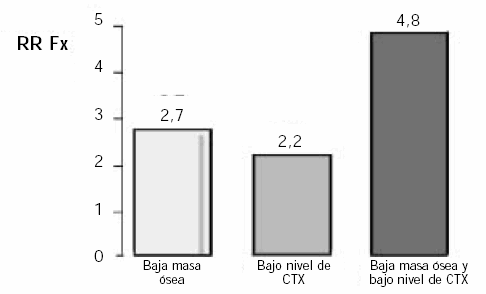
Figura 12. Riesgo relativo de fracturas evaluado por DMO y por marcadores bioquímicos específicos de resorción ósea (47).
La ventaja más importante de la medición de los marcadores es que se trata de métodos poco invasivos que si son aplicados e interpretados correctamente se convierten en herramientas útiles que ayudan al diagnóstico y seguimiento terapéutico de las enfermedades metabólicas óseas (13)(40). En este sentido determinan, en un corto periodo de tiempo, la adherencia y efectividad del tratamiento (48). Una caída en los niveles de los marcadores de resorción de alrededor del 50% entre el tercero y sexto mes de una terapia antirresortiva predice una buena respuesta (46).
Los niveles de los marcadores pueden identificar problemas en la absorción de la medicación o carencia de respuesta al tratamiento (individuos no respondedores) pero también pueden indicar, por parte del paciente, disconformidad y falta de adherencia a la terapia instituida (Fig. 13).

Figura 13. Diferentes respuestas de un marcador de resorción específico ante un tratamiento instituido.
Si el objetivo es controlar la eficacia terapéutica, lo más adecuado sería utilizar un marcador de resorción para aquellos tratamientos con anticatabólicos ya que en un periodo corto de tiempo (entre 1 a 3 meses) determinan los cambios que al año podrían recién observarse en la DMO (21)(31). En caso de tratamientos anabólicos, como la inyección en forma de pulsos de PTH, lo más apropiado sería utilizar marcadores de formación ósea (3).
La respuesta "clínicamente significativa" al tratamiento puede ser evaluada mediante el denominado "Minino Cambio Significativo" (LSC) el cual, mediante una fórmula en la que se contempla tanto la variabilidad biológica como la variabilidad analítica, determinará si los cambios son específicos del tratamiento o no (ruido)(42). Para evaluar el LSC se debe realizar la medición basal del marcador en dos muestras tomadas en forma consecutiva a la primera y la 12a. semana. Con dichos valores se obtendrá un valor promedio del marcador bioquímico utilizado que disminuirá la variabilidad individual. Asimismo, se deberá contar con una muestra postratamiento cuya extracción dependerá del marcador usado y del tipo de tratamiento (rápidamente efectivos o de efectividad más lenta). En este sentido se considera tres meses como un período adecuado para el tratamiento con bisfosfonatos y de seis meses para un tratamiento con terapia hormonal de reemplazo (21).
El LSC dependerá de la sensibilidad y especificidad del marcador utilizado, es decir cuanto más específico y sensible sea el marcador, los porcentajes de cambio para determinar una respuesta positiva al tratamiento son menores. Por supuesto, los valores de LSC menores se presentan en los marcadores óseos evaluados en sangre.
Otra de las formas de evaluar la efectividad del tratamiento es comparar el nivel actual del marcador óseo con un rango predefinido como de "referencia" o de "normalidad". En general se toma como rango normal al obtenido en mujeres premenopáusicas sanas: promedio ± 2DE. Para ello, cada laboratorio debería contar con un valor de referencia independientemente del suministrado por el fabricante del equipo. Respecto de las mujeres postmenopáusicas con remodelamiento normal se considera que el nivel del marcador óseo evaluado no debe sobrepasar los 2DE del correspondiente a mujeres premenopáusicas sanas. Todo valor por encima del mismo se tomará como remodelamiento aumentado.
Interpretación clínica de un marcador bioquímico óseo
En un sujeto individual, la interpretación del valor de un marcador bioquímico de remodelamiento óseo es complicada debido a los distintos factores que podrían influir en sus resultados y que, por lo tanto, deben tenerse en cuenta. Entre ellos se encuentran la influencia de las condiciones preanalíticas, sus características analíticas de sensibilidad y especificidad y su variabilidad biológica. Asimismo, la falta de estandarización hace aún más engorrosa la comparación entre los resultados obtenidos por los distintos laboratorios.
La variación preanalítica incluye la preparación del paciente antes de la obtención de la muestra (horas de ayuno, necesidad de dieta diaria) y tipo de muestra (suero-orina), anticoagulantes utilizados, temperatura de manipulación y almacenamiento, ciclos de congelamiento y descongelamiento, entre otros. Todas estas fuentes de variabilidad técnicas son importantes y pueden ser controladas (49).
La variación analítica es función de la reproducibilidad y exactitud de las técnicas empleadas (50). Las muestras sanguíneas presentan menos variación analítica que las urinarias ya que a estas últimas se le debe sumar el error de la determinación de creatinina. Aunque el error de precisión analítica de los marcadores es alto (10 a 20%), el porcentaje de descenso por efecto del tratamiento utilizando un marcador sensible y específico es mayor (40 a 60% luego de 3 a 6 meses), esto hace que los marcadores sean útiles para determinar la eficacia de la terapia instituída (21).
La variabilidad biológica depende de la regulación del remodelado óseo relacionado con factores mecánicos (actividad física y fuerza muscular) y humorales (concentración de Ca++ y fosfatos, hormonas, vitamina D, citoquinas) que actúan sobre la células óseas para el reclutamiento, proliferación y función celular (50). Ciertos factores biológicos como la edad, género, etnicidad, etc., no pueden modificarse; en cambio, otros factores pueden ser modificables y, por lo tanto, deben tenerse en cuenta para tratar de disminuir su influencia al máximo posible.
Distintos estudios han investigado diversas condiciones que influirían en los resultados de los marcadores óseos tales como la dieta, tipo de muestra, cambio diario (ritmo circadiano), ciclo menstrual, menopausia, estación anual, edad, sexo, crecimiento (44). A continuación se enumeran los más importantes.
- Variación diaria (circadiana): salvo las determinaciones enzimáticas, los marcadores bioquímicos presentan variación diaria con valores más elevados en las primeras horas de la mañana y más bajos en horas de la tarde. En general, la amplitud de la variación se encuentra entre el 20-30%, aunque el mayor o menor valor dependerá del marcador utilizado. La etiología de esta variación es desconocida aunque varias hormonas que presentan ritmo diario (PTH, hormona de crecimiento, cortisol, etc) podrían estar involucradas parcialmente en dicho cambio.
- Edad: las concentraciones de marcadores óseos, tanto en suero como en orina, no son estables a través de la vida. Son altas al nacimiento y descienden en la niñez siguiendo la curva de velocidad de crecimiento; se incrementan nuevamente en la pubertad debido a la 2° etapa de velocidad de crecimiento. Es más temprano y de menor intensidad en las niñas. A partir de ahí, decrecen y se mantienen estables hasta la menopausia, en que se incrementan, en la mujer, nuevamente en relación directa a la deficiencia de estrógenos. En los hombres, en cambio, permanecen sin grandes variaciones. A partir de los 70 años se observa un incremento que es independiente del género (48).
- Variación en días consecutivos: En general, la variación para un mismo individuo observada al evaluar un marcador en sangre es menor a la observada en la medición de los marcadores bioquímicos evaluados en orina.
- Variación estacional (circoanuales): En climas templados, en general, se observan valores más altos en otoño-invierno (20-30%) debido, en parte, a la influencia que presenta sobre el metabolismo óseo el estado fisiológico de la vitamina D.
- Ciclo menstrual: La mayoría de los marcadores óseos presentan variación durante el ciclo menstrual. La resorción es de mayor amplitud (10- 20%) durante el período medio y tardío de la fase folicular y temprano de la fase luteal. Por tal motivo se recomienda la extracción de la muestra entre el 3er. y 7mo. día del ciclo menstrual.
- Dieta: La ingestión de alimentos reduce la resorción ósea en forma postprandial posiblemente mediada por la liberación de péptidos intestinales y/o pancreáticos. La composición de la dieta por largos período de tiempo (ingestión de Ca, vitamina D, proteínas y fosfatos) pueden modificar el remodelamiento óseo. Por ello, la medición de marcadores en sangre debería ser evaluada en ayunas y, si es posible, permanecer con una dieta estable durante una o dos semanas previas a la recolección.
- Estilo de vida: El ejercicio moderado reduce el recambio óseo. Asimismo el alcoholismo y tabaco alteran los valores.
- Funcionamiento hepático y renal: Un mal funcionamiento hepático puede alterar marcadores que se metabolizan en hígado mientras que la insuficiencia renal crónica produce acumulación de los marcadores óseos que por su estructura química no pueden filtrar en dichas condiciones por el glomérulo.
- Actividad física: la ingravidez o la inmovilización prolongada da lugar a un aumento acelerado de la resorción ósea, con aumento de los marcadores.
- Otras causas: raza, embarazo y lactancia.
Conclusiones
Desde el punto de vista fisiopatológico, la osteoporosis se define como "pérdida cuantitativa de la DMO que causa una disminución de la resistencia biomecánica del hueso, por consiguiente, facilita la aparición de fracturas ante traumatismos que no serian suficientes para causarla, si el esqueleto hubiera conservado sus características iniciales". En esta patología no se observan anormalidades en la estructura de la matriz orgánica del hueso, sino que se presenta una reducción de la masa ósea, indicativa de una mayor tasa de resorción del hueso, menor formación o ambas. Para prevenirla es de suma utilidad determinar el nivel de remodelamiento óseo, ya que todo aumento lleva a la pérdida de masa ósea. Los marcadores bioquímicos de resorción y formación son una herramienta atractiva no sólo para identificar aumentos exagerados del remodelamiento sino para controlar la eficacia de una terapia en un corto período de tiempo. Sin embargo, la interpretación de los resultados exige contar con niveles de referencia adecuados.
Los marcadores no sirven para diagnosticar osteoporosis porque aun los marcadores más sensibles y específicos presentan valores que se superponen en condiciones de normalidad o de osteoporosis. Sin embargo, la medición de los marcadores óseos en conjunto con las de DMO provee información adicional que ayuda a optimizar el control de la osteoporosis.
CORRESPONDENCIA
PROF. DRA. SUSANA N. ZENI
Sección Osteopatías Médicas. Hospital de Clínicas
Córdoba 2351- 8vo. Piso
1120 CIUDAD AUTÓNOMA DE BUENOS AIRES
Argentina
1. Canalis E. Effect of insuline like growth factor I on DNA and protein synthesis in cultures rat calvariae. J Clin Invest 1980; 66: 709-19. [ Links ]
2. Manolagas SC. Birth and death of bone cells: basic regulatory mechanisms and implications for the pathogenesis and treatment of osteoporosis. Endocr Rev 2000; 21: 115-37. [ Links ]
3. Camozzi V, Tossi A, Simoni E, Pagani F, Francucci CM, Moro L. Role of biochemical markers of bone remodelling in clinical practices. J Endocrinol Invest 2007; 30: 13-7. [ Links ]
4. Ross PF, Christiano AM. Nothing but skin and bone. J Clin Invest 2006; 116: 1140-9. [ Links ]
5. Allison´s Restrospection. Bone remodelling. Physiology by Alliraph 2007. Disponible en: http://alliraph.wordpress.com/2007/11/03/bone-remodelling/. Fecha de acceso 2 de noviembre de 2008. [ Links ]
6. Mundy GR. Bone-Resorbing Cells. In: Favus MJ editor. Primer on the metabolic bone diseases and disorders of mineral metabolism. 3st. ed. New York: Lippincott- Raven publishers; 1996. [ Links ]
7. Davies J, Warwick J, Tatty N, Philip R, Helfrich M, Horton M. The osteoclast functional antigen, implicated in the regulation of bone resorption, is biochemically related to vitronectin receptor. J Cell Biol 1989; 109: 1817-26. [ Links ]
8. Baron R. Anatomy and ultrastructure of bone. In: Favus MJ, Ed. Primer on Metabolic Bone diseases and disorders of mineral metabolism. New York: Raven Press; 1993. [ Links ]
9. Cordova A. Compendio de Fisiología para Ciencias de la Salud Interamericana de España - Madrid: Mc- GRAW - HILL; 1996. [ Links ]
10. Dempster D. Bone remodeling and its regulation. En: ECTX training course in bone markers. 35 th European Symposium on Calcified Tissues (ECTS) 24 de mayo de 2008. Barcelona - España; 2008. p.9. [ Links ]
11. McCormick RK. Osteoporosis: intergrating biomarkers and other diagnostic correlates into the management of bone fragility. Altern Med Rev 2007; 12: 113-45. [ Links ]
12. Oliveri B, Wittich A, Nadal M, Zeni SN. Telopéptido carboxilo terminal del colágeno tipo I (=-CTX) sérico y compromiso óseo en la insuficiencia renal crónica. Medicina (Buenos Aires) 2005; 65: 321-8. [ Links ]
13. Seibel MJ. Biochemical markers of bone turnover. Part II: Clinical applications in the management of osteoporosis. Clin Biochem Rev 2006; 27: 123-38. [ Links ]
14. Noble BS. The osteocyte lineage. Arch Biochem Biophys 2008; 473: 106-11. [ Links ]
15. Behnke B, Kemper M, Kruse HP, Muller-Weifel D. Bone alkaline phosphatase in children with chronic renal failure. Nephrol Dial Transplant 1998; 13: 662-7. [ Links ]
16. van Bezooijen RL, Roelen BA, Visser A, van der Wee- Pals L, de Wilt E, Karperien M, et al. Sclerostin is an osteocyte-expressed negative regulator of bone formation, but not a classical BMP antagonist. J Exp Med 2004; 199: 805-14. [ Links ]
17. Boyce BF, Xing L. Biology of RANK, RANKL, and osteoprotegerin. Arthritis Res Ther 2007; 9:S1 (doi: 10.1186 - 2165). [ Links ]
18. Tanaka Y, Maruo A, Fujii K, Nomi M, Nakamura T, Eto S, et al. Intercellular adhesion molecule 1 discriminates functionally different populations of human osteoblasts: characteristic involvement of cell cycle regulators. J Bone Miner Res 2000; 15: 1912-23. [ Links ]
19. Yasuda H, Shima N, Nakagawa N, Yamaguchi K, Kinosaki M, Mochizuki S, et al. Osteoclast differentiation factor is a ligand for osteoprotegerin/osteoclastogenesis- inhibitory factor and is identical to TRANCE/RANKL. Proc Natl Acad Sci U S A 1998; 95: 3597-602. [ Links ]
20. Watts WS. Clinical utility of biochemical markers of bone remodelling. Clin Chem 1999; 45: 1359-68. [ Links ]
21. Jamal SA, Leiter RE, Bayoumi AM, Bauer DC, Cummings SR. Clinical utility of laboratory testing in women with osteoporosis. Osteoporos Int 2005; 16: 534-40. [ Links ]
22. Vasikaran SD. Utility of biochemical markers of bone turnover and bone mineral density in management of osteoporosis. Crit Rev Clin Lab Sci 2008; 45: 221-58. [ Links ]
23. Lee NK, Sowa H, Hinoi E, Ferron M, Ahn JD, Confavreux C, et al. Endocrine regulation of energy metabolism by the skeleton. Cell 2007; 130: 456-69. [ Links ]
24. Khosla S, Kleerekoper M. In: Favus MJ editor. Primer on the metabolic bone diseases and disorders of mineral metabolism. 5th. ed. Whashington DC: American Society for Bone and Mineral Research publishers; 2003. [ Links ]
25. Kessler E, Takahara K, Biniaminov L, Brusel M, Greenspan DS. Bone morphogenetic protein-1: The type I procollagen C-proteinase. Science 1996; 271: 360-2. [ Links ]
26. Robins SP, Woitge H, Hesley R, Ju J, Seyedin S, Seibel MJ. A direct, enzyme-linked immunoassay for urinary deoxypyridinoline as a specific marker for measuring bone resorption. J Bone Miner Res 1994; 9: 1643-9. [ Links ]
27. Orum O, Hansen M, Jensen CH, Sorensen HA, Jensen LB, Horslev-Petersen K, et al. Procollagen type I N-terminal propeptide (PINP) as an indicator of type I collagen metabolism: ELISA development, reference interval, and hypovitaminosis D induced hyperparathyroidism. Bone 1996; 19: 157-63. [ Links ]
28. Melkko J, Kauppila S, Risteli L, Niemi S, Haukipuro K, Jukkola A, et al. Immunoassay for intact aminoterminal propeptide of human type I procollagen. Clin Chem 1996; 42: 947-54. [ Links ]
29. Melkko J, Niemi S, Risteli L, Risteli J. Radioimmunoassay of the carboxyterminal propeptide of human type I procollagen. Clin Chem 1990; 36: 1328-32. [ Links ]
30. Kanis JA, Delmas PD. European guidance for the diagnosis and management of osteoporosis in postmenopausal women. Osteoporos Int 2008; 19: 99-428. [ Links ]
31. Manjón Llorente G, Fernández Espuelas C. Normal values of bone turnover markers in childhood. An Pediatr (Barc) 2004; 60: 330-6. [ Links ]
32. Wassen MHM, Lammens J, Tekoppele JM, Sakkers RJB, Liu Z, Verbout Aj, et al. Collagen structure regulates fibril mineralization in osteogenesis as revealed by crosslink patterns in calcifying callus. J Bone Miner Res 2000; 15: 1776-85. [ Links ]
33. Rosano TG, Peaston RT, Bone HG, Woitge HW, Francis RM, Seibel MJ. Urinary free deoxypyridinoline by chemiluminescence immunoassay: analytical and clinical evaluation. Clin Chem 1998; 44: 2126-32. [ Links ]
34. Everts V, Delaisse JM, Korper W, Beertsen W. Cysteine proteinases and matrix metalloproteinases play distinct roles in the subosteoclastic resorption zone. J Bone Miner Res 1998; 13: 1420-30. [ Links ]
35. Bjoerm H, Christian E, Feld M, Zichner L, Kurth A. Tartrate-resistant acid phosphatase 5b (TRAP 5b) as a marker of osteoclast activity in the early phase after cement less total hip replacement. Acta Orthopaedic 2007; 78: 221-5. [ Links ]
36. Scariano JK, Garry PJ, Montoya GD, Wilson JM, Baumgartner RN. Critical differences in the serial measurement of three biochemical markers of bone turnover in the sera of pre - and postmenopausal women. Clin Biochem 2001; 34: 639-44. [ Links ]
37. Fledelius C, Johnsen AH, Cloos PAC, Bonde M, Qvist P. Characterization of urinary degradation products derived from type I collagen. Identification of a b-isomerized Asp-Gly sequence within the C-terminal telopeptide (a1) region. J Biol Chem 1997; 272: 9755-63. [ Links ]
38. Pedersen BJ, Ravn P, Bonde M. Type I collagen Ctelopeptide degradation products as bone resorption markers. J Clin Ligand Assay 1998; 21: 118-27. [ Links ]
39. Delmas PD, Committee of Scientific Advisors of the International Osteoporosis Foundation. Bone marker nomenclature. Bone 2001; 28: 575-6. [ Links ]
40. Garnero P, Delmas PD. Contribution of bone mineral density and bone turnover markers to the estimation of risk of osteoporotic fracture in postmenopausal women. J Musculoskelet Neuronal Interact 2004; 4: 50-63. [ Links ]
41. Kanis A. Diagnosis of osteoporosis and assessment of fracture risk. The Lancet 2002; 359: 9321. [ Links ]
42. Zeni S, Wittich A, Di Gregorio S, Casco C, Oviedo A, Somoza J, et al. Utilidad clínica de los marcadores de formación y resorción ósea. Acta Bioquím Clín Latinoam 2001; 35: 3-36. [ Links ]
43. Srivastava AK, Vliet EL, Lewiecki EM, Maricic M, Abdelmalek A, et al. Clinical use of serum and urine bone markers in the management of osteoporosis. Curr Med Res Opin 2005; 21: 1015-26. [ Links ]
44. Abe Y, Ishikawa H, Fukao A. Higher efficacy of urinary bone resorption marker measurements in assessing response to treatment for osteoporosis in postmenopausal women. Tohoku J Exp Med 2008; 214: 51-9. [ Links ]
45. Ross PD, Knowlton W. Rapid bone loss is associated with increased levels of biochemical markers. J Bone Miner Res 1998; 13: 297-302. [ Links ]
46. Allende Vigo MZ. The use of biochemical markers of bone turnover in osteoporosis. P R Health Sci J 2007; 26: 91-5. [ Links ]
47. Garnero P, Hausherr E, Chapuy MC, Marcelli C, Grandjean H, et al. Markers of bone resorption predict hip fracture in elderly women: the EPIDOS Prospective Study. J Bone Miner Res 1996; 11: 1531-8. [ Links ]
48. Souberbielle JC, Cormier C, Kindermans C. Bone markers in clinical practice. Curr Opin Rheumatol 1999; 11: 312-9. [ Links ]
49. Seibel MJ, Lang M, Geilenkeuser WJ. Interlaboratory variation of biochemical markers of bone turnover. Clin Chem 2001; 47: 1443-50. [ Links ]
50. Alvarez H, Santana M, Casas E. Variabilidad Analítica y Biológica de los Marcadores de Osteoporosis. Rev Cub Reumatol 2006; 8 (9,10): 86-7. [ Links ]
Aceptado para su publicación el 17 de marzo de 2009














