Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Acta bioquímica clínica latinoamericana
Print version ISSN 0325-2957
Acta bioquím. clín. latinoam. vol.44 no.4 La Plata Oct./Dec. 2010
BIOQUÍMICA CLÍNICA
Estudio de las enzimas lisosomales N-acetil-α-D-glucosaminidasa y arilsulfatasa A en adultos cubanos*
Assay of lysosomal N-acetyl-α-D-glucosaminidase and arylsulfatase A activities in Cuban adults*
Derbis Campos1, Yenia Ledesma2, Madelyn Monaga1, Darlenis Herrera3, Yanadelys Pampín4
1. Licenciado en Bioquímica.
2. Especialista Genética Clínica.
3. MSc Bioquímica.
4. Téc. Química.
* Centro Nacional de Genética Médica. Campus del ICBP Victoria de Girón. Calle 146 N° 3102, Playa. La Habana 16, C.P: 1600. Cuba.
Resumen
El objetivo de este estudio fue determinar, en una muestra de individuos cubanos, un rango preliminar de valores normales de actividad específica de N-acetil- α-D-glucosaminidasa y arilsulfatasa A, enzimas deficientes en la mucopolisacaridosis tipo III B y la leucodistrofia metacromática, respectivamente. Se realizó una investigación de corte transversal, en muestras de sangre de 38 individuos adultos. Se realizó la extracción de los leucocitos y se determinó la actividad específica de las enzimas por métodos espectrofotométricos. Todos los participantes fueron caracterizados desde el punto de vista clínico como sanos para ambas enfermedades. Se obtuvieron valores medios de actividad específica de N-acetil-α-D-glucosaminidasa y arilsulfatasa A de 1,52±0,30 y 121,37±20,14 nmol/mg/h, respectivamente. No se encontraron diferencias significativas en relación a las características étnicas para ninguna de las dos enzimas (p<0,05). Este constituye el primer estudio cubano en el cual se publican rangos de actividad específica para estas enzimas en individuos cuya condición de sanos y no relacionados familiarmente con la enfermedad ha sido clínicamente demostrada. El análisis de un mayor número de muestras permitirá establecer los puntos de corte que dotarán al diagnóstico bioquímico de estas enfermedades de una mayor confiabilidad.
Palabras clave: Mucopolisacaridosis III B; Leucodistrofia metacromática; Acetilglucosaminidasa; Arilsulfatasa A; Enfermedades lisosomales; Valores de referencia; Errores innatos del metabolismo
Summary
The aim of this study was to determine, in a sample of Cuban individuals, a preliminary range of normal values of N-acetyl-α-D-glucosaminidase and arylsulfatase A activity, enzymes that are deficient in mucopolysaccharidosis type III B and metachromatic leukodystrophy, respectively. A cross-sectional research was conducted. Blood samples were obtained out of 38 adult individuals. The leucocytes were extracted and the specific enzymatic activity was assayed by spectrophotometric methods. All participants were characterized from the clinical point of view as healthy for both diseases. Average values of N-acetyl-α-D-glucosaminidase and arylsulfatase A specific activities of 1.52 ± 0.30 and 121.37 ± 20.14 nmol/mg/h, respectively were obtained. There were no significant differences related to ethnicity for any of the two enzymes (p <0.05). This is the first Cuban study in which ranges of activity for these enzymes have been reported in healthy individuals whose healthy and non-familiarly related with the disease status have been clinically demonstrated. The analysis of more samples will establish the cutoff points that will increase the reliability of the biochemical diagnosis of these diseases.
Key words: Mucopolysaccharidosis III B; Metachromatic leukodystrophy; Acetylglucosaminidase; Arylsulfatase A; Lisosomal diseases; Reference values; Inborn errors of metabolism
Introducción
La mucopolisacaridosis tipo III B (MPS III B) y la leucodistrofia metacromática son enfermedades genéticas de almacenamiento lisosomal con un patrón de herencia autosómico recesivo. Se producen debido a la deficiencia de las enzimas N-acetil-α-D-glucosaminidasa y arilsulfatasa A, respectivamente. La deficiencia de estas enzimas produce la acumulación de los sustratos sin degradar en diferentes tejidos y órganos. Aunque el fenotipo clínico es variable, en el 95% de los casos se producen alteraciones neurológicas y no neurológicas graves que pueden provocar la muerte del paciente antes de los primeros cinco años de vida (1). Actualmente no existe un tratamiento capaz de detener el curso de estas enfermedades pero cuando se detectan precozmente se pueden tomar medidas paliativas que ayudan a mejorar la calidad de vida del paciente y esto permite el asesoramiento genético de su familia. Es por ello que resulta de gran importancia el diagnóstico temprano de las mismas. En Cuba el diagnóstico bioquímico que permite confirmar una sospecha clínica inicial se realiza mediante la determinación de la actividad enzimática específica en homogenados de leucocitos. Para esto se toma una muestra de sangre del paciente, de sus progenitores en caso de ser posible y de individuos controles presentes en el momento de la extracción y que se asumen como sanos para la enfermedad. A partir del valor promedio de actividad enzimática específica de estos controles negativos se determina el porcentaje de actividad relativa del paciente. Cuando este valor es menor del 30% se diagnóstica al paciente como deficiente para la actividad enzimática en estudio (2). En Cuba no se han publicado estudios que permitan establecer valores de referencia nacionales para estas actividades enzimáticas específicas, teniendo en cuenta las características genéticas propias de esta población y su interacción con el ambiente, lo cual brindaría una mayor confiabilidad en el diagnóstico. El objetivo de este trabajo fue determinar, en leucocitos de individuos cubanos sanos, la actividad de las enzimas N-acetil-α-D-glucosaminidasa y arilsulfatasa A.
Materiales y Métodos
SELECCIÓN DE INDIVIDUOS CONTROL
Esta investigación se realizó de acuerdo con la Declaración de Helsinki de la Organización Mundial de la Salud (3) y fue aprobada por el Comité de Ética en la Investigación del Centro Nacional de Genética Médica. La muestra de individuos estuvo conformada por todos los donantes voluntarios que asistieron al Banco de Sangre Provincial de Marianao (La Habana, Cuba) durante la última quincena del mes de mayo de 2007 y que dieron su consentimiento informado para participar en la investigación. En total se incluyeron en el estudio 38 individuos.
A cada participante se le confeccionó la historia clínica con el objetivo de demostrar la ausencia de antecedentes personales y familiares para ambas enfermedades en estudio. Para este propósito, un especialista en Genética Clínica realizó un interrogatorio profundo y el examen físico a cada participante buscando la presencia de signos clínicos característicos de estas enfermedades como: demencia progresiva, conducta agresiva, hiperactividad, convulsiones, sordera, pérdida de la visión, retardo en el aprendizaje, pérdida de capacidades de lenguaje, pérdida parcial o total de la audición, alteraciones de la marcha, debilidad distal de extremidades inferiores, epilepsia, entre otros. La búsqueda de signos clínicos característicos de la enfermedad mediante el interrogatorio clínico se extendió hasta tres generaciones para la confección del árbol genealógico.
MUESTRAS
Las muestras de leucocitos se obtuvieron a partir de 10 mL de sangre venosa periférica colectada en tubos de prolipropileno estériles con heparina. La extracción de los leucocitos a partir de la sangre se realizó mediante sedimentación en una mezcla de dextrán-ácido cítricoglucosa, según el método de Skoog y Beck (4). El precipitado final de leucocitos se conservó a -20 °C hasta el momento de realizar el ensayo enzimático, en un período inferior a las 72 h posteriores a la extracción. En ese momento se resuspendió el precipitado en agua destilada y se lisaron las células mediante tres ciclos de congelación-descongelación. A cada muestra de homogenado de leucocitos se le determinó la concentración de proteínas totales mediante el método de Lowry (5) empleando una curva de calibración de albúmina de suero bovino.
DETERMINACIÓN DE ACTIVIDAD ESPECÍFICA DE N-ACETIL-α-D-GLUCOSAMINIDASA
La actividad específica de N-acetil-α-D-glucosaminidasa se determinó por un método espectrofotométrico utilizando como sustrato p-nitrofenil-N-acetil-α-D-glucosaminida (6). A 80 μL del homogenado de leucocitos, con una concentración de proteínas de 0,3 μg/mL, se le adicionaron 200 μL del sustrato a una concentración de 10 mmol/L, preparado en solución amortiguadora fosfato-citrato, 0,1 mol/L, pH 4,5. Los tubos de reacción se incubaron durante 16 h a 37 °C en baño termostatizado. Posteriormente se adicionaron 80 μL de ácido tricloroacético 10% (peso/volumen), se agitó y se centrifugó a 15 700 g por 10 min. Se tomaron 200 μL del sobrenadante y se le adicionaron 1000 μL de solución amortiguadora carbonato de sodio 0,5 mol/L, pH 10,7. La absorbancia del producto formado se midió en un espectrofotómetro Jasco V-530 (Jasco International corp., Tokio, Japón) a 410 nm y se calculó su concentración mediante una curva de calibración de p-nitrofenol. La actividad enzimática específica de cada muestra se expresó como nmoles de producto formado en una hora por mg de proteína total.
DETERMINACIÓN DE ACTIVIDAD ESPECÍFICA DE ARILSULFATASA A
La actividad específica de arilsulfatasa A se determinó mediante un método espectrofotométrico utilizando como sustrato el p-nitrocatecol sulfato (6). A 100 mL del homogenado de leucocitos, con una concentración de proteína de 1 μg/mL, se le adicionaron 500 μL del sustrato a una concentración de 10 mmol/L. El sustrato se preparó en solución amortiguadora de acetato de sodio 0,5 mol/L, pH 5 conteniendo pirofosfato de sodio 0,5 mmol/L y cloruro de sodio 1,7 mol/L. Los tubos de reacción se incubaron 1 h a 37 °C en baño termostatizado. La reacción se detuvo adicionando 500 μL de solución de hidróxido de sodio 1 mol/L. La absorbancia del producto formado se midió en un espectrofotómetro Jasco V-530 a 516 nm y se calculó su concentración mediante una curva de calibración de p-nitrocatecol. La actividad enzimática específica de cada muestra se expresó como nmoles de producto formado en una hora por mg de proteína total.
ANÁLISIS ESTADÍSTICO
El procesamiento estadístico de los resultados se realizó mediante el programa Statistica 6.0 (StatSoft Inc., 2001) utilizando un nivel de significación menor de 0,05. Para la determinación de diferencias dentro de cada grupo de valores de actividad enzimática específica se utilizaron las características étnicas como variable independiente mediante un modelo de análisis de varianza de efectos fijos. El intervalo de referencia de valores normales para cada actividad específica se estableció para dos valores de desviación estándar a cada lado de la media de actividad obtenida (7).
Resultados
A partir de la historia clínica de cada individuo se demostró que los mismos no tenían antecedentes personales ni familiares de errores innatos del metabolismo y en especial de MPS III B y leucodistrofia metacromática. Del total de individuos incluidos en el estudio, sólo uno pertenecía al sexo femenino y las edades oscilaron entre 18 y 59 años.
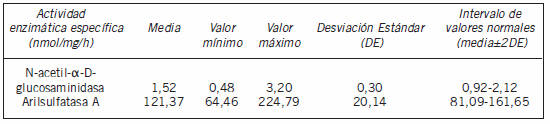
En la Tabla I se muestran los valores de actividad específica de N-acetil-α-D-glucosaminidasa y arilsulfatasa A obtenidos para esta muestra. A partir de estos valores se estimó la media de la actividad específica de N-acetil-α-D-glucosaminidasa en la población adulta sana, principalmente de género masculino, entre 1,26-1,78 nmol/mg/h con un 95% de confianza. También se determinó con un 95% de confianza, que la media de la actividad específica de arilsulfatasa A en esta misma población se encuentra entre 108,14 y 134,61 nmol/mg/h.
Tabla I. Resumen de las actividades lisosomales ensayadas.
Las características étnicas se utilizaron como variable independiente para determinar posibles diferencias en los valores de ambas actividades enzimáticas específicas (Tabla II). Previamente se constató la homogeneidad de varianza entre los grupos mediante la prueba de Brown-Forsythe para un valor de p<0,05; F(2,37) = 0,41 para la actividad específica de N-acetil-α-D-glucosaminidasa y F(2,37) = 0,53 para la actividad específica de arilsulfatasa A. Al comparar las medias de actividad de cada grupo mediante un análisis de varianza de efectos fijos no se encontraron diferencias significativas para un valor de p<0,05; F(2,37) = 0,64 para la actividad específica de Nacetil-α-D-glucosaminidasa y F(2,37) = 1,45 para la actividad específica de arilsulfatasa A (Fig. 1).
Tabla II. Actividades enzimáticas específicas según las características étnicas.
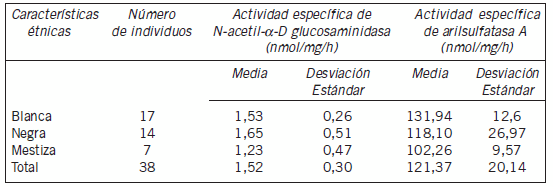

Figura 1. Variación de las actividades enzimáticas específicas de N-acetil-α-D-glucosaminidasa (A) y arilsulfatasa A (B) según las característicasétnicas.
N: características étnicas negras (n=14), B: blancas (n=17) y M: mestizas (n=7). El extremo superior de cada barra indica el valor de la media y cada bigote representa su desviación estándar. Para ambas enzimas no se detectaron diferencias significativas entre ninguno de los tres grupos (p<0,05).
Discusión y Conclusiones
Es una práctica común en el diagnóstico bioquímico enzimático de la MPS III B, la leucodistrofia metacromática y el resto de las enfermedades de almacenamiento lisosomal, informar el resultado final de una muestra problema como el porcentaje de actividad enzimática específica relativa al promedio de muestras de individuos sanos analizados en forma simultánea. Si este valor es menor del 30%, entonces se diagnóstica al individuo como deficiente para la enzima analizada (2).
No obstante, dada la gran variabilidad que se ha informado para los valores de la mayoría de las actividades enzimáticas lisosomales, resulta fundamental la obtención de rangos de valores normales de estas actividades enzimáticas. Disponer de esta información optimiza la confiabilidad y certeza del diagnóstico final al eliminar el papel protagónico de un número reducido de controles negativos en el resultado final del ensayo.
El diagnóstico enzimático de las enfermedades de almacenamiento lisosomal se realiza de forma centralizada en este laboratorio. Las muestras de sangre de las diferentes regiones del país son frecuentemente sometidas a un complejo proceso de transporte desde el lugar de residencia del paciente hasta las instalaciones de este Centro. Por estas razones, la utilización de muestras de individuos no relacionados con el paciente bajo sospecha como controles negativos, desde el mismo momento en que se toma la muestra hasta la determinación enzimática final, seguiría siendo muy importante para estimar la influencia de factores externos durante el transporte sobre la calidad de las muestras y por tanto, del resultado final de la actividad enzimática específica.
Un requisito fundamental para la obtención de un rango de valores normales es demostrar la ausencia de la condición patológica en cuestión en los individuos analizados. La metodología seguida en este estudio permitió cumplir con este requisito. A través de la confección de la historia clínica de cada participante se aseguró la ausencia de antecedentes personales y familiares relacionados con las dos deficiencias enzimáticas objeto del estudio.
El intervalo preliminar de valores normales de actividad específica de N-acetil-α-D-glucosaminidasa que se estableció es similar a los informados por otros autores. En este sentido, Ficher et al. refieren un rango de actividad para esta enzima en leucocitos de individuos sanos de 1,5 a 3,5 nmol/mg/h (8), el cual incluye al valor de actividad media que se estimó a partir de los resultados experimentales de este grupo.
En un estudio realizado por Wenger et al. en el cual se refieren intervalos de valores normales para diferentes enzimas lisosomales se informó una media de actividad específica de arilsulfatasa A de 71,1 nmol/mg/h con una desviación estándar de 11,4 nmol/mg/h (2), valor significativamente menor que el obtenido en el presente estudio. Sin embargo, Dubois et al. luego de analizar 91 muestras de leucocitos, obtuvieron una media de actividad de 100 nmol/mg/h y un intervalo de valores normales de 82,26 a 117,74 nmol/mg/h (9), el cual se solapa en gran medida con el obtenido por estos autores, sobre todo en la región de valores bajos de actividad que aporta la mayor importancia para el diagnóstico bioquímico de la deficiencia enzimática.
Se ha estimado que un 7-15% de la población de individuos sanos presentan una actividad arilsulfatasa A in vitro baja, incluso comparable a la de un enfermo (10-13). Esta condición conocida como pseudodeficiencia enzimática también se ha informado para otras hidrolasas lisosomales como la hexosaminidasa A, deficiente en la enfermedad de Tay-Sachs (14).
De acuerdo con un estudio bioquímico y molecular realizado por Rafi et al., individuos con valores de actividad enzimática específica entre 50 y 120 nmol/mg/h presentan ambos genes para la arilsulfatasa A sin ninguna mutación (15). La amplia variación entre los valores de actividad se debe a diferencias en las condiciones de procesamiento de las muestras de sangre (16), a la diferenciación entre los distintos tipos de leucocitos (7) y al efecto de otros genes, entre otros factores. Algunos autores informan que valores de actividad de 25-45 nmol/mg/h se corresponden con portadores de leucodistrofia metacromática o con portadores de la mutación para la pseudodeficiencia, mientras que valores por debajo de 15 nmol/mg/h se corresponden con individuos que padecen la enfermedad, homocigóticos para la mutación de la pseudodeficiencia u homocigóticos compuestos (14).
En el presente estudio no se obtuvo ningún valor extremo bajo de actividad específica de arilsulfatasa A que pudiera indicar la presencia de pseudodeficiencia enzimática. La existencia de esta condición en los individuos analizados, no obstante, sólo es posible descartarla mediante la detección molecular de esta mutación. Algunos estudios han relacionado la presencia de la pseudodeficiencia de arilsulfatasa A con otras enfermedades neurológicas y psiquiátricas (17)(18) debido posiblemente a la presencia de otras mutaciones en posición cis con el alelo causante de la pseudodeficiencia (15). Es por esto que nuevamente adquiere gran importancia la caracterización clínica que se realizó de cada individuo en este estudio, incluyendo cualquier sintomatología de este tipo.
En ninguna de las dos actividades enzimáticas específicas analizadas se encontraron diferencias significativas en relación a las características étnicas. Vance et al., al estudiar la actividad de la enzima N-acetil-α-D-glucosaminidasa en muestras de suero de miembros de una misma familia e individuos no relacionados con características étnicas blanca o negra, obtuvieron un valor medio de actividad y de desviación estándar mayor en aquellos individuos con características étnicas negra: 0,50±0,30 nmol/mL/min y de 0,29±0,10 nmol/mL/min en los de características étnicas blanca (19). A partir de análisis de segregación estos autores sugieren la presencia de un polimorfismo genético causante de una menor actividad enzimática en ambas poblaciones pero con una contribución diferente en dependencia de las características étnicas (20). En el presente estudio, aunque también se constató un aumento de la actividad específica de N-acetil-α-D-glucosaminidasa en los individuos con características étnicas negra de 1,65±0,51 nmol/mg/h por 1,53±0,26 nmol/mg/h en los de características étnicas blancas, dicha diferencia no resultó significativa (p<0,05).
Debido a las características de la población a partir de la cual se obtuvieron los individuos para el estudio, fundamentalmente adultos jóvenes de sexo masculino, no se pudo realizar un análisis de variables como el sexo y la edad sobre la actividad de ambas enzimas, aunque no existen estudios publicados que demuestren una influencia de estas variables.
Este constituye el primer estudio cubano en el cual se comunican rangos preliminares de actividad específica de N-acetil-α-D-glucosaminidasa y arilsulfatasa A en individuos cubanos cuya condición de sanos y no relacionados familiarmente con la enfermedad ha sido demostrada, lo cual generalmente no queda claro en la literatura consultada.
Debido al tamaño limitado de la muestra empleada, el próximo objetivo de los autores será extender este estudio a un mayor número de individuos con el propósito de establecer los intervalos de referencia y los puntos de corte para el diagnóstico de las enfermedades en consideración. Se considera importante realizar este tipo de estudios en individuos en edad infantil, debido a que la mayoría de las muestras problemas que se reciben para realizar el diagnóstico enzimático corresponden precisamente a individuos de estas edades. Estos datos serían de gran utilidad a fin de asegurar la confiabilidad del diagnóstico final obtenido.
AGRADECIMIENTOS
Los autores agradecen la colaboración de los investigadores Héctor I. Pimentel, Caridad Menéndez y Marisol Peña, quienes desinteresadamente contribuyeron a la revisión crítica del presente manuscrito.
CORRESPONDENCIA
DERBIS CAMPOS
Centro Nacional de Genética Médica
Campus del ICBP Victoria de Girón
Calle 146 No. 3102, Playa La Habana 16, C.P: 1600. CUBA
Teléfono: 208 9991
E-mail: derbisch@cngen.sld.cu
1. Scriver CR, Beaudet AL, Sly WS, Valle D. The metabolic and molecular bases of inherited disease. Vol 2. 7th ed. New York: McGraw-Hill; 1995. [ Links ]
2. Wenger DA, Williams C. Screening for Lysosomal Disorders. En: Hommes FA, editor. Tecniques in diagnostic human biochemical genetics: a laboratory manual. New York: Wiley-Liss; 1991. p. 588-615. [ Links ]
3. World Medical Association Declaration of Helsinki: ethical principles for medical research involving human subjects. JAMA 2000; 284(23): 3043-5. [ Links ]
4. Skoog WA, Beck WS. Studies on the fibrinogen, dextran and phytohemagglutinin methods of isolating leukocytes. Blood 1956; 11(5): 436-54. [ Links ]
5. Lowry OH, Rosebrough NJ, Farr AL, Randall R. Protein measurement with the Folin reagent. J Biol Chem 1951; 193(1): 265-75. [ Links ]
6. Galjaard H. Genetic metabolic diseases. Early diagnosis and prenatal analysis. Amsterdam: Elsevier/North-Holland Biomedical Press; 1980. p. 813. [ Links ]
7. Isman F, Palomaki GE, Natowicz MR. Lysosomal enzymes in human peripheral blood mononuclear cells and granulocytes. Clin Chem 2005; 51(3): 646-9. [ Links ]
8. Fischer L, Shin YS. Four enzymes involved in mucopolysaccharidosis III (Sanfilippo syndrome): expression in various tissues and the diagnostic possibility using leucocytes. Bratisl Lek Listy 2004; 105 (9): 323. [ Links ]
9. Dubois G, Harzer K, Baumann N. Very low arylsulfatase A and cerebroside sulfatase activities in leukocytes of healthy members of metachromatic leukodistrophy family. Am J Hum Genet 1977; 29(2): 191-4. [ Links ]
10. Pedron CG, Gaspar PA, Giugliani R, Pereira ML. Arylsulfatase A pseudodeficiency in healthy Brazilian individuals. Braz J Med Biol Res 1999; 32(8): 941-5. [ Links ]
11. Chabás A, Castellvi S, Bayés M, Balcells S, Grinberg D, Vilageliu L, et al. Frequency of the arylsulphatase A pseudodeficiency allele in the Spanish population. Clin Genet 1993; 44(6): 320-3. [ Links ]
12. Regis S, Filocamo M, Stroppiano M, Corsolini F, Gatti R. Molecular analysis of the arylsulphatase A gene in late infantile metachromatic. J Med Genet 1996; 33(3): 251-2. [ Links ]
13. Emre S, Topçu M, Terzioglu M, Renda Y. Arylsulfatase A pseudodeficiency incidence in Turkey. Turk J Pediatr 2000; 42(2): 115-7. [ Links ]
14. Bronner P, Rodier G, Cohen E, Derouiche F, Boulay C, Courtois S. Lysosome enzyme pseudodeficiency. Rev Neurol (Paris) 2000; 156(11): 1005-12. [ Links ]
15. Rafi MA., Coppola S, Liu SL, Rao HZ, Wenger DA. Disease- causing mutations in cis with the common arylsulfatase A pseudodeficiency allele compound the difficulties in accurately identifying patients and carriers of metachromatic leukodystrophy. Mol Genet Metab 2003; 79(2): 83-90. [ Links ]
16. Burin M, Dutra-Filho C, Brum J, Mauricio T, Amorim M, Giugliani R. Effect of collection, transport, processing and storage of blood specimens on the activity of lysosomal enzymes in plasma and leukocytes. Braz J Med Biol Res 2000; 33(9): 1003-13. [ Links ]
17. Farrell K, Applegarth DA, Toone JR, McLeod PM, Savage AV. Pseudoarylsulfatase-A deficiency in the neurologically impaired patient. Can J Neurol Sci 1985; 12(3): 274-7. [ Links ]
18. Sangiorgi S, Ferlini A, Zanetti A, Mochi M. Reduced activity of arylsulfatase A and predisposition to neurological disorders: analysis of 140 pediatric patients. Am J Med Genet 1991; 40(3): 365-9. [ Links ]
19. Vance JM, Pericak-Vance MA, Elston RC, Conneally PM, Namboodiri KK, Wappner RS, et al. Evidence of genetic variation for alpha-N-acetyl-D-glucosaminidase in black and white populations: a new polymorphism. Am J Med Genet 1980; 7(2): 131-40. [ Links ]
20. Pericak-Vance MA, Vance JM, Elston RC, Namboodiri KK, Fogle TA. Segregation and linkage analysis of alpha-N-acetyl-D-glucosaminidase (NAG) levels in a black family. Am J Med Genet 1985; 20(2): 295-306. [ Links ]
Aceptado para su publicación el 5 de noviembre de 2010














