Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957
Acta bioquím. clín. latinoam. vol.45 no.2 La Plata abr./jun. 2011
BIOQUÍMICA CLÍNICA
Sistema cromatográfico miniaturizado para la determinación de coenzima Q10 en plasma, músculo y plaquetas
Miniaturized chromatographic system for determination of coenzyme Q10 in plasma, muscle and platelets
Sistema cromatográfico miniaturizado para a determinação de coenzima Q10 em plasma, músculo e plaquetas
Mario Contin1a,b, Manuela Martinefski2a, Silvia Lucangioli3b,c, Valeria Tripodi4a,b
1 Farmacéutico
2 Bioquímica
3 Doctora de la Universidad de Buenos Aires. Área Química Analítica
4 Doctora de la Universidad de Buenos Aires. Área Bioquímica Clínica
a Cátedra de Química Analítica, Departamento de Química Analítica y Fisicoquímica, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires.
b Consejo Nacional de Investigaciones Científicas y Tecnológicas, CONICET.
c Cátedra de Control de Calidad de Medicamentos, Departamento de Tecnología Farmacéutica, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires.
Resumen
La coenzima Q10 (CoQ10) es un componente esencial de la cadena respiratoria que interviene en la producción celular de energía. A su vez, es considerada un potente antioxidante que actúa en la prevención del daño oxidativo del ADN, membranas biológicas y lipoproteínas. En los últimos tiempos se ha demostrado que su deficiencia está implicada en varias patologías como enfermedades mitocondriales, cardíacas y musculares, cáncer y durante el tratamiento con estatinas. Como la terapia con CoQ10 resulta beneficiosa en dichas patologías, sus niveles deben ser monitoreados durante el tratamiento. La determinación de los niveles de CoQ10 para el diagnóstico de su deficiencia y control post tratamiento representa un gran desafío analítico puesto que es una molécula de elevada hidrofobicidad, fácil oxidación y su concentración endógena es extremadamente pequeña aun en sujetos controles. Debido a ello, es necesario utilizar un método analítico de elevada sensibilidad y una preparación de muestra adecuada para evitar pérdidas durante su procesamiento. Si bien CoQ10 es frecuentemente analizada en plasma, recientemente se ha demostrado que, en algunos casos, la CoQ10 plasmática no refleja exactamente la concentración intracelular, por lo que sería necesario realizar su determinación en otras matrices como plaquetas y músculo. En el presente trabajo se han desarrollado preparaciones de muestras adecuadas para la determinación de CoQ10 en plasma, plaquetas y músculo que requieren pequeñas cantidades de muestra utilizando un sistema analítico cromatográfico miniaturizado, sencillo, de elevada sensibilidad, precisión y exactitud que permitirá un diagnóstico y seguimiento apropiado de las patologías que involucran la deficiencia de CoQ10.
Palabras clave: Coenzima Q10; Sistema miniaturizado de cromatografía líquida de alta resolución; Plaquetas; Músculo; Plasma
Summary
Coenzyme Q10 (CoQ10) is an essential component of the respiratory chain involved in cellular energy production. Moreover, it is considered a potent antioxidant that acts in the prevention of oxidative DNA, biological membrane and lipoprotein damage. Recently, it has been demonstrated that its deficiency is implicated in several diseases such as mitochondrial, heart and muscle diseases, cancer and during treatment with statins. Since CoQ10 therapy is beneficial in these diseases, their levels should be monitored during treatment. The determination of CoQ10 levels in deficiency diagnosis and post-treatment control is a major analytical challenge since it is a highly hydrophobic molecule that iseasily oxidized, and its endogenous concentration is extremely low even in control subjects. As a result, an analytical method with high sensitivity and an adequate sample preparation to avoid losses during processing must be used. Although CoQ10 is often analyzed in plasma, it has recently been shown that in some cases, plasma CoQ10 does not accurately reflect the intracellular concentration; and it would be necessary to determine it in other matrices such as platelets and muscle. In this paper, adequate sample preparations were determined for the determination of CoQ10 in plasma, platelets and muscle that require small quantities of sample using a miniaturized chromatographic analytical system, that is simple and has high sensitivity, precision and accuracy that will enable the diagnosis and monitoring of the diseases involving CoQ10 deficiency.
Keywords: Coenzyme Q10; Miniaturized chromatographic analytical system; Platelets; Muscle; Plasma
Resumo
A coenzima Q10 (CoQ10) é um componente essencial da cadeia respiratória que intervém na produção celular da energia. Por sua vez, é considerada um potente antioxidante que age na prevenção do dano oxidativo ao DNA, membranas biológicas e lipoproteínas. Nos últimos tempos se tem demonstrado que sua deficiência está envolvida em várias patologias como doenças mitocondriais, cardíacas e musculares, câncer e durante o tratamento com estatinas. Como a terapia com CoQ10 resulta benéfica em tais patologias, seus níveis devem ser monitorados durante o tratamento. A determinação dos níveis de CoQ10 para o diagnóstico de sua deficiência e controle pós-tratamento representa um grande desafio analítico visto que é uma molécula de elevada hidrofobicidade, fácil oxidação e sua concentração endógena é extremamente pequena mesmo em sujeitos controle. Por esse motivo, é necessário utilizar um método analítico de elevada sensibilidade e a preparação de amostras adequada para evitar perdas durante o processamento. Embora CoQ10 seja frequentemente analisada em plasma, recentemente se tem demonstrado que, em alguns casos, a CoQ10 plasmática não reflete exatamente a concentração intracelular, portanto seria necessário realizar sua determinação em outras matrizes como plaquetas e músculo. Neste trabalho foram desenvolvidas preparações de amostra adequadas para a determinação de CoQ10 em plasma, plaquetas e músculo que requerem pequenas quantidades de amostra utilizando um sistema analítico cromatográfico miniaturizado, simples, de elevada sensibilidade, precisão e exatidão que permitirá um diagnostico e acompanhamento apropriado das patologias que envolvem a deficiência de CoQ10.
Palavras chave: Coenzima Q10; Sistema analítico cromatográfico miniaturizado; Plaquetas; Músculo; Plasma
Introducción
La coenzima Q10 (2,3-dimetoxi-5-metil-6-decaprenil- 1,4-benzoquinona) (CoQ10), también llamada ubiquinona, es un compuesto liposoluble esencial que se encuentra integrado en la cadena respiratoria mitocondrial desempeñando un papel clave en la transferencia de electrones para la producción de energía celular. Además, es considerada un potente antioxidante que actúa en la prevención del daño oxidativo del ADN, membranas biológicas y lipoproteínas (1)(2).
La CoQ10 es sintetizada como producto terminal de la vía del mevalonato (3) y es incorporada a través de la dieta y de suplementos dietarios.
El contenido celular de CoQ10 es homeostáticamente regulado; sin embargo, se encuentra disminuida en varias patologías como cáncer, enfermedades mitocondriales, cardíacas y musculares así como también durante el tratamiento con estatinas (4). El tratamiento con CoQ10 presenta grandes beneficios terapéuticos revirtiendo, en algunos casos, las patologías y / o en otros mejorando la calidad de vida del paciente (5)(6).
La CoQ10 se determina frecuentemente en plasma en donde la concentración está extremadamente disminuida aun en sujetos sanos (0,3-1,7 μM) (7)(8). Sin embargo, existen algunos trabajos que cuestionan el valor de la determinación plasmática de la CoQ10 puesto que no reflejaría exactamente la concentración intracelular y, por lo tanto, su relación con la patología podría ser discutida (9). Es por ello que recientemente, para la investigación clínica de las posibles deficiencias de CoQ10, se está poniendo atención en su determinación en células sanguíneas. Las células de elección son las plaquetas puesto que son ricas en mitocondrias y se pueden aislar fácilmente de pequeños volúmenes sanguíneos.
No obstante, se ha demostrado que sólo en algunos pacientes se encuentran disminuidos los niveles tisulares de CoQ10, siendo poco clara la correlación de la patología o de la respuesta terapéutica con los niveles plasmáticos y / o plaquetarios de CoQ10 (1). Este hecho hace indispensable, aunque resulte invasivo, la determinación de CoQ10 en músculo para evidenciar su alteración.
Por lo tanto, es prioritario desarrollar metodologías analíticas que permitan la evaluación de la CoQ10 en las matrices de mayor importancia, para el correcto diagnóstico de las patologías que involucran su deficiencia, mediante sistemas analíticos y de preparación de muestra altamente sensibles, que requieran el procesamiento de poca cantidad de muestra y que sean lo suficientemente sencillos para ser utilizados en laboratorios clínicos de rutina.
Hasta el presente, el método más utilizado para la determinación de CoQ10 es la cromatografía líquida (HPLC) con detección electroquímica debido a su elevada sensibilidad (5). Sin embargo, el uso de dicho detector requiere de largos períodos de estabilización y, por otro lado, el electrodo puede ser pasivado por componentes lipofílicos de la muestra, lo que acorta su tiempo de vida media. Otros autores han propuesto métodos por HPLC acoplados a detector de masa (10). Aunque con este tipo de detector se obtiene una elevada sensibilidad, aún mayor que con detector electroquímico, su uso es muy costoso, se necesitan operadores altamente calificados y se requiere de una instrumentación sofisticada que no es común en laboratorios clínicos.
Si bien una de las instrumentaciones más comúnmente utilizadas en el laboratorio clínico es la HPLC con detección UV, su sensibilidad no resulta adecuada para analitos que se encuentran en muy bajas concentraciones como la CoQ10 (11).
Una de las tendencias actuales de la química analítica avanzada es la miniaturización del instrumental y de los procedimientos analíticos. Separaciones ultra rápidas, consumo de pequeñas cantidades de solventes y reactivos, utilización de pequeñas cantidades de muestra, así como el incremento de la sensibilidad y fácil automatización, son las principales ventajas y metas a ser alcanzadas con los micrométodos (12). Es por ello que la utilización de microcolumnas cromatográficas (1-2 mm de diámetro interno) podría ser sumamente útil para superar las dificultades de la determinación de CoQ10 utilizando HPLC con detección UV.
En un trabajo previo, este grupo ha informado el uso de microcolumnas cromatográficas que han sido utilizadas para la determinación de CoQ10 en productos farmacéuticos y cosméticos. Dicho método permitió reducir el consumo de solventes y fase móvil, con mínimo requerimiento de muestra y un incremento de la sensibilidad comparable al obtenido con detección electroquímica (13).
Es por ello que el objetivo del presente trabajo fue diseñar y optimizar la preparación de muestra adecuada para la determinación de CoQ10 en plasma, músculo y plaquetas, adecuando el sistema analítico a la miniaturización cromatográfica con detección UV.
La determinación de CoQ10 en dichas muestras será de gran importancia clínica en la detección de la deficiencia de CoQ10 en distintos tipos de patologías.
Materiales y Métodos
REACTIVOS
Coenzima Q10 (2,3-dimetoxi-5-metil-6-decaprenil-1,4- benzoquinona) (CoQ10) fue provista por Sigma (St. Louis, MO, EE.UU.). Todos los solventes utilizados fueron de calidad HPLC: isopropanol (Carlo Erba, Italia), 1-propanol (MERK, Darmstadt, Alemania), y metanol (J.T Baker, EE.UU.). El agua desionizada se obtuvo del equipo EASY pure TM RF (Barnstead, EE.UU.). Se utilizaron las siguientes sales de elevada pureza: ácido cítrico (Carlo Erba, Italia), citrato de sodio dihidrato (Anedra, Austria), Tris (hidroximetil)- aminometano (MERCK, Darmstadt, Alemania), cloruro de sodio (Mallinckrodt Chemical Works, St. Louis, EE.UU.) y heparina sódica (Fada Pharma, Argentina). Todas las soluciones fueron filtradas a través de una membrana de nylon de 0,45 μm (Micron Separations Inc., EE.UU.) y desgasificadas antes de su utilización.
SOLUCIONES ESTÁNDARES
Se preparó una solución madre de CoQ10 1 mM en 1- propanol al resguardo de la luz, la cual se almacenó a –20 °C permaneciendo inalterada durante dos meses. La concentración exacta de la solución patrón de trabajo se obtuvo espectrofotométricamente a 275 nm, ε = 14020 L/mol. cm. A partir de la solución madre se realizaron diluciones en fase móvil para obtener la curva de calibración de CoQ10 con las siguientes concentraciones: 0,08; 0,35; 1,2; 3,5; 7,0 y 15,0 μM.
INSTRUMENTACIÓN Y CONDICIONES CROMATOGRÁFICAS
Se utilizaron los siguientes equipos: centrífuga Rolco modelo CM 36 R. Equipo de HPLC compuesto por bombas HPLC Waters 590 y Waters 510, Waters Automated Gradient Controller (Waters, MI, EE.UU.), Jasco UV-975 intelligent UV/VS detection (Japón) e inyector manual (Rheodyne, modelo 7125, CA, EE.UU.). Los cromatogramas fueron procesados utilizando el software Win PCChrome XY.
La separación se realizó utilizando una columna C18 microbore Spherisorb ® S3 ODS 2 (Waters, MI, EE.UU.) (150 mm x 2 mm i.d., 3,0 μm tamaño partícula) y guarda columna XTerra C18 (Waters, MI, EE.UU.) (1 mm x 2,1 mm i.d., 3,5 μm tamaño de partícula)
Condiciones cromatográficas: la columna se mantuvo a temperatura ambiente, corrida isocrática utilizando como fase móvil metanol:isopropanol (80:20) y el flujo se fijó en 0,6 mL/min. La detección UV se realizó a 275 nm con un volumen de inyección de 10 μL.
PREPARACIÓN DE MUESTRA
Plasma
Se trabajó con muestras de sangre heparinizada y obtenidas de voluntarios sanos en ayunas, procesadas inmediatamente; se centrifugó a máxima velocidad durante 10 min a temperatura ambiente. Se recogió el plasma en un tubo de polipropileno y se almacenó en forma inmediata a –70 °C tapado hasta el posterior análisis de CoQ10. Antes del análisis las muestras fueron descongeladas a temperatura ambiente. A 600 μL de plasma se le adicionaron 800 μL de 1-propanol frío agitando en vortex a máxima velocidad durante 2 min y se centrifugó a máxima velocidad durante 10 min a temperatura ambiente para precipitar las proteínas. Luego, se evaporó la fase orgánica a sequedad bajo atmósfera de nitrógeno. El residuo se reconstituyó en un volumen final de 100 μL de fase móvil conteniendo un 10% de 1-propanol, lo que permitió concentrar la muestra 6 veces.
Músculo
Las muestras de tejido muscular utilizadas para la extracción de CoQ10 fueron músculo esquelético bovino y músculo cardíaco porcino.
Se pesaron exactamente 20 mg de tejido y se homogeneizó en mortero con 400 μL de 1-propanol frío y 20 μL de agua en baño de hielo. La mezcla homogeneizada fue transferida a un tubo de polipropileno, se agitó en vortex durante 3 min y se centrifugó a máxima velocidad durante 5 min. El sobrenadante se inyectó directamente en el sistema de HPLC.
Plaquetas
Se trabajó con 2,5 mL de sangre citratada obtenida de voluntarios sanos con 8 h de ayuno. El procesamiento de las muestras se completó dentro de un período de 2 a 3 horas luego de su extracción.
El plasma rico en plaquetas (PRP) se obtuvo por decantación hasta obtener aproximadamente el 10% del volumen total. Se tomó una alícuota de 10 μL de PRP para efectuar el recuento manual de plaquetas en cámara de Neubauer.
Otra alícuota de 400 μL de PRP se centrifugó a máxima velocidad durante 20 min a temperatura ambiente; se descartó el sobrenadante y se lavó el pellet de plaquetas con buffer Tris 10 mM pH= 7,40, utilizando vortex a baja velocidad durante 1 min y luego se centrifugó a máxima velocidad durante 20 min a temperatura ambiente para la obtención del pellet de plaquetas. En este paso se puede optar por la determinación de CoQ10 en el día de extracción de la muestra o guardar el pellet de plaquetas a –70 °C para el posterior análisis de CoQ10.
Luego del lavado del pellet de plaquetas se adicionaron 800 μL de 1-propanol frío agitando en vortex a máxima velocidad durante 2 min y se centrifugó a máxima velocidad durante 10 min. Luego se evaporó la fase orgánica a sequedad bajo atmósfera de nitrógeno. El residuo se reconstituyó en un volumen final de 200 μL de fase móvil con 10% de 1-propanol, lo que permitió concentrar la muestra dos veces.
Cuantificación y validación del método
La cuantificación de las muestras fue realizada utilizando una curva de calibración de seis puntos cuyo rango de concentración fue entre 0,08 a 15,0 μM de CoQ10 preparada en fase móvil. La validación fue realizada de acuerdo con criterios internacionales (14)(15). En cuanto a la preparación de muestra para la determinación de CoQ10 en plaquetas, se optimizaron los siguientes parámetros: número de lavados, número de centrifugaciones para la obtención del pellet de plaquetas, tiempo y velocidad de las distintas centrifugaciones, volumen de muestra requerida y tipo de muestra que puede almacenarse a –70 °C. La exactitud se evaluó a través de ensayos de recuperación marcando las muestras con CoQ10 a tres niveles por triplicado. Los límites de detección (LODs) y los límites de cuantificación (LOQs) se determinaron como la relación señal: ruido de 3:1 y 10:1, respectivamente.
ANÁLISIS DE MUESTRAS
La cuantificación de CoQ10 en plasma y plaquetas se realizó en 5 sujetos controles sanos de los cuales se obtuvo el consentimiento informado. Las muestras de músculo fueron de origen animal tales como corazón porcino y músculo esquelético bovino.
Resultados
La curva de calibración resultó lineal dentro de un rango de concentración de 0,08-15,0 μM de CoQ10 con un coeficiente de correlación (r2) de 0,997. El límite de cuantificación (LOQ) de CoQ10 plasmática fue de 0,08 μM, mientras que el límite de detección (LOD) fue 0,02 μM. Como resultado de la preparación de muestra de plasma, se concentró la muestra en un factor de 6, lo que permitió cuantificar valores tan bajos como 0,03 μM y detectar hasta 0,0033 μM de CoQ10 en muestra de plasma.
Los valores de LOD y LOQ para la determinación de CoQ10 en plaquetas son 21 pmoles/109 plaquetas y 84 pmoles/109 plaquetas, respectivamente, mientras que los valores de LOD y LOQ para la determinación de CoQ10 en músculo son: 1,38 μg/g de tejido y 4,62 μg/g de tejido, respectivamente siendo posible la cuantificación en pequeñas biopsias de hasta 2,5 mg.
La precisión en el día (n=3) y entre días (n=9) se realizó analizando cada tipo de muestra en tres niveles de concentración (bajo, medio y alto) obteniéndose resultados que oscilaron entre 4,0 y 6,3% expresados como desviación estándar relativa (RSD).
La exactitud se evaluó a través de la recuperación de cada tipo de muestra marcada a tres niveles de concentración. Las recuperaciones de CoQ10 en muestras biológicas oscilaron entre 89,0% y 95,3% con RSD aceptables. Los parámetros de validación del método analítico se presentan en la Tabla I.
Tabla I. Parámetros de validación del método analítico para la determinación de CoQ10 en muestras biológicas

La preparación de muestra de plaquetas se optimizó evaluando diferente cantidad de centrifugaciones y de lavados para la obtención del pellet de plaquetas. Como no se observaron diferencias significativas al efectuar dichas operaciones más de una vez, se optó por realizar una sola centrifugación y lavado, disminuyendo así la complejidad de la preparación de muestra. El mínimo volumen de muestra necesario para la determinación de CoQ10 plaquetaria fue de 2,5 mL que resultó mucho menor al volumen requerido por otros autores (9)(16). Se observó que la muestra debe ser procesada en el día al menos hasta la obtención del pellet el cual se puede mantener a –70 °C hasta un mes sin pérdida de la concentración de CoQ10. Por otra parte, si bien la decantación de plasma hasta un 10% del volumen total permite obtener un PRP, de todas maneras es necesario realizar el recuento exacto de la misma ya que es indispensable conocerlo para poder expresar correctamente los niveles de CoQ10.
La Figura 1 muestra un cromatograma en donde se observa la presencia de CoQ10 en plasma y en plaquetas de un voluntario sano y en tejido muscular animal comparada con un estándar.
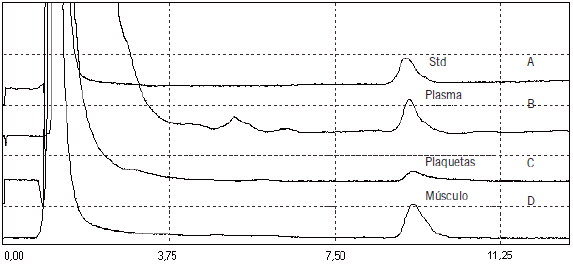
Figura 1. Análisis por micro HPLC de CoQ10 en (A) estándar de CoQ10 1,4 μM, (B) plasma de voluntario sano: 0,8 μM, (C) plaquetas de voluntario sano: 333,0 pmoles/109plaquetas, (D) músculo cardíaco porcino 234,0 μg/g de tejido.
Discusión
PREPARACIÓN DE MUESTRA
Los métodos tradicionales para la extracción de CoQ10 en plasma consisten en una precipitación proteica utilizando 1-propanol que, en algunos casos, es seguida de una extracción líquido-líquido con hexano e inyección directa del extracto al sistema cromatográfico. Si bien la preparación de muestra utilizada en este trabajo se basa en las metodologías tradicionales, para la determinación de CoQ10 en condiciones patológicas, en las que dicha coenzima se encuentra muy disminuida, es necesario realizar una concentración del analito mediante procedimientos de evaporación. Por otra parte, se obtiene mejor forma de pico si la muestra se reconstituye en fase móvil en lugar de 1-propanol. Es por ello que se ha utilizado una combinación de evaporación a sequedad junto con una reconstitución en fase móvil obteniéndose elevados porcentajes de recuperación con elevada precisión.
Respecto de la preparación de muestras de tejido muscular, gracias al aumento de sensibilidad obtenido con el procedimiento analítico desarrollado, se ha podido disminuir notablemente la cantidad de tejido necesario para realizar el análisis. De la misma manera, el procedimiento de preparación de muestra ha sido optimizado a una simple extracción proteica con 1-propanol.
Por otra parte, existe muy poca bibliografía respecto de la extracción de CoQ10 de plaquetas. Los métodos informados suelen ser bastante engorrosos y requieren de mucha cantidad de muestra, por lo que resultan difíciles de adaptar a laboratorios de rutina y a muestras pediátricas. El método de preparación de muestra propuesto en este trabajo reduce la cantidad de sangre necesaria y el procedimiento sólo implica distintas centrifugaciones.
MICROSISTEMA CROMATOGRÁFICO
El método de elección para la determinación de CoQ10 informado en la bibliografía es HPLC con detección electroquímica o detector de masa que, si bien es muy sensible, sus principales desventajas son: la gran complejidad y costo y la necesidad de personal altamente calificado.
Para lograr un análisis sencillo, rápido y de elevada sensibilidad, la miniaturización de la columna es una gran ventaja. El método desarrollado por este grupo de trabajo permitió no sólo simplificar la determinación analítica de CoQ10 sino, además, disminuir los límites de sensibilidad hasta hacerlos comparables a los obtenidos con detección electroquímica utilizando detector UV, una instrumentación accesible a laboratorios clínicos de mediana complejidad.
El uso de las microcolumnas utilizadas permite alcanzar la sensibilidad y rapidez necesaria para la determinación de CoQ10 aún en muestras biológicas con bajos niveles de dicha coenzima.
Conclusiones
Se han desarrollado sistemas de preparación de muestra sencillos, con pequeño requerimiento de material a analizar y un método analítico miniaturizado simple y de elevada sensibilidad que permite la determinación de CoQ10 en las matrices más importantes para el diagnóstico y seguimiento de patologías que involucran su deficiencia.
CORRESPONDENCIA
DRA. VALERIA TRIPODI
E-mail: vtripodi@ffyb.uba.ar
1. Barshop B, Gangoiti J. Analysis of coenzyme Q in human blood and tissues. Mitochondrion S7 2007; S89-S93. [ Links ]
2. Crane F. Biochemical functions of coenzyme Q10. J Am Coll Nutr 2000; 20 (6): 591-8. [ Links ]
3. Ernster L, Dallner G. Biochemical, physiological and medical aspects of ubiquinone function. Biochim Biophys Acta 1995; 1271: 195-204. [ Links ]
4. Teran E, Hernandez I, Nieto B, Tavara R, Ocampo J, Calle A. Coenzyme Q10 suplementation during pregnancy reduces the risk of pre-eclampsia. Int J Gyneacol Obstet 2009; 105: 43-5. [ Links ]
5. Matthews R, Yang L, Browne S, Baik M, Beal, MF. Coenzyme Q10 administration increases brain mitochondrial concentration and exerts neuroprotective effects. Proc Natl Acad Sci USA 1998; 95: 8892-7. [ Links ]
6. Shults C, Oakes D, Kieburtz K, Beal M, Haas R, Plumb S, et al. Effects of coenzyme Q10 in early Parkinson disease. Arch Neurol 2002; 59: 1541-50. [ Links ]
7. Molyneux S, Young J, Florkowski C, Lever M. Coenzyme Q10: is there a clinical role and a case for measurement? Clin Biochem Rev 2008; 29 (2); 71-82. [ Links ]
8. Kaplan P, Sebestianová N, Turiaková J, Kucera I. Determination of coenzyme Q in human plasma. Physiol Res 1996; 45 (1): 39-45. [ Links ]
9. Niklowitz P, Menke T, Andler W, Okun J. Simultaneous analysis of coenzyme Q10 in plasma, erythrocytes and platelets: comparison of the antioxidant level in blood cells and their environment in healthy children and after oral supplementation in adults. Clin Chim Acta 2004; 342: 219-26. [ Links ]
10. Hansen G, Christensen P, Tüchsen E,Lund T. Sensitive and selective analysis of coenzyme Q10 in human serum by negative APCI LC-MS. Analyst 2004; 129: 45-50. [ Links ]
11. Grossi G, Bargossi A, Fiorella P, Piazzi S.Improved high-performance liquid chromatographic method for the determination of coenzyme Q10 in plasma. J Chromatogr 1992; 593: 217-26. [ Links ]
12. Asensio Ramos M, Hernández Borges J, Rocco A, Fanali S. Food analysis: A continuous challenge for miniaturized separation techniques. J Sep Sci 2009; 32(24): 3764-800. [ Links ]
13. Tripodi V, Flor S, Contin M, Lucangioli S. Simple, highly sensitive micro HPLC method for the determination of coenzyme Q10 and its major related substances. J Liq Chromatogr Relat Technol 2009; 32: 1-14. [ Links ]
14. U.S. Department of Health and Human Services Food and Drug Administration (FDA). Guidance for Industry Bioanalytical Method Validation. Disponible en: http://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInformation/Guidances/ucm070107.pdf (Fecha de acceso 1 de mayo de 2001). [ Links ]
15. Gopta O, Semenov A, Bloch D. Electrogenic proton transfer in Rhodobacter sphaeroides reaction centers: effect of coenzyme Q10 substitution by decylubiquinone in the CB binding site. FEBS Lett 2001; 499: 116-20. [ Links ]
16. Miles M, Tang P, Miles L, Steele, P, Moye M, Horn P. Validation and application of an HPLC-EC method for analysis of coenzyme Q10 in blood platelets. Biomed Chromatogr 2008; 22: 1403-8. [ Links ]
Aceptado para su publicación el 5 de agosto de 2010














