Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957
Acta bioquím. clín. latinoam. vol.45 no.3 La Plata jul./set. 2011
TOXICOLOGÍA
Metodología UV para la determinación de los antichagásicos Nifurtimox y Benznidazol en sangre*
UV methodology for determination of antichagasic drugs Nifurtimox and Benznidazol in blood
Metodologia UV para a determinação dos antichagásicos Nifurtimox e Benznidazol em sangue
Romina Fernanda Bulffer1, José Alberto Castro2, Silvia Laura Fanelli2
1 Farmacéutica
2 Doctor en Química
* Centro de Investigaciones Toxicológicas (CEITOX)-CITEFA/CONICET J.B. de La Salle 4397. B1603ALO, Villa Martelli, Buenos Aires. Argentina
Resumen
El Mal de Chagas es una enfermedad parasitaria endémica en América del Sur y Central. Existen dos fármacos disponibles para el tratamiento médico de la enfermedad, el Nifurtimox (Nfx) y el Benznidazol (Bz). No existen protocolos estandarizados, validados y accesibles en laboratorios regionales para determinar niveles de los antichagásicos en sangre. En este trabajo se presenta un método espectrofotométrico para la determinación de Nfx y Bz en sangre. Los metabolitos en sangre se extraen con columnas Extrelut®. Los extractos se evaporan, se redisuelven en mezclas de metanol/agua y se analizan espectrofotométricamente a 400 nm y a 320 nm para Nfx y Bz, respectivamente. Se cuantifica comparando con soluciones estándar de Nfx o Bz en el solvente. La metodología utilizada fue validada entre 0,5 y 50 ug/mL de sangre para Nfx y entre 0,5 y 100 ug/mL de sangre para Bz. La exactitud, precisión, linealidad y robustez del método fueron satisfactorias. Se aplicó el procedimiento determinando concentraciones sanguíneas post administración de ambos fármacos a ratas.
Palabras clave: Benznidazol; Nifurtimox; Sangre; Enfermedad de Chagas espectrofotometría
Summary
Chagas' Disease is an endemic parasitic disease in South and Central America. There are two drugs available for medical treatment of the disease, Nifurtimox (Nfx) and Benznidazol (Bz). There are no standardized or accessible protocols in regional laboratorios to determine the levels of antichagasic drugs in blood. A spectrophotometric method for Nfx and Bz determination in blood is presented in the present work. Blood metabolites are extracted through Extrelut® columns. Extracts are evaporated, redissolved in metanol/water mixanalysed by spectrophotometry at 400 nm and 320 nm for Nfx and Bz, respectively. They are quantified comparing with standard Nfx or Bz solutions in the solvent. The methodology used was validated between 0.5 and 50 jg/mL of blood for Nfx, and between 0.5 and 100 jg/mL of blood for Bz. The accuracy, precision, lineality and robustness of the method were satisfactory. The procedure was applied determining blood concentrations after administration of both drugs to rats.
Key words: Benznidazol; Nifurtimox; Blood; Chagas' disease; Spectrophotometry
Resumo
O Mal de Chagas é uma doenga parasitaria endémica na América do Sul e Central. Existem dois fármacos disponíveis para o tratamento médico da doença, o Nifurtimox (Nfx) e o Benznidazol (Bz). Não existem protocolos padronizados, validados e acessíveis em laboratorios regionais para determinarem níveis dos antichagásicos em sangue. Neste trabalho se apresenta um método espectrofotométrico para a determinação de Nfx e Bz em sangue. Os metabólitos em sangue são extraídos com colunas Extrelut®. Os extratos se evaporam, são redissolvidos em misturas de metanol/água e se analisam espectrofotometricamente a 400 nm e a 320 nm para Nfx e Bz, respectivamente. São quantificados comparando com soluções padrão de Nfx ou Bz no solvente. A metodologia utilizada foi validada entre 0,5 e 50 μg/mL de sangue para Nfx e entre 0,5 e 100 μg/mL de sangue para Bz. A exatidão, precisao, linearidade e robustez do método foram satisfatórias. Aplicouse o procedimento determinando concentrações sanguíneas pós- administragao de ambos os fármacos em ratos.
Palavras chave: Benznidazol; Nifurtimox; Sangue; Doença de Chagas; Espectrofotometria
Introducción
El Mal de Chagas es una enfermedad parasitaria de carácter endémico en algunas áreas de América del Sur y Central. En la actualidad, existen aproximadamente 1820 millones de individuos infectados con Trypanosoma cruzi. A su vez, se considera que 100 millones de personas están en riesgo de contraer la infección por el parásito (1).
Existen dos fármacos disponibles para el tratamiento etiológico de la enfermedad de Chagas, el Nifurtimox (Nfx) y el Benznidazol (Bz). El Nfx (Lampit®) fue introducido en el mercado en 1967 por Bayer y el Bz (Rochagan® en Brasil, Radanil® en Argentina) fue introducido en 1972 por Roche (2). La producción de Nfx fue suspendida por Bayer en 1997 al no ser redituable. Sin embargo, se retomó su producción para tratar la enfermedad del sueño en África (3). Actualmente, lo produce Bayer en El Salvador y lo entrega sin cargo por medio de la OPS (Organización Panamericana de la Salud) y OMS (Organización Mundial de la Salud), lo que hace que su empleo sea mayor en América Central (2-4). En Argentina, Brasil, Chile y Uruguay, el Nfx se retiró del mercado y se usa el Bz que se produce, actualmente, en Brasil (4).
El tratamiento con Nfx, tanto como con Bz, es relativamente prolongado (ej. 60-90 días) y se ha evidenciado en el curso de los mismos la aparición de serios efectos laterales adversos que, con frecuencia, fuerzan la interrupción por parte del médico (5) (6). El uso de estos dos fármacos en las etapas aguda e indeterminada de la enfermedad ha sido considerado imprescindible, a pesar de los efectos indeseables observados. El empleo de los mismos en la fase crónica, en cambio, es motivo de controversia debido a sus efectos laterales y a las dudas existentes acerca del beneficio de su empleo (7-10). De hecho, algunos autores mencionan evoluciones favorables en pacientes con la enfermedad aún cuando en la etapa crónica están en curso trastornos cardíacos o digestivos (megacolon o mega esófago) (8)(10). El empleo de Nfx o Bz en esos casos podrían ocasionar riesgos adicionales a los derivados de las lesiones propias de la enfermedad (5)(6)(11-14) o provenientes de otras patologías presentes ajenas a la enfermedad de Chagas (ej. renales, hepáticas o derivadas de otros tratamientos o exposiciones simultáneas) (7), lo que requeriría un cuidadoso monitoreo de niveles de Nfx y Bz presentes en sangre. Estas consideraciones sugieren la necesidad de contar con la existencia de protocolos para monitoreo de Nfx y Bz en sangre validados y accesibles a la mayor parte de los laboratorios hospitalarios.
En este trabajo se presenta y describe una técnica espectrofotométrica UV-visible para determinar Nfx y Bz en sangre.
Materiales y Métodos
REACTIVOS
Benznidazol o N-bencil-2-nitro-1-imidazol acetamida (Bz, Lot N°BS05041005, 98,6% pureza) fue donado por F. Hoffmann La Roche y Cía, Nifurtimox (Nfx, Lote N° R-0176-03, 99.7% pureza) fue donado por Bayer y, el relleno Extrelut® fue adquirido en Merck. El resto de los reactivos utilizados fueron de grado analítico.
PROCESAMIENTO DE LAS MUESTRAS
Las muestras de sangre (1 mL) se diluyeron con solución fisiológica (1,5 mL) y se pasaron por columnas de Extrelut® (2,4 g en jeringas de 10 mL con agujas 25 G) que luego se eluyeron con diclorometano (15 mL). El solvente fue evaporado hasta sequedad en atmósfera de nitrógeno. Los extractos de las muestras se conservaron en cámara fría (12 °C, en oscuridad) hasta el momento de la medición, luego se redisolvieron (1 mL) en una mezcla metanol/agua (CH3OH:H2O, 60:40) y se analizaron con un espectrofotómetro Shimadzu 2550 (Tokio, Japón) a 400 nm para Nfx y 320 nm para Bz.
PREPARACIÓN DE SOLUCIONES ESTÁNDAR DE BENZNIDAZOL Y NIFURTIMOX
Se prepararon soluciones estándar de 100 ug/mL de Nfx o Bz en metanol/agua, (60:40) a partir de soluciones estándar 1 mg/mL en dimetilformamida, almacenadas en viales de vidrio a -20 °C (estables durante más de un mes).
VALIDACIÓN DEL MÉTODO
La validación se realizó siguiendo los procedimientos de las guías de International Conference on Harmonization (ICH), USP (United States Pharmacopeia) and FDA (Food and Drug Administration) (16-18). Los parámetros evaluados fueron: linealidad, límite de detección y cuantificación, exactitud, precisión y robustez.
Linealidad. Se define como la capacidad de obtener resultados proporcionales a las concentraciones de las muestras. A las muestras de sangre se les adicionaron diferentes cantidades de Nfx o Bz. Luego de la extracción del metabolito y del análisis espectrofotométrico se determinó el porcentaje de recuperación comparando la respuesta del extracto con la respuesta del estándar. Las muestras estándar para obtener el recupero del ensayo se prepararon agregando concentraciones conocidas de Nfx o Bz en solución fisiológica.
Límites de Detección (LD) y de Cuantificación (LC). Se midieron con la linealidad, basados en la curva de calibración (18).
La curva de calibración se elaboró a partir de diferentes concentraciones de estándares analizadas por triplicado. Se determinó el coeficiente de correlación (r2) y otros parámetros de regresión. Se tomó como criterio aceptable r2 ≥ 0,99.
El LD y el LC se calcularon basados en la desviación estándar de la respuesta y la pendiente de la ecuación de regresión. El LD se calculó utilizando 3.3 σ/S, y para el LC se utilizó 10 σ/S, donde o es la desviación estándar de la intersección en y y S es la pendiente de la curva de calibración.
Precisión. Se determinó por la repetitividad y reproducibilidad en muestras que tenían 10 μ/mL de Nfx o Bz. Los resultados se expresaron como la desviación estándar relativa (RSD) de una serie de determinaciones.
Repetitividad. Se obtuvo examinando por duplicado diez muestras individuales.
Reproducibilidad. Se determinó por diferentes analistas en diferentes días. Se analizaron 3 muestras por triplicado.
Exactitud. Se analizó calculando el porcentaje (%) de Recuperación de la técnica analítica. Se prepararon tres muestras con 1 mL de sangre + 1,5 mL de solución fisiológica y otras tres muestras con 2,5 mL de solución fisiológica solamente. Se le agregaron 50 μL de la solución patrón de 100 μ/mL a cada una de las muestras. Cada muestra y cada estándar se realizaron por triplicado.
Se preparó una alícuota de la muestra según lo indicado en la técnica y se calculó la concentración del activo de la muestra. Luego, se midió la muestra con el agregado de estándar y calculó el % recuperado del activo.
Se realizó el procedimiento por triplicado.
Se calculó el % recuperado:

Donde:
Concentración Obtenida: concentración obtenida por medio de la técnica analítica en estudio (mg/mL).
Concentración Teórica: concentración conocida de la muestra calculada en forma teórica (mg/mL).
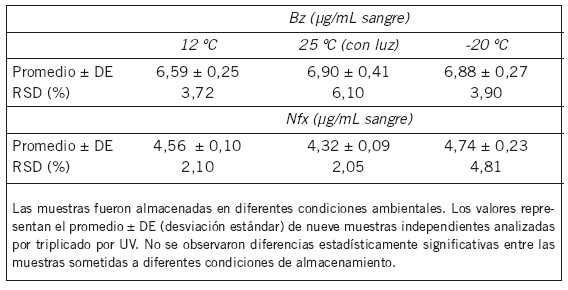
Robustez. Se examinó la capacidad del método de mantenerse inalterado ante pequeños cambios en las condiciones experimentales. Se analizó esta propiedad sometiendo las muestras a diferentes temperaturas.
Tratamiento estadístico. La significancia de las diferencias entre los valores promedios se evaluó utilizando el test de t no apareado (test t de Student) (18). Los cálculos se realizaron con el software GraphPad. Las diferencias se consideraron significativas con p< 0,05.
ANIMALES
Se utilizaron ratas macho de la cepa Sprague-Dawley (10 semanas de vida, 260-290 g de peso) que se mantuvieronen un ambiente controlado con un ciclo de 12 h de luz-12 h de oscuridad (de 6 a 18 h luz) ; la temperatura fue controlada en 23 ±2 °C y la humedad relativa entre 45 y 65%. El procedimiento utilizado para el manejo y la crianza de los animales siguió lo estipulado por la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT, Buenos Aires). Los animales se sometieron a ayuno de 12-14 h antes del ensayo, recibiendo agua ad libitum. Se les administró una única dosis intragástrica (ig) de 100 mg de Nfx o Bz/kg de peso, en una suspensión homogénea de carboximetilcelulosa (CMC) al 1%; los controles sólo recibieron CMC al 1%. Se sacrificaron por decapitación y sangrado a diferentes tiempos (1, 3, 6 y 24 h). La sangre se extrajo en tubos con heparina y se procesó.
Resultados
En la Figura 1 se muestran los espectros de absorción de los antichagásicos Nfx y Bz, donde se observan los máximos de absorción a 400 y 320 nm, respectivamente.

Figura 1. Barrido espectral de muestras de sangre que contenían Nifurtimox o Benznidazol
En las condiciones descriptas para el procesamiento de la muestra, la matriz biológica no interfiere en la determinación de los antichagásicos (Figura 1).
VALIDACIÓN DE LA TÉCNICA ESPECTROFOTOMÉTRICA PARA DOSAJE DE NFX Y BZ EN SANGRE
Linealidad. En el gráfico de absorbancia versus concentración (Figura 2) se observó una relación lineal en todo el rango evaluado 0,25-10 μg/mL para Nfx y 0,5 -100 μg/mL para Bz. El análisis de regresión lineal indica que no existen desviaciones significativas de la linealidad (r2: 0,99) para ambos antichagásicos (Tabla I).

Figura 2. Curvas de Calibración de los fármacos antichagásicos Nifurtimox y Benznidazol
Tabla I. Análisis de regresión lineal de las curvas de calibración de los antichagásicos Nifurtimox y Benznidazol

Los límites de detección obtenidos fueron de 0,68 μg/mL para Bz y 0,69 μg/mL para Nfx. Los límites de cuantificación fueron de 1,77 y 1,49 ug/mL para Bz y Nfx, respectivamente.
Precisión: Repetitividad y Reproducibilidad. Las muestras de sangre que contenían Bz o Nfx mostraron un coeficiente de variación relativo en un mismo día de 4,14% y 3,64%, respectivamente (Tabla II). Las determinaciones de las muestras en días diferentes dieron como resultado un coeficiente de variación menor del 5% (Tabla II).
Tabla II. Exactitud y Precisión
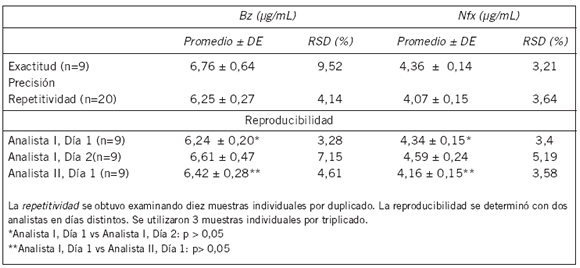
Exactitud. Las muestras de sangre que contenían Bz o Nfx mostraron un RSD menor al 5% (Tabla II). El porcentaje de recuperación obtenido fue de 75,45% para Nfx y de 97,18% para Bz.
Robustez. Se demostró que cambios en las condiciones de temperatura durante el almacenamiento de los extractos evaporados a sequedad no modificaron los resultados de la cuantificación (12 °C, 25 °C con luz y -20 °C) (Tabla III).
Tabla III. Ensayo de Robustez
Evolución del contenido de Bz o Nfx en muestras de sangre de ratas
Se determinó la concentración de Bz o Nfx en sangre a diferentes tiempos de la administración intragástrica del antichagásico. En ambos casos hubo absorción inmediata. Se observó un máximo de concentración a las 3 h, decreciendo hasta un nivel no detectable a las 24 h (Tabla IV).
Tabla IV. Concentración de antichagásicos Benznidazol y Nifurtimox en sangre a diferentes tiempos.

Discusión
El objetivo de este trabajo fue desarrollar y validar una metodología para la determinación de Bz y Nfx en sangre.
La metodología propuesta pudo ser validada, resultando ser un procedimiento exacto, reproducible, repetitivo y robusto.
Los autores consideran que las diferencias encontradas en los porcentajes de recuperación entre ambos antichagásicos podrían atribuirse a una mayor unión de las proteínas con el Nfx. Esta diferencia se ha observado con los distintos solventes de extracción utilizados.
El empleo de una metodología sencilla como la espectrofotometría UV, permitiría su posible aplicación al biomonitoreo de muestras humanas en laboratorios de baja complejidad por ejemplo, cuando los pacientes manifiesten reacciones adversas que requieran protocolos de tratamiento modificados o cuando, por tener ciertas patologías adicionales al mal de Chagas, su capacidad de metabolizar estos dos agentes quimioterápicos, se encuentre perturbada. Esas circunstancias podrían ser más frecuentes cuando los tratamientos se efectuaran a pacientes durante las etapas indeterminada y crónica de la enfermedad. En esas etapas, los efectos adversos de ambos quimioterápicos en diferentes órganos (1) (8) (11-15) podrían sumarse a otras patologías pre-existentes en los mismos. Ello requeriría modificar los protocolos de tratamiento en el propósito de atenuar los efectos adversos. En todas estas circunstancias, el monitoreo de los niveles sanguíneos de estos fármacos es recomendable al decidir el protocolo nuevo a seguir.
Conclusiones
El procedimiento propuesto para la determinación de los antichagásicos Nifurtimox y Benznidazol en sangre resultó ser una metodología rápida y simple como para ser estandarizada. Por lo tanto, se sugiere que la misma podría ser de utilidad para su empleo en laboratorios regionales donde se administran estos compuestos.
AGRADECIMIENTOS
Este trabajo fue patrocinado por FONCyT y Universidad Nacional de San Martín (UNSAM) (PICT 38235).
CORRESPONDENCIA
DR. JOSÉ A. CASTRO
Centro de Investigaciones Toxicológicas (CEITOX)- CITEFA/
CONICET
J.B. de La Salle 4397
B1603ALO, Villa Martelli, BUENOS AIRES. Argentina jacastro2808@yahoo.com
1. Rassi Jr A, Rassi A, Marin-Neto JA. Chagas heart disease: pathophysiologic, prognostic factors and risk stratification. Mem Inst Oswaldo Cruz 2OO9; 1O4 (Suppl. I): 152-8. [ Links ]
2. Schofield CJ, Jannin J, Salvatellan R. The future of Chagas disease control. Trends Parasitol 2OO6; 22: 583-8. [ Links ]
3. Jannin J, Villa L. An overview of Chagas disease treatment. Mem Inst Oswaldo Cruz 2OO7; 1O2 (Suppl. I): 95-7. [ Links ]
4. Rodriguez Coura J, de Castro SL. A critical review on Chagas disease chemotherapy. Mem Inst Oswaldo Cruz 2OO2; 97 (1): 3-24. [ Links ]
5. Castro JA, Montalto de Mecca M, Bartel LC. Toxic side effects of drugs used to treat Chagas'disease (American Trypanosomiasis). Hum Exp Toxicol 2OO6; 25: 471-9. [ Links ]
6. Castro JA, de Toranzo EG. Toxic effects of Nifurtimox and Benznidazole, two drugs used against American Trypanosomiasis (Chagas disease). Biomed Environ Sci 1988; 1: 19-33. [ Links ]
7. Rodriguez Coura J. Present situation and strategies for Chagas disease chemotherapy- a proposal. Mem Inst Oswaldo Cruz 2OO9; 1O4 (4): 549-54. [ Links ]
8. Viotti R, Vigliano C, Lococo B, Bertocchi G, Petti M, Alvarez MG, et al. Long-term cardiac outcomes of treating chronic Chagas'disease in the Benznidazole versus no treatment. Ann Intern Med 2OO6; 144: 724-34. [ Links ]
9. Perez- Molina JA, Perez-Ayala A, Moreno S, Fernandez-Gonzalesz MC, Zamora J, Lopez-Velez R. Use of benznidazole to treat chronic Chagas'disease: a systemic review with a meta-analysis. J Anticrobial Chemother 2OO9; 64 (6): 1139-47. [ Links ]
10. Sosa-Estani S, Viotti R, Segura EL. Therapy, diagnosis and prognosis of chronic Chagas'disease. Insight gained in Argentina. Mem Inst Oswaldo Cruz 2OO9; 1O4 (Suppl.1): 167-8O. [ Links ]
11. Díaz G, Rodríguez de Castro C, Montalto de Mecca M, Castro JA. Benznidazole-induced ultrastructural and biochemical alterations in rat colon. Acta Pharmacol Sin 2OOO; 21 (11): 961-6. [ Links ]
12. Montalto de Mecca M, Rodriguez de Castro C, Díaz EG, Castro JA. Alteraciones ultraestructurales en la mucosa del colon de ratas tratadas con Nifurtimox. Medicina (Buenos Aires) 2OO1; 61: 67-72. [ Links ]
13. Rodríguez de Castro C, Montalto de Mecca M , Fanelli SL, Cignoli de Ferreyra E, Díaz EG, Castro JA. Benznidazole-induced ultrastructural and biochemical alterations in rat esophagus. Toxicology 2OO3; 191: 189-98. [ Links ]
14. Bartel LC, Montalto de Mecca M, Fanelli SL, Rodriguez de Castro C, Díaz EG, Castro JA. Early Nifurtimox-induced biochemical and ultrstructural alterations in rat heart. Hum Exp Toxicol 2OO7; 26: 781-8. [ Links ]
15. Montalto de Mecca M, Bartel LC, Rodriguez de Castro C, Castro JA. Benznidazole biotransformation in rat heart microsomal fraction without observable ultrastructural alterations: comparison to Nifurtimox-induced cardiac effects. Mem Inst Oswaldo Cruz 2OO8; 1O3(6): 549-53. [ Links ]
16. General Chapter 1225, Validation of compendial methods, United States Pharmacopeia 30, National Formulary 25, Rockville, Md., USA, The United States Pharmacopeial Convention Inc., 2007. [ Links ]
17. Bioanalytical Method Validation. US Department of Health and Human Services. Food and Drug Administration. Center for Drug Evaluation and Research (CDER). Center for Veterinary Medicine (CVM), 2001. [ Links ]
18. Q2B Validation of Analytical Procedures: Methodology. US Department of Health and Human Services. Food and Drug Administration. Center for Drug Evaluation and Research (CDER). Center for Veterinary Medicine (CVM). International Conference Harmonization (ICH), 1996. [ Links ]
19. Gad SC, Principles and Methods in Toxicology. Philadelphia: Taylor & Francis; 2001. [ Links ]
Aceptado para su publicación el 28 de junio de 2011














