Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Acta bioquímica clínica latinoamericana
Print version ISSN 0325-2957
Acta bioquím. clín. latinoam. vol.46 no.1 La Plata Jan./Mar. 2012
INMUNOLOGÍA
Primer Consenso Argentino para la Estandarización de la Determinación de Anticuerpos Anti-Nucleares por Inmunof uorescencia Indirecta-HEp-2
First Argentine Consensus for Standardization of Antinuclear Antibodies by Indirect Immunofluorescence-HEp-2
Primeiro Consenso Argentino para a Padronizagáo da Determinagáo de Anticorpos Antinucleares por Imunofluorescéncia Indireta-HEp-2
Orlando Gabriel Carballo1ae, Fernanda Beatriz Ingénito2a, Alejandra Andrea Ginaca2b, Patricia Carabajal3b, Marta Alicia Costa2c, Jeannette Balbaryski4d
1 Bioquímico
2 Bioquímica
3 Médica
4 Licenciada en Química
a Laboratorio de Inmunología, Hospital Gral. de Agudos Carlos G. Durand. Díaz Vélez 5044, CABA, Argentina
b Hospital de Niños Ricardo Gutiérrez. Gallo 1330, CABA, Argentina
c Laboratorio Central, Área de Inmunología, Hospital Alemán, Av. Pueyrredón 1640, CABA, Argentina
d Laboratorio de Inmunología, Hospital Pedro Elizalde, Avenida Montes de Oca 40, CABA, Argentina
e Área de Inmunología, Laboratorio Central Hospital Italiano de Buenos Aires, Perón 4190, CABA, Argentina
Resumen
La presencia de anticuerpos antinucleares (AAN) es el denominador común de muchas enfermedades autoinmunes sistémicas y su significancia clínica depende de la metodología utilizada en su determinación. En la actualidad, la inmunofluorescencia indirecta (IFI) utilizando células HEp-2 como sustrato es la técnica más usada. Siendo un procedimiento subjetivo se deben optimizar los métodos de estandarización de las distintas variables involucradas, para asegurar la calidad de los resultados obtenidos. El uso de este sustrato permite la descripción no sólo de patrones de fluorescencia nucleares sino también citoplasmáticos y de diferentes organelas. El 29 de agosto de 2008 se llevó a cabo en Buenos Aires el Primer Consenso Argentino para la Estandarización de la Determinación de AAN por IFI-HEp-2, con la participación de 28 expertos. Se discutieron los aspectos metodológicos más importantes y se decidió llamar a la determinación "anticuerpos anti núcleo-citoplasmáticos". Se consensuó la sigla representativa de la determinación, el nombre en español de los diferentes patrones y el uso de controles de calidad internos y externos. La unificación de criterios llevará a la optimización de los resultados y a su correcta interpretación.
Palabras clave: Anticuerpos antinucleares; HEp-2; Inmunofluorescencia
Summary
Antinuclear antibodies (ANA) are a common feature of many systemic autoimmune diseases. Their clinical significance depends on working conditions. Nowadays, indirect immunofluorescence (IFI), using HEp-2 cells as substrate, is the most used assay. Since IFI is a subjective method, different variables should be strictly standardized to assure the quality of the results. By using HEp-2 cells, not only a nuclear fluorescent pattern will be described but also cytoplasmic and different organelle patterns. In order to standardize the operative procedures, the 1st Argentine Consensus for AAN IFI HEp-2 determination took place in Buenos Aires on August 29, 2008, with 28 experts as participants. The most important methodological aspects were discussed and the assay was decided to be named: anti nuclear- cytoplasmic antibodies. Consesus was also CAICYThed about the acronym for the determination, the Spanish names for the different patterns and the use of internal and external quality controls. Using common criteria will improve the quality of the results and optimize assay interpretation.
Keys works: Antinuclear antibodies; HEp-2; Immunofluorescence
Resumo
A presenga de anticorpos antinucleares (AAN) é o denominador comum de muitas doengas autoimunes sistémicas e sua significancia clínica depende da metodologia utilizada em sua determinagáo. Na atualidade, a imunofluorescéncia indireta (IFI) utilizando células HEp-2 como substrato é a técnica mais utilizada. Sendo um procedimento subjetivo devem ser otimizados os métodos de padronizagáo das diferentes variáveis envolvidas, para garantir a qualidade dos resultados obtidos. O uso deste substrato permite a descrigáo náo apenas de padróes de fluorescéncia nucleares mas também citoplasmáticos e de diferentes organelas. Em 29 de agosto de 2008, foi levado a cabo, em Buenos Aires, o Primeiro Consenso Argentino para a Padronizagáo da Determinagáo de AAN por IFI-HEp-2, com a participagáo de 28 especialistas. Foram discutidos os aspectos metodológicos mais importantes e se decidiu chamar a determinagáo de "anticorpos antinúcleo-citoplasmáticos". Foi estabelecida por consenso a sigla representativa da determinagáo, o nome em espanhol dos diferentes padróes e o uso de controles de qualidade internos e externos. A unificagáo de critérios levará a otimizago dos resultados e a sua correta interpretagáo.
Palavras chaves: Anticorpos antinucleares; HEp-2; Imunofluorescéncia
Introducción
La presencia de anticuerpos antinucleares (AAN) es el denominador común de muchas enfermedades autoinmunes sistémicas con relevancia clínica demostrada (1-3). La frecuencia de AAN es especialmente alta en Lupus Eritematoso Sistémico (LES), Síndrome de Sjógren, Esclerodermia, Enfermedad Mixta del Tejido Conectivo y hepatopatías autoinmunes, entre otras. Su presencia en las distintas patologías tiene valor diagnóstico, pronóstico y de monitoreo, sin embargo, estos autoanticuerpos también están presentes en infecciones y en individuos sanos (4). Se debe considerar, además, que el grado de positividad indicado por el título tiene importancia diagnóstica, ya que el valor predictivo positivo aumenta a títulos elevados (5).
La primera referencia histórica de AAN son las células LE descriptas por Hargraves, et al. (6) en 1948, cuando, en una punción de médula ósea, describieron la presencia de fagocitosis de material nuclear intacto opsonizado por autoanticuerpos. El factor responsable del fenómeno de células LE resultó ser una familia de auto-anticuerpos que reconocía diferentes constituyentes nucleares.
Al final de la década del 50 se desarrolló la técnica de IFI empleando como sustratos cortes criostáticos de tejidos (hígado y riñón) de roedores (rata o ratón). La positividad de la misma era dada por la presencia de coloración fluorescente en los núcleos de las células. Comparado con la prueba de células LE, la IFI demostró ser mucho más sensible, aunque con una disminución en la especificidad diagnóstica (7-9).
En un esfuerzo por reducir el número de falsos positivos o resultados clínicamente irrelevantes, los laboratorios comenzaron a informar los títulos. En general, los pacientes con LES presentaban títulos mucho más altos que los individuos normales o con otras enfermedades. La prueba de AAN positiva fue incorporada como uno de los criterios diagnósticos de LES por el Colegio Americano de Reumatología (10).
El análisis de los resultados de las pruebas de AAN sobre cortes criostáticos de tejidos revelaban diferentes patrones de coloración nucleares, por lo que los laboratorios comenzaron a informar dichos patrones como: homogéneo, moteado, nucleolar o periférico. Posteriormente fueron incorporadas líneas celulares como sustrato para la detección de AAN por IFI, que demostraron tener considerables ventajas sobre la utilización de cortes criostáticos de tejidos de roedores. La línea celular más comúnmente utilizada es la HEp-2 proveniente de un carcinoma de laringe humano. Entre las ventajas más importantes que han llevado a convertir a esta línea celular en sustrato de referencia para la determinación de AAN se puede mencionar:
1) Las células HEp-2 son más sensibles porque presentan mayor concentración de antígenos, por ej: SSA/Ro.
2) Al provenir de un cultivo celular asincrónico, permiten la detección de anticuerpos contra múltiples estructuras nucleares, citoplasmáticas y relacionadas con la división celular.
3) Los núcleos presentan mayor tamaño por lo que los patrones de fluorescencia son más fácilmente visualizables.
Con el objeto de evitar resultados falsos positivos o falsos negativos, los laboratorios deben ajustar perfectamente sus condiciones de trabajo para interpretar los resultados correctamente, en especial buscando la dilución de corte que permita discernir mejor entre los individuos sanos y los enfermos. De esta manera se mejora el valor predictivo positivo (VPP) y el valor predictivo negativo (VPN).
Con la utilización de HEp-2 la cantidad de patrones observados se ha incrementado con los años hasta llegar, aproximadamente, a 50, teniendo en cuenta no sólo el teñido nuclear sino también el citoplasmático y de diferentes organelas como ser mitocondrias, Golgi, nucléolo y distintas estructuras del aparato mitótico tales como huso mitótico, centriolos, etc. Esto requiere de profesionales muy entrenados en la interpretación de imágenes y con conocimientos de biología celular. Los patrones permiten la orientación en la especificidad antigénica del anticuerpo, para luego utilizar un método específico de identificación como ELISA, Western Blot, Inmunoensayo Lineal, Dot Blot, Hemoaglutinación, etc. (11).
Como en otras determinaciones del laboratorio, la detección de los anticuerpos antinucleares debe cumplir con indicaciones estrictas que permitan el aseguramiento de la calidad de los resultados obtenidos. Basados en distintas publicaciones y guías (12), profesionales e instituciones están comprometidos en desarrollar sistemas de control de calidad e informar aspectos referidos a la mejor interpretación de estas pruebas, sobre todo en situaciones clínicas donde los resultados son muy significativos.
En Argentina, en 1997 se llevó a cabo en Buenos Aires, organizado por la Unidad de Inmunología del Hospital Durand, el Primer Workshop y Conferencia Latinoamericana de Autoinmunidad (13) con la presencia de importantes investigadores de todo el mundo: Dr. Eng Tan de Estados Unidos, Dr. Michel Kazatchkine y Dr. Patrice Debre de Francia; Dr. Luis A. Cohelo Andrade, Dr. Carlos von Mühlen de Brasil, Dr. Ignacio García De La Torre, Dr. Jorge Alcocer Varela y Dr. Luis Llorente de Méjico, entre otros. En Brasil se han organizado tres reuniones de consenso de patrones de HEp-2 (14-16). Desde el año 2006, en Argentina, dentro del Programa de Evaluación Externa de Calidad de la Fundación Bioquímica Argentina, se desarrolla el Subprograma para Autoanticuerpos que se plantea como el único programa nacional de Control de Calidad para AAN(http://www.fba.org.ar/)
Por otra parte, existen numerosos trabajos que intentan solucionar diferentes problemas a la hora de estandarizar la técnica de IFI para AAN, como así también realizan recomendaciones para asegurar la calidad. Entre estos trabajos y guías se destaca la realizada por el Clinical Laboratory and Standards Institute (CLSI) aprobada y publicada en 1996, (17) modificada en 2006.
En la determinación de anticuerpos anti nucleares por IFI se presentan diversos problemas:
. Falta de unanimidad en el criterio para el título de corte.
. Título del informe: habitualmente denominado FAN (factor anti núcleo) o ANA (del inglés, AntiNuclear Antibodies). Estos nombres se interpretan como anticuerpos dirigidos contra antígenos exclusivamente nucleares, dejando fuera los anticuerpos dirigidos contra antígenos citoplasmáticos u otras estructuras celulares, como aparato mitótico.
. Falta de consenso en el contenido del informe, cuáles son los datos más relevantes y cuáles no deben faltar. Los distintos informes pueden conducir a errores en la interpretación médica.
. Denominación de los patrones: se utilizan distintos nombres para identificar los mismos patrones; este hecho se debe a que el nombre de los patrones surge, en general, de la traducción del inglés al español.
. Dificultad en la estandarización de la técnica de IFI.
En base a estas y otras dificultades surgidas del análisis del Programa de Evaluación Externa de la Calidad, se decidió organizar un Consenso para la Estandarización de la Determinación de Anticuerpos Anti-Nucleares por IFI.
Materiales y Métodos
Durante un año los organizadores de este primer consenso se reunieron periódicamente para delinear los aspectos técnicos y el contenido a tratar. El día 29 de agosto de 2008 se llevó a cabo, en Buenos Aires, el Primer Consenso Argentino para la Estandarización de la Determinación de AAN por inmunofluorescencia Indirecta - HEp-2, con la participación de 28 expertos de 24 centros. La metodología de trabajo fue: presentación del tema, descripción de los aspectos más importantes de la técnica, concluyendo con discusión y votación del nombre de la determinación, denominación de los patrones en español y el contenido del informe.
CONSIDERACIONES METODOLÓGICAS PARA ASEGURAR LA CALIDAD DE LA DETERMINACIÓN DE AAN POR IFI.
Muchas son las variables que pueden intervenir en la calidad analítica del resultado:
1) Microscopio.
2) Recolección y almacenamiento de las muestras.
3) Elección del sustrato.
4) Conjugado fluorescente.
5) Controles internos.
6) Sueros de referencia.
7) Valor de corte.
1) Microscopio
Debido a la variedad de fuentes de luz y filtros disponibles, la elección del microscopio es muy importante. Las lámparas pueden ser halógenas o de mercurio de distintas potencias (50 o 100 w) o lámparas halógenas de alta presión o sistema de LED.
Para asegurarse que la intensidad de la lámpara de fluorescencia es la adecuada se requiere contar con estándares fluorescentes que cubran el mismo espectro de fluorescencia que se puede obtener en los estudios. Estos estándares fluorescentes son portaobjetos comerciales (Fig. 1) que contienen micro esferas fluorescentes con distintas intensidades que permiten controlar el comportamiento del microscopio. La magnificación recomendada para la observación de los preparados es de 400X.

Figura 1. Estándares fluorescentes: micro esferas fluorescentes con distintas intensidades (400X).
2) Recolección y almacenamiento de las muestras
La determinación debe realizarse en suero. La muestra debe ser refrigerada entre 2 y 8 °C si se procesa dentro de las 72 h, de lo contrario debe ser conservada a -20 °C o menos. Sucesivas congelaciones y descongelaciones pueden alterar el resultado. Evitar muestras muy hemolizadas o lipémicas.
3) Elección del sustrato
Existen diversos sustratos y agentes fijadores, cada uno con diferentes grados de sensibilidad y especificidad. El sustrato recomendado son las células HEp-2, obtenidas por cultivo en monocapa sobre portaobjetos. El fijador de elección es la acetona. La importancia del mismo reside en que hay fijadores que no permiten visualizar determinados patrones o pueden disolver algunos antígenos como el SSA/Ro. Las empresas comerciales no revelan el fijador utilizado, por lo tanto, la recomendación es evaluar las improntas con controles trazables de los distintos patrones para analizar el comportamiento de las mismas, especialmente con un suero positivo para SSA/Ro (17).
4) Conjugado fluorescente
El anticuerpo antiinmunoglobilina humana puede ser marcado con isotiocianato de fluoresceína (FITC) o con isotiocianato de tetrametilrrodamina (TRITC). Sin embargo, anticuerpos conjugados con FITC son los más comúnmente utilizados en este medio. La sensibilidad y la especificidad de la determinación de AAN depende, en gran medida, de la elección de un buen conjugado.
Existen algunas consideraciones con respecto a la elección del conjugado:
a) Especificidad isotípica del conjugado: en la determinación de AAN por IFI pueden ser usados tanto conjugados polivalentes (CAICYTtivos contra IgG, IgA e IgM) como conjugados anti-IgG específicos. El 96% de los pacientes con LES producen AAN de clase IgG. La mayoría de los autoanticuerpos asociados a daño, severidad o subtipos clínicos en las enfermedades autoinmunes sistémicas son de clase IgG. Si se utiliza un conjugado IgG específico no podrán ser detectados los AAN de clase IgM asociados con artritis reumatoidea, drogas o la edad. Sin embargo, sólo 4% de los pacientes con enfermedades autoinmunes sistémicas producen cantidades significativas de AAN IgM específicas (17).
b) Relación Fluoreceína/Proteína (F/P): se recomienda que la relación se encuentre entre 2,5 y 4,0. Si la relación F/P es mayor, aumentará la tinción fluorescente no específica; por otro lado, si la relación F/P es menor disminuirá mucho la fluorescencia específica obteniendo resultados falsos negativos (17)(18).
c) Relación anticuerpo específico/Proteína (Ac esp/P): debe ser aproximadamente 0,1 o mayor; si es menor disminuye la especificidad. La concentración final (dilución de trabajo) del anticuerpo específico debe estar entre 30 y 60 ug/mL (17) (18)
d) Dilución de trabajo del conjugado: El laboratorio deberá evaluar la dilución de trabajo recomendada por el fabricante. Cada laboratorio deberá titular los conjugados utilizando un suero positivo de título conocido (control primario o secundario) para establecer la dilución óptima de trabajo requerida. No se recomienda utilizar conjugados prediluídos o listos para usar ya que las condiciones de trabajo del laboratorio pueden no ser iguales a las del fabricante. Si el fabricante decide utilizar para su técnica un conjugado "listo para usar" se recomienda que agregue en el inserto las condiciones de trabajo y el microscopio utilizado para la lectura.
La dilución óptima de trabajo del conjugado debe establecerse bajo las siguientes circunstancias:
. Si se cambia el sustrato (tipo, marca o lote)
. Cada vez que se use un nuevo lote de conjugado.
. Si se cambia el sistema óptico de lectura o al cambiar la lámpara.
. Ante la falta de resultados adecuados en los controles internos procesados en cada corrida.
. Ante la falta de resultados adecuados en los controles de calidad externo: resultado fuera del acuerdo o con un desvío sistemático dentro del acuerdo.
e) Titulación del conjugado: El método más aceptado de titulación del conjugado es la titulación en damero o tablero de ajedrez. Se debe contar con un suero de referencia o patrón primario, o en su defecto con un patrón secundario, de título conocido, y con un suero negativo. Se procede a realizar la determinación frente a diluciones seriadas del conjugado (por ejemplo 1:50, 1:100, 1:200, 1:400 y 1:800), enfrentándolas con diluciones seriadas de los controles positivos y negativos. Estas diluciones cubrirán el rango por encima y por debajo del título asignado al control positivo. Suponiendo que el patrón primario tenga un título de 1:640, se podrían obtener los resultados que figuran en la Tabla I. Se define Título plateau, a la mayor dilución del patrón primario que es positivo en al menos tres diluciones diferentes y consecutivas del conjugado, luego el título cae abruptamente (en el ejemplo 1:640). El último título positivo a nivel del plateau se lo denomina punto final del plateau, en el ejemplo 1:400. Usualmente, la dilución de trabajo del conjugado es un cuarto de la dilución del punto final del plateau, 1:100 en el ejemplo. En general, la dilución obtenida de esta manera y teniendo en cuenta la relación F/P y Ac. esp/P contiene aproximadamente entre 30 y 60 ug/mL. Se debe controlar que el buffer de trabajo no produzca coloración inespecífica, testeándolo ante cada dilución del conjugado.(18)
Tabla I. Titulación en damero del conjugado fluorescente. Se tomó para el ejemplo el título del control primario positivo 1/640. C(+): control positivo. C(-): control negativo.
3) Controles internos
Deben ser utilizados en cada ensayo controles positivos y negativos. Dentro de los controles internos es recomendable incorporar un suero anti SSA/Ro positivo para determinar la presencia de este antígeno en el sustrato, en un título 2 veces superior al título de corte, por ej: si el título de corte es 1:80, el título del control positivo debería ser 1:320 (18).
6) Sueros de referencia
En 1980, la Arthritis Foundation en colaboración con el Center forDisease Control (CDC) en Estados Unidos, establecieron un comité de AAN, con la función de producir y promover el uso de sueros de referencia. Fueron definidos según su especificidad y se establecieron como patrones primarios. Otro control primario disponible es el producido por el National Institute for Biological Standards and Control, en colaboración con la Organización Mundial de la Salud. Este control tiene la particularidad de estar expresado en unidades, definido como la actividad presente en 0,186 mg de la preparación internacional de referencia que corresponde a 100 UI. De esta manera, los laboratorios deberían transformar los resultados de títulos a unidades internacionales y así disminuiría la variabilidad interlaboratorial (19).
7) Valor de corte
Cada laboratorio debe establecer, en individuos normales y según la edad, el valor de corte por debajo del cual el resultado se considera negativo. Para individuos adultos, la recomendación es de ensayar la determinación en dos títulos: 1:40 y 1:160, aclarando qué porcentaje de individuos sanos dan resultados positivos a estas diluciones. Teniendo en cuenta razones económicas se propone hacer el screening a la dilución de 1:80 con una sensibilidad del 90 al 95% (20). En individuos más jóvenes se recomendaría una dilución de corte de 1:40 (17). Por otro lado McGhee et al. demostraron que en niños menores de 18 años el valor predictivo negativo fue de 1,0 cuando se ensayaba una dilución de 1:180 (21).
En la Tabla II se detallan consideraciones prácticas a tener en cuenta a la hora de realizar la determinación de AAN por IFI.
Tabla II. Recomendaciones técnicas

Resultados
NOMENCLATURA E INFORME DE RESULTADOS
La determinación de AAN debe informarse de manera dicotómica (positivo o negativo). El resultado positivo debe ser acompañado por el título y el patrón.
Definición de resultado negativo: un resultado es considerado negativo cuando no se discrimina un patrón fluorescente definido.
Definición de resultado positivo: un resultado debe ser considerado positivo cuando se observa una prueba CAICYTtiva por encima de la dilución de corte distinguiéndose perfectamente un patrón fluorescente.
Las líneas celulares permiten distinguir distintos patrones nucleares, citoplasmáticos y relacionados con el ciclo celular. Debido a la disparidad entre laboratorios en la forma de informar los resultados y en las denominaciones de los patrones de fluorescencia, se realizaron varias propuestas basadas en trabajos publicados (14) (22).
NOMBRE DE LA DETERMINACIÓN:
Luego de varias propuestas se aceptó por votación llamar a la determinación: ANTICUEPROS ANTI-NUCLEO-CITOPLASMATICOS (FAN/AAN), considerando que es el nombre más explicativo y adecuado, aclarando entre paréntesis FAN/AAN, siglas con las que se identifica esta determinación en español y que están referidas a Factor Anti-Nuclear/Anticuerpos Anti-Nucleares.
INFORME:
Se propone que en el informe se consigne la siguiente información: nombre de la determinación, método, sustrato, dilución de corte y resultados, identificando la fluorescencia nuclear, aclarando título/s y patrón/es, y la fluorescencia citoplasmática, aclarando título/s y patrón/es, dejando un lugar para observaciones.
PATRONES DE FLUORESCENCIA:
En la Tabla III se describen los nombres consensuados de los patrones fluorescentes, considerando aquellos que deben ser de reconocimiento obligatorio por el operador.
Tabla III. Clasificación de patrones obligatorios (verde) y no obligatorios (negro).

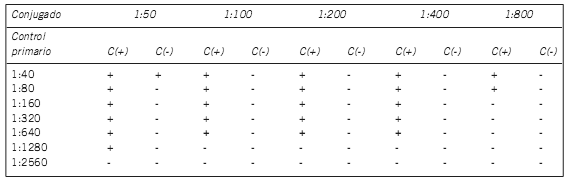
PATRONES NUCLEARES (Fig. 2)
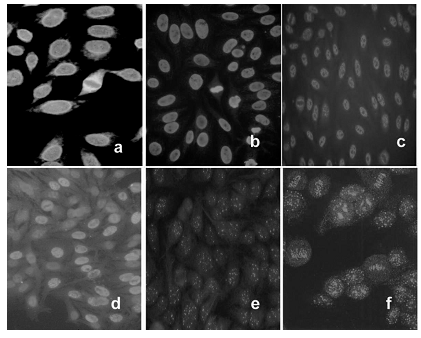
Figura 2. Patrones de fluorescencia nucleares: a) periférico, b) homogéneo, c) moteado, d) pleomórfico, e) puntos nucleares, f) centromérico.
Patrón Nuclear Periférico: Fluorescencia nuclear periférica con metafases negativas, citoplasma y nucleolo negativos (Fig. 2.a).
Patrón Nuclear Homogéneo: Nucleoplasma homogéneo, placa metafásica homogénea, nucleolos poco visibles (Fig. 2.b).
Patrón Nuclear Moteado: Nucleoplasma moteado, nucleolos negativos, metafases negativas (Fig. 2.c).
Patrón Nuclear Pleomórfico: Nucleoplasma moteado de distintas intensidades en células en división, células en interfase negativas y metafases negativas (Fig. 2.d).
Patrón moteado puntos nucleares: Nucleoplasma con puntos fluorescentes brillantes y dispersos, no se distingue el nucléolo, metafases negativas (Fig. 2.e).
Patrón Centromérico: Nucleoplasma moteado discreto, las motas tienden al apareamiento, metafase moteada, nucleolos no visibles (Fig. 2.f).
a. Para la dilución de las muestras, de los conjugados y para la realización de los lavados se utiliza buffer fosfato salino (PBS) con un pH de 7.2 (+/-0,2).
b. Las improntas deben sacarse del envase sólo inmediatamente antes de la siembra.
c. Utilizar puntas adecuadas que se ajusten bien a la pipeta.
d. Se debe cubrir bien los pocillos de la impronta con las diluciones de la muestra y controles, sin tocar el pocillo con las puntas.
e. Evitar corrientes de aire que puedan secar las improntas.
f. Al realizar los lavados proceder por lo menos con un lavado rápido con piseta para retirar el exceso no fijado y dos lavados posteriores de 5-10 minutos aproximadamente con agitación suave.
g. No volcar el buffer directamente sobre la impronta.
h. No dejar secar las improntas.
i. Evitar la luz directa sobre las improntas durante las incubaciones.
j. Verificar el pH del líquido de montaje (recomendado pH: 8 o mayor)
k. Realizar la lectura microscópica en cuarto oscuro. l. Verificar con frecuencia concordancia de lectores por sistema doble ciego.
PATRONES NUCLEOLARES
Fluorescencia nucleolar con metafases positivas o negativas (Fig. 3)
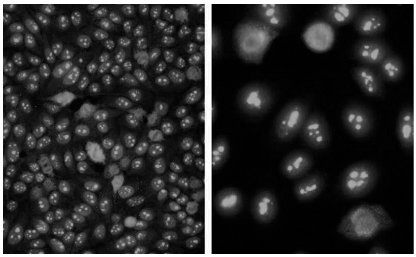
Figura 3. Patrones de fluorescencia nucleolares
Patrones citoplasmáticos (Fig. 4)
Figura 4. Patrones de fluorescencia citoplasmáticos: a) reticular, b) granular, c) granular polar, d) fibrilar
Patrón citoplasmático Reticular: Fluorescencia citoplasmática granular con una tendencia a la disposición reticular (Fig. 4.a).
Patrón Citoplasmático Granular: Citoplasma con gránulos de distintos tamaños con metafases negativas (Fig. 4.b).
Patrón Citoplasmático Granular Polar: Fluorescencia perinuclear polar con gránulos groseros, metafases negativas (Fig. 4.c).
Patrón Citoplasmático Fibrilar: Fibras citoplasmáticas que atraviesan las células, metafases negativas, núcleo y nucléolo negativos (excepto la presencia de otro anticuerpo) (Fig. 4.d).
Patrón Aparato Mitótico: fluorescencia presente en distintas estructuras relacionadas al ciclo celular, como por ejemplo centríolo, huso mitótico, etc. (Fig. 5).
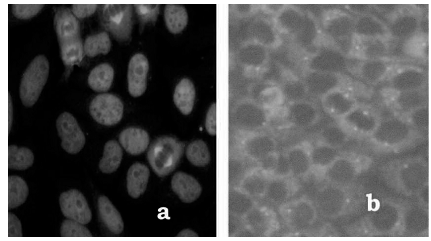
Figura 5. Patrones de fluorescencia aparato mitótico: a) NuMA1, b) centríolo
CONTROL DE CALIDAD INTERNO
El control de calidad interno tiene por objeto estudiar los errores casuales y sistemáticos dentro del mismo ensayo y permite constatar si los parámetros estadísticos obtenidos permanecen constantes en ensayos posteriores. Estos procedimientos permiten evaluar las variables internas del laboratorio y asegurar que las modificaciones observadas en muestras sucesivas de un mismo paciente se deben a cambios fisiopatológicos del enfermo y no a variaciones arbitrarias del mismo método. Para cumplir con este control se debe incluir, cada vez que se realiza la determinación, un suero negativo y uno positivo. Es deseable que el suero positivo sea de bajo título, siempre positivo teniendo en cuenta el error del método, y específicamente positivo para SSA/Ro, ya que este antígeno está en baja concentración en las células HEp-2 y se puede perder en los procedimientos de fijación.
CONTROL DE CALIDAD EXTERNO
El control de calidad externo es un conjunto de procedimientos y técnicas que se utilizan para operar sobre cada uno de los factores que afectan los resultados. Permite evaluar la desviación de cada laboratorio participante respecto a los demás y conocer la exactitud analítica de sus resultados. A través de la comparación de los resultados entre los distintos laboratorios tiene como objetivo principal garantizar la calidad de los laboratorios en su conjunto, controlando las distintas variables para emitir un resultado confiable permitirle a los participantes la posibilidad de comprobar el comportamiento de su laboratorio y su relación con el resto, y proveer información relativa al comportamiento de los equipos disponibles; identificar factores asociados al buen o mal desempeño, debiéndose adoptar medidas correctivas cuando esto no sucede.
Desde 2006 la Fundación Bioquímica Argentina pone a disposición de los laboratorios el Subprograma de Autoanticuerpos dentro del Programa de Evaluación Externa de la Calidad (PEEC). Este programa comprende la determinación de anticuerpos anti-nucleocitoplasmáticos (HEp-2) y anti-dsADN.
Discusión
La determinación de anticuerpos anti-núcleocitoplasmáticos es de gran utilidad para el diagnóstico de diversas Enfermedades Autoinmunes Sistémicas. Se encuentran en un alto porcentaje de pacientes con LES, EMTC, Esclerodermia, Artritis Reumatoidea, Sjógren y en otras enfermedades como las Hepatopatías autoinmunes. Su presencia en altos títulos es altamente sugestiva de enfermedad autoinmune sistémica.
En la actualidad la técnica de referencia para su detección es la Inmunofluorescencia Indirecta utilizando células HEp-2 como sustrato. Sus características de células tumorales humanas le proporcionan alta sensibilidad y especificidad al ensayo.
Por ser una técnica manual y subjetiva, las condiciones de trabajo y la idoneidad del operador para la lectura, afectan el resultado en la determinación de AAN. Esto enfatiza la importancia en la estandarización de las distintas variables que participan.
Al considerar los distintos factores que intervienen en la calidad analítica de los resultados se debe comenzar por tener en cuenta ciertas características respecto al microscopio. La potencia de las lámparas utilizadas pueden ser de 50 o 100 watts, ya se utilice lámpara de mercurio o halógena. La ventaja de las primeras es su gran potencia, pero requieren de más cuidados respecto al tiempo que permanecen encendidas (no debe excederse la hora -hora y media) y a la vida útil. Las lámparas de halógeno no tienen limitación respecto al tiempo de permanencia de encendido, pero su intensidad es menor. Hoy se puede disponer de lámparas de halógeno de alta presión o LED las cuales presentan una potencia semejante a las de mercurio, sin los inconvenientes del tiempo de encendido y con un mayor rendimiento. El desgaste de la lámpara en función del uso lleva a una disminución de la intensidad de luz, lo que hace importante la utilización de estándares fluorescentes con los que se puede chequear la misma. Los filtros que permiten pasar la longitud de onda adecuada de excitación, están determinados por el tipo de fluorocromo utilizado, que para la detección de AAN es isotiocianato de fluoresceína.
La determinación de anticuerpos antinucleares se realiza en suero, y si bien se puede detectar en otros materiales (por ejemplo líquido sinovial, pleural) no está totalmente demostrada la utilidad de las mismas, no siendo mencionada en las guías existentes. El correcto almacenamiento de las muestras evita la desnaturalización y contaminación que podrían llevar a falsos resultados.
Otro de los puntos importantes es el sustrato. Las células de cultivo HEp-2 son las recomendadas. Al pertenecer a un cultivo asincrónico son células en distintas etapas del ciclo celular, exponiendo antígenos no presentes en las células en reposo y que pueden CAICYTcionar con anticuerpos que son importantes en ciertas patologías. La concentración del antígeno nuclear SSA\Ro es adecuado en estas células, aunque su solubilidad depende de los fijadores usados, dato que no siempre es conocido. El más recomendado es la acetona.
Debido a que la mayoría de los autoanticuerpos con significado clínico en las enfermedades autoinmunes son de subtipo IgG, la recomendación es utilizar como conjugado antigammaglobulina de este subtipo, no descartando el uso de antigammaglobulina total, que permite detectar autoanticuerpos de otros subtipos.
Con respecto al conjugado, es importante mantener la relación F/P y Ac esp/P adecuadas, ya que la falta de cumplimiento en algunas de estas condiciones, implicaría falsos resultados negativos, exceso de coloración inespecífica con pegado inespecífico del conjugado, disminución de la especificidad y falta de definición de resultados. Si se cumplen las relaciones establecidas del conjugado, se podrá llegar en la dilución de trabajo, a la concentración final de anticuerpo específico entre 30-60 ug/ mL mediante la titulación de la antigamma marcada.
La titulación del conjugado es indispensable para adecuarla a nuestro sistema de trabajo, ya que permitirá la correcta diferenciación de negativos y positivos. No se pueden utilizar diluciones finales de conjugados sugeridos determinados en otros sistemas, bajo otras condiciones de trabajo, sin por lo menos verificarlos en nuestro sistema con un control primario o secundario positivo de título conocido.
Se debe fijar el valor de corte de la determinación, o sea el título a partir del cual el resultado es considerado positivo. La importancia reside fundamentalmente en poder definir un positivo con verdadero significado clínico con muy buena especificidad y una adecuada sensibilidad. En distintos trabajos y guías se comunican los porcentajes de positividad obtenidos en individuos sanos, siendo entre 25-30% para títulos de 1/40; 10-15% para 1/80 y 5% para títulos de 1/160(4). En familiares sanos de pacientes con enfermedades autoinmunes suelen reportarse títulos mayores de 1/40 en un 25-30% de los casos (23). Esto demuestra el gran significado que tiene establecer un título de corte en el laboratorio o bien utilizar un valor determinado en una población y bajo condiciones de trabajo semejantes a las nuestras. Una guía de Medicina Basada en la Evidencia para el uso de AAN recomienda informar junto al título positivo el porcentaje de individuos sanos que presentan el mismo título (23).
Para la evaluación de los procedimientos en cada ensayo es indispensable la utilización de controles internos positivos y negativos. Ante las dificultades presentadas por el antígeno SSA/Ro referentes tanto a su concentración como a su solubilización es recomendable que el control positivo usado contenga anticuerpos contra este antígeno en un título dos veces superior al título de corte.
La visualización de diversos patrones de fluorescencia permite pensar cuál es el autoanticuerpo involucrado y utilizar otras técnicas como inmunodifusión, inmunoprecipitación, radioinmunoensayo, hemoaglutinación o enzimoinmunoensayo para demostrar la CAICYTtividad de los sueros AAN positivos contra diferentes antígenos nucle-ocitoplasmáticos tales como dsADN, pequeñas ribonucleoproteínas nucleares como SSA/Ro, SSB/La, Sm, snRNP, enzimas tales como la Topoisomerasa I (Scl-70), histonas, etc.
La demostración de un determinado autoanticuerpo junto con la interpretación de los hallazgos clínicos constituyen los pilares esenciales en el diagnóstico de diversas enfermedades, muchas veces con importancia en el pronóstico o en la respuesta a la terapéutica.
Se debe tener en cuenta que el resultado negativo no implica ausencia de enfermedad. Estos pueden observarse en pacientes con síndrome de Sjógren, polimiositis, artritis reumatoidea, esclerodermia y en un sub-grupo de pacientes con LES considerados AAN negativos - SSA/Ro positivos con características clínicas particulares. Con el objeto de determinar anticuerpos anti-SSA/Ro por IFI se diseñaron las HEp2000, células transfectadas con cADN de SSA/Ro de 60 kd. Estas células presentan la dificultad de no detectar anticuerpos anti-SSA/Ro de 52 kd.
Ante un resultado negativo, si aún existe una sospecha de una enfermedad autoinmune sistémica hay que investigar la presencia de anti-SSA/Ro, antiribosomal P y anti-Jo-1 por ELISA u otro método específico (22).
Por otro lado un resultado positivo no implica enfermedad, pudiendo encontrarlo en individuos adultos sanos, por lo tanto, el resultado debe ser interpretado en el contexto clínico de cada paciente.
Por último, hay que tener en cuenta que la correcta interpretación de los resultados requiere considerar:
. La edad y el género del paciente.
. El uso de drogas que provoquen LES inducido, como por ejemplo: Hidralazina.
. El título obtenido.
. El patrón inmunofluorescente. Estos patrones pueden cambiar cuando se leen a diferentes diluciones. Debe ser informada la presencia de más de un patrón con sus respectivos títulos.
. Tener en cuenta los criterios diagnósticos de enfermedades autoinmunes sistémicas.
. La posibilidad de la presencia de autoanticuerpos como fenómenos paraneoplásicos, como puede ocurrir en el cáncer de mama.
. La posibilidad de la presencia de enfermedades infecciosas, como, por ejemplo, suele ocurrir en la lepra o pacientes HIV positivos.
. La posibilidad de tener resultados positivos en pacientes sanos y en personas con edad avanzada.
Conclusión
La naturaleza técnica de estas pruebas, la falta de estandarización, la dificultad en la obtención de patrones primarios, la observación subjetiva de los resultados, la utilización de diferentes microscopios, crean problemas singulares a la hora de establecer un programa de control de la calidad. Sólo una gran preocupación en la validez, exactitud y reproducibilidad de la técnica, usando sueros de referencia para la titulación del conjugado, estableciendo un control de calidad interno y participando en programas de control externo de la calidad, conseguirán resultados más confiables y habrá mayor acuerdo entre los laboratorios. Esto será apreciado por médicos y redundará en el beneficio de los pacientes.
Los autores declaran no tener conflicto de intereses.
Organizadores del Primer Consenso Argentino para la Estandarización de la Determinación de Anticuerpos Anti-Nucleares por Inmunofluorescencia Indirecta-HEp-2: Carballo OG (Coordinador), Ingénito FB, Ginaca A, Carabajal P, Costa MA, Balbaryski J.
Participantes: Arana RM, Guilleron C, Stafuza MG, Roquel L, Mitsui M, Arcavi M,Catoggio LJ, Yamamoto L, Da Representacao SR, Vergini V, Eichelmann AI, Larregina A, Schoijedman A, Manti V, Etchevez, PC, Murgo RD, Lapena MA, Orfus G, Aristimuño AM, Ori DB, Lirssi ML, Yeyati E, Pérez Colman MF
CORRESPONDENCIA
DR. ORLANDO GABRIEL CARBALLO Estados Unidos 3826
1228 CIUDAD AUTÓNOMA DE BUENOS AIRES - Argentina E-mail: gabriel@carballo.com.ar
1. Tan EM. Antinuclear antibodies: diagnostic markers for autoimmune disease and probes for cell biology. Acv Immunol 1989; 44: 93-151. [ Links ]
2. Hahn BH. Antibodies to DNA. N Engl J Med 1998; 338:1359-68.
3. von Mühlen CA, Tan EM. Autoantibodies in the diagnosis of systemic rheumatic disease. Semin Arthitis Rheum 1995; 24: 323-58. [ Links ]
4. Tan EM, Feltkamp TE, Smolen JS, Butcher B, Dawkins R, Fritzler MJ. et al. Range of antinuclear antibodies in "healthy" individuals. Arthritis Rheum 1997; 40: 1601-11. [ Links ]
5. Mill JA. Systemic lupus erythematosus. N Eng J Med 1994; 330: 871-9. [ Links ]
6. Hargraves M, Richmond H, Morton R. Presentation of two bone marrow components, the tart cell and the LE cell. Mayo Clin Proc 1948; 27: 25-8. [ Links ]
7. Holborow EJ, Weir DM, Johnson GD. A serum factor in lupus erythematosus with affinity for tissue nuclei. Br Med J 1957; 2: 732-57.
8. Friou CJ. Clinical application of lupus serum nucleoprotein CAICYTtion using fluorescent antibody technique. J Clin Invest 1957; 36: 890-7.
9. Holman HR, Kunkel HG. Affinity between the LE factor and cell nucleic acid nucleoprotein. Science 1957; 126: 162-3.
10. Tan EM, Cohen AS, Fries JF, Masi AT, McShane DJ, Rothfield NF. et al. The 1982 revised criteria for the classification of systemis lupus erythematosus. Arthritis Rheum 1982; 25: 1271-7.
11. Damoiseaux JGMC, Cohen Tervaert JW. From ANA to ENA: How to proceed. Autoimmun Rev 2006; 5(1): 10-17.
12. Kavanaugh A, Tomar R, Reveille J, Solomon DH, Homburger HA. Guidelines for clinical use of the antinuclear antibody test and teas for specific autoantibodies to nuclear antigens. Arch Pathol Lab Med 2000; 124: 71-81.
13. Carballo OG, Sarchi MI, Di Lonardo AM. Taller de Autoanticuerpos Antinucleares (ANA): una experiencia Latinoamericana. M Rev Mex Reumatol 1999; 14: 43-50.
14. Dellavance A, Junior AG, Cintra AFU, Ximenes AC, Nuccitelli B, von Mühlen CA, et al. I Consenso Nacional Para Padronizacio dos Laudos de FAN HEp-2 .Rio de Janeiro, J Bras Paol Med Lab 2002; 38: 3.
15. Dellavance A, Junior AG, Cintra AFU, Ximenes AC, Nuccitelli B, Taliberti BH, et al. II Consenso Brasileiro de Fator Antinuclear em Células HEp-2 Definicoes para a padronizacio da pesquisa de auto-anticorpos contra constituintes do núcleo (FAN HEp-2), nucléolo, citoplasma e aparelho mitótico e suas associacoes clínicas. Rev Bras Reumatol 2003; 43 (3): 129-40.
16. Dellavance A, Júnior AG, Nuccitelli B, Taliberti BH, von Mühlen CA, Araújo Bichara CD. Third Brazilian Consensus for autoantibodies in HEp-2 cells (ANA). Recommendations for standardization of autoantibodies screening Trial in HEp-2 cell, quality control and clinical associations. Rev Bras Reumatol 2009; 49 (2): 89-109.
17. NCCLS. Quality Assurance for the Indirect Immunofluorescence Test for Autoantibodies to Nuclear Antigen (IF-ANA); Approved Guideline. NCCLS document I/LA2-A (ISBN 156238-311-6). NCCLS, 940. West Valley Road, Suite 1400, Wayne, Pennsylvania 19087, 1996.
18. Rose NR, Bigazzi PE. Methods in Immunodiagnosis. (2° ed) New York, Chiester, Brisbane, Toronto: John Wiley and Sons; 1980.
19. Feltkamp TEW, Klein F, Janssens MBJA. Standardisation of the quantitative determination of antinuclear antibodies (ANAs) with a homogeneous pattern. Ann Rheumatic Dis 1988; 47: 906-9.
20. Ghosh P, Dwivedi S, Naik S, Agarwal V, Verma A, Agarwal A. Antinuclear antibodies by indirect immunofluorescence: Optimun screening dilution for diagnosis of systemic lulus erythematosus. Indian J Med Res 2007; 126:34. pp. 34-8.
21. McGhee JL, Kickingbird LM, Jarvis JN. Clinical utility of nuclear antibodies test in children. Clinical utility of antinuclear antibodies test in Children. BMC Pediatrics 2004; 4:13.
22. Carballo OG, von Muhlen CA, Nakamura R, García de la Torre I, Carvahlho Francescantonio PL. Atlas, Anticuerpos anti-nucleocitoplasmáticos (HEp-2). Buenos Aires: JC Ciccolella; 2006.
23. Gladman DD, Chalmers A, Urowitz, MB. Systemic lupus erithematosus with negative cells and antinuclear factor. J Rheumatol 1978; 5: 142-7.
24. Maddison PJ, Provost TT, Reichlin M. Serological findings in patiens with ANA-negative systemic lupus erythematosus. Medicine (Baltimore) 1981; 60: 87-94.
25. Solomon DH, Kavanaugh AJ, Schur PH and The American Collage of Rheumatology ad hoc Committee on Immunologic Testing Guidelines. Arthritis Rheum 2002; 47 (4): 434-44.
Aceptado para su publicación el 4 de marzo de 2011














