Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Acta bioquímica clínica latinoamericana
Print version ISSN 0325-2957
Acta bioquím. clín. latinoam. vol.46 no.2 La Plata Apr./June 2012
BIOQUÍMICA CLÍNICA
Efecto de hidrolizados de caseína o soja sobre el metabolismo glucídico en ratas
Effects of casein or soy hydrolysates on glucose metabolism in rats
Efeito de hidrolisados de caseína ou soja sobre o metabolismo glicídico em camundongos
Milaidi García1a, Rafael Agudelo2a, Laurent Savoie2b
1 Master of Sciences
2 Philosophy Doctor
a Departamento de Nutrición y Alimentación. Escuela de Nutrición y Dietética. Universidad de Los Andes. Mérida, Venezuela
b Departamento de Ciencias de Alimentos y Nutrición. Facultad de Ciencias de la Agricultura y de la Alimentación. Universidad Laval. Québec, Canadá.
Resumen
El efecto de hidrolizados de caseína o soja sobre el metabolismo glucídico fue estudiado en ratas. Se determinaron las variaciones de la glicemia, insulinemia y aminoácidos plasmáticos después de alimentación por sonda con diferentes péptidos obtenidos por proteólisis de caseína o soja. Los productos de digestión fueron separados combinando diálisis, cromatografía de intercambio iónico y ultrafiltración. Dos proteínas enteras, tres fracciones peptídicas de cada proteína y dos mezclas de L-aminoácidos simulando la composición de la proteína entera fueron suministradas a las ratas mediante sonda nasogástrica (gavage). Las fracciones del hidrolizado de caseína produjeron niveles de insulinemia más elevados que las de la soja, con excepción de los péptidos con masa molecular entre 10 y 1 kDa. No se encontraron diferencias significativas (p<0,05) de insulinemia dentro de las fracciones del hidrolizado de caseína. El nivel de insulina plasmática luego del gavage con la fracción peptídica de la soja S10-1 fue significativamente más elevado que con otros grupos peptídicos de la soja. Elevaciones significativas de insulina se observaron luego de los gavage con L-aminoácidos libres. Correlaciones directas fueron observadas en la insulinemia con los niveles plasmáticos de Tre (p<0,01, r=0,78), Glu (p<0,01, r=0,85), Pro (p<0,01, r=0,76), Ala (p<0,05, r=0,66), Met (p<0,05, r=0,71), Fen (p<0,05, r=0,69) e His (p<0,05, r=0,71). Los resultados muestran que cuando se administran con glucosa, la insulinemia en la rata puede ser influenciada por la naturaleza de los péptidos de la soja, mientras que estas diferencias no se observaron en los péptidos de la caseína.
Palabras clave: Digestión; Hidrolizado; Proteína; Péptidos; Aminoácido; Insulinemia; Glicemia
Summary
To determine the effects of different peptide mixtures on glycemic regulation in rats, plasma glucose, insulin and amino acid responses were monitored after gavage administration of different casein or soy digests obtained by in vitro hydrolysis. Peptides present in hydrolysates were separated combining dialysis, low pressure ion-exchange chromatography and ultrafiltration. Two intact proteins (casein and soy isolate), three peptide mixtures obtained from each protein and two free L-amino acid mixtures simulating dietary protein compositions were tested. The insulin responses after administration of the three casein peptide solutions were not significantly different (p<0,05). However, rat groups fed casein material had higher insulin concentrations than those fed soy material, except for animals fed soy peptides with molecular weight between 10 and 1 kDa (S10-1). Also, the insulin response after S10-1 gavage was statistically higher (p<0,05) than other soy-peptide solutions tested. Significant increase in insulin secretion was observed by rat groups after free L-amino acid gavages. The insulin response showed strong correlation with plasma Thr (p<001, r=078), Glu (p<001, r=085), Pro (p<001, r=076), Ala (p<005, r=066), Met (p<005, r=071), Phe (p<005, r=069) and His (p<005, r=071) concentrations. Results with soy peptide fractions indicate that the insulin secretion in rats can be influenced by the nature of the peptidic fraction administered, whereas in casein, these differences were not observed between digests.
Key words: Digestion; Hydrolysates; Protein; Peptides; Amino acids; Insulin; Glycaemia
Resumo
O efeito de hidrolisados de caseína ou soja sobre o metabolismo glicídico foi estudado em camundongos. Foram determinadas as variações da glicemia, insulinemia e aminoácidos plasmáticos depois de alimentação por sonda com diferentes peptídeos obtidos por proteólise de caseína ou soja. Os produtos de digestão foram separados combinando a diálise, a cromatografia de intercâmbio iônico e a ultrafiltragem. Duas proteínas inteiras, três frações peptídicas de cada proteína e duas misturas de L-aminoácidos simulando a composição da proteína inteira foram fornecidas aos camundongos através de sonda nasogástrica (Gavage). As frações do hidrolisado de caseína produziram níveis de insulinemia mais elevados que as da soja, com exceção dos peptídeos com massa molecular entre 10 y 1 kDa. Não foram encontradas diferenças significativas (p<0,05) de insulinemia dentro das frações do hidrolisado de caseína. O nível de insulina plasmática depois do gavage com a fração peptídica da soja S10-1 foi significativamente mais elevado que com outros grupos peptídicos da soja. Elevações significativas de insulina foram observadas depois dos gavage com L-aminoácidos livres. Correlações diretas foram observadas na insulinemia com os níveis plasmáticos de Tre (p<0,01, r=0,78), Glu (p<0,01, r=0,85), Pro (p<0,01, r=0,76), Ala (p<0,05, r=0,66), Met (p<0,05, r=0,71), Fen (p<0,05, r=0,69) e His (p<0,05, r=0,71). Os resultados mostram que quando se administram com glicose, a insulinemia no camundongo pode ser influenciada pela natureza dos peptídeos da soja, enquanto que estas diferenças não se observaram nos peptídeos da caseína.
Palavras chave: Digestão; Hidrolisado; Proteína; Peptídeos; Aminoácido; Insulinemia; Glicemia
Introducción
Las proteínas juegan un papel fundamental en la secreción de insulina; esta acción resulta más efectiva cuando las proteínas son ingeridas en combinación con hidratos de carbono (1) (2). Estudios acerca del efecto que proteínas de distintas naturaleza tienen sobre la secreción de insulina han sido también muy bien documentados (3) (4). Las diferencias en la secreción de insulina al evaluar distintos tipos de proteína son generalmente atribuidas al efecto que poseen algunos aminoácidos para estimular las células beta del páncreas.
Aminoácidos tales como Arg, Lis, Fen y Leu son los primeros en ser liberados por la acción secuencial de las enzimas digestivas (5) y han sido identificados por ser los más efectivos para inducir la secreción de insulina (6). Definitivamente, la manera y secuencia en la que los aminoácidos llegan a la circulación sanguínea tienen una influencia sobre la secreción de insulina y en consecuencia sobre la regulación de la glicemia. Sin embargo, el mecanismo no esta claro aún; el papel que algunos aminoácidos tienen sobre la secreción de insulina puede ser atribuido por una parte, a la modulación del flujo de iones en las células beta del páncreas y también a la activación de la enzima deshidrogenasa pancreática (7) (8).
Otros estudios han determinado que la estimulación directa de los aminoácidos sobre la secreción de insulina está acompañada de una acción indirecta que estaría relacionada con hormonas gastrointestinales. De hecho, la presencia de productos de la digestión proteica sobre el lumen intestinal puede estimular la liberación de hormonas a nivel del yeyuno, las cuales podrían influenciar la secreción de insulina (9). En este sentido, se ha informado una mayor secreción de insulina luego de que mezclas de aminoácidos fueron administradas por vía enteral que cuando se suministraron por vía intravenosa (10) (11).
Otras investigaciones se han dedicado a evaluar el efecto sinérgico de hidrolizados proteicos con hidratos de carbono sobre la insulinemia (12-14). Estos estudios confirman que hidrolizados proteicos administrados con hidratos de carbono actúan sinérgicamente sobre la secreción de insulina, indistintamente del tipo de proteína. Es de hacer notar que en la mayoría de estos estudios, los hidrolizados no provienen de las proteínas estudiadas. Caso contrario a este estudio, donde los péptidos suministrados por sonda se obtuvieron de las mismas proteínas objeto de estudio. En estudios previos (15) (16) se ha demostrado que péptidos resistentes a la digestión son liberados en diferentes momentos y cantidades según la fuente de proteína, y que posiblemente estos péptidos son responsables de diferentes procesos fisiológicos que ocurren luego de la ingesta de proteínas. El objetivo de este trabajo fue investigar el efecto que péptidos de diferente masa molecular obtenidos de la caseína o de la soja, tienen sobre el metabolismo glucídico en ratas. Las proteínas fueron hidrolizadas in vitro y los productos de digestión sometidos a una separación basada en la diálisis, cromatografía de intercambio iónico y ultrafiltración.
Materiales y Métodos
ANIMALES
Ratas Wistar machos entre 325 y 350 g fueron alojadas individualmente en un ambiente controlado a 21 ºC y con un ciclo de luz: oscuridad de 12 horas. Durante un periodo de adaptación de 7 días, los animales fueron alimentados con un producto comercial para ratas (comida para ratas Purina; Ralston Purina, Québec, Canadá), recibiendo agua ad libitum. Al día 4, bajo los efectos de anestesia con isoflurano, un catéter PE50 de diámetros interno 0,580 mm y externo 0,965 mm, manufacturado por Intramedic®, EE.UU., fue introducido y fijado a la vena yugular. El catéter fue dirigido de manera subcutánea hasta la parte posterior del cuello. Luego, los animales se dejaron recuperar por 3 días y se consideraron aptos para la prueba de sobrealimentación forzada por sonda nasogástrica o gavage, sólo los que mostraron un restablecimiento de su consumo normal de alimento (30 ± 7 g/día).
Al séptimo día, después de 12 horas de ayuno, 10 animales por grupo experimental, recibieron la solución de gavage con ayuda de una cánula de metal. Los animales se dejaron reposar individualmente en cajas plásticas de 15 x 30 cm. Muestras sanguíneas se obtuvieron desde el catéter con ayuda de jeringas que contenían EDTA a razón de 1,5 g/L sangre. La toma sanguínea se realizó inmediatamente antes del gavage (tiempo 0) y 30, 60, 90, 120, 180, y 240 minutos después del mismo. El plasma fue rápidamente separado por centrifugación a 4 ºC y almacenado -70 ºC hasta que los análisis de glucosa, insulina y aminoácidos fueron realizados. Los eritrocitos fueron resuspendidos en una solución salina y reinyectados al animal con el fin de prevenir una caída de los hematocritos y de minimizar el estrés. Los estudios fueron realizados acorde al protocolo aprobado por el Comité Canadiense del Cuidado de Animales.
SOLUCIONES UTILIZADAS EN LOS GAVAGES
Las soluciones de gavage consistieron en: sólo glucosa (grupo control) o glucosa más el material nitrogenado de origen proteico (grupos experimentales). Dos proteínas (caseína y soja), sus péptidos obtenidos por digestión in vitro y soluciones de aminoácidos libres sintéticos fueron utilizadas en el modelo experimental. La composición en detalle de cada solución usada en los gavages se muestra en la Tabla I. Un volumen equivalente a 5 mL de material nitrogenado fue administrado a razón de 2,25 g (N x 6,25) por kg de peso, acorde a lo establecido en trabajos previos desarrollados por otros investigadores (17).
Tabla I. Composición de las soluciones utilizadas en los gavages*

Como fuente de proteínas se utilizó caseína (88,3%) y proteína de soja (88,1%) comercializadas por ICN Nutritional Biochemicals (Mississauga, Ontario, Canadá). Para obtener las fracciones peptídicas se empleó el procedimiento descrito en la Figura 1; para ello la caseína y la soja fueron previamente hidrolizadas según el método de digestión in vitro descrito en trabajos previos (15). Las proteínas fueron sometidas a una hidrólisis con pepsina proveniente de la mucosa gástrica del cerdo (P-7012, 1:6000, 3080 unidades/mg proteína; Sigma Chemicals Co, San Luis, MO, EE.UU.) a una relación enzima: sustrato de 1:250. La hidrólisis con pepsina se efectuó durante 30 min a 37 ºC y pH 1,9. Luego, el pH se incrementó hasta 7,5 y el digerido pepsínico fue introducido en una membrana tubular de diálisis (Spectra/Por® 6; Spectrum Medical Industries Inc., LA, EE.UU.) de porosidad 1 kDa. La digestión pancreática se inició con la adición de una solución de pancreatina (Pancreatina porcina 5XUSP; ICN Nutritional Biochemicals, Canadá). La relación enzima:sustrato fue 1:25 y la hidrólisis pancreática se desarrolló durante 2 h a 37 ºC y a pH 7,5. Los digeridos dializados provenientes de la caseína y de la soja fueron liofilizados y utilizados como material nitrogenado en las soluciones de gavage denominadas respectivamente (C-día) y (S-día). La actividad enzimática dentro el digerido no dializado fue detenida por tratamiento térmico de 70 ºC durante 10 min, y el material no dializado fue fraccionado por cromatografía de intercambio iónico a baja presión usando una resina aniónica (gel Q Ceramic Hyper D®F; BioSepra SA, Life Technologies, Francia). La elusión fue realizada con una solución tampón de fosfato de sodio (0,05M a pH 7,5) obteniéndose una fracción peptídica con características básico-neutras, la cual fue sometida a ultrafiltraciones secuenciales usando membranas filtrantes en polietersulfona (Omega®; Pall Gelman Laboratory, Montreal, Canadá) de porosidades 10 y 1 kDa. Por cada proteína, dos fracciones de ultrafiltración fueron seleccionadas: una fracción con masa molecular entre 10 y 1 kDa (denominadas C10-1 para la caseína y S10-1 para la soja) y una fracción con masa molecular menor a 1 kDa (C<1 y S<1, respectivamente para casina y soja). Estas fracciones fueron liofilizadas y usadas en las soluciones de gavage.

Figura 1. Esquema del procedimiento de separación utilizado para la obtención de las fracciones peptídicas.
Finalmente, de manera de reproducir la composición aminoacídica de las fuentes proteicas, soluciones equivalentes fueron preparadas a partir de L-aminoácidos (Sigma Chemicals Co, San Luis, MO, EE.UU.) y usadas en los gavages, C-aa para la caseína y S-aa para la soja.
ANÁLISIS DE LAS MUESTRAS
El contenido de nitrógeno de las proteínas fue analizado por triplicado usando un autoanalizador Kjeldhal Foss modelo 1612 (Foss, Hillerod, Dinamarca), mientras que en las fracciones peptídicas y en la mezcla de aminoácidos, el contenido de nitrógeno se determinó por piroquimioluminescencia usando un analizador Anatek, modelo 7000 (Antek Instruments Inc, Houston, TX, EE.UU.).
La composición aminoacídica de las soluciones usadas en los gavages fue determinada por cromatografía de intercambio iónico usando un analizador Beckman modelo 6300 (Beckman Instruments, Palo Alto, CA, EE.UU.), para lo cual las muestras fueron previamente hidrolizadas por 24 horas en HCl 6N a 100 °C al vacío. La norleucina se utilizó como estándar interno y externo.
Los aminoácidos plasmáticos fueron determinados solamente a los tiempos de 0, 60 y 240 minutos, teniendo en cuenta lo limitado del volumen sanguíneo. Las alícuotas de plasma fueron desproteinizadas con ácido sulfosalicílico y los aminoácidos libres, analizados con el mismo equipo Beckman descrito anteriormente.
La glucosa plasmática de determinó por el método de la glucosa oxidasa usando un analizador Beckman modelo 2 (Beckman, Instruments Inc, Fulleton, CA, EE.UU.).
La insulina plasmática se analizó por un método de radioinmunoensayo para lo cual se utilizó un equipo producido por Linco Research (St. Charles, MO, EE.UU.).
ANÁLISIS ESTADÍSTICO
Los resultados de la glucosa e insulina plasmática se presentan en forma de histogramas en base a los valores promedios y la desviación estándar de las repeticiones (n=7-10).
La respuestas de glucosa, insulina y aminoácidos plasmáticos fueron calculadas como el incremento de las áreas bajo la curva (IABC) por encima de la línea base establecida por el tiempo cero (t=0 min) y separadas en dos periodos: durante la primera hora (0-60 min) y durante las 3 horas subsiguientes (60-240 min). Los datos fueron analizados por separado por cada grupo de proteína (caseína o soja) a través de un análisis de varianza (ANOVA) de una sola vía usando el programa estadístico Statistical Analysis System (SAS Institute, Cary, NC). Una prueba tipo Bartlett fue realizada para verificar la homogeneidad de la varianza. Las diferencias entre las soluciones de gavage utilizadas dentro de cada grupo proteico (caseína o soja) fueron establecidas a través de una prueba basada en Rango Múltiple de Duncan considerando una significancia de p<0,05.
Las variaciones plasmáticas de concentración de aminoácidos esenciales (AAE) fueron calculadas mediante la sumatoria de las concentraciones plasmáticas de Tre, Val, Met, Iso, Leu, Fen, Trp, Lis, His y Arg que se presentaron como valores promedios ± desviación estándar (n=7-10). Finalmente, un estudio de correlación fue desarrollado para establecer la relación entre los incrementos plasmáticos (IABC) de insulina y de cada aminoácido.
Resultados
La composición en aminoácidos de las soluciones de gavage se muestra en la Tabla II. Al comparar las soluciones de soja con las de caseína, se observa que estas últimas presentaron mayores proporciones de Pro y Met; contrariamente, Asp, Gli, Ala y Arg predominaron en los digeridos de la soja. Por otro lado, cuando se comparan los digeridos de diferente masa molecular dentro de una misma proteína, se observa que los péptidos con masa molecular entre 10 y 1 kDa (C10-1 y S10-1) son los que presentan las mayores proporciones de Pro, siendo a su vez pobres en Tir, Fen, Leu y Arg. También se observa que las fracciones peptídicas mostraron mayor contenido de aminoácidos esenciales (SAAE) que la proteína que les dio origen.
Tabla II. Composición porcentual en aminoácidos de las soluciones utilizadas en los gavages*

Todos los gavages produjeron un rápido incremento de la glucosa plasmática en los primeros 30 minutos (Figura 2A y 2D). Luego, con excepción del grupo Control, la concentración disminuyó durante el periodo 30-60 minutos. En el grupo Control, el nivel plasmático de glucosa continuó su incremento durante el periodo 30-60 minutos, alcanzando un valor máximo de 11,3 mmol/L, luego disminuyó drásticamente en el periodo de 120-180 minutos. Con las fracciones peptídicas de caseína C10-1, C<1 y C-día, así como con la fracción peptídica de la soja S<1, se observó una segunda elevación del nivel plasmático de glucosa en el periodo 60-240 min.
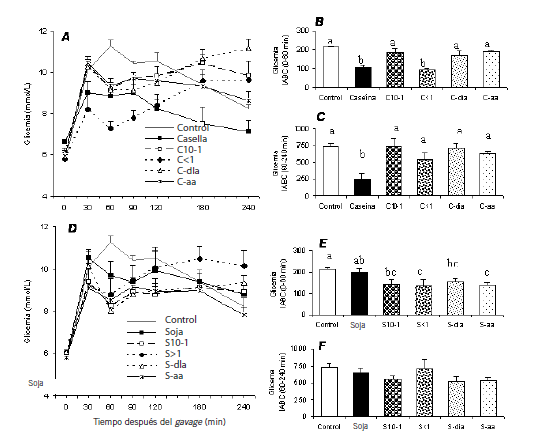
Figura 2. Efecto de los gavages sobre la glicemia. Los valores se presentan como promedios ± desviación estándar, n = 7-10 ratas/grupo. (A) Glicemia después de las pruebas con los productos de la caseína. (B) Incremento del área bajo la curva (mmol×1h/L) en el periodo 0-60 min después del gavage con productos de la caseína. (C) Incremento del área bajo la curva (mmol×3h/L) en el periodo 60-240 min después del gavage con productos de la caseína. (D) Glicemia después de las pruebas con los productos de la soja. (E) Incremento del área bajo la curva (mmol×1h/L) en el periodo 0-60 min después del gavage con productos de la soja. (F) Incremento del área bajo la curva (mmol×3h/L) en el periodo 60-240 min después del gavage con productos de la soja. Promedios que no muestran una misma letra presentan diferencias a un nivel de significancia p<0,05.
Como se observa en la Figura 2B, los niveles plasmáticos de glucosa obtenidos durante la primera hora después del gavage mostraron diferencias significativas entre las fracciones peptídicas de la caseína; la glicemia fue significativamente más baja luego de los gavages con caseína y con la fracción peptídica CL1. Al observar las últimas 3 horas (Figura 2C), sólo los animales que recibieron caseína no hidrolizada mostraron los niveles de glicemia más bajos. Los resultados de los gavages con soja (Figura 2E) muestran que las fracciones peptídicas obtenidas de esta proteína produjeron una glicemia significativamente más baja que la del grupo Control. La Figura 2F demuestra que no hubo diferencias en los niveles de glicemia representados como IABC entre las soluciones utilizadas en los gavages.
Los niveles plasmáticos de insulina se muestran en las Figuras 3A y 3D. La insulinemia se incrementó rápidamente en los primeros 30 minutos, particularmente luego de los gavages con las soluciones C-aa y S10-1, con los cuales se alcanzaron respectivamente niveles promedios de 800 y 650 pmol/L. Luego de este incremento inicial, salvo en las curvas del grupo Control y de la proteína de soja, se notó que las concentraciones plasmáticas de insulina disminuyeron drásticamente durante el periodo de 30-60 minutos. Cuando los resultados se presentan bajo la forma IABC, la Figura 3B demuestra que en la primera hora después del gavage, sólo la mezcla de aminoácidos libres C-aa se diferenció de las demás pruebas con material proveniente de la caseína. La figura 3C muestra que la respuesta insulínica para la solución C-aa fue significativamente más elevada en las últimas 3 horas. En lo que respecta a las fracciones provenientes de la soja, diferencias significativas entre las IABC de insulina plasmática fueron evidenciadas (Figura 3E), particularmente con la solución S10-1. Estas diferencias no se observaron en el periodo 60-240 minutos después del gavage (Figura 3F). Observando las respuestas durante la primera hora, los gavages con las soluciones provenientes de caseína presentaron valores de insulina más elevados que los realizados con las obtenidas de la soja.

Figura 3. Efecto de los gavages sobre la insulinemia. Los valores se presentan como promedios ± desviación estándar, n = 7-10 ratas/grupo. (A) Insulinemia después de las pruebas con los productos de la caseína. (B) Incremento del área bajo la curva (pmol×1h/L) en el periodo 0-60 min después del gavage con productos de la caseína. (C) Incremento del área bajo la curva (pmol×3h/L) en el periodo 60-240 min después del gavage con productos de la caseína. (D) Insulinemia después de las pruebas con los productos de la soja. (E) Incremento del área bajo la curva (pmol×1h/L) en el periodo 0-60 min después del gavage con productos de la soja. (F) Incremento del área bajo la curva (pmol×3h/L) en el periodo 60-240 min después del gavage con productos de la soja. Promedios que no muestran una misma letra presentan diferencias a un nivel de significancia p<0,05.
Una visión global sobre el nivel de aminoácidos plasmáticos, representados como el incremento del área bajo la curva (IABC) por cada grupo de proteínas se presenta en las Tablas III a VI. Solo se tratarán con mayor énfasis los cambios más relevantes del presente estudio. En la Tabla III se observa que en la primera hora después del gavage, los niveles plasmáticos de Tre, Pro, Ala, Met, Fen e His fueron significativamente más altos en los grupos caseína y C-aa que en los animales alimentados con las soluciones peptídicas provenientes de la caseína. En lo referente al periodo 60-240 minutos, la Tabla IV muestra que los niveles plasmáticos de Tre, Pro y Met fueron más elevados en los animales que recibieron los gavages con caseína o con sus aminoácidos libres C-aa. Los niveles plasmáticos de Pro fueron moderadamente altos en el grupo C10-1, cuando los resultados se presentaron como IABC calculada en las últimas 4 horas.
Tabla III. Variación de aminoácidos plasmáticos en el periodo 0-60 min después de los gavages con productos de la caseína*

Tabla IV. Variación de aminoácidos plasmáticos en el periodo 60-240 min después de los gavages con productos de la caseína*

Tabla V. Variación de aminoácidos plasmáticos en el periodo 0-60 min después de los gavages con productos de la soja*

Tabla VI. Variación de aminoácidos plasmáticos en el periodo 60-240 min después de los gavages con productos de la soja*

En lo que respecta a los ensayos con soja, los niveles plasmáticos de Tre, Pro, Val, Ile y Leu fueron significativamente más altos durante la primera hora en los animales que recibieron la fracción peptídica S10-1 (Tabla V). Los niveles de Tre y Pro también se mostraron elevados durante la primera hora en los animales que recibieron los aminoácidos libres de la soja (S-aa). La Tabla VI muestra que los niveles plasmáticos de Val, Ile y Leu permanecen aún elevados en los animales que recibieron la solución S10-1 aún en las últimas 3 horas después de gavage.
Al observar la concentración plasmática de aminoácidos esenciales (Figura 4A) se denota que con la excepción del grupo Control y del C-día, los valores aumentaron luego de recibir las diferentes soluciones de caseína. Por el contrario, con las soluciones de soja (Figura 4B), sólo en las ratas que recibieron los gavages con S10-1 y S-aa hubo un incremento de los aminoácidos esenciales plasmáticos durante el periodo 0-30 minutos.

Figura 4. Variación de la concentración de aminoácidos esenciales a nivel del plasma luego de los gavages. Los valores se expresan como promedios ± desviación estándar, n = 7-10 ratas/grupo. (A) Valores luego de los gavages con productos de la caseína. (B) Valores luego de los gavages con productos de la soja.
Un análisis de regresión realizado sobre los datos durante la primera hora después del gavage muestra una estrecha correlación entre la insulinemia y los niveles plasmáticos de Tre (p<0,01; r=0,78), Glu (p<0,01; r=0,85), Pro (p<0,01; r=0,76), Ala (p<0,05; r=0,66), Met (p<0,05; r=0,71), Fen (p<0,05; r=0,69) e His (p<0,05; r=0,71).
Discusión
En un primer lugar, el estudio confirma que la naturaleza de la proteína ingerida tiene un efecto sobre el metabolismo glucídico en ratas. En este sentido estos resultados confirman los estudios desarrollados en animales (3) y humanos (5), que señalan diferencias en los niveles de glicemia postprandial cuanto se comparan diferentes tipos de proteínas.
Acorde a otros estudios que comparan el efecto de diferentes tipos de proteínas sobre la secreción de insulina (2) (4), los datos de este trabajo reflejan que las soluciones con material proveniente de caseína producen una mayor secreción de insulina que la producida con soluciones de soja. Sin embargo, esta observación es sólo válida para las fracciones con masa molecular menor a 1 kDa, ya que la fracción de la soja S10-1 produce un incremento en la secreción de insulina equivalente a las fracciones peptídicas de la caseína. Precisamente, es la fracción S10-1 dentro de las fracciones de la soja, la que presentó los mayores niveles de Leu, un aminoácido que según lo informado estimula la secreción de insulina.
En estudios preliminares (15) (16), se ha reportado que cantidades importantes de péptidos ricos en Pro, con masa molecular entre 10 y 1 kDa, pueden ser liberados durante las primeras horas de digestión proteica y permanecer presentes aún después de 6 horas de digestión. ¿Podrían estos péptidos jugar un papel en la secreción de insulina?
A pesar de que el nivel plasmático de aminoácidos no es un reflejo directo de la absorción intestinal de estos productos, en este estudio, se observó que el nivel plasmático de los aminoácidos esenciales (SAAE) aumentó durante la primera hora luego de los gavages con las fracciones de caseína y con la solución S10-1 proveniente de la soja. Estas observaciones confirman los resultados de otros investigadores (18), que informaron que los productos de digestión de la caseína se absorben de manera más rápida que aquellos que provienen de la proteína de soja.
En otro orden de ideas, los resultados del presente trabajo también indican que las mezclas de L-aminoácidos libres simulando la composición de las proteínas de la caseína y de soja, produjeron un aumento en la secreción de insulina significativamente mayor que las fracciones peptídicas correspondientes dentro de cada grupo (caseína o soja). Posiblemente, los L-aminoácidos libres presentes en las soluciones C-día y S-día, fueron rápidamente absorbidos e incrementaron los niveles plasmáticos de aminoácidos totales y con ello los niveles periféricos de Arg, Leu, Fen, Lis, quienes posiblemente ejercieron un efecto sobre las células beta del páncreas, estimulando la secreción de insulina.
Los mecanismos para explicar el efecto de los productos de digestión proteica sobre la regulación de la glicemia son parcialmente explicados por la llegada de los aminoácidos absorbidos al corriente sanguíneo. Estos resultados indican una fuerte correlación positiva entre la respuesta insulínica y los incrementos plasmáticos de Tre, Glu, Pro, Ala, Met, Fen e His, a pesar de que ninguno de ellos es considerado como gran estimulador de la secreción de insulina.
El efecto que sobre la secreción de insulina ejercen algunos aminoácidos ha sido ampliamente documentado en estudios previos basados en la incubación de células beta del páncreas (6) (11) o por administración de aminoácidos libres por vía intravenosa (2) (12) (19). En todos estos trabajos, la Arg, Lis, Fen y Leu han sido informados como los más efectivos para estimular la secreción de insulina. Sin embargo, estudios posteriores sugieren que la secreción de insulina puede ser influenciada por aminoácidos que afecten la concentración de iones y el flujo eléctrico de la membrana celular de las células beta del páncreas (8) (20) (21). En este sentido, algunos autores (7) señalan que aminoácidos neutros como la Ala y Pro, que no habían sido anteriormente señalados como estimuladores de la secreción de insulina, podrían actuar en sinergia con iones Na+, y al transportados a través de la membrana de las células beta del páncreas, causarían su despolarización debido al efecto sobre la concentración citoplasmática de iones Ca2+ y en consecuencia estimularían la secreción de insulina. En este sentido, algunos investigadores (22) han señalado que la glutaminólisis en células beta del páncreas puede también contribuir significativamente en la liberación de insulina pero el mecanismo molecular debe ser aún dilucidado.
Un interesante hallazgo de este estudio es que durante la primera hora después del gavage, los más altos niveles de insulina coinciden con los altos niveles de Pro a nivel plasmático, tales fueron los casos de las mezclas de L-aminoácidos y de la solución peptídica S10-1. En contraste, niveles plasmáticos de Pro bajos fueron observados en otras fracciones peptídicas de la soja que originaron las menores secreciones de insulina. Esta observación debe ser analizada con precaución tomando en cuenta que en este trabajo no se analizaron los aminoácidos a nivel de la sangre portal. Sin embargo, algunos estudios (23) han evidenciado que la Pro proveniente de la dieta es poco metabolizada en el intestino delgado, razón por la cual puede incrementar su concentración en la sangre portal durante un periodo postprandial. La Pro como otros aminoácidos de la familia del glutamato (Gln, His, Arg y Orn) pudiera estar relacionada con la secreción de insulina a través de un mecanismo relacionado al metabolismo del glutamato o la glutamina (24-26). En consecuencia su presencia en fracciones peptídicas, aseveración respaldada por nuestro análisis de correlación, pudiera explicar en parte, las diferencias en los niveles plasmáticos de insulina luego de los gavages con los productos de caseína o soja. De hecho, péptidos de la dieta que ofrecen resistencia a la hidrólisis, tales como las exorfinas reportadas en el gluten o las casomorfinas señaladas en la caseína, podrían jugar un papel en la secreción de insulina o glucagón (27-29); sin embargo, estos mecanismos permanecen aún desconocidos.
De manera general, el presente estudio evidencia que la caseína o sus péptidos inducen a una secreción de insulina más elevada que los productos de la soja, pero esto es solamente válido para las fracciones peptídicas con masa molecular menor a 1 kDa. Los péptidos de la soja entre 10 y 1 kDa generan una insulinemia equivalente a los péptidos de la caseína. La contribución de esta fracción peptídica a los niveles plasmáticos de Pro, podría ser la responsable de este fenómeno. Esta observación es especialmente importante considerando el gran interés desarrollado en los últimos años por el flujo de iones a través de la membrana en células beta del páncreas.
FINANCIAMIENTO
Este estudio fue financiado por Natural Sciences and Engineering Research Council of Canada.
CORRESPONDENCIA
PhD. RAFAEL AGUDELO
Fax: 58-274-2403070
E-mail: agudelo@ula.ve
milaidigarciabravo@gmail.com
1. Pinheiro A, Canaan F y Goncalves R. Insulinemia, Ingesta alimentaria y metabolismo energético. Rev Chil Nutr 2008; 35 (1): 18-24. [ Links ]
2. Guzmán L, Rodríguez M, Camejo M, Izquierdo M. Respuesta de glucosa e insulina: comparación entre dos tipos de desayuno y prueba de tolerancia oral con 75g de glucosa. Rev Ven Endocr Metab 2011; 9 (1): 20-6. [ Links ]
3. Van Loon LJ, Saris WH, Verhagen H, Wagenmakers AJ. Plasma insulin responses after ingestion of different amino acid or protein mixtures with carbohydrates. Am J Clin Nutr 2000; 72: 96-105. [ Links ]
4. Petry C, Dorling M, Pawlak D, Ozanne S, Hales C. LES, C.N. Diabetes in old male offspring of rat dams fed a reduced protein diet, Diabetes Res 2001; 2 (2): 139-43. [ Links ]
5. Noriega L, Tovar A, Gonzales M, Hernandez R, Escalante B, Santillan P, et al. Pancreatic insulin secretion in rats fed a soy protein high fat diet depends on the interaction between the amino acid pattern and isoflavones. JBC 2007; 286(28): 20657-66. [ Links ]
6. Pennings B, Boirie Y, Senden J, Gijsen A, Kuipers H, van Loon L. Why protein stimulates postprandial muscle protein accretion more effectively than do casein and casein hydrolysate in older men. Am J Clin Nutr 2011; 93 (5): 997-1005. [ Links ]
7. McClenaghan NH, Barnett CR, Flatt PR. Na+ cotransport by metabolizable and nonmetabolizable amino acids stimulates a glucose-regulated insulin-secretory response. Biochem Biophys Res Commun 1998; 249: 299-303. [ Links ]
8. Bertrand G, Ishiyama N, Nenquin M, Ravier MA, Henquin JC. The elevation of glutamate content and the amplification of insulin secretion in glucose-stimulated pancreatic islets are not casually related. J Biol Chem 2002; 277:32883-91. [ Links ]
9. Karamanlis A, Chaikomin R, Doran S, Bellon M, Bartholomeusz D, Wishart J, et al. Effects of protein on glycemic and incretin responses and gastric emptying after oral glucose in healthy subjects. Am J Clin Nutr 2007; 86 (5): 1364-8. [ Links ]
10. Karhunen LJ, Juvonen KR, Huotari A, Purhonen AK, Herzig KH. Effect of protein, fat, carbohydrate and fibre on gastrointestinal peptide release in humans. Regulatory Peptides 2008;149 (1-3):70-8. [ Links ]
11. Rossetti P, Porcellati F, Busciantella N, Candeloro P, Cioli P, Sreekumaran K, et al. Effect of oral amino acids on counterregulatory responses and cognitive function during insulin-induced hypoglycemia in nondiabetic and type 1 Diabetic People. Diabetes 2008; 57(7):1905-17. [ Links ]
12. Fukumori R, Yokotani A, Sugino T, Itoh F, Kushibiki S, Shingu H, et al. Effects of amino acids infused into the vein on ghrelin-induced GH, insulin and glucagon secretion in lactating cows. Animal Science J 2011; 82(2): 267-73. [ Links ]
13. van Loon LJ, Kruijshoop M, Verhagen H, Saris WH, Wagenmakers AJ. Ingestion of protein hydrolysate and amino acid-carbohydrate mixtures increases postexercise plasma insulin responses in men. J Nutr 2000; 130: 2508-13. [ Links ]
14. Calbet JA, MacLean DA. Plasma glucagon and insulin responses depend on the rate of appearance of amino acids after ingestion of different protein solutions in human. J Nutr 2002; 132: 2174-82. [ Links ]
15. Agudelo R, Gauthier S, Pouliot Y, Marin J, Savoie L. Kinetics of peptide fraction release during in vitro digestion of casein. J Sci Food Agric 2004; 84: 325-32. [ Links ]
16. Savoie L, Agudelo R, Gauthier S, Marin J, Pouliot Y. In vitro determination of the release kinetics of peptides and free amino acids during the digestion of food proteins. J AOAC Int 2005; 88(3): 935-48. [ Links ]
17. Hara H, Kiriyama S. Absorptive behavior of oligo-l-methionine and dietary proteins in a casein or soy protein diet: porto-venous differences in amino acid concentrations in unrestrained rats. J Nutr 1991; 121: 638-45. [ Links ]
18. Hall WL, Millward DJ, Long SJ, Morgan M. Casein and whey exert different effects on plasma amino acid profiles, gastrointestinal hormone secretion and appetite. BJN 2003; 89: 239-48. [ Links ]
19. Gannon M, Nutall F. Amino acid ingestion and glucose metabolism-A review. IUBMB life 2010; 62 (9): 660-8. [ Links ]
20. Weinhaus AJ, Muhammad TT, Poronnik P, Cook DI, Tuch BE. Insulin secretagogues, but not glucose, stimulate an increase in [i in the fetal Human and porcine beta-cell. JCEM 2003; 88 (6):2753-9. [ Links ]
21. Thams P, Capito K. L-arginine stimulation of glucose-induced insulin secretion through membrane depolarization and independent of nitric oxide. Eur J Endocrinol 1999; 140: 87-93. [ Links ]
22. Kelly A, Li C, Gao Z, Stanley C, Matschinsky FM. Glutaminolysis and Insulin Secretion From Bedside to Bench and Back. Diabetes 2002; 51(3): S421-S426. [ Links ]
23. Glucose regulation of glutaminolysis and its role in insulin secretion. Diabetes 1999; 48: 1535-42. [ Links ]
24. Galibois I, Pitre F, Parent G, Savoie L. Analysis of bound amino acids in the plasma of fed rats: a new preparation procedure. J Nutr Biochem 1991; 2: 25-30. [ Links ]
25. Newsholme P, Brennan L, Rubi B, Maechlen P. New insights into amino acid metabolism, b-cell function and diabetes. Clinical Science 2005; 108:185-94. [ Links ]
26. Newsholme P, Gaudel C, McClenaghan. Nutrient Regulation of Insulin Secretion and beta cell functional integrity. Adv in Exper Med Biol 2010; 654:91-114. [ Links ]
27. Brosnan JT. Glutamate, at the interface between amino acid and glutamate metabolism. J Nutr 2000; 130: 988S-990S. [ Links ]
28. Makris A, Borradaile K, Oliver T, Cassim N, Rosenbaum D, Boden G, et al. The individual and combined effects of glycemic index and protein on glycemic response, hunger and energy intake. Obesity 2011; 19: 2365-73. [ Links ]
29. Mulero J, Zafrilla P, Martínez A, Leal M, Abellán J. Péptidos bioactivos. Rev Clin Invest Arterioscl 2011; 23(5): 219-27. [ Links ]
Aceptado para su publicación el 3 de febrero de 2012














