Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957
Acta bioquím. clín. latinoam. vol.47 no.1 La Plata ene./mar. 2013
BIOQUÍMICA CLÍNICA
Relación entre síndrome metabólico e insulino resistencia en adultos con riesgo para diabetes tipo 2
Relationship between the metabolic syndrome and the insulin resistance in adults with type 2 diabetes risk
Relação entre síndrome metabólica e insulino-resistência em adultos com risco para diabetes tipo 2
Raúl Ignacio Coniglio1a, Roberto Ferraris2b, Andrea Prieto2b, Luis Alberto Vásquez3c, Sandra Garro2b, Marco Antonio Trípodi2b, Ana María Salgueiro3a, Juan Carlos Otero3a, María Marcela Malaspina1a, Hugo Montiel5c
1 Doctor en Bioquímica Clínica (UBA).
2 Médico.
3 Licenciado en Bioquímica.
4 Bioquímica.
5 Licenciado en Enfermería.
a Instituto Bioquímico Clínico Integral SRL. Saavedra 372. Viedma. Argentina.
b Hospital Pedro Ecay. Carmen de Patagones.
c Sanatorio Austral. Gallardo 170. Viedma.
CORRESPONDENCIA DR. RAÚL IGNACIO CONIGLIO Saavedra 372 8500 VIEDMA, Río Negro, Argentina Fax (54-02920) 423320. E-mail: raulconiglio@speedy.com.ar
Resumen
La diabetes mellitus tipo 2 (DBT2) es muy frecuente en la población pero no siempre está diagnosticada. Las alteraciones en el metabolismo de la glucosa (Glu) y el síndrome metabólico (SM) se presentan años antes de DMT2. Se realizó un estudio poblacional transversal, aleatorio y estratificado según nivel socioeconómico en 223 sujetos de 45 y más años con riesgo para DMT2. SM se determinó según AHA/NHLBI. El objetivo de este trabajo consistió en: a) Determinar la frecuencia de sujetos con Glu alterada en ayunas y SM; b) Determinar la relación entre diferentes índices de insulino-resistencia (IR), QUICKI, HOMA, Insulina (Ins) e Ins/Glu con SM y sus componentes. Los resultados fueron: la Glu elevada en ayunas (100-125 mg/dL) fue 19,3% (varones 22,1% y mujeres 17,8% (ns)); Glu=126 mg/dL, 2,2%; SM 38,1% (varones 33,8%, mujeres 40,4% (ns)). La IR se asoció con cintura y triglicéridos (p<0,001), C-HDL y presión arterial (p<0,01). Con curvas ROC se hallaron valores de corte de índices de IR para predicción de SM: QUICKI<0,33, HOMA>2,1; Ins>10 mU/L, Ins/Glu>1,8. HOMA-IR>2,1 vs SM mostró: sensibilidad 72,6%, especificidad 70,1%, valor predictivo positivo 60,4%, valor predictivo negativo 80,3%. Por análisis de regresión logística se hallaron predictores de SM: HOMA>2,1, OR = 8,76, (IC95% 4,37-17,55), p<0,001; historia familiar de diabetes, OR=4,74 (IC 95% 2,23-10,05), p≤0,001; bajo nivel de educación formal OR=2,69 (IC 95% 1,33-5,46), p=0,006. Se concluye que la frecuencia de Glu alterada en ayunas no fue mayor que para población general pero SM fue muy frecuente en las mujeres. HOMA-IR >2,1 y QUICKI<0,33 fueron fuertes predictores de SM asociados a aumentos de cintura y triglicéridos. La historia familiar de diabetes y el bajo nivel de educación formal configuraron un perfil fuertemente predictor de SM.
Palabras clave: Diabetes mellitus tipo 2; Glucosa alterada en ayunas; Síndrome metabólico; Índices de insulino-resistencia; Insulina; Insulina/glucosa; Educación formal; Riesgo para diabetes mellitus.
Glosario
Abreviaturas: GAA: glucosa alterada en ayunas; SM: síndrome metabólico; DMT2: diabetes mellitus tipo 2; ADA: American Diabetes Association; EC: enfermedad coronaria; C-HDL: colesterol de lipoproteínas de alta densidad; C-No-HDL: Colesterol no-HDL; TG: triglicéridos; Glu: glucosa; Ins: insulina; HOMA: Homeostasis Model Assessment; QUICKI: Quantitative Insulin Sensitivity Check Index; NCEP-ATP III: National Cholesterol Education Program - Adult Treatment Panel III; AHA: American Heart Association; NHLBI: National Heart, Lung and Blood Institute
Summary
Type 2 diabetes mellitus (T2DM) is very common in the population but not always diagnosed. Alterations in the metabolism of glucose (Glu) and the metabolic syndrome (MS) are presented years before T2DM. A cross-population study, randomized and stratified by socioeconomic level in 223 subjects aged 45 and over at risk for T2DM was performed. SM was determined according to AHA / NHLBI. Objectives: a) to determine the frequency of subjects with impaired fasting Glu and SM; b) to determine the relationship between different indices of insulin resistance (IR), QUICKI, HOMA, insulin (Ins) and Ins/Glu with MS and its components. Results: elevated fasting Glu (100-125 mg/dL) was 19.3% (males 22.1%, women 17.8% (ns)), Glu=126 mg/dL, 2.2%, SM 38.1% (males 33.8%, women 40.4% (ns)). IR was associated with waist and triglycerides (p <0.001), HDL cholesterol and blood pressure (p<0.01). With ROC curves were found the cutoff values IR for predicting MS: QUICKI <0.33, HOMA>2.1, Ins>10 mU/L, Ins/Glu>1.8. HOMA-IR>2.1 vs MS showed: sensitivity 72.6%, specificity 70.1%, positive predictive value 60.4%, negative predictive value 80.3%. For logistic regression analysis found predictors of MS: HOMA> 2.1, OR=8.76 (95% CI 4.37-17.55), p<0.001; family history of diabetes, OR=4.74 (95% CI 2.23-10.05), p≤0.001; low level of formal education OR=2.69 (95% CI 1.33-5.46), p=0.006. Conclusions: The frequency of impaired fasting Glu was no greater than for the general population but SM was very common in women. HOMA-IR> 2.1 and QUICKI <0.33 were strong predictors of SM associated with increases in waist and triglycerides. Family history of diabetes and low levels of formal education shaped a strong predictor of SM profile.
Key words: Type 2 diabetes mellitus; Impaired fasting glucose; Metabolic syndrome; Insulin resistance indices; Insulin; Insulin/glucose; Formal education; Risk for diabetes mellitus.
Glossary
Abbreviations: IFG: impaired fasting glucose, MS: Metabolic syndrome; T2DM: type 2 diabetes mellitus; ADA: American Diabetes Association; CHD: coronary heart disease; C-HDL cholesterol: high density lipoprotein cholesterol; C-Non-HDL: Cholesterol non-HDL; TG: triglycerides; Glu: glucose; Ins: insulin; HOMA: Homeostasis Model Assessment; QUICKI: Quantitative insulin Sensitivity Check Index. NCEP-ATP III: National Cholesterol Education Program - Adult Treatment Panel III; AHA: American Heart Association; NHLBI: National Heart, Lung and Blood Institute
Resumo
A diabetes mellitus tipo 2 (DBT2) é muito frequente na população mas nem sempre está diagnosticada. As alterações no metabolismo da glicose (Glu) e da síndrome metabólica (SM) se apresentam anos antes de DMT2. Foi realizado um estudo populacional transversal, aleatório e estratificado conforme o nível socioeconômico em 223 sujeitos de 45 e mais anos com risco para DMT2. A SM foi determinada segundo AHA/NHLBI. O objetivo deste trabalho consistiu em: a) determinar a frequência de sujeitos com Glu alterada em jejum e SM; b) Determinar a relação entre diferentes índices de insulino-resistência (IR), QUICKI, HOMA, Insulina (Ins) e Ins/Glu com SM e seus componentes. Os resultados foram: Glu elevada em jejum (100-125 mg/dL) foi 19,3% (homens 22,1% e mulheres 17,8% (ns)); Glu=126 mg/dL, 2,2%; SM 38,1% (homens 33,8%, mulheres 40,4% (ns)). A IR foi associada a cintura e triglicerídeos (p<0,001), C-HDL e pressão arterial (p<0,01). Com curvas ROC foram achados valores de corte de índices de IR para predição de SM: QUICKI<0,33, HOMA>2,1, Ins>10 mU/L, Ins/Glu>1,8. HOMA-IR>2,1 vs. SM mostrou: sensibilidade 72,6%, especificidade 70,1%, valor preditivo positivo 60,4%, valor preditivo negativo 80,3%. Por análise de regressão logística foram achados preditores de SM: HOMA>2,1, OR = 8,76, (IC95% 4,37-17,55), p<0,001; história familiar de diabetes, OR=4,74, (IC 95% 2,23-10,05), p<0,001; baixo nível de educação formal OR=2,69, (IC 95% 1,33-5,46), p=0.006. Conclui-se que: a frequência de Glu alterada em jejum não foi maior que para a população geral mas SM foi muito frequente nas mulheres. HOMA-IR>2,1 e QUICKI<0,33 foram fortes preditores de SM associados a aumentos de cintura e triglicerídeos. A história familiar de diabetes e o baixo nível de educação formal configuraram um perfil fortemente preditor de SM.
Palavras chave: Diabetes mellitus tipo 2; Glicose alterada em jejum; Síndrome metabólica; Indices de insulino-resistência; Insulina; Insulina/glicose; Educação formal; Risco para diabetes mellitus.
GLOSSÁRIO
Abreviaturas: GAA: glicose alterada em jejum; SM: síndrome metabólica; DMT2: diabetes mellitus tipo 2; ADA: American Diabetes Association; EC: doença coronária; C-HDL: colesterol de lipoproteínas de alta densidade; C-No-HDL: Colesterol não-HDL; TG: triglicerídeos; Glu: glicose; Ins: insulina; HOMA: Homeostasis Model Assessment; QUICKI: Quantitative Insulin Sensitivity Check Index; NCEP-ATP III : National Cholesterol Education Program - Adult Treatment Panel III; AHA: American Heart Association; NHLBI: National Heart, Lung and Blood Institute
"Es para mí una gran satisfacción participar en la publicación del número de Acta Bioquímica Clínica Latinoamericana como homenaje al Dr. Pizzolato y agradezco una vez más el haberme invitado. El Dr. Pizzolato fue jurado mío cuando rendí la tesis de doctorado y además he compartido con él muchos momentos amigables".
Raúl Ignacio Coniglio
Introducción
Las alteraciones en el metabolismo de la glucosa y el síndrome metabólico (SM) se presentan años antes de la expresión clínica de la diabetes mellitus tipo 2 (DMT2). La incidencia de DMT2 está en expansión en el mundo y con expectativas para el crecimiento (1). Cambios desfavorables en el estilo de vida conducen a un balance calórico positivo y sedentarismo en una gran parte de la población y se vinculan con el aumento en la frecuencia de obesidad y diabetes (2).
La DMT2 es muy frecuente en la población; sin embargo, en una significativa proporción de sujetos no está diagnosticada. Estudios en poblaciones con riesgo han mostrado que existen estrategias para prevenir y/o retardar la aparición de DMT2 y sus complicaciones. El Diabetes Prevention Study (DPS) (3) y el Diabetes Prevention Program (DPP) (4) mostraron en sujetos con tolerancia alterada a la glucosa que los cambios en el estilo de vida se asociaban con una reducción del 58% en la tasa de aparición de nuevos casos de diabetes. El Study to Prevent Non-Insulin Dependent Diabetes Mellitus (STOP-NIDDM) (5) y el Xenical in the Prevention of Diabetes in Obese Subjets (XENDOS) (6) entre otros estudios, mostraron que la prevención también es posible utilizando fármacos, pero es menos efectiva que los cambios en el estilo de vida.
El SM está asociado con un riesgo incrementado para la DMT2 (7) y la enfermedad cardiovascular (8)(9), y la detección precoz de SM tiene un impacto económico muy relevante si se tienen en cuenta los elevados costos en la atención médica (10). El SM puede estar afectado por factores genéticos y medioambientales y puede incluir: obesidad central, hiperglucemia, hiperinsulinemia, insulino-resistencia, dislipemia aterogénica (hipertrigliceridemia, disminución de C-HDL y presencia de partículas lipoproteicas LDL pequeñas y densas), hipertensión arterial, un estado protrombótico y un estado proinflamatorio, aunque no siempre se presentan todas las alteraciones juntas en un mismo individuo (11-13). Han sido propuestos diferentes criterios para el diagnóstico de SM los cuales han sido revisados y modificados por diferentes asociaciones científicas (13).
En 1988 Reaven GM (14) propuso que la insulino-resistencia podría ser la base fisiopatológica de anormalidades asociadas con la presión arterial, colesterol HDL, triglicéridos y tolerancia a la glucosa. En 1991 el Paris Prospective informó que la hiperinsulinemia estaba asociada con un riesgo incrementado de enfermedad coronaria cuando estaba acompañada por hipertrigliceridemia (15) aunque otros autores señalaron que concentraciones altas de insulina son un predictor independiente de enfermedad coronaria en el varón (16).
El clamp euglucémico hiperinsulinémico es el método de referencia para determinar la resistencia periférica a la insulina, pero es costoso y no práctico en la clínica o para estudios de población (17). Aunque se han descrito otros métodos (18-21), para estudios de población son preferibles los índices que utilizan la insulinemia y la glucemia en ayunas por su fácil acceso, bajo costo y aceptable correlación con el método de referencia. Entre estos se encuentran el HOMA-IR (20), QUICKI (21) o insulina/glucosa (22), la insulina (23), aunque también se han informado otros (22).
En 1997 la American Diabetes Association creó la categoría de glucosa alterada en ayunas (GAA) para el rango de valores de glucemia entre 110 y 125 mg/dL (24), pero en 2003 modificó el punto de corte al rango entre 100-125 mg/dL (25) con el objeto de mejorar la sensibilidad e identificar similares porcentajes de individuos en la población general con GAA y tolerancia alterada a la glucosa (TAG). Ambos son estados de insulino-resistencia pero diferentes desde el punto de vista fisiopatológico; los individuos con GAA tienen presente en forma predominante la insulino-resistencia hepática y normal sensibilidad a la glucosa en el músculo, mientras que los individuos con TAG presentan normal a ligeramente aumentada la insulino-resistencia hepática pero moderada a severa la insulino-resistencia muscular (26).
La Asociación Americana de Diabetes (ADA) ha recomendado que las alteraciones del metabolismo de la glucosa sean investigadas en sujetos con riesgo para DMT2 y describió los criterios para caracterizarlos (27).
En este trabajo se estudió un grupo poblacional con riesgo para diabetes mellitus tipo 2, con los siguientes objetivos: a) determinar la frecuencia de sujetos con Glu alterada en ayunas y SM; b) determinar la relación entre diferentes índices de insulino-resistencia (IR), QUICKI, HOMA, Insulina (Ins) e Ins/Glu con SM y sus componentes.
Materiales y Métodos
POBLACIÓN
Este estudio es de tipo observacional transversal; la recolección de muestras se realizó en el período mayo-diciembre de 2004. Se estudió una muestra poblacional randomizada y estratificada según el nivel socioeconómico de los barrios, en sujetos de 45 y más años, de la ciudad de Viedma, capital de la Provincia de Río Negro, en la Patagonia argentina.
Para el muestreo en campo se tuvo en cuenta la proporción de sujetos con necesidades básicas insatisfechas (NBI) según los barrios de Viedma, para lo cual se utilizó información suministrada por la Dirección de Estadística de la Provincia de Río Negro. Se determinaron en forma aleatoria las manzanas a encuestar. Un grupo de médicos del equipo entrenó a los encuestadores (asistentes sociales). Concurrieron para realizarse el estudio 223 sujetos de 45 años y más de edad, 77 varones y 146 mujeres. La muestra poblacional fue representativa de un universo de 8013 personas, según el censo del año 2001 ajustado a 2004.
CRITERIOS DE EXCLUSIÓN
Cada sujeto fue consultado por el encuestador por: presencia de diabetes, infarto de miocardio, by-pass coronario o angioplastia, enfermedad cerebrovascular, aterosclerosis periférica, hipotiroidismo, enfermedades renales, medicación hipolipemiante, uso de anticonceptivos orales o corticoides. Los que respondieron negativamente a todas las preguntas pasaron al interrogatorio sobre criterios de inclusión.
CRITERIOS DE INCLUSIÓN
Para ser incluidos los individuos debían tener riesgo para la DMT2 según criterio de la ADA (27), 45 años o más y responder afirmativamente por lo menos una de las siguientes preguntas: presencia de padres o hermano con diabetes, obesidad o sobrepeso, historia previa de hiperglucemia, hipertensión arterial o con tratamiento, colesterol o triglicéridos altos en sangre, glucemia elevada durante el embarazo o por lo menos un hijo con un peso al nacer de 4,1 kg o más.
Si el voluntario era admitido se anotaban sus datos personales en la planilla del encuestador y se entregaba un cupón al sujeto para presentarse en el laboratorio con un ayuno de 12 horas, informándole que se le entregarían gratuitamente los resultados de glucosa, colesterol, colesterol HDL, colesterol LDL y triglicéridos.
DESCRIPCIÓN DEL INSTRUMENTO DE RECOLECCIÓN DE DATOS
Para cada uno de los sujetos que se presentaron en el laboratorio un profesional participante en este estudio obtuvo la siguiente información: ocupación; nivel de educación formal: sin estudios; primario incompleto o primario (hasta 7 años de educación); secundario incompleto o secundario (7 a 13 años de educación); terciario/universitario completo o incompleto (14 y más años de educación); peso (en kg), talla (en cm), circunferencia de la cintura (en cm), estado respecto de la menopausia, historia familiar de enfermedad cardiovascular (padre antes de los 55 años o su madre antes de los 65 años o algún hermano que hubiera sufrido algún infarto de corazón o se le hubiera realizado by-pass o angioplastia), historia familiar de diabetes en padres o hermanos. Actividad física: se consideraron sedentarios los sujetos que no caminaban por lo menos algún día de la semana 30 minutos ni practicaban deportes. Se consideraron fumadores aquellos que habían consumido cigarrillos en el último año. Se les preguntó si estaban con o sin tratamiento para la hipertensión arterial. Todos los participantes firmaron el consentimiento informado aprobado por el Comité de Ética del Instituto Bioquímico Clínico Integral de acuerdo con la Declaración de Helsinki.
METODOLOGÍA CLÍNICA
Los sujetos fueron pesados y su talla se midió sin zapatos y con ropa liviana. Se utilizó el índice de masa corporal como medida antropométrica (peso (kg) dividido el cuadrado de la talla (m)). La presión arterial fue medida en el brazo derecho, sentado, con reposo previo de 5 minutos con un esfingomanómetro de mercurio previamente calibrado. Se realizaron dos determinaciones y se halló el promedio. Hipertensión arterial fue presión sistólica =140 mmHg o presión diastólica =90 mmHg o tratada con medicamentos (28). Todas las mediciones del estudio fueron realizadas por un mismo profesional.
El síndrome metabólico (SM) fue determinado según los criterios del NCEP-ATP III (11) modificado por AHA/NHLBI (29), por la presencia de por lo menos tres de los siguientes parámetros: Obesidad abdominal (circunferencia de la cintura); hombres =102 cm, mujeres =88 cm; triglicéridos =150 mg/dL; colesterol HDL, hombres <40 mg/dL, mujeres <50 mg/dL; presión arterial sistólica =130 mmHg o diastólica =85 mmHg o tratada; glucosa en ayunas =100 mg/dL.
Una vez completados los datos personales y clínicos se extrajeron 10 mL de sangre para los análisis bioquímicos.
METODOLOGÍA BIOQUÍMICA
Glucosa, colesterol y triglicéridos se determinaron por métodos enzimáticos con colorimetría final según Trinder; C-HDL con un método directo homogéneo (Wiener-Lab, Argentina). Se utilizó un autoanalizador Technicon RA-1000 (Miles Inc, Tarrytown (NY), EE.UU.). La insulina por electroquimioluminiscencia (Roche) con autoanalizador Elecsys 1010, (Boehringer Mannheim GmbH, Mannheim, Alemania) se determinó en 217 sujetos. Los coeficientes de variación intraensayos y entre ensayos fueron: glucosa 0,9% y 1,2%, colesterol 1,3% y 2,4%, triglicéridos 1,3% y 1,8%, C-HDL 2,1% y 2,2%, insulina 1,5% y 4,9%, respectivamente.
El laboratorio bioquímico-clínico participaba en programas de evaluación externa de calidad a través de la Fundación Bioquímica Argentina y del CEMIC (Programa Buenos Aires) para las determinaciones de glucosa, colesterol, triglicéridos, C-HDL e insulina.
Se calcularon los índices de sensibilidad a la insulina: Homeostasis model asessment (HOMA) (19) = ((Insulina (mUI/L) x Glucosa (mmol/L))/ 22.5; Quantitative Insulin Sensitivity Check Index (QUICKI) (20) = 1/ (Log Ins (mU/L) + Log Glucosa (mg/dL)); Ins(mU/L)/Glu (mmol/L) (21).
METODOLOGÍA ESTADÍSTICA
Se utilizó un software estadístico SPSS 11.5. La normalidad de las variables continuas fue estudiada aplicando el test de Kolmogorov-Smirnov y fueron normalizadas con logaritmo neperiano cuando correspondía. En el análisis descriptivo se utilizaron el valor de la media y la desviación estándar para las variables paramétricas y la mediana y el rango intercuartílico cuando la distribución no fue gaussiana. Para el análisis de variables paramétricas se usó la diferencia de las medias (prueba t de Student) y para las variables no paramétricas se aplicó la prueba de Mann-Whitney. Para las correlaciones entre variables continuas se utilizó el coeficiente de Pearson o Spearman, ajustando para edad y sexo. Para la comparación de proporciones entre variables discretas se utilizó Chi cuadrado de Pearson. Todos los tests fueron de dos colas y se utilizó un nivel de significación alfa menor que 0,05 para descartar la hipótesis nula. La sensibilidad, especificidad y valor predictivo positivo fueron calculados a partir de tablas 2 x 2.
Para comprobar el poder discriminante de cada uno de los índices de IR respecto de la presencia o no de SM, se utilizaron las áreas debajo de las curvas ROC. Se establecieron los valores de corte para cada uno de los índices de IR a partir de la intersección entre la bisectriz y la curva ROC.
Para determinar el valor predictivo de las variables independientes se utilizó el análisis de regresión logística multivariable paso a paso hacia delante según Wald. El criterio de inclusión en el modelo fue p<0,05, determinado con el test F.
Resultados
DESCRIPCIÓN DE LA POBLACIÓN CON RIESGO PARA DMT2
En la Tabla 1 se muestran los datos poblacionales, clínicos y bioquímicos de los sujetos con riesgo para DM. No se observaron diferencias significativas entre sexos para el nivel de educación formal. La obesidad central fue mayor en mujeres que en varones, 63,7% vs 28,6% (p<0,001) respectivamente, pero no hubo diferencias significativas entre sexos respecto del sedentarismo. El hábito de fumar en el último año fue similar entre ambos sexos, 22,1% en varones y 27,4% en mujeres. La presión sistólica y diastólica fue mayor en varones que mujeres y también la frecuencia de presión arterial =130/85 mmHg o tratados 81,8% vs. 56,8% (p<0,001), respectivamente.
Tabla I. Datos poblacionales, clínicos y bioquímicos en 223 individuos de 45 años y más con riesgo para la diabetes mellitus tipo 2, residentes en Viedma (Capital de la Provincia de Río Negro, Argentina)
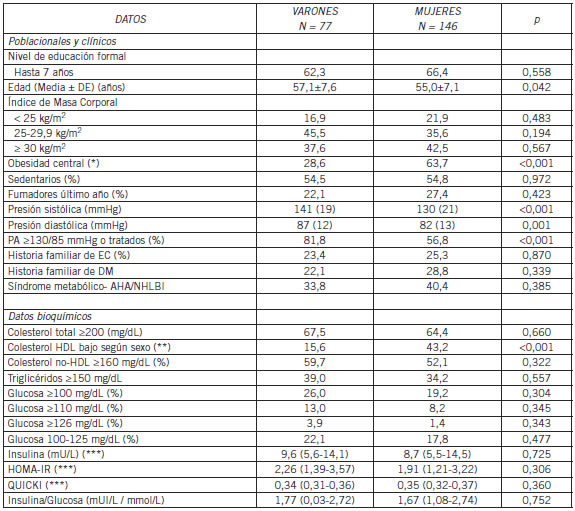
Circunferencia de cintura: Varones =102 cm, Mujeres =88 cm; Colesterol HDL bajo <40 mg/dL en varones y <50 mg/dL en mujeres; ** *Mediana (percentil 25-75)
Abreviaturas: PA=presión arterial; EC=enfermedad coronaria; DM=diabetes mellitus; HDL=lipoproteínas de alta densidad; HOMA=Homeostasis Model Assessment-Insulin-Resistance; QUICKI = Quantitative Insulin Sensitivity Check Index
Respecto de los datos bioquímicos, colesterol no-HDL=160 mg/dL se halló en 59,7% de varones y 52,1% de mujeres; C-HDL bajo ajustado según el sexo fue más frecuente en mujeres que varones, 43,2% vs 15,6% (p<0,001); TG=150 mg/dL fue similar entre ambos sexos; glucosa=100 mg/dL, 26,0% de varones, 19,2% de mujeres (ns). Los percentiles 25, 50 y 75 para los índices de IR fueron: HOMA-IR 1,2, 2,0 y 3,3; QUICKI 0,32; 0,34 y 0,37; Ins/Glu 1.1, 1.7 y 2.7; Ins 5.5, 9.9 y 14.4 mU/L respectivamente.
La frecuencia de GAA (100 a 125 mg/dL) fue 19,3% (IC 95% 14,1%-24,5%) y glucosa =126 mg/dL 2,2% (IC 95% 0,3%-4,1%). La frecuencia de SM según AHA/NHLBI fue 38,1% (IC 95% 31,7%- 44,5%).
Se calcularon HOMA-IR, QUICKI y Ins/Glu y en la Tabla II se muestra su asociación con los componentes de SM. Todos los indicadores de IR correlacionaron fuertemente con la circunferencia de la cintura, TG y TG/C-HDL y la presión arterial (p<0,001), pero los coeficientes de correlación fueron más bajos con C-HDL.
Tabla II. Correlación de Spearman, ajustada para el sexo y la edad, entre índices de resistencia a la insulina y componentes del síndrome metabólico en 217 individuos con riesgo para la diabetes de 45 años y más

Abreviaturas: IR=Insulino resistencia; TG=triglicéridos; C-HDL=colesterol de lipoproteínas de alta densidad; PAS=presión arterial sistólica; PAD=presión arterial diastólica; Ins= Insulina; Glu=Glucosa; HOMA-IR=Homeostasis Model Assessment - Insulin resistance; QUICKI = Quantitative Insulin Sensitivity Check Index
* p<0,001; ** p<0,01; # p<0,05
(Las variables fueron normalizadas con logaritmo natural para los cálculos estadísticos)
Se determinaron los valores de corte para los índices de IR respecto de la presencia o no de SM, utilizando las curvas ROC que se muestran en la Figura 1. Los valores de corte fueron: QUICKI <0,33, HOMA-IR >2,1, Ins >10 mU/L y Ins/Glu >1,8 y se utilizaron para este estudio. Las áreas bajo la curva ± error estándar, con intervalo de confianza del 95% fueron: QUICKI 0,79±0,03, (0,72-0,85), HOMA-IR, 0,78±0,03 (0,71-0,84), Ins 0,76±0,03 (0.69-0.82) e Ins/Glu 0,71±0,04 (0,64-0,78) (p<0,001) en todos los casos).

Figura 1. Curvas ROC para los índices de insulino resistencia QUICKI, HOMA-IR, Insulina e Insulina/Glucosa respecto del síndrome metabólico definido según AHA/NHLBI en 217 individuos de 45 y más años con riesgo para la DMT2
La asociación de obesidad central con TG=150 mg/dL (cintura hipertrigliceridémica) estuvo fuertemente asociada con HOMA-IR>3,3 (percentil 75), OR 5,25 (IC 2,54-10,82, p<0,001).
Se observó que 4,6% de los sujetos (10/217) tenían simultáneamente SM con GAA, HOMA>2,1 e historia familiar de diabetes presente y estos sujetos tendrían alto riesgo para DMT2.
La inactividad física, el bajo nivel de educación formal, la historia familiar de diabetes y todos los índices de IR se hallaron fuertemente asociados a SM. A fin de determinar el papel predictor independiente de estas variables respecto de SM, se realizó un análisis de regresión logística múltiple. Se construyó un modelo para cada uno de los indicadores de IR. Los resultados se observan en la Tabla III. En los cuatro modelos la variable mejor predictora de SM fue el indicador de IR, luego la historia familiar de diabetes y por último, el bajo nivel de educación formal del sujeto. HOMA>2,1 y QUICKI<0,33 fueron los mejores índices de IR asociados con SM con poder predictor similar para ambos. El bajo nivel de educación fue predictor independiente de SM en todos los modelos.
Tabla III. Predictores de síndrome metabólico en 217 individuos con riesgo para diabetes mellitus tipo 2 de 45 y más añosutilizando diferentes indicadores de insulino-resistencia

Variable dependiente: Síndrome metabólico definido según criterio de AHA/NHLBI
Variables independientes: Índices de insulino resistencia según el modelo (HOMA-IR >2.1, QUICKI<0,33, Insulina>10 mU/L, Insulina/Glucosa>1,8), sexo, edad, nivel de educación formal, actividad física e historia familiar de diabetes
Codificación de las variables ingresadas en los modelos: Historia familiar de diabetes, presente=1, ausente=0; nivel de educación formal ≤7 años de estudios=1; >7 años de estudios=0; actividad física, sedentario=1, activo=0
La relación entre HOMA-IR >2,1 y SM mostró: sensibilidad 72,6%, especificidad 70,1%, valor predictivo positivo 60,4%, valor predictivo negativo 80,3%.
La relación entre QUICKI vs SM mostró: sensibilidad 73,5%, especificidad 71,6%, valor predictivo positivo 61,6%, valor predictivo negativo 81,4%.
Discusión
Para la detección de GAA se utilizó como valor de corte para glucemia el valor 100 mg/dL por tratarse de un grupo poblacional con riesgo para DMT2 de acuerdo con el Consenso de la Sociedad Argentina de Diabetes (30). La frecuencia de GAA en sujetos con riesgo para DMT2 no fue mayor que la observada por otros autores en población general. En EEUU el National Health and Nutrition Examination Survey (NHANES) informó 19,4% (31), en Castilla-La Mancha (España) se reportó 22,3% (32) aunque en México se informó un valor más alto, 24,6% para sujetos de 30 a 65 años (33).
No puede afirmarse que los sujetos con Glu =126 mg/dL fueran diabéticos no diagnosticados porque se realizó una sola determinación de glucemia, pero los individuos fueron informados del hallazgo y se les recomendó consultar a su médico. Se ha informado que del total de diabéticos, un tercio está sin diagnosticar (34). Habida cuenta que la muestra poblacional de este estudio fue obtenida en el año 2004, si se asume una prevalencia de diabetes similar a la reportada en Argentina por el Ministerio de Salud de la Nación para el año 2005, que fue 8,4% (35), 2,8% no la conocería y esta frecuencia sería similar a la hallada en este trabajo para Glu =126 mg/dL. La prevalencia de diabetes en Argentina está en aumento como lo mostró la 2º Encuesta Nacional de Factores de Riesgo (35) pasando de 8,4% en el año 2005 a 9,6% en el año 2009 (p=0.006).
La frecuencia de SM en los varones con riesgo para DMT2 de 33,8% fue similar a la informada en un trabajo anterior (34,0%) obtenida en empleados de Argentina de 40 a 65 años de edad (n=1603) utilizando el mismo criterio de definición de SM (36); sin embargo, se halló significativamente mayor en las mujeres con riesgo, 40,4% respecto de 25,0% hallado en el país para N=1203. Esto puede explicarse por la elevada frecuencia de obesidad central y C-HDL bajo hallado en este grupo de mujeres. En EE.UU. la prevalencia de SM fue del 21,8% en la población adulta (37) y varió desde 6,7% entre 20 y 29 años hasta 43,5% entre 60 y 69 años.
Teniendo en cuenta que la presencia de SM aumenta entre 3 y 5 veces el riesgo para DMT2 en lo próximos 10 años, la elevada frecuencia de mujeres con riesgo para DMT2 con SM presente en esta muestra poblacional parecería indicar que éstas estaban más predispuestas que los varones para sufrirla en el futuro.
La medida de la cintura corporal estuvo fuertemente asociada con los índices de IR. La obesidad central (circunferencia de la cintura aumentada) con TG =150 mg/dL se asoció fuerte y significativamente con niveles de HOMA-IR>3,3 (percentil 75) y constituyó un indicador rápido y económico para estimar la presencia de insulino-resistencia. Esta asociación ha sido denominada cintura hipertrigliceridémica y es un práctico estimador de la presencia de SM (38).
El análisis de regresión multivariable mostró que los indicadores de insulino resistencia se asociaron fuertemente con la presencia de SM en los modelos estudiados. De ellos, HOMA y QUICKI fueron los mejores predictores de SM y no se observaron diferencias significativas entre ambos. Sin embargo, HOMA fue más práctico de utilizar por no necesitar del cálculo de logaritmos. Un sujeto con HOMA-IR>2,1 tenía un riesgo 8,8 veces mayor de tener SM que si tuviera un HOMA-IR inferior a ese valor de corte luego de ajustar para sexo, edad, nivel de educación, actividad física e historia familiar de diabetes. Fue observado que HOMA-IR>2,1 también estaba presente en 29,9% de los sujetos sin SM (40/134) (1-especificidad, falsos positivos). Estas observaciones estarían de acuerdo con otros autores que informaron que la IR se puede encontrar en la población general en 10 a 25% (39) y que no todos los sujetos con insulino-resistencia desarrollan anormalidades metabólicas (40).
La historia familiar de diabetes, como estimador de la carga genética del sujeto respecto de DMT2, mostró en todos los modelos que los sujetos que la tenían presente tenían un riesgo entre 3,3 y 4,7 veces mayor de tener SM respecto de aquellos que no la tenían presente luego de ajustar para las variables indicadas y según el índice de IR que se utilizara.
Aunque en el análisis univariable el sedentarismo mostró una asociación significativa con SM, en el multivariable perdió fuerza la asociación y no ingresó en ninguno de los modelos estudiados.
Los sujetos con nivel de educación primaria o menor tuvieron un riesgo 2,7 veces mayor de tener SM respecto de aquellos con mayor nivel de educación formal, luego de ajustar para otras variables (modelo 1). Para la evaluación del nivel socioeconómico y cultural se ha utilizado la ocupación, el nivel de ingreso y el nivel de educación formal (41)(42) pero el nivel de educación formal es una variable fácil de determinar para estimar el nivel socioeconómico de un sujeto y generalmente el sujeto responde con sinceridad durante la encuesta. Ha sido reportado que el bajo nivel socioeconómico está asociado con SM (43). Estos sectores suelen tener dietas más ricas en calorías (sobre todo hidratos de carbono) respecto de aquellos sectores con mayor poder adquisitivo y más alto nivel de educación (44) facilitando el desarrollo de la obesidad central y los desórdenes metabólicos siguientes.
La asociación hallada entre SM y el bajo nivel socioeconómico señala la necesidad de elaborar estrategias para promover la educación para la salud en todos los niveles pero con un enfoque especial en áreas urbanas periféricas, estimulando una alimentación más armónica y variada y a la vez una mayor actividad física.
Conclusiones
La frecuencia de glucosa alterada en ayunas no pareció más alta en esta población con riesgo para DMT2 que la reportada para población general por otros autores; sin embargo, la frecuencia de SM definida según AHA/NHLBI fue más alta en las mujeres que la observada para población aparentemente sana de este país. El SM estuvo significativamente asociado con niveles aumentados en los índices de insulino-resistencia, la historia familiar de diabetes y con el bajo nivel de educación formal. Los índices de insulino resistencia HOMA-IR y QUICKI se asociaron con SM en forma indistinta. Entre los componentes de SM, la circunferencia de la cintura y la trigliceridemia mostraron significativa asociación con los indicadores de IR. HOMA-IR >2,1; la historia familiar de DM y el bajo nivel de educación formal fueron predictores independientes para SM.
AGRADECIMIENTOS
El estudio fue declarado de Interés Municipal según ordenanza Nº 5516 de fecha 14 de octubre de 2004 por la Municipalidad de la Ciudad de Viedma, capital de la Provincia de Río Negro. Los autores agradecen a Laboratorio Roemmers por su colaboración económica para poder llevar adelante los estudios de campo; a Wiener- Lab y Productos Roche SAQ por su colaboración con reactivos bioquímicos; a la Dirección de Estadística de la Provincia de Río Negro por la información suministrada sobre aspectos socio-económicos de la ciudad de Viedma; a la Licenciada en Sociología Carmen Julia Freundlich por sus comentarios sobre la utilización de las variables socioeconómicas.
1. Danaei G, Finucane MM, Lu Y, Singh GM, Cowan MJ, Paciorek CJ, et al. National, regional, and global trends in fasting plasma glucose and diabetes prevalence since 1980: systematic analysis of health examination surveys and epidemiological studies with 370 country-years and 2·7 million participants. Lancet 2011; 378 (9785): 31-40. [ Links ]
2. Zimmet P. Diabetes epidemiology as a trigger to diabetes research. Diabetologia 1999; 42: 499-518. [ Links ]
3. Tuomilehto J, Lindstrom J, Ericsson JG, Valle TT, Hamalainen H, Ilanne-Parikka P, et al. Prevention of type 2 diabetes mellitus by changes in lifestyle among subjets with imparied glucosa tolerance. N Engl J Med 2001; 344: 1344-50. [ Links ]
4. Diabetes Prevention Program Research Group. Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. N Engl J Med 2002; 346: 393-403. [ Links ]
5. Chiasson JL, Josse RG, Gomis R, Hanefeld M, Karasik A, Laakso M, for the STOP-NIDDM Trial Research Group. Acarbose for prevention of type 2 diabetes mellitus: The STOP-NIDDM randomised trial. Lancet 2002; 359: 2072-7. [ Links ]
6. Torgerson JS, Hauptman J, Boldrin MN, Sjostrom L. Xenical in the prevention of diabetes in obese sujects (XENDOS) study: a randomized study of orlistat as an adjunct to lifestyle changes for the prevention of type 2 diabetes in obese patients. Diabetes Care 2004; 27: 155-61. [ Links ]
7. Grundy SM, Hansen B., Smith SC, Cleeman JI, Kahn RA. Clinical management of metabolic syndrome: report of the American Heart Association/National Heart, Lung, and Blood Institute/American Diabetes Association conference on scientific issues related to management. Circulation 2004; 109: 551-6. [ Links ]
8. Isomaa B, Almgren P, Tuomi T, Forsén B, Lahti K, Nissén M, et al. Cardiovascular morbidity and mortality asociated with the Metabolic syndrome. Diabetes Care 2001; 24: 683-9. [ Links ]
9. Malik S, Wong ND, Franklin SS, Kamath TV, L'Italien GJ, Pio JR, et al. Impact of the metabolic syndrome on mortality from coronary heart disease, cardiovascular disease, and all causes in United States adults. Circulation 2004; 110: 1245-50. [ Links ]
10. García-Garcia E, De la LLata-Romero M, Kaufer-Horwitz M, Tusié-Luna MT, Calzada-León R, Vásquez-Velázquez V, et al. La obesidad y el síndrome metabólico como problema de salud pública. Una reflexión. Salud Pública de México 2008; 50: 530-47. [ Links ]
11. Third Report of the National Cholesterol Education Program Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). Final Report. Circulation 2002; 106: 3143-421. [ Links ]
12. Scot t CL. Diagnosis, prevention and intervention for the metabolic syndrome. Am J Cardiol 2003; 92 (Suppl): 35i-42i. [ Links ]
13. Alberti KG, Eckel RH, Grundy SM, Zimmet PZ, Cleeman JI, Karen A, et al. Harmonizing the metabolic syndrome. A joint interim statement of the International Diabetes Federation Task Force on Epidemiology and Prevention; National Heart, Lung and Blood Institute; American Heart Association; Word Heart Federation; International Atherosclerosis Society; and International Association for the Study of Obesity. Circulation 2009; 120: 1640-5. [ Links ]
14. Reaven GM. Role of insulin resistance in human disease. Diabetes 1988; 37: 1595-607. [ Links ]
15. Fontbonne AM, Eschwege EM. Insulin and cardiovascular disease. Paris Prospective Study. Diabetes Care 1991; 14: 461-9. [ Links ]
16. Despres JP, Lamarche D, Mauriege P, Cantin B, Dagenais GR, Moorjani S, et al. Hyperinsulinemia as an independent risk factor for ischemic heart disease. N Engl J Med 1996; 334: 952-7. [ Links ]
17. Wallace TM, Mattews DR. The assessment of insulin resistance in man. Diabet Med 2002; 19: 527-34. [ Links ]
18. Harano Y, Ohgaku S, Hidaka H, Haneda K, Kikkawa R, Shigeta Y. Glucose, insulin and somatostatin infusion for the determination of insulin sensitivity. J Clin Endocrinol Metab 1977; 45: 1124-7. [ Links ]
19. Bergman R, Ider Y, Bowden C, Cobelli C. Quantitative estimation of insulin sensitivity. Am J Physiol 1979; 236: E667-77. [ Links ]
20. Hirst S, Phillips D, Vines S, Clark P, Hales C. Reproducibility of the short insulin tolerance test. Diabet Med 1993; 10: 839-42. [ Links ]
21. Stumvoll M, Mitrakou A, Pimenta W, Jenssen T, Yki-Jarvinen H, Van Haeften T, et al. Use of the oral glucose tolerance test to assess insulin release and insulin sensitivity. Diabetes 2000; 23(3): 395-01. [ Links ]
20. Matthews DR, Hosker JP, Rudenski AS, Naylor BA, Treacher DF, Turner RC. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia 1985; 28: 412-9. [ Links ]
21. Katz A, Nambi SS, Mather K, Baron AD, Follmann DA, Sullivan G, et al. Quantitative insulin sensitivity check: a simple, accurate method for assessing insulin sensitivity in humans. J Clin Endocrinol Metab 2000; 85: 2402-10. [ Links ]
22. Hanson RL, Pratley RE, Bogardus C., Narayan KM, Roumain JM, Imperatore G, et al. Evaluation of simple indices of insulin sensitivity anad insulin secretion for use in epidemiologic studies. Am J Epidemiol 2000; 151: 190-8. [ Links ]
23. Laakso M. How good a marker is insulin level for insulin resistance? Am J Epidemiol 1993; 137: 959-65. [ Links ]
24. Expert Committee on the Diagnosis and Classification of Diabetes Mellitus: Report of the Expert Committee on the Diagnosis and Classification of Diabetes Mellitus. Diabetes Care 1997; 20: 1183-97. [ Links ]
25. Genuth S, Alberti KG, Bennett P, Buse J, Defronzo R, Kahn R, et al. Expert Committee on the Diagnosis and Classification of Diabetes Mellitus: Follow-up report on the diagnosis of diabetes mellitus. Diabetes Care 2003; 26: 3160-7. [ Links ]
26. Agdul-Ghani MA, Tripathy D, DeFronzo RA. Contributions of beta-cell dysfunction and insulin resistance to the pathogenesis of impaired glucose tolerance and impaired fasting glucose. Diabetes Care 2006; 29: 1130-9. [ Links ]
27 . Report of the Expert Committee on the Diagnosis and Classification of Diabetes Mellitus. Diabetes Care 2002; 25 (Suppl 1): S5-20. [ Links ]
28. The Seventh Report of the Joint National Committee on Prevention, Detection, Evaluation and Treatment of High Blood Pressure. JAMA 2003; 289: 2560-72. [ Links ]
29. Grundy SM, Cleeman JI, Daniels SR, Donato KA, Eckel RH, Franklin BA, et al. AHA/NHLBI Scientific Statement: Diagnosis and management of the metabolic syndrome: An American Heart Association/National Heart, Lung and Blood Institute Scientific Statement. Circulation 2005; 112: 2735-52. [ Links ]
30. De Sereday M, Arias P, Bragagnolo JC, Burlando G, Cédola N, Commendatore V. Consenso sobre criterio diagnóstico de la glucosa alterada en ayunas. Rev Soc Argent Diabetes 2007; 41: 95-106. [ Links ]
31. Jarve A, Hayward RA. Prevalence, diagnosis, and treatment of impaired fasting glucose and impaired glucose tolerance in nondiabetic US adults. Diabetes Care 2010; 33: 2355-9. [ Links ]
32 . Giralt Muiña P, Gutiérrez Ávila G, Ballester Herrera MJ, Botella Romero F, Angulo Donado JJ; Grupo de Epidemiología de Diabetes de Castilla-La Mancha (GEDCAM). Prevalence of known diabetes mellitus and unknown diabetes in adults from Castilla-La Mancha, Spain. Med Clin (Barc) 2011; 137: 484-90. [ Links ]
33. Guerrero-Romero F, Rodríguez-Morán M, Pérez-Fuentes R, Sánchez-Guillén MC, González-Ortiz M, Martínez-Abundis E, et al. Prediabetes and its relationship with obesity in Mexican adults: The Mexican Diabetes Prevention (MexDiab) Study. Metab Syndr Relat Disord 2008; 6: 15-23. [ Links ]
34. Mokdad AH, Bowman BA, Ford ES, Vinicor F, Marcks JS, Koplan JP. The continuing epidemics of obesity and diabetes in the United States. JAMA 2001; 286: 1195-200. [ Links ]
35. Ferrante D, Linetzky B, Konfino J, King A, Virgolini M, Laspiur S. Encuesta nacional de factores de riesgo 2009: Evolución de la epidemia de enfermedades crónicas no transmisibles en Argentina. Estudio de corte transveral. Rev Argent Salud Pública 2011; 2: 34-41. [ Links ]
36. Coniglio RI, Nellem J, Gentili R, Sibechi N, Agusti E, Torres M, por los autores del estudio IFRALAC 0001. Síndrome metabólico en empleados de Argentina. Medicina (Buenos Aires) 2009; 69: 246-52. [ Links ]
37. Ford ES, Giles WH, Dietz WH. Prevalence of the metabolic syndrome among US adults. Findings from Third National Health and Nutrition Examination Survey. JAMA 2002; 287: 356-9. [ Links ]
38. Després JP, Lemieux I, Bergeron J, Pibarot P, Mathieu P, Larose E, et al. Abdominal obesity and the metabolic syndrome: contribution to global cardiometabolic risk. Arterioscler Thromb Vasc Biol 2008; 28: 1039-49. [ Links ]
39. Ferrannini E., Balkau B. Insulin: in search of a syndrome. Diabet Med 2002; 19(9): 724-9. [ Links ]
40. Reaven G. Metabolic syndrome. Pathophysiology and implications for management of cardiovascular disease. Circulation 2002; 106: 286-8. [ Links ]
41. Liberatos P LBKJ. The measurement of social class in epidemiology. Epidemiological Rev 1988; 10: 87-121. [ Links ]
42. Winkleby MA, Jatulis DE, Frank E, Fortmann SP. Socioeconomic status and health: How education, income, and occupation contribute to risk factors for cardiovascular disease. Am J Public Health 1992; 82: 816-20. [ Links ]
43. Silventoinen K, Pankow J, Jousilahti P, Hu G, Tuomilehto J. Educational inequalities in the metabolic syndrome and coronary heart disease among middle-aged men and women. Int J Epidem 2005; 34: 327-34. [ Links ]
44. Martins IS, Mazzilli RN, Alonso Nieto R. Atherogenic food habits of population groups in a metropolitan area of south-eastern Brazil. Rev Saude Publica 1994; 28: 349-56. [ Links ]
Aceptado para su publicación el 20 de julio de 2012














