Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957
Acta bioquím. clín. latinoam. vol.47 no.1 La Plata ene./mar. 2013
BIOQUÍMICA CLÍNICA
Gammapatía monoclonal de significado incierto: factores de pronóstico, evolución y riesgo
Monoclonal gammopathy of undetermined significance: prognostic factor and risk of progression
Gamopatia monoclonal de significado indeterminado: fatores prognósticos: risco da evolução
Mariel Emilce Alejandre1, 2, Federico Sackmann3, Santiago Pavlovsky (†)3, Guillermina Remaggi3, Miguel Arturo Pavlovsky3, Marcela Pandolfo1, Leticia Madalena1, 2, Susana Fraind1, María Laura Facio1, Astrid Pavlovsky3, Pablo Bresciani1, Marco Pizzolato1, 2
1 Bioquímico.
2 Doctor de la Universidad de Buenos Aires. Departamento de Bioquímica Clínica, Laboratorio de Proteínas. INFIBIOC. Facultad de Farmacia y Bioquímica. Hospital de Clínicas "José de San Martín". Universidad de Buenos Aires.
3 Médico. Centro de Internación e Investigación Clínica "Angélica Ocampo". FUNDALEU.
CORRESPONDENCIA BIOQ. MARIEL EMILCE ALEJANDRE Departamento de Bioquímica Clínica, Facultad de Farmacia y Bioquímica Junín 956 1113 - CIUDAD DE BUENOS AIRES, Argentina.E-mail: marielalejandre@hotmail.com
Resumen
La Gammapatía Monoclonal de Significado Incierto (GMSI) tiene una prevalencia que varía entre 1 y 3%, su frecuencia tiende a aumentar con la edad y aunque presentan evolución indolente y una sobrevida prolongada, un porcentaje de ellas desarrollará una enfermedad maligna. Con el objetivo de evaluar el valor pronóstico de diversos parámetros proteicos y hematológicos al momento del diagnóstico, se estudiaron mediante estudios proteicos completos en sangre y en orina, 407 pacientes con diagnóstico de GMSI que ingresaron a la institución en el período comprendido entre 1982 y 2008. La concentración del componente monoclonal (CM) (>1,5 g/dL) y el tipo inmunológico (No IgG), la disminución de las inmunoglobulinas no comprometidas (INC), el porcentaje de infiltración de células plasmáticas en médula ósea (>5%) y la mediana de las relaciones anormales de las cadenas livianas monoclonales libres, fueron los parámetros que marcaron riesgo de progresión a una enfermedad maligna. El estudio proteico completo de orina demostró una asociación entre el aumento en la concentración de proteínas de bajo peso molecular con valores de estimado de filtración glomerular menor de 60 mL/min/1,73 m2 y presencia de proteinuria de Bence Jones, independientemente del tipo de cadena liviana y de los niveles de proteínas totales. Debido a ello, la adición de dichos marcadores de daño tubular podría ofrecer una visión más profunda, siendo su aumento un posible indicador, en la profilaxis renal, de una severa lesión tubular futura. Finalmente, en pacientes con GMSI, los controles de laboratorio deberán ser ajustados en su periodicidad pero no en su contenido. La mayor información así obtenida será lo que permitirá una decisión médica más segura al momento de recomendar la frecuencia del seguimiento del paciente y la consiguiente detección temprana de una evolución maligna de la enfermedad.
Palabras clave: Gammapatía monoclonal de significado incierto; Factores pronósticos; Riesgo de evolución.
Summary
Monoclonal gammopathy of undetermined significance (MGUS) is considered a premalignant state with a stable clinical course, and increased prevalence/risk of developing multiple myeloma (MM) or related malignancy according to age. To evaluate some hematologycal and protein parameters of prognostic value, 407 patients diagnosed as MGUS had been analyzed between 1982 to 2008 by means of complete urine and serum profile. A densitometry spike value (>1.5 g/dL), the monoclonal immunoglobulin class (No-IgG), the reduced concentration of non related immunoglobulin's, the percentage of plasma cells in bone marrow (>5%) and an abnormal serum kappa/lambda free ratio; marked the increased risk of malignant progression. In urine, the presence of low molecular weight proteins has been associated with eGFR < 60 mL/min/1.73 m2 and the confirmation of Bence Jones proteinuria, independently of light chain type and the proteinuria level, reflecting a tubular damage. With an in deep view, a urine protein profile should detect an early renal compromise. We concluded that laboratory controls in patients with MGUS should be adjusted by periodicity but not in its content. A clear medical decision for the controls frequency or for establishing a worse outcome should be based on a complete protein profile evaluation.
Key words: Monoclonal gammopathy of undetermined significance; Evolution risk; Kappa lambda ratio; Protein profile.
Resumo
A gamopatia monoclonal de significado indeterminado (GMSI) tem uma prevalência variando de 1 a 3%, a sua frequência tende a aumentar com a idade, apesar de apresentarem sobrevivência indolentes e prolongada, uma percentagem de los a desenvolver uma doença maligna. A fim de avaliar o valor prognóstico da proteína vários parâmetros hematológicos e no momento do diagnóstico, foram estudados 407 pacientes com diagnóstico de MGUS que foram internados em nossa instituição entre 1982 a 2008, com estudos de proteínas completas em sangue e urina. A concentração do componente monoclonal (CM) (>1,5 g/dL e imunológica (no IgG), diminuição da imunoglobulina não confirmada (INC), a percentagem de infiltração de células de plasma na medula óssea (>5%) e mediana de relações anormais de cadeias leves livres monoclonais, foram os parâmetros que marcaram risco de progressão para malignidade.O estudo de proteína total de urina mostraram que o aumento da concentração de proteínas de baixo peso molecular associados com valores estimados de filtração glomerular de menos de 60 mL/min/1.73 m2 e proteinúria Bence Jones, independentemente da cadeia leves e total níveis de proteína. Como resultado, a adição destes marcadores de dano tubular, pode oferecer um conhecimento mais profundo, e seu aumento um indicador possível para a profilaxia lesão tubular renal de futuro grave. Finalmente, em pacientes com GMSI, controles laboratoriais devem ser ajustados em frequência, mas não no conteúdo. A maioria da informação obtida será permitindo uma decisão médica mais segura quando recomendando a frequência da monitorização do paciente e, por conseguinte, a detecção precoce de progressão maligna da doença.
Palavras-chave: Gamopatia monoclonal de significado indeterminado; Fatores prognósticos; Risco de evolução.
Abreviaturas por orden alfabético
Ace/Aga: Acetato de celulosa /Agarosa.
a1m-ur: alfa1 microglobulina en orina.
Alb-ur: Albúmina en orina.
B-J: proteinuria de Bence-Jones.
ß2M: Beta-2 microglobulina en suero.
ß2m-ur: Beta-2 microglobulina en orina.
CLL: Cadenas Livianas Libres.
CM: Componente Monoclonal.
CP: Células Plasmáticas.
DES: Diferencias Estadísticamente Significativas.
EC: Electroforesis Capilar.
FISH: técnicas de hibridación in situ con fluorescencia.
GM: Gammapatía Monoclonal.
GMSI: Gammapatía Monoclonal de Significado Incierto.
IEF: Inmunoelectroforesis.
IF: Inmunofijación.
INC: Inmunoglobulinas No Comprometidas
MM: Mieloma Múltiple.
MO: Médula Ósea.
NP: No Progresión.
P: Progresión.
PBPM: Proteínas de Bajo Peso Molecular.
PE: Proteinograma Electroforético.
RAKL: Relación Anormal de Cadenas Livianas Kappa/Lambda en suero.
R?/?: Relación de Cadenas Livianas Libres Kappa/Lambda en suero.
RNKL: Relación Normal de Cadenas Livianas Kappa/Lambda en suero.
SDS-PAGE: electroforesis en gel de poliacrilamida con dodecil sulfato de sodio.
SG: Sobrevida Global.
SLE: Sobrevida Libre de Enfermedad.
Introducción
Dentro del grupo de gammapatías monoclonales (GM), la gammapatía monoclonal de significado incierto (GMSI) es la más común y se define por la presencia de un componente monoclonal (CM) IgG, IgA o IgM en suero, menor a 3 g/dL, ausencia o pequeñas cantidades de cadenas livianas monoclonales libres en orina (proteinuria inferior a 1 g/24 h), ausencia de lesiones osteolíticas, anemia, hipercalcemia e insuficiencia renal secundaria al CM (1)(2) y, si fuera analizada, una médula ósea (MO) con menos del 10% de infiltración por células plasmáticas (CP) (3).
La prevalencia de la GMSI varía entre 1 y 3% y su frecuencia tiende a aumentar con la edad, dato coincidente con un estudio anterior en este medio sobre 850 pacientes que reveló una incidencia de GMSI del 2,8% (4). Afecta al 3,2% de las personas de 50 años o más y al 5,3% de los mayores de 70 años (5). En general presentan una evolución indolente, no requieren tratamiento y la sobrevida es prolongada, pero varios son los trabajos que han confirmado que existe un riesgo de progresión (6)(7). Este riesgo es muy bajo cuando el CM es menor a 1,5 g/dL, la infiltración de MO por CP es menor a 5% (reflejando una baja carga tumoral), no hay reducción de las inmunoglobulinas no comprometidas (INC) y no hay proteinuria de Bence Jones (B-J). Otro estudio demostró, además. que la concentración inicial del CM en suero fue el factor de riesgo más importante para progresión neoplásica y los pacientes con CM de tipo IgM o IgA tuvieron mayor riesgo de progresar que los que tenían un CM de tipo IgG (p = 0,001) (2). Sin embargo, en contraste con los dos trabajos mencionados anteriormente, la presencia de cadenas livianas libres en orina y la reducción de una o más INC no se asociaron a un mayor riesgo de progresión.
Un reporte preliminar sobre 285 pacientes con diagnóstico de GMSI determinó que la concentración del CM, el nivel de las INC y la velocidad de sedimentación globular, separaban dos grupos con distinto riesgo de progresión (8).
Más recientemente, el análisis de la relación de las cadenas livianas libres (CLL) en el suero de los pacientes con GMSI al diagnóstico y con un seguimiento de 15 años, evidenció que entre el 33 - 44% de los mismos tenían una relación alterada al momento del diagnóstico, demostrándose que estos individuos presentan un mayor riesgo de progresión (9) y que éste resultó independiente de la concentración y tipo de CM (10).
Se conoce que el riesgo de progresión de los pacientes con GMSI a Mieloma Múltiple (MM), Macroglobulinemia de Waldenström, Amiloidosis (AL) u otro desorden linfoproliferativo es aproximadamente del 1% por año (3)(5). Las GMSI de bajo riesgo se caracterizan por tener un CM con concentraciones menores de 1,5 g/dL, ser de tipo IgG y tener relación normal de CLL en suero. Estos pacientes se controlan con proteinograma electroforético (PE) cada 6 meses y, si permanecen estables, pueden controlarse cada 2-3 años si no aparecen síntomas sugestivos de malignización. Pacientes con riesgo intermedio o alto deben tener un seguimiento cada 6 meses y luego cada año de por vida (11).
Generalmente, los estudios citogenéticos convencionales (utilizando el bandeo G) son normales en el grupo de pacientes con GMSI, debido al pequeño número de CP y a la baja tasa de proliferación. Sin embargo, utilizando pruebas más sensibles como la técnica de hibridación in situ con fluorescencia (FISH) para determinar la presencia y frecuencia de las translocaciones que afectan el gen IgH y de la IgL ?, (incluyendo t (4; 14) (p16; q32) y t (14; 16) (q32; q23)), se han encontrado alteraciones citogenéticas en casi todos los pacientes (12), aunque su asociación con progresión no ha sido aún identificada.
Otros factores que están siendo estudiados son la angiogénesis medular (13), mutaciones a nivel del oncogén N-Ras y K-Ras (14) y el porcentaje de CP circulantes (15). Sin embargo, su valor pronóstico y utilidad clínica no han sido aún claramente establecidos. En cuanto a la cuantificación de CLL se sabe que su valor predictivo se extiende a la mayoría de las GM, y aunque todavía no esté clara la relación entre CLL y patogenicidad, hay indicios de que los niveles elevados de CLL pueden estar relacionados con translocaciones IgH (16) y con una carga tumoral elevada (17)(18).
Muchos años de observación sobre esta entidad generaron la hipótesis de que podría haber 2 tipos de GMSI: una con un patrón evolutivo y otra, con patrón estable, independientemente de los factores pronósticos iniciales (19). De esta manera, la GMSI evolutiva podría ser vista como los estadios iniciales de un MM u otra enfermedad linfoproliferativa y la otra, una verdadera GM benigna, estable, que para su transformación neoplásica necesitaría de un segundo evento desencadenante. Para poder determinar esto, sería interesante el estudio de la expresión génica de estos dos subtipos de gammapatía y ver si existe alguna diferencia entre ambos grupos.
La presencia de cadenas livianas monoclonales libres de inmunoglobulina en orina se ha considerado un factor de riesgo significativo para la progresión de los pacientes con GMSI a la enfermedad sintomática (6)(7). Por otro lado y en pacientes con diagnóstico de MM, la importancia de la presencia de insuficiencia renal y su valor pronóstico ha sido extensamente estudiado y se ha mencionado que la cuantificación urinaria de proteínas de bajo peso molecular (PBPM), como por ejemplo alfa-1 microglobulina (a1m-ur) y albúmina (Alb-ur), serían indicadores precoces que permitirían definir y evaluar la existencia de un compromiso renal (20). En adición a esto, las mayores alteraciones renales se han descripto en pacientes de mayor edad, con discrasia de células plasmáticas asociadas a cadenas livianas y con una función renal severamente comprometida; en ellos, las cadenas livianas monoclonales libres pudieron ser detectadas sólo con el uso de técnicas específicas, puesto que las tiras reactivas no permitieron evidenciar ni las cadenas livianas ni otros marcadores de lesión tubular (21).
En GMSI un escaso número de trabajos mencionan la presencia de compromiso renal como una disfunción tubular, tanto proximal como distal, e incluso la misma podría ser atribuida a una nefritis túbulointersticial o enfermedades no relacionadas a la gammapatía. Podría tratarse de una nefritis túbulointersticial no específica con inclusiones cristalinas en el citoplasma de las células epiteliales tubulares distintas a los cilindros del mieloma o a los depósitos amiloides (22)(23). Sin embargo, otros autores han podido confirmar el diagnóstico de Enfermedad por Depósito de Cadenas Livianas luego de 15 años de evolución de una GMSI (IgAk), y el desarrollo de insuficiencia renal aguda, con la observación en una biopsia renal de depósitos de cilindros en el túbulo como evidencia del compromiso sistémico secundario y recuento normal de células en MO (24)(25). Recientemente, en un estudio basado en los resultados obtenidos mediante biopsia de MO, se ha reportado que la GMSI fue la entidad que más se asoció con la presencia de glomerulonefritis membrano-proliferativa (26).
El objetivo de este trabajo fue determinar, en el grupo de pacientes con GMSI, el valor pronóstico de parámetros bioquímicos y hematológicos, tanto en suero como en orina, al momento del diagnóstico, incluyendo la determinación de CLL en suero y el fraccionamiento proteico en orina mediante electroforesis en gel de poliacrilamida con dodecil sulfato de sodio (SDS-PAGE), la cuantificación de PBPM (marcadoras de daño tubular) y de Alb-ur, como marcadores de compromiso renal. Esto último, con el objetivo de establecer los niveles urinarios en estos pacientes y conocer su asociación con la presencia de daño renal, la presencia de B-J y el tipo de cadena liviana monoclonal.
Como objetivo secundario se evaluó si la incorporación de la electroforesis capilar (EC) para la realización de los PE modifica la concentración del CM, comparado con la electroforesis convencional en acetato de celulosa / agarosa (Ace/Aga) y si ello reclasifica a los pacientes con GMSI según este factor de riesgo de progresión.
Materiales y Métodos
Se incluyó un total de 407 pacientes con diagnóstico de GMSI de acuerdo con la definición de Kyle (1)(2) que ingresaron en la institución durante el período comprendido entre 1982 y 2008. Fueron excluidos del estudio los pacientes con diagnóstico de MM Indolente, definido como aquel que presenta un CM con concentración mayor a 3 g/dL y/o una infiltración de CP en MO por más de 10%, sin daño de órgano blanco (anemia, insuficiencia renal o lesiones líticas causadas por la enfermedad) o portador de alguna enfermedad linfoproliferativa (linfoma no Hodgkin de bajo o alto grado, leucemia linfática crónica).
La progresión a MM se consideró cuando el CM fuera mayor a 3 g/dL o el porcentaje de plasmocitos en MO mayor a 10% y/o aparición de lesiones osteolíticas secundarias a la enfermedad. La progresión a otra neoplasia de células B se consideró cuando hubo evidencia histológica de enfermedad.
Se identificaron las variables clínicas (edad, sexo, enfermedades concomitantes) y parámetros de laboratorio (hemograma, función renal, calcemia, hepatograma, láctico deshidrogenasa, beta 2 microglobulina, albúmina, proteinograma en sangre y orina y biopsia de MO, cuando fue realizada) de todos los pacientes. El 61% de los mismos (248) fueron mujeres y el 39% restante (159), hombres. La mediana de seguimiento de los pacientes a diciembre de 2010 fue de 6,1 años (95% de intervalo de confianza, rango 1,6 - 31,5). La mediana de edad al momento del diagnóstico fue de 62 años (95% de intervalo de confianza, rango 24 - 88). El 3,4% (14 pacientes) fueron menores de 40 años y 126 pacientes (30,9%) tenían 70 años o más.
Para la detección y cuantificación del CM se realizó el PE mediante el equipo automatizado Hydrasys (Sebia-Francia) con posterior registro densitográfico. La identidad inmunológica del CM se realizó por Inmunofijación (IF) en soporte de acetato de celulosa o agarosa con antisueros anti-gamma (g), anti-alfa (a), anti-mu (m), anti-delta (d), anti-épsilon (e), anti-kappa (k) y anti-lambda (l), utilizando como colorante violeta ácido (27), o inmunoelectroforesis (IEF) en forma manual en gel de acetato de celulosa, con los mismos antisueros monoespecíficos pero utilizando Negro Amido para su coloración. La cuantificación de inmunoglobulinas IgM, IgA e IgG y de ß2-microglobulina (ß2M) se realizó por ensayo de inmunoturbidimetría (Tina Quant, Roche, EE.UU.) usando el equipo Hitachi 917-Roche. La reducción de INC fue considerada cuando al menos una de las tres inmunoglobulinas mayoritarias del suero (IgM, IgA e IgG) se encontraba disminuida en su concentración.
En una segunda instancia fueron seleccionados 71 pacientes del total de 407, en función de su largo seguimiento (mediana de 15 años; 95% intervalo de confianza, rango 3 - 30) y del riesgo de progresión a una enfermedad maligna. En ellos se realizó la comparación metodológica del PE realizado mediante EC (Minicap Protein (E) 6-Sebia-Francia) vs electroforesis convencional (PE en soporte de acetato de celulosa con técnica manual y en soporte de gel de agarosa mediante el equipo automatizado Hydrasys (Sebia-Francia)) y la relación de las CLL en suero (Freelite; The Binding Site, Birmingham, Reino Unido) por técnica de inmunoturbidimetría, equipo Hitachi 917-Roche (28)(10). Este ensayo consiste en dos mediciones por separado, una para medir la concentración de cadenas livianas libres kappa (rango normal: 3,3-19,4 mg/L) y la otra medición para las cadenas libres lambda (rango normal: 5,7-26,3 mg/L) (29). Luego de ambas mediciones el valor que demuestra presencia/ausencia de clonalidad es el valor de la relación kappa-lambda cuyo rango hematológico normal fue estimado en 0,26-1,65.
Además, y con el fin de cuantificar los valores urinarios de PBPM y Alb-ur como marcadores de compromiso renal se estudiaron 93 muestras de orina de 24 h de recolección al momento de la solicitud por primera vez del estudio de IF. Posteriormente a su separación por centrifugación, se congelaron a -70 ºC hasta su análisis; y se utilizó azida sódica como conservante (concentración final: 0,1 g/L) (30). Los límites superiores de referencia considerados para los distintos analitos fueron: 30 mg/L para Alb-ur, 12 mg/L para a1m-ur y de 0.30 mg/L para la ß2-microglobulina en orina (ß2m-ur) (Tina Quant- Roche. Hitachi 917- EEUU) (31). Los perfiles proteicos urinarios se obtuvieron mediante electroforesis convencional y en SDS-PAGE, ambas con tinción argéntica (32)(33).
ANÁLISIS ESTADÍSTICO
El análisis estadístico fue realizado con el programa GraphPad in Stat (GraphPad Software-CA EEUU), usando comparación de medianas (Unpaired t-test), análisis de tablas de contingencia (Fisher's exact test) y el análisis de regresión con el programa (Linear-Pearson-Correlation). Se consideró estadísticamente significativo un valor de p<0,05.
El estudio fue aprobado por el Comité de Ética de la Facultad de Farmacia y Bioquímica de la Universidad de Buenos Aires (Expte 709307/07, Nota Nº 1972), de acuerdo a la declaración de Helsinki, World Medical Association's (WMA), (1964-Helsinski, 1975-Tokyo, 1983-Venice, 1989-Hong Kong, 1996 - Somerset West, 2000-Scotland, 2002-Geneva.)
Resultados
El control de laboratorio al momento del diagnóstico arrojó los siguientes resultados: la mediana de hemoglobina fue de 13,1 g/dL (95% de intervalo de confianza, rango 7 - 16,8) y 75 pacientes (18,4%) presentaron anemia, definida como hemoglobina menor a 12 g/dL. La albúmina fue normal en el 88,2% de los casos (VR: 3,5 - 4,5 g/dL) y disminuida en 48 pacientes (11,8%), con una mediana de 3,95 g/dL (95% de intervalo de confianza, rango 2,41 - 4,7). Los valores de ß2M fueron obtenidos al momento del primer control de laboratorio en el 56,5% de los casos (230 pacientes) con una mediana de 2,5 mg/L (95% de intervalo de confianza, rango 0,36 - 11,4), encontrándose aumentada en 115 pacientes (50%).
La mediana del pico densitométrico del CM en el PE fue de 0.55 g/dL (95% de intervalo de confianza, rango 0,1 - 2,91) mientras que 184 pacientes (45%) presentaron un valor de CM menor o igual a 0,5 g/dL, solo 13 pacientes (3,2%) tuvieron una concentración mayor o igual que 2. La concentración de INC estaba disminuida solo en 81 de los 407 pacientes (20%) y en 9 pacientes no fueron evaluadas (2,2%).
El tipo inmunológico del CM determinado por IF y/o IEF resultó ser en el 67,3% de los casos de tipo IgG (274 pacientes), el 14,7% de tipo IgA (60 pacientes), 12,3% fueron de tipo IgM (50 pacientes), el 1% biclonal (4 pacientes) mientras que 19 pacientes (4,7%) no pudieron ser evaluados. La cadena liviana se determinó en 296 pacientes siendo de tipo kappa en el 65% y el 35% restante, de tipo lambda.
El estudio proteico de orina se realizó en 300 pacientes (73,7%) obteniéndose valores de proteinuria dentro del rango fisiológico (menor de 0,2 g/ 24 h) en el 88% de los casos, mientras que en la electroforesis de las proteínas urinarias se observó una proteinuria de "tipo mielomatoso" con B-J positiva en el 12% restante (36 pacientes).
Se realizó biopsia de MO sólo a 80 pacientes (19,6%) y la mediana de porcentaje de plasmocitos encontrada fue 3% (95% de intervalo de confianza, rango 0 - 10). La sobrevida libre de enfermedad (SLE) a 5 años de los pacientes según el porcentaje de infiltración de CP en MO fuera menor o mayor al 5% fue de 96% y 50% respectivamente (p<0,001) (Figura 1).
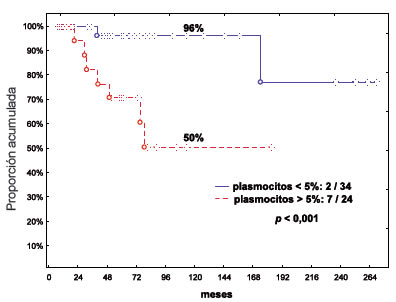
Figura 1. Sobrevida Libre de Enfermedad de pacientes con Gammapatía Monoclonal de Significado Incierto
según el porcentaje de plasmocitos en médula ósea (menor o mayor a 5%).
Al agrupar a los 407 pacientes según la ocurrencia o no de progresión, se comprobó que el 9,1% (37 pacientes) evolucionaron a una enfermedad maligna: 21 a MM (55,5%), 7 a MM indolente (19,4%), 3 a macroglobulinemia de Waldenström (8.3%), 5 a un linfoma no Hodgkin (13,9%) y 1 a amiloidosis (2,8%). La mediana de la SLE desde la detección de la GMSI hasta el diagnóstico de la enfermedad maligna para este grupo, fue de 4,8 años (95% de intervalo de confianza, rango 1 - 22,5) mientras que la mediana de la sobrevida global (SG) a diciembre de 2010 fue de 8,5 años (95% de intervalo de confianza, rango 1,8 - 27,5).
La Tabla I muestra los resultados de los distintos parámetros bioquímicos del grupo que no progresó (NP) (370 pacientes) y de los 37 pacientes que progresaron (P). El análisis por tabla de contingencia únicamente arrojó diferencias estadísticamente significativa (DES) entre ambos grupos (P y NP), para el tipo de CM (IgG vs no IgG) con un valor de p=0,03, la concentración del CM (>1,5 g/dL vs <1,5 g/dL) con p=0,003 y el nivel de las INC (disminuidas o no) con p=0,001.
Tabla I. Parámetros en pacientes con GMSI con y sin progresión
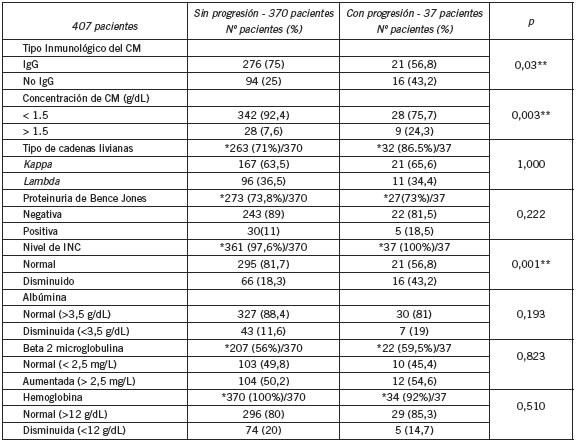
*Número y Porcentaje de casos estudiados / Total de pacientes **p<0,05, considerado estadísticamente significativo
Posteriormente los pacientes fueron agrupados según el tipo de cadena liviana (kappa o lambda) de su CM y se compararon nuevamente los valores de los parámetros bioquímicos estudiados. Los valores de las medianas de hemoglobina, ß2M, albúmina y concentración de CM al momento del diagnóstico no arrojaron DES. El análisis de tabla de contingencia para ambos grupos (kappa vs lambda) tampoco demostró una DES en la disminución o no de las INC (p= 0,0793), la presencia o no de B-J (p=0,1719) ni la cantidad de pacientes que sufrieron o no progresión a una enfermedad maligna (p= 0,8433) (Tabla II).
Tabla II. Parámetros en Pacientes con GMSI y cadena liviana del CM de tipo Kappa vs Lambda.
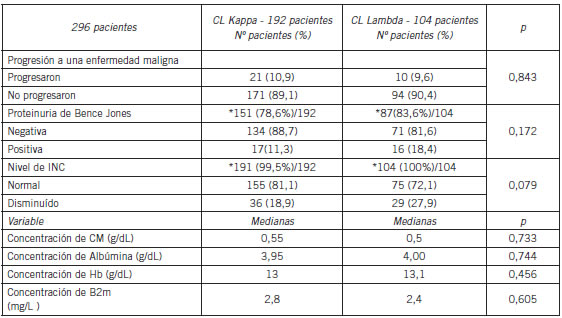
*Número y Porcentaje de casos estudiados / Total de pacientes
RESULTADOS DE LA CUANTIFICACIÓN DE CADENAS LIVIANAS LIBRES EN SUERO DE PACIENTES CON GMSI
Se seleccionaron las muestras, conservadas al momento del diagnóstico a -70 °C, de 71 pacientes elegidos por su largo seguimiento, 61 de ellos NP con una mediana de SG a diciembre de 2010 de 16 años (95% intervalo de confianza, rango 5 a 30) y los 10 restantes que P a una enfermedad maligna (8 a MM y 2 a linfoma no Hodgkin) lo hicieron con una mediana de SLE de 3,8 años (95% intervalo de confianza, rango 1,8 - 16). La mediana de SG y de sobrevida desde el diagnóstico de la enfermedad maligna para el grupo P, fue de 10 años (95% intervalo de confianza, rango 3 - 25) y de 4 años (95% intervalo de confianza, rango 2 - 16) respectivamente, ambas calculadas a diciembre de 2010.
El análisis por tabla de contingencia para el grupo P y NP de los distintos parámetros bioquímicos, no encontró DES entre ambos grupos para los valores al momento del diagnóstico de hemoglobina (>12 g/dL vs 12 g/dL) (p=1,000), ß2M (>2,5 mg/L vs <2,5 mg/L) (p=1,000), albúmina (>3,5 g/dL vs <3,5 g/dL) (p=0,179), concentración de CM (>1,5 g/dL vs <1,5 g/dL) (p=0,071), disminución o no de las INC (p= 0,162), presencia o no de B-J (p=0,437), CM de tipo IgG o no IgG (p=0,685) y CM con cadenas livianas kappa vs lambda (p=0,261).
La relación de cadenas livianas libres kappa/lambda (R?/?) resultó ser anormal (<0,26 o >1,65) en el 73,2% de los pacientes (52 pacientes) y normal para el 26,8% restante (19 pacientes), mientras que separando los resultados para los grupos de pacientes que NP y P, en el grupo que P (10 pacientes) el 90% tenía relación anormal kappa/lambda (RAKL) al momento del diagnóstico; mientras que en el grupo que NP (61 pacientes) el porcentaje disminuía al 68,9%. No se encontró DES (p=0,674) al comparar la relación normal kappa/lambda (RNKL) vs relación RAKL y pacientes NP vs P. La comparación de los resultados de los dos factores de riesgo de progresión estándar (CM >1,5 g/dL vs <1,5 g/dL e IgG o no IgG) con la R?/? (RNKL y RAKL) para ambos grupos de pacientes (NP y P) incluidos en este estudio, no mostró DES.
Al analizar los pacientes que NP y tenían RAKL, la mediana de la relación superior a 1,65 fue de 4,9 (95% de intervalo de confianza, rango 1,7 - 32) mientras que la mediana de dicha relación para el grupo que P fue de 11,57 (95% de intervalo de confianza, rango 2,12 - 814) observándose una diferencia extremadamente significativa entre ambas, con un valor de p=0,0023. Por otro lado la mediana de la RAKL inferior a 0,25 para el grupo NP fue de 0,13 (rango 0,02 - 0,23) y solo un paciente del grupo P tenía cadenas livianas de tipo lambda monoclonal con RAKL de 0,12 al momento del diagnóstico.
RESULTADOS DE LA COMPARACIÓN DE LA METODOLOGÍA PARA REALIZAR EL PE
Con el fin de establecer si al realizar los PE por EC se modificaban los valores del CM sérico y con ello la clasificación según el riesgo de progresión de los pacientes con GMSI respecto a dicho parámetro, se comparó en los 71 pacientes seleccionados, esta metodología con los otros métodos tradicionales.
En cuanto a la comparación del valor del pico "M" (>1,5 g/dL<) en el PE por EC vs electroforesis en Ace/Aga, éste no presentó DES en el procesamiento del total de los GMSI seleccionados (p=1,000), tampoco las hubo individualmente para los que NP (p=1,000) ni para los que P (p=1,000). Sólo dos pacientes reclasificaron con EC pasando a tener dos y no un factor de riesgo de progresión, debido a que la cuantificación del CM fue superior a 1,5 g/dL para esta técnica y su CM era de tipo no IgG.
Se encontraron diferencias en la posición del CM en la EC en 13 pacientes: 5 por estar el CM en la banda de ß2-globulinas en la electroforesis convencional y en zona gamma rápida en la EC, otros 5 pacientes que presentaron un CM en la electroforesis convencional y dos en EC; en los últimos 3 casos se vio la relación inversa, dos CM en la electroforesis convencional y uno en EC. Asimismo, no se encontraron DES en el análisis de la tabla de contingencia para el grupo que NP (p=0,055) ni para el que P (p=0,166) al comparar la concentración del CM por EC menor o mayor de 1,5 g/dL con su tipo inmunológico (IgG /no IgG).
RESULTADOS DEL ESTUDIO DEL PERFIL URINARIO INCLUYENDO SDS-PAGE Y PBPM
Se estudiaron 93 muestras de orina de 24 h de recolección de 88 pacientes con las determinaciones de PBPM y SDS-PAGE, de las cuales el 5,4% correspondieron a pacientes cuya futura progresión a MM fue demostrada.
La mediana de edad de este subgrupo de pacientes fue de 67 años, la mediana de hemoglobina de 12,5 g/dL y de creatinina de 1,03 mg/dL; mientras que los parámetros proteicos de proteínas totales séricas, mediana de albúmina, INC y CM fueron de 7,23 g/dL, 3,8 g/dL, 0,73 g/dL y 1,08 g/dL, respectivamente. La mediana de la concentración de proteínas totales urinarias en gramos por 24 h, resultó igual a 0,23.
La distribución de la clase de cadena pesada y tipo de cadena liviana fue la siguiente: de tipo IgG (n: 59, 47% k - 16% ?), IgA (n: 19, 12% k - 9% ?), IgM (n: 10, 9% k - 1% ?) y pacientes con doble CM de tipo IgG - kappa representaron el 3% (Figura 2).

CM: Componente Monoclonal - GMSI: Gammapatía Monoclonal de Significado Incierto - PBPM: Proteínas de Bajo Peso Molecular - SDS-PAGE: Electroforesis en Gel de Poliacrilamida con Dodecil Sulfato de Sodio
Figura 2. Distribución de la clase de cadena pesada del CM de los pacientes con GMSI en cuyas orinas se estudiaron PBPM y SDS-PAGE
En cuanto a la distribución de los pacientes según la cadena liviana de su CM, 65 de ellos tenían cadenas livianas de tipo kappa (73,8%) y 23 pacientes con cadenas de tipo lambda (26,2%).
La prueba exacta de Fisher determinó una asociación entre la presencia de B-J y la clase de cadena pesada del CM (IgG vs no IgG) pero no hubo DES con un valor de p=0,2488.
Entre ambos grupos, kappa vs. lambda no se encontró DES para los datos de creatinina sérica (kappa: 0,90 mg/dL, 95% de intervalo de confianza, rango 0,59 - 2,89 y del grupo lambda con mediana de 0,92 mg/dL, 95% de intervalo de confianza, rango 0,52 - 2,01, con p=0,6731) ni para los datos de proteinuria en orina de 24 h (Kappa con mediana de 0,46 g/24 h, 95% de intervalo de confianza, rango 0,05 -19,8 y el grupo lambda con mediana de 0,51 g/24h, 95% de intervalo de confianza, rango 0,05 - 3,5, con p=0,9226).
La comparación de la excreción urinaria de las PBPM entre ambos grupos no mostró DES en los datos de Alb-ur y ß2m-ur, siendo las medianas de las concentraciones urinarias de Alb-ur igual a 28,7 mg/L vs 50,1 mg/L y la de ß2m-ur de 0,12 mg/L vs 0,20 mg/L, para el grupo kappa y lambda respectivamente. Mientras que la cuantificación de a1m-ur arrojo DES entre los pacientes pertenecientes a ambos grupos: con cadena liviana kappa una mediana de 2,6 mg/L, 95% de intervalo de confianza, rango 0,00 - 41,25 y para grupo lambda una mediana de 7,7 mg/L, 95% de intervalo de confianza, rango 0,00 - 65,62, con p=0,0482.
El 81,5% de orinas del grupo de pacientes con cadenas livianas kappa presentó un patrón de excreción fisiológico, un 15,4% fueron de tipo "mielomatoso" y el 3,1% (2 pacientes) fueron orinas con compromiso glomerular de alta selectividad y B-J negativa por IF. De estos dos últimos pacientes, uno tenía un CM IgAk presentando valores elevados de a1m-ur (41,25 mg/L) y falla renal (eGFR 21 mL/min/1,73 m2) mientras que el otro pacientes tenía un CM IgGk sin observarse evidencias de falla renal (eGFR 130 mL/min/1,73 m2). En la Figura 3 se puede ver el estudio de SDS-PAGE en pacientes con proteinuria glomerular (bandas con 88 y 69 kDa de peso molecular) en presencia de B-J (calle 10) y pacientes con proteinuria glomerular sin B-J (IF negativa) (calle 4). El resto de los perfiles presentan bandas en 69 y débil en 45 kDa correspondiente a perfiles fisiológicos (calles 2, 3, 6, 7, 8 y 9).

1. Control de Peso Molecular - 2-3-6-7-8 y 9. Orina que presenta una proteinuria fisiológica - 4. Orina con una Proteinuria de tipo Glomerular de Alta Selectividad con B-J (-) (Pt(o)=2,05 g/24 h.
5. Orina con una proteinuria de tipo "Mielomatoso" con B-J (+).
10. Orina con una Proteinuria de tipo Glomerular de Alta Selectividad, con B-J (+) (Pt(o)=1,23 g/24 h.
Figura 3. Estudio de SDS-PAGE en orina de pacientes con GMSI
Por otro lado, el grupo de orinas con cadenas livianas lambda en su CM mostró un 65% de orinas de tipo fisiológico, 26,3% de tipo "mielomatoso" puro y el 8,7% restante (2 pacientes) presentó una proteinuria mixta de tipo "mielomatoso" con compromiso glomerular de alta selectividad. Estos dos últimos fueron pacientes con un CM IgG-? (concentración de CM por pico densitométrico de 1,2 g/dL) y un eGFR<60 mL/min/1,73 m2, mientras que el otro tenía un CM IgA- ? (concentración de CM por pico densitométrico de 1,05 g/dL) sin alteración del filtrado glomerular (eGFR=90 mL/min/1,73 m2). Ambos presentaron injuria tubular (a1m-ur igual a 65,62 mg/L y 21,56 mg/L, respectivamente) evidenciándose esta alteración en el estudio de orina SDS-PAGE con la visualización de un perfil tubular completo.
Según el tipo de cadena liviana en orina (kappa vs. lambda) los pacientes fueron separados en subgrupos de acuerdo a la presencia o no de B-J. La presencia de B-J pudo asociarse estadísticamente con un eGFR<60 mL/min/1.73m2 (p=0,0038) y valores de a1m-ur elevados (p<0,0001). Sin embargo, en los grupos de pacientes agrupados según la clase de cadena pesada del CM (IgG vs no IgG) y el factor de riesgo adicional del valor del CM (>1,5 g/dL<), no se pudo observar DES para valores elevados de a1m-ur (p=1,000), la presencia de un daño en la función glomerular (p=0,6241) o la presencia de B-J (p=1,000), al ser analizados considerando los dos factores de riesgo juntos (CM>1,5g/dL más GMSI no IgG).
En las Tablas III y IV se pueden observar los resultados de la comparación de los distintos parámetros bioquímicos en los pacientes según su perfil urinario en el uroproteinograma resulte fisiológico vs "mielomatoso" y su cadena liviana sea kappa vs lambda. Ambos tipos inmunológicos presentaron comportamientos similares, con medianas de creatinina sérica, proteínas totales en orina, a1m-ur y Alb-ur más elevadas en los pacientes con B-J positiva (p<0,05) en ambas cadenas.
Tabla III. Comparación de Parámetros Bioquímicos entre los pacientes con CM con cadena liviana de tipo Kappa y uroproteinograma fisiológico vs mielomatoso.

*p<0,05, considerado estadísticamente significativo
Tabla IV. Comparación de Parámetros Bioquímicos entre los pacientes con CM con cadena liviana de tipo Lambda y uroproteinograma fisiológico vs mielomatoso

*p<0,05, considerado estadísticamente significativo
Por otro lado, la evaluación del SDS-PAGE permitió observar que la presencia de B-J dificultó la correcta visualización de los perfiles, con bandas en pesos moleculares correspondientes a dímeros/monómeros o fragmentos de cadenas livianas (16-14 kDa). La presencia de bandas débiles en 45 kDa (4 casos) podría ser sugestiva de la aparición de B-J aún con resultados negativos de la IF. En la Figura 4 se puede ver el perfil en SDS-PAGE de proteinurias de "tipo mielomatoso" B-J positiva (calle 1), en la calle 2 una proteinuria de tipo fisiológica con B-J negativa por IF y un paciente con probable presencia de B-J en 25 kDa por la técnica de SDS-PAGE que en la electroforesis en gel de acetato de celulosa por técnica manual con tinción argéntica había resultado de tipo fisiológica con estudio de IF negativa (calle 3).

1. Orina con una proteinuria de tipo "Mielomatoso" con B-J (+) que fue de tipo kappa por IF - 2. Orina con proteinuria de tipo fisiológica y B-J (-) - 3. Orina con probable B-J (+) en SDS-PAGE, que fue negativa por IF - 4. Control de Peso Molecular.
Figura 4. Estudio de SDS-PAGE en orina de pacientes con GMSI
Solo 13 pacientes presentaron valores de eGFR< 60 mL/min/1,73 m2 (13,9%), 7 tenían presencia de B-J (5 kappa y 2 lambda) y los otros 6 no tenían cadenas livianas en la orina. La diferencia de mayor importancia observada entre estos dos grupos fue la edad, dado que los pacientes con B-J tenían un promedio de 65 años y el grupo sin B-J un promedio de 88 años, encontrándose DES para este parámetro entre ambos grupos (p<0,05). Los valores medios para la concentración de proteínas totales urinarias no tuvieron DES entre estos pacientes, mientras que se pudo observar datos más elevados de a1m-ur (35,1 mg/L vs 3,31 mg/L), Alb-ur (21,1 mg/L vs 5,3 mg/L) y ß2m-ur (0,55 mg/L vs 0,17 mg/L) en los pacientes con bajo eGFR y presencia de B-J vs bajo eGFR y ausencia de B-J. La asociación entre falla renal y valores anormales de a1m-ur y Alb-ur fue estadísticamente significativa (p<0,05 y p<0,001, respectivamente), no así para los datos de ß2m-ur.
Discusión
La edad, sexo, niveles de hemoglobina, ß2M, albúmina, tipo de cadenas livianas de inmunoglobulinas del CM y la presencia de B-J, no tuvieron valor pronóstico con respecto a la progresión, no pudiéndose encontrar DES en estos parámetros entre los pacientes que P y los que NP. La inversa de esta situación fue observada respecto de la clase de inmunoglobulina comprometida (IgG/no IgG), la concentración del CM (>1,5g/dL<) y la disminución ó no de las INC al momento del diagnóstico.
La concentración de plasmocitos en MO tiene un valor pronóstico establecido en la literatura (6)(34), el subgrupo de pacientes que tenían realizado un estudio de MO era muy pequeño para poder realizar dicha evaluación.
Se sabe que el valor predictivo de la R?/? se extiende a la mayoría de las GM, y aunque todavía no esté clara la relación entre R?/? y patogenicidad, hay indicios de que los niveles elevados de R?/? pueden estar relacionados con translocaciones IgH (16) y con una carga tumoral elevada (17)(18). Dentro del grupo de GM, la GMSI es la más común y entre el 33-44% de estos pacientes tienen valores alterados de R?/? en el momento del diagnóstico, demostrándose que estos individuos presentan un mayor riesgo de progresión a MM sintomático (10). En el presente trabajo se encontró un porcentaje de pacientes con RAKL (73%), muy superior al relatado en la bibliografía, tal vez por el bajo número de pacientes incluidos y que no necesariamente significó progresión de la GMSI para ellos. Pero la comparación de las medianas de las RAKL fue el único parámetro bioquímico que difería significativamente, en el subgrupo de pacientes evaluados con esta técnica, separando claramente a pacientes con mayor y menor riesgo de progresión.
Mediante el estudio comparativo del PE realizado por EC vs Ace/Aga se pudo demostrar que es indistinto utilizar cualquiera de las tres metodologías para la realización de los mismos. En cuanto al cambio de ubicación del CM visto en la EC vs electroforesis convencional, es un inconveniente sólo en los casos de cambio de método durante el seguimiento de los pacientes, debido que la IF certificó que se trata del CM original. Asimismo, la no observación en EC de dobles CM detectados en las otras técnicas, tampoco constituye un problema en estos pacientes, desde el punto de vista de que ninguno de ellos progresó a una enfermedad maligna, con seguimiento muy largos, de hasta 28 años.
Del total de pacientes diagnosticados como GMSI (407) se han analizado las orinas en 88 pacientes que fueron estudiados oportunamente mediante el pedido de IF en el momento del diagnóstico, de los cuales sólo algunos casos pudieron ser evaluados en su seguimiento, ya que el parámetro a medir, aconsejado hasta el momento, es sólo la determinación de PT en orina de 24 horas de recolección. En este sentido los resultados obtenidos, tanto en los valores de creatinina sérica como en los de proteinurias de 24 h, muy por debajo de 1g/24h, permiten considerarlos dentro de los límites aceptados para mantener la condición de GMSI (35)(36). Sin embargo, analizando el grupo en profundidad con los marcadores de mayor sensibilidad para la lesión renal se han podido observar valores de a1m-ur elevados en el grupo de pacientes con un CM cuya cadena liviana era de tipo lambda, la cual generalmente se asocia a peores pronósticos (37). Asimismo, al separar el grupo según tengan o no presencia de B-J, en aquellos pacientes con B-J positiva, independientemente del tipo de cadena liviana, se observó que mayoritariamente tenían concentraciones elevadas de a1m-ur (con lo que se evidencia una agresión a nivel túbulointersticial) y valores de estimado de filtrado glomerular comparables a los hallados en una enfermedad renal crónica (eGFR<60mL/min/1,73m2). La concentración de Alb-ur ha sido elevada también en estos pacientes lo que mostraría, junto a la elevación de la a1m-ur, la agresión de las B-J a nivel renal. A su vez los valores de Alb-ur eran más elevados en los pacientes cuya B-J era de tipo lambda y esto posiblemente se deba a la mayor capacidad de agregación y posibilidad de interacción con la estructura glomerular, asociado a esta cadena liviana.
Esto ya ha sido observado previamente en un estudio comparativo, entre pacientes con diagnóstico de MM y proteinurias de "tipo mielomatoso" puras y pacientes con enfermedad renal de distintos orígenes (38).
Por otro lado, en los dos casos en los que se observó un compromiso glomerular detectado con la determinación de los perfiles proteicos urinarios, ambos pacientes tenían IF negativa en orina y ambos presentaron CM séricos de tipo kappa, por lo que se podría pensar en un depósito a nivel glomerular debido a las características de este tipo de cadena asociada a enfermedad por depósito de cadenas livianas (39). Este mecanismo ha sido recientemente descripto también por Ramos R et al, quienes luego de certificar la presencia del depósito por medio de una biopsia renal, propusieron un tratamiento temprano con buenos resultados para estos pacientes (40).
En los pacientes donde la glomerulopatía ha sido detectada concomitantemente a la presencia de B-J, el análisis del perfil proteico podría indicar la búsqueda de la existencia de amiloidosis, que de otro modo, pasaría insospechada aunque es de esperar que menos del 2% de los pacientes con MM presenten amilodosis al momento del diagnóstico (41). De todos modos, hoy en día la búsqueda de una enfermedad renal crónica está indicada en pacientes con enfermedades neoplásicas, tanto en el momento del diagnóstico como cada vez que la terapia sufra alguna modificación (42)(43).
A la luz de los resultados aquí presentados, el estudio adicional de marcadores como a1m-ur y ß2m-ur podría ofrecer un conocimiento más profundo del estado renal, con un mínimo impacto en la conducta de seguimiento una vez establecido el riesgo de progresión, tal como han propuesto Bianchi et al (44). Por otro lado, la edad avanzada es probablemente la causa de los datos de eGFR<60mL/min/1,73m2, hallados en los pacientes que tenían ausencia de B-J.
En los perfiles de SDS-PAGE la presencia de la B-J dificultó la correcta evaluación del estudio, sin embargo en los casos de ausencia de la misma, la sensibilidad de la tinción argéntica ha permitido observar en el SDS-PAGE vestigios de cadenas livianas que indican un incremento de su concentración aún no detectable por IF, seguramente por encontrarse debajo del límite de su sensibilidad (50 mg/L). En estos casos, se debería recomendar un control de seguimiento más próximo en el tiempo. De este modo se puede prevenir y detectar posible daño renal futuro, de igual forma como que se procede en la actualidad para la detección temprana de la enfermedad ósea, en la población de pacientes con GMSI (45).
Conclusiones
La GMSI es una patología con curso indolente durante largos períodos de tiempo pero una proporción de pacientes desarrollará una enfermedad maligna durante su evolución. Identificar factores con valor pronóstico de posible progresión es fundamental para establecer los estudios de laboratorio y la periodicidad de los controles clínicos, teniendo en cuenta la adhesión del paciente a sus regímenes de controles seriados.
Con una prevalencia de más del 3% en la población blanca y el doble en la población negra con 50 años o más, la GMSI afecta a millones de personas en todo el mundo, lo que obliga a justificar los gastos totales asociados con el seguimiento anual y por otro lado, el hecho de ser el CM en la mayoría de los casos un hallazgo del laboratorio, amerita proponer la inclusión del PE en suero, dentro del grupo de los análisis de rutina recomendados a la población en general.
Se conoce que un seguimiento óptimo de estos pacientes (controles cada seis meses), principalmente en los de alto riesgo, incrementa el porcentaje de diagnóstico de MM Indolente (38% de pacientes vs 15%), aunque al presente el beneficio clínico de un diagnóstico temprano no esté claro. Por otro lado, el 16% de los pacientes con GMSI arriban a un diagnóstico de MM sobre la base de resultados anormales de laboratorio en ausencia de síntomas o complicaciones (44). Asimismo como la mayor parte de los pacientes con diagnóstico de GMSI, nunca desarrollará MM, aunque exista un riesgo de evolucionar de por vida, no está claro aún si una rutina anual de seguimiento sería beneficioso en todos los casos (46). A su vez, siendo el MM una enfermedad actualmente incurable, no hay datos definitivos que soporten que una intervención temprana prolongue la sobrevida en estos pacientes.
Es conocido que en tiempos de frecuentes cambios, las nuevas pruebas de screening de laboratorio asumen una relevante condición epidemiológica, con un valor crucial desde el punto de vista ético, social y económico. Por lo tanto, establecer una rutina racional de controles periódicos en la GMSI será fundamental por varios motivos: evitar efectos psicológicos adversos en los pacientes que hagan peligrar la adhesión a la periodicidad de sus controles y posibilitar el diagnóstico oportuno de la enfermedad maligna evitando complicaciones innecesarias, hospitalizaciones y altos costos futuros en el servicio de salud (47)(48).
Los resultados del presente estudio llevan a recomendar, en la evaluación inicial de las GMSI, la inclusión de las determinaciones de PE, IF, concentración de las INC y R?/? libres en suero para identificar los pacientes con mayor riesgo de progresión. Los controles de orina deberían solicitarse en forma rutinaria y deberían ser más completos que el propuesto en la actualidad (sólo proteínas totales), e incluir tanto en el momento del diagnóstico como en los controles sucesivos, las determinaciones de PE, IF, el estudio de SDS-PAGE y la cuantificación de PBPM en orina de 24 h de recolección. El SDS-PAGE y las PBPM particularmente aportarían información valiosa respecto de la posibilidad de la detección temprana de una enfermedad renal, ya que el aumento de PBPM está asociado con un valor de eGFR<60 y a B-J positiva, independientemente del tipo inmunológico de cadena liviana y de los niveles de proteínas totales detectados en orina.
1. Kyle RA. Monoclonal gammopathy of undetermined significance: natural history in 241 cases. Am J Med 1978; 64: 814-26. [ Links ]
2. Kyle RA. Monoclonal gammopathy of undetermined significance (MGUS). Bailliere´s Clin. Haematol 1995; 8: 761-81. [ Links ]
3. Kyle RA, Therneau TM, Rajkumar SV, Offord JR, Larson DR, Plevak MF, et al. A long-term study of prognosis of monoclonal gammopathy of undetermined significance. N Engl J Med 2002; 346: 564-9. [ Links ]
4. Pizzolato M, Torquatti S, Stoliar A, Pizzolato MB, Wikinski R. Paraproteínas idiopáticas ¿;Benignas? Incidencia en individuos aparentemente sanos. Rev Asoc Bioquim Argent 1975; 221: 96-101. [ Links ]
5. Kyle RA, Therneau TM, Rajkumar SV, Larson DR, Plevak MF, Offord JR, et al. Prevalence of monoclonal gammopathy of undetermined significance. N Engl J Med 2006; 354: 1362-9. [ Links ]
6. Baldini L, Guffanti A, Cesana BM, Colombi M, Chiorboli O, Damilano I, et al. Role of different hematologic variables in defining the risk of malignant transformation in monoclonal gammopathy. Blood 1996; 87: 912-8. [ Links ]
7. Vuckovic J, Ilic A, Knezevic N, Marinkovic M, Zemunik T, Dubravcic M. Prognosis in monoclonal gammopathy of undetermined significance. Br J Haematol 1996; 97: 649-51. [ Links ]
8. Sackmann F, Pavlovsky MA, Corrado C, Pizzolato M, Alejandre M, Pavlovsky S. Prognostic factors in monoclonal gammopathy of undetermined significance. Haematologica 2008; 93(1): 153-4. [ Links ]
9. Rajkumar SV, Kyle RA, Therneau TM, Clark RJ, Bradwell AR, Melton LJ, et al. Presence of monoclonal free light chains in the serum predicts risk of progression in monoclonal gammopathy of undetermined significance. Br J Haematol 2004; 127: 308-10. [ Links ]
10. Rajkumar SV, Kyle RA, Therneau TM, Melton LJ, Bradwell AR, Clark RJ, et al. Serum free light chain ratio is an independent risk factor for progression in monoclonal gammopathy of undetermined significance. Blood 2005; 106: 812-7. [ Links ]
11. Kyle RA, Durie BG, Rajkumar SV, Landgren O, Blade J, Merlini G, et al. Monoclonal gammopathy of undetermined significance (MGUS) and smoldering (asymptomatic) multiple myeloma: IMWG consensus perspectives risk factors for progression and guidelines for monitoring and management. Leukemia 2010; 24(6): 1121-7. [ Links ]
12. Fonseca R, Bailey RJ, Ahmann GJ, Rajkumar SV, Hoyer JD, Lust JA, et al. Genomic abnormalities in monoclonal gammopathy of undetermined significance. Blood 2002; 100: 1417-24. [ Links ]
13. Rajkumar SV, Mesa RA, Fonseca R, Schroeder G, Plevak MF, Dispenzieri A, et al. Bone marrow angiogenesis in 400 patients with monoclonal gammopathy of undetermined significance, múltiple myeloma and primary amyloidosis. Clin Cancer Res 2002; 8: 2210-6. [ Links ]
14. Rasmussen T, Kuehl M, Lodahl M, Johnsen HE, Dahl IMS. Possible roles for activating RAS mutations in the MGUS to MM transition and in the intramedullary to extramedullary transition in some plasma cell tumors. Blood 2005; 105: 317-23. [ Links ]
15. Kumar S, Rajkumar SV, Kyle RA, Lacy MQ, Dispenzieri A, Fonseca R, et al. Prognostic value of circulating plasma cells in monoclonal gammopathy of undetermined significance. J Clin Oncol 2005; 23: 5668-74. [ Links ]
16. Kumar S, Fonseca R, Dispenzieri A, Katzmann JA. High Incidence of IgH translocations in monoclonal gammopathies with abnormal free light chain levels. ASH Annual Meeting Abstracts 2006; 108(11): 3514. [ Links ]
17. Dispenzieri A, Lacy MQ, Katzmann JA, Rajkumar SV, Abraham RS, Hayman SR, et al. Absolute values of immunoglobulin free light chains are prognostic in patients with primary systemic amyloidosis undergoing peripheral blood stem cell transplantation. Blood 2006; 107(8): 3378-83. [ Links ]
18. Van Rhee F, Bolejack V, Hollmig K, Pineda-Roman M, Anaissie E, Epstein J, et al. High serum-free light chain levels and their rapid reduction in response to therapy define an aggressive multiple myeloma subtype with poor prognosis. Blood 2007; 110(3): 827-32. [ Links ]
19. Bladé J. On the significance of monoclonal gammopathy of undetermined significance. Mayo Clinic Proc 2004; 79: 855-6. [ Links ]
20. Corso A, Zappasodi P, Pascutto C, Bosoni T, Mangiacavalli S, Lorenzi A, et al. Urinary proteins in multiple myeloma: correlation with clinical parameters and diagnostic implications. Ann Hematol 2003; 82: 487-91. [ Links ]
21. Stratta P, Airoldi A, Izzo C, Rossi D, Gaidano GL. Free light-chains and renal disorders: when small is worse. The Lancet 2010; 376: 1221-2. [ Links ]
22. Kobayashi T, Muto S, Nemoto J, Miyata Y, Ishiharajima S, Hironaka M, et al. Fanconi's syndrome and distal (type 1) renal tubular acidosis in a patient with primary Sjögren's syndrome with monoclonal gammopathy of undetermined significance. Clin Nephrol 2006; 65: 427-32. [ Links ]
23. Hashimoto T, Arakawa K, Ohta Y, Suehiro T, Uesugi N, Nakayama M, et al. Acquired Fanconi syndrome with osteomalacia secondary to monoclonal gammopathy of undetermined significance. Intern Med 2007; 46: 241-5. [ Links ]
24. Okura T, Miyoshi K, Nagao T, Jotoku M, Enomoto D, Irita J, et al. Light chain deposition disease developing 15 years following the diagnosis of monoclonal gammopathy of undetermined significance. Intern Med 2009; 48: 101-14. [ Links ]
25. Hii IM, Chen ML, Chang CC. Benign monoclonal gammopathy-associated acute kidney injury: case report and literature review. Ren Fail 2010; 32: 636-8. [ Links ]
26. Sethi S, Zand L, Leung N, Smith R, Jevremonic D, Herrmann S, et al. Membranoproliferative glomerulonephritis secondary to monoclonal gammopathy. Clin J Am Soc Nephrol 2010; 5: 770-82. [ Links ]
27. Bossuyt X, Bogaerts A, Schiettekatte G, Blanckaert N. Serum protein electrophoresis and immunofixation by a semiautomated electrophoresis system. Clin Chem 1998; 44: 944-49. [ Links ]
28. Drayson M, Tang LX, Drew R, Mead GP, Carr-Smith H, Bradwell AR. Serum free light-chain measurements for identifying and monitoring patients with nonsecretory multiple myeloma. Blood. 2001; 97: 2900-2. [ Links ]
29. Katzmann JA, Clark RJ, Abraham RS, Bryant S, Lymp JF, Bradwell AR, et al. Serum reference intervals and diagnostic ranges for free kappa and free lambda immunoglobulin light chains: Relative sensitivity for detection of monoclonal light chains. Clin Chem 2002; 48: 1437-44. [ Links ]
30. Klasen I, Reichert L, de Kat Angelino C, Wetzels J. Quantitative determination of low and high molecular weight proteins in human urine: influence of temperature and storage time. Clin Chem 1999; 45: 430-2. [ Links ]
31. Finn W: Tubulointerstitial disease. In: Primer on Kidney Diseases, 2nd Ed., edited by Greenberg A. Madrid: Harcourt Brace; 1999; pp 342. [ Links ]
32. García M, Madalena L, Bragantini G, Bresciani P, Pizzolato M. Urine immunofixation without prior concentration with silver stain. Acta Bioquím Clín Latinoam 1996; 3: 215-20. [ Links ]
33. Sasse J, Gallagher S. Staining Proteins in gels. In: Ausubel FM et al, editors. Current Protocols in Molecular Biology: New York: John Wiley & Sons Inc. 2003; 10-6. [ Links ]
34. Cesana C, Klersy C, Barbarano L, Nosari AM, Crugnola M, Pungolino E, et al. Prognostic factors for malignant transformation in monoclonal gammopathy of undetermined significance and smoldering myeloma. J Clin Oncol 2002; 20: 1625-34. [ Links ] 35. Wadhera R, Rajkumar V. Prevalence of monoclonal gammopathy of undetermined significance:A systematic review. Mayo Clin Proc 2010; 85: 933-42. [ Links ]
36. Kyle R, Rajkumar V. Monoclonal gammopathy of undetermined significance and smouldering multiple myeloma: emphasis on risk factors for progression. Brit J Haem 2007; 139: 730-43. [ Links ]
37. Drayson M, Begum S, Makkuni S, Dunn J, Barth N, Child A. Effects of paraprotein heavy and light chain types and free light chain load on survival in myeloma: an analysis of patients receiving conventional-dose chemoteraphy in Medical research Council UK multiple myeloma trials. Blood 2006; 108: 2013-9. [ Links ]
38. Madalena L, Facio ML, Angerosa M, Pandolfo M, Bresciani P, Alejandre M, et al. Urinary excretion of low molecular weight proteins in patients with pure monoclonal light chain proteinuria. J Nephol 2007; 20: 683-8. [ Links ]
39. Ronco P, Plaisier E, Mougenot B, Aucouturier P. Immunoglobulin light (heavy)-chain deposition disease: from molecular medicine to pathophysiology-driven therapy. Clin J Am Soc Nephrol 2006; 1: 1342-50. [ Links ]
40. Ramos R, Poveda R, Bernis C, Ara J, Sunyer M, Arrizabalaga P, et al. Afectación renal en las gammopatías monoclonales benignas: ¿;una entidad infra diagnosticada? Nefrología 2008: 525-30. [ Links ]
41. Siragusa S, Morice W, Gertz M, Kyle R, Greipp P, LusT J, et al. Asymptomatic immunoglobulin light chain amyloidosis (AL) at the time of diagnostic bone marrow biopsy in newlydiagnosed patients with multiple myeloma and smoldering myeloma. A series of 144 cases and a review of the literature. Ann Hematol 2011; 90: 101-6. [ Links ]
42. Levey A, Atkins R, Coresh J, Cohen EP, Collins AJ, Eckardt KU, et al. Chronic kidney disease as a global public health problem: approaches and initiatives - a position stament from Kidney Disease Improving Global Outcomes. Kidney Int 2007; 72: 247-59. [ Links ]
43. Tentori F. Screening for chronic kidney disease: who, how and when. J Nephol 2008; 21:17-9. [ Links ]
44. Bianchi G, Kyle R, Colby C, Larson D, Kumar S, Katzmann J, et al. Impact of optimal follow-up of monoclonal gammopathy of undetermined significance on early diagnosis and prevention of myeloma-related complications. Blood 2010; 116: 2019-25. [ Links ]
45. Kristinsson S, Tang M, Pfeiffe R, BJPörkholm M, Blimark C, Mellqvist U-H, et al. Monoclonal gammopathy of undetermined significance and risk of skeletal fractures: a population-based study. Blood 2010; 116: 2651-5 [ Links ]
46. Go RS. Monoclonal gammopathy of undetermined significance: to screen or not to screen for multiple myeloma? Br J Haematol 2010; 149(4): 620-1. [ Links ]
47. Brody H. Medicine´s ethical responsibility for health care reform: the top five list. N Engl J Med 2010; 362(4): 283-5. [ Links ]
48. Luft HS. Health care reform: toward more free-dom, and responsibility, for physicians. N Engl J Med 2009; 361(6): 623-8. [ Links ]
Aceptado para su publicación el 23 de octubre de 2012














