Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957
Acta bioquím. clín. latinoam. vol.47 no.2 La Plata abr./jun. 2013
BIOQUÍMICA CLÍNICA
Flavoproteínas que actúan como amino-oxidasas: Estructura, función e importancia clínica
Flavoproteins acting as amine oxidases: Structure, function and clinical significance
Flavoproteínas atuando como amina oxidases: Estrutura, função e significado clínico
Alicia Beatriz Pomilio1, Jorge Oscar Ciprian Ollivier2, Arturo Alberto Vitale3
1 Doctora de la Universidad de Buenos Aires, Investigadora Superior de CONICET. Instituto de Bioquímica y Medicina Molecular [IBIMOL, ex PRALIB] (UBA y CONICET).
2 Médico. Doctorado en la Facultad de Medicina, Universidad de Buenos Aires. IBIMOL [ex PRALIB] (UBA y CONICET).
3 Doctor en Ciencias Químicas, UBA; Investigador de CONICET. IBIMOL [ex PRALIB] (UBA y CONICET).
Instituto de Bioquímica y Medicina Molecular [IBIMOL, ex PRALIB] (UBA y CONICET), Facultad de Farmacia y Bioquímica (FFyB), Universidad de Buenos Aires (UBA), Junín 956, C1113AAD Ciudad Autónoma de Buenos Aires. Argentina. E-mail: pomilio@ffyb.uba.ar
CORRESPONDENCIA PROF. DRA. ALICIA B. POMILIO IBIMOL (ex PRALIB) (UBA y CONICET) Facultad de Farmacia y Bioquímica (FFyB) Universidad de Buenos Aires (UBA) Junín 956, C1113AAD CIUDAD AUTÓNOMA DE BUENOS AIRES, Argentina E-mail: pomilio@ffyb.uba.ar
Todos los autores contribuyeron de igual manera a este trabajo.
Resumen
Se destaca la actividad de las flavoenzimas como amino-oxidasas, que intervienen en el metabolismo de las aminas biogénicas como biorreguladores, especialmente en el crecimiento y la diferenciación celular. La clasificación de las amino-oxidasas incluye flavoenzimas y quinoenzimas. Se analizan las amino-oxidasas que son flavoproteínas, como las monoamino-oxidasas y las poliamino-oxidasas. Se discuten las isoformas, estructuras y función de ambas, sus sustratos e inhibidores, la expresión de MAO-A y MAO-B en tejidos humanos y sus implicancias clínicas. MAO plaquetaria es un biomarcador de desórdenes mentales y neurodegenerativos. Los inhibidores selectivos de MAO-A resultaron ser eficaces antidepresivos, mientras que algunos de MAO-B se utilizan en el tratamiento de enfermedades de Parkinson y de Alzheimer. La identificación de elevadas concentraciones de poliaminas en varias enfermedades, desde cáncer y psoriasis hasta infecciones parasitarias, hace que la manipulación de su metabolismo sea un blanco terapéutico o preventivo en ciertas enfermedades. Se discute además qué poliamino-oxidasas actúan en el metabolismo de las poliaminas en humanos, frente a las presentes en plantas, bacterias y protistas. Las poliaminas y las enzimas de su metabolismo desempeñan funciones relevantes en los procesos de envejecimiento y en algunas enfermedades, como cáncer, diabetes mellitus, accidentes cerebro-vasculares, insuficiencia renal y trastornos psiquiátricos.
Palabras clave: Flavoproteínas; Amino-oxidasas; Monoamino-oxidasas; Poliamino-oxidasas; Estructura; Función; Implicancia clínica.
Summary
The activity of flavoenzymes as amine oxidases involved in the metabolism of biogenic amines as bioregulators is highlighted, particularly for cell growth and differentiation. The classification of amine oxidases includes flavoenzymes and quinoenzymes. Amine oxidases that are flavoproteins, such as monoamine oxidases and polyamine oxidases, are analyzed herein. The isoforms, structures and functions of both enzyme families, their substrates and inhibitors, the expression of MAO-A and MAO-B in human tissues, and their clinical implications are discussed. Platelet MAO is a biomarker of mental and neurodegenerative disorders. Selective MAO-A inhibitors proved to be effective antidepressants, while some MAO-B inhibitors are used for treatment of Parkinson's and Alzheimer's diseases. The identification of high concentrations of polyamines in a variety of diseases, from psoriasis to cancer and parasitic infections, makes handling their metabolism a therapeutic or preventive target for the treatment of some diseases. Also polyamine oxidase activity on polyamine metabolism in humans, compared to those present in plants, bacteria and protists,is discussed. Polyamines and the enzymes involved in their metabolism play important roles in the aging processes, as well as in certain diseases such as cancer, diabetes mellitus, stroke, kidney failure, and defined psychiatric disorders.
Keywords: Flavoproteins; Amine oxidases; Monoamine oxidases; Polyamine oxidases; Structure; Function; Clinical significance.
Resumo
Foi enfatizada a atividade de flavoenzimas como as amina oxidases envolvidas no metabolismo de aminas biogênicas como biorreguladores, especialmente no crescimento e diferenciação celular. A classificação das amina oxidases inclui flavoenzimas e quinoenzimas. Amina oxidases que são flavoproteínas, tais como monoamina oxidases e poliamina oxidases, são analisadas. Isoformas, estrutura e função das duas oxidases são discutidas, os seus substratos e inibidores, a expressão de MAO-A e MAO-B em tecidos humanos e suas implicações clínicas. MAO plaquetária é um biomarcador de desordens mentais e neurodegenerativas. Os inibidores selectivos da MAO-A resultaram ser eficazes antidepressivos, embora alguns dos MAO-B sejam utilizados no tratamento da doença de Parkinson e de Alzheimer. A identificação de elevadas concentrações de poliaminas em várias doenças, desde câncer e psoríase a infecções parasitárias, faz com que a manipulação do seu metabolismo seja um alvo terapêutico ou preventivo em certas doenças. Também se discute que a poliamina oxidase atua sobre o metabolismo das poliaminas no ser humano, em comparação com aquelas presentes em plantas, bactérias e protistas. As poliaminas e enzimas do seu metabolismo desempenham papéis relevantes nos processos de envelhecimento e em algumas doenças, tais como câncer, diabetes miellitus, acidente vascular cerebral, insuficiência renal e perturbações psiquiátricas.
Palavras-chave: Flavoproteínas; Amina oxidases; Monoamina oxidases; Poliamina oxidases; Estrutura; Função; Implicações clínicas.
Introducción
Las flavoproteínas participan en variados procesos biológicos y además, actúan como enzimas. Estas proteínas se caracterizan por poseer un nucleótido derivado de la vitamina B2, como flavín-adenín-dinucleótido (FAD) o flavín-mononucleótido (FMN) conocido también como riboflavina-5'-monofosfato. Las flavoenzimas de interés en este trabajo son las monoamino-oxidasas.
Las amino-oxidasas son enzimas que están muy distribuidas en los organismos vivos (bacterias, plantas, animales) (1)(2) y que catalizan la desaminación oxidativa de las aminas (mono-, di- y poliaminas), con consumo de oxígeno y agua, y producen el aldehído correspondiente, amoníaco y peróxido de hidrógeno (2), según la reacción general:
RCH2NH2 (mono-, di- y poliaminas) + H2O + O2 g RCHO + NH3 + H2O2
Las amino-oxidasas de mamíferos son una familia heterogénea de enzimas que metabolizan varias monoaminas (primarias y secundarias), diaminas, cadenas laterales metiladas de lisina en las proteínas y poliaminas, endógenas o xenobióticas y también de origen dietario (2).
Su función en el metabolismo de las aminas biogénicas les confiere un rol importante durante los procesos esenciales en los que estas aminas intervienen como la proliferación (3) (4), la diferenciación celular y la apoptosis (5).
Clasificación de las amino-oxidasas
La familia de las amino-oxidasas se puede dividir en dos grupos, en base a la naturaleza química de sus cofactores:
1) Las amino-oxidasas con FAD como cofactor, denominadas FAD-amino-oxidasas, comprenden las monoamino-oxidasas (MAOs; EC 1.4.3.4) y las poliamino-oxidasas [PAOs; EC 1.5.3.13 hasta 1.5.3.17, siendo importantes en humanos la N1-acetilpoliamino-oxidasa, (PAO o APAO peroxisomal humana; EC 1.5.3.13) y la espermina-oxidasa (SMO; EC 1.5.3.16)].
Estas flavoenzimas catalizan la oxidación de aminas primarias y secundarias, con la transferencia de un equivalente de hidruro de un enlace carbono-nitrógeno al cofactor flavina.
Dentro de las flavoproteínas se encuentra también el grupo de enzimas con aminoácidos como sustratos, que no serán tratados en el presente trabajo. Como por ejemplo: L-aminoácido-oxidasa (LAO) que fue aislada primero de veneno de serpiente, cataliza la desaminación oxidativa de L-aminoácidos y los convierte en cetoácidos, amoníaco y peróxido de hidrógeno (6). LAO es una proteína específica de la glándula mamaria en el período de lactancia de humanos y en mamíferos en general, que presenta actividad antibacteriana por la producción de peróxido de hidrógeno; se encuentra también en la leche. También se conoce la D-aminoácido-oxidasa (DAAO; también DAO, OXDA, DAMOX), que es una enzima peroxisomal, que se expresa en una variedad de especies, desde levaduras a humanos, pero no en bacterias ni en plantas (7)(8). Su función es la oxidación de los D-aminoácidos a los correspondientes iminoácidos, produciendo amoníaco y peróxido de hidrógeno. Recientemente, la DAAO de mamíferos se ha asociado al metabolismo de D-serina en el cerebro y a la regulación de la neurotransmisión glutamatérgica. En un estudio postmortem, se encontró que la actividad de DAAO era dos veces mayor en la esquizofrenia (9). El activador de la DAAO (DAOA, sigla del inglés: D-amino acid oxidase activator), también conocido como G72, es una proteína enriquecida en varias partes del cerebro, médula espinal y testículos, que interactúa con DAAO y su gen (10), pudiendo jugar un rol en los mecanismos glutamatérgicos de la esquizofrenia (11-13); confiere susceptibilidad al trastorno bipolar.
También la enzima D-aspartato-oxidasa [aspártico-oxidasa; D-aspártico-oxidasa; nombre sistemático:D-aspartato:oxidorreductasa de oxígeno (desaminante)] (14) participa en el metabolismo de alanina y aspartato; es codificada por el gen DDO.
2) Las amino-oxidasas que tienen cobre en su sitio activo y un cofactor orgánico con uno o más grupos carbonilo, como: fosfato de piridoxal, quinona de pirroloquinolina o 6-hidroxidopa (también llamadas amino-oxidasas carbonilo-dependientes) denominadas Cu-amino-oxidasas.
Estas quinoenzimas, con actividad enzimática de amino-oxidasas, comprenden la diamino-oxidasa (DAO; EC 1.4.3.22), la MAO circulante, MAO plasmática o amino-oxidasa sensible a la semicarbazida (SSAO, sigla del inglés: semicarbazide-sensitive amine oxidases) o proteína-1 de adhesión vascular (VAP-1, sigla del inglés: vascular adhesion protein-1) (EC 1.4.3.21) (15) (16) y la enzima del tejido conectivo: lisil-oxidasa (LOX; EC 1.4.3.13).
Las MAO, las PAO y las SSAO parecen contribuir al metabolismo de los xenobióticos (16)(17).
Esta compilación estará enfocada hacia el primer grupo de amino-oxidasas que son flavoenzimas, como las MAOs y las PAOs.
Monoamino-oxidasas: isoformas, estructuras, función, sustratos e inhibidores
La monoamino-oxidasa (MAO) fue aislada por primera vez en 1928 por Hare y llamada tiramino-oxidasa por su capacidad para catalizar la desaminación oxidativa de la tiramina. Más tarde, surgieron otros sustratos de MAO, tipo monoaminas, como las catecolaminas (dopamina, noradrenalina, adrenalina) y la serotonina, por lo que se la denominó monoamino-oxidasa.
Por lo tanto, MAO (EC 1.4.3.4) es una flavoenzima que cataliza la desaminación oxidativa de las monoaminas naturales, como los neurotransmisores y las aminas biogénicas. MAO es importante en la regulación de la degradación metabólica de las catecolaminas y de la serotonina en el tejido nervioso y en otros tejidos (18). MAO hepática tiene un papel defensivo crucial en la desactivación de las monoaminas circulantes o aquellas que, como la tiramina, se originan en el intestino y son absorbidas por la circulación portal.
ISOFORMAS DE MAO
Existen dos isoformas de MAO, llamadas MAO-A y MAO-B, diferenciadas históricamente por la selectividad de ciertos inhibidores de bloquear una u otra de las dos formas: clorgilina bloquea MAO-A (19) y L-deprenilo resulta específico para MAO-B (20)(21).
También hay una preferencia de sustrato, MAO-A metaboliza preferentemente serotonina, mientras que MAO-B tiene preferencia por β-feniletilamina. Tiramina, adrenalina, noradrenalina y dopamina son metabolizadas igualmente por las dos isoenzimas (22).
Ambas isoformas de MAO tienen pesos moleculares ligeramente diferentes: 60 kDa para MAO-A y 58 kDa para MAO-B en humanos (23).
A nivel genómico, las MAOs son codificadas por dos genes diferentes situados en el cromosoma X (24). Su organización genómica es muy similar: 15 exones y 14 intrones (25). Además, la clonación de ADNc mostró en humanos una homología de secuencia en aminoácidos del 70% entre las dos isoformas (26). Con los clones de ADNc de MAO-A y -B se demostró la distribución en los tejidos y la estructura genómica de MAO-A y -B, sugiriendo que derivan del mismo gen ancestral. Se han establecido los sitios activos, el rol de las unidades de cisteína, los modelos tridimensionales y los dominios blanco de las mitocondrias de ambas isoenzimas (27).
Los estudios de los ratones MAO-A y de los MAO-B KO sugirieron que ambas MAOs tienen distintas funcio nes bioquímicas y fisiológicas (27).
La comparación de las secuencias de MAO-A y de MAO-B entre especies también mostró una conservación significativa de cada una de las isoformas, con una homología del 87% entre MAO-A humana y bovina, del 85% con la rata (28)(29) y del 88% entre MAO-B humana y bovina (29)(30).
ESTRUCTURAS DE MAOs
Las MAOs están formadas por dos subunidades unidas por un puente disulfuro, asociado con un grupo FAD que actúa como cofactor: MAOs son así enzimas que pertenecen a la familia de las flavoproteínas. Mediante el estudio dirigido por mutagénesis del sitio activo de las MAOs se demostró que ciertos aminoácidos juegan un papel clave en la actividad enzimática (31) o en la especificidad del sustrato (32).
La cristalografía (Fig. 1) de MAOs se realizó recientemente y permitió avanzar en el conocimiento de sus sitios catalíticos y de sus sitios de unión a los inhibidores o a sus sustratos (33) (34); este nuevo enfoque debería permitir el modelado de nuevas moléculas.

LOCALIZACIÓN DE MAOs
Las MAOs son flavoenzimas ubicuas altamente conservadas en eucariotas y situadas a nivel subcelular en la membrana mitocondrial externa, ya sea en las terminales nerviosas, en el hígado u otros órganos.
La localización tisular de MAOs se ha estudiado principalmente en el sistema nervioso central debido a su rol en el turn-over de las catecolaminas, de la dopamina y de la serotonina, cuya vida media puede verse afectada en muchas patologías neurodegenerativas, como en la enfermedad de Parkinson y en la enfermedad de Alzheimer. La ubicación de MAOs dentro de las neuronas no necesariamente corresponde a aquella de su sustrato natural: MAO-A está a menudo presente en las neuronas catecolaminérgicas y MAO-B en las neuronas serotoninérgicas (37).
La expresión de MAOs en los tejidos periféricos humanos, en los de ratón y de rata se ha estudiado intensamente, en función de la edad (48)(49), de la relación de MAO-A vs MAO-B (42) y del tejido (38)(40)(43)(46). La Tabla I es una lista no exhaustiva de la expresión de MAO-A y -B en diferentes tejidos periféricos humanos y unos de rata.
Tabla I. Expresión de MAO-A y -B en diferentes tejidos humanos

Figura 1. Estructura cristalográfica de las monoamino-oxidasas humanas. MAO-A: Cristaliza bajo forma monomérica
FUNCIÓN DE MAOs
Las MAOs están implicadas en la desaminación oxidativa de las monoaminas (adrenalina, noradrenalina, dopamina, serotonina, triptamina, tiramina). Por lo tanto, juegan un rol primordial en el mantenimiento de la homeostasis de las monoaminas y catecolaminas en el control de sus concentraciones, especialmente a nivel de las vesículas sinápticas (sistema nervioso). También intervienen en la desintoxicación, incluyendo el metabolismo de las monoaminas dietarias (50).
REACCIÓN ENZIMÁTICA CATALIZADA
Ambas MAOs catalizan la desaminación oxidativa de aminas primarias alifáticas y aromáticas, así como algunas aminas secundarias y terciarias, de acuerdo con la siguiente reacción general:
RCH2NH2 + H2O + O2 RCHO + NH3 + H2O2
Esta reacción se desarrolla en tres etapas: el sustrato se oxida primero, generando la imina correspondiente y el cofactor FAD (FAD está unido a la enzima: E-FAD) se reduce a hidroquinona (reacción 1). La imina después se hidroliza a aldehído con liberación de amoníaco (reacción 2). Durante la reoxidación del cofactor FAD por el oxígeno, se produce peróxido de hidrógeno (reacción 3).
(reacción 1) RCH2NH2 + E-FAD → RCH=NH + E-FADH2
(reacción 2) RCH=NH + H2O → R-CHO + NH3
(reacción 3) E-FADH2 + O2 → E-FAD + H2O2
El aldehído producido en esta reacción se convierte a continuación en ácido carboxílico o en alcohol, mediante las respectivas enzimas, aldehído-deshidrogenasa o aldehído-reductasa.
ROL EN EL SISTEMA NERVIOSO CENTRAL
A nivel central, ambas MAOs participan en el turn-over y, por lo tanto, en la inactivación de catecolaminas y de serotonina, así como también en la desintoxicación de ciertos xenobióticos.
Así, 1-metil-4-fenil-1,2,3,6-tetrahidropiridina o MPTP, un potente neurotóxico proveniente de drogas sintéticas (meperidina), es metabolizado por MAO-B en MPP+ o 1-metil-4-fenilpiridinio, un metabolito capturado específicamente por las neuronas dopaminérgicas y su destrucción, causando síntomas similares a los de la enfermedad de Parkinson.
Algunas enfermedades debidas a un defecto en la síntesis de las monoaminas (enfermedad de Parkinson y de Alzheimer) son tratadas con inhibidores de monoamino-oxidasas (IMAOs). La enfermedad de Alzheimer está aparentemente asociada con un aumento en la actividad de MAO-B (49).
Además, los estudios de comportamiento realizados en animales con eliminación de MAO-A o MAO-B permiten una mejor comprensión de la importancia de cada isoforma a nivel central. Los ratones knock-out (KO) para MAO-A presentan un aumento de serotonina y de noradrenalina centrales (51); muestran una agresividad exagerada. Los animales knock-out para MAO-B presentan un aumento de β-feniletilamina (52); no tienen un comportamiento especialmente agresivo, a diferencia de lo que ocurre en el hombre, donde una disminución en MAO-B plaquetaria parece estar asociada con un aumento de la agresividad (53). Sin embargo, estos ratones son más susceptibles al estrés y presentan poca capacidad para habituarse a actividades motoras (54).
No se puede hacer un doble KO por cruzamiento de las dos líneas debido a la proximidad demasiado grande de los dos genes, pero tal doble KO pudo ser aislado por mutación espontánea (55). Presenta el mismo tipo de comportamiento agresivo que KO de MAO-A.
Por último, ambas MAOs intervienen en el desarrollo y la maduración de ciertas áreas del cerebro (56) y, debido a la importante producción de especies reactivas del oxígeno (ROS, sigla del inglés: reactive oxygen species) intervienen en los procesos de envejecimiento cerebral (57)(58), sobre todo porque aumenta su expresión con la edad en ciertas regiones del cerebro (56)(59)(60).
Se considera que la actividad de MAO plaquetaria es un índice de la actividad serotoninérgica cerebral. Se ha evaluado la actividad de MAO plaquetaria en 29 pacientes con trastorno obsesivo compulsivo (TOC) frente a controles sanos apareados por edad, género y consumo de tabaco (61). Los pacientes con TOC y obsesiones agresivas presentaron niveles significativamente menores de actividad MAO plaquetaria que los pacientes sin obsesiones agresivas. Por lo tanto, la actividad de MAO plaquetaria puede ser un marcador de la gravedad de TOC y la actividad baja de MAO plaquetaria puede asociarse con obsesiones agresivas en pacientes con TOC.
Recientemente, se estudiaron los marcadores bioquímicos en 34 pacientes psicóticos frente a controles, efectuándose dosaje de MAO plaquetaria y amino-oxidasa sérica (AO sérica, SSAO o MAO circulante), actividad transmetilante y dosaje de N,N-dimetilindol-alquilaminas urinarias: bufotenina y N,N-dimetiltriptamina (62). Se realizaron simultáneamente ensayos neuropsicológicos para evaluar los parámetros psicométricos en los mismos sujetos de estudio. Los niveles urinarios de DMT y bufotenina fueron evaluados por cromatografía gas-líquido-espectrometría de masas y por cromatografía líquida de alta resolución. Las enzimas fueron dosadas por métodos espectrofluorimétricos. Se establecieron relaciones entre los valores estadísticamente significativos de bufotenina urinaria y MAO plaquetaria, de DMT urinaria con MAO plaquetaria y con AO sérica. Los valores estadísticamente significativos de MAO plaquetaria y los de actividad de transmetilación fueron satisfactoriamente correlacionados lográndose así categorizar el 91,1% de los 34 sujetos participantes en cuatro tipos principales. La marcada disminución de MAO plaquetaria mostró concordancia con el aumento de bufotenina y DMT, y con la alteración perceptual observada en los ensayos neuropsicológicos. La disminución de AO sérica fue moderada, pero acorde con la actividad transmetilante registrada. Los resultados apoyan la teoría de transmetilación patológica de la esquizofrenia y muestran que estas indolalquilaminas metiladas son marcadores de estado para estas patologías (62).
ROL EN LOS ÓRGANOS PERIFÉRICOS
A nivel hepático e intestinal, ambas MAOs participan en la desintoxicación de las aminas biogénicas como tiramina (63) (Fig. 2), pero también de algunos xenobióticos, como 1-metil-4-fenil-1,2,3,6-tetrahidropiridina o MPTP (64).

Figura 2. Metabolismo de la tiramina alimentaria (67).
Las MAOs renales (38)(45) participan de la regulación de la concentración de las monoaminas producidas. Estas monoaminas (serotonina, dopamina) desempeñan un papel importante en la regulación de las funciones renales (filtración, excreción, reabsorción). Las MAOs, al regular las concentraciones de estas aminas podrían participar en la regulación de la función renal (65)(66).
FUNCIÓN RELACIONADA CON EL ESTRÉS OXIDATIVO Y LA PRODUCCIÓN DE ROS
La MAO pancreática podría participar en la liberación de insulina. En efecto, la estimulación farmacológica de los receptores β2-adrenérgicos (terbutalina) parece estimular la actividad de MAO pancreática, resultando en un cambio del estado redox de los islotes β del páncreas por la liberación de peróxido de hidrógeno (H2O2) (68).
El riñón es un órgano con una de las actividades más importantes de MAO (38)(44)(45)(69). En las células del túbulo proximal las MAOs son la principal vía de degradación de serotonina y de dopamina, que participan en la regulación de la reabsorción de sodio (70)(71)(72). Además, el peróxido de hidrógeno producido por las MAOs durante la degradación de dopamina puede,
dependiendo de su concentración (y de la concentración de sustrato) ser proliferativo (3) o pro-apoptótico (73). In vivo, el peróxido de hidrógeno producido por las MAOs durante los fenómenos de isquemia/reperfusión en ratas es responsable de daños tisulares (74)(75).
El tejido adiposo blanco y marrón de la rata, y los adipocitos humanos expresan MAO, incluyendo MAO-A (39), capaz de generar peróxido de hidrógeno durante el metabolismo de tiramina (76). Además, el transporte de glucosa (77) y la producción de AMPc (76) por los adipocitos se incrementará mediante la tiramina en relación con la producción de peróxido de hidrógeno por MAOs. La lipólisis está también regulada negativamente por las MAOs (78). Estos resultados indican un rol importante de MAOs en el balance de almacenamiento/ lipólisis del tejido adiposo, favoreciendo más bien al almacenamiento.
Muchos otros órganos también expresan una u otra isoforma de MAO. Así, el corazón es un órgano de alta expresión de MAO-A (79)(80). La expresión de MAO aumenta con la edad en algunos órganos como el corazón (81) y podría contribuir a los procesos de envejecimiento tisular debido al estrés oxidativo que se genera (58).
SUSTRATOS E INHIBIDORES DE MAOs
La especificidad por el sustrato y por el inhibidor de ambas isoformas de MAO (82) se resume en la Tabla II (83).
Tabla II. Principales sustratos e inhibidores de MAOs

SUSTRATOS DE MAOs
Hay especificidad de sustrato para ambas enzimas, MAO-A metaboliza sobre todo serotonina, MAO-B tiene como sustrato preferencial a la β-feniletilamina.
Algunos sustratos son comunes a las dos isoformas de MAOs, como dopamina y tiramina que son metabolizadas con la misma eficiencia por ambas enzimas (Tabla II).
Sin embargo, aunque cada isoforma tiene una afinidad variable en función del sustrato (teniendo cada una sus sustratos preferidos), a altas concentraciones de la enzima o del sustrato, las enzimas metabolizan de manera menos específica un sustrato con el que tienen menos afinidad.
Los xenobióticos, como por ejemplo el más conocido MPTP, son también susceptibles a la degradación por MAOs (84).
Entre los sustratos de MAOs, se encuentran algunos derivados O- y N-metilados de catecolaminas o de serotonina, producidos respectivamente por la catecol-O-metiltransferasa (COMT) y la 5-hidroxiindol-O-metiltransferasa (5-HIOMT).
Por último, MAOs comparten algunos de sus sustratos con otras enzimas, como la bencilamina, principalmente metabolizada por SSAO o la metilhistamina, normalmente metabolizada por DAO o por SSAO.
INHIBIDORES DE MAOs (IMAOs)
Los IMAOs se han desarrollado para tratar enfermedades, como por ejemplo: la depresión y enfermedades neurodegenerativas (85).
Los primeros IMAOs comerciales eran irreversibles y no específicos de una forma de MAO (fenelzina, iproniazida, tranilcipromina). Su uso produjo efectos secundarios importantes, tales como hepatotoxicidad y riesgos de interacción con otros antidepresivos del tipo de los tricíclicos (inhibidores del transporte de la serotonina) o los opiáceos. Además, debido a su unión irreversible a la enzima, su uso ha dado lugar a crisis hipertensivas denominadas "efecto queso", por ser inducidas entre otros por un consumo de queso, pero también de cerveza, de chocolate y en general, de todos los alimentos ricos en tiramina (86).
La industria farmacéutica ha desarrollado una amplia gama de IMAOs, irreversibles o reversibles, y específicos para una u otra de las dos enzimas (87).
Recientemente, se describió una nueva clase de inhibidores de MAO-A y MAO-B y de SSAO/VAP-1 basados en 3-fluoroalilamina; estudios de síntesis y SAR llevaron al compuesto 28 (PXS-4159A) (88).
Los IMAOs (Tabla II) pertenecen a varias grandes familias:
• Los inhibidores irreversibles son reconocidos por la enzima y se convierten en intermediarios reactivos que reaccionan con el grupo FAD de MAO, formando aductos covalentes estables, dando una enzima inactiva (89):
- Derivados de hidrazina (iproniazida, fenelzina).
- Derivados de ciclopropilamina (tranilcipromina, LY51646, LY54761).
- Derivados acetilénicos no selectivos (pargilina), selectivos de MAO-A (clorgilina), o de MAO-B (L-deprenil, selegilina, rasagilina).
• Los inhibidores reversibles, debido a su reversibilidad, no interaccionan con otros medicamentos y no presentan restricciones dietarias (89):
- Inhibidores con estructura de oxazolidinona (toloxatona, befloxatona).
- Derivados de moclobemida (IMAO-A).
- Inhibidores del grupo 2-aminoetilcarboxamida (RO-41-1049 y RO-19-6327).
Recientemente se desarrolló un método para la detección de IMAOs mediante electroforesis capilar, en base a la interacción de MAO y su sustrato (90). El proteoliposoma bioactivo se reconstituyó mediante liposoma y MAO y luego se aplicó como fase pseudoestacionaria de electroforesis capilar para imitar la interacción entre la enzima y su sustrato. R-2-HPA y rasagilina [N-propargil-1-(R)-aminoindano], que son dos tipos de IMAOs, se añadieron en los buffers de corrida que contenían proteoliposoma. Los resultados indicaron que la interacción entre kinuramina y MAO se debilitó con el aumento de los inhibidores. La eficiencia de la inhibición de rasagilina fue más fuerte que la de R-2-HPA a la misma concentración. Además, se investigó también la interacción entre kinuramina y el liposoma. Este nuevo método podría proporcionar una herramienta potencial para la detección de IMAOs (90).
Implicancias clínicas de MAO
Resulta importante determinar la actividad de la enzima MAO en plaquetas. Como MAO-B se expresa sólo, o predominantemente, en las plaquetas y linfocitos periféricos (91), la evaluación de MAO plaquetaria, corresponde en realidad a dosar MAO-B en las plaquetas, las cuales constituyen un modelo periférico de los sinaptosomas centrales serotoninérgicos (5-HT), ya que comparten procesos bioquímicos similares con las neuronas 5-HT (92).
Además de actuar en la fisiología de la hemostasia, las plaquetas son herramientas importantes en la investigación psiquiátrica sobre el estrés físico y psicológico, para la comprensión de ciertas condiciones psiquiátricas y de las propiedades farmacológicas de algunos medicamentos psicotrópicos. En realidad, ofrecen una variedad de perspectivas bioquímicas en neuropsiquiatría (62)(92). Entonces, por todo lo expresado, la actividad de MAO plaquetaria es un índice de la actividad serotoninérgica cerebral.
Recientemente se dosó MAO plaquetaria en 34 pacientes frente a controles, mediante un método espectrofluorimétrico utilizando kinuramina como sustrato (62).
Dado que el tabaquismo disminuye la actividad la actividad de MAO-B plaquetaria (93), en este tipo de estudios es necesario registrar a los fumadores y el número de cigarrillos que fuman por día. Sin embargo, no se encontró correlación entre la actividad de MAO plaquetaria y el número de cigarrillos diarios (62)(94).
Dado que la actividad de MAO plaquetaria se encuentra bajo la influencia del género (93)(95), edad (56), etnia o raza (96), tabaquismo, alcoholismo (97), enfermedades neurodegenerativas, sustancias psicotrópicas y psicodislépticas (98), medicamentos (99) y el tratamiento con litio o haloperidol, al realizar estudios en humanos es necesario controlar estas características en los sujetos bajo estudio y en los controles. En cuanto al alcoholismo, se ha estudiado (97) su influencia sobre MAO plaquetaria, demostrando que el tabaquismo, y no el alcoholismo, reduce la actividad de MAO-B en sujetos alcohólicos. Los valores normales de MAO plaquetaria se han descripto en la literatura (100).
En especial, MAO plaquetaria es considerada un biomarcador de los diferentes rasgos de personalidad, tales como comportamiento agresivo, adicción, búsqueda de sensaciones, trastornos afectivos, psicosis afectiva y depresión neurótica (99)(101) y se han encontrado niveles alterados de MAO plaquetaria en varias psicopatologías.
Se observó que en pacientes psiquiátricos un porcentaje significativamente grande: 73,5% presenta un marcado descenso en MAO plaquetaria (MAO-B) (62), lo cual está de acuerdo con observaciones previas de disminución en algunos desórdenes mentales y neurodegenerativos, alcoholismo, esquizofrenia, enfermedad de Alzheimer, enfermedad de Parkinson, corea de Huntington, anemia perniciosa (99), trastorno infantil de hiperactividad con déficit de atención (102), pilotos de alto riesgo que admiten el riesgo, veteranos de guerra con trastorno de estrés postraumático (103) relacionado con el combate (94), trastorno obsesivo compulsivo y obsesiones agresivas (61). En cambio, se registraron aumentos de MAO plaquetaria en pacientes depresivos (104).
Recientemente, se ha estudiado la asociación entre el polimorfismo del gen de MAO-A y el suicidio (105).
Las indicaciones clínicas y la eficacia de los IMAOs se establecen para los siguientes trastornos: enfermedad de Parkinson, trastornos depresivos y trastornos de ansiedad (fobia social, trastorno de pánico, trastorno de estrés postraumático). Otros posibles usos terapéuticos e indicaciones pueden ser: dejar de fumar, trastorno de déficit de atención con hiperactividad y déficits cognitivos en demencia para moclobemida (106)(107).
Los inhibidores selectivos de MAO-A (IMAO-A) han demostrado ser eficaces antidepresivos, mientras que algunos IMAO-B resultaron ser beneficiosos en el tratamiento de las enfermedades de Parkinson (108-111) y de Alzheimer (112)(113).
La enfermedad de Alzheimer es un síndrome multifactorial que implica una serie compleja de diferentes, aunque relacionados, factores en su progresión. La acumulación y agregación de b-amiloide en el cerebro parece ser un dato temprano y central en la patogénesis del Alzheimer. El b-amiloide deriva del procesamiento proteolítico de la proteína precursora de amiloide (APP, sigla del inglés: amyloid precursor protein) por b- y g-secretasas. En consecuencia, se desarrollaron nuevas moléculas híbridas con actividad multimodal: i) M30, IMAO-A e IMAO-B selectivo, permeable en el cerebro, con actividad quelante y neuroprotectora, ii) HLA20, un quelante de metales, permeable en el cerebro, con actividad neuroprotectora, iii) HLA20A, un inhibidor de la acetilcolinesterasa con sitio activo quelante y actividad neuroprotectora, iv) M30D, un inhibidor de la acetilcolinesterasa, de MAO-A y de MAO-B con sitio activo quelante y actividad neuroprotectora; y v) análogos del péptido neuroprotector NAPVSIPQ. HLA20A y M30D actúan como pro-quelantes y pueden ser activados para liberar sus respectivos quelantes activos HLA20 y M30 a través de la seudoinhibición de la acetilcolinesterasa (113). Estos fármacos presentan una amplia gama de actividades in vitro e in vivo, con potencia antioxidante-quelante y actividad inhibidora de acetilcolinesterasa, de MAO-A y de MAO-B, así como efectos neuroprotectores/ neurorescatadores. Estos compuestos actúan mediante diversos mecanismos moleculares, como la modulación de expresión/procesamiento del β-amiloide y de la proteína precursora de β-amiloide (APP), la inducción de la detención del ciclo celular, la inhibición de los marcadores de muerte neuronal, y la regulación positiva de factores neurotróficos, así como la activación de las vías de señalización de la proteín-quinasa (113).
La enfermedad de Parkinson (114) es un trastorno que se caracteriza patológicamente por la neurodegeneración progresiva de las células dopaminérgicas de la vía nigroestriatal. La levodopa (3,4-dihidroxifenilalanina: L-dopa) sigue siendo la mejor medicación estándar para el tratamiento de pacientes con enfermedad de Parkinson avanzada. Una vez que emergen las complicaciones motoras después de algunos años de terapia con L-dopa, los médicos pueden añadir otras clases de fármacos antiparkinsonianos, como los agonistas de la dopamina, inhibidores de la catecol-O-metiltransferasa (ICOMTs) o bien, los IMAO-Bs (115).
Se utilizan IMAO-Bs en el tratamiento sintomático de la enfermedad de Parkinson, ya que aumentan la dopamina sináptica mediante el bloqueo de su degradación. Dos IMAO-Bs, selegilina y rasagilina (116-118), se usan actualmente en Europa y América del Norte. Un tercer IMAO-B (safinamida), que también combina propiedades no dopaminérgicas adicionales de beneficio potencial para la enfermedad de Parkinson, se encuentra actualmente en desarrollo en fase III de ensayos clínicos como terapia adyuvante a un agonista de dopamina o a levodopa. Los IMAO-Bs también se han estudiado extensamente por su acción neuroprotectora (119).
Dado que los fármacos aprobados sólo ejercen efectos paliativos y sintomáticos, se está desarrollando una estrategia para el descubrimiento de fármacos modificadores de la enfermedad que se basa en el diseño de ligandos dirigidos a blancos múltiples (MTDL, sigla del inglés: multi-target directed ligand). Este es un cambio innovador del enfoque tradicional de un fármaco-un blanco, teniendo ahora la meta más ambiciosa de un fármaco-blancos múltiples. Recientemente se discutieron la estrategia, el mecanismo de acción y la evaluación biofarmacológica de ligandos multipotentes que presentan inhibición de MAO, como actividad principal con un potencial para el tratamiento de la enfermedades neurodegenerativas (120). En particular, se examinaron los IMAOs que exhiben inhibición adicional de la acetilcolinesterasa o de la óxido nítrico sintasa (NOS), o actividades de modulación de quelación de iones/antioxidante-captación de radicales/anti-inflamatorio/ antagonista de los receptores de adenosina A2A / procesamiento de la proteína precursora de β-amiloide (APP) (120)(121).
Recientemente se estudió el efecto tipo antidepresivo del nuevo IMAO 2-(3,4-dimetoxifenil)-4,5-dihidro-1H-imidazol (2-DMPI) en ratones (122). Se encontró que 2-DMPI inhibió ambas isoformas de MAO, con 30 veces mayor selectividad hacia MAO-A, siendo un IMAO-A reversible con potencial actividad antidepresiva, debido a su efecto modulador sobre los sistemas serotoninérgico y dopaminérgico.
Se conoce una nueva generación de antidepresivos que se utilizan en el tratamiento de la depresión y trastornos relacionados, que corresponde a los inhibidores selectivos de la recaptación de serotonina (SSRIs, sigla del inglés: selective serotonin reuptake inhibitors) (123). Sus características son la eficacia clínica, una buena tolerabilidad y la seguridad relativa en comparación con los "antidepresivos de primera generación", es decir, los antidepresivos clásicos y los IMAOs. Esta clase de fármacos incluye fluoxetina, citalopram, paroxetina, sertralina, fluvoxamina y, desde 2011, vilazodona (124).
Se continúan realizando investigaciones orientadas hacia nuevos IMAOs para palear los efectos de las enfermedades neurodegenerativas y otras de origen psiquiátrico, como así también hacia el diseño de MTDLs para cambiar el paradigma del tratamiento de estas enfermedades.
Poliamino-oxidasas: características, función, sustratos e inhibidores
Las flavoenzimas poliamino-oxidasas pertenecen a la familia de las óxido-reductasas y producen desaminación oxidativa de las poliaminas; por lo tanto, es importante conocer más de estos compuestos, su función fisiológica y su relevancia clínica.
BIOSÍNTESIS DE LAS POLIAMINAS
Las poliaminas son sintetizadas en las células a través de rutas metabólicas muy reguladas. La putrescina se biosintetiza por dos vías diferentes, ambas a partir de la arginina (125).
En una vía, especialmente en plantas y bacterias, la arginina se convierte en agmatina, con una reacción catalizada por la enzima arginina-descarboxilasa (ADC); luego, la agmatina se transforma en carbamilputrescina mediante la agmatina-iminohidroxilasa (AIH). Finalmente, la carbamilputrescina se convierte en putrescina.
En la segunda vía, en humanos y en general en mamíferos, la arginina se convierte en ornitina y luego la ornitina se convierte en putrescina mediante la enzima ornitina- descarboxilasa (ODC) (126) (Fig. 3).

Figura 3. Biosíntesis de las poliaminas
La espermidina se obtiene a partir de putrescina, usando un grupo aminopropilo de descarboxi-S-adenosil-L-metionina (dcSAM). La reacción es catalizada por la espermidina- sintasa (SpdS) (125).
La espermina se obtiene mediante la reacción de espermidina con dcSAM en presencia de la enzima espermina-sintasa (SpmS) (Fig. 3).
FUNCIÓN DE LAS POLIAMINAS
Las poliaminas naturales, como putrescina, espermidina (Spd) y espermina (Spm), son policationes alifáticos ubicuos, con cargas positivas que se encuentran a intervalos regularmente espaciados. Como cationes, se unen a los polianiones intracelulares, como los ácidos nucleicos y ATP, modulando sus funciones (127). Se encuentran en cada célula viva en cantidades que varían apreciablemente. Se sabe también que actúan como promotores del cambio de marco ribosomal programado durante la traducción (128).
Las poliaminas son esenciales para las funciones celulares normales (129) (130). Estos compuestos están muy regulados; mantienen la estructura y función del ADN como inmunomoduladores y como antioxidantes. En realidad, las poliaminas desempeñan numerosas y relevantes funciones bioquímicas y fisiológicas (131)(132).
Desde hace tiempo se sabe que tienen una acción similar a la insulina, pero su efecto antiglicante, sólo recientemente ha llamado la atención de los investigadores, relacionándolas en humanos con los perfiles glucémicos (133).
La identificación de elevadas concentraciones de poliaminas en una variedad de enfermedades, desde cáncer y psoriasis hasta infecciones parasitarias, ha conducido a la hipótesis de que la manipulación del metabolismo de las poliaminas es un blanco para la intervención terapéutica o preventiva en el tratamiento de ciertas enfermedades (134).
Si se inhibe la síntesis celular de las poliaminas, el crecimiento celular se detiene o se retrasa severamente, pero se restaura con la provisión de poliaminas exógenas. La mayoría de las células eucariotas tienen un sistema transportador de poliaminas en su membrana celular que facilita la internalización de las poliaminas exógenas. Este sistema es muy activo en las células que proliferan rápidamente y es el blanco de algunos agentes quimioterapéuticos actualmente en desarrollo (135).
Las poliaminas son también importantes moduladores de una variedad de canales iónicos, incluyendo los receptores NMDA (N-metil-D-aspartato), y los receptores AMPA [también conocidos como receptores para quisqualato (ácido α-amino-3,5-dioxo-1,2,4-oxadiazolidina-2-propanoico)]. Bloquean los canales de potasio rectificadores hacia adentro, de manera que las corrientes de los canales son rectificadas interiormente, con lo que se conserva la energía celular, es decir, el gradiente iónico de K+ a través de la membrana celular.
Las poliaminas pueden acrecentar la permeabilidad de la barrera hemato-encefálica (136).
En las plantas están involucradas en la modulación de la senescencia de los órganos y por lo tanto, se las considera como una hormona vegetal (137).
ENZIMAS QUE ACTÚAN EN EL METABOLISMO DE LAS POLIAMINAS
Las enzimas que actúan en el metabolismo de las poliaminas se denominan genéricamente poliamino-oxidasas y, como hemos indicado, pertenecen a la familia de las oxidorreductasas, específicamente las que actúan sobre el grupo CH-NH de donores con oxígeno como aceptor (desaminantes). Poseen dos cofactores: FAD y hierro.
Existen varias poliamino-oxidasas, que están presentes en plantas, bacterias y mamíferos; se han caracterizado y estudiado sus estructuras.
Durante mucho tiempo, la poliamino-oxidasa (PAO) fue considerada como una enzima registrada con EC 1.5.3.11. Dado que se han encontrado diferentes tipos de actividad y reacciones enzimáticas, desde 2009 ha sido reemplazada por: EC 1.5.3.13: N1-acetilpoli-amino-oxidasa, EC 1.5.3.14: poliamino-oxidasa (forma propano-1,3-diamina), EC 1.5.3.15: N8-acetilespermidina-oxidasa (forma propano-1,3-diamina), EC 1.5.3.16: espermina-oxidasa y EC 1.5.3.17: poliamino-oxidasa no específica, según la nomenclatura de enzimas de IUBMB (sigla del inglés: International Union of Biochemistry and Molecular Biology). También se conoce la putrescina-oxidasa de bacterias (EC 1.4.3.10).
Hasta el momento, las más importantes en humanos son: N1-acetilpoliamino-oxidasa [EC 1.5.3.13] llamada PAO, hPAO o APAO y espermina-oxidasa [EC 1.5.3.16] denominada SMO.
Ø N1-Acetilpoliamino-oxidasa peroxisomal humana (PAO, hPAO o APAO):
La N1-acetilpoliamino-oxidasa [PAO, hPAO o APAO; EC 1.5.3.13; nombre sistemático: N1-acetilpoliamina:oxígeno oxidorreductasa (forma 3-acetamidopropanal)] es una flavoproteína (FAD), codificada por el gen PAOX, que se encuentra en los peroxisomas de los mamíferos y oxida poliaminas N1-acetiladas en el lado exo (tres carbonos) de la amina secundaria, formando 3-acetamidopropanal (138) (139). Dado que los productos de las reacciones son poliaminas desacetiladas, este proceso se conoce como retroconversión a la poliamina (140).
Cataliza las siguientes reacciones:
1) N1-Acetilespermidina + O2 + H2O Putrescina + 3-Acetamidopropanal + H2O2
2) N1-Acetilespermina + O2 + H2O Espermidina + 3-Acetamidopropanal + H2O2
3) N1,N12-Diacetilespermina + O2 + H2O N1-Acetilespermidina + 3-Acetamidopropanal + H2O2 (140).
No hay actividad o muy débil con espermina, ni con espermidina en ausencia de aldehídos. En presencia de aldehídos la enzima cataliza las reacciones:
4) Espermina + O2 + H2O Espermidina + 3-Aminopropanal + H2O2,
y con débil eficiencia:
5) Espermidina + O2 + H2O Putrescina + 3-Aminopropanal + H2O2
Esta enzima recibe también otros nombres: hPAO-1; PAO (ambiguo); mPAO; hPAO (141). Difiere en especificidad de: poliamino-oxidasa (EC 1.5.3.14), N8-acetilespermidina-oxidasa (EC 1.5.3.15), espermina-oxidasa (EC 1.5.3.16) y poliamino-oxidasa no específica (EC 1.5.3.17).
Ø Poliamino-oxidasa de plantas vasculares
La poliamino-oxidasa (forma propano-1,3-diamina) [EC 1.5.3.14; nombre sistemático: espermidina:oxígeno oxidorreductasa (forma propano-1,3-diamina)] es una flavoproteína (FAD) que se encuentra principalmente en plantas como maíz (Zea mays) y tabaco (Nicotiana tabacum) (142). Por ello, recibe también los nombres de MPAO y PAO de maíz. Cataliza la reacción:
Espermidina + O2 + H2O Propano-1,3-diamina + 4-Aminobutanal + H2O2
Como los productos de reacción no se pueden convertir directamente en otras poliaminas, se considera que esta clase de poliamino-oxidasas está implicada en el catabolismo terminal de las poliaminas (142)(143). Interviene en la ruta de degradación II de espermina y espermidina. Esta enzima cataliza menos eficientemente la oxidación de N1-acetilespermina y espermi na. Difiere en especificidad de las otras poliamino-oxidasas nombradas anteriormente.
Ø N8-acetilpoliamino-oxidasa de Amoebozoa (protistas del suelo y agua dulce):
La N8-acetilpoliamino-oxidasa [EC 1.5.3.15; nombre sistemático: N8-acetilespermidina: oxígeno oxidorreductasa (forma propano-1,3-diamina)]. Se ha encontrado en Acanthamoeba culbertsoni (144). Cataliza la reacción:
N8-Acetilespermidina + O2 + H2O Propano-1,3-diamina + 4-Acetamidobutanal + H2O2
También tiene actividad con N1-acetilespermina y débil actividad con N1,N12-diacetil-espermina. No hay actividad con diaminopropano, putrescina, cadaverina, diaminohexano, norespermidina, espermina y espermidina. Ausencia de actividad de MAO (EC 1.4.3.4).
Ø Espermina-oxidasa citosólica humana (SMO):
La espermina-oxidasa o SMO [EC 1.5.3.16; nombre sistemático: Espermina:oxígeno oxidoreductasa (forma espermidina)] es una flavoproteína (FAD) que se encuentra en plantas y en mamíferos. La enzima de mamíferos, codificada por el gen SMOX, es una enzima citosólica que cataliza la oxidación de espermina en el lado exo (tres carbonos) de la amina (145)(146). La enzima de Arabidopsis thaliana (AtPAO1) oxida norespermina a norespermidina con una alta eficiencia (147).
Esta enzima cataliza las siguientes reacciones:
Espermina + O2 + H2O Espermidina + 3-Aminopropanal + H2O2 (Homo sapiens)
N1-Acetilespermina + O2 + H2O Espermidina + 3-Acetamidopropanal + H2O2
No hay actividad con espermidina. Actividad débil con N1-acetilespermina.
Esta enzima recibe también otros nombres: PAOh1/SMO; PAOh1 (ambiguo); AtPAO1; AtPAO4; mSMO; SMO(PAOh1); SMO/PAOh1; SMO5; mSMOmu (148). Difiere en especificidad de las otras enzimas mencionadas. SMO es la enzima metabólica de las poliaminas más recientemente caracterizada.
Se han llevado a cabo estudios mecanísticos con la enzima SMO recombinante humana. El patrón de velocidad inicial, en la que se mantiene constante la relación entre las concentraciones de espermina y oxígeno, establece el patrón cinético del estado estacionario como ping-pong. La reducción de SMO por espermina en ausencia de oxígeno es bifásica (149).
Los productos de la reacción catalizada por SMO, es decir, peróxido de hidrógeno (H2O2) y 3-aminopropanal, y en particular el primero, han sido implicados en las respuestas celulares citotóxicas a análogos específicos de poliaminas antitumorales, así como en la generación de daño en el ADN, asociado con inflamación. Se ha descripto recientemente un método rápido, sensible y barato para la medición quimioluminiscente de la actividad enzimática de SMO (o, alternativamente, N1-acetilpoliamino-oxidasa, APAO) en lisados de células cultivadas, sin necesidad de reactivos radioactivos o el uso de cromatografía líquida de alta resolución (HPLC, sigla del inglés: high performance liquid chromatography) (150). Específicamente, la producción de peróxido de hidrógeno (H2O2) por SMO está acoplada a la quimioluminiscencia generada por la oxidación, catalizada por peroxidasa de rábano, de luminol (150).
Ø Poliamino-oxidasas no específicas:
Las poliamino-oxidasas específicas se clasifican como hemos visto en: EC 1.5.3.13, EC 1.5.3.14, EC 1.5.3.15 y EC 1.5.3.16. Pero también existen las llamadas poliamino-oxidasas no específicas [EC 1.5.3.17; nombre sistemático: poliamina:oxígeno oxidoreductasa (forma 3-aminopropanal o 3-acetamidopropanal)], que son flavoproteínas (FAD), que catalizan las siguientes reacciones:
1) Espermina + O2 + H2O Espermidina + 3-Aminopropanal + H2O2
2) Espermidina + O2 + H2O Putrescina + 3-Aminopropanal + H2O2
3) N1-Acetilespermina + O2 + H2O Espermidina + 3-Acetamidopropanal + H2O2
4) N1-Acetilespermidina + O2 + H2O Putrescina + 3-Acetamidopropanal + H2O2
Las poliamino-oxidasas no específicas pueden diferir entre sí considerablemente. La enzima de Saccharomyces cerevisiae muestra una especificidad más bien amplia y también oxida N8-acetilespermidina (151). La enzima de Ascaris suum muestra una alta actividad con espermina y espermidina, pero también oxida norespermina (152). La enzima de Arabidopsis thaliana muestra alta actividad con espermidina, pero también oxida otras poliaminas (153).
Estas enzimas reciben también otros nombres: poliamino-oxidasa (ambiguo); Fms1 (de levadura); AtPAO3 (de A. thaliana).
Ø Putrescina-oxidasa de bacterias:
La putrescina-oxidasa [EC : 1.4.3.10; nombre sistemático: putrescina:oxígeno oxidorreductasa (desaminante)] es una flavoproteína (FAD) que cataliza la reacción:
Putrescina + O2 + H2O 4-aminobutanal + NH2 + H2O2
El 4-aminobutanal formado se condensa posteriormente de manera no enzimática para dar 1-pirrolina. Esta entrada fue creada en 1976. La enzima se describió en Micrococcus rubens (154)(155). Continúa como tal.
METABOLISMO DE LAS POLIAMINAS:
El contenido intracelular de las poliaminas se incrementa en respuesta a estímulos de crecimiento (156) y se regula mediante la biosíntesis y la degradación (157). La captación y la exportación también desempeñan roles importantes en la regulación de los niveles de las poliaminas celulares (157).
En la Fig. 4 se muestra el metabolismo de las poliaminas a nivel celular (158). Se puede observar que las enzimas del tipo de poliamino-oxidasas son PAO (o APAO) y SMO que son peroxisomal y citosólica respectivamente (159).
El metabolismo en humanos se inicia con el aminoácido arginina. El metabolismo de la arginina, que es producida en el ciclo de la urea, a través de la acción de la arginasa, da como resultado la producción de ornitina (Fig. 4) (no se muestran otros detalles del ciclo de la urea). Se requiere ornitina descarboxilasa (ODC) para el primer paso en la síntesis de poliaminas, en la que la ornitina se descarboxila para dar putrescina (160)(161). La descarboxilación de la S-adenosilmetionina (SAM), por S-adenosilmetionina descarboxilasa (SamDC) produce SAM descarboxilada (dcSAM), que dona su grupo aminopropilo para la formación de espermidina y espermina mediante las respectivas enzimas, SpdS y SpmS (158)
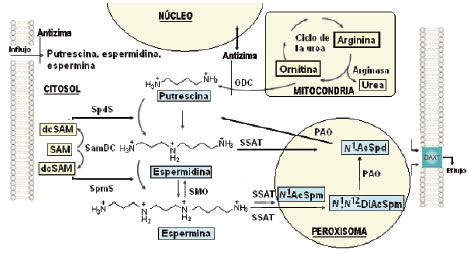
Figura 4. Metabolismo de las poliaminas a nivel celular. N1-AcSpm: N1-acetilespermina; N1,N12-DiAcSpm: N1,N12-diacetilespermina, dcSAM: SAM descarboxilada, ODC: ornitina-descarboxilasa, PAO: poliamino-oxidasa, SAM: S-adenosilmetionina, SamDC: SAM-descarboxilasa, SMO: Spm-oxidasa, Spd: espermidina, Spm: espermina, SSAT: Spd/Spm-N1-acetiltransferasa.
La espermidina/espermina N1-acetiltransferasa (SSAT) es una propilamina acetiltransferasa que monoacetila la espermidina y puede mono- o diacetilar a la espermina (162). Estas poliaminas acetiladas tienen al menos dos destinos potenciales. Las diaminas y las poliaminas acetiladas son sustratos para exportar mediante el transportador putativo exportador de diaminas (DAX, sigla del inglés: diamine exporter) y luego son eliminados en orina. La espermidina y la espermina acetiladas también son sustratos para una poliamino-oxidasa flavina-dependiente (PAO o APAO), que cataliza la retroconversión a putrescina. Recientemente ha sido caracterizada SMO, que puede oxidar a la espermina no acetilada, aunque su papel fisiológico no ha sido totalmente establecido. La putrescina, la espermidina y la espermina pueden ser también importadas desde los compartimentos extracelulares a través de un mecanismo de transporte que no está bien definido, aunque se ha avanzado recientemente en su conocimiento (163).
En los últimos años, se identificaron los transportadores de poliamina en bacterias, levaduras y protozoarios, y se estudiaron sus propiedades. En Escherichia coli, la captación de las poliaminas está mediada por tres sistemas: el sistema PotABCD de captación preferencial de espermidina (164)(165), el sistema Pot-FGHI de captación específica de putrescina (166) y PuuP (167). La exportación de las poliaminas está mediada por PotE (168) y CadB (169) y MdtJI (170) en E. coli. Blt es un exportador de poliaminas en Bacillus subtilis (171). En Saccharomyces cerevisiae, la captación de poliaminas está mediada por DUR3, SAM3, GAP1 (172)(173), y AGP2 (174) en la membrana plasmática y UGA4 en las membranas vacuolares (175). Los cuatro transportadores TPO1-4 en la membrana plasmática (176-178) y TPO5 en las vesículas secretoras de post-Golgi (179) son exportadores de poliaminas en la levadura. Se describió un transportador de membrana plasmática de las poliaminas, LmPot1, en el parásito protozoario Leishmania major (180). En estos organismos unicelulares, el transporte de las poliaminas incluye canales de proteínas.
En las células animales, la captación de poliaminas está mediada, al menos en parte, por un mecanismo endocítico caveolar-dependiente (181) y está regulado positivamente por K-RAS a través de la fosforilación de la proteína caveolina-1 (182). La exportación de las diaminas putrescina y cadaverina fue estudiada en varias células (183-186). En cambio, la exportación de las poliaminas a nivel molecular se caracterizó, sólo recientemente, en células de origen animal (163).
Se describieron las propiedades bioquímicas de DAX en células de ovario de hámster chino (CHO) (187) y las células CHO aisladas putrescina-tolerantes (CHO-T) que parecen exportar putrescina a una mayor velocidad que las células sensibles (188). Para abordar este mecanismo molecular, se compararon las proteínas de membrana de las células CHO-T con las de las células CHO normales, putrescina-sensibles (CHO-S) y se encontró SLC3A2, un miembro de la familia transportadora de solutos (189), como una de las proteínas altamente expresada en las células CHO-T (163). Se evaluó el rol de SLC3A2 en el transporte de las poliaminas en una línea celular de cáncer de colon humano (163).
El catabolismo de las poliaminas (Fig. 5) también juega un rol destacado en el balance de salud/enfermedad (159)(190). La expresión de las enzimas catabólicas SSAT y SMO aumenta después de lesiones y este aumento de la respuesta catabólica contribuye al daño tisular (191) y a enfermedades definidas.

Figura 5. Catabolismo de las poliaminas mediante la acción de las amino-oxidasas. DAO: diamino-oxidasa; GABA: ácido γ-aminobutírico; PAO: poliamino-oxidasa; PDH: pirrolina deshidrogenasa.
SMO cataliza la degradación de la espermina a espermidina, generando peróxido de hidrógeno y aminoaldehídos. SSAT cataliza la acetilación de estas poliaminas, y ambas se oxidan adicionalmente en una reacción que genera putrescina, peróxido de hidrógeno y aminoaldehídos. Malondialdehído (MDA) y acroleína (CH2 = CHCHO), agentes potencialmente tóxicos, que inducen estrés oxidativo en las células de mamíferos, se forman luego espontáneamente a partir de los aminoaldehídos. Acroleína y peróxido de hidrógeno (H2O2) se encuentran entre los productos metabólicos de espermina y espermidina, siendo la acroleína más tóxica que el peróxido de hidrógeno.
La actividad de SSAT proporciona sustratos para APAO o sustratos para el exportador de poliaminas, reduciendo así la concentración intracelular de las mismas; el efecto neto de ésto depende de la magnitud y la velocidad de cualquier aumento en SSAT. SSAT también puede influir en el metabolismo celular a través de la interacción con otras proteínas y mediante la perturbación del contenido de acetil-CoA y ATP (192).
En la Fig. 6 se muestra la interacción del metabolismo de las poliaminas con la histamina.
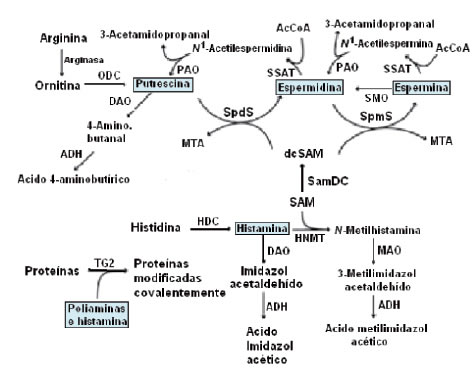
Figura 6. Interacción entre el metabolismo de las poliaminas y la histamina y las principales enzimas involucradas. ADH: aldehído-deshidrogenasa, DAO: diamino-oxidasa, HDC: histidina-descarboxilasa, HNMT: histamina-N-metiltransferasa, MAO: monoamino-oxidasa, MTA: 5'-metiltioadenosina, ODC: ornitina-descarboxilasa, PAO: poliamino-oxidasa, SAM: S-adenosilmetionina, SamDC: S-adenosilmetionina-descarboxilasa, SMO: espermina-oxidasa, SSAT: espermidina/espermina-N1-acetiltransferasa, SpdS: espermidina-sintasa, SpmS: espermina-sintasa, TG2: transglutaminasa tipo 2.
SIGNIFICANCIA CLÍNICA DE LAS POLIAMINAS Y LAS ENZIMAS DE SU METABOLISMO
Las poliaminas y las enzimas que intervienen en su metabolismo desempeñan funciones relevantes en los procesos de envejecimiento y en el desarrollo de algunas enfermedades, como cáncer, diabetes mellitus, acci dentes cerebro-vasculares, insuficiencia renal y trastornos psiquiátricos definidos (193-195).
Ø Amino-oxidasas en la apoptosis y el cáncer. Rol de las poliaminas
Se ha demostrado que las amino-oxidasas participan en la inhibición y progresión del crecimiento del cáncer, especialmente debido a los aldehídos, peróxido de hidrógeno y otras especies reactivas de oxígeno, productos de la desaminación oxidativa de las aminas biogénicas por amino-oxidasas.
Las amino-oxidasas participan en la inhibición del crecimiento del cáncer debido al mayor contenido de aminas biogénicas en las células tumorales con respecto a las normales (196). El efecto citotóxico se puede explicar por el daño a las membranas y/o núcleos celulares o, indirectamente, a través de la modulación de la transición de la permeabilidad de la membrana y, por lo tanto, la apoptosis. Los productos de oxidación de las aminas biogénicas parecen ser también cancerígenos, mientras que la acroleína, producida a partir de la oxidación de espermina y espermidina, es un compuesto clave tanto cancerígeno como citotóxico. El balance de las amino-oxidasas y de las enzimas antioxidantes es crucial para la inhibición o la progresión del cáncer. Un desequilibrio de larga duración de estas enzimas parece ser carcinogénico, mientras que, en el de corto tiempo, las amino-oxidasas son citotóxicas para las células cancerosas (196).
Las poliaminas se han asociado desde hace tiempo con el crecimiento celular y el cáncer, y oncogenes específicos y genes supresores de tumores regulan el metabolismo de estas sustancias (197)(198). En las células normales, los niveles de poliaminas están muy controlados mediante las enzimas biosintéticas y catabólicas que hemos visto. Anomalías múltiples en el control del metabolismo y en la captación de las poliaminas pueden ser responsables del aumento de sus niveles en las células cancerígenas en comparación con los observados en las normales. Por eso es necesario conocer la biosíntesis, el catabolismo y las vías de transporte de las poliaminas, así como las funciones de estos compuestos, para evaluar la posibilidad de utilizar su metabolismo o su funcionalidad como blancos en la terapia del cáncer (199).
La inhibición de la síntesis de las poliaminas resultó ser ineficaz como estrategia contra el cáncer en ensayos clínicos, pero es útil en la quimioprevención del cáncer en estudios preclínicos (199).
El aumento de las poliaminas en las células malignas y proliferativas atrajo el interés en las últimas déca das, por lo que se consideró su disminución como una nueva estrategia para inhibir el crecimiento celular. Por ello, se desarrollaron inhibidores selectivos enzimáticos para disminuir el metabolismo de las poliaminas y actuar como agentes anticancerígenos quimioterapéuticos. Recientemente, las investigaciones se enfocaron en SMO, que es la única enzima catabólica capaz de oxidar específicamente a la espermina. Es de interés que, la ausencia de espermina es compatible con la vida, pero su acumulación y degradación es letal (200). El aumento de la actividad de SMO provoca gran estrés oxidativo y sus consecuencias. La espermina extra-celular es citotóxica, pero sus análogos son capaces de inhibir el crecimiento celular a bajas concentraciones, muy probablemente por disminución de la espermina intracelular. Por lo tanto, alterar el metabolismo de la espermina podría permitir una estrategia terapéutica multi-tarea, dirigida no sólo a inhibir el metabolismo de las poliaminas. Varias tetraminas se encuentran actualmente en las fases iniciales (I y II) de los ensayos clínicos, y deberán esperarse unos cuantos años más para entender si los enfoques terapéuticos relacionados con la espermina son beneficiosos para los protocolos de tratamiento de cáncer (200).
El desarrollo de los inhibidores de una única enzima en la biosíntesis de las aminas, como a-difluorometilornitina (DFMO) y metilglioxal bis(guanilhidrazona), resultó promisorio in vitro, pero fracasó in vivo. A pesar de esto, DFMO se encuentra actualmente en uso, como un eficaz agente antiparasitario y recientemente también se ha demostrado que tiene además potencial como un agente quimiopreventivo en el cáncer colorrectal (134). Los resultados in vitro llevaron al desarrollo y ensayo de otros inhibidores potenciales de la vía biosintética, como es el caso de los análogos de las poliaminas, los cuales han tenido mayor éxito que los inhibidores de la enzima única, posiblemente debido a sus múltiples blancos. Estos incluyen la disminución de la biosíntesis de las poliaminas a través de la inhibición de las enzimas ODC y SamDC, así como la disminución de la captación de poliaminas. Estos hechos, junto con una mayor actividad de las enzimas catabólicas, PAO y SSAT, y el aumento de la exportación de poliaminas ha hecho a los análogos más efectivos en el debilitamiento de los reservorios de poliaminas, por lo que pueden convertirse en una parte importante de los futuros regímenes quimioterapéuticos y/o quimiopreventivos (134).
Ø Poliaminas y cáncer de próstata
Los altos niveles de ROS presentes en los epitelios de la próstata humana son un importante factor etiológico en la ocurrencia, la recurrencia y la progresión del cáncer de próstata. Se demostró que los andrógenos inducen una sobreexpresión de SSAT que es la enzima limitante de la velocidad de oxidación de las poliaminas (201). Como los epitelios de la próstata producen un gran exceso de poliaminas, su oxidación, inducida por andrógenos, produce peróxido de hidrógeno que causa los altos niveles de ROS en esos epitelios. Un inhibidor de poliamino-oxidasa, como es la N,N'-butanodienilbutanodiamina (MDL 72.527 o CPC-200) bloquea eficazmente el estrés oxidativo (producción de ROS) inducido por andrógenos en las células de cáncer de próstata humano y retrasa de manera significativa la progresión de este cáncer en el adenocarcinoma transgénico del modelo de próstata de ratón, así como la muerte en animales que desarrollan cáncer de próstata espontáneamente (201).
Los análogos N-alquilados de las poliaminas son potenciales drogas contra el cáncer y también, antiparasitarias. Recientemente, Häkkinen et al. (202) estudiaron la degradación de tres diferentes análogos de espermina: N,N'-bis(3-etilaminopropil)butano-1,4-diamina (DESPM), N-(3-bencilaminopropil)-N'-(3-etilaminopropil)butano-1,4-diamina (BnEtSPM) y N,N'-bis(3-bencilaminopropil)butano-1,4-diamina (DBSPM) y los correspondientes derivados mono-alquilados como sustratos de APAO recombinante humana y SMO. Además, se estudió la degradación de DESPM, BnEtSPM o DBSPM en la línea celular DU145 de carcinoma de próstata. Los datos mostraron que SMO inducible en paralelo con APAO podría desempeñar un rol importante en la acción de fármacos basados en poliaminas, teniendo un impacto significativo en la eficacia de estos fármacos, y por lo tanto para el desarrollo de nuevos análogos N-alquilados de poliaminas (202).
Ø Poliaminas y cáncer de mama
El metabolismo de las poliaminas tiene un papel crítico en la muerte y la proliferación celular representando un blanco potencial para la intervención en el cáncer de mama. Asimismo, los análogos de las poliaminas han demostrado una actividad significativa contra líneas celulares de cáncer de mama humano, solos o en combinación con otros fármacos citotóxicos.
Recientemente se investigó la expresión de SMO y su significado en el pronóstico del cáncer de mama. También se realizó el análisis bioquímico de los análogos de espermina, BENSpm y CPENSpm, utilizados en la terapia contra el cáncer, con el objeto de ensayar su propiedad in silico e in vitro en la enzima recombinante SMO (203).
Las muestras de tejidos de cáncer de mama fueron analizadas por el nivel de transcripción de SMO y de su actividad. Se examinó el análisis de modelado estructural de los complejos de BENSpm y CPENSpm formados con la enzima SMO y sus propiedades de inhibición, ensayada en experimentos in vitro.
Tanto el nivel de expresión de ARNm de SMO como la actividad enzimática de SMO fueron significativamente inferiores en las muestras de cáncer de mama en comparación con las de tejido normal. BENSpm y CPENSpm resultaron buenos inhibidores según el mo delado de los complejos que forman con SMO y sus propiedades de inhibición.
Se demostró así que la disminución en la expresión de SMO es un marcador negativo en cáncer de mama. La inducción de SMO es un blanco quimioterapéutico notable. Las propiedades de inhibición mostradas por los análogos permitieron explicar los pocos resultados positivos obtenidos en las Fases I y II de los ensayos clínicos (203).
Recientemente, se evaluó la capacidad del análogo N1,N11-bis(etil)norespermina (BENSpm), para crear una sinergia con seis agentes quimioterápicos estándares: 5-fluorouracilo (FU), fluorodesoxiuridina, cis-diaminocloroplatino(II) (C-DDP), paclitaxel, docetaxel y vinorelbina (204). Se utilizaron cuatro líneas celulares de cáncer de mama humano (MDA-MB-231, MCF-7, Hs578t, y T47D) y una línea celular epitelial mamaria inmortalizada, no tumorigénica (MCF-10A) en los estudios de combinación in vitro con BENSpm y fármacos citotóxicos. Se usaron modelos de ratones de xenoinjertos generados con células MDA-MB-231 para los estudios in vivo con BENSpm y paclitaxel.
Los resultados mostraron que BENSpm exhibió efecto sinérgico inhibitorio sobre la proliferación celular en combinación con 5-FU o paclitaxel en las líneas celulares de cáncer de mama humano, MDA-MB-231 y MCF-7, y fue antagonístico o bien menos eficaz en la línea celular MCF-10A no-tumorigénica. El sinergismo fue mayor con 120 h de tratamiento concomitante o pre-tratamiento con BENSpm durante 24 h seguido de un tratamiento concomitante durante 96 h adicionales.
Dado que los efectos citotóxicos de los muchos análogos de las poliaminas y agentes citotóxicos se cree que actúan, en parte, mediante la inducción de las enzimas catabólicas SSAT y SMO, se las evaluó en la respuesta sinérgica en MDA-MB-231 y MCF 7- tratados con BENSpm y 5-FU o paclitaxel. En las células MCF-7, sólo SSAT pareció estar involucrada en la respuesta a estos tratamientos. En un esfuerzo para traducir los estudios de combinación desde in vitro a in vivo, y para formar una base para el ajuste clínico, se evaluó la eficacia terapéutica in vivo de BENSpm solo y en combinación con paclitaxel en la regresión del tumor en los ratones modelo. La exposición intraperitoneal a BENSpm o taxol solos y en combinación durante 4 semanas causó una inhibición significativa del crecimiento del tumor. Estos hallazgos ayudan a elucidar los mecanismos implicados en la respuesta sinérgica al fármaco y a apoyar las combinaciones de análogos de poliaminas con agentes quimioterapéuticos, que podrían potencialmente ser utilizados en el tratamiento de cáncer de mama (204).
Ø Alteraciones en el metabolismo de las poliaminas causadas por la infección por Helicobacter pylori.
Helicobacter pylori es una bacteria Gram-negativa que infecta el estómago de la mitad de la población de todo el mundo. La colonización es seguida por la infiltración de la mucosa gástrica por linfocitos y células mieloides. Estas células son activadas por varios factores bacterianos, haciendo que se produzcan mediadores inmunes/inflamatorios, incluyendo especies reactivas de nitrógeno y poliaminas que contribuyen al daño celular y a la patogénesis del cáncer gástrico asociado al H. pylori. Experimentos in vitro revelaron que H. pylori induce la producción de macrófagos de poliaminas mediante el aumento de la vía metabólica arginasa/ODC y aumenta la síntesis de peróxido de hidrógeno a través de la actividad de SMO. Gobert et al. (205) presentaron recientemente los métodos para analizar la inducción y el rol de las enzimas arginasa, ODC y SMO en macrófagos infectados con H. pylori.
La carcinogénesis gástrica inducida por H. pylori se ha relacionado con el gen A, asociado a la citotoxina, de la oncoproteína microbiana (CagA, sigla del inglés: cytotoxin-associated gene A). SMO metaboliza espermina en espermidina y genera peróxido de hidrógeno, el cual provoca apoptosis y daños en el ADN. Recientemente, se determinó que los efectos patógenos de CagA son atribuibles a SMO (206).
Se midieron los niveles de SMO, la apoptosis y el daño en el ADN (8-oxoguanosina) en líneas celulares epiteliales gástricas infectadas con cepas cagA (+) o cagA (-) de H pylori, o transfectadas con un plásmido de expresión CagA, en ausencia o presencia de ARN de interferencia de SMO, o de un inhibidor de SMO. Se evaluó el rol de CagA en la inducción de SMO y el daño al ADN en los tejidos de gastritis infectados con H. pylori procedentes de humanos, jerbos y ratones tipo salvaje y ratones hipergastrinémicos insulina-gastrina, usando inmunohistoquímica y citometría de flujo.
Los resultados mostraron que las cepas cagA (+) o expresión ectópica de CagA, pero no las cepas cagA (-), llevaron a un aumento de los niveles de SMO, apoptosis y daño del ADN en las células epiteliales gástricas y el knock-down o la inhibición de SMO bloqueó la apoptosis y el daño en el ADN. Todos los resultados en su conjunto, mostraron que, mediante la inducción de SMO, CagA de H. pylori genera células con daño oxidativo del ADN, y una subpoblación de estas células son resistentes a la apoptosis y por lo tanto presentan un alto riesgo de transformación maligna (206).
Ø Poliaminas y lesiones cerebrales traumáticas
La homeostasis de las poliaminas se interrumpe después de lesiones cerebrales y en varias patologías cerebrales, con la generación concomitante de metabolitos tóxicos que pueden contribuir a lesiones secundarias (207)(208). Para probar la hipótesis del aumento del catabolismo de las poliaminas cerebrales tras un traumatismo craneoencefálico, Zahedi et al. (191) determinaron los cambios en las enzimas catabólicas y los niveles de las poliaminas en el cerebro de rata después del impacto del traumatismo cerebral cortical lateral controlado.
En ese modelo en rata, el ARNm de SSAT aumentó subagudamente (6-24 h) después de la lesión cerebral traumática en la corteza ipsilateral (cortex ipsilateral) y en el hipocampo. Los niveles de ARNm de SMO se elevaron más tarde, de 3 a 7 días después de la lesión. El catabolismo de las poliaminas aumentó también. Los niveles de espermina fueron normales a las 6 h y disminuyeron ligeramente a las 24 h, pero fueron normales otra vez a las 72 h después de la lesión. Los niveles de espermidina también disminuyeron ligeramente (6-24 h), luego se incrementaron en aproximadamente un 50% a las 72 h después de la lesión. En cambio, los niveles de putrescina, normalmente bajos, aumentaron hasta seis veces (6-72 h) después de la lesión. Además, la N-acetilespermidina (pero no la N-acetilespermina) fue detectable (24-72 h) cerca del sitio de la lesión, consistente con la actividad mayor de SSAT. Ninguno de estos cambios se observó en el hemisferio contralateral. La confirmación inmunohistoquímica indicó que SSAT y SMO se expresaron en todo el cerebro. La inmunorreactividad de SSAT (SSAT-ir) aumentó en las poblaciones tanto neuronal como no neuronal (probablemente glial) ipsilateral a la lesión. Es de interés que los aumentos bilaterales en la SSAT-ir de las neuronas corticales se produjeron a las 72 h después de la lesión, mientras que los cambios del hipocampo ocurrieron sólo ipsolateralmente. Aumentos prolongados en el catabolismo de las poliaminas cerebrales son la causa probable de la pérdida de la homeostasis en esta vía (191). La importancia de este tipo de estudios reside en el potencial de las intervenciones terapéuticas simples, como por ejemplo: suplementación de poliaminas o inhibición de la oxidación de las mismas.
Ø Poliaminas en la insuficiencia renal
Se determinaron los niveles de las poliaminas: putrescina, espermidina y espermina y de poliamino-oxidasa en plasma de pacientes con insuficiencia renal crónica (209).
El nivel de putrescina se incrementó, pero el nivel de espermina disminuyó en el plasma de estos pacientes. Los pacientes también presentaron un aumento de la actividad de poliamino-oxidasa plasmática lo cual llevó a una mayor degradación de espermina. Como la acroleína es el principal compuesto tóxico producido a partir de espermina por la poliamino-oxidasa, también se midieron los niveles de acroleína libre y conjugada con proteína en plasma. Los niveles de acroleína aumentaron en el plasma de los pacientes con insuficiencia renal crónica. La acroleína acumulada, encontrada en forma de conjugados de proteínas, fue equivalente a 170 mM, que fue aproximadamente 5 veces mayor que en el plasma de los sujetos normales.
Se encontró que la acroleína se produce principalmente mediante SMO en el plasma. Se observó un aumento de putrescina, SMO y acroleína en plasma en todos los casos de nefropatía diabética, glomerulonefritis crónica y nefroesclerosis. Después que los pacientes con insuficiencia renal crónica se sometieran a hemodiálisis, sus niveles de poliaminas plasmáticas, SMO y acroleína volvieron a la normalidad. Es probable que la acroleína producida a partir de espermina se acumule en la sangre, debido a la disminución de la excreción en orina, y funcione como una "toxina" urémica (209).
Acroleína y peróxido de hidrógeno (H2O2) se encuentran entre los productos metabólicos de espermina y espermidina, siendo la primera más tóxica. Se analizó si la acroleína podría ser un marcador bioquímico para el accidente cerebrovascular (infarto cerebral) y la insuficiencia renal crónica. Dado que la acroleína reacciona rápidamente con las unidades de lisina en la proteína, se midió la acroleína conjugada con proteína (PC-Acro, sigla del inglés: protein-conjugated acrolein:) (210). PC-Acro se incrementó en el locus de infarto cerebral y en plasma en un modelo ratón de accidente cerebrovascular involucrando trombosis inducida fotoquímicamente. Se encontró que un aumento de PC-Acro en plasma es un buen marcador bioquímico en pacientes con accidente cerebro-vascular o con insuficiencia renal crónica. Se describieron los procedimientos para medir PC-Acro y poliamino-oxidasas (SMO y APAO), y su aplicación como marcadores en el accidente cerebrovascular e insuficiencia renal crónica (210).
En realidad, el rol de las poliaminas en la fisiología renal sólo se conoce parcialmente. Además, la mayoría de los datos sobre las enzimas del metabolismo de las poliaminas provienen de estudios que utilizan riñones enteros. Recientemente, se analizó la abundancia de ARNm de los genes implicados en la biosíntesis de poliaminas y en las vías catabólicas en diferentes zonas renales de ratones machos y hembras, por medio de la reacción cuantitativa en cadena de la polimerasa con transcripción reversa (qRT-PCR, sigla de inglés: quantitative reverse transcription-polymerase chain reaction) (211). Los resultados indicaron que existe una distribución desigual de los diferentes ARNm estudiados en las cinco zonas renales: corteza superficial, corteza profunda, banda exterior de la médula externa (OS, sigla del inglés: outer stripe of the outer medulla), banda interior de la médula externa (IS, sigla del inglés: inner stripe of the outer medulla), y la médula interna + papila (IM, inner medulla + papilla). Los genes de la biosíntesis, ODC y SpmS, se expresaron más en la corteza, mientras que los ARNm de los genes catabólicos SMO y DAO fueron más abundantes en IS e IM. Los genes involucrados en la regulación de la síntesis de poliaminas (AZ1, AZ2 y AZIN1) se expresaron en todas las zonas renales, sobre todo en la corteza, mientras que el gen AZIN2 fue más abundante en OS. La expresión de ODC, SMO, SpdS y SSAT fue mayor en los machos que en las hembras (211). En conclusión, los genes que codifican para el metabolismo de poliaminas fueron distribuidos específica- y cuantitativamente a lo largo del eje corticopapilar de los riñones de ratones machos y hembras, lo que sugiere que su función fisiológica es esencial en determinadas zonas renales y/o segmentos del nefrón (211).
Ø Rol de SSAT en la lesión renal aguda inducida por endotoxina
La expresión de las enzimas catabólicas SSAT y SMO aumenta después de la lesión por reperfusión isquémica. Zahedi et al. (212) plantearon la hipótesis de que el catabolismo de las poliaminas aumenta y que este aumento contribuye al daño tisular en la lesión renal aguda inducida por endotoxina. Entre otros resultados, se observó que la expresión de ARNm de SSAT se triplicó 24 h después de la inyección de LPS y retornó a los niveles basales a las 48 h. La actividad de SSAT se correlacionó con los niveles de su ARNm. La expresión de SMO también aumentó en el riñón después de la administración de LPS.
Los animales tratados con MDL72527, que es un inhibidor de las enzimas SSAT y SMO, mostraron una protección significativa contra la lesión renal inducida por endotoxina. Se llegó a la conclusión que el aumento del catabolismo de las poliaminas, a través de la generación de sus subproductos de oxidación, contribuye al daño renal y que la modulación de ese catabolismo puede ser un enfoque viable para el tratamiento de la lesión renal inducida por endotoxina (212).
Ø Poliaminas y diabetes mellitus
La diabetes mellitus es una enfermedad metabólica caracterizada por una secreción inadecuada de insulina. La poliamino-oxidasa (PAO) biodegrada a la espermina y a la espermidina mediante la catálisis de su desaminación oxidativa, lo que causa la producción de amoníaco, los correspondientes aminoaldehídos y peróxido de hidrógeno. Malondialdehído (MDA) y acroleína (CH2 = CHCHO), agentes potencialmente tóxicos, que inducen estrés oxidativo en las células de mamíferos, se forman luego espontáneamente a partir de los aminoaldehídos. Los principales signos de estrés oxidativo en niños diabéticos fueron los valores de los niveles de hemoglobina glucosilada (HbA1c) y MDA. Las poliaminas tienen una acción similar a la insulina. La propiedad de antiglicación de espermina y espermidina se confirmó recientemente. Se evaluó el metabolismo de las poliaminas mediante la estimación de la actividad de PAO en niños con diagnóstico reciente de diabetes mellitus tipo 1 (213).
Se midieron los niveles de glucosa en el plasma sanguíneo y de hemoglobina glucosilada en los eritrocitos hemolizados (HbA1c) mediante el uso de métodos estándar de laboratorio. Se midieron la actividad de PAO en el plasma de sangre venosa y la cantidad de MDA mediante métodos espectrofotométricos. La actividad de PAO, la glucemia, HbA1c y MDA fueron significativamente superiores en los niños diabéticos en comparación con los controles. La actividad de PAO en los niños con diabetes mellitus tipo 1 fue muy alta. Los resultados de niveles más altos de HbA(1c) y de MDA en sangre confirman la presencia de estrés oxidativo en niños con diabetes mellitus tipo 1 y demuestran que la actividad de PAO puede participar en estas circunstancias (213).
Ø Poliaminas y trastornos psiquiátricos
En una serie de trastornos psiquiátricos se observan alteraciones en los niveles de las poliaminas y en la expresión de los genes relacionados con su metabolismo. Se identificaron asociaciones de las variantes genéticas de espermidina/espermina N1-acetiltransferasa (SAT1) con la ansiedad y el suicidio; varios polimorfismos parecen ser importantes en la determinación de la expresión génica.
Recientemente se determinaron los genotipos de 63 polimorfismos, repartidos en cuatro genes poliaminérgicos (SAT1), espermina-sintasa (SMS), espermina-oxidasa (SMOX), y ornitina aminotransferasa tipo-1 (OATL1), en 1255 personas canadienses franceses que habían sido seguidos longitudinalmente durante 22 años (214). Se evaluaron las asociaciones univariadas con la ansiedad, los trastornos del humor y el intento de suicidio, según la evaluación durante la edad adulta temprana. También se investigó la participación de las interacciones gen-ambiente en términos de abuso infantil, y se evaluaron los síntomas de internalización y externalización como endofenotipos que median estas interacciones. En general, cada gen estaba asociado con al menos un resultado principal: la ansiedad (SAT1, SMS), los trastornos del humor (SAT1, SMOX), e intentos de suicidio (SAT1, OATL1). Varios polimorfismos SAT1 mostraron alelos de riesgo de enfermedades específicas, y los polimorfismos en este gen fueron involucrados en interacciones gen-gen con SMS para conferir riesgo de trastornos de ansiedad, así como de interacciones gen-ambiente entre el abuso físico infantil y los trastornos de humor.
Estos resultados demostraron que las variantes genéticas en los genes poliaminérgicos están asociadas con trastornos psiquiátricos, cada uno de los cuales involucra un conjunto de alelos de riesgo separados y distintos. Como varios de estos polimorfismos están asociados con la expresión génica, estos hallazgos pueden proporcionar mecanismos para explicar las alteraciones en el metabolismo de las poliaminas que se han observado en los trastornos psiquiátricos (214).
Recientemente, también se estudiaron las influencias genéticas y epigenéticas en la expresión de SpmS y SMO en suicidas (215).
Conclusiones
Las flavoenzimas con actividad de amino-oxidasas están representadas por las monoamino-oxidasas y las poliamino-oxidasas. Están enzimas son analizadas desde un punto de vista estructural y funcional.
Las monoamino-oxidasas tienen importancia por su participación en las enfermedades neurodegenerativas, como la enfermedad de Parkinson y la de Alzheimer, y en varios trastornos psiquiátricos. Se discute en este trabajo el uso clínico-terapéutico de los inhibidores para ambas isoformas y los selectivos para cada una de ellas, reversibles e irreversibles, así como los novedosos cambios de estrategia en los tratamientos.
Con respecto a las poliamino-oxidasas, por lo descripto en este trabajo, además de la homeostasis de las poliaminas, se ha vuelto cada vez más claro que el catabolismo de las poliaminas puede jugar un rol dominante en la respuesta a los fármacos, la apoptosis y la respuesta a estímulos estresantes y, además, contribuir a la etiología de varios estados patológicos, incluyendo el cáncer. Las enzimas altamente inducibles, SSAT (espermidina/espermina N1-acetiltransferasa) y SMO (espermina-oxidasa), y la generalmente expresada constitutivamente APAO (N1-acetilpoliamino-oxidasa) parecen jugar roles críticos en muchas condiciones normales y en procesos de enfermedad. La desregulación del catabolismo de las poliaminas con frecuencia acompaña a varios estados de enfermedad y sugiere que tal desregulación puede proveer al conocimiento útil del mecanismo de la enfermedad y, además, proporcionar blancos únicos para fármacos, que puedan ser explotados en beneficio terapéutico. Cada una de estas enzimas tiene el potencial para alterar la homeostasis de las poliaminas en respuesta a señales celulares múltiples y las dos oxidasas producen las especies reactivas de oxígeno, peróxido de hidrógeno y aldehídos, cada una con el potencial de producir estados patológicos.
AGRADECIMIENTOS
Al CONICET y a la Universidad de Buenos Aires (Argentina) por apoyo económico; al Ministerio de Ciencia, Tecnología e Innovación Productiva (MINCYT, Argentina) por el acceso a Science-Direct. Los Dres. Pomilio y Vitale son Miembros de la Carrera de Investigador Científico de CONICET.
1. Mondovì B, Riccio P, Agostinelli E. The biological functions of amine oxidases and their reaction products: an overview. Adv Exp Med Biol 1988; 250: 147-61. [ Links ]
2. Gaweska H, Fitzpatrick PF. Structures and mechanism of the monoamine oxidase family. Biomol Concepts 2011; 2 (5): 365-77. [ Links ]
3. Vindis C, Séguélas MH, Bianchi P, Parini A, Cambon C. Monoamine oxidase B induces ERK-dependent cell mitogenesis by hydrogen peroxide generation. Biochem Biophys Res Commun 2000; 271 (1): 181-5. [ Links ]
4. Polgár E, Campbell AD, MacIntyre LM, Watanabe M, Todd AJ. Phosphorylation of ERK in neurokinin 1 receptor-expressing neurons in laminae III and IV of the rat spinal dorsal horn following noxious stimulation. Mol Pain 2007; 3: 4. [ Links ]
5. Toninello A, Salvi M, Pietrangeli P, Mondovì B. Biogenic amines and apoptosis: minireview article. Amino Acids 2004; 26 (4): 339-43. [ Links ]
6. Du XY, Clemetson KJ. Snake venom L-amino acid oxidases. Toxicon 2002; 40 (6): 659-65. [ Links ]
7. Pollegioni L, Piubelli L, Sacchi S, Pilone MS, Molla G. Physiological functions of D-amino acid oxidases: from yeast to humans. Cell Mol Life Sci 2007; 64 (11): 1373-94. [ Links ]
8. Fitzpatrick PF. Oxidation of amines by flavoproteins. Arch Biochem Biophys 2010; 493 (1): 13-25. [ Links ]
9. Madeira C, Freitas ME, Vargas-Lopes C, Wolosker H, Panizzutti R. Increased brain D-amino acid oxidase (DAAO) activity in schizophrenia. Schizophr Res 2008; 101 (1-3): 76-83. [ Links ]
10. Gene overview of all published schizophrenia-association studies for DAO - SZGene database. Disponible en: http://www.szgene.org/geneoverview.asp?geneid=131. (Fecha de acceso: 12 de setiembre de 2012). [ Links ]
11. Detera-Wadleigh SD, McMahon FJ. G72/G30 in schizophrenia and bipolar disorder: review and meta-analysis. Biol Psychiatry 2006; 60 (2): 106-14. [ Links ]
12. Boks MP, Rietkerk T, van de Beek MH, Sommer IE, de Koning TJ, Kahn RS. Reviewing the role of the genes G72 and DAAO in glutamate neurotransmission in schizophrenia. Eur Neuropsychopharmacol 2007; 17 (9): 567-72. [ Links ]
13. Andreou D, Saetre P, Werge T, Andreassen OA, Agartz I, Sedvall GC, et al. D-amino acid oxidase activator gene (DAOA) variation affects cerebrospinal fluid homovanillic acid concentrations in healthy Caucasians. Eur Arch Psychiatry Clin Neurosci 2012; 262 (7): 549-56. [ Links ]
14. Dixon M, Kenworthy P. D-aspartate oxidase of kidney. Biochim Biophys Acta 1967; 146 (1): 54-76. [ Links ]
15. Lyles GA. Mammalian plasma and tissue-bound semicarbazide-sensitive amine oxidases: biochemical, pharmacological and toxicological aspects. Int J Biochem Cell Biol 1996; 28 (3): 259-74. [ Links ]
16. Gong B, Boor PJ. The role of amine oxidases in xe nobiotic metabolism. Expert Opin Drug Metab Toxicol 2006; 2 (4): 559-71. [ Links ]
17. Magyar K, Mészáros Z. Semicarbazide-sensitive amine oxidase (SSAO): present and future. Inflammopharmacology 2003; 11 (2): 165-73. [ Links ]
18. Edmondson DE, Mattevi A, Binda C, Li M, Hubálek F. Structure and mechanism of monoamine oxidase. Curr Med Chem 2004; 11 (15): 1983-93. [ Links ]
19. Johnston JP. Some observation upon a new inhibitor of monoamine oxidase in brain tissue. Biochem Pharmacol 1968; 17:1285-97. [ Links ]
20. Knoll J, Magyar K. Some puzzling pharmacological effects of monoamine oxidase inhibitors. Adv Biochem Psychopharmacol 1972; 5: 393-408. [ Links ]
21. Knoll J. On the dual nature of monoamine oxidase. Horiz Biochem Biophys 1978; 5: 37-64. [ Links ]
22. Glover V, Sandler M, Owen F, Riley GJ. Dopamine is a monoamine oxidase B substrate in man. Nature 1977; 265 (5589): 80-1. [ Links ]
23. Cawthon RM, Breakefield XO. Differences in A and B forms of monoamine oxidase revealed by limited proteolysis and peptide mapping. Nature 1979; 281 (5733): 692-4. [ Links ]
24. Kochersperger LM, Parker EL, Siciliano M, Darlington GJ, Denney RM. Assignment of genes for human monoamine oxidases A and B to the X chromosome. J Neurosci Res 1986; 16 (4): 601-16. [ Links ]
25. Grimsby J, Chen K, Wang LJ, Lan NC, Shih JC. Human monoamine oxidase A and B genes exhibit identical exon-intron organization. Proc Natl Acad Sci U S A 1991; 88 (9): 3637-41. [ Links ]
26. Bach AW, Lan NC, Johnson DL, Abell CW, Bembenek ME, Kwan SW, et al. cDNA cloning of human liver monoamine oxidase A and B: molecular basis of differences in enzymatic properties. Proc Natl Acad Sci U S A 1988; 85 (13): 4934-8. [ Links ]
27. Shih JC. Cloning, after cloning, knock-out mice, and physiological functions of MAOA and B. Neurotoxicology 2004; 25 (1-2): 21-30. [ Links ]
28. Powell JF, Hsu YP, Weyler W, Chen SA, Salach J, Andrikopoulos K, et al. The primary structure of bovine monoamine oxidase type A. Comparison with peptide sequences of bovine monoamine oxidase type B and other flavoenzymes. Biochem J 1989; 259 (2): 407-13. [ Links ]
29. Kwan SW, Abell CW. cDNA cloning and sequencing of rat monoamine oxidase A: comparison with the human and bovine enzymes. Comp Biochem Physiol B 1992; 102 (1): 143-7. [ Links ]
30. Abell CW, Kwan SW. Molecular characterization of monoamine oxidases A and B. Prog Nucleic Acid Res Mol Biol 2001; 65: 129-56. [ Links ]
31. Wu HF, Chen K, Shih JC. Site-directed mutagenesis of monoamine oxidase A and B: role of cysteines. Mol Pharmacol 1993; 43 (6): 888-93. [ Links ]
32. Tsugeno Y, Ito A. A key amino acid responsible for substrate selectivity of monoamine oxidase A and B. J Biol Chem 1997; 272 (22): 14033-6. [ Links ]
33. Binda C, Li M, Hubalek F, Restelli N, Edmondson DE, Mattevi A. Insights into the mode of inhibition of human mitochondrial monoamine oxidase B from high-resolution crystal structures. Proc Natl Acad Sci U S A 2003; 100 (17): 9750-5. [ Links ]
34. De Colibus L, Li M, Binda C, Lustig A, Edmondson DE, Mattevi A. Three-dimensional structure of human monoamine oxidase A (MAO A): relation to the structures of rat MAO A and human MAO B. Proc Natl Acad Sci U S A 2005; 102 (36): 12684-9. [ Links ]
35. Estructura cristalográfica de MAO-A: Orientations of proteins in membranes (opm) database. Available from: http://opm.phar.umich.edu/protein.php?pdbid=2z5x. Fecha de acceso: 12 Set 2012. [ Links ]
36. Son S-Y, Ma J, Kondou Y, Yoshimura M, Yamashita E, Tsukihara T. Structure of human monoamine oxidase A at 2.2-Å resolution: The control of opening the entry for substrates/inhibitors. Proc Natl Acad Sci U S A 2008: 105 (15): 5739-44. [ Links ]
37. Weyler W, Hsu YP, Breakefield XO. Biochemistry and genetics of monoamine oxidase. Pharmacol Ther 1990; 47 (3): 391-417. [ Links ]
38. Saura J, Kettler R, Da Prada M, Richards JG. Quantitative enzyme radioautography with 3H-Ro 41-1049 and 3H-Ro 19-6327 in vitro: localization and abundance of MAO-A and MAO-B in rat CNS, peripheral organs, and human brain. J Neurosci 1992; 12 (5): 1977-99. [ Links ]
39. Pizzinat N, Marti L, Remaury A, Leger F, Langin D, Lafontan M, et al. High expression of monoamine oxidases in human white adipose tissue: evidence for their involvement in noradrenaline clearance. Biochem Pharmacol 1999; 58 (11): 1735-42. [ Links ]
40. Rodríguez MJ, Saura J, Finch CC, Mahy N, Billett EE. Localization of monoamine oxidase A and B in human pancreas, thyroid, and adrenal glands. J Histochem Cytochem 2000; 48 (1): 147-51. [ Links ]
41. Rodríguez MJ, Saura J, Billett EE, Finch CC, Mahy N. Cellular localization of monoamine oxidase A and B in human tissues outside of the central nervous system. Cell Tissue Res 2001; 304 (2): 215-20. [ Links ]
42. Sivasubramaniam SD, Finch CC, Rodríguez MJ, Mahy N, Billett EE. A comparative study of the expression of monoamine oxidase-A and -B mRNA and protein in non-CNS human tissues. Cell Tissue Res 2003; 313 (3): 291-300. [ Links ]
43. Billett EE. Monoamine oxidase (MAO) in human peripheral tissues. Neurotoxicology 2004; 25 (1-2): 139-48. [ Links ]
44. Pizzinat N, Remaury A, Parini A. The renal monoamine oxidases: pathophysiology and targets for therapeutic intervention. Curr Opin Nephrol Hypertens 1998; 7 (1): 33-6. [ Links ]
45. Fernandes MH, Soares-da-Silva P. Type A and B monoamine oxidase activities in the human and rat kidney. Acta Physiol Scand 1992; 145 (4): 363-7. [ Links ]
46. Rodríguez MJ, Saura J, Billett E, Finch C, Mahy N. MAO-A and MAO-B localisation in human lung and spleen. Neurobiology (Bp) 2000; 8 (3-4): 243-8. [ Links ]
47. Auda GR, Kirk SH, Billett MA, Billett EE. Localization of Monoamine Oxidase mRNA in Human Placenta. J Histochem Cytochem 1998; 46 (12): 1393-400. [ Links ]
48. Saura J, Richards JG, Mahy N. Age-related changes on MAO in Bl/C57 mouse tissues: a quantitative radioautographic study. J Neural Transm Suppl 1994; 41: 89-94. [ Links ]
49. Saura J, Richards JG, Mahy N. Differential age-related changes of MAO-A and MAO-B in mouse brain and peripheral organs. Neurobiol Aging 1994; 15 (4): 399-408. [ Links ]
50. Ilett KF, George CF, Davies DS. The effect of monoamine oxidase inhibitors on 'first-pass' metabolism of tyramine in dog intestine. Biochem Pharmacol 1980; 29 (19): 2551-6. [ Links ]
51. Cases O, Seif I, Grimsby J, Gaspar P, Chen K, Pournin S, et al. Aggressive behavior and altered amounts of brain serotonin and norepinephrine in mice lacking MAOA. Science 1995; 268 (5218): 1763-6. [ Links ]
52. Grimsby J, Toth M, Chen K, Kumazawa T, Klaidman L, Adams JD, et al. Increased stress response and b-phenylethylamine in MAOB-deficient mice. Nat Genet 1997; 17 (2): 206-10. [ Links ]
53. Garpenstrand H, Longato-Stadler E, af Klinteberg B, Grigorenko E, Damberg M, Oreland L, Hallman J. Low platelet monoamine oxidase activity in Swedish imprisoned criminal offenders. Eur Neuropsychopharmacol 2002; 12 (2): 135-40. [ Links ]
54. Lee M, Chen K, Shih JC, Hiroi N. MAO-B knockout mice exhibit deficient habituation of locomotor activity but normal nicotine intake. Genes Brain Behav 2004; 3 (4): 216-27. [ Links ]
55. Chen K, Holschneider DP, Wu W, Rebrin I, Shih JC. A spontaneous point mutation produces monoamine oxidase A/B knock-out mice with greatly elevated monoamines and anxiety-like behavior. J Biol Chem 2004; 279 (38): 39645-52. [ Links ]
56. Nicotra A, Pierucci F, Parvez H, Senatori O. Monoamine oxidase expression during development and aging. Neurotoxicology 2004; 25 (1-2): 155-65. [ Links ]
57. Strolin Benedetti M, Dostert P. Monoamine oxidase, brain ageing and degenerative diseases. Biochem Pharmacol 1989; 38 (4): 555-61. [ Links ]
58. Cadenas E, Davies KJ. Mitochondrial free radical generation, oxidative stress, and aging. Free Radic Biol Med 2000; 29 (3-4): 222-30. [ Links ]
59. Fowler JS, Volkow ND, Wang GJ, Logan J, Pappas N, Shea C, MacGregor R. Age-related increases in brain monoamine oxidase B in living healthy human subjects. Neurobiol Aging 1997; 18 (4): 431-5. [ Links ]
60. Mahy N, Andrés N, Andrade C, Saura J. Age-related changes of MAO-A and -B distribution in human and mouse brain. Neurobiology (Bp) 2000; 8 (1): 47-54. [ Links ]
61. Arrojo M, Baca-García E, Pérez-Rodríguez MM, Dolengevich-Segal H, Navio-Acosta M, Rodríguez-Salgado B, Saiz-Ruiz J. Actividad de la monoaminooxidasa plaquetaria en el trastorno obsesivo compulsivo. Eur Psychiatry 2007; 22 (8): 525-9. [ Links ]
62. Vitale AA, Jorge Ciprian-Ollivier J, Vitale MG, Romero Esther, Pomilio AB. Estudio clínico de marcadores de la hipermetilación indólica en las alteraciones de la percepción. Clinical studies of markers of the indolic hypermethylation in human perception alterations. Acta Bioquím Clín Latinoamer 2010; 44 (4): 627-42. [ Links ]
63. O'Carroll AM, Fowler CJ, Phillips JP, Tobbia I, Tipton KF. The deamination of dopamine by human brain monoamine oxidase. Specificity for the two enzyme forms in seven brain regions. Naunyn Schmiedebergs Arch Pharmacol 1983; 322 (3): 198-202. [ Links ]
64. Benedetti MS. Biotransformation of xenobiotics by amine oxidases. Fundam Clin Pharmacol 2001; 15 (2): 75-84. [ Links ]
65. Fernandes MH, Soares-da-Silva P. Role of monoamine oxidase and catechol-O-methyl- transferase in the metabolism of renal dopamine. J Neural Transm Suppl 1994; 41: 101-5. [ Links ]
66. Soares-da-Silva P, Pinto-do-O PC, Bertorello AM. Antagonistic actions of renal dopamine and 5-hydroxytryptamine: increase in Na+, K+-ATPase activity in renal proximal tubules via activation of 5-HT1A receptors. Br J Pharmacol 1996; 117 (6): 1199-203. [ Links ]
67. Youdim MB, Weinstock M. Therapeutic applications of selective and non-selective inhibitors of monoamine oxidase A and B that do not cause significant tyramine potentiation. Neurotoxicology 2004; 25 (1-2): 243-50. [ Links ]
68. Panagiotidis G, Stenström A, Lundquist I. Influence of b2-adrenoceptor stimulation and glucose on islet monoamine oxidase activity and insulin secretory response in the mouse. Pancreas 1993; 8 (3): 368-74. [ Links ]
69. Fernandes MH, Soares-da-Silva P. Effects of MAO-A and MAO-B selective inhibitors Ro 41-1049 and Ro 19-6327 on the deamination of newly formed dopamine in the rat kidney. J Pharmacol Exp Ther 1990; 255 (3): 1309-13. [ Links ]
70. Hubbard PC, Henderson IW. Renal dopamine and the tubular handling of sodium. J Mol Endocrinol 1995; 14 (2): 139-55. [ Links ]
71. Soares-da-Silva P, Vieira-Coelho MA, Pestana M. Antagonistic actions of renal dopamine and 5-hydroxytryptamine: endogenous 5-hydroxytryptamine, 5-HT1A receptors and antinatriuresis during high sodium intake. Br J Pharmacol 1996; 117 (6): 1193-8. [ Links ]
72. Aperia AC. Intrarenal dopamine: a key signal in the interactive regulation of sodium metabolism. Annu Rev Physiol 2000; 62: 621-47. [ Links ]
73. Bianchi P, Séguélas MH, Parini A, Cambon C. Activation of pro-apoptotic cascade by dopamine in renal epithelial cells is fully dependent on hydrogen peroxide generation by monoamine oxidases. J Am Soc Nephrol 2003; 14 (4): 855-62. [ Links ]
74. Kunduzova OR, Bianchi P, Parini A, Cambon C. Hydrogen peroxide production by monoamine oxidase during ischemia/reperfusion. Eur J Pharmacol 2002; 448 (2-3): 225-30. [ Links ]
75. Kunduzova OR, Bianchi P, Pizzinat N, Escourrou G, Séguélas MH, Parini A, Cambon C. Regulation of JNK/ERK activation, cell apoptosis, and tissue regenera tion by monoamine oxidases after renal ischemia-reperfusion. FASEB J 2002; 16 (9): 1129-31. [ Links ]
76. Raimondi L, Banchelli G, Sgromo L, Pirisino R, Ner M, Parini A, Cambon C. Hydrogen peroxide generation by monoamine oxidases in rat white adipocytes: role on cAMP production. Eur J Pharmacol 2000; 395 (3): 177-82. [ Links ]
77. Marti L, Morin N, Enrique-Tarancon G, Prévot D, Lafontan M, Testar X, et al. Tyramine and vanadate synergistically stimulate glucose transport in rat adipocytes by amine oxidase-dependent generation of hydrogen peroxide. J Pharmacol Exp Ther 1998; 285 (1): 342-9. [ Links ]
78. Visentin V, Prévot D, Marti L, Carpéné C. Inhibition of rat fat cell lipolysis by monoamine oxidase and semicarbazide-sensitive amine oxidase substrates. Eur J Pharmacol 2003; 466 (3): 235-43. [ Links ]
79. Cao Danh H, Strolin Benedetti M, Dostert P, Mousset A. Age-related changes in benzylamine oxidase activity in rat tissues. J Pharm Pharmacol 1984; 36 (9): 592-6. [ Links ]
80. Sawyer DB, Siwik DA, Xiao L, Pimentel DR, Singh K, Colucci WS. Role of oxidative stress in myocardial hypertrophy and failure. J Mol Cell Cardiol 2002; 34 (4): 379-88. [ Links ]
81. Maurel A, Hernandez C, Kunduzova O, Bompart G, Cambon C, Parini A, Francés B. Age-dependent increase in hydrogen peroxide production by cardiac monoamine oxidase A in rats. Am J Physiol Heart Circ Physiol 2003; 284 (4): H1460-7. [ Links ]
82. Vindis C, Séguélas MH, Lanier S, Parini A, Cambon C. Dopamine induces ERK activation in renal epithelial cells through H2O2 produced by monoamine oxidase. Kidney Int 2001; 59 (1): 76-86. [ Links ]
83. Especificidad por el sustrato y por el inhibidor de ambas isoformas de MAO: CNS spectrums: First in Applied Neuroscience. Fecha de acceso: 12 Set 2012. http://www.cnsspectrums.com/aspx/articledetail.aspx?articleid=400 [ Links ]
84. Trevor AJ, Singer TP, Ramsay RR, Castagnoli N Jr. Processing of MPTP by monoamine oxidases: implications for molecular toxicology. J Neural Transm Suppl 1987; 23: 73-89. [ Links ]
85. Szelenyi I, editor. Inhibitors of monoamine oxidase B. Pharmacology and Clinical Use in Neurodegenerative Disorders. Basilea (Suiza): Birkhäuser Verlag; 1993. [ Links ]
86. Finberg JP, Gillman K. Selective inhibitors of monoamine oxidase type B and the "cheese effect". Int Rev Neurobiol 2011; 100: 169-90. [ Links ]
87. Laux G, Volz HP, Möller HJ. Newer and older monoamine oxidase inhibitors. A comparative profile. CNS Drugs 1995; 3 (Suppl 2): 145-58. [ Links ]
88. Foot JS, Deodhar M, Turner CI, Yin P, van Dam EM, Silva DG, et al. The discovery and development of selective 3-fluoro-4-aryloxyallylamine inhibitors of the amine oxidase activity of semicarbazide-sensitive amine oxidase/vascular adhesion protein-1 (SSAO/VAP-1). Bioorg Med Chem Lett 2012; 22 (12): 3935-40. [ Links ]
89. Cesura AM, Pletscher A. The new generation of monoamine oxidase inhibitors. Prog Drug Res 1992; 38: 171-297. [ Links ]
90. Li B, Lv X, Geng L, Qing H, Deng Y. Proteoliposome-based capillary electrophoresis for screening membrane protein inhibitors. J Chromatogr Sci 2012; 50 (7): 569-73. [ Links ]
91. Shih JC, Grimsby J, Chen K, Zhu Q-s. Structure and promoter organization of the human monoamine oxidase A and B genes. J Psychiatr Neurosci 1993; 18 (1): 25-32. [ Links ]
92. Camacho A, Dimsdale JE. Platelets and psychiatry: lessons learned from old and new studies. Psychosom Med 2000; 62 (3): 326-36. [ Links ]
93. Fowler JS, Logan J, Wang GJ, Volkow ND. Monoamine oxidase and cigarette smoking. Neurotoxicology 2003; 24 (1): 75-82. [ Links ]
94. Pivac N, Knezevic J, Kozaric-Kovacic D, Dezeljin M, Mustapic M, Rak D, et al. Monoamine oxidase (MAO) intron 13 polymorphism and platelet MAO-B activity in combat-related posttraumatic stress disorder. J Affect Disord 2007; 103 (1-3): 131-8. [ Links ]
95. Costa-Mallen P, Costa LG, Checkoway H. Genotype combinations for monoamine oxidase-B intron 13 polymorphism and dopamine D2 receptors TaqIB polymorphism are associated with ever-smoking status among men. Neurosci Lett 2005; 385 (2): 158-62. [ Links ]
96. Sobell JL, Lind TJ, Hebrink DD, Heston LL, Sommer SS. Screening the monoamine oxidase B gene in 100 male patients with schizophrenia: a cluster of polymorphisms in African-American but lack of functionally significant sequence changes. Am J Med Genet 1997; 74 (1): 44-9. [ Links ]
97. Anthenelli RM, Tipp J, Li T-K, Magnes L, Schuckit MA, Rice J, et al. Platelet monoamine oxidase activity in subgroups of alcoholics and controls: results from the collaborative study on the genetics of alcoholism. Alcohol Clin Exp Res 1998; 22 (3): 598-604. [ Links ]
98. Vitale AA, Pomilio AB, Cañellas CO, Vitale MG, Putz EM, Ciprian-Ollivier J. In vivo long-term kinetics of N,N-dimethyltryptamine and tryptamine in brain by radioiodination planar imaging. J Nuclear Med 2011; 52 (6): 970-7. [ Links ]
99. Oreland L. Platelet monoamine oxidase, personality and alcoholism: the rise, fall and resurrection. Neurotoxicology 2004; 25 (1-2): 79-89. [ Links ]
100. Meltzer HY, Arora RC. Skeletal muscle MAO activity in the major psychoses: Relationship with platelet and plasma MAO activities. Arch Gen Psychiatry 1980; 37 (3): 333-9. [ Links ]
101. Ruchkin VV, Koposov RA, af Klinteberg B, Oreland L, Grigorenko EL. Platelet MAO-B, personality, and psychopathology. J Abnorm Psychol 2005; 114 (3): 477-82. [ Links ]
102. Roessner V, Uebel H, Becker A, Beck G, Bleich S, Rothenberger A. Serum level of semicarbazide-sensitive amine oxidase in children with ADHD. Behav Brain Funct 2006; 2: 5. [ Links ]
103. Nemeroff CB, Bremner JD, Foa EB, Mayberg HS, North CS, Stein MB. Posttraumatic stress disorder: a state-of-the-science review. J Psychiatr Res 2006; 40 (1): 1-21. [ Links ]
104. White K, Shih JC, Fong TL, Young H, Gelfand R, Boyd J. Elevated platelet monoamine oxidase activity in non-endogenous depressives. Am J Psychiatry 1980; 37: 1258-9. [ Links ]
105. Hung CF, Lung FW, Hung TH, Chong MY, Wu CK, Wen JK, Lin PY. Monoamine oxidase A gene polymorphism and suicide: an association study and meta-analysis. J Affect Disord 2012; 136 (3): 643-9. [ Links ]
106. Chan-Palay V. Depression and senile dementia of the Alzheimer type: a role for moclobemide. Psychopharmacology (Berl) 1992; 106 Suppl: S137-9. [ Links ]
107. Berlin I, Saïd S, Spreux-Varoquaux O, Launay JM, Olivares R, Millet V, et al. A reversible monoamine oxidase A inhibitor (moclobemide) facilitates smoking cessation and abstinence in heavy, dependent smokers. Clin Pharmacol Ther 1995; 58 (4): 444-52. [ Links ]
108. Jann MW. Advanced strategies for treatment of Parkinson's disease: the role of early treatment. Am J Manag Care 2011; 17 (Suppl 12): S315-21. [ Links ]
109. Kalinderi K, Fidani L, Katsarou Z, Bostantjopoulou S. Pharmacological treatment and the prospect of pharmacogenetics in Parkinson's disease. Int J Clin Pract 2011; 65 (12): 1289-94. [ Links ]
110. Riederer P, Laux G. MAO-inhibitors in Parkinson's Disease. Exp Neurobiol 2011; 20 (1): 1-17. [ Links ]
111. Sozio P, Cerasa LS, Abbadessa A, Di Stefano A. Designing prodrugs for the treatment of Parkinson's disease. Expert Opin Drug Discov 2012; 7 (5): 385-406. [ Links ]
112. Helguera AM, Pérez-Machado G, Cordeiro MN, Borges F. Discovery of MAO-B inhibitors - present status and future directions. Part I: Oxygen heterocycles and analoges. Mini Rev Med Chem 2012; 12 (10): 907-19. [ Links ]
113. Zheng H, Amit T, Bar-Am O, Fridkin M, Youdim MB, Mandel SA. From Anti-Parkinson's Drug Rasagiline to Novel Multitarget Iron Chelators with Acetylcholinesterase and Monoamine Oxidase Inhibitory and Neuroprotective Properties for Alzheimer's Disease. J Alzheimers Dis 2012; 30 (1): 1-16. [ Links ]
114. Fernandez HH. Updates in the medical management of Parkinson disease. Cleve Clin J Med 2012; 79 (1): 28-35. [ Links ]
115. Maranis S, Tsouli S, Konitsiotis S. Treatment of motor symptoms in advanced Parkinson's disease: a practical approach. Prog Neuropsychopharmacol Biol Psychiatry 2011; 35 (8): 1795-807. [ Links ]
116. Weinreb O, Amit T, Bar-Am O, Youdim MB. Rasagiline: a novel anti-Parkinsonian monoamine oxidase-B inhibitor with neuroprotective activity. Progr Neurobiol 2010; 92 (3): 330-44. [ Links ]
117. Weinreb O, Amit T, Riederer P, Youdim MB, Mandel SA. Neuroprotective profile of the multitarget drug rasagiline in Parkinson's disease. Int Rev Neurobiol 2011; 100: 127-49. [ Links ]
118. Hoy SM, Keating GM. Rasagiline: a review of its use in the treatment of idiopathic Parkinson's disease. Drugs 2012; 72 (5): 643-69. Erratum in: Drugs 2012; 72 (6): 870-1. [ Links ]
119. Schapira AH. Monoamine oxidase B inhibitors for the treatment of Parkinson's disease: a review of symptomatic and potential disease-modifying effects. CNS Drugs 2011; 25 (12): 1061-71. [ Links ]
120. Pisani L, Catto M, Leonetti F, Nicolotti O, Stefanachi A, Campagna F, Carotti A. Targeting monoamine oxidases with multipotent ligands: an emerging strategy in the search of new drugs against neurodegenerative diseases. Curr Med Chem 2011; 18 (30): 4568-87. [ Links ]
121. Zhang YW, Thompson R, Zhang H, Xu H. APP processing in Alzheimer's disease. Mol Brain 2011; 4: 3. [ Links ]
122. Villarinho JG, Fachinetto R, de Vargas Pinheiro F, da Silva Sant'Anna G, Machado P, Dombrowski PA, et al. Antidepressant-like effect of the novel MAO inhibitor 2-(3,4-dimethoxy-phenyl)-4,5-dihydro-1H-imidazole (2-DMPI) in mice. Prog Neuropsychopharmacol Biol Psychiatry 2012; 39 (1): 31-9. [ Links ]
123. Mandrioli R, Mercolini L, Saracino MA, Raggi MA. Selective Serotonin Reuptake Inhibitors (SSRIs): Therapeutic Drug Monitoring and Pharmacological Interactions. Curr Med Chem 2012; 19 (12): 1846-63. [ Links ]
124. Marazziti D, Carlini M, Dell'Osso L. Treatment strategies of obsessive-compulsive disorder and panic disorder/agoraphobia. Curr Top Med Chem 2012; 12 (4): 238-53. [ Links ]
125. Lawrence SA. Amines: synthesis, properties and applications. Cambridge: Cambridge University Press; p. 64, 2004. [ Links ]
126. Bachrach U. The early history of polyamine research. Plant Physiol Biochem 2010; 48 (7): 490-5. [ Links ]
127. Igarashi K, Kashiwagi K. Polyamines: mysterious modulators of cellular functions. Biochem Biophys Res Commun 2000; 271 (3): 559-64. [ Links ]
128. Rato C, Amirova S.R, Bates D.G, Stansfield I, Wallace HM. Translational recoding as a feedback controller: systems approaches reveal polyamine-specific effects on the antizyme ribosomal frameshift. Nucleic Acid Res 2011; 39 (11): 4587-97. [ Links ]
129. Cohen SS. A Guide to the Polyamines. Oxford: Oxford University Press; 1998. [ Links ]
130. Wang X, Ikeguchi Y, McCloskey DE, Nelson P, Pegg AE. Spermine synthesis is required for normal viability, growth, and fertility in the mouse. J Biol Chem 2004; 279 (49): 51370-5. [ Links ]
131. Gugliucci A. Polyamines as clinical laboratory tools. Clin Chim Acta 2004; 344: 23-5. [ Links ]
132. Wang J-Y (Ed) Polyamine Cell Signaling: Physiology, Pharmacology, and Cancer Research. Humana Press; 2006. [ Links ]
133. Kondo T, Yamamoto K, Kimata A, Ueyama J, Hori Y, Takagi K. Association of glycemic profiles with whole blood polyamine among middle-aged Japanese men: colorimetric assay using oat and barley seedling polyamine oxidase. Environ Health Prev Med 2008; 13 (1): 43-51. [ Links ]
134. Wallace HM, Fraser AV. Inhibitors of polyamine metabolism: review article. Amino Acids 2004; 26 (4): 353-65. [ Links ]
135. Wang C, Delcros JG, Cannon L, Konate F., Carias H., Biggerstaff J., et al. Defining the molecular requirements for the selective delivery of polyamine conjugates into cells containing active polyamine transporters. J Med Chem 2003; 46 (24): 5129-38. [ Links ]
136. Zhang L, Lee HK, Pruess TH, White HS, Bulaj G. Synthesis and applications of polyamine amino acid residues: improving the bioactivity of an analgesic neuropeptide, neurotensin. J Med Chem 2009; 52 (6): 1514-7. [ Links ]
137. Pandey S, Ranade SA, Nagar PK, Kumar N. Role of polyamines and ethylene as modulators of plant senescence. J Biosci 2000; 25 (3): 291-9. [ Links ]
138. Wu T, Yankovskaya V, McIntire WS. Cloning, sequencing, and heterologous expression of the murine peroxisomal flavoprotein, N1-acetylated polyamine oxidase. J Biol Chem 2003; 278 (23): 20514-25. [ Links ]
139. Järvinen A, Grigorenko N, Khomutov AR, Hyvönen MT, Uimari A, Vepsäläinen J, et al. Metabolic stability of a-methylated polyamine derivatives and their use as substitutes for the natural polyamines. J Biol Chem 2005; 280 (8): 6595-601. [ Links ]
140. Vujcic S, Liang P, Diegelman P, Kramer DL, Porter CW. Genomic identification and biochemical characterization of the mammalian polyamine oxidase involved in polyamine back-conversion. Biochem J 2003; 370 (Pt 1): 19-28. [ Links ]
141. Wang Y, Hacker A, Murray-Stewart T, Frydman B, Valasinas A, Fraser AV, et al. Properties of recombinant human N1-acetylpolyamine oxidase (hPAO): potential role in determining drug sensitivity. Cancer Chemother Pharmacol 2005; 56 (1): 83-90. [ Links ]
142. Tavladoraki P, Schininà ME, Cecconi F, Di Agostino S, Manera F, Rea G, et al. Maize polyamine oxidase: primary structure from protein and cDNA sequencing. FEBS Lett 1998; 426 (1): 62-6. [ Links ]
143. Federico R, Ercolini L, Laurenzi M, Angelini R. Federico R, Ercolini L, et al. Oxidation of acetylpolyamines by maize polyamine oxidase. Phytochemistry 1996; 43 (2): 339-41. [ Links ]
144. Shukla OP, Müller S, Walter RD. Polyamine oxidase from Acanthamoeba culbertsoni specific for N8-acetylspermidine. Mol Biochem Parasitol 1992; 51 (1): 91-8. [ Links ]
145. Cervelli M, Polticelli F, Federico R, Mariottini P. Heterologous expression and characterization of mouse spermine oxidase. J Biol Chem 2003; 278 (7): 5271-6. [ Links ]
146. Murray-Stewart T, Wang Y, Goodwin A, Hacker A, Meeker A, Casero RA Jr. Nuclear localization of human spermine oxidase isoforms - possible implications in drug response and disease etiology. FEBS J 2008; 275 (11): 2795-806. [ Links ]
147. Tavladoraki P, Rossi MN, Saccuti G, Perez-Amador MA, Polticelli F, Angelini R, Federico R. Heterologous expression and biochemical characterization of a polyamine oxidase from Arabidopsis involved in polyamine back conversion. Plant Physiol 2006; 141 (4): 1519-32. [ Links ]
148. Wang Y, Murray-Stewart T, Devereux W, Hacker A, Frydman B, Woster PM, Casero RA Jr. Properties of purified recombinant human polyamine oxidase, PAOh1/SMO. Biochem Biophys Res Commun 2003; 304 (4): 605-11. [ Links ]
149. Adachi MS, Juarez PR, Fitzpatrick PF. Mechanistic studies of human spermine oxidase: kinetic mechanism and pH effects. Biochemistry 2010; 49 (2): 386-92. [ Links ]
150. Goodwin AC, Murray-Stewart TR, Casero RA Jr. A simple assay for mammalian spermine oxidase: a polyamine catabolic enzyme implicated in drug response and disease. Methods Mol Biol 2011; 720: 173-81. [ Links ]
151. Landry J, Sternglanz R. Yeast Fms1 is a FAD-utilizing polyamine oxidase. Biochem Biophys Res Commun 2003; 303 (3): 771-6. [ Links ]
152. Müller S, Walter RD. Purification and characterization of polyamine oxidase from Ascaris suum. Biochem J 1992; 283 (Pt 1): 75-80. [ Links ]
153. Moschou PN, Sanmartin M, Andriopoulou AH, Rojo E, Sanchez-Serrano JJ, Roubelakis-Angelakis KA. Bridging the gap between plant and mammalian polyamine catabolism: a novel peroxisomal polyamine oxidase responsible for a full back-conversion pathway in Arabidopsis. Plant Physiol 2008; 147 (4): 1845-57. [ Links ]
154. Yamada H. Putrescine oxidase (Micrococcus rubens). Methods Enzymol 1971; 17B: 726-30. [ Links ]
155. DeSa RJ. Putrescine oxidase from Micrococcus rubens. Purification and properties of the enzyme. J Biol Chem 1972; 247 (17): 5527-34. [ Links ]
156. Kakinuma Y, Hoshino K, Igarashi K. Characterization of the inducible polyamine transporter in bovine lymphocytes. Eur J Biochem 1988; 176 (2): 409-14. [ Links ]
157. Pegg AE. Polyamine metabolism and its importance in neoplastic growth and a target for chemotherapy. Cancer Res 1988; 48 (4): 759-74. [ Links ]
158. Seiler N. Polyamine metabolism. Digestion 1990; 46 (Suppl 2): 319-30. [ Links ]
159. Jänne J, Alhonen L, Pietilä M, Keinänen TA. Genetic approaches to the cellular functions of polyamines in mammals. Eur J Biochem 2004; 271 (5): 877-94. [ Links ]
160. Auvinen M, Paasinen A, Andersson LC, Hölttä E. Ornithine decarboxylase activity is critical for cell transformation. Nature 1992; 360 (6402): 355-8. [ Links ]
161. Wallace HM, Fraser AV, Hughes A. A perspective of polyamine metabolism. Biochem J 2003; 376 (Pt 1): 1-14. [ Links ]
162. Igarashi K, Kashiwagi K. Characteristics of cellular polyamine transport in prokaryotes and eukaryotes. Plant Physiol Biochem 2010; 48 (7): 506-12. [ Links ]
163. Uemura T, Yerushalmi HF, Tsaprailis G, Stringer DE, Pastorian KE, Hawel L 3rd, et al. Identification and characterization of a diamine exporter in colon epithelial cells. J Biol Chem 2008; 283 (39): 26428-35. [ Links ]
164. Kashiwagi K, Hosokawa N, Furuchi T, Kobayashi H, Sasakawa C, Yoshikawa M, Igarashi K. Isolation of polyamine transport-deficient mutants of Escherichia coli and cloning of the genes for polyamine transport proteins. J Biol Chem 1990; 265 (34): 20893-7. [ Links ]
165. Furuchi, T., Kashiwagi, K., Kobayashi, H., Igarashi, K. Characteristics of the gene for a spermidine and putrescine transport system that maps at 15 min on the Escherichia coli chromosome. J Biol Chem 1991; 266 (31): 20928-33. [ Links ]
166. Pistocchi R, Kashiwagi K, Miyamoto S, Nukui E, Sadakata Y, Kobayashi H, Igarashi K. Characteristics of the operon for a putrescine transport system that maps at 19 minutes on the Escherichia coli chromosome. J Biol Chem 1993; 268 (1): 146-52. [ Links ]
167. Kurihara S, Oda S, Kato K, Kim HG, Koyanagi T, Kumagai H, Suzuki H. A novel putrescine utilization pathway involves g-glutamylated intermediates of Escherichia coli K-12. J Biol Chem 2005; 280 (6): 4602-8. [ Links ]
168. Kashiwagi K, Miyamoto S, Suzuki F, Kobayashi H, Igarashi K. Excretion of putrescine by the putrescine-ornithine antiporter encoded by the potE gene of Escherichia coli. Proc Natl Acad Sci U S A 1992; 89 (10): 4529-33. [ Links ]
169. Soksawatmaekhin W, Kuraishi A, Sakata K, Kashiwagi K, Igarashi K. Excretion and uptake of cadaverine by CadB and its physiological functions in Escherichia coli. Mol Microbiol 2004; 51 (5): 1401-12. [ Links ]
170. Higashi K, Ishigure H, Demizu R, Uemura T, Nishino K, Yamaguchi A, et al. Identification of a spermidine excretion protein complex (MdtJI) in Escherichia coli. J Bacteriol 2008; 190 (3): 872-8. [ Links ]
171. Woolridge DP, Vazquez-Laslop N, Markham PN, Chevalier MS, Gerner EW, Neyfakh AA. Efflux of the natural polyamine spermidine facilitated by the Bacillus subtilis multidrug transporter Blt. J Biol Chem 1997; 272 (14): 8864-6. [ Links ]
172. Uemura T, Kashiwagi K, Igarashi K. Uptake of putrescine and spermidine by Gap1p on the plasma membrane in Saccharomyces cerevisiae. Biochem Biophys Res Commun 2005; 328 (4): 1028-33. [ Links ]
173. Uemura T, Kashiwagi K, Igarashi K. Polyamine uptake by DUR3 and SAM3 in Saccharomyces cerevisiae. J Biol Chem 2007; 282 (10): 7733-41. [ Links ]
174. Aouida M, Leduc A, Poulin R, Ramotar D. AGP2 encodes the major permease for high affinity polyamine import in Saccharomyces cerevisiae. J Biol Chem 2005; 280 (25): 24267-76. [ Links ]
175. Uemura T, Tomonari Y, Kashiwagi K, Igarashi K. Uptake of GABA and putrescine by UGA4 on the vacuolar membrane in Saccharomyces cerevisiae. Biochem Biophys Res Commun 2004; 315 (4): 1082-7. [ Links ]
176. Tomitori H, Kashiwagi K, Sakata K, Kakinuma Y, Igarashi K. Identification of a gene for a polyamine transport protein in yeast. J Biol Chem 1999; 274 (6): 3265-7. [ Links ]
177. Tomitori H, Kashiwagi K, Asakawa T, Kakinuma Y, Michael AJ, Igarashi K. Multiple polyamine transport systems on the vacuolar membrane in yeast. Biochem J 2001; 353 (Pt 3): 681-8. [ Links ]
178. Uemura T, Tachihara K, Tomitori H, Kashiwagi K, Igarashi K. Characteristics of the polyamine transporter TPO1 and regulation of its activity and cellular localization by phosphorylation. J Biol Chem 2005; 280 (10): 9646-52. [ Links ]
179. Tachihara K, Uemura T, Kashiwagi K, Igarashi K. Excretion of putrescine and spermidine by the protein encoded by YKL174c (TPO5) in Saccharomyces cerevisiae. J Biol Chem 2005; 280 (13): 12637-42. [ Links ]
180. Hasne MP, Ullman B. Identification and characterization of a polyamine permease from the protozoan parasite Leishmania major. J Biol Chem 2005; 280 (15): 15188-94. [ Links ]
181. Belting M, Mani K, Jönsson M, Cheng F, Sandgren S, Jonsson S, et al. Glypican-1 is a vehicle for polyamine uptake in mammalian cells: a pivital role for nitrosothiol-derived nitric oxide. J Biol Chem 2003; 278 (47): 47181-9. [ Links ]
182. Roy UK, Rial NS, Kachel KL, Gerner EW. Activated K-RAS increases polyamine uptake in human colon cancer cells through modulation of caveolar endocytosis. Mol Carcinog 2008; 47 (7): 538-53. [ Links ]
183. Hawel L 3rd, Tjandrawinata RR, Fukumoto GH, Byus CV. Biosynthesis and selective export of 1,5-diaminopentane (cadaverine) in mycoplasma-free cultured mammalian cells. J Biol Chem 1994; 269 (10): 7412-8. [ Links ]
184. Hawel L 3rd, Tjandrawinata RR, Byus CV. Selective putrescine export is regulated by insulin and ornithine in Reuber H35 hepatoma cells. Biochim Biophys Acta 1994; 1222 (1): 15-26. [ Links ]
185. Tjandrawinata RR, Hawel L 3rd, Byus CV. Characterization of putrescine and cadaverine export in mammalian cells. A pharmacological approach. Biochem Pharmacol 1994; 48 (12): 2237-49. [ Links ]
186. Tjandrawinata RR, Hawel L 3rd, Byus CV. Regulation of putrescine export in lipopolysaccharide or IFN-g-activated murine monocytic-leukemic RAW 264 cells. J Immunol 1994; 152 (6): 3039-52. [ Links ]
187. Xie X, Gillies RJ, Gerner EW. Characterization of a diamine exporter in Chinese hamster ovary cells and identification of specific polyamine substrates. J Biol Chem 1997; 272 (33): 20484-9. [ Links ]
188. Pastorian KE, Byus CV. Tolerance to putrescine toxicity in Chinese hamster ovary cells is associated with altered uptake and export. Exp Cell Res 1997; 231 (2): 284-95. [ Links ]
189. Sala R, Rotoli BM, Colla E, Visigalli R, Parolari A, Bussolati O, et al. Two-way arginine transport in human endothelial cells: TNF-a stimulation is restricted to system y+. Am J Physiol Cell Physiol 2002; 282 (1): C134-43. [ Links ]
190. Seiler N. Catabolism of polyamines. Amino Acids 2004; 26 (3): 217-33. [ Links ]
191. Zahedi K, Huttinger F, Morrison R, Murray-Stewart T, Casero RA, Strauss KI. Polyamine catabolism is enhanced after traumatic brain injury. J Neurotrauma 2010; 27 (3): 515-25. [ Links ]
192. Casero RA, Pegg AE. Polyamine catabolism and disease. Biochem J 2009; 421 (3): 323-38. [ Links ]
193. Muller AJ, Scherle PA. Targeting the mechanisms of tumoral immune tolerance with small-molecule inhibitors. Nat Rev Cancer 2006; 6 (8): 613-25. [ Links ]
194. Hong SK, Chaturvedi R, Piazuelo MB, Coburn LA, Williams CS, Delgado AG, et al. Increased expression and cellular localization of spermine oxidase in ulcerative colitis and relationship to disease activity. Inflamm Bowel Dis 2010; 16 (9): 1557-66. [ Links ]
195. Minois N, Carmona-Gutierrez D, Madeo F. Polyamines in aging and disease. Aging 2011; 3 (8): 1-17. [ Links ]
196. Toninello A, Pietrangeli P, De Marchi U, Salvi M, Mondovì B. Amine oxidases in apoptosis and cancer. Biochim Biophys Acta 2006; 1765 (1): 1-13. [ Links ]
197. Keller JM, Cablé S, el Bouhtoury F, Heusser S, Scotto C, Armbruster L, et al. Peroxisome through cell differentiation and neoplasia. Biol Cell 1993; 77 (1): 77-88. [ Links ]
198. Casero RA Jr, Wang Y, Stewart TM, Devereux W, Hacker A, Wang Y, et al. The role of polyamine catabolism in anti-tumour drug response. Biochem Soc Trans 2003; 31 (2): 361-5. [ Links ]
199. Thomas T, Thomas TJ. Polyamine metabolism and cancer. J Cell Mol Med 2003; 7 (2): 113-26. [ Links ]
200. Amendola R, Cervelli M, Fratini E, Polticelli F, Sallustio DE, Mariottini P. Spermine metabolism and anticancer therapy. Curr Cancer Drug Targets 2009; 9 (2): 118-30. [ Links ]
201. Basu HS, Thompson TA, Church DR, Clower CC, Mehraein-Ghomi F, Amlong CA, et al. A small molecule polyamine oxidase inhibitor blocks androgen-induced oxidative stress and delays prostate cancer progression in the transgenic adenocarcinoma of the mouse prostate model. Cancer Res 2009; 69 (19): 7689-95. [ Links ]
202. Häkkinen MR, Hyvönen MT, Auriola S, Casero RA Jr, Vepsäläinen J, Khomutov AR, et al. Metabolism of N-alkylated spermine analogues by polyamine and spermine oxidases. Amino Acids 2010; 38 (2): 369-81. [ Links ]
203. Cervelli M, Bellavia G, E Fratini, Amendola R, F Polticelli, M Barba, et al. Spermine oxidase (SMO) activity in breast tumor tissues and biochemical analysis of the anticancer spermine analogues BENSpm and CPENSpm. BMC Cancer 2010; 10: 555. [ Links ]
204. Pledgie-Tracy A, Billam M, Hacker A, Sobolewski MD, Woster PM, Zhang Z, et al. The role of the polyamine catabolic enzymes SSAT and SMO in the synergistic effects of standard chemotherapeutic agents with a polyamine analogue in human breast cancer cell lines. Cancer Chemother Pharmacol 2010; 65 (6): 1067-81. [ Links ]
205. Gobert AP, Chaturvedi R, Wilson KT Methods to evaluate alterations in polyamine metabolism caused by Helicobacter pylori infection. Methods Mol Biol 2011; 720: 409-25. [ Links ]
206. Chaturvedi R, Asim M, Romero-Gallo J, Barry DP, Hoge S, de Sablet T, et al. Spermine oxidase mediates the gastric cancer risk associated with Helicobacter pylori CagA. Gastroenterology 2011; 141 (5): 1696-708.e1-2. [ Links ]
207. Paschen W. Polyamine metabolism in different pathological states of the brain. Mol Chem Neuropathol 1992; 16 (3): 241-71. [ Links ]
208. Seiler N. Oxidation of polyamines and brain injury. Neurochem Res 2000; 25 (4): 471-90. [ Links ]
209. Igarashi K, Ueda S, Yoshida K, Kashiwagi K. Polyamines in renal failure. Amino Acids 2006; 31 (4): 477-83. [ Links ]
210. Igarashi K, Kashiwagi K. Use of polyamine metabolites as markers for stroke and renal failure. Methods Mol Biol 2011; 720: 395-408. [ Links ]
211. Levillain O, Ramos-Molina B, Forcheron F, Peñafiel R. Expression and distribution of genes encoding for polyamine-metabolizing enzymes in the different zones of male and female mouse kidneys. Amino Acids 2012; 43 (5): 2153-63. [ Links ]
212. Zahedi K, Barone S, Kramer DL, Amlal H, Alhonen L, Jänne J, Porter CW, Soleimani M. The role of spermidine/spermine N1-acetyltransferase in endotoxin-induced acute kidney injury. Am J Physiol Cell Physiol 2010; 299 (1): C164-74. [ Links ]
213. Bjelakovic G, Beninati S, Bjelakovic B, Sokolovic D, Jevtovic T, Stojanovic I, et al. Does polyamine oxidase activity influence the oxidative metabolism of children who suffer of diabetes mellitus? Mol Cell Biochem 2010; 341 (1-2): 79-85. [ Links ]
214. Fiori LM, Wanner B, Jomphe V, Croteau J, Vitaro F, Tremblay RE, et al. Association of polyaminergic loci with anxiety, mood disorders, and attempted suicide. PLoS One 2010; 5 (11): e15146. [ Links ]
215. Fiori LM, Turecki G. Genetic and epigenetic influences on expression of spermine synthase and spermine oxidase in suicide completers. Int J Neuropsychopharmacol 2010; 13 (6): 725-36. [ Links ]
Aceptado para su publicación el 12 de septiembre de 2012













