Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957
Acta bioquím. clín. latinoam. vol.47 no.2 La Plata abr./jun. 2013
BIOQUÍMICA CLÍNICA
Actividad antiproliferativa y anticolesterogénica de estatinas y monoterpenos*
Antiproliferative and anticholesterogenic activityof statins and monoterpenes
Atividade antiproliferativa e anticolesterogênicade estatinas e monoterpenos
Mónica Polo1a, Rosana Crespo2a, Marianela Galle3a, Boris Rodenak Kladniev4a, Sandra Montero Villegas5b, Margarita García de Bravo6a
1 Dra. de la Facultad de Ciencias Exactas.
2 Dra. en Ciencias Naturales.
3 Bioquímica.
4 Licenciado en Biotecnología y Biología Molecular.
5 Médica.
6 Dra. en Ciencias Bioquímicas.
a Universidad Nacional de La Plata.
b Universidad de Costa Rica.
* Instituto de Investigaciones Bioquímicas de La Plata (INIBIOLP). UNLP-CONICET CCT La Plata. Facultad de Ciencias Médicas Calle 60 y 120. 1900 La Plata. Provincia de Buenos Aires, Argentina.
CORRESPONDENCIA DRA. MARGARITA GARCÍA DE BRAVO INIBIOLP. Facultad de Ciencias Médicas Calle 60 y 120 1900 LA PLATA mgarcia@med.unlp.edu.ar
Resumen
Las estatinas son inhibidores competitivos de la 3-hidroxi-3-metilglutaril-coenzima A (HMG-CoA) reductasa ampliamente usados en los tratamientos contra las hipercolesterolemias. Los monoterpenos son componentes no nutritivos de la dieta presentes en aceites esenciales de varias plantas que han demostrado tener múltiples efectos en la vía del mevalonato. Se estudia el efecto y mecanismo de acción de monoterpenos presentes en aceites esenciales, así como la combinación de éstos entre sí y con simvastatina sobre la síntesis de colesterol, el metabolismo lipídico y la proliferación celular in vitro en células hepáticas Hep G2 y no hepáticas A549, e in vivo en ratones atímicos huéspedes y no huéspedes de tumores derivado de células A549 implantados en ellos. Se abre así una gran expectativa sobre la potencialidad de la administración conjunta de distintos monoterpenos y de extractos naturales de aceites esenciales en el mejoramiento de las terapias antihipercolesterolemiantes y/o el tratamiento del cáncer, como así también en el potencial sinergismo con estatinas como una alternativa para disminuir las dosis efectivas y los efectos indeseados y/o tóxicos.
Palabras clave: Vía del mevalonato; Estatinas; Monoterpenos; Proliferación celular; Colesterogénesis; Células hep G2; Células A549; Ratones atímicos.
Summary
Statins are competitive inhibitors of HMG-CoA reductase used in hypercholesterolemic patients. Monoterpenes are non-nutritive dietary components found in the essential oils of many plants with pharmacologic effects on mevalonate metabolism. The study is centered on the effects and action mechanisms of the monoterpene components of essential oils and the combination of monoterpenes between them and combined with simvastatin on cholesterogenesis, lipid metabolism and cellular proliferation in vitro using two established cell lines, Hep G2 (derived from a human hepatoblastoma), A549 (derived from a human lung adenocarcinoma) and in vivo in no host and host nude mice carrying implanted tumors derived from A549. This opens up great expectations about the potential of co-administration of different natural isoprenoids and essential oils in improving anti-cholesterolemic therapies and/or cancer treatment as well as in the potential synergism with statins as an alternative to lower effective doses, decreasing the likelihood of undesired and/or toxic effects.
Key words: Mevalonte pathway; Statins; Monotepenes; Cellular proliferation; Cholesterogenesis; Hep G2 cells; A549 cells; Athymic mice.
Resumo
As estatinas são inibidores competitivos da 3-hidroxi-3-metilglutaril - coenzima A (HMG-CoA) reductase amplamente utilizados nos tratamentos contra as hipercolesterolemias. Os monoterpenos são componentes não nutritivos da dieta encontrados em óleos essenciais de várias plantas que demonstraram ter múltiplos efeitos na via do mevalonato. Estudamos o efeito e o mecanismo de ação de monoterpenos encontrados em óleos essenciais, bem como a combinação deles entre si e com sinvastatina sobre a síntese de colesterol, o metabolismo lipídico e a proliferação celular in vitro em células hepáticas Hep G2 e não hepáticas A549 e in vivo em camundongos atímicos hospedeiros ou não hospedeiros de tumores derivados de células A549 implantadas neles. Isto abre grandes expectativas sobre o potencial da co-administração de diferentes monoterpenos e de extratos naturais de óleos essenciais na melhoria das terapias anti-hipercolesterolemiantes e/ou tratamento do câncer, assim como no potencial sinergismo com estatinas como uma alternativa para reduzir as doses efetivas e os efeitos indesejáveis e/ou tóxicos.
Palavras-chave: Via do mevalonato; Estatinas; Monoterpenos; Proliferação celular; Colesterogênese; Células hep G2; Células A549; Camundongos atímicos.
Vía del mevalonato
La vía del mevalonato produce isoprenoides que son finalmente incorporados en diversos productos finales (esteroles y no esteroles) como colesterol, dolicol, ubiquinona, isopenteniladenina, geranilgeranilpirofosfato (GGPP) y farnesilpirofosfato (FPP) (1). El colesterol es un componente esencial de la membrana celular y precursor para la síntesis de hormonas esteroideas y ácidos biliares (2). El dolicol es una molécula portadora de oligosacáridos en la N-glicosilación de proteínas vinculadas a la producción de glicoproteínas. La ubiquinona está involucrada en la respiración mitocondrial y puede desempeñar un papel importante en la inhibición de la peroxidación lipídica (3). La isopenteniladenina es el sustrato esencial para la modificación de algunos ARNt. Geranilgeranil transferasa y farnesil transferasa utilizan GGPP y FPP, respectivamente, para las modificaciones postraduccionales de ciertas proteínas de la superfamilia Ras, GTPasas pequeñas que regulan importantes procesos celulares, como proliferación celular, diferenciación, apoptosis y organización del citoesqueleto (4).
La vía del mevalonato está presente en células de todos los tejidos estudiados y es particularmente activa en el hígado, órgano que cumple un rol central en el mantenimiento de la homeostasis del colesterol corporal. La etapa limitante de la velocidad de la vía es la conversión de 3-hidroxi-3-metil glutaril coenzima A (HMG CoA) en mevalonato, que es catalizada por la HMG CoA reductasa (HMGCR). Esta enzima se encuentra regulada a nivel transcripcional, traduccional y postraduccional a través del propio colesterol y de algunos intermediarios de la vía (1).
Ensayos in vivo han demostrado un incremento de la actividad de HMGCR en hígado de ratones NIH nude portadores de un carcinoma mucoepidermoide de pulmón humano (HLMC) en respuesta a la disminución de la colesterolemia ocasionada por la elevada demanda de colesterol del tejido tumoral (5) (Tabla I) y una correlación positiva entre la actividad de reductasa hepática y la severidad de la patología tumoral mamaria en ratas seniles (6).
Tabla I. Actividad HMGCR hepáticaa y colesterolemiab de ratones nude no portadores y portadores del HLMC sacrificados a la medianoche.

a La actividad de HMGCR se determinó cuantificando la conversión de 14C-HMG CoA en 14C-mevalonato utilizando microsomas hepáticos aislados como fuente de enzima. Los valores son medias ± DE de diez muestras individuales, cada una analizada por duplicado.
b La colesterolemia se determinó en plasma utilizando un kit enzimático. Los valores son medias ± DE de cinco muestras individuales, cada una analizada por duplicado.
Las medias dentro de un tejido común son diferentes: * p<0,05 y ** p<0,01.
En la mayoría de las células tumorales la regulación negativa ejercida por el colesterol e intermediarios de la vía sobre la HMGCR está ausente o deteriorada, lo cual resulta en una generación descontrolada de productos (7). No obstante, los estudios realizados en células de la línea Hep G2 (derivadas de un hepatoblastoma humano) han demostrado que la presencia de suero fetal en el medio de cultivo inhibe la actividad de la HMGCR (Vmax en pmoles mevalonato/min/mg de proteína celular: 314,01 sin suero vs 113,20 con suero)
sin modificar los valores de KM (1,88 x 10-5M sin suero vs 1,99 x 10-5M con suero) y que la adición de mevalonato a un medio con suero inhibe aún más a la actividad reductasa (Tabla II). Estos resultados permiten sugerir que, al igual que en diversas células normales en cultivo, en Hep G2 el control por esteroles y no-esteroles derivados de la vía del mevalonato está conservado de modo que estas células pueden considerarse un modelo útil y fidedigno para el estudio de esta vía en células hepáticas (8).
Tabla II. Efecto de la adición de suero y/o mevalonato al medio de cultivo sobre la actividad HMGCR en células Hep G2.

Células Hep G2 en fase logarítmica de crecimiento fueron incubadas durante las últimas 24 horas en medios con o sin suero fetal y en presencia o ausencia de mevalonato. La actividad de HMGCR se determinó cuantificando la conversión de 14C-HMG CoA en 14C-mevalonato utilizando suspensión de células homogeneizadas por sonicación como fuente de enzima. Los valores son medias ± DE de cuatro muestras individuales, cada una analizada por duplicado.
Significativamente diferente respecto al control correspondiente: * p<0,001.
Estatinas
Las estatinas son inhibidores competitivos de la HMGCR que afectan la colesterogénesis en una etapa temprana de la vía del mevalonato (9). Estos compuestos se utilizan con éxito en el tratamiento de la hipercolesterolemia en humanos, ya que ocasionan una disminución del contenido de colesterol celular que se traduce vía proteínas de unión al elemento regulador de esteroles 2 (SREBP-2) en un incremento del número de receptores para lipoproteínas plasmáticas de baja densidad (LDL) con el concomitante aumento de la captación de LDL-colesterol del plasma (1)(10). La dosis terapéutica de estatinas para el tratamiento de la hipercolesterolemia es 1 mg/kg/día la cual conduce a niveles séricos de 0,1 mM (11). Si bien las dosis utilizadas son bien toleradas, pueden presentarse efectos secundarios adversos, los cuales incluyen hepatotoxicidad y miotoxicidad, pudiendo llegar en raros casos a la rabdomiólisis. La aparición de estos efectos secundarios aumenta por factores predisponentes (edad, sexo, tamaño corporal), con el incremento de las concentraciones plasmáticas de estatina, y con el uso concomitante de diversas drogas como inhibidores de citocromo P450 y otros fármacos reductores de lípidos (12)(13).
Ensayos realizados en ratones nude demostraron que dosis diarias de 50 mg/kg de simvastatina (una de las estatinas más utilizadas en el tratamiento de hipercolesterolemias en humanos) administradas a través del agua de bebida disminuyen el contenido de colesterol en hígado, incrementan 4,4 veces la HMGCR hepática y no modifican el colesterol plasmático (Tabla III). El hecho que las estatinas no posean actividad hipocolesterolemiante en roedores es atribuido a una capacidad limitada de catabolizar lipoproteínas plasmáticas a nivel hepático (14) y a una pronunciada inducción de la síntesis de HMGCR estimulada por SREBP-2.
Tabla III. Actividad HMGCR hepáticaa, contenido de colesterol hepáticob y colesterolemiac de ratones nude tratados durante 30 días con simvastatina (50 mg/kg/día) y sacrificados a la medianoche..
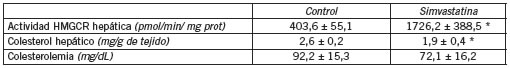
a La actividad de HMGCR está expresada en picomoles de 14C-mevalonato formado por minuto por miligramo de proteína microsomal. Como fuente se enzima se utilizaron microsomas lavados con buffer conteniendo Brij 96 para eliminar la simvastatina.
b La cuantificación del contenido de colesterol hepático se realizó por GLC con un estándar interno de b-sitosterol.
c La colesterolemia se determinó en plasma utilizando un kit enzimático.
Los valores son medias ± DE de cinco muestras individuales, cada una analizada por duplicado.
Las medias dentro de un tejido común son diferentes: * p<0,05.
Para evaluar in vitro el efecto de la simvastatina en la biosíntesis de lípidos insaponificables, se realizaron estudios en células Hep G2 empleando 14C-acetato. Se demostró que la concentración mínima requerida para inhibir la incorporación de acetato en lípidos insaponificables es de 0,025 mM y que una concentración 1 mM inhibe un 41% la colesterogénesis (15).
Otro efecto descrito de las estatinas sobre el metabolismo lipídico es su influencia sobre los niveles de triglicéridos (TG) y ácidos grasos no esterificados (NEFA) plasmáticos por mecanismos no bien elucidados (16)(17) desconociéndose si controlan de alguna manera la incorporación y el destino intracelular de los lípidos. Bellini et al describieron por primera vez el efecto de una estatina sobre el metabolismo lipídico en una célula del epitelio pulmonar (células A549). Esta droga aumenta la incorporación de ácidos grasos poliinsaturados (Figura 1) e incrementa un 30% la actividad de la D5 desaturasa medida por conversión de ácido eicosatrienoico (n-6) en ácido araquidónico (% de conversión 58,1 vs 75,7) (18).

Figura 1. Incorporación de radiactividad en células A549 incubadas en presencia de varios [1-14C] ácidos grasos con y sin 90 mM simvastatina. Los valores representan las medias ± DE (n = 4), (*) p<0,05. Todos los ácidos grasos fueron adicionados como sales sódicas unidos a albúmina delipidizada en concentración 0,66 mM por 24 h.
Tabla IV. Actividad HMGCR hepáticaa y colesterolemiab de ratones nude portadores del HLMC tratados con 50 mg/kg/día de simvastatina durante 33 días y sacrificados a la medianoche.
a La actividad de HMGCR está expresada en picomoles de 14C-mevalonato formado por minuto por miligramo de proteína microsomal. Como fuente se enzima se utilizaron microsomas lavados con buffer conteniendo Brij 96 para eliminar la simvastatina.
b La colesterolemia se determinó en plasma utilizando un kit enzimático.
Los valores son medias ± DE de cinco muestras individuales, cada una analizada por duplicado.
Las medias dentro de un tejido común son diferentes: * p<0,05.
Además de los efectos sobre la colesterogénesis, y dado que la inhibición de la vía del mevalonato por las estatinas se da en una etapa temprana de la misma, estas drogas afectan también la generación de los otros productos finales estrechamente vinculados con el crecimiento y la proliferación celular (19).
Diversos estudios demuestran que las estatinas poseen actividad antitumoral y sugieren un potencial rol para la prevención de cánceres humanos. Sus efectos antitumorales resultarían de la inhibición de la proliferación celular, la promoción de la apoptosis y la prevención de la metástasis y serían mediados fundamentalmente por la inhibición de la actividad de Ras y RhoA ocasionada por la falta de prenilación (20).
La inhibición de la proliferación celular por estatinas se ha descrito en diversas líneas celulares (20). El efecto antiproliferativo se logra a concentraciones efectivas para la inhibición de la prenilación de proteínas, las cuales son cientos de veces mayores a las requeridas para disminuir colesterogénesis debido a la baja afinidad relativa de la escualeno sintasa por el FPP (21)(22).
Estudios en líneas tumorales humanas, en los cuales la viabilidad y proliferación fueron determinadas por conteo en hemocitómetro de células que excluyen el azul tripán y por medida de la reducción del bromuro de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolium (MTT) a formazan por acción de la succinato deshidrogenasa mitocondrial, demostraron que la simvastatina inhibe la proliferación de células Hep G2 y A549 a partir de concentraciones 10 mM y 40 mM, respectivamente (15)(23).
A diferencia de lo observado en cultivos celulares, los resultados respecto a la capacidad antitumoral de las estatinas in vivo son contradictorios y dependen de la dosis utilizada, la vía de administración y la velocidad de crecimiento del tumor. La administración a través del agua de bebida de 50 mg/kg de peso/día de simvastatina durante 33 días a ratones NIH nude portadores del carcinoma de pulmón humano HLMC no disminuye el crecimiento del tumor ocasionando una gran inducción de la HMGCR hepática y tumoral con un colesterolemia conservada (Tabla IV) (24).
Tabla IV. Actividad HMGCR hepáticaa y colesterolemiab de ratones nude portadores del HLMC tratados con 50 mg/kg/día de simvastatina durante 33 días y sacrificados a la medianoche.

a La actividad de HMGCR está expresada en picomoles de 14C-mevalonato formado por minuto por miligramo de proteína microsomal. Como fuente se enzima se utilizaron microsomas lavados con buffer conteniendo Brij 96 para eliminar la simvastatina.
b La colesterolemia se determinó en plasma utilizando un kit enzimático.
Los valores son medias ± DE de cinco muestras individuales, cada una analizada por duplicado.
Las medias dentro de un tejido común son diferentes: * p<0,05.
En aquellos estudios donde se ha logrado disminuir el crecimiento tumoral la cantidad administrada por kg de peso fue al menos 50 veces superior a la dosis máxima recomendada en terapias hipocolesterolemiantes en humanos, pudiendo resultar tóxicas para el huésped. También son contradictorios los resultados respecto a la asociación del uso de estatinas con el riesgo de contraer determinados tumores (25). Por lo tanto, la utilización de las estatinas como drogas antitumorales es muy discutida y la mayor parte de los resultados prometedores se han obtenido con la combinación de estatinas y agentes quimioterapéuticos (20)(26).
Monoterpenos
Los monoterpenos, como el geraniol, d-limoneno, perililalcohol y mentol son isoprenoides componentes no nutritivos de la dieta presentes en aceites esenciales de frutas cítricas, cereza, romero, albahaca, menta y otras hierbas aromáticas. Los isoprenoides (más de 22.000 compuestos) son derivados de la vía del mevalonato en plantas pero no son producidos por mamíferos y hongos (27). En la naturaleza están implicados en diversas interacciones entre las plantas, plantas con animales y/o plantas con microorganismos. Pueden funcionar como agentes de defensa, quimioatrayentes y repelentes de insectos. Funcionan también como hormonas, moléculas de señalización, de expresión de genes, en vías de transducción de señales, transportadores de electrones o dentro de la maquinaria fotosintética (28).
Se ha demostrado que algunos isoprenoides son capaces de disminuir el colesterol sérico (29) e inhibir el crecimiento de células tumorales tanto in vitro (30)(31) como in vivo (32-35), fenómeno que ha sido atribuido a los múltiples efectos farmacológicos de estos compuestos sobre la vía del mevalonato: inhibición la actividad HMG-CoA reductasa (36), inhibición de alguna enzima involucrada en la conversión de lanosterol en colesterol (30)(37) e inhibición de la isoprenilación de proteínas posiblemente a nivel de las enzimas prenil:proteína transferasas (38).
Estudios in vitro, realizados en células Hep G2 y A549, con geraniol, limoneno, linalool y cineol demuestran que todos ellos poseen actividad anticolesterogénica y antiproliferativa (15)(30)(39)(40) aunque las concentraciones efectivas varían según la línea celular y el monoterpeno utilizado (Tabla V).
Tabla V. Actividad antiproliferativaa y anticolesterogénicasb de monoterpenos naturales en células Hep G2 y A549.

Células Hep G2 y A549 en fase exponencial de crecimiento fueron tratadas con concentraciones crecientes de cada uno de los monterpenos.
a La proliferación celular fue determinada por el test de MTT. Se construyeron curvas dosis vs % de inhibición de proliferación y se calcularon las concentraciones que inhiben la proliferación un 50% (IC50 p).
b La síntesis de colesterol fue cuantificada por incorporación de acetato. Se construyeron curvas dosis vs % de inhibición de síntesis de colesterol y se calcularon las concentraciones que inhiben colesterogénesis un 50% (IC50 sc).
Los valores son medias ± DE de cuatro muestras individuales.
Estudios realizados para analizar el efecto del geraniol, un monoterpeno dietario, sobre la vía del mevalonato y la proliferación en células Hep G2 demostraron que concentraciones superiores a 1 μM inhiben la colesterogénesis (15) y que concentraciones mayores a 100 μM inhiben la proliferación, la actividad HMGCR celular, la conversión de lanosterol en colesterol y la prenilación de proteínas, e incrementan la incorporación de colesterol desde el medio de manera dosis dependiente (30). La inhibición de la proliferación ocasionada por el geraniol 200 mM no es revertida por la adición de mevalonato exógeno, demostrando que la inhibición de la HMGCR no es responsable de la disminución del crecimiento a esa concentración (30).
En cuanto a los mecanismos de acción de monoterpenos sobre la HMGCR, Crespo et al demostraron que el geraniol ocasiona un incremento ARNm de SREBP-2 y HMGCR (Figura 2) conjuntamente con una disminución de la cantidad y actividad de HMGCR (Figura 3). De modo que este monoterpeno regula la actividad de la reductasa por un mecanismo postranscripcional que podría estar mediado por el propio geraniol o por intermediarios de la vía del mevalonato acumulados como consecuencia del tratamiento (41)(42).
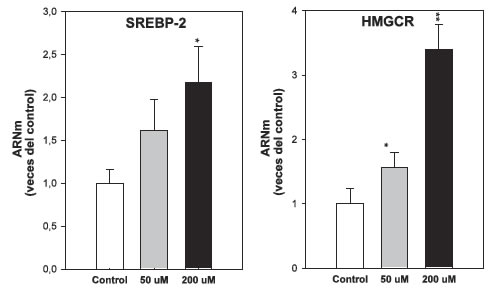
Figura 2. Cuantificación de ARNm de SREBP-2 y HMGCR en células Hep G2 tratadas con geraniol. Las células fueron cultivadas en botellas de 25 cm2 y tratadas con geraniol (50 y 200 μM) en IMEM-Zo durante 24 h. La expresión del ARNm fue determinada por real-time RT-PCR. Los valores son medias ± DE de tres experimentos independientes, cada uno analizado por triplicado. (*) p<0,05 vs. control, (**) p<0,01 vs. Control.

Figura 3. Efecto del geraniol sobre la cantidada y actividadb de HMGCR en células Hep G2. Las células fueron cultivadas en botellas de 95 cm2 y tratadas con geraniol (50 y 200 μM) en IMEM-Zo durante 24 h.
a Las proteínas de lisados celulares fueron separadas por electroforesis en gel de poliacrilamida 12,5% (p/v) con dodecilsulfato de sodio (SDS) seguida de inmunotransferencia.
b La actividad HMGCR fue determinada por radioensayo utilizando suspensión de células homogeneizadas por sonicación como fuente de enzima.
Los valores representan la media ± DE de tres experimentos independientes, cada uno analizado por triplicado. (*) p<0.05 vs. control, (**) p<0.01 vs. control.
Estudios realizados in vivo demostraron la capacidad antilipogénica e hipolipemiante del geraniol en ratones nude. El tratamiento de los animales con dietas suplementadas con geraniol (50-75 mmol/kg de dieta) durante 21 días inhibe la HMGCR hepática a nivel postranscripcional -en concordancia con lo observado en células Hep G2- y la síntesis de colesterol y ácidos grasos a partir de acetato. También ocasiona un aumento del ARNm del receptor de LDL hepático y una disminución de la colesterolemia y la trigliceridemia (43).
Los estudios realizados en el modelo de células A549 implantadas en ratones atímicos demuestran la capacidad antitumoral del geraniol in vivo. El geraniol administrado como suplemento dietario (50-75 mmoles/kg dieta) reduce significativamente el crecimiento tumoral y aumenta la apoptosis (medida por actividad caspasa-3 y ensayo TUNEL) en las células tumorales (41). Estos resultados conjuntamente con las evidencias bien documentadas por 250 estudios epidemiológicos (44) de la relación inversa entre el riesgo de cáncer y el consumo de frutas y vegetales, presentan al geraniol como un compuesto natural con un gran potencial anticancerígeno.
Si bien los niveles de cada uno de los isoprenoides obtenidos a partir de la ingesta alimentaria probablemente no tienen suficiente impacto sobre la vía del mevalonato para ejercer un efecto contra el cáncer, la protección conferida por los productos derivados de las plantas puede ser atribuida a la acumulación de los efectos de los isoprenoides constituyentes sobre la actividad desregulada de la vía del mevalonato característica del tejido tumoral (45). Por este motivo, en los últimos años ha habido un interés considerable y creciente en el uso de aceites esenciales ricos en isoprenoides en el tratamiento de múltiples patologías como cáncer (44-46), diabetes (47)(48) o hipercolesterolemia (49).
Resultados alentadores de estudios realizados en células tumorales humanas Hep G2 y A549 demuestran efectos sinérgicos al combinar monoterpenos puros (39) y alta eficacia antiproliferativa y anticolesterogénica de aceites esenciales ricos en múltiples isoprenoides (40)(50).
Combinación estatinas-monoterpenos
El hecho de que la inhibición de la HMG-CoA reductasa por los monoterpenos se produzca a través de un mecanismo diferente del empleado por las estatinas y que, además, afecten a la vía del mevalonato a otros niveles, abre una expectativa enorme respecto a la posibilidad de que el uso combinado de estatinas con monoterpenos naturales (suministrados como complemento o suplemento de la dieta) permita:
- disminuir la dosis efectiva de las estatinas en el tratamiento de hipercolesterolemias hasta valores en los cuales los efectos indeseables sean prácticamente nulos e
- incrementar la eficacia antitumoral de ambos compuestos
Al respecto, Polo et al demostraron efectos sinérgicos de la combinación de geraniol con simvastatina en células Hep G2, tanto en lo que respecta a la inhibición del la proliferación celular como en la inhibición de la colesterogénesis (15). Estos estudios también sugieren que la vía del mevalonato está potencialmente ligada a la regulación de la biosíntesis de fosfolípidos. Se están llevando a cabo experimentos in vivo a fin de estudiar el efecto del tratamiento combinado de geraniol con simvastatina en el crecimiento tumoral y la homeostasis del colesterol y analizar la potencial capacidad de los monoterpenos para evitar la inducción de la reductasa (hepática y tumoral) ocasionada por las estatinas. Se utilizan hembras (nu/nu) ya que también se demostró que los machos nude son hipocolesterolémicos e hipotrigliceridémicos, en comparación con las hembras (51) y/o ratones heterocigotas (+/nu).
Estos estudios contribuirán a un mejor conocimiento de la acción de isoprenoides naturales que interfieren en una vía metabólica tan compleja como la vía del mevalonato. El uso de combinaciones de estos compuestos o de aceites esenciales ricos en ellos, podría mejorar el uso de estatina en la lucha contra el cáncer y/o enfermedades cardiovasculares.
1. Goldstein JL, Brown M S. Regulation of the mevalonate pathway. Nature (Lond.) 1990; 343: 425-30. [ Links ]
2. Edwards PA, Ericsson J. Sterols and isoprenoids: signaling molecules derived from the cholesterol biosynthetic pathway. Annu Rev Biochem 1999; 68: 157-85. [ Links ]
3. Stocker R, Bowry VW, Frei B. Ubiquinol-10 protects human low density lipoprotein more efficiently against lipid peroxidation than does -tocopherol. Proc Natl Acad Sci USA 1991; 88: 1646-50. [ Links ]
4. Vojtek AB, Der CJ. Increasing complexity of the Ras signaling pathway. J Biol Chem 1998; 273: 19925-8. [ Links ]
5. Polo M, Bravo MG de, Carbone C. 3-Hydroxy-3-methylglutaryl coenzyme A reductase activity in liver of athymic mice with or without an implanted human carcinoma. Comp Biochem Phys Part B 1999; 122: 433-7. [ Links ]
6. Polo M, García-Bravo M, Igal IN, Tacconi-Gómez Dumm IN, Goya R. Age changes in the activity of liver 3-hydroxy-3-methylglutaryl-CoA reductase in female rats: Influence of mammary pathology. Mech Ageing Dev 1998; 100: 41-51. [ Links ]
7. Siperstein MD. Role of cholesterogenesis and isoprenoids synthesis in DNA replication and cell gowth. J Lipid Res 1984; 25: 1462-8. [ Links ]
8. Polo MP, Alaniz MJT de, Bravo MG de. Algunos aspectos de la regulación de la síntesis de mevalonato en células Hep G2 en cultivo. FABICIB 2002; 6: 9-17. [ Links ]
9. Istvan FS, Deisenhofer J. Structural mechanism for statin inhibition of HMG-CoA reductase. Science 2001; 292: 1160-4. [ Links ]
10. Brown MS, Goldstein J L. A proteolytic pathway that controls the cholesterol content of membranes, cells, and blood. Proc Natl Acad Sci USA 1999; 96:11041-8. [ Links ]
11. Pan HY, DeVault AR, Wang-Iverson D, Ivashkiv E, Swanson BN, Sugerman AA. Comparative pharmacokinetics and pharmacodynamics of pravastatin and lovastatin. J Clin Pharmacol 1990; 30: 1128-35. [ Links ]
12. Rosenson RS. Current overview of statin-induced myopathy. Am J Med 2004; 116: 408-16. [ Links ]
13. Spalvieri MP, Oyola ME. Estatinas: incidencia de efectos adversos. Acta Bioquím Clín Latinoam 2011; 45 (4): 727-38. [ Links ]
14. Endo A, Tsujita Y, Kuroda M, Tanzawa K. Biochim Biophys Acta 1979; 575: 266-76. [ Links ]
15. Polo M, Crespo R, Bravo MG de. Geraniol and simvastatin show a synergistic effect on a human hepatocarcinoma cell line. Cell Biochem Funct 2011; 29: 452-8. [ Links ]
16. Gaw A. HDL-C and triglyceride levels: relationship to coronary heart disease and treatment with statins. Cardiovasc Drugs Ther 2003; 17: 53-62. [ Links ]
17. Roglans N, Sanguino E, Peris C, Alegret M, Vazquez M, Adzet T. Atorvastatin treatment induced peroxisome proliferator-activated receptor a expression and decreased plasma nonesterified fatty acids and liver triglyceride in fructose-fed rats. J Pharmaco Exp Ther 2002; 302: 232-9. [ Links ]
18. Bellini MJ, Polo MP, Alaniz MJT de, Bravo MG de. Effect of simvastatin on the uptake and metabolic conversion of palmitic, dihomo-gamma-linoleic and alpha-linolenic acids in A549 cells. Prostagland., Leukotr & Ess Fatty Acids 2003; 69: 351-7. [ Links ]
19. Demierre MF, Higgins PD, Gruber SB, Hawk E, Lippman SM. Statins and cancer prevention. Nat Rev Cancer 2005; 5: 930-42. [ Links ]
20. Sassano A, Platanias LC. Statins in tumor supresion. Cancer Lett 2008; 260: 11-9 [ Links ]
21. Moyad MA. Why a statin and/or another proven heart healthy agent should be utilized in the next major cancer chemoprevention trial: part I and II. Urol Oncol 2004; 22: 466-77. [ Links ]
22. Martinez-Botas J, Ferruelo AJ, Suarez Y. Dose-dependent effects of lovastatin on cell cycle progression. distinct requirement of cholesterol and non-sterol mevalonate derivatives. Biochim Biophys Acta 2001; 1532: 185-94. [ Links ]
23. Polo M, Crespo R, Bravo MG de. Simvastatin and geraniol show a synergistic effect on A549 cells. Biocell 2007; 31: Suplement 126. [ Links ]
24. Polo M, Bravo MG de. Simvastatin effect on a human lung carcinoma and cholesterol homeostasis of host and non-host mice. Arch Physiol Biochem 2001; 109(5): 435-40. [ Links ]
25. Brown AJ. Cholesterol, statins and cancer. Clin Exp Pharmacol Physiol 2007; 34: 135-41. [ Links ]
26. Osmak M. Statins and cancer: Current and future prospects. Cancer Lett 2012; 324: 1-12. [ Links ]
27. McGarvey DJ., Croteau R. Terpenoid Metabolism. Plant Cell 1995; 7: 1015-26. [ Links ]
28. Holstein S, Hohl R. Isoprenoids: Remarkable diversity of form and function. Lipids 2004; 39: 293-309. [ Links ]
29. Yu SG, Abuirmeileh NM, Qureshi AA, Elson CE. Dietary b-ionone suppresses hepatic 3-hydroxy-3-methyglutarul coenzyme A reductase activity. J Agric Food Chem 1994; 42: 1443-96. [ Links ]
30. Polo MP, Bravo MG de. Effect of geraniol on fatty acid and mevalonate metabolism in the human hepatoma cell line Hep G2. Biochem Cell Biol 2006; 84: 102-11. [ Links ]
31. Wiseman DA, Werner SR, Crowell PL. Cell cycle arrest by the isoprenoids perillyl alcohol, geraniol, and farnesol is mediated by p21Cip1 and p27Kip1 in human pancreatic adenocarcinoma cells. JPET 2007; 320: 1163-70. [ Links ]
32. Yuri1T, Danbara N, Tsujita-Kyutoku M, Kiyozuka Y, Senzaki H, Shikata N, et al. Perillyl alcohol inhibits human breast cancer cell growth in vitro and in vivo. Breast Cancer Res Treat 2004; 84: 251-60. [ Links ]
33. Burke YD, Ayoubi AS, Werner SR, McFarland BC, Heilman DK, Ruggeri BA, et al. Effects of the isoprenoids perillyl alcohol and farnesol on apoptosis biomarkers in pancreatic cancer chemoprevention. Anticancer Res 2002; 22: 3127-34. [ Links ]
34. Rao CV, Newmark HL, Reddy BS. Chemopreventive effect of farnesol and lanosterol on colon carcinogenesis. Cancer Detect Prev 2002; 26: 419-25. [ Links ]
35. Ong TP, Heidor R, de Conti A, Dagli ML, Moreno FS. Farnesol and geraniol chemopreventive activities during the initial phases of hepatocarcinogenesis involve similar actions on cell proliferation and DNA damage, but distinct actions on apoptosis, plasma cholesterol and HMGCoA reductase. Carcinogenesis 2006; 27: 1194-203. [ Links ]
36. Peffley DM, Gayen AK. Plant-derived monoterpenes suppress hamster kidney cel 3-hydroxy-3-methylglutaryl Coenzyme A reductase synthesis at the post-transcriptional level. J Nutr 2003; 133: 38-44. [ Links ]
37. Ren Z, Gould MN. Inhibition of ubiquinone and cholesterol synthesis by the monoterpene perillyl alcohol. Cancer Lett 1994; 76: 185-90. [ Links ]
38. Mo H, Elson CE. Studies of the isoprenoid-mediated inhibition of mevalonate synthesis applied to cancer chemotherapy and chemoprevention. Exp Biol Med (Maywood) 2004; 229: 567-85. [ Links ]
39. Rodenak-Kladniew B, Manassero C, Polo M, García de Bravo MM. Synergistic effects of monoterpenes on Hep G2 and A549 tumor cells. Biocell 2010; 34 Supl: 92. [ Links ]
40. Manassero CA, Girotti JR, Mijailovsky S, García de Bravo M, Polo M. In vitro comparative analysis of antiproliferative activity of essential oil from mandarin peel and its principal component limonene. Nat Prod Res 2012 (en prensa). [ Links ]
41. Crespo R, Galle M, Bravo MG de, Polo MP. Geraniol inhibits tumor cell proliferation in vitro and in vivo by posttranscriptional regulation of HMGCR. Biomedical Papers 2012; 156 Supl 1, 595. [ Links ]
42. Crespo R, Montero Villegas S, Abba M, García de Bravo M, Polo M. Transcriptional and posttranscriptional inhibition of HMGCR and PC biosynthesis by geraniol in two Hep-G2 cell-proliferation-linked pathways. Biochem Cell Biol 2012 (En prensa). [ Links ]
43. Galle M, Crespo R, Soberon MV, Polo M, García de Bravo M. Geraniol as a nutrigenomic hypolipidemic agent". Biocell 2012; 36 Supl: 107. [ Links ]
44. Smith-Warner SA, Giovannucci E. Fruit and vegetable intake and cancer. En: Heber D, Blackburn G, editors. Nutritional Oncology, San Diego, CA: Academic Press, 1999. p. 153-83. [ Links ]
45. Tatman D, Mo H. Volatile isoprenoid constituents of fruits, vegetables and herbs cumulatively suppress the proliferation of murine B16 melanoma and human HL-60 leukemia cells. Cancer Letters 2002; 175: 129-39. [ Links ]
46. Smith-Warner SA, Spiegelman D, Yaun SS, Adami H.O, Beeson WL, van den Brandt PA, et al. Intake of fruits and vegetables and risk of breast cancer: a pooled analysis of cohort studies, J Am Med Assoc 2001; 285: 769-76. [ Links ]
47. Tavafi M, Ahmadvand H, Tamjidipoor A, Delfan B, Khalatbari AR. Satureja khozestanica essential oil ameliorates progression of diabetic nephropathy in uninephrectomized diabetic rats. Tissue Cell 2011; 43: 45-51. [ Links ]
48. Chung MJ, Cho SY, Bhuiyan MJ, Kim KH, Lee SJ. Anti-diabetic effects of lemon balm (Melissa officinalis) essential oil on glucose- and lipid-regulating enzymes in type 2 diabetic mice. Br J Nutr 2010; 104(2):180-8. [ Links ]
49. Suanarunsawat T, Devakul Na Ayutthaya W, Songsak T, Thirawarapan S, Poungshompoo S. Antioxidant activity and lipid-lowering effect of essential oils extracted from ocimum sanctum L. leaves in rats fed with a high cholesterol diet. J Clin Biochem Nutr 2010; 46(1): 52-9. [ Links ]
50. Montero Villegas S, Cicció Alberti JF, Castro A, Polo M, García de Bravo M. Differential modulation of the mevalonate pathway by diverse Lippia alba chemotypes. Biocell 2012; 36 Supl, 107. [ Links ]
51. Bravo MG de, Polo M, Reggiani P, Galassi P, Rimoldi O, Goya R. Metabolic alterations in congenitally athymic male mice: effects of neonatal thymulin gene therapy . Biocell 2007; 31 Supl: 126. [ Links ]
Aceptado para su publicación el 20 de diciembre de 2012













