Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Acta bioquímica clínica latinoamericana
Print version ISSN 0325-2957
Acta bioquím. clín. latinoam. vol.47 no.2 La Plata Apr./June 2013
MEDICINA NUCLEAR
Detectores y aceleradores que curan
Curing detectors and accelerators
Detectores e aceleradores que curam
Mario Benedetti1
1 Investigador Principal del CONICET, Miembro Fundador del Laboratorio de Instrumentación y Control (LIC)de la Universidad Nacional de Mar del Plata, Agregado Científico Permanente del Centro Europeo de Investigación Nuclear (CERN) .
CORRESPONDENCIA MARIO BENEDETTI Universidad Nacional de Mar del Plata, Fac. de Ingeniería Laboratorio de Instrumentación y Control, LIC J. B. Justo 4302 7600 MAR DEL PLATA, Buenos Aires, Argentina E-mail: mbenedet14@gmail.com
Prólogo
Me sentí muy honrado cuando me invitaron a participar con un trabajo en un número homenaje de Acta Bioquímica Clínica Latinoamericana y mucho más cuando me enteré que estaba dedicado al Prof. Dr. Rodolfo Brenner.
Mi ingreso al Departamento de Física de la Universidad Nacional de La Plata, a mediados de los sesenta, se vio favorecido por la necesidad que tenía el Instituto de Fisiología de la Facultad de Ciencias Médicas de dicha universidad, de asegurar el buen funcionamiento de los equipos de Radiocromatografía que utilizaba justamente el Dr. Brenner.
Para esta tarea fue necesario crear y diseñar fuentes de laboratorio muy especiales, dando los primeros pasos de la especialidad hoy conocida como Electrónica de Potencia.
Con el tiempo, me he convertido en un especialista en la concepción y control de las fuentes utilizadas en los aceleradores de partículas, realizando varios aportes para el Centro Europeo de Investigación Nuclear (CERN), Suiza.
Así que mis inicios profesionales están íntimamente relacionados con él… ¡Gracias Dr. Brenner!
Resumen
Los aceleradores y los detectores utilizados en las investigaciones en física de partículas sirven y han servido desde hace más de 100 años para la detección y cura de enfermedades. Gracias a los avances en la física experimental de partículas, se han desarrollado a lo largo de los años aceleradores más potentes y sistemas de detección más precisos y sofisticados. Estos, conjuntamente con los modernos sistemas de cómputo, han permitido aplicaciones hasta hace poco tiempo impensadas en la medicina. En este trabajo se esboza la historia de estos instrumentos, sus principios de funcionamiento y sus ventajas en las aplicaciones médicas, especialmente en el campo de la detección y tratamiento de tumores.
Palabras clave: Detectores; Aceleradores; Tomografía de emisión de positrones; Hadronterapia; Detección y tratamiento de tumores.
Summary
Accelerators and detectors used in particle physics research have been used for more than 100 years for detection and cure of diseases. Thanks to the progress in experimental particle physics, more powerful accelerators and more precise and sophisticated systems have been developed. These, together with modern computation systems have enabled applications in medicine not even thought of until recently. This work outlines the history of these instruments, their working principles and advantages for health applications, especially in the field of tumor detection and treatment.
Key words: Detectors; Accelerators; Positron emission tomography; Hadrontherapy; Tumor detection and treatment.
Resumo
Os aceleradores e os detectores utilizados nas pesquisas em física de partículas servem e têm servido já faz mais de 100 anos para a detecção e cura de doenças. Devido aos avanços na física experimental de partículas, aceleradores mais potentes e sistemas de detecção mais precisos e sofisticados têm sido desenvolvidos ao longo dos anos. Eles, junto com os modernos sistemas de cômputo, permitiram aplicações até pouco tempo atrás impensadas em medicina. Neste trabalho esboçamos a história destes instrumentos, seus princípios de funcionamento e suas vantagens nas aplicações médicas, especialmente no campo da detecção e tratamento de tumores.
Palabras chave: Detectores; Aceleradores; Tomografia por emissão de positrones; Hadronterapia; Detecção e tratamento de tumores.
Introducción
Las partículas que se aceleran en los laboratorios de investigación en física, son partículas subatómicas cargadas, es decir electrones, protones o iones (siendo los iones los núcleos de moléculas a los cuales se les han extraído sus electrones). Para acelerar estas partículas se les aplica una diferencia de potencial con la polaridad conveniente, de tal forma que se alejen del electrodo de origen, de igual signo, y sean atraídas por el electrodo de destino, de signo contrario (1). La energía que alcanzan al final del recorrido depende de la diferencia de potencial entre los electrodos. Para el caso de un electrón y una diferencia de potencial de 1 volt, la energía es de 1 electrón volt, en forma abreviada 1eV. De la misma manera, si utilizamos un diferencia de potencial de 1000 Volt la energía alcanzada por las partículas es 1 KeV(Kilo electrón volt), para una tensión equivalente de un millón de Volt es 1 MeV (Mega electrón volt), para un mil millones de Volt es 1 GeV (Giga electrón volt) y para un millón de millones de Volt es 1 TeV (Tera electrón volt), etc.
Estas partículas, aceleradas a velocidades cercanas a la velocidad de la luz, se utilizan en física experimental para realizar estudios sobre el comportamiento de la materia, para lo cual se las hace colisionar contra un blanco fijo o contra otro haz de partículas aceleradas en sentido contrario. En los puntos de impacto se colocan detectores para registrar el resultado de las colisiones. Las diferentes partículas detectadas, deben ser identificadas tanto energéticamente como corpuscularmente. Estos detectores, cada vez más sofisticados, permiten reconstruir el resultado de la colisión en tres dimensiones con muy alta definición.
Los aceleradores de partículas y los detectores utilizados en el campo de la física fundamental, también son muy valiosos para la medicina, ya que hicieron posible el desarrollo de nuevas técnicas para el diagnóstico y tratamiento de numerosas enfermedades (2-5).
El Origen
El lunes 9 de noviembre 1895 el físico Wilhelm Conrad Röntgen observó un fenómeno que no habían advertido sus colegas, a pesar de que desde hacía muchos años utilizaban los mismos instrumentos para acelerar electrones, los tubos de Crookes (Fig. 1).

Figura 1. El aparato usado para la primera radiografía de la historia, el 22 de diciembre de 1895. La exposición fue larga: la señora de Röntgen tuvo que tener la mano inmóvil por 15 minutos.
En la oscuridad Röntgen observó por casualidad un brillo proveniente de un banco ubicado a un metro de distancia, donde estaba apoyada una hoja fluorescente de platino cianuro de bario: el débil resplandor aparecía cada vez que los electrones eran acelerados.
La nueva radiación -misteriosa, al punto que el descubridor la llamó "Rayos X"- era eléctricamente neutra, por lo tanto muy diferente de un haz de electrones (que está cargado negativamente, debido a que cada electrón tiene una carga elemental negativa).
En efecto, Röntgen había descubierto que los electrones acelerados -proyectiles subatómicos- cuando golpean los átomos del vidrio del recipiente -blancos fijos- crean, a expensas de su energía, una radiación hasta entonces desconocida, similar a la de los fotones que constituyen cada rayo de luz.
Pero, cada "fotón" de Röntgen transportaba mil veces más energía que un fotón de luz y era por lo tanto mucho más penetrante cuando se encontraba con la materia. Estos "Rayos X" atravesaban un bloque de madera, eran detenidos por una placa de plomo de 15 mm de espesor y producían en una placa fotográfica una imagen nunca antes vista de los huesos de una mano.
La señora de Röntgen pudo constatarlo cuando vio los huesos de su propia mano izquierda, con el anillo que llevaba en su dedo, en una placa fotográfica recientemente revelada por su marido.
El descubrimiento de la capacidad de "fotografiar lo invisible" tuvo un eco enorme. En pocas semanas los tubos de Rayos X se difundieron en los laboratorios de todo el mundo como herramientas para el diagnóstico de enfermedades y malformaciones y, en los hospitales militares de campaña, para radiografiar a los soldados heridos.
En la primera década del siglo XX se mejoraron las técnicas para controlar, colimar (obtener un fino haz de luz paralelo a partir de un haz divergente) y dosificar la radiación. Sin embargo, con los tubos de Crookes la duración de la exposición seguía siendo muy larga. En 1913, el médico norteamericano William Coolidge desarrolló y patentó el tubo que lleva su nombre (Fig. 2) El cátodo del tubo de Coolidge, hecho de filamento de tungsteno que se mantenía caliente, emitía una corriente elevada y estable de electrones y, luego de la gran aceleración debida a la alta diferencia de potencial, impactaba con un ánodo refrigerado; el haz de Rayos X resultante era muy intenso. Las mejoras de Coolidge permitieron reducir la duración de la irradiación.

Figura 2. Tubo de Coolidge: a la izquierda se encuentra el filamento (cátodo) y a la derecha el ánodo.
Cincuenta años más tarde se introdujo el ánodo giratorio que disipaba todavía mejor el calor y permitió la producción de haces intensísimos de Rayos X.
La "Tomografía Axial Computarizada" (TAC)
Los tubos usados actualmente en la TAC son parecidos al tubo de Coolidge. Pero, gracias a la mejorada técnica de producción de la tensión aceleratriz, se llega a alrededor de cien mil voltios, produciendo fotones (Rayos X) con energías que llegan al 0,1 MeV. Luego, el haz de fotones es colimado a fin de formar una fina "proyección" de Rayos X, a menudo de uno o dos milímetros (Fig. 3).Durante una TAC, los fotones enviados al paciente interactúan con los electrones de las moléculas de los tejidos y son absorbidos en parte. Una vez atravesados los órganos del cuerpo del paciente, emerge un flujo variable de fotones, que es medido por los detectores. En un hueso, por ejemplo, la densidad de electrones es una vez y media la de los tejidos blandos: en consecuencia del tórax y de las costillas los detectores miden un flujo de fotones menor que en la zona del abdomen.

Figura 3. El colimador metálico de una TAC produce a la salida un amplio haz de rayos X que atraviesan el cuerpo del paciente. Los fotones no absorbidos son medidos en los detectores.
El tubo de un TAC se mueve lentamente sobre una trayectoria espiral, escaneando el cuerpo del paciente acostado. Luego, un potente ordenador combina los valores de las fracciones de Rayos X que no son absorbidos por el cuerpo -medidos en todas las direcciones- y reconstruye la imagen tridimensional del tejido: los huesos, que más absorben, son claros mientras el tejido pulmonar aparece oscuro. El resultado es una imagen que muestra la forma y las dimensiones de los órganos internos (Fig. 4a), trayendo a la luz las eventuales alteraciones patológicas.

Figura 4. (a) Imagen tridimensional de una TAC. (b) Imagen PET del mismo paciente. (c) Fusión de las dos imágenes donde se ven tejidos que metabolizan mejor el azúcar y frecuentemente no son visibles con la TAC.
La Tomografía por Emisión de Positrones (PET)
Una TAC no proporciona información sobre el metabolismo de los órganos y sobre sus procesos fisiológicos; no da a conocer, por ejemplo, la irregular actividad metabólica debida a la proliferación de células tumorales. Para esto se recurre a la PET, acrónimo del inglés, Positron Emission Tomography (Tomografía por Emisión de Positrones) (6-10).
Para aplicar esta técnica se requiere inyectar al paciente un radio fármaco trazador, es decir, una sustancia ligeramente radioactiva que pueda ingresar en los órganos a través del torrente sanguíneo para rastrear la actividad de las células. ¿Cómo se hace el rastreo?
El núcleo radioactivo más usado en la PET es el Fluor-18, que se une químicamente a las moléculas de un azúcar, la desoxiglucosa, para poder inyectarlo; el radio trazador se llama por lo tanto fluoro-desoxiglucosa o FDG (11-14).
Los tejidos tumorales tienen una intensa actividad metabólica, por lo que absorben una gran cantidad de azúcares de la sangre y, de esta manera, asimilan también el FDG; el Fluor-18 decae -con una vida media de aproximadamente dos horas- emitiendo positrones (los positrones poseen iguales características que los electrones pero distinto signo de la carga).
Cada positrón emitido viaja en el tejido unos pocos milímetros, perdiendo velocidad a medida que suministra energía a los átomos cercanos a su trayectoria; finalmente se aniquila con uno de los numerosos electrones atómicos presentes en las células. La aniquilación produce dos fotones, que tienen cada uno una energía igual a la masa del electrón o del positrón, que es 0,5 MeV.
Estos fotones son los que se observan con el aparato PET: viajan en sentidos opuestos (Fig. 5a) y son detectados con detectores de alta tecnología similares a los desarrollados para las aplicaciones físicas. Los detectores están compuestos por una corona de bloques de material "centellante" (Fig. 5b), hechos con un cristal especial transparente que emite una pequeño destello de luz cuando el fotón que lo atraviesa cede su energía.

Figura 5. (a) El positrón se detiene y se aniquila con un electrón. (b) Los dos fotones son detectados simultáneamente por dos bloques de cristal centellante.
Una computadora reconstruye la línea que une los dos bloques opuestos, golpeados por sendos fotones, se identifica así con precisión de unos pocos milímetros, la línea recta a lo largo de la cual se encontraba el átomo de Fluor-18 que se ha desintegrado. Por el entrecruzamiento de cientos de miles de estos segmentos, se determina la forma del tejido en el que se concentra el FDG, como se muestra en la Fig. 4b.
Si se aplican simultáneamente la PET y la TAC, y se combinan las imágenes tridimensionales, como se muestra en la Fig. 4c, se obtiene una exploración PET-CT (la tomografía computarizada TAC en inglés se llama CT, Computed Tomography), que proporciona información simultánea sobre la morfología y sobre el metabolismo de los tejidos, permitiendo diagnósticos muy precisos.
La técnica PET-CT constituye una moderna herramienta para la detección de tumores, el seguimiento de terapias tumorales, la detección temprana del Alzheimer y la detección y seguimiento de cardiopatías.
El origen de la terapia de los tumores
Muchos historiadores de la medicina fijan la fecha de nacimiento de la radioterapia como el 24 de noviembre de 1896, con el primer tratamiento llevado a cabo por el médico vienés Leopold Freund, quien los usó para tratar a un tumor superficial de una niña, que vivió luego hasta los setenta años.
En un organismo sano las células se duplican en modo controlado, es decir, sólo cuando el organismo necesita crecer o reemplazar células muertas o dañadas. En nuestro cuerpo, siempre hay unos cuantos miles de células (aproximadamente una de cada mil millones) potencialmente cancerígenas: su ADN ha sufrido muchas mutaciones y los genes que regulan la división celular actúan de manera descontrolada.
Afortunadamente, estas células son normalmente eliminadas por nuestro sistema inmune; cuando esto no sucede pueden proliferar incluso aunque el organismo no lo requiera. Cuando el tejido crece fuera de control, se lo denomina tumor o cáncer (términos que utilizamos aquí como sinónimos).
En el hombre pueden aparecer más de cien tipos diferentes de cáncer. En muchos casos, las células cancerosas que se originaron en un órgano pueden invadir otros tejidos, difundiéndose a través del sistema sanguíneo y el sistema linfático a otras partes del cuerpo, incluso distantes, dando lugar a colonias llamadas metástasis.
Dada la variedad de los órganos afectados y de las manifestaciones patológicas, para el tratamiento de estas enfermedades se utilizan metodologías diferentes y complementarias.
El tratamiento más directo de los tumores "sólidos", cuando tienen fronteras bien definidas, consiste en la eliminación del tejido enfermo a través de la cirugía, que a menudo también interviene los ganglios linfáticos cercanos, lugares de posibles metástasis.
La radioterapia es la segunda metodología "loco-regional"; cada año se le aplica a cerca del 50% de los pacientes. A menudo se la combina con la quimioterapia, que es el suministro de fármacos que tienen como objetivo destruir las células metastásicas y los tejidos que no pueden ser removidos por cirugía ni destruidos con la radioterapia.
¿Cómo funciona la radioterapia?
La radioterapia se basa en la destrucción de las células malignas por intermedio de las llamadas radiaciones ionizantes, que ionizan la materia (extraen los electrones de sus estados ligados al átomo). Las radiaciones ionizantes pueden provenir de sustancias radioactivas, que emiten dichas radiaciones de forma espontánea, o de generadores artificiales tales como los generadores de Rayos X y los aceleradores de partículas. La radiobiología se dedica al estudio de esta interacción y de sus efectos (5).
El tratamiento de los tumores basado en Rayos X utiliza un haz de fotones penetrantes de 5-10 MeV de energía, para dañar el patrimonio genético de las células enfermas e impedir así que proliferen. Los fotones de Rayos X impactan los electrones de los átomos de los tejidos y los ponen en movimiento. Estos electrones "secundarios " recorren zigzagueando uno o dos centímetros en los tejidos e ionizan los átomos de las moléculas de ADN de las células que encuentran, desactivando así el funcionamiento de sus genes.
Hasta los años cincuenta los Rayos X para fines médicos fueron producidos por los tubos de Coolidge, pero la radiación era poco eficaz para tratar tumores profundos, como se muestra en la Fig. 6, curva de trazos. Cuando se aplica una dosis de 1 gray (gray, unidad de medida de radiación ionizante, equivalente a 20.000 ionizaciones en los núcleos de las células enfermas) sobre la piel de un paciente, con Rayos X producidos por un tubo de Coolidge (electrones de 0,2 MeV), la dosis absorbida por las células tumorales a 20 centímetros de profundidad es de sólo 0,04 gray.

Figura 6. La dosis de Rayos X absorbida por un tejido biológico uniforme aumenta considerablemente cuando se pasa de electrones de 0,2 MeV (tubos de Coolindge) a aquellos de 10 MeV de los aceleradores lineales.
En los años cincuenta, para llegar a los tumores profundos, los radioterapeutas aumentaban las dosis de radiación con tratamientos más prolongados, para ionizar más núcleos celulares, pero esto producía enrojecimiento y, a veces, quemaduras de la piel.
Pero si en lugar de los electrones de 0,2 MeV de los tubos de Coolidge se usan electrones de 10 MeV, la situación es completamente diferente, como muestra la línea continua de la Fig. 6: la dosis a 20 centímetros de profundidad es diez veces mayor e, igualmente importante, la dosis sobre la piel es de aproximadamente la mitad del máximo, que se encuentra a 2 centímetros de profundidad.
Por lo tanto, actualmente en radioterapia los electrones son acelerados a aproximadamente 10 MeV y con este fin se utilizan aceleradores lineales (linac, linear accelerators), inventados en la mitad de los años cuarenta.
Los aceleradores lineales de electrones
La invención del linac nació a partir de la exitosa colaboración de tres amigos: el físico estadounidense William Webster Hansen y los hermanos irlandeses Russell y Sigurd Varian, que se habían conocido durante los años de la universidad. Ellos desarrollaron un sistema especial de radio para la detección nocturna de la posición de los aviones y pequeños obstáculos.
Durante la guerra, los tres contribuyeron al desarrollo de los radares militares pero el objetivo de Bill Hansen era construir un acelerador lineal de electrones para llevar a cabo experimentos de bombardeo de núcleos. Su primer linac aceleró electrones en 1947.
Hansen y los hermanos Varian continuaron colaborando y muy pronto los linac encontraron aplicaciones en el campo de la medicina, para la producción de Rayos X. En 1948, los tres fundaron Varian Associates, sociedad productora de klistrones y de aceleradores lineales que, más tarde, se convirtió en la Varían Medical, que todavía es líder en la fabricación de equipos de radioterapia (16-20).
Los Rayos X y los tumores radio sensibles
Las máquinas para radioterapia utilizadas en la actualidad se basan en un modelo patentado por Varian Medical en los años sesenta: electrones de 5 a 25 MeV, acelerados por un acelerador lineal, desviados por un campo magnético, luego impactan sobre un blanco de metal emitiendo fotones (Fig. 7 arriba).
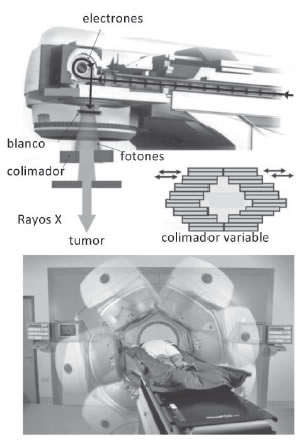
Figura 7. Arriba: el haz de Rayos X es colimado por un conjunto de láminas metálicas controladas por computadora. Abajo: el haz rota alrededor del paciente, irradiándolo a través de direcciones tales que minimicen el efecto sobre los tejidos sanos.
El linac está montado en el interior de un soporte que gira alrededor de un eje (Fig. 7 abajo). El médico radioterapeuta, con la ayuda del físico sanitario que programa en un computador el plan de tratamiento, puede elegir las direcciones de entrada del haz y su energía. En efecto, usando diferentes direcciones se puede aplicar la dosis necesaria al blanco tumoral, incluso cuando éste esté cerca de órganos críticos, que no pueden absorber demasiada radiación sin comprometer la calidad de vida del paciente.
Un plan de tratamiento con radioterapia prevé una media de treinta sesiones de 15-20 minutos cada una, dentro de un período de seis semanas. Utilizando rayos láser, el técnico en radioterapia alinea el aparato con respecto al paciente acostado en la camilla, con una precisión de pocos milímetros. Luego, durante los pocos minutos de irradiación, la aplicación es completamente indolora.
El tratamiento es repetido tantas veces porque subdividiendo la dosis en muchas sesiones, separadas un día una de otra, se da tiempo a los tejidos sanos cercanos a los cancerosos para que se auto reparen. De hecho, estos tejidos sanos reciben inevitablemente una dosis de radiación. Afortunadamente, en el 90% de los casos, las células tumorales son más sensibles a la radiación ionizante que las células sanas; se habla entonces de "tumor radio sensible". Esto significa que después de un día, cuando los sistemas de reparación del daño celular han actuado, la fracción de las células fatalmente dañadas es mayor en el tumor que en los tejidos sanos.
Subdividiendo una dosis típica de 60-70 gray en 30-35 sesiones durante 6-7 semanas, se saca beneficio de la mayor resistencia a la radiación ionizante de los órganos sanos cerca del tumor. Estos últimos, además, reciben una dosis más baja, ya que en su ciclo de vida, las células son en ciertos momentos más sensibles a la radiación. La división de la dosis durante varios días sirve también para aumentar la probabilidad de encontrar, tarde o temprano, a todas las células malignas en una fase de alta sensibilidad a la irradiación.
En cada sesión se suelen utilizar 2 gray en el blanco tumoral. Las células de las moléculas de agua son las que más se ionizan y representan el 70% de la masa celular; el resultado es la formación de radicales libres, pequeñas moléculas dotadas de una notable capacidad oxidante.
Algunos de estos radicales, moviéndose al azar, alcanzan al ADN y rompen uno o ambos filamentos de la doble hélice. Los daños a una sola hélice son en su mayoría remediados por los mecanismos de reparación molecular, que protegen nuestras células contra los rayos ultravioleta y las sustancias químicas oxidantes que a menudo ingerimos.
Las doble rupturas y las modificaciones aún más complejas constituyen, por el contrario, daños de difícil reparación; la célula pone en marcha un "suicidio programado", llamado apoptosis, triplicando así el efecto de la acción directa de las ionizaciones sobre el ADN.
Este mecanismo de defensa del organismo le impide a la célula dañada por las radiaciones seguir reproduciéndose: la ionización inducida por los Rayos X en el ADN empuja a la apoptosis a las células tumorales, interrumpiendo su proliferación anormal. Gracias a estos efectos, la radioterapia contribuye a la curación de aproximadamente el 90% de todos los tipos de tumores sólidos, es decir, los llamados precisamente radio sensibles.
Protonterapia, la radioterapia con haces de protones
La Hadronterapia, "terapia con hadrones", es la radioterapia que utiliza, en lugar de fotones de Rayos X, haces de partículas hechas de quarks (los quark son las partículas elementales que forman los protones y neutrones, entre otras) y es una de las nuevas armas a disposición de los médicos que tratan el cáncer.
Actualmente se utilizan solo dos tipos de hadrones en los hospitales especializados: los protones y los iones de carbono. Se los obtiene separando el único electrón de los átomos de hidrógeno, o los seis electrones de los átomos de carbono, quedando entonces los núcleos (iones) compuestos de 1 protón y 1 neutrón (hidrógeno) o 6 protones y 6 neutrones (carbono).
La historia de esta tecnología comenzó en 1945, cuando Ernest Lawrence le pidió al estudiante Bob Wilson que calculara las interacciones con la materia de un haz de protones de unos pocos cientos de MeV de energía. Wilson encontró que en la profundidad la dosis de protones tiene un efecto completamente diferente a la de un haz de Rayos X (21-24).
Supongamos que se bombardea la piel con un fino haz de protones, todos de la misma energía. Atravesando los tejidos, los protones arrancan electrones de las moléculas, ionizándolas. El punto en el que tenemos el máximo número de ionizaciones se llama "pico de Bragg", llamado así por el físico inglés que descubrió por primera vez su existencia; el pico se encuentra a una profundidad que depende de la energía de los protones. En el ejemplo de la Fig. 8, con protones de 200 MeV se obtiene un pico de Bragg muy pronunciado a 27 cm de profundidad.
Usando simultáneamente protones de energías diferentes se obtienen muchos picos solapados, que forman un "pico de Bragg expandido" con lo que se puede cubrir un blanco tumoral de cualquier longitud y a cualquier profundidad.

Figura 8. (a) Penetrando en el tejido biológico, un haz sutil y mono energético de protones produce el mayor número de ionizaciones al final del recorrido. (b) Numerosos picos de Bragg, debidos a un haz de protones con energía variable entre 160 MeV y 200 MeV sobreponiéndose, dan una dosis uniforme a un tumor de diez centímetros de largo.
En 1946, Bob Wilson publicó en la revista científica Radiology un trabajo famoso en el que proponía el uso de haces de protones de unos 200 MeV para la terapia de tumores incluyendo a los profundos. Las ventajas eran indiscutibles: la curva de la Fig. 8, en comparación con la de la Fig. 6, muestra claramente que con los protones los tejidos más allá del tumor no son irradiados y, también, que el tejido sano, a 3-5 cm de profundidad, recibe un haz de protones de sólo un tercio de la dosis liberada por los Rayos X.
Hicieron falta casi cincuenta años para que la protonterapia se convirtiera en una técnica reconocida y generalizada; se ha tenido que esperar hasta fines de los años ochenta para superar el umbral de diez mil pacientes. Las razones son fáciles de explicar. Para la terapia de tumores profundos con Rayos X, es suficiente acelerar los electrones hasta 10 MeV; los protones en cambio deben ser llevados al menos a 200 MeV, es decir una energía veinte veces mayor. Además, la masa de un protón (1 GeV, es decir, 1000 MeV) es dos mil veces mayor que la de un electrón; los aceleradores médicos de protones -ciclotrones o sincrotrones- son por lo tanto muchísimo más grandes y más caros que los linac que producen Rayos X. Por estas razones, hasta principios de los años noventa para la protonterapia se utilizaban aceleradores normalmente usados para hacer experimentos en física: solo una parte del tiempo-máquina era dedicada al tratamiento de unos pocos pacientes.
Recién en 1992 se puso en funcionamiento en California el Centro médico-universitario de Loma Linda, dedicado solamente a la radioterapia, dotado de tres salas de tratamiento con un sincrotrón de 250 MeV. Hoy, veinte años después, son casi cuarenta los centros en funcionamiento o en construcción en el mundo, y cinco empresas ofrecen centros de protonterapia "llave en mano", estructurados en torno a un ciclotrón o sincrotrón de 6-8 metros de diámetro. A finales de 2011 habían sido irradiados más de 100.000 pacientes con esta técnica, una cifra que aumenta exponencialmente a un ritmo del 10% anual (25-30).
Para aprovechar bien el acelerador, cada centro hospitalario tiene de 3 a 5 salas de tratamiento (Fig. 9), de modo que, mientras un paciente se irradia durante 3-5 minutos en una habitación, en las otras se efectúan las mediciones de alineación de precisión para preparar otros pacientes. Debido a que cada tratamiento requiere unas 20-30 sesiones, un centro con tres salas puede tratar hasta 1.200 pacientes al año.

Figura 9. (a) Un típico centro de la firma belga Ion Beam Applications (IBA), que es líder en el mercado; el ciclotrón de 230 MeV pesa doscientas toneladas. (b) Los protones son deflectados por imanes montados sobre tres "cabezales rotantes", cada una con un diámetro de diez metros y un peso de casi cien toneladas. (c) Rotando el cabezal se puede enviar el haz sobre el paciente acostado sobre una camilla en la dirección que minimiza la dosis aplicada a los tejidos críticos.
La precisión y la eficaciade los hadrones
La precisión de la radioterapia fue posible por el uso cada vez más extendido de aparatos de CT y PET (y también de la Gammagrafía y la Resonancia Magnética), que dan imágenes precisas de los tejidos y su metabolismo y permiten al médico radioterapista definir con precisión el blanco tumoral a irradiar y proteger los órganos críticos. Él establece la dosis mínima que ha de aplicarse al tumor y la dosis máxima que puede recibir cada órgano crítico para luego -en estrecha colaboración con el físico médico, utilizando programas de computadora sofisticados- definir el plan de tratamiento, especificando las direcciones, las energías de los haces y la duración que se utilizarán para la irradiación.
La Fig. 10 muestra, para el caso de un raro tumor de nariz (la zona oscura marcada por el número "72") una comparación entre las distribuciones de las dosis debidas a los Rayos X y a los protones. Los dos globos oculares, vecinos al tumor, son los órganos críticos, así como los nervios ópticos (triángulos blancos) y el tronco cerebral (líneas discontinuas). Cada una de las seis líneas blancas encierra el volumen de tejido al que le es aplicada una dosis mayor al número de gray indicado. En la figura 10 (a), por ejemplo, la zona más amplia marcada por el número 30 recibe una dosis mayor a 30 gray en todas partes. El blanco tumoral en cambio recibe una dosis superior a 72 gray.
Es evidente que la protonterapia permite salvar los tejidos sanos: en el tratamiento con Rayos X la mitad de la región de los globos oculares absorbe más de 38 gray y el nervio óptico recibe más de 46 gray, mientras con los protones un ojo y un nervio óptico quedan casi completamente inafectados, reduciendo drásticamente el riesgo de disminución de la capacidad visual.

Figura 10. (a) Una comparación entre las dosis dadas a un carcinoma del seno paranasal, cuando se usan los Rayos X y (b) cuando se utilizan protones.
La disminución de la dosis que logramos conseguir con protones es fundamental en los niños: de hecho, sus tejidos, aún en desarrollo, son considerablemente más sensibles a los efectos dañinos de la radiación. La limitación de la dosis impartida a estos tejidos no sólo permite un crecimiento equilibrado de los órganos (y, en el caso de irradiación cerebral, una reducción del frecuente deterioro cognitivo), sino que además reduce muchísimo la probabilidad de la aparición de un tumor secundario en la vida adulta.
En resumen, con los haces de protones se puede administrar la misma dosis de los Rayos X para las células tumorales produciéndole los mismos efectos biológicos y clínicos, pero dando una dosis inferior a los tejidos circundantes y reduciendo así los efectos negativos sobre los tejidos sanos. Teniendo en cuenta todos estos factores, se ha estimado que, sobre cada 100.000 pacientes irradiados con Rayos X, alrededor de 10.000 obtendrían un beneficio significativo con la protonterapia, es decir un 10%.
La hadronterapia con ionesde carbono
Los iones de carbono logran efectos diferentes a los producidos por los Rayos X o por los protones. La ionización producida en los tejidos presenta un pico de Bragg similar al de la Fig. 8 y las distribuciones de las dosis son prácticamente idénticas a aquellas de los protones. Sin embargo, para llegar a 27 centímetros de profundidad, un ión de carbono debe tener 5000 MeV de energía, en vez de la 200 MeV de un protón. Los iones de carbono, teniendo carga eléctrica seis veces mayor, arrancan muchos más electrones a las moléculas del tejido que atraviesan; esto los "lentifica" y se requiere un aumento de la energía para lograr una penetración profunda. A igualdad de recorrido, el número de ionizaciones producidas en cada núcleo celular atravesado por un ión de carbono es por lo tanto, 5000/200 = 25 veces mayor que la causada por un protón que llega a la misma profundidad. La consecuencia es que, si se aplica la misma dosis a las células tumorales con haces de iones de carbono, la distribución de la dosis en los tejidos es similar a la de los protones, pero a nivel molecular los efectos biológicos producidos son diferentes a los de los protones y de los Rayos X (31-33).
Mientras los protones (y los Rayos X) dañan el ADN, esencialmente a través del efecto indirecto de los radicales libres, un ión de carbono deja detrás de él -especialmente en los últimos centímetros del recorrido, es decir, en el interior del tumor- una serie continua de ionizaciones que producen sobre el ADN efectos directos letales para las células cancerosas (rupturas dobles y clustered damages "daños agrupados" tan severos que la célula no logra casi nunca repararlos).
En suma, desde el punto de vista biológico y clínico, los protones y los Rayos X son similares entre sí. En cambio, un haz de iones de carbono es una irradiación de diferente naturaleza y potencial, capaz de curar tumores radio-resistente que representan aproximadamente el 10% del millón de tumores irradiados cada año en Europa central con Rayos X (33-36).
Los tejidos enfermos que más resisten a la radioterapia con Rayos X y con protones son aquellos hipóxicos, es decir carentes de oxígeno (a menudo debido a que están en el centro de un tumor poco vascularizado). Los tejidos tumorales bien oxigenados por el contrario son radiosensibles: el oxígeno estabiliza los radicales libres y los hace más agresivos, facilitando los efectos indirectos que destruyen las células cancerosas. Cuando la falta de oxígeno suprime los efectos indirectos sobre el ADN de los Rayos X y de los protones, se puede lograr inducir a la apoptosis a las células de los tumores radiorresistentes gracias a los efectos directos típicos de los iones.
Es así que los iones de carbono son utilizados desde 1994 en el primer centro hospitalario dedicado a esta terapia, el centro japonés HIMAC (Heavy Ion Medical Accelerator in Chiba), cerca de Tokio. Este centro es líder mundial de la hadronterapia con iones de carbono. A finales de 2011 habían tratado a unos 7.000 pacientes. Los resultados son muy prometedores, incluso para los cánceres comunes, tales como los tumores primarios de pulmón y de hígado.
En 2009 entró en funcionamiento en Alemania el HIT (Heidelberg Ion Therapy Center) (37)(38), creado por el médico radioterapista alemán Jürgen Debus y sus colaboradores, asistido en el diseño por los científicos del centro de investigación GSI de Darmstadt y, en la construcción, por la Siemens Medical.
En 2010 entró en funcionamiento el Centro Nacional de Hadronterapia Oncológica (CNAO) (39)(40) en Pavía, primer centro de Hadronterapia en Italia. Este centro cuenta en la actualidad con un haz de protones para la irradiación de pacientes. En una etapa posterior, se iniciará la irradiación con iones de carbono, una vez terminada la caracterización dosimétrica y radiobiológica del haz de este ion.
Este centro fue diseñado por la Fundación TERA (Terapia con Radiazioni Adroniche) (41), que tiene su sede administrativa en Novara, mientras que el laboratorio de investigación, para el diseño y la construcción de prototipos se encuentra en el CERN, Suiza.
La Fig.11 muestra un dibujo en perspectiva del centro y el sincrotrón que genera los haces.

Figura 11. (a) El sincrotón del CNAO tiene un diámetro de 25 metros y alimenta tres salas de tratamiento. (b) Los componentes esenciales del sincrotón son los imanes deflectores, los cuadrupolos y la cavidad de aceleración
El primer paciente, un joven de 26 años ya operado dos veces por un condrosarcoma de la base del cráneo, fue irradiado en septiembre de 2011.
El futuro de la radioterapia
La terapia de Rayos X se difunde rápidamente y es también cada día más precisa. El número de aceleradores lineales se incrementa rápidamente: la tasa de crecimiento es del 2% por año en los EE.UU. y del 12% en China, donde en 2011 ya estaban funcionando 1500 linacs.
En el futuro necesitaremos muchos más. En el mundo occidental se irradian un promedio de 2000 pacientes por millón de habitantes por año. Un acelerador lineal puede tratar a 300 pacientes por año, las normas internacionales indican como suficiente un linac cada 150.000 habitantes. De acuerdo con estos criterios, China necesitará unos 8.000 aceleradores lineales.
En la actualidad, las ventajas médicas de la protonterapia son reconocidas. Lo demuestra el crecimiento exponencial de los pacientes tratados en el mundo, a un ritmo del 10% por año. En los Estados Unidos en 2011 estaban en funcionamiento diez centros y en construcción ocho. Europa se mueve más lentamente, con siete centros en funcionamiento y tres en construcción.
Un equipamiento de protonterapia requiere inversiones que contemplen los siguientes componentes:
a) un acelerador de protones y/o iones que produzca una serie de haces de partículas (por ejemplo un acelerador circular llamado sincrotrón);
b) un sistema de transporte del haz a las salas de tratamiento;
c) un sistema extremadamente preciso de posicionamiento del paciente;
d) un riguroso sistema de control de la liberación de energía (dosis);
e) un plan de tratamiento tridimensional, personalizado para el paciente, obtenido integrando los resultados del diagnóstico por imágenes (TAC, RMN, PET).
Es por ello que la inversión para un centro de protonterapia es de más de 110 millones de dólares. Sin embargo el costo de una protonterapia completa (alrededor de 20.000 dólares), resulta competitiva frente a los 50.000 a 70.000 dólares de muchas quimioterapias prolongadas (42).
Hay que remarcar que la protonterapia es tan beneficiosa que podría sustituir por completo -en cada hospital, el 90% de los tumores sólidos- a la terapia con Rayos X, si tan sólo pudiéramos construir aceleradores de 200 a 250 MeV pequeños y económicos como el acelerador lineal de electrones de 10 MeV.
Este logro tecnológico es ambicioso, pero las empresas especializadas y los laboratorios de investigación ya ofrecen ciclotrones y linacs de protones bastante compactos, tanto que pueden ser montados en un cabezal móvil de 8-10 metros de diámetro, que gira alrededor del paciente. También se están estudiando los aceleradores en base al láser, mucho más pequeños que los ciclotrones y sincrotrones existentes (43-44).
Los tratamientos con iones de carbono, a diferencia de aquellos con protones, siempre quedarán como una pequeña fracción del total, porque son útiles sólo para los tumores radiorresistentes, aproximadamente 10% de todos los cánceres. Actualmente en el mundo hay 32 centros con 100.000 pacientes ya tratados con esta metodología, los países donde se están utilizando este tipo de aplicaciones son EE.UU., Europa, Japón y Sudáfrica. En Latinoamérica lamentablemente no están implementados. En cambio, en lo que respecta a la tomografía PET-CT, en Argentina hay 14 centros, 13 en Buenos Aires y 1 en Mendoza.
Conclusiones
Como hemos visto, los aceleradores de partículas, los nuevos detectores y los sistemas de cómputo conjuntamente con la quimioterapia nos han dado la oportunidad de realizar avances magníficos en el tratamiento del cáncer, a tal punto que los tumores tomados a tiempo, en su gran mayoría serían controlados e incluso curados. Lamentablemente en América Central y Sudamérica estamos desprovistos de los equipamientos asociados a la Hadronterapia, ya sea, de protones o de iones de carbono, que por su precio, solo pueden ser encarados con una decisión gubernamental.
En el CERN, en este momento, en la Fundación TERA, se está desarrollando un nuevo acelerador compacto de tecnología Láser, montado sobre un cabezal móvil, de mucho menor costo, que nos permite pensar, que en un futuro cercano podríamos disponer de esta nueva terapia en nuestro país.
AGRADECIMIENTOS
El autor agradece al Dr. Ugo Amaldi, al Dr. Daniel Oscar Carrica, por sus aportes y sugerencias y al CONICET, al MinCyT, al CERN, a EPLANET y al Laboratorio de Instrumentación y Control (LIC) de la UNMDP, por su soporte.
1. Benedetti M. LHC, Acelerador de partículas casero con TRC español CERN 2010. Disponible en: https://www.youtube.com/watch?v=krql5AFgQ4g. (Fecha de acceso: 20 de marzo de 2013).
2. Lawrence EO, Livingston MS. Production of high speed light ions without the use of high voltages. Phys Rev 1932; 40: 19-35. [ Links ]
3. CERN. How a detector works. Disponible en http://home.web.cern.ch/about/how-detector-works. (Fecha de acceso: 20 de marzo de 2013).
4. Lawrence JH, Tennant R. The comparative effects of neutrons and x-rays on the whole body. J Exp Med 1937; 66: 667-88.
5. Larsson B, Leksell L, Rexed B, Sourander P, Mair W, Andersson B. The high-energy proton beam as a neurosurgical tool. Nature 1958; 182: 1222-3.
6. Benedetti M. Positron emission tomography. Disponible en http://www.youtube.com/watch?v=kEhW6BSpOBw. (Fecha de acceso 17 de mayo de 2013).
7. Bashkirovetal V. Development of proton computed tomography for applications in proton therapy, application of accelerators in research and industry: Twentieth International Conference, AIP Conference Proceedings, 2009; 1099: 460-3.
8. Enghardt W, Crespo P, Fiedler F, Hinz R, Parodi K, Pawelke J, et al. Charged hadron tumour therapy monitoring by means of PET. Nucl Instr Meth A 2005; 525: 284-4
9. Parodi K, Ponisch F, Enghardt W. Experimental study on the feasibility of in-beam PET for accurate monitoring of proton therapy: results of a comprehensive experimental study, IEEE Trans Nucl Sci June 2005; 52 (3): 778-9.
10. Crespo P. Optimization of in-beam positron emission tomography for monitoring heavy ion tumor therapy, Ph. D.Thesis [dissertation]. Hesse, Alemania, Technische Universität Darmstadt; 2005.
11. Fowler JS, Ido T. Initial and subsequent approach for the synthesis of 18FD. Semin Nucl Med 2002; 32 (1): 6-12.
12. Mackay DB, Steel CJ, Poole K, Mc Knight S, Schmitz F, Ghyoot M, et al. Quality assurance for PET gas production using the Cyclone 3D oxygen-15 generator, Appl Rad Isotop 1999; 51(4): 403-9.
13. Richter JÁ, Torre W, Gámez C, Aramendia JM, Crespo A, Nicolás A, et al. Valor de la tomografÍa por emisión de positrones (PET)- 18FDG en el cáncer de pulmón. Med Clin Barcelona España 1999; 113 (15): 567-71.
14. Shefer RE, Klinkowstein RE, Welch M.J, Brodack JW. The production of short lived pet isotopes at low bombarding energy with a high current electrostatic accelerator. Proc Third Workshop on Targetry and Target Chemistry, Vancouver, (BC) Canada: The University of British Columbia UBC; 1989. Disponible en: http://wttc.triumf.ca/89-pdf.html. (Fecha de acceso 17 de mayo de 2013).
15. Amaldi U. Sempre piú veloci. Primera edición. Bologña: Editorial Zanichelli; 2012.
16. Wilson R, Brief A. History of the Harvard University Cyclotrons. Harvard: Harvard University Press; 2004.
17. Vérdu-Andrés S, Amaldi U, Faus-Golfe A. Literature review on Linacs and FFAGs for hadron therapy. Int J Mod Phys A 2011; 26: 1659-89.
18. Amaldi U. Private Communication to Varian Medical System, November 2006.
19. Larsson B. Application of a185 MeV proton beam to experimental cancer therapy and neuro surgery: a bio physical study, Ph. D. Thesis [dissertation], Uppsala, Suecia. University of Uppsala, 1962.
20. An organization for those interested in proton, light ion and heavy charged particle radiotherapy. Particle Therapy Co Operative Group (PTCOG), Disponible en: http://www.ptcog.com and http://ptcog.web.psi.ch/. (Fecha de acceso 17 de mayo de 2013).
21. Braccini S. Scientific and Technological Development of Hadrontherapy, Proceedings of the 11th Conference of Astroparticle, Particle and Space Physics, Detectors and Medical Physics Applications. Volume 5. World Scientific; 2010.
22. Bragg WH, Kleeman R. On the a particles of radium, and their loss of range in passing through various atoms and molecules. Philos Mag 1905; 325 (10): 318-40.
23. Wilson RR. Radiological use of fast protons. Radiobiology 1946; 47: 487-91.
24. Benedetti M. Hadronterapia, Aplicaciones del LHC, Protonterapia, Radioterapia. Disponible en http://www.youtube.com/watch?v=8SfsDvMwfy4. (Fecha de acceso 17 de mayo de 2013).
25. Amaldi U, Braccini S, Puggioni P. High frequency linacs for hadrontherapy, reviews of accelerator science and technology. World Scientific 2009; 2: 111-31.
26. Suit HD, Goitein M, Munzenrider J, Verhey L, Davis KR, Koehler A, et al. Definitive radiation therapy for chordoma and chondrosarcoma of base of skull and cervical spine, J. Neurosurg 1982; 56 (3): 377-85.
27. Umegaki K, Hiramoto K, Kosugi N, Moriyama K, Akiyama H, Kakiuchi S. Development of advanced proton beam therapy system for cancer treatment. Hitachi Rev 2003; 52 (4): 196-201.
28. Keil E, Sessler AM, Trbojevic D. Hadron cancer therapy complex using non-scaling fixed field alternating gradient accelerator and gantry design. Phys Rev ST Accel Beams 2007; 10 (5): 054701-14.
29. Castro JR. Heavy ion therapy: the BEVALAC epoch. En: "Hadrontherapy in oncology", Amaldi U, Larsson B. Edits. Amsterdam: Elsevier; 1994.
30. Levy RP, Fabrikant JI, Frankel KA, Phillips MH, Lyman JT, Lawrence JH, et al. Heavy-charged-particle radiosurgery of the pituitary gland: clinical results of 840 patients, Stereotact. Funct Neurosurg 1991; 57 (1-2): 22-35.
31. Hirao Y, Ogawa H, Yamada S, Sato Y, Yamada T, Sato K, et al. Heavy ion synchrotron for medical use. Nucl Phys 1992; 538 (A): 541-9.
32. Amaldi U. Hadrontherapy in the World University of Milano Bicocca and TERA Foundation, Italy, Rivista Medica 2008; 14 (1): 7-15.
33. Carbon-ion therapy, Proceedings of the Heavy Charged Particles in Biology and Medecine (HPCBM) and ENLIGHT meetings held in Baden (Sept. 2002) and in Lyon (Oct. 2003), Radiotherapy and Oncology 2004; 73 (2): 1-217.
34. Lagniel JM. Status of the hadrontherapy projects in Europe. Proceedings of PAC07, Albuquerque, New Mexico IEEE Applications of Accelerators, Technology Transfer and Relations with Industry; 2007.
35. Suit H, Delaney TF, Trofimov A. Physical and biological basis of proton and carbon ion radiation therapy and clinical outcome, Reviews of Accelerator Science and Technology, World Scientific 2009; 2: 1-15.
36. Hirohiko T, Tadashi K, Masayuki B, Hiroshi T, Hirotoshi K, Shingo K, et al. Clinical advantages of carbon-ion radiotherapy. New J Phys 2008; 10: 1-16.
37. The Heidelberg Ion-Beam Therapy Center (HIT). Disponible en: http://www.klinikum.uni-heidelberg.de/index.php?id=113005&L=1. (Fecha de acceso 17 de mayo de 2013).
38. Combs SE, Ellerbrock M, Haberer T, Habermehl D, Hoess A, Jäkel O, et al. Heidelberg Ion Therapy Center (HIT): Initial clinical experience in the first 80 patients. Acta Oncol 2010; 49 (7): 1132-40.
39. Amaldi U, Magrin G (Eds.). The Path to the Italian National Centre for Ion Therapy. Vercelli: Ed. Mercurio; 2005.
40. Centro Nazionale di Adronterapia Oncologica . CNAO Foundation. Disponible en: http://www.cnao.it. (Fecha de acceso 17 de mayo de 2013).
41. Fondazione per Adroterapia Oncologica. TERA Foundation. Disponible en: http://www.tera.it. (Fecha de acceso 23 de mayo de 2013).
42. Goitein M, Jermann M. The relative costs of proton and X-ray radiation therapy, project at the Paul Scherrer Institute: conceptual design and practical realization. Med Phys 1995; 22: 37-53.
43. Crandall K, Weiss M. Preliminary design of compact linac for TERA, nota TERA 93/34, CERN Ginebra, Suiza; 1994; ACC 20.
44. Linz U, Alonso J. What will it take for laser driven proton accelerators to be applied to tumor therapy? Phys Rev ST Acc Beams 2007; 10: 094801-8.
Aceptado para su publicación el 12 de junio de 2013













