Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957
Acta bioquím. clín. latinoam. vol.47 no.2 La Plata abr./jun. 2013
NANOTECNOLOGÍA
Transferencia génica asistida por campos magnéticos: Estudios en células gliales
Magnetic field-assisted gene transfer:Studies in glial cells
Transferência gênica assistida por camposmagnéticos: Estudos em células gliais
Joaquín Pardo1a*, Yolanda Elena Sosa2a*, Paula Cecilia Reggiani3a, Magda Lorena Arciniegas4b, Francisco Homero Sánchez5b, Rodolfo Gustavo Goya6a
1. Bioquímico.
2. Profesional Históloga.
3. Dra. de la Facultad de Ciencias Exactas, UNLP.
4. Ingeniera Física.
5. Dr. en Física.
6. Dr. en Bioquímica.
a INIBIOLP-Cátedras de Histología B y Patología B, Facultad de Ciencias Médicas, UNLP.
b Instituto de Física, Facultad de Ciencias Exactas, UNLP, La Plata, Argentina.
* Estos dos autores contribuyeron en igual medida a este trabajo
CORRESPONDENCIA DR. RODOLFO GOYA INIBIOLP, Facultad de Medicina, UNLP, CC 455 (1900) LA PLATA, Buenos Aires, Argentina Teléfono: (0221)425-6735: Fax: (0221) 425-0924 E-mail: goya@isis.unlp.edu.ar E-mail: joaquin_p88@hotmail.com
Resumen
Las nanopartículas magnéticas (MNP) complejadas con vectores génicos pueden, en presencia de un campo magnético externo, amplificar sustancialmente la eficiencia de la transferencia génica. Esta técnica, denominada magnetofección, es de gran interés en el campo de la terapia génica. En este estudio se caracterizó la mejora de transferencia génica en células gliales B92 utilizando complejos constituidos por diferentes proporciones de MNP asociadas a dos vectores adenovirales, a saber: los complejos entre las MNP denominadas PEI-Mag2 asociadas al adenovector RAd-GFP que expresa la proteína fluorescente verde GFP o al adenovector RAd-DsRed que expresa la proteína fluorescente roja DsRed2. Se demostró que para ambos vectores, a medida que la relación MNP/partícula viral física (PVF) va aumentando, la amplificación de la transfección también aumenta hasta que se llega a una relación MNP/PVF a partir de la cual el factor de amplificación alcanza un plateau. Se determinó que para el complejo PEI-Mag2/RAd-GFP la relación a partir de la cual se alcanza el plateau es de aproximadamente 0,5 fg Fe/PVF mientras que para el complejo PEI-Mag2/RAd-DsRed, esta relación corresponde a aproximadamente 71 fg Fe/PVF. Se concluye que los dos complejos magnéticos estudiados representan promisorias herramientas para mejorar la eficiencia en la terapia génica en células cerebrales.
Palabras clave: Nanotecnología; Nanopartículas magnéticas; Adenovectores; Terapia génica; Magnetofección; Sistema nervioso; Glia; Proteína fluorescente verde; Proteína fluorescente roja.
Summary
It is known that certain types of magnetic nanoparticles (MNPs) complexed to gene vectors can, in the presence of an external magnetic field, greatly enhance gene transfer into cells. This technique, called magnetofection, is of great relevance to gene therapy. In the present study the ability of MNP/adenovector complexes to enhance gene transfer to B92 glial cells was assessed. Two complexes were assessed, namely PEI-Mag2/RAd-GFP and PEI-Mag2/RAd-DsRed, which are constituted by the MNP PEI-Mag2 complexed to the adenovector RAd-GFP (expressing the green fluorescent protein GFP) and RAd-DsRed (expressing the red fluorescent protein DsRed2), respectively. It was shown that for both vectors, an increase in the ratio MNP/PVP (physical viral particle) is paralleled by an increase in transduction efficiency, up to a certain threshold value at which an efficiency plateau is reached. This threshold value was 0.5 fg Fe/PVP for the RAd-GFP complex and about 71 fg Fe/PVP for the RAd-DsRed complex. It can be concluded that both magnetic complexes assessed in this study represent promising tools for enhancing the efficiency of gene therapy in brain cells.
Key words: Nanotechnology; Magnetic nanoparticles; Adenovectors; Gene therapy; Magnetofection; Nervous system; Glia; Green fluorescent protein; Red fluorescent protein.
Resumo
As nanopartículas magnéticas (MNPs) complexadas com vetores de genes podem, em presença de um campo magnético externo, aumentar consideravelmente a eficiência da transferência gênica. Esta técnica, chamada magnetofecção, é de grande relevância para a terapia genética. No presente estudo, foi caracterizada a melhoria de transferência de genes em células gliais B92 utilizando complexos constituídos por diferentes proporções de MNP associadas a dois vetores adenovirais, a saber: os complexos entre as MNP denominadas PEI-Mag2 associadas ao adenovetor RAd-GFP que expressa a proteína fluorescente verde GFP ou ao adenovetor RAd-DsRed que expressa a proteína fluorescente vermelha DsRed2. Foi demonstrado que para ambos os vetores, enquanto a relação MNP/partícula viral física (PVF) vai aumentando, a amplificação da transfecção também aumenta até que se chega a uma relação MNP/PVF a partir da qual o fator de amplificação alcança um limiar. Determinou-se que para o complexo PEI-Mag2/RAd-GFP a relação a partir da qual se atinge o limiar é de aproximadamente 0,5 fg Fe/PVF ao passo que para o complexo PEI-Mag2/RAd-DsRed, esta relação corresponde a aproximadamente 71 fg Fe/PVF. Conclui-se que os dois complexos magnéticos estudados representam promissoras ferramentas para melhorar a eficiência na terapia de genes em células cerebrais.
Palavras-chave: Nanotecnologia; Nanopartículas magnéticas; Adenovetores; Geneterapia; Magnetofecção; Sistema nervoso; Glia; Proteína fluorescente verde; Proteína fluorescente vermelha.
Introducción
La terapia génica en el sistema nervioso central (SNC) constituye un particular desafío tecnológico debido a la relativa inaccesibilidad del cerebro y la médula espinal, y a la extraordinaria complejidad de las estructuras nerviosas centrales. Por otra parte, esta estrategia terapéutica ofrece ventajas únicas para la expresión prolongada de moléculas neuroprotectoras en regiones específicas del SNC afectadas por procesos degenerativos.
A pesar de que los resultados documentados sobre la terapia génica para factores neurotróficos en modelos animales de enfermedades neurodegenerativas son prometedores (1)(2), hasta ahora la única forma de administrar estos factores es mediante la inyección de los vectores génicos por vía estereotáxica directamente en las áreas blanco del cerebro. La invasividad de este procedimiento limita significativamente su eventual implementación en pacientes humanos. Una posible vía para superar este problema surge de la asociación de la transferencia génica con la nanotecnología, combinación que ofrece ahora la posibilidad de desarrollar estrategias de terapia génica intracerebral de alta eficiencia e invasividad mínima.
Este abordaje combina al Direccionamiento Magnético de Drogas (MDT, magnetic drug targeting) con la magnetofección, dos tecnologías emergentes basadas en el uso de nanopartículas magnéticas (MNP). El propósito de la MDT es el de concentrar nanocomplejos terapéuticos magnéticos en regiones precisas del organismo por medio de campos magnéticos externos. Hasta ahora la principal aplicación de la MDT ha sido la terapia oncológica. Típicamente, se utilizan MNP funcionalizadas con compuestos terapéuticos, las cuales son inyectadas en una de las arterias que irrigan al tumor, concentrándolas en la región blanco por medio de un campo magnético externo. Esta estrategia ha alcanzado resultados promisorios en ensayos clínicos (3-5) aunque debe señalarse la ausencia de estudios clínicos publicados en años recientes. También se han utilizado transportadores (carriers) magnéticos para direccionar drogas citotóxicas (doxorrubicina) en sarcomas implantados en la cola de rata (6). Los resultados iniciales fueron alentadores ya que se observó una total remisión de lo tumores en contraste con ratas inyectadas con 10 veces la dosis de doxorrubicina sin carrier, en las que no se observó remisión. Posteriormente a este estudio, hubo publicaciones adicionales documentando el éxito en la aplicación direccionada de drogas citotóxicas en el tratamiento de modelos animales como el cerdo (7)(8), el conejo (9) y la rata (10-12).
Por su parte, la magnetofección es una metodología desarrollada a principios de la década del 2000 por el grupo liderado por Christian Plank en Munich (13)(14). Esta técnica se basa en la asociación de MNP con vectores virales o no virales con el objeto de optimizar la transferencia génica en presencia de un campo magnético. De este modo, el grupo alemán pudo desarrollar nanocomplejos magnéticos no virales capaces de alcanzar altas eficiencias en la transferencia génica por magnetofección en cultivos celulares (15). El mismo grupo logró desarrollar nanocomplejos magnéticos que mejoran sustancialmente la eficiencia de transferencia génica mediada por vectores adenovirales(16). Recientemente se ha descripto la implementación exitosa de magnetofección en el cerebro fetal. En este estudio se utilizaron complejos de adenovectores con MNP que se inyectaron intracerebro-ventricularmente (ICV) en fetos de ratón en presencia de un campo magnético externo unilateral. Al final de la preñez se observó que se había logrado una expresión significativa del transgén (beta galactosidasa) en las células ependimarias del hemisferio cerebral que fue expuesto al campo (generado por un pequeño imán externo) mientras que en el hemisferio no expuesto la expresión transgénica fue despreciable (8). En el presente estudio se abordó la implementación de magnetofección en cultivos de células gliales B92 de rata empleando dos vectores adenovirales construidos en el laboratorio de los autores y MNP provistas por el grupo de Christian Plank en Munich.
Materiales y Métodos
VECTORES ADENOVIRALES RECOMBINANTES (RAd)
RAd-GFP. Este adenovector expresa el gen de la proteína fluorescente verde (GFP) de Aequorea victoria bajo el control del promotor del citomegalovirus murino (mCMV), poseyendo aguas abajo del transgén la señal de poliadenilación del Simian Virus 40 (Fig. 1A).

Figura 1. Estructura génica de los vectores adenovirales recombinantes (RAd) utilizados. (A) RAd-GFP: Adenovector portador del gen que codifica para la proteína fluorescente verde (GFP) de Aequorea victoria. (B), RAd-DsRed: Adenovector portador del gen que codifica para la proteína flurescente roja DsRed2 de Discosoma sp. Referencias: PmCMV, Promotor del citomegalovirus murino; ITR, terminales repetidos invertidos; DE1 y DE3, deleciones de los genes E1 y E3 en el genoma del Ad 5; SV40, señal de poliadenilación del Virus Simian 40; ψ, señal de empaquetamiento.
RAd-DsRed2. Este adenovector expresa el gen de la proteína fluorescente roja (DsRed2) de Discosoma sp. bajo el control del promotor del mCMV, poseyendo aguas abajo del transgén, la señal de poliadenilación del Simian Virus 40 (Fig. 1B).
DETERMINACIÓN DE LA CONCENTRACIÓNDE PARTÍCULAS VIRALES FÍSICAS
La titulación de RAd-GFP y RAd-DsRed se realizó por duplicado a una dilución 1/10 de la muestra del virus en 0,1% de SDS (Dodecil Sulfato de Sodio) en PBS (buffer fosfato-salina), utilizando la misma dilución del buffer de diálisis en 0,1% de SDS como control. La mezcla se homogeneizó con vortex y se centrifugó a 8000 rpm durante 5 minutos. Se determinó la densidad óptica del sobrenadante a 260 nm y a 280 nm. La relación DO260/DO280 debía encontrarse en el rango de 1.3-1.6. Se calculó así la concentración de partículas virales físicas (PVF) a partir de la densidad óptica DO260 utilizando la siguiente ecuación:
PV/mL= (OD260 - OD320) x factor de dilución / 9,09.10-13, donde 9,09.10-13 es el coeficiente de extinción para el adenovirus de tipo salvaje.
FORMULACIÓN DE LAS NANOPARTÍCULAS MAGNÉTICAS UTILIZADAS
Inicialmente se evaluaron dos formulaciones: PB-Mag1-4 y PEI-Mag2. Las principales características físicas de las preparaciones se indican en la Tabla I. En base al número N de nanopartículas por partícula viral física (PVF) que se determinó para la relación de 1 fg Fe/PVP, se estimaron los diámetros de los complejos, que van desde 229 nm (relación 0,05) hasta 613 nm (relación 1,00). Datos no mostrados
Tabla I. Características de las nanopartículas magnéticas utilizadas en este estudio.
Provistas por los Dres. Christian Plank y Olga Mykhaylyk, Universidad de Munich, Alemania

APLICADOR DE CAMPO MAGNÉTICO PARA CÉLULAS EN CULTIVO
Se utilizó una placa magnética comercial (Oz Biosciences, Marsella, Francia) del tamaño de una microplaca estándar de ELISA. Esta consiste en un arreglo de magnetos permanentes con forma rectangular, de Nd-Fe-B (magneto de neodimio) dispuestos en una orientación paralela alternante. Esta placa produce una densidad de flujo magnético máxima de aproximadamente 0,3 T y gradientes de campo magnético en el rango de 67 a 123 T/m a una distancia de 2 mm para la superficie de los magnetos individuales, la cual es aproximadamente la posición donde las células estarán ubicadas. Esta inducción magnética lleva aproximadamente a 80% de saturación de las nanopartículas, si éstas son de magnetita de alta pureza, requiriéndose una inducción de 0,5-0,6 T para que la saturación sea completa.
PROTOCOLO DE MAGNETOFECCIÓN EN CULTIVOS CELULARES
La línea celular B92 (glial de tejido nervioso de rata) se cultivó en medio MEM (Minimum Essential Medium), suplementado con 10% de suero fetal bovino (SFB), 100 U de penicilina/mL, 0,1 mg de estreptomicina/mL, y 0,25 μg de anfotericina B/mL; y se mantuvo a 37 °C en una atmósfera con 5% de CO2.
Para el recuento celular se utilizó el método de recuento en cámara de Neubauer.
Para esto, partiendo de una botella con células B92 al 90% de confluencia, se procedió a realizar dos lavados con PBS. Posteriormente se añadieron 3 mL de solución cítrico salina (10 g/L de KCl, 4,4 g/L de citrato de sodio, estéril, conservada a 4 ºC). Se incubó en cámara de cultivo hasta desprendimiento completo de la monocapa. Se agregaron 4 mL de PBS. Se tomaron 100 μL de la suspensión célular en PBS, y se agregaron 100 μL de Azúl tripán (Trypan Blue, SIGMA). Se contaron por triplicado las células viables contenidas en los retículos de la cámara y en base a esa cantidad se hicieron los cálculos correspondientes para obtener el número de células viables por mL.
Las células B92 se sembraron (750.000 por mL) en placas de 12 pocillos hasta una confluencia del 80% en medio MEM conteniendo 10% de SFB y antibióticos. Los cultivos se incubaron entonces con complejos adenovirales magnéticos generados mezclando diferentes proporciones de MNP y adenovector. Inmediatamente después del agregado de los complejos magnéticos a los cultivos, éstos se sometieron a una densidad de flujo magnético de unos 0,3 T (generado por el aplicador anteriormente descripto) durante 30 min, continuándose luego con una incubación estandar a 37 ºC y 5% CO2 durante 48 h. La expresión de DsRed2 y GFP se siguió en las células vivas por microscopía de fluorescencia con un microscopio invertido. En el caso de las células magnetofectadas con el complejo que contenía RAd-GFP, la expresión de GFP se cuantificó por medición de fluorescencia en los correspondientes lisados celulares. Para este fin, se aspiró el sobrenadante celular, procediéndose después a lisar las células. Los lisados se transfirieron a placas de NUNC (96 Well Plate PS Optical Btm Polymer Base Non-Treated NS w/o Lid Blk. Nunc Code: 265301) de 96 pocillos con fondo óptico a fin de medir la fluorescencia en un lector de placas Beckman Coulter® DTX 880 Multimode Detector. Este procedimiento permitió determinar la relación MNP/RAd óptima.
Resultados
Las dos clases de MNP evaluadas mostraron una buena performance in vitro pero las recubiertas con polietilenimina (PEI-Mag2) fueron más efectivas in vivo que las PB-Mag 1-4, que están recubiertas con polibreno (resultados no mostrados). Por esta razón se focalizó la caracterización in vitro en el uso de las PEI-Mag2. La magnetofección con complejos PEI-Mag2/RAd-GFP mostró un máximo a una relación de 0,5 fg Fe/PVF, lo cual se evidenció a través de la comparación cualitativa de microfotografías correspondientes a una dosis subóptima de vector desnudo con imágenes correspondientes a diferentes relaciones MNP/vector en los complejos magnéticos (Fig. 2 A y B, Fig. 4), así como de la cuantificación de la fluorescencia intracelular de la GFP transgénica (Fig. 3). Los complejos PEI-Mag2/RAd-GFP mostraron una performance máxima que se mantuvo constante hasta al menos 12,5 fg Fe/PVF (Fig. 5). Con el complejo PEI-Mag2/RAd-DsRed también pudo evidenciarse un claro efecto de amplificación de la capacidad de transfección a través del análisis cualitativo de microfotografías 48 h post agregado del vector al cultivo celular (Fig. 2 C y D). La amplificación máxima de la capacidad de transfección (complejo /virus desnudo) que se registró en el presente estudio fue de 5,1 para PEI-Mag2/RAd-GFP a una relación MNP/vector de 0,5 fg Fe /PVF (Fig. 3).
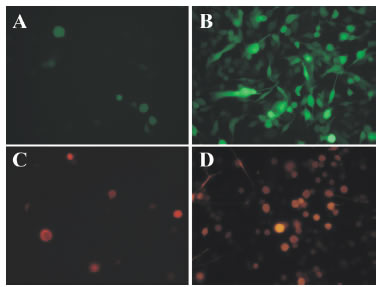
Figura 2. Magnetofección en células gliales B92. Se utilizaron los complejos magnéticos PEI-Mag2/RAd-GFP (B) y PEI-Mag2/RAd-DsRed (D). Como controles se usaron los adenovectores desnudos correspondienes (A y C). En los cuatro casos los adenovectores se usaron a dosis subóptimas a fin de hacer más evidente la amplificación de la transfección inducida por la magnetofección. La relación MNP/PVF del complejo magnético en B es de 0,5 fg Fe/PVF mientras que la correspondiente relación para D es 71 fg Fe/PVF. (20X).

Figura 3. Variación de la eficiencia de la transfección del complejo PEI-Mag2/RAd-GFP en relación a la proporción de MNP/PVF. El efecto se estudió en presencia o ausencia de un campo magnético externo.
* p<0,05; ** p<0,01 versus el nivel de transducción (fluorescencia) del vector desnudo. Los experimentos se realizaron por duplicado.
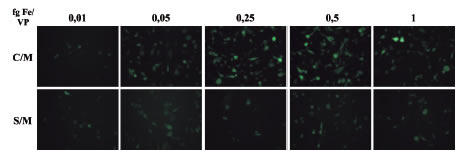
Figura 4. Microfotografías de células transfectadas con complejos PEI-Mag2/RAd-GFP variando la relación MNP/PVP. Se fotografiaron campos representativos de células B92 expresando la GFP para distintas relaciones MNP/PVP con imán (C/M) o sin éste (S/M). (20X).

Figura 5. Factor de amplificación de la transfección en función de la proporción MNP/PVF en el complejo PEI-Mag2/RAd-GFP. El factor se calculó en ausencia y presencia del campo. N=1
Discusión y Conclusiones
El presente estudio confirma la notable propiedad de la magnetofección de incrementar la capacidad de transducción de los vectores adenovirales. Se piensa que este fenómeno se debe en parte a que la sedimentación de los complejos magnéticos inducida por el campo genera una elevada concentración local de viriones en torno de las células adheridas al fondo de la placa de cultivo (17). Existe, sin embargo, creciente evidencia de que los complejos MNP/vector viral favorecen la internalización del vector a través de mecanismos independientes de los receptores celulares al adenovirus (18). Una línea de evidencia que apoya esta hipótesis es que la magnetofección con complejos MNP-adenovector permite la eficiente transfección de ciertas líneas celulares (como NIH3T3, K56215) o cultivos primarios de células como los linfocitos y los miocitos, todas las cuales casi no expresan el receptor adenoviral del virus coxsackie (CAR) y son por tanto refractarias a los adenovirus (19). Además, el análisis ultraestructural de los complejos MNP-adenovectores recombinantes por microscopía electrónica y microscopía de fuerza atómica demostró partículas adenovirales intactas completamente rodeadas por nanopartículas magnéticas que ocasionalmete asociaban varios viriones (16). En virtud de que esta configuración impide que los viriones se unan a sus receptores celulares de membrana, es posible que la internalización de los complejos se produzca por mecanismos aún no elucidados. Asimismo, estudios cinéticos con complejos RAd-MNP basados en óxidos de oro e hierro que se aplicaron a líneas celulares refractarias a los adenovirus, proveen evidencia adicional de la existencia de mecanismos de internalización que no son mediados por receptores virales de membrana (20).
En cuanto a si se internaliza en la célula el virión disociado de las MNP o el complejo completo, recientes estudios de análisis de imágenes por doble haz realizados en el Instituto de Nanociencias de Aragón por Asin et al. (21) revelan que el complejo magnético ingresa a la célula sin disociarse, ya que pueden observarse partículas de complejo en el interior celular.
En este estudio se utilizaron dos métodos para determinar la relación óptima MNP/vector. Uno es el método visual de imágenes seriadas de fluorescencia (Fig. 4); el otro es la determinación cuantitativa de fluorescencia de los correspondientes lisados celulares (Fig. 3). Mientras que el primero provee más información cualitativa sobre los efectos del complejo magnético sobre las células, el segundo es cuantitativamente más preciso. Ambos métodos se complementan.
Los resultados de este trabajo coinciden en general con estudios previos de otros grupos aunque la proporción óptima MNP/PVF encontrada en el presente estudio es algo más baja de la informada por Mykhaylyk et al. in vivo e in vitro, la cual está alrededor de los 2,5 fg Fe/PVF (16)(20). Debe señalarse además, que aunque en el presente estudio no se evaluó la toxicidad de los complejos, en un estudio previo se determinó que los complejos PEI-Mag/RAd-GFP poseen muy baja toxicidad sobre las células B92 cuando se utiliza una relación de 2,5 fg Fe/PV en un rango de multiplicidades de infección de 1 a 20 unidades formadoras de placa/célula (21).
De los datos aquí presentados se concluye que los vectores adenovirales utilizados muestran una marcada mejora en su desempeño in vitro cuando se los utiliza complejados a MNPs recubiertas con PEI o PB. Si bien estos resultados son alentadores, por el momento no hay suficientes estudios en modelos animales como para establecer con seguridad la efectividad de la magnetofección in vivo. Actualmente se está tratando de implementar la magnetofección in vivo, en el cerebro y músculo de rata.
Referencias bibliográfica
1. Hereñú CB, Cristina C, Rimoldi OJ, Becú-Villalobos D, Cambiaggi V, Portiansky EL, et al. Restorative effect of insulin-like growth factor-I gene therapy in the hypothalamus of senile rats with dopaminergic dysfunction. Gene Ther 2007; 14(3): 237-45.
2. Nishida F, Morel GR, Hereñú CB, Schwerdt JI, Goya RG, Portiansky EL. Restorative effect of intracerebroventricular insulin-like growth factor-I gene therapy on motor performance in aging rats. Neuroscience 2011; 177: 195-206.
3. Lübbe AS, Bergemann C, Riess H, Schriever F, Reichardt P, Possinger K, et al. Clinical experiences with magnetic drug targeting: a phase I study with 4'-epidoxorubicin in 14 patients with advanced solid tumors. Cancer Res 1996; 56(20): 4686-93. [ Links ]
4. Lübbe AS, Alexiou C, Bergemann C. Clinical applications of magnetic drug targeting. J Surg Res 2001; 95(2): 200-6.
5. Gallo JM. Häfeli U. Preclinical experiences with magnetic drug targeting: tolerance and efficacy and clinical experiences with magnetic drug targeting: a phase I study with 4'-epidoxorubicin in 14 patients with advanced solid tumors. Cancer Res 1997; 57: 3063-5.
6. Widder KJ, Morris RM, Poore GA, Howard DP, Senyei AE. Selective targeting of magnetic albumin microspheres containing low-dose doxorubicin: total remission in Yoshida sarcoma-bearing rats. Eur J Cancer Clin Oncol 1983; 19(1): 135-9.
7. Goodwin S, Peterson C, Hob C, Bittner C . Targeting and retention of magnetic targeted carriers (MTCs) enhancing intra-arterial chemotherapy. J Magn Magn Mater 1999; 194: 132-9.
8. Goodwin SC, Bittner CA, Peterson CL, Wong G. Single-dose toxicity study of hepatic intra-arterial infusion of doxorubicin coupled to a novel magnetically targeted drug carrier. Toxicol Sci 2001; 60(1): 177-83.
9. Alexiou C, Arnold W, Klein RJ, Parak FG, Hulin P, Bergemann C, et al. Locoregional cancer treatment with magnetic drug targeting. Cancer Res 2000; 60(23): 6641-8.
10. Lübbe AS, Bergemann C, Brock J, McClure DG. Physiological aspects in magnetic drug-targeting . J Magn Magn Mater 1999; 194: 149-55.
11. Pulfer SK, Gallo JM. Enhanced brain tumor selectivity of cationic magnetic polysaccharide microspheres. J Drug Target 1998; 6(3): 215-27.
12. Pulfer SK, Ciccotto SL, Gallo JM. Distribution of small magnetic particles in`brain tumor-bearing rats. J Neurooncol 1999; 41(2): 99-105.
13. Scherer F, Plank C. Magnetofection: Using magnetic particles and magnetic force to enhance and to target nucleic acid delivery. En: Smyth Templeton N, ed. Gene and Cell Therapy: Therapeutic mechanisms and strategies; 3rd ed. Boca Raton, FL: CRC Press; 2009; p. 379-404.
14. Plank C, Zelphati O, Mykhaylyk O. Magnetically enhanced nucleic acid delivery. Ten years of magnetofection-progress and prospects. Adv Drug Deliv Rev 2011; 63: 1300-31.
15. Mykhaylyk O, Antequera YS, Vlaskou D, Plank C. Generation of magnetic nonviral gene transfer agents and magnetofection in vitro. Nat Protoc 2007; 2(10): 2391-411.
16. Tresilwised N, Pithayanukul P, Mykhaylyk O, Holm PS, Holzmüller R, Anton M, et al. Boosting oncolytic adenovirus potency with magnetic nanoparticles and magnetic force. Mol Pharm 2010; 7(4): 1069-89.
17. Hashimoto M, Hisano Y. Directional gene-transfer into the brain by an adenoviral vector tagged with magnetic nanoparticles. J Neurosci Methods 2011; 194(2): 316-20.
18. Schwerdt JI, Goya GF, Calatayud MP, Hereñú CB, Reggiani PC, Goya RG. Magnetic field-assisted gene delivery: achievements and therapeutic potential. Curr Gene Ther 2012; 12(2): 116-26.
19. Scherer F, Anton M, Schillinger U, Henke J, Bergemann C, Krüger A, et al. Magnetofection: enhancing and targeting gene delivery by magnetic force in vitro and in vivo. Gene Ther 2002; 9(2): 102-9.
20. Kamei K, Mukai Y, Kojima H, Yoshikawa T, Yoshikawa M, Kiyohara G, et al. Direct cell entry of gold/iron-oxide magnetic nanoparticles in adenovirus mediated gene delivery. Biomaterials 2009; 30(9): 1809-14.
21. Asin L. Biomedical applications of magnetic nanoparticles: magnetic hyperthermia in dendritic cells and magnetofection of brain cells. Tesis Doctoral, Instituto de Nanociencia de Aragón, Universidad de Zaragoza, 2012. Disponible en: http://zaguan.unizar.es/record/7369/files/TESIS-2012-059.pdf. (Fecha de acceso: 21 de febrero de 2013).
Aceptado para su publicación el 26 de abril de 2013













