Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957
Acta bioquím. clín. latinoam. vol.47 no.2 La Plata abr./jun. 2013
TEMAS DE INTERÉS

Guías de práctica del laboratorio clínico
Uso de marcadores tumorales en cáncer de testículo, próstata, colorrectal, mama y ovario
Capítulo 3
EDITADO POR
Catharine M. Sturgeon
Elefterios P. Diamandis
Catharine M. Sturgeon
Department of Clinical Biochemistry, Royal Infirmary of Edinburgh, Edinburgh, Reino Unido.
Michael J. Duffy
Department of Pathology and Laboratory Medicine, St Vincent's University Hospital and UCD School of Medicine and Medical Science, Conway Institute of Biomolecular and Biomedical Research, University College Dublin, Dublin, Irlanda.
Ulf-Håkan Stenman
Department of Clinical Chemistry, Helsinki University Central Hospital, Helsinki, Finlandia.
Hans Lilja
Departments of Clinical Laboratories, Urology and Medicine, Memorial Sloan-Kettering Cancer Center, New York, NY 10021.
Nils Brünner
Section of Biomedicine, Department of Veterinary Pathobiology, Faculty of Life Sciences, University of Copenhagen, Dinamarca.
Daniel W. Chan
Departments of Pathology and Oncology, Johns Hopkins Medical Institutions, Baltimore, MD.
Richard Babaian
Department of Urology, The University of Texas M. D. Anderson Cancer Center, Houston, TX.
Robert C. Bast, Jr
Department of Experimental Therapeutics, University of Texas M. D. Anderson Cancer Center, Houston, TX.
Barry Dowell
Abbott Laboratories, Abbott Park, IL.
Francisco J. Esteva
Departments of Breast Medical Oncology, Molecular and Cellular Oncology, University of Texas M. D. Anderson Cancer Center, Houston, TX.
Caj Haglund
Department of Surgery, Helsinki University Central Hospital, Helsinki, Finlandia.
Nadia Harbeck
Frauenklinik der Technischen Universität München, Klinikum rechts der Isar, Munich, Alemania.
Daniel F. Hayes
Breast Oncology Program, University of Michigan Comprehensive Cancer Center, Ann Arbor, MI.
Mads Holten-Andersen
Section of Biomedicine, Department of Veterinary Pathobiology, Faculty of Life Sciences, University of Copenhagen, Dinamarca.
George G. Klee
Department of Laboratory Medicine and Pathology, Mayo Clinic College of Medicine, Rochester, MN.
Rolf Lamerz
Department of Medicine, Klinikum of the University Munich, Grosshadern, Alemania.
Leendert H. Looijenga
Laboratory of Experimental Patho-Oncology, Erasmus MC-University Medical Center Rotterdam, and Daniel den Hoed Cancer Center, Rotterdam, Holanda.
Rafael Molina
Laboratory of Biochemistry, Hospital Clinico Provincial, Barcelona, España.
Hans Jørgen Nielsen
Department of Surgical Gastroenterology, Hvidovre Hospital, Copenhagen, Dinamarca.
Harry Rittenhouse
Gen-Probe Inc, San Diego, CA.
Axel Semjonow
Prostate Center, Department of Urology, University Clinic Muenster, Muenster, Alemania.
Ie-Ming Shih
Departments of Pathology and Oncology, Johns Hopkins Medical Institutions, Baltimore, MD.
Paul Sibley
Siemens Medical Solutions Diagnostics, Glyn Rhonwy, Llanberis, Gwynedd, Reino Unido.
György Sölétormos
Department of Clinical Biochemistry, Hillerød Hospital, Hillerød, Dinamarca.
Carsten Stephan
Department of Urology, Charité Hospital, Universitätsmedizin Berlin, Berlin, Alemania.
Lori Sokoll
Departments of Pathology and Oncology, Johns Hopkins Medical Institutions, Baltimore, MD.
Barry R. Hoffman
Department of Pathology and Laboratory Medicine, Mount Sinai Hospital, and Department of Laboratory Medicine and Pathobiology, University of Toronto, Ontario, Canadá.
Eleftherios P. Diamandis
Department of Pathology and Laboratory Medicine, Mount Sinai Hospital, and Department of Laboratory. Medicine and Pathobiology, University of Toronto, Ontario, Canadá.
Copyright © 2011 by the American Association for Clinical Chemistry, Inc and the American Diabetes Association. Todos los derechos reservados.
The National Academy of Clinical Biochemistry Board of Directors aprobó este documento (PID 6278) en enero de 2011.
La NACB es la Academia de la Asociación Norteamericana de Bioquímica Clínica.
Este documento ha sido traducido con permiso de la National Academy of Clinical Biochemistry (NACB).
La NACB no se hace responsable de la exactitud de la traducción. Los puntos de vista presentados son los de los autores y no necesariamente los de la NACB.
TABLA DE CONTENIDOS
1. Introducción
2. Marcadores Tumorales en Cáncer de Testículo
3. Marcadores Tumorales en Cáncer de Próstata
4. Marcadores Tumorales en Malignidad Colorrectal
5. Marcadores Tumorales en Cáncer de Mama
6. Marcadores Tumorales en Cáncer de Ovario
Referencias
Agradecimientos
Apéndice
Capítulo 3
Marcadores tumorales en cáncer de próstata
Hans Lilja, Richard Babaian, Barry Dowell, George G. Klee, Harry Rittenhouse, Axel Semjonow, Paul Sibley, Lori Sokoll y Carsten Stephan
Antecedentes
El cáncer de próstata es el cáncer más frecuente en hombres en los Estados Unidos. En 2007 se produjeron 218.890 nuevos casos y 27.050 muertes. A pesar de que el cáncer de próstata es sin lugar a dudas mortal en algunos pacientes, la mayoría de los hombres muere con su cáncer, y no a causa del mismo (118). Datos de autopsias sugieren que el 42% de los hombres mayores de 50 años tienen focos cancerígenos en la próstata pero sólo se les diagnostica cáncer de próstata a lo largo de toda su vida a aproximadamente el 16% de ellos y sólo un cuarto muere a causa de esta enfermedad. Muchos más hombres mueren con cáncer de próstata que a causa del mismo (119). Las tasas de incidencia actuales de la enfermedad clínica son 15 veces más altas en los Estados Unidos que en Japón, a pesar de tener frecuencias similares de tipos histológicos de cáncer. Por consiguiente, la prevalencia mucho mayor de los tipos histológicos de cáncer sobre los sintomáticos fue citada para sustentar un enfoque conservador, no intervencionista de esta enfermedad. Sin embargo, cuando el cáncer de próstata alcanza etapas avanzadas ya sea con tratamiento local o sistémico para metástasis en los huesos o se vuelve refractario a la terapia hormonal, existen pocos o prácticamente ningún medio terapéutico de cura.
El tratamiento óptimo para pacientes con cáncer de próstata requiere el uso del marcador tumoral, el antígeno prostático específico (PSA), en todas las instancias y estados de la enfermedad. El uso de isoformas relacionadas al PSA es apropiado en circunstancias específicas. Aquí se presentan las nuevas guías de la NACB sobre el uso de estos y otros marcadores tumorales serológicos en el cáncer de próstata. También se presenta un resumen de las guías más importantes publicadas por otros paneles de expertos sobre este tema.
Para preparar estas guías, se revisó la literatura pertinente al uso de marcadores tumorales en el cáncer de próstata. Se dedicó especial atención a las revisiones (incluyendo las revisiones sistemáticas), a las pruebas aleatorias prospectivas que incluyeron el uso de marcadores y a las guías publicadas por paneles de expertos. En la medida de lo posible, las recomendaciones consensuadas del panel de la NACB estuvieron basadas en la evidencia disponible (es decir, estuvieron basadas en la evidencia).
Marcadores para el cáncer de próstata disponibles en la actualidad
Los marcadores PSA disponibles comercialmente aprobados por la Food and Drug Administration (FDA) para su uso en el tratamiento de pacientes con cáncer de próstata se enumeran en la Tabla VI junto con la fase de desarrollo para cada marcador así como también el nivel de evidencia (LOE) para su uso clínico (120).
Tabla VI. Recomendaciones de la NACB para el uso clínico de marcadores serológicos de PSA en el tratamiento del cáncer de próstata
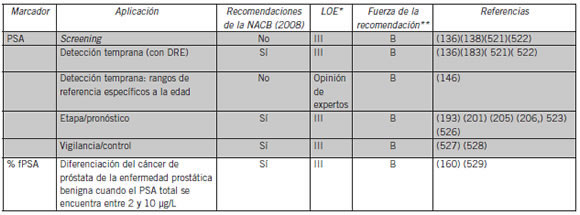
Abreviaturas: NACB, National Academy of Clinical Biochemistry; PSA, antígeno prostático específico; LOE, nivel de evidencia; DRE, examen rectal digital; %fPSA, porcentaje del antígeno prostático específico libre.
*LOE (120): nivel 1, evidencia de un único estudio prospectivo controlado que está específicamente diseñado para probar el marcador o evidencia de un metanálisis, de un análisis agrupado o una perspectiva general de los estudios II o III; nivel II, evidencia de en estudio en el cual los datos de los marcadores están determinados en relación a una prueba terapéutica prospectiva realizada para comprobar hipótesis terapéuticas pero no diseñada específicamente para probar la utilidad del marcador; nivel III, evidencia de grandes estudios prospectivos; nivel IV, evidencia de pequeños estudios prospectivos; nivel V, evidencia de pequeños estudios pilotos.
** Fuerza de la recomendación (520): A= Alta [es muy poco probable que investigaciones posteriores cambien la confianza del Panel sobre la estimación del efecto]; B= Moderada [es probable que investigaciones posteriores tengan un impacto importante en la confianza del Panel sobre la estimación del efecto y es probable que modifique la estimación; C= Baja [es muy probable que investigaciones posteriores tengan un efecto importante en la confianza del Panel sobre la estimación del efecto y es probable que modifiquen la estimación; D= Muy baja [todas las valoraciones de los efectos son muy inciertas].
Marcadores tumorales en cáncer de próstata: recomendaciones de la NACB
La Tabla VII resume las guías de la NACB para el uso de PSA en el cáncer de próstata junto con las recomendaciones de otras guías representativas publicadas sobre el uso de marcadores tumorales en el cáncer de próstata, incluyendo las recomendaciones publicadas recientemente por el United Kingdom National Institute for Health and Clinical Excellence (NICE) que realizó una revisión sistemática de la mejor evidencia disponible (121). Aunque se investigaron otros marcadores (Tabla VIII) basados en la evidencia disponible actualmente, sólo se puede recomendar el uso del PSA y sus isoformas para el cáncer de próstata. A continuación se presenta una discusión más detallada sobre el uso de estas mediciones.
PSA en el tratamiento de pacientes
Tabla VII. Recomendaciones de diferentes grupos de expertos para el uso del PSA, el PSA complejado y del porcentaje libre: PSA total como marcadores tumorales para cáncer de próstata
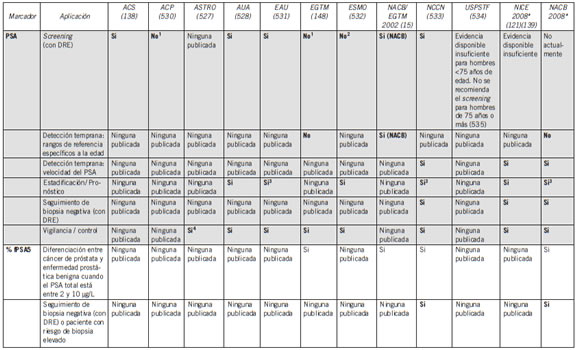
* Para referirse a la fuerza de la recomendación obsérvese la Tabla VI.
Abreviaturas: ACS, American Cancer Society; ACP, American College of Physicians; ASTRO, American Society for Therapeutic Radiology and Oncology; AUA, American Urological Association; EGTM, European Group on Tumor Marker; DRE, examen rectal digital; ESMO, European Society for Medical Oncology; Ins, Evidencia insuficiente para su recomendación; NACB, National Academy of Clinical Biochemistry; NCCN, National Comprehensive Cancer Network; NICE, National Institute for Health and Clinical Excellence; PCa, Cáncer de Próstata; USPSTF, U.S. Preventive Services Task Force.
1 No como rutina, decisión en particular; 2 excepto en hombres con síntomas urinarios; 3 como parte de nomogramas con DRE y grado Gleason de la biopsia (Tabla de Partin); 4 a continuación de la terapia de radiación; 5 en hombres con un total de PSA de 4 a 10 μg/L y un DRE negativo.
Tabla VIII. Biomarcadores actualmente en exploración para el cáncer de próstata
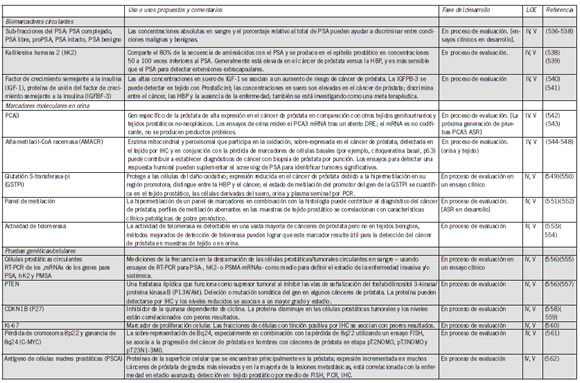
NOTA. Tabla basada en la Tabla III del Prostate Cancer Foundation Report to the Nation on Prostate Cancer (563).Abreviaturas: HBP, hiperplasia prostática benigna; FISH, hibridación por flouorescencia in situ; IHC, inmunohistoquímica; LOE, niveles de evidencia, según se de_ nen en la Tabla VI; PCR, reacción en cadena de la polimerasa.
Para referirse a la fuerza de la recomendación obsérvese la Tabla VI.
PSA EN EL SCREENING Y LA DETECCIÓN TEMPRANA DEL CÁNCER DE PRÓSTATA
La medición del PSA en suero ampliamente generalizada es en gran parte responsable del aumento en la incidencia del cáncer de próstata en los Estados Unidos en las últimas dos décadas. Como los datos epidemiológicos muestran tanto un marcado aumento de la cantidad de hombres diagnosticados con cáncer de próstata y una profunda migración hacia un estadio temprano de la enfermedad al momento del diagnóstico (122), existe evidencia contundente a favor de la creciente preocupación de que dicha "migración de etapa" provoque un sobre-diagnóstico y un excesivo tratamiento en hombres con cáncer indolente, condición que puede representar una pequeña amenaza para la vida o la salud del paciente (123). El screening con PSA también fue cuestionado por su escasa especificidad cuando las concentraciones en suero son moderadamente elevadas (124). Aunque hay suficiente evidencia para demostrar que los aumentos del PSA en suero están asociados exclusivamente a enfermedades en la próstata, no son específicos del cáncer y también aparecen en otras afecciones, tales como la hiperplasia prostática benigna y la prostatitis. Esta falta de especificidad, ampliamente documentada, de la prueba convencional de PSA incluso indujo a los investigadores a cuestionar si existe alguna relación entre los niveles de PSA en suero y el cáncer de próstata (125). Por otra parte, informes de muchos otros investigadores demostraron que existe una vasta evidencia sobre la significativa asociación entre los niveles de PSA en suero y la presencia o los resultados de cáncer de próstata (126-130). Además, la falta de especificidad de la prueba de PSA es menos crítica en el monitoreo de pacientes con diagnóstico de cáncer de próstata que como marcador más importante para evaluar la respuesta a las intervenciones terapéuticas y para detectar remisiones tumorales. Aunque resulta potencialmente valiosa como parte de paneles multivariados para identificar cánceres agresivos o la recurrencia del cáncer, la medición de la fosfatasa ácida prostática por sí sola no proporciona ninguna información clínicamente útil adicional a la medición del PSA (131)(132) y por lo tanto no es recomendada por la NACB.
RECOMENDACIÓN 1 DEL PANEL DE CÁNCER DE PRÓSTATA DE LA NACB: ELECCIÓN DE MARCADORES TUMORALES PARA EL TRATAMIENTO DE PACIENTES CON CÁNCER DE PRÓSTATA
El PSA es actualmente el marcador tumoral serológico más útil en el tratamiento de pacientes con cáncer de próstata y es necesario en todos los estados de la enfermedad [LOE, III; SOR, A].
Los niveles medios basados en la población son inferiores a 0,6 μg/L para los hombres ≥ 50 años, la gran mayoría de los cuales aún tienen que desarrollar algún síntoma de cáncer de próstata o de agrandamiento benigno de la glándula (130)(133)(134). El percentil 80 se encuentra cercano a 1 μg/L y el percentil 90 es aproximadamente 1,25 μg/L (130). Nunca se ha implementado un límite máximo normal en la práctica clínica según el percentil 95 para hombres ≥ 50 años pero correspondería a un nivel de PSA de aproximadamente 1,5 μg/L. Un incremento moderado en los niveles de PSA en hombres mayores refleja una mayor frecuencia de afecciones de próstata benignas a una edad más avanzada. Los niveles de PSA basados en la demografía de la población para hombres de 50 a 70 años muestran que entre 8% y 9% de estos hombres tienen niveles de PSA ≥ 4,0 μg/L, mientras que entre 11% y 12% tienen niveles de PSA ≥ 3,0 μg/L y el 20% del total de hombres tienen niveles de PSA en suero ≥ 2,0 μg/L (135).
En los hombres que presentan niveles de PSA en suero modestamente elevados (es decir 4 a 10 μg/L) existe gran cantidad de evidencia que demuestra que los exámenes histopatológicos del tejido recogido por biopsias sistemáticas de próstata confirman la presencia de cáncer de próstata en 25% a 35% de estos hombres (136)(137). Cuando los niveles de PSA en suero se elevan por encima de 10 μg/L, la especificidad de la prueba para cáncer es de 40% a 50% o superior. Las recomendaciones actuales en los Estados Unidos sugieren que se les debería aconsejar a la mayoría de los hombres mayores de 50 años que se realicen un screening de cáncer de próstata con PSA y un examen rectal digital (DRE), además se les tendría que aconsejar la realización de una biopsia cuando el DRE es anormal o cuando los niveles de PSA en suero son ≥ 4,0 μg/L (138). Las guías del NICE concluyen que el nivel de PSA en suero por sí solo es un pobre predictor de la presencia de cáncer de próstata y no debería conducir automáticamente a una biopsia de próstata, especialmente porque muchos cánceres diagnosticados sólo sobre esta base van a ser de bajo riesgo, causando poco o ningún impacto en la esperanza de vida (121)(139).
Todas estas recomendaciones tienen algunas limitaciones, como se discutió recientemente (140). El corte de PSA de ≥ 4,0 μg/L representa un límite de decisión clínica que se introdujo sobre la base de un solo informe que evalúa la combinación óptima de sensibilidad y especificidad de la prueba de PSA en un estudio de cohorte y la distribución de los valores observados en este estudio original probablemente hayan dejado de tener validez (141). Es discutible si un valor de corte de PSA inferior a 4 μg/L debería ser recomendado. También es discutible si las decisiones para recomendar la biopsia de próstata deberían basarse solamente en un único valor de punto de corte de PSA (por ejemplo ≥ 4 μg/L).
Los valores menores de corte de PSA aumentan los índices de detección de cáncer a costa de elevar el número de hombres a quienes se les aconseja realizarse una biopsia. Sin embargo, también se demostró claramente que el 20% o más de todos los hombres que tienen niveles de PSA de entre 2,0 (ó 3,0) y 4,0 μg/L confirman tener cáncer de próstata con la biopsia (142)(143). Esto se confirmó en un estudio reciente, donde al 15,2% de 2.950 hombres a los que se les realizó una biopsia con valores de PSA <4,0 μg/L se les diagnosticó cáncer de próstata por biopsia. Este estudio demostró que la prevalencia del cáncer de próstata en hombres entre 62 y 91 años aumentó de 6,6% en hombres con PSA entre 0 y 0,5 μg/L ,10% entre 0,6 y 1,0 μg/L, 17% entre 1 y 2 μg/L, hasta un 23,9% entre 2,1 y 3,0 μg/L y 26,9% entre valores de PSA de 3,1 y 4,0 μg/L (128). Además, la prevalencia del cáncer de próstata de alto grado aumentó con el aumento de los valores de PSA. Por lo tanto, el valor predictivo positivo de la prueba de PSA en términos de cáncer de próstata comprobado (histológicamente) por biopsia es similar para los hombres con un valor de PSA entre 2 y 4 μg/L y para aquellos con valores de PSA entre 4 y 10 μg/L (136)(144).
RECOMENDACIÓN 2 DEL PANEL DE CÁNCER DE PRÓSTATA DE LA NACB: LÍMITES DE DECISIÓN CLÍNICA
Dada la controversia sobre el uso del PSA para detectar tumores muy pequeños, los beneficios informados surgidos de bajar el límite de decisión clínica para biopsias por debajo de 4 μg/L son demasiado inciertos como para acordar alguna recomendación general. Los puntos de corte inferiores al límite comúnmente utilizado de 4 μg/L van a aumentar la sensibilidad con un descenso concomitante en la especificidad a menos que se empleen otras pruebas o medidas complementarias para aumentar la especificidad.
A la inversa, el uso de límites de decisión clínica para un PSA superior a 4,0 μg/L disminuye la sensibilidad, lo cual ocasiona diagnósticos erróneos de tumores clínicamente significativos en hombres que podrían beneficiarse potencialmente con un tratamiento temprano [LOE, no aplicable; SOR, B].
La recomendación generalizada de realizar la prueba anual de PSA en hombres mayores de 50 años es demasiado simplista y no altera la frecuencia de la prueba basada en el riesgo individualizado impartido por los niveles de PSA determinados previamente. Por ejemplo, es mucho menos probable que un hombre de 55 años con un PSA basal de 0,4 μg/L desarrolle cáncer de próstata en el futuro que un hombre de edad similar con un PSA basal de 3,3 μg/L. Stenman et al (126) utilizaron muestras de suero congelado e información de la Health Examination Survey en Finlandia, y Gann et al.(145) utilizaron información del Physicians' Health Study para evaluar la capacidad del PSA para identificar los hombres a los que posteriormente se les diagnosticó o no clínicamente cáncer de próstata. Los datos de Gann et al sugieren que los hombres con niveles de PSA entre 2,0 y 3,0 μg/L tienen 5,5 veces mayores posibilidades de riesgo relativo de ser diagnosticados con cáncer de próstata que los hombres con niveles de PSA inferiores a 1,0 μg/L. En el primer grupo, los niveles de PSA en suero llegaron a los 2 - 3 μg/L en promedio más de 5 años antes de que el cáncer fuese detectado por DRE. Recientemente, Lilja et al (130) demostraron una asociación muy fuerte entre los niveles de PSA en suero tomados más de 20 años antes del diagnóstico del cáncer de próstata y la probabilidad de dicho diagnóstico en una amplia población representativa de hombres suecos de entre 44 y 50 años quienes no habían sido sometidos a pruebas de PSA previamente. Estos datos junto con los informados por otros (129) sugieren que puede ser importante tener en cuenta la estratificación del riesgo en los primeros años de la mediana edad para perfeccionar las estrategias de detección temprana de cáncer que resultan deficientes actualmente. Varios temas adicionales particularmente importantes para los programas de screening se discuten más adelante.
Intervalos de referencia para PSA específicos para la edad. Debido a que los niveles de PSA en suero aumentan gradualmente con la edad en los hombres mayores de 40 años, se propusieron valores de referencia específicos para la edad con la expectativa de que su implementación aumentara los índices de detección de cáncer en los hombres más jóvenes al bajar el punto de corte y aumentara la especificidad en los hombres mayores al elevar el punto de corte (146). Aunque no hay consenso, muchos expertos-inclusive la opinión mayoritaria de la National Comprehensive Cancer Network (NCCN)-son partidarios de utilizar límites de decisión inferiores a 4,0 μg/L para el PSA en suero en los hombres más jóvenes. La NACB, sin embargo, aún no está convencida del beneficio neto de hacer esto sin una o más pruebas adicionales que podrían aumentar significativamente la especificidad del diagnóstico (es decir, reducir biopsias innecesarias). A la vez, la NACB recomienda cautela al elevar el límite de decisión por encima de 4,0 μg/L ya que podría no diagnosticar tumores clínicamente significativos en hombres que podrían beneficiarse potencialmente con un tratamiento temprano (147). Por lo tanto, al contrario de las recomendaciones publicadas anteriormente (148), la NACB no avala el uso de rangos de referencia específicos por edad.
RECOMENDACIÓN 3 DEL PANEL DE CÁNCER DE PRÓSTATA DE LA NACB: VALORES DE REFERENCIA ESPECÍFICOS POR EDAD PARA EL PSA
Los valores de referencia específicos por edad no deberían utilizarse para el PSA [LOE, opinión de expertos; SOR B].
Aumentar la especificidad del PSA en el screening para cáncer de próstata. El PSA total circulante corresponde aproximadamente a la suma del PSA libre (fPSA) en circulación y del PSA unido como un complejo estable de alfa 1 antiquimotripsina (PSA- ACT). La fracción libre constituye desde 5% hasta más de 40% del total (149). Las formas libres y unidas pueden ser detectadas en forma selectiva por ensayos disponibles comercialmente sin que ninguna reacción cruzada significativa interfiera (150). Se propusieron varias mediciones combinadas para mejorar la especificidad de una única concentración total de PSA en suero para la detección temprana del cáncer de próstata. La densidad del PSA (151-153), la velocidad del PSA (154), el tiempo de duplicación del PSA (155)(156) y el porcentaje de fPSA (%fPSA) (157-161) fueron todos evaluados en este contexto, pero sólo el %fPSA fue ampliamente validado e implementado en la práctica clínica. Los hombres con enfermedades benignas generalmente presentan %fPSA más elevados que los hombres con cáncer de próstata (y agrandamientos no benignos). Desafortunadamente, el agrandamiento benigno de la próstata concurrente con el cáncer de próstata complica la interpretación de los datos de %fPSA (162). No obstante, en una revisión sistemática llevada a cabo en 2005 el uso del %fPSA fue propuesto como un medio para reducir la cantidad de biopsias innecesarias, particularmente para los hombres con niveles de PSA entre 4 y 10 μg/L (163). De acuerdo con las conclusiones de un meta-análisis reciente (164), tanto el panel actual de la NACB como el European Group on Tumor Markers (EGTM) (148) recomiendan el uso del %fPSA para facilitar la diferenciación entre los hombres con cáncer de próstata y los hombres con enfermedades benignas en grupos selectos de alto riesgo (por ejemplo, cuando el PSA total es <10 μg/L y el DRE es negativo). En particular el %fPSA puede ser útil para identificar hombres que tienen cáncer de próstata a pesar de haber obtenido resultados negativos en la primera biopsia. En los hombres que se sospecha pueden tener alto riesgo de albergar una enfermedad maligna debido al bajo %fPSA, el diagnóstico de cáncer se puede hacer efectivo después de repetir la biopsia. Esta recomendación está atenuada por la necesidad de validar el límite de decisión médica para cada combinación de ensayos comerciales de PSA total y libre (165).
RECOMENDACIÓN 4 DEL PANEL DE CÁNCER DE PRÓSTATA DE LA NACB: USO DEL %fPSA EN EL DIAGNÓSTICO
Se recomienda el uso del %fPSA para facilitar la diferenciación entre los hombres con cáncer de próstata y los hombres con hipertrofia prostática benigna cuando el nivel de PSA en suero total se encuentra entre 4 y 10 μg/L y el DRE es negativo, por lo general, en los hombres que se están realizando un nueva biopsia, en grupos selectos de alto riesgo y particularmente para identificar hombres que tienen cáncer de próstata a pesar de haber obtenido resultados negativos en la primera biopsia. El límite de decisión clínica debe ser validado adecuadamente para cada combinación de ensayos de fPSA y PSA total [LOE, I; SOR A].
Más del 95% de la fracción de PSA complejado (cPSA) inmunodetectable está unida a la alfa 1 antiquimotripsina y menos del 5% unido a otros ligandos complejos (por ejemplo, el inhibidor de proteasa alfa-1
(157)(166-168)). El PSA unido a la alfa-2 macroglobulina no es detectado por los inmunoensayos actuales para PSA. Los niveles de cPSA en suero pueden determinarse directamente utilizando ensayos PSA-ACT (157)(158)(169) que primero bloquean el acceso al fPSA y luego miden los niveles de cPSA o indirectamente al restar el fPSA de los niveles de tPSA (171) utilizando dos ensayos diseñados para funcionar juntos y estandarizados adecuadamente. La medición del cPSA solo proporciona una detección del cáncer comparable al PSA total, pero parece ofrecer de algún modo una mejor especificidad en un escaso rango de concentración (172). Sin embargo, los niveles de cPSA por sí solos no pueden lograr una especificidad similar a la del %fPSA (170).
GUÍAS PARA LA DETECCIÓN TEMPRANA DEL CÁNCER DE PRÓSTATA
La American Cancer Society (ACS) ha publicado algunas guías en relación a la detección temprana del cáncer de próstata. Estas guías recomiendan un screening anual con DRE y mediciones del PSA en suero a partir de los 50 años en hombres con riesgo medio con una expectativa de vida de por lo menos 10 años (138). Aunque se considera que el PSA es la mejor prueba bioquímica disponible actualmente para detectar cáncer de próstata, según la ACS también debería incluirse un DRE siempre que fuese posible. Se justifica el screening a edades más tempranas (45 o incluso 40 años) en hombres con riesgo elevado, inclusive en aquellos de descendencia afroamericana y en quienes tengan uno o más familiares de primer grado con cáncer de próstata. Estos dos grupos a menudo desarrollan cáncer de próstata varios años antes que la población en general y también suelen presentar un tipo de cáncer más agresivo (173).
Las pruebas de seguimiento recomendadas para los individuos de alto riesgo que se realizaron un screening por primera vez a los 40 años de edad dependen del resultado del PSA. Aquellos con niveles de PSA <1 μg/L deberían reanudar las pruebas a los 45 años de edad, quienes tengan niveles >1 pero < 2,5 μg/L deberían realizarse las pruebas anualmente, mientras que aquellos que tengan niveles ≥2,5 μg/L deberían realizarse otros estudios y considerar la realización de una biopsia (138).
Estas guías no avalan una recomendación general de screening masivo, pero apoyan la noción de que debería informarse a cada hombre sobre las ventajas y limitaciones del screening de cáncer de próstata antes de que tomen una decisión, como por ejemplo se recomienda en el Reino Unido por medio del Prostate Cancer Risk Management Programme (174) y por el NICE (121)(139)(174). Se está poniendo mucho más énfasis que antes en la toma de decisión informada por parte del individuo. Este tema fue recientemente sujeto de una revisión sistemática en la cual se identificaron y se estimaron las ayudas y las evaluaciones para la decisión del PSA (175). Los autores concluyeron que las ayudas para las decisiones del PSA mejoraron el conocimiento sobre las pruebas de PSA por lo menos en el corto plazo. Hay muchos temas a considerar, incluyendo la disparidad entre la incidencia y la mortalidad asociadas al cáncer de próstata, ya que se les diagnostica cáncer de próstata a muchos más hombres que los que eventualmente mueren por el mismo. Sin embargo, la detección temprana ofrece la posibilidad de detectar la enfermedad confinada al órgano cuando todavía es posible realizar un tratamiento curativo. La enfermedad metastásica ahora constituye solamente alrededor del 5% de los diagnósticos iniciales en los Estados Unidos, una caída dramática a partir del índice de incidencia del 50% en la época previa al PSA (122). No obstante, todavía hay muchas dudas respecto al tratamiento de la enfermedad en etapa temprana, incluyendo el tratamiento preferido para el cáncer de próstata localizado clínicamente.
MÉRITOS DE LA DETECCIÓN TEMPRANA DEL CÁNCER DE PRÓSTATA
Por consiguiente, todavía hay una enorme controversia respecto a los méritos de la detección temprana del cáncer de próstata, y no todas las entidades médicas avalan el screening de rutina (176). Mientras que la American Urological Association avala las políticas sobre la detección temprana del cáncer de próstata de la American Cancer Society, otras organizaciones discrepan sobre las ventajas del screening de cáncer de próstata(177)(178). Los argumentos en contra del screening se basan en que no hay evidencia concluyente mediante ninguna prueba randomizada de que la detección y el tratamiento temprano influyan sobre la mortalidad total, a la vez que los tratamientos estándares para el cáncer de próstata órgano-confinado están asociados con una significativa asiduidad de efectos colaterales. Actualmente, la US Preventive Task Force, la American Academy of Family Physicians, el American College of Physicians, el National Cancer Institute (NCI) y el EGTM no recomiendan el screening de cáncer de próstata basado en la población (177)(178). La preocupación más importante es que las modalidades de screening actuales se traducen en diagnósticos y tratamientos excesivos de la enfermedad en etapas tempranas que pueden no ser clínicamente significativas, como se revisó recientemente (179).
La NACB y el EGTM recomiendan que la implementación masiva del screening para cáncer de próstata en la población en general debería aguardar el resultado final de los estudios randomizados prospectivos que se están llevando a cabo, en particular de la prueba del European Randomized Screening for Prostate Cancer (ERSPC) (180), que tienen la suficiente autoridad para establecer si la detección y el tratamiento temprano disminuyen la mortalidad por cáncer de próstata. El ERSPC es tuvo en vías de ejecución por 10 años y se esperaban sus resultados en el 2010 (181). También se encuentran en curso en los Estados Unidos los estudios multicéntricos a largo plazo, bajo los auspicios del NCI y del U. S. Public Health Service, para determinar el impacto del screening de cáncer de próstata en la supervivencia (182).
Sin evidencias bien definidas hasta ahora de que el screening de cáncer de próstata otorgue un beneficio neto, los partidarios del screening apuntan a la asociación entre la prueba de PSA con las etapas de detección de cáncer más tempranas y la reducción de la mortalidad a causa del cáncer de próstata. Los datos de registro de poblaciones masculinas que se realizaron screening en forma masiva y reducida en Austria proporcionan un ejemplo claro. La tasa de mortalidad esperada por cáncer de próstata (183) se redujo mucho más en el Tirol, un área del país donde se realizaron screenings en forma masiva, que en áreas donde se realizaron de manera menos intensa (184). El descenso en la mortalidad observada estaba asociado con un cambio hacia una etapa más auspiciosa al momento del diagnóstico, en particular a un aumento en la proporción de enfermedad confinada al órgano. Se infiere que la detección temprana y la accesibilidad a tratamientos efectivos tuvieron como consecuencia una correspondiente mejoría en la supervivencia específica de la enfermedad. Se observó una tendencia similar en los datos del programa Surveillance, Epidemiology and End Results del NCI, en un estudio llevado a cabo en el condado de Olmsted, Minnesota, MN (185) y en una comparación en la mortalidad por cáncer de próstata entre los Estados Unidos y el Reino Unido entre 1975 y 2004 (186).
Aunque los datos recientes sugieren que el aparente cambio hacia la etapa precoz de la enfermedad y el tratamiento subsiguiente del cáncer de próstata localizado detectado con PSA influyó de manera positiva en las tasas de mortalidad, aún queda pendiente saber si la detección temprana y la intervención terapéutica alteran el curso natural de la enfermedad, ya que los beneficios observados pueden ser el resultado de sesgos de selección o de anticipación en el tiempo de diagnóstico (187). La etapa al momento del diagnóstico puede estar más condicionada por el comportamiento biológico del tumor (agresividad) que por la demora en la aparición, y la detección temprana puede no tener un impacto significativo en la mortalidad. Un aumento en la proporción de cánceres de próstata localizados que están siendo tratados puede justificar parte del cambio en las estadísticas de mortalidad (181).
Actualmente no hay evidencia suficiente para avalar ni para refutar el uso masivo, selectivo u oportunista del screening basado en el PSA ni tampoco está claro si se debe desalentar el uso del screening basado en el PSA, por lo cual el éxito para reducir la mortalidad por cáncer de próstata queda aún por demostrarse. Actualmente, no hay evidencia contundente de pruebas controladas randomizadas respecto al impacto del screening sobre la calidad de vida, las desventajas del screening o su valor económico. Es necesario que los resultados de dos pruebas controladas randomizadas multicéntricas a gran escala que se están llevando a cabo y que van a estar disponibles en los próximos años tomen decisiones basadas en la evidencia respecto al screening de cáncer de próstata (188).
RECOMENDACIÓN 5 DEL PANEL DE CÁNCER DE PRÓSTATA DE LA NACB: SCREENING DE CÁNCER DE PRÓSTATA
La decisión acerca de si puede recomendarse la implementación generalizada del screening de PSA para el cáncer de próstata en la población en general debe aguardar los resultados de los estudios sobre screening randomizados prospectivos que se están desarrollando (por ejemplo, la prueba ERSPC en Europa) y que están previstos finalizar para el 2010. [LOE, III; SOR A].
EL PSA EN LOS TRATAMIENTOS EN PACIENTES
El tratamiento óptimo para la enfermedad en su etapa temprana todavía queda por establecerse. Algunas opciones de tratamiento incluyen el tratamiento expectante (vigilancia activa o espera vigilada), prostatectomía radical o terapia de radiación (radiación con rayos externa o braquiterapia) (139). Las modalidades de tratamientos alternativos (por ejemplo, la criocirugía o el ultrasonido focalizado de alta intensidad) se encuentran a la espera de la evaluación de sus resultados a largo plazo. A los pacientes con la enfermedad en etapa avanzada (metastásica) generalmente se les ofrece terapia hormonal para impedir la estimulación de andrógenos en la próstata. La síntesis del PSA que realizan las células diferenciadas se ve muy deteriorada por dicho tratamiento y los niveles de PSA en suero reflejan la carga tumoral de manera diferente a como lo hacen antes de la privación de andrógenos. Cuando la enfermedad se vuelve refractaria a la privación de andrógenos de primera o segunda línea, los pacientes pueden incorporarse a la quimioterapia o a protocolos experimentales con varios agentes (por ejemplo, Taxotere, Sanofi-aventis, Bridgewater, NJ). La evaluación de los niveles de PSA en sangre tiene un rol fundamental en todos los aspectos del tratamiento de cáncer de próstata desde la vigilancia hasta la selección del tratamiento óptimo para la estimación del pronóstico y para el monitoreo post terapéutico. No se ha demostrado que las mediciones de fPSA ofrezcan ninguna ventaja sobre el total del PSA durante el seguimiento del cáncer de próstata (189).
El tratamiento seleccionado, una vez detectado el cáncer de próstata, depende críticamente de si la enfermedad está confinada a la próstata o no. La prostatectomía radical es más que nada una opción para los pacientes con la enfermedad órgano-confinada, aunque los pacientes con la enfermedad extracapsular también se pueden beneficiar con la cirugía radical (190). Sin embargo, la magnitud de la enfermedad es difícil de predecir con precisión. El PSA por sí solo no es informativo (191), pero en combinación con la etapa clínica y el score de Gleason puede predecir razonablemente bien la etapa patológica del cáncer de próstata localizado. Se publicaron tablas predictivas que incorporan estos parámetros (192-194) y son utilizadas por los médicos para estimar la probabilidad de la enfermedad órgano-confinada y para determinar si se indica o no una prostatectomía radical. La NICE recomienda que equipos multidisciplinarios de urología les asignen una categoría de riesgo a todos los hombres con cáncer de próstata localizado recién diagnosticado tomando en cuenta estos parámetros (121)(139).
La evaluación de los cambios en los niveles de PSA con el tiempo [velocidad del PSA (PSAv) o tiempo de duplicación del PSA (PSADT)] fue introducida por primera vez en 1992 (154), donde un rápido incremento indicaba un riesgo más alto para el desarrollo subsiguiente de cáncer de próstata. Se sugirió asimismo en varios estudios que un aumento más rápido del PSA antes del tratamiento guarda correlación con una enfermedad más agresiva y una recurrencia temprana después del tratamiento. En estudios más recientes informados por D'Amico et al (195)(196), se observó que una PSAv de más de 2,0 μg/L/año medida durante el año anterior al diagnóstico estaba significativamente asociada a la mortalidad específica por cáncer de próstata. Recientemente, Carter et al aportaron evidencia de que la PSAv también se podría utilizar para predecir cáncer de próstata terminal hasta 15 años antes del diagnóstico (197). Sin embargo, para demostrar que la PSAv tiene un valor clínico importante debe demostrarse de forma inequívoca que un modelo multivariable que incorpore tanto el PSA como la PSAv (por ejemplo, agregar la PSAv a un modelo que incluya el tPSA, la edad y la fecha del diagnóstico) sea mejor que el modelo que utiliza el PSA solo. Parece que aún no existe este nivel de evidencia, tampoco en los últimos estudios informados sobre este tema.
Después de una cirugía exitosa, los valores del PSA deberían descender a niveles indetectables (198)(199). Un PSA persistentemente elevado indica evidencia de enfermedad residual. Sin embargo, lo contrario no siempre ocurre, es decir que un PSA indetectable en el post operatorio no indica una curación quirúrgica. Puede pasar un tiempo considerable antes de que la enfermedad residual se vuelva evidente por medio del PSA detectable. Por lo general la enfermedad residual se declara dentro de los 3 años de realizada la cirugía. Hasta un 20% a 30% de los hombres que se someten a una prostatectomía radical presentan enfermedad residual durante los primeros 10 años posteriores a la cirugía.
Un nivel en aumento del PSA luego de una prostatectomía radical es un signo bioquímico de enfermedad recurrente que generalmente precede otros signos de progresión por varios años. Sin embargo, no todos los pacientes con recurrencia bioquímica van a desarrollar síntomas de la enfermedad clínica ni de propagación metastásica a lo largo de sus vidas ni tampoco requieren tratamiento (200)(201). Los factores descriptos que predicen la evolución del desarrollo de la enfermedad metastásica incluyen el tiempo de recurrencia bioquímica, el grado del tumor (score de Gleason) y el PSADT (156)(161). Estos parámetros pueden utilizarse para estimar la probabilidad de pacientes que permanecen libres de enfermedad metastásica explícita y facilitarles a los médicos la estratificación de los pacientes en categorías de bajo y alto riesgo para tomar mejores decisiones de tratamientos.
El monitoreo de la respuesta luego del tratamiento inicial y la evaluación de los resultados durante la terapia subsiguiente son las aplicaciones clínicas más importantes de las determinaciones del PSA. La medición del PSA brinda información esencial sobre la eficacia de la cirugía o de la terapia de radiación, ayuda a establecer la posibilidad de enfermedad residual (local o distante), da indicios de enfermedad metastásica recurrente antes de que pueda ser detectada por otros procedimientos de diagnóstico convencionales y suministra un complemento útil para la evaluación de la respuesta terapéutica.
El PSA puede proporcionar las primeras mediciones de la eficacia del tratamiento o de la recurrencia de la enfermedad y como tal influir en la percepción de bienestar del paciente. Para algunos pacientes puede ser más apropiado dejar de medir el PSA, especialmente si no existen tratamientos alternativos efectivos para contrarrestar las conclusiones adversas (148).
PSA EN EL CONTROL POST TRATAMIENTO DEL CÁNCER DE PRÓSTATA
Después del tratamiento, el panel opina que una única medición del PSA en el límite de detección inferior del ensayo o cercana al mismo no es suficiente para diagnosticar la recurrencia del cáncer de próstata. El aumento de los niveles de PSA comprobado por mediciones seriales o repetidas brinda una evidencia mucho más confiable (121) (139) (202). Después de una prostatectomía radical el PSA circulante disminuye a niveles indetectables si el cáncer de próstata estaba órgano-confinado y todos los tejidos prostáticos residuales fueron extirpados. La detección sostenida del PSA indica, ya sea una resección incompleta o depósitos metastásicos. Si se utilizan pruebas de PSA ultrasensibles en este contexto, se debería establecer el límite de detección funcional de la prueba y éste debería corresponder al límite informado más bajo.
El tratamiento seleccionado, una vez detectado el cáncer de próstata, depende críticamente de si la enfermedad está confinada a la próstata o no. La prostatectomía radical es más que nada una opción para los pacientes con la enfermedad órgano-confinada, aunque los pacientes con la enfermedad extracapsular también se pueden beneficiar con la cirugía radical (190). Sin embargo, la magnitud de la enfermedad es difícil de predecir con precisión. El PSA por sí solo no es informativo (191), pero en combinación con la etapa clínica y el score de Gleason puede predecir razonablemente bien la etapa patológica del cáncer de próstata localizado. Se publicaron tablas predictivas que incorporan estos parámetros (192-194) y son utilizadas por los médicos para estimar la probabilidad de la enfermedad órgano-confinada y para determinar si se indica o no una prostatectomía radical. La NICE recomienda que equipos multidisciplinarios de urología les asignen una categoría de riesgo a todos los hombres con cáncer de próstata localizado recién diagnosticado tomando en cuenta estos parámetros
La evaluación de los cambios en los niveles de PSA con el tiempo [velocidad del PSA (PSAv) o tiempo de duplicación del PSA (PSADT)] fue introducida por primera vez en 1992 (154), donde un rápido incremento indicaba un riesgo más alto para el desarrollo subsiguiente de cáncer de próstata. Se sugirió asimismo en varios estudios que un aumento más rápido del PSA antes del tratamiento guarda correlación con una enfermedad más agresiva y una recurrencia temprana después del tratamiento. En estudios más recientes informados por D'Amico et al
Después de una cirugía exitosa, los valores del PSA deberían descender a niveles indetectables
Un nivel en aumento del PSA luego de una prostatectomía radical es un signo bioquímico de enfermedad recurrente que generalmente precede otros signos de progresión por varios años. Sin embargo, no todos los pacientes con recurrencia bioquímica van a desarrollar síntomas de la enfermedad clínica ni de propagación metastásica a lo largo de sus vidas ni tampoco requieren tratamiento (200)(201). Los factores descriptos que predicen la evolución del desarrollo de la enfermedad metastásica incluyen el tiempo de recurrencia bioquímica, el grado del tumor (score de Gleason) y el PSADT (156)(161). Estos parámetros pueden utilizarse para estimar la probabilidad de pacientes que permanecen libres de enfermedad metastásica explícita y facilitarles a los médicos la estratificación de los pacientes en categorías de bajo y alto riesgo para tomar mejores decisiones de tratamientos.
El monitoreo de la respuesta luego del tratamiento inicial y la evaluación de los resultados durante la terapia subsiguiente son las aplicaciones clínicas más importantes de las determinaciones del PSA. La medición del PSA brinda información esencial sobre la eficacia de la cirugía o de la terapia de radiación, ayuda a establecer la posibilidad de enfermedad residual (local o distante), da indicios de enfermedad metastásica recurrente antes de que pueda ser detectada por otros procedimientos de diagnóstico convencionales y suministra un complemento útil para la evaluación de la respuesta terapéutica.
El PSA puede proporcionar las primeras mediciones de la eficacia del tratamiento o de la recurrencia de la enfermedad y como tal influir en la percepción de bienestar del paciente. Para algunos pacientes puede ser más apropiado dejar de medir el PSA, especialmente si no existen tratamientos alternativos efectivos para contrarrestar las conclusiones adversas (148).
PSA EN EL CONTROL POST TRATAMIENTO DEL CÁNCER DE PRÓSTATA
Después del tratamiento, el panel opina que una única medición del PSA en el límite de detección inferior del ensayo o cercana al mismo no es suficiente para diagnosticar la recurrencia del cáncer de próstata. El aumento de los niveles de PSA comprobado por mediciones seriales o repetidas brinda una evidencia mucho más confiable (121)(139)(202). Después de una prostatectomía radical el PSA circulante disminuye a niveles indetectables si el cáncer de próstata estaba órgano-confinado y todos los tejidos prostáticos residuales fueron extirpados. La detección sostenida del PSA indica, ya sea una resección incompleta o depósitos metastásicos. Si se utilizan pruebas de PSA ultrasensibles en este contexto, se debería establecer el límite de detección funcional de la prueba y éste debería corresponder al límite informado más bajo.
Actualmente, la evidencia sobre las ventajas clínicas de informar la recurrencia bioquímica del cáncer de próstata con niveles de PSA inferiores a 0,4 μg/L es ambigua (200). Recientemente, sin embargo, se ha observado que la terapia de radiación de último recurso después de una prostatectomía aporta mejores resultados cuando los niveles de PSA son aún muy bajos (≥ 0,5 μg/L) (203). El límite de recurrencia es menos claro después de la terapia de radiación debido a la disminución normalmente más lenta de la concentración de PSA circulante. La American Society for Therapeutic Radiation and Oncology definió la recurrencia bioquímica como un aumento de 2 μg/L o más sobre el PSA nadir, después de radioterapia con rayos externos con o sin terapia hormonal (204).
El monitoreo con PSA después del tratamiento para el cáncer próstata es el soporte principal de la práctica clínica, aunque la utilidad clínica del PSA es variable y depende de la etapa de la enfermedad en cada paciente. Como se observó recientemente, la falta de información de alta calidad y la escasez de pruebas clínicas obstaculiza el desarrollo de recomendaciones guía para el cáncer de próstata, pero donde se implementan, las guías disponibles suelen mejorar los resultados del cáncer de próstata a la vez que reducen la atención innecesaria, inefectiva y costosa (140). El PSA posee una gran sensibilidad para detectar la recurrencia después de la prostatectomía radical, pero es menos sensible para detectar la recurrencia después de la terapia de radiación. Para el monitoreo del tratamiento hormonal, el PSA proporciona una herramienta sensible para verificar la respuesta al tratamiento y detectar el crecimiento del tumor (recurrencia). Sin embargo, en los pacientes cuya enfermedad avanzada reaparece durante la terapia de deprivación androgénica, el PSA tiene sólo una capacidad limitada para predecir resultados de supervivencia.
RECOMENDACIÓN 6 DEL PANEL DE CÁNCER DE PRÓSTATA DE LA NACB: EL USO DEL PSA EN EL CONTROL POST-TRATAMIENTO DEL CÁNCER DE PRÓSTATA
El PSA se recomienda para el tratamiento de pacientes con cáncer de próstata para controlar el estado de la enfermedad después del tratamiento. [LOE, III; SOR, A].
USO DE NOMOGRAMAS QUE INCORPORAN EL PSA PARA TRATAR EL CÁNCER DE PRÓSTATA
Los nomogramas que incorporan uno o más factores brindan el medio más exacto para individualizar la terapia y predecir los resultados además de reflejar los últimos avances en el tratamiento del paciente (205). En lugar de atenerse a la experiencia del médico o al análisis de riesgos generales de poblaciones de pacientes con características similares, los nomogramas evalúan las opciones de tratamiento o los pronósticos basándose en modelos computarizados de los análisis de regresión de riesgos proporcionales de Cox. Los resultados predictivos proporcionados por los modelos computarizados no son perfectos, pero los nomogramas pueden resultar sumamente útiles para decidir sobre los tratamientos. En ocasiones, puede ser difícil seleccionar el mejor nomograma cuando varias versiones contrapuestas aplican a la misma decisión clínica. Kattan y sus colegas (205)(206) han desarrollado nomogramas pre y post operatorios incorporando el PSA junto al score de Gleason y otras variables para predecir la recurrencia de la enfermedad después de una prostatectomía radical.
CONSIDERACIONES PRE-ANALÍTICAS, ANALÍTICAS Y POST-ANALÍTICAS
Diversos factores en las etapas pre-analíticas, analíticas y post-analíticas pueden afectar la interpretación clínica de los resultados de PSA y deben ser considerados cuidadosamente. Muchos de estos factores estuvieron sujetos a una revisión sistemática que se llevó a cabo en el 2001 (207).
Procesamiento y almacenamiento pre-analítico de las muestras. Es conveniente tomar las muestras de sangre antes de cualquier manipulación de la próstata por DRE, cistoscopia o biopsia de próstata (166). De no ser posible la toma previa, entonces es prudente esperar varios días después del DRE antes de extraer sangre para el PSA, aunque en la mayoría de los hombres el DRE no provoca cambios clínicamente relevantes en la concentración del PSA circulante (166). Después de una biopsia o de una cirugía, la espera recomendada es de varias semanas, dejando suficiente tiempo para que el PSA-ACT complejo sea eliminado de la circulación sanguínea, aún cuando los riñones rápidamente liberen de la sangre todo el fPSA que fue liberado de la próstata por el procedimiento (208)( 209).
RECOMENDACIÓN 7 DEL PANEL DE CÁNCER DE PRÓSTATA DE LA NACB: REQUERIMIENTOS PRE-ANALÍTICOS PARA EL PSA: MANIPULACIÓN DE LA PRÓSTATA
Se debe realizar la extracción de sangre antes de cualquier manipulación de la próstata y varias semanas después de la resolución de una prostatitis. [LOE, no aplicable; SOR, B].
Para eliminar los productos in vitro, la sangre debería centrifugarse dentro de las 3 horas de la extracción para aislar el suero o plasma (210). El suero o plasma puede mantenerse a temperatura refrigerada hasta 24 horas sin pérdida de PSA. Si el análisis se demora más, entonces es vital almacenar las muestras congeladas, preferentemente a -30 °C o menos para evitar el punto eutéctico. Es conveniente mantener temperaturas de por lo menos -70 °C para el almacenamiento a largo plazo. Los datos muestran que el fPSA es más propenso a perder la inmunorreactividad que el cPSA (166)(211) y que para el fPSA esto ocurre más lentamente en plasma que en suero (210).
RECOMENDACIÓN 8 DEL PANEL DE CÁNCER DE PRÓSTATA DE LA NACB: REQUERIMIENTOS PRE-ANALÍTICOS PARA EL PSA: MANIPULACIÓN DE LA MUESTRA
Las muestras se deberían centrifugar y refrigerar dentro de las 3 horas de la extracción; esta recomendación es especialmente importante para el fPSA, que es más lábil que el PSA total. Las muestras pueden almacenarse a temperaturas refrigeradas hasta 24 horas, pero las que no van a analizarse dentro de las 24 horas deberían almacenarse congeladas (por lo menos a -20 °C y preferentemente a -30 °C o menos). Para el almacenamiento a largo plazo, las muestras deben congelarse a -70 °C o menos [LOE, no aplicable; SOR, B].
Estandarización de la prueba de PSA. Comúnmente se utilizan dos estándares de referencia para las pruebas de PSA - los trazables a los estándares internacionales de la OMS y los trazables al estándar de Hybritech. La mayoría de los médicos clínicos dan por sentado que todos los ensayos de PSA arrojan valores similares y que los cambios en estos valores están probablemente asociados a cambios fisiopatológicos en las glándulas prostáticas. Se supone que las mediciones de PSA son consistentes entre laboratorios y entre los fabricantes de ensayos, pero esto no es necesariamente siempre así (212). Mientras que las guías de práctica y las estrategias de tratamiento de la enfermedad varían en términos de qué ‘número' debería utilizarse para el seguimiento de tipos específicos de pacientes, estas guías muy pocas veces tienen sub-categorías para varios métodos analíticos.
En la práctica hay importantes diferencias entre los ensayos de PSA. Históricamente, el ensayo de PSA Tandem-R de Hybritech (Hibritech, Inc, San Diego, CA) fue el primer ensayo comercial aprobado por la FDA que se utilizó en forma generalizada. Este ensayo se estandarizó utilizando el coeficiente de extinción para el PSA de 1,42 mL/mg/cm informado por Graves et al en 1990 (213). El ensayo Hybritech tuvo una buena aceptación de la comunidad médica y conformó las bases para el límite de referencia superior tradicional de 4,0 μg/L (141). El segundo ensayo comercial ampliamente utilizado (Abbott IMx; Laboratorios Abbott, Chicago, IL) fue estandarizado para homologarse con este primer ensayo de Hybritech y también otros ensayos se alinearon estrechamente con éstos (214). Sin embargo, en 1995, Stamey et al publicaron un artículo demostrando que el verdadero coeficiente de extinción para el PSA es de 1,84±0,04 mL/mg/cm, según el análisis cuantitativo de aminoácidos (215). Hubo indicios de que el error en el primer análisis gravimétrico fue causado por la presencia de hidratos de carbono, sal o agua unida en las preparaciones liofilizadas. El resultado neto de este error es que los valores preliminares del PSA de Hybritech son cerca de 20% más altos que los del First International Standard for PSA de la OMS (IRR 96/670) (216).
El First International Standard for PSA (IRR 96/670) y el Free PSA (IRR 96/688) se establecieron en 1999 utilizando el coeficiente de extinción correcto. Los dos estándares contienen PSA proveniente del plasma seminal. El IRR 96/670 es una mezcla del PSA y del ACT en una proporción de 90:10 para imitar el PSA circulante y el IRR 96/688 contiene solamente PSA libre (no ligado). Un editorial que acompañaba el artículo sobre estandarización titulado: "Los Primeros Estándares Internacionales de la OMS para el antígeno prostático específico: el comienzo del fin para las discrepancias entre ensayos" llegaba a la conclusión de que este estándar conduciría a una mayor uniformidad del PSA a medida que los fabricantes comenzaran a utilizar este material para calibrar los ensayos de PSA (217). Ahora se recomienda que los ensayos de PSA utilizados en el United Kingdom National Health Service se calibren con precisión según el Estándar Internacional adecuado y que sean equimolares (218), con las disposiciones formales ahora implementadas para la confirmación anual independiente de desempeño satisfactorio. Mientras que varios estudios sugieren que la equivalencia entre métodos mejoró a partir de la introducción de los Estándares Internacionales aún existen diferencias entre los ensayos de PSA, las cuales pueden llevar a un error en la interpretación clínica si se utilizan diferentes ensayos de PSA al evaluar un paciente determinado (218-220).
Consideraciones analíticas y de informes de datos. Por lo general el PSA se utiliza junto con el examen físico para detectar el cáncer de próstata. Una única detección positiva de PSA siempre debería verificarse mediante la repetición de la medición de PSA en una muestra tomada por separado antes de pedir un examen de confirmación histopatológico del tejido (por ejemplo, obtenido por biopsia). Esto puede reducir sustancialmente la cantidad de biopsias innecesarias (221). El diagnóstico de cáncer de próstata sólo puede confirmarse por medio de un examen histopatológico del tejido.
El desempeño analítico debería controlarse con material de control de calidad que contenga PSA en concentraciones cercanas a los puntos de decisión clínicamente relevantes. La información sobre las características y la utilidad de los ensayos, incluyendo las concentraciones notificables más bajas del ensayo [a menudo definidas como la concentración de PSA debajo de las cuales la variación del coeficiente analítico [CV] supera el 20%] y los CVs del ensayo en concentraciones correspondientes a los puntos de decisión clínica relevantes deberían estar a disposición de los médicos a través de fuentes de información sobre las pruebas de laboratorio.
RECOMENDACIÓN 9 DEL PANEL DE CÁNCER DE PRÓSTATA DE LA NACB: REQUERIMIENTOS ANALÍTICOS PARA PSA: CONTROL DE CALIDAD
La concentración notificable más baja debería ser determinada por el laboratorio y notificada a los médicos. Se deberían implementar controles de calidad en estas concentraciones [LOE, no aplicable; SOR, A].
Variabilidad biológica. Para interpretar los datos del PSA de muestras tomadas de cualquier individuo o en forma serial, la variabilidad del PSA en la sangre también debería tomarse en cuenta (207) (222). El EGTM recientemente revisó publicaciones relativas a la variabilidad del PSA e informó que una estimación razonable de la variación biológica del PSA es de 20% en hombres mayores a 50 años dentro del rango de concentración de PSA de 0,1 a 20 μg/L (223). En hombres sanos con concentraciones de PSA inferiores a 2 μg/L, la variación biológica era inferior al 14%, a la vez que se sugirió que un cambio del 30% entre las sucesivas mediciones de PSA era clínicamente significativo
RECOMENDACIÓN 10 DEL PANEL DE CÁNCER DE PRÓSTATA DE LA NACB: REQUISITOS POST-ANALÍTICOS PARA EL PSA: VARIACIÓN BIOLÓGICA INTRA-INDIVIDUAL
La contribución de la variación biológica intra-individuo debe tenerse en cuenta al interpretar los resultados clínicos [LOE, no aplicable; SOR, A].
Es prudente incluir junto con el resultado del PSA un recordatorio de que un solo resultado de una prueba de sangre de screening no debería utilizarse como única evidencia de la presencia o ausencia de enfermedad maligna. El informe de laboratorio debería incluir el fabricante del ensayo de PSA utilizado, atraer la atención hacia cualquier límite de decisión clínica relevante y, de ser necesario, advertir que los resultados no pueden intercambiarse con los generados por otros ensayos a menos que el intercambio de valores entre los ensayos haya sido validado previamente (212)(220).
RECOMENDACIÓN 11 DEL PANEL DE CÁNCER DE PRÓSTATA DE LA NACB: REQUERIMIENTOS POST-ANALÍTICOS PARA EL PSA - INFORMACIÓN QUE DEBE INCLUIRSE EN LOS INFORMES CLÍNICOS
Los informes clínicos deberían incluir el nombre del ensayo, los límites de decisiones clínicas relevantes y un recordatorio de que un solo resultado de una prueba de sangre de screening no debería utilizarse como única evidencia de la presencia o ausencia de enfermedad maligna. [LOE, no aplicable; SOR, A].
Futuros desarrollos
USO DE ENSAYOS EXPERIMENTALES PARA MEDIR LAS CÉLULAS TUMORALES CIRCULANTES EN SANGRE PARA DETECTAR Y EVALUAR LA PROGRESIÓN DE ETAPAS (MICRO) METASTÁSICAS DEL CÁNCER DE PRÓSTATA
Los ensayos que detectan las células tumorales circulantes (CTCs) en la sangre periférica fueron desarrollados y autorizados para el uso clínico por la FDA para brindar información sobre el pronóstico en mujeres con cáncer de mama con nódulo positivo (226). Sin embargo, nuestra capacidad actual para detectar y perfilar (micro) metástasis de cáncer de próstata es limitada. Se han desarrollado y probado muchas técnicas para aislar y caracterizar las CTCs. Los ensayos de reacción en cadena por la polimerasa - transcripción inversa (RT-PCR) son sensibles y muy específicos cuando la expresión del gen diana está limitada a las células del tumor maligno. La citometría de flujo se puede utilizar para detectar y verificar la identidad de las células como CTCs, pero no permite evaluaciones morfológicas y no discrimina cambios moleculares a un nivel sub-celular. La inmovilización (por ejemplo, sobre partículas magnéticas) de los anticuerpos sobre la molécula de adhesión de la célula epitelial (EpCAM) facilita el enriquecimiento y la inspección por microscopio de células tumorales circulantes derivadas del epitelio de la sangre periférica. Recientemente, se desarrolló un sistema semi-automatizado, que utiliza métodos de captura inmunomagnética basada en anticuerpos por EpCAM y métodos de tinción (227). Se han informado factores predictivos de detección de CTCs en cáncer de próstata y para los pacientes con cáncer de próstata metastásico la detección de > 5 CTCs por 7,5 mL de sangre predice una menor sobrevida libre de progresión y una menor sobrevida en general. En este caso, el recuento de CTC resultó ser más predictivo de los resultados que los parámetros clínicos estándares (228). Para el cáncer de próstata, los análisis preliminares de la correlación del recuento de CTC con el mRNAs del PSA o del antígeno prostático específico de la membrana y los predictores clínicos (229) disponibles son alentadores pero todavía no fueron lo suficientemente evaluados o validados como para garantizar recomendaciones para ningún uso en la práctica clínica de rutina.
RECOMENDACIÓN 12 DEL PANEL DE CÁNCER DE PRÓSTATA DE LA NACB: MEDICIÓN DE LAS CÉLULAS TUMORALES PROSTÁTICAS CIRCULANTES EN SANGRE PERIFÉRICA
A pesar de que los primeros resultados son alentadores, estas técnicas todavía no fueron lo suficientemente validadas como para garantizar recomendaciones para su aplicación en la práctica clínica de rutina. [LOE, IV; SOR, C].
Puntos clave: marcadores tumorales en el cáncer de próstata
Las mediciones del PSA en suero claramente tienen un rol fundamental tanto en el diagnóstico como en el tratamiento de los pacientes con cáncer de próstata. Mejorar aún más la comprensión de la historia natural de la enfermedad debería posibilitar una mejor utilización de estos marcadores en el futuro.
118. Jemal A, Siegel R, Ward E, Murray T, Xu J, Thun MJ. Cancer statistics, 2007. CA Cancer J Clin 2007;57:43-66. [ Links ]
119. Sakr WA, Grignon DJ. Prostate cancer: indicators of aggressiveness. Eur Urol 1997;32 Suppl 3:15-23.
120. Hayes DF, Bast RC, Desch CE, Fritsche H, Jr., Kemeny NE, Jessup JM, et al. Tumor marker utility grading system: a framework to evaluate clinical utility of tumor markers. J Natl Cancer Inst 1996;88:1456-1466.
121. National Institute for Health and Clinical Excellence (NICE). Prostate cancer: Diagnosis and treatment. http://www.nice.org.uk/guidance/index.jsp?action=byID&o=11924 (Accessed 24th May 2008).
122. Makinen T, Tammela TL, Hakama M, Stenman UH, Rannikko S, Aro J, et al. Tumor characteristics in a population-based prostate cancer screening trial with prostate-specific antigen. Clin Cancer Res 2003;9:2435-2439.
123. Draisma G, Boer R, Otto SJ, van der Cruijsen IW, Damhuis RA, Schroder FH, de Koning HJ. Lead times and overdetection due to prostate-specific antigen screening: estimates from the European Randomized Study of Screening for Prostate Cancer. J Natl Cancer Inst 2003;95:868-878.
124. Punglia RS, D'Amico AV, Catalona WJ, Roehl KA, Kuntz KM. Effect of verification bias on screening for prostate cancer by measurement of prostate-specific antigen. N Engl J Med 2003;349:335-342.
125. Stamey TA, Caldwell M, McNeal JE, Nolley R, Hemenez M, Downs J. The prostate specific antigen era in the United States is over for prostate cancer: what happened in the last 20 years? J Urol 2004;172:1297-1301.
126. Stenman UH, Hakama M, Knekt P, Aromaa A, Teppo L, Leinonen J. Serum concentrations of prostate specific antigen and its complex with alpha 1-antichymotrypsin before diagnosis of prostate cancer. Lancet 1994;344:1594-1598.
127. Gann PH, Hennekens CH, Stampfer MJ. A prospective evaluation of plasma prostate-specific antigen for detection of prostatic cancer. Jama 1995;273:289-294.
128. Thompson IM, Pauler DK, Goodman PJ, Tangen CM, Lucia MS, Parnes HL, et al. Prevalence of prostate cancer among men with a prostate-specific antigen level, or =4.0 ng per milliliter. N Engl J Med 2004;350:2239-2246.
129. Whittemore AS, Cirillo PM, Feldman D, Cohn BA. Prostate specific antigen levels in young adulthood predict prostate cancer risk: results from a cohort of Black and White Americans. J Urol 2005;174:872-876; discussion 876.
130. Lilja H, Ulmert D, Bjork T, Becker C, Serio AM, Nilsson JA, et al. Long-term prediction of prostate cancer up to 25 years before diagnosis of prostate cancer using prostate kallikreins measured at age 44 to 50 years. J Clin Oncol 2007;25:431-436.
131. Wirth MP, Frohmuller HG. Prostate-specific antigen and prostate acid phosphatase in the detection of early prostate cancer and the prediction of regional lymph node metastases. Eur Urol 1992;22:27-32.
132. Kontturi M. Is acid phosphatase (PAP) still justified in the management of prostatic cancer? Acta Oncol 1991;30:169-170.
133. Hugosson J, Aus G, Lilja H, Lodding P, Pihl CG. Results of a randomized, population-based study of biennial screening using serum prostate-specific antigen measurement to detect prostate carcinoma. Cancer 2004;100:1397-1405.
134. Oesterling JE, Jacobsen SJ, Klee GG, Pettersson K, Piironen T, Abrahamsson PA, et al. Free, complexed and total serum prostate specific antigen: the establishment of appropriate reference ranges for their concentrations and ratios. J Urol 1995;154:1090-1095.
135. Aus G, Damber JE, Khatami A, Lilja H, Stranne J, Hugosson J. Individualized screening interval for prostate cancer based on prostate-specific antigen level: results of a prospective, randomized, population-based study. Arch Intern Med 2005; 165:1857-1861.
136. Catalona WJ, Richie JP, Ahmann FR, Hudson MA, Scardino PT, Flanigan RC, et al. Comparison of digital rectal examination and serum prostate specific antigen in the early detection of prostate cancer: results of a multicenter clinical trial of 6,630 men. J Urol 1994;151:1283-1290.
137. Crawford ED, Leewansangtong S, Goktas S, Holthaus K, Baier M. Efficiency of prostate-specific antigen and digital rectal examination in screening, using 4.0 ng/ml and age-specific reference range as a cutoff for abnormal values. Prostate 1999; 38:296-302.
138. Smith RA, Cokkinides V, Eyre HJ. American Cancer Society Guidelines for the Early Detection of Cancer, 2005. CA Cancer J Clin 2005;55:31-44.
139. Graham J, Baker M, Macbeth F, Titshall V. Diagnosis and treatment of prostate cancer: summary of NICE guidance. Bmj 2008;336:610-612.
140. Wilt TJ. Commentary: controversies in NICE guidance on prostate cancer. Bmj 2008;336:612-614.
141. Myrtle JF, Klimley PG, Ivor IP, Bruni JF. Clinical utility of prostate specific antigen (PSA) in the management of prostate cancer. Adv Cancer Diagn, Hybritech Inc, Vol., 1986:1-5.
142. Catalona WJ, Smith DS, Ornstein DK. Prostate cancer detection in men with serum PSA concentrations of 2.6 to 4.0 ng/mL and benign prostate examination. Enhancement of specificity with free PSA measurements. JAMA 1997;277:1452-1455.
143. Lodding P, Aus G, Bergdahl S, Frosing R, Lilja H, Pihl CG, Hugosson J. Characteristics of screening detected prostate cancer in men 50 to 66 years old with 3 to 4 ng./ml. Prostate specific antigen. J Urol 1998;159:899-903.
144. Thompson IM, Ankerst DP, Chi C, Goodman PJ, Tangen CM, Lucia MS, et al. Assessing prostate cancer risk: results from the Prostate Cancer Prevention Trial. J Natl Cancer Inst 2006; 98:529-534.
145. Gann PH. Interpreting recent trends in prostate cancer incidence and mortality. Epidemiology 1997;8:117-120.
146. Oesterling JE, Jacobsen SJ, Chute CG, Guess HA, Girman CJ, Panser LA, Lieber MM. Serum prostate-specific antigen in a community-based population of healthy men. Establishment of age-specific reference ranges. JAMA 1993;270:860-864.
147. Catalona WJ, Smith DS. Comparison of different serum prostate specific antigen measures for early prostate cancer detection. Cancer1994;74:1516-1518.
148. Semjonow A AW, Bialk P, Gerl A, Lamerz R, Schmid HP, et al. Tumour markers in prostate cancer: EGTM recommendations. Anticancer Res 1999;19:2799-2801.
149. Partin AW, Brawer MK, Bartsch G, Horninger W, Taneja SS, Lepor H, et al. Complexed prostate specific antigen improves specificity for prostate cancer detection: results of a prospective multicenter clinical trial. J Urol 2003;170:1787-1791.
150. Pettersson K, Piironen T, Seppala M, Liukkonen L, Christensson A, Matikainen MT, et al. Free and complexed prostate-specific antigen (PSA): in vitro stability, epitope map, and development of immunofluorometric assays for specific and sensitive detection. Cancer 1987;60:1017-1021.
151. Babaian RJ, Fritsche HA, Evans RB. Prostate-specific antigen and prostate gland volume: correlation and clinical application. J Clin Lab Anal 1990;4:135-137.
152. Veneziano S, Pavlica P, Querze R, Nanni G, Lalanne MG,Vecchi F. Correlation between prostate-specific antigen and prostate volume, evaluated by transrectal ultrasonography: usefulness in diagnosis of prostate cancer. Eur Urol 1990;18:112-116.
153. Benson MC, Whang IS, Pantuck A, Ring K, Kaplan SA, Olsson CA, Cooner WH. Prostate specific antigen density: a means of distinguishing benign prostatic hypertrophy and prostate cancer. J Urol 1992;147:815-816.
154. Carter HB, Pearson JD, Metter EJ, Brant LJ, Chan DW, Andres R, et al. Longitudinal evaluation of prostate-specific antigen levels in men with and without prostate disease. JAMA 1992; 267:2215-2220.
155. Schmid HP, McNeal JE, Stamey TA. Observations on the doubling time of prostate cancer. The use of serial prostate-specific antigen in patients with untreated disease as a measure of increasing cancer volume. Cancer 1993;71:2031-2040.
156. Semjonow A, Schmid HP. The rise and fall of PSA: clinical implications of prostate specific antigen kinetics. Urol Res 2002;30:85-88.
157. Lilja H, Christensson A, Dahlen U, Matikainen MT, Nilsson O, Pettersson K, Lovgren T. Prostate-specific antigen in serum occurs predominantly in complex with alpha 1-antichymotrypsin. Clin Chem 1991;37:1618-1625.
158. Stenman UH, Leinonen J, Alfthan H, Rannikko S, Tuhkanen K, Alfthan O. A complex between prostate-specific antigen and alpha 1-antichymotrypsin is the major form of prostate-specific antigen in serum of patients with prostatic cancer: assay of the complex improves clinical sensitivity for cancer. Cancer Res 1991;51:222-226.
159. Catalona WJ, Partin AW, Finlay JA, Chan DW, Rittenhouse HG, Wolfert RL, Woodrum DL. Use of percentage of free prostatespecific antigen to identify men at high risk of prostate cancer when PSA levels are 2.51 to 4 ng/mL and digital rectal examination is not suspicious for prostate cancer: an alternative model. Urology 1999;54:220-224.
160. Catalona WJ, Partin AW, Slawin KM, Brawer MK, Flanigan RC, Patel A, et al. Use of the percentage of free prostate-specific antigen to enhance differentiation of prostate cancer from benign prostatic disease: a prospective multicenter clinical trial. JAMA 1998;279:1542-1547.
161. Raaijmakers R, Blijenberg BG, Finlay JA, Rittenhouse HG, Wildhagen MF, Roobol MJ, Schroder FH. Prostate cancer detection in the prostate specific antigen range of 2.0 to 3.9 ng/ml: value of percent free prostate specific antigen on tumor detection and tumor aggressiveness. J Urol 2004;171:2245-2249.
162. Stephan C, Lein M, Jung K, Schnorr D, Loening SA. The influence of prostate volume on the ratio of free to total prostate specific antigen in serum of patients with prostate carcinoma and benign prostate hyperplasia. Cancer 1997;79:104-109.
163. Roddam AW, Duffy MJ, Hamdy FC,Ward AM, Patnick J, Price CP, et al. Use of prostate-specific antigen (PSA) isoforms for the detection of prostate cancer in men with a PSA level of 2- 10 ng/ml: systematic review and meta-analysis. Eur Urol 2005;48:386-399; discussion 398-389.
164. Lee R, Localio AR, Armstrong K, Malkowicz SB, Schwartz JS. A meta-analysis of the performance characteristics of the free prostate-specific antigen test. Urology 2006;67:762-768. Tumor Markers.qxd 6/22/10 7:51 PM Page 65
165. Oberpenning F, Weining C, Brandt B, De AG, Heinecke A, Hamm M, et al. Combining free and total prostate specific antigen assays from different manufacturers: the pitfalls. Eur Urol 2002;42:577-582.
Lilja H, Haese A, Bjork T, Friedrich MG, Piironen T, Pettersson K, et al. Significance and metabolism of complexed and noncomplexed prostate specific antigen forms, and human glandular kallikrein 2 in clinically localized prostate cancer before and after radical prostatectomy. J Urol 1999;162:2029-2034.
167. Allard WJ, Zhou Z, Yeung KK. Novel immunoassay for the measurement of complexed prostate-specific antigen in serum. Clin Chem 1998;44:1216-1223.
168. Finne P, Zhang WM, Auvinen A, Leinonen J, Maattanen L, Rannikko S, et al. Use of the complex between prostate specific antigen and alpha 1-protease inhibitor for screening prostate cancer. J Urol 2000;164:1956-1960.
169. Lein M, Jung K, Hammerer P, Graefen M, Semjonow A, Stieber P, et al. A multicenter clinical trial on the use of alpha1-antichymotrypsin- prostate-specific antigen in prostate cancer diagnosis. Prostate 2001;47:77-84.
170. Lein M, Kwiatkowski M, Semjonow A, Luboldt HJ, Hammerer P, Stephan C, et al. A multicenter clinical trial on the use of complexed prostate specific antigen in low prostate specific antigen concentrations. J Urol 2003;170:1175-1179.
171. Okihara K, Fritsche HA, Ayala A, Johnston DA, Allard WJ, Babaian RJ. Can complexed prostate specific antigen and prostatic volume enhance prostate cancer detection in men with total prostate specific antigen between 2.5 and 4.0 ng./ml. J Urol 2001;165:1930-1936.
172. Keller T, Butz H, Lein M, Kwiatkowski M, Semjonow A, Luboldt HJ, et al. Discordance analysis characteristics as a new method to compare the diagnostic accuracy of tests: example of complexed versus total prostate-specific antigen. Clin Chem 2005;51:532-539.
173. Moul JW, Sesterhenn IA, Connelly RR, Douglas T, Srivastava S, Mostofi FK, McLeod DG. Prostate-specific antigen values at the time of prostate cancer diagnosis in African-American men. JAMA 1995;274:1277-1281.
174. NHS Cancer Screening Programmes: Prostate Cancer Risk Management. http://www.cancerscreening.nhs.uk/prostate/index.html (Accessed 20th October 2007.
175. Evans R, Edwards A, Brett J, Bradburn M, Watson E, Austoker J, Elwyn G. Reduction in uptake of PSA tests following decision aids: systematic review of current aids and their evaluations. Patient Educ Couns 2005;58:13-26.
176. Sturgeon C. Practice guidelines for tumor marker use in the clinic. Clin Chem 2002;48:1151-1159.
177. Zoorob R, Anderson R, Cefalu C, Sidani M. Cancer screening guidelines. Am Fam Physician 2001; 63:1101-1112.
178. Harris R, Lohr KN. Screening for prostate cancer: an update of the evidence for the U.S. Preventive Services Task Force. Ann Intern Med 2002;137:917-929.
179. Bangma CH, Roemeling S, Schroder FH. Overdiagnosis and overtreatment of early detected prostate cancer. World J Urol 2007;25:3-9.
180. Schroder FH, Denis LJ, Roobol M, Nelen V, Auvinen A, Tammela T, et al. The story of the European Randomized Study of Screening for Prostate Cancer. BJU Int 2003;92 Suppl 2:1-13.
181. de Koning HJ, Liem MK, Baan CA, Boer R, Schroder FH, Alexander FE. Prostate cancer mortality reduction by screening: power and time frame with complete enrollment in the European Randomised Screening for Prostate Cancer (ERSPC) trial. Int J Cancer 2002;98:268-273.
182. Andriole GL, Levin DL, Crawford ED, Gelmann EP, Pinsky PF, Chia D, et al. Prostate Cancer Screening in the Prostate, Lung, Colorectal and Ovarian (PLCO) Cancer Screening Trial: findings from the initial screening round of a randomized trial. J Natl Cancer Inst 2005;97:433-438.
183. Bartsch G, Horninger W, Klocker H, Reissigl A, Oberaigner W, Schonitzer D, et al. Prostate cancer mortality after introduction of prostate-specific antigen mass screening in the Federal State of Tyrol, Austria. Urology 2001;58:417-424.
184. Oberaigner W, Horninger W, Klocker H, Schonitzer D, Stuhlinger W, Bartsch G. Reduction of prostate cancer mortality in Tyrol, Austria, after introduction of prostate-specific antigen testing. Am J Epidemiol 2006;164:376-384.
185. Xia Z, Jacobsen SJ, Bergstralh EJ, Chute CG, Katusic SK, Lieber MM. Secular changes in radical prostatectomy utilization rates in Olmsted County, Minnesota 1980 to 1995. J Urol 1998;159:904-908.
186. Collin SM, Martin RM, Metcalfe C, Gunnell D, Albertsen PC, Neal D, et al. Prostate-cancer mortality in the USA and UK in 1975-2004: an ecological study. Lancet Oncol 2008;9:445-452.
187. Hugosson J, Aus G, Becker C, Carlsson S, Eriksson H, Lilja H, et al. Would prostate cancer detected by screening with prostatespecific antigen develop into clinical cancer if left undiagnosed? A comparison of two population-based studies in Sweden. BJU Int 2000;85:1078-1084.
188. Ilic D, D OC, Green S, T W. Screening for prostate cancer: A Cochrane systematic review. Cancer Causes Control 2006;3.
189. Hammerer P, Graefen M, Henke RP, Haese A, Palisaar J, Huland E, Huland H. Analysis of molecular isoforms of PSA and their ratios in men with PSA-relapse alter radical prostatectomy. Anticancer Res 2000;20:5253-5255.
190. Hsu CY, Joniau S, Oyen R, Roskams T, Van Poppel H. Outcome of surgery for clinical unilateral T3a prostate cancer: a singleinstitution experience. Eur Urol 2007;51:121-128; discussion 128-129.
191. Narayan P, Gajendran V, Taylor SP, Tewari A, Presti JC, Jr., Leidich R, et al. The role of transrectal ultrasound-guided biopsy-based staging, preoperative serum prostate-specific antigen, and biopsy Gleason score in prediction of final pathologic diagnosis in prostate cancer. Urology 1995;46:205-212.
192. Kattan MW, Stapleton AM,Wheeler TM, Scardino PT. Evaluation of a nomogram used to predict the pathologic stage of clinically localized prostate carcinoma. Cancer 1997;79:528-537.
193. Partin AW, Kattan MW, Subong EN, Walsh PC, Wojno KJ, Oesterling JE, et al. Combination of prostate-specific antigen, clinical stage, and Gleason score to predict pathological stage of localized prostate cancer. A multi-institutional update. JAMA 1997;277:1445-1451.
194. Ohori M, Kattan MW, Koh H, Maru N, Slawin KM, Shariat S, et al. Predicting the presence and side of extracapsular extension: a nomogram for staging prostate cancer. J Urol 2004; 171:1844-1849.
195. D'Amico AV, Chen MH, Roehl KA, Catalona WJ. Preoperative PSA velocity and the risk of death from prostate cancer after radical prostatectomy. N Engl J Med 2004;351:125-135.
196. D'Amico AV, Manola J, Loffredo M, Renshaw AA, DellaCroce A, Kantoff PW. 6-month androgen suppression plus radiation therapy vs radiation therapy alone for patients with clinically localized prostate cancer: a randomized controlled trial. Jama 2004;292:821-827.
197. Carter HB, Ferrucci L, Kettermann A, Landis P, Wright EJ, Epstein JI, et al. Detection of life-threatening prostate cancer with prostate-specific antigen velocity during a window of curability. J Natl Cancer Inst 2006;98:1521-1527.
198. Pontes JE, Jabalameli P, Montie J, Foemmel R, Howard PD, Boyett J. Prognostic implications of disappearance rate of biologic markers following radical prostatectomy. Urology 1990;36:415-419.
199. Semjonow A, Hamm M, Rathert P. Half-life of prostate-specific antigen after radical prostatectomy: the decisive predictor of curative treatment? Eur Urol 1992;21:200-205.
200. Amling CL, Bergstralh EJ, Blute ML, Slezak JM, Zincke H. Defining prostate specific antigen progression after radical prostatectomy: what is the most appropriate cut point? J Urol 2001;165:1146-1151.
201. Pound CR, Partin AW, Eisenberger MA, Chan DW, Pearson JD, Walsh PC. Natural history of progression after PSA elevation following radical prostatectomy. JAMA 1999;281:1591-1597.
202. Semjonow A, De Angelis G. "Ultrasensitive" prostate specific antigen (PSA) assays: How low do we want to go?" J Lab Med 2003;27:16-19.
203. Stephenson AJ, Scardino PT, Bianco FJ, Jr., Eastham JA. Salvage therapy for locally recurrent prostate cancer after external beam radiotherapy. Curr Treat Options Oncol 2004;5:357-365.
204. Coquard R, Bachaud J. Report of the 38th meeting of the American Society for Therapeutic Radiology and Oncology (ASTRO). Cancer Radiother 1997;1:88-93.
205. Kattan MW, Eastham JA, Stapleton AM, Wheeler TM, Scardino PT. A preoperative nomogram for disease recurrence following radical prostatectomy for prostate cancer. J Natl Cancer Inst 1998;90:766-771.
206. Kattan MW, Wheeler TM, Scardino PT. Postoperative nomogram for disease recurrence after radical prostatectomy for prostate cancer. J Clin Oncol 1999;17:1499-1507.
207. Price CP, Allard J, Davies G, Dawnay A, Duffy MJ, France M, et al. Pre-and post-analytical factors that may influence use of serum prostate specific antigen and its isoforms in a screening programme for prostate cancer. Ann Clin Biochem 2001; 38:188-216.
208. Oberpenning F, Schmid HP, Fuchs-Surdel W, Hertle L, Semjonow A. The impact of intraoperative manipulation of the prostate on total and free prostate-specific antigen. Int J Biol Markers 2002;17:154-160.
209. Bjork T, Ljungberg B, Piironen T, Abrahamsson PA, Pettersson K, Cockett AT, Lilja H. Rapid exponential elimination of free prostate-specific antigen contrasts the slow, capacity-limited elimination of PSA complexed to alpha 1-antichymotrypsin from serum. Urology 1998;51:57-62.
210. Piironen T, Pettersson K, Suonpaa M, Stenman UH, Oesterling JE, Lovgren T, Lilja H. In vitro stability of free prostate-specific antigen (PSA) and prostate-specific antigen (PSA) complexed to alpha 1-antichymotrypsin in blood samples. Urology 1996;48:81-87.
211. Woodrum D, French C, Shamel LB. Stability of free prostatespecific antigen in serum samples under a variety of sample collection and sample storage conditions. Urology 1996;48:33-39.
212. Sturgeon CM, Ellis AR. Improving the comparability of immunoassays for prostate-specific antigen (PSA): Progress and problems. Clin Chim Acta 2007;381:85-92.
213. Graves HC, Kamarei M, Stamey TA. Identity of prostate specific antigen and the semen protein P30 purified by a rapid chromatography technique. J Urol 1990;144:1510-1515.
214. Vessella RL, Noteboom J, Lange PH. Evaluation of the Abbott IMx automated immunoassay of prostate-specific antigen. Clin Chem 1992;38:2044-2054.
215. Stamey TA, Teplow DB, Graves HC. Identity of PSA purified from seminal fluid by different methods: comparison by amino acid analysis and assigned extinction coefficients. Prostate 1995;27:198-203.
216. Rafferty B, Rigsby P, Rose M, Stamey T, Gaines DR. Reference reagents for prostate-specific antigen (PSA): establishment of the first international standards for free PSA and PSA (90:10). Clin Chem 2000;46:1310-1317.
217. Chan DW, Sokoll LJ. WHO first international standards for prostate-specific antigen: the beginning of the end for assay discrepancies? Clin Chem 2000;46:1291-1292.
218. Roddam AW, Rimmer J, Nickerson C, Ward AM. Prostate-specific antigen: bias and molarity of commercial assays for PSA in use in England. Ann Clin Biochem 2006;43:35-48.
219. Kort SA, Martens F, Vanpoucke H, van Duijnhoven HL, Blankenstein MA. Comparison of 6 automated assays for total and free prostate-specific antigen with special reference to their reactivity toward the WHO 96/670 reference preparation. Clin Chem 2006;52:1568-1574.
220. Stephan C, Klaas M, Muller C, Schnorr D, Loening SA, Jung K. Interchangeability of measurements of total and free prostatespecific antigen in serum with 5 frequently used assay combinations: an update. Clin Chem 2006;52:59-64.
221. Singh R, Cahill D, Popert R, O'Brien TS. Repeating the measurement of prostate-specific antigen in symptomatic men can avoid unnecessary prostatic biopsy. BJU Int 2003;92:932-935.
222. Eastham JA, Riedel E, Scardino PT, Shike M, Fleisher M, Schatzkin A, et al. Variation of serum prostate-specific antigen levels: an evaluation of year-to-year fluctuations. JAMA 2003;289:2695-2700.
223. Soletormos G, Semjonow A, Sibley PE, Lamerz R, Petersen PH, Albrecht W, et al. Biological variation of total prostate-specific antigen: a survey of published estimates and consequences for clinical practice. Clin Chem 2005;51:1342-1351.
224. Bruun L, Becker C, Hugosson J, Lilja H, Christensson A. Assessment of intra-individual variation in prostate-specific antigen levels in a biennial randomized prostate cancer screening program in Sweden. Prostate 2005;65:216-221.
225. Bunting PS, DeBoer G, Choo R, Danjoux C, Klotz L, Fleshner N. Intraindividual variation of PSA, free PSA and complexed PSA in a cohort of patients with prostate cancer managed with watchful observation. Clin Biochem 2002;35:471-475.
226. Cristofanilli M, Budd GT, Ellis MJ, Stopeck A, Matera J, Miller MC, et al. Circulating tumor cells, disease progression, and survival in metastatic breast cancer. N Engl J Med 2004;351:781-791.
227. Allard WJ, Matera J, Miller MC, Repollet M, Connelly MC, Rao C, et al. Tumor cells circulate in the peripheral blood of all major carcinomas but not in healthy subjects or patients with nonmalignant diseases. Clin Cancer Res 2004;10:6897-6904.
228. Moreno JG, Miller MC, Gross S, Allard WJ, Gomella LG, Terstappen LW. Circulating tumor cells predict survival in patients with metastatic prostate cancer. Urology 2005; 65:713-718.
229. Rissanen M, Helo P, Vaananen RM,Wahlroos V, Lilja H, Nurmi M, et al. Novel homogenous time-resolved fluorometric RT-PCR assays for quantification of PSA and hK2 mRNAs in blood. Clin Biochem 2007;40:111-118.













