Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957
Acta bioquím. clín. latinoam. vol.47 no.4 La Plata dic. 2013
MICROBIOLOGÍA
Bactericidia de hipoclorito de sodio sobre Staphylococcus cohnii productor de biofilm en una fabrica*
Bactericidal activity of sodium hypochlorite against biofilm-producing Staphylococcus cohnii in a factory
Atividade bactericida de hipoclorito de sodio sobre Staphylococcus cohnii produtor de biofilme numa fabrica
Norma Dolores Porcel de Fernandez1, Raquel Urueña2, Maria Cristina Gaudioso de Allori3, Marta Elena Cecilia de Castillo3
1 Magister en Salud Ambiental.
2 Licenciada en Biotecnologia.
3 Dra. en Bioquimica.
* Catedra de Bacteriologia del Instituto de Microbiologia. Facultad de Bioquimica, Quimica y Farmacia. Universidad Nacional de Tucuman, Ayacucho 471, T4000INI, San Miguel de Tucuman, Argentina.
correspondencia BQCA. NORMA DOLORES PORCEL DE FERNANDEZ. Especialista en Salud Ambiental. Crisostomo Alvarez 4433. T4000CKK San Miguel de Tucuman, Argentina.
Resumen
En equipamientos industriales la persistencia de las bacterias se debe al desarrollo de biofilms. El hipoclorito de sodio (NaClO) es usado rutinariamente como desinfectante. El objetivo del trabajo fue determinar el efecto inhibitorio del NaClO sobre S. cohnii productoras y no productoras de biofilms aisladas de una fabrica de pastas a partir de maquinarias de un establecimiento de Tucuman, Argentina. Se estudio produccion de biofilm, concentracion inhibitoria minima (CIM), concentracion bactericida minima (CBM) y curva de tiempo de muerte con NaClO frente a S. cohnii productora y no productora de biofilm. Los resultados obtenidos demostraron que de los ocho cocos grampositivos aislados, cuatro correspondieron a S. cohnii. Los valores CIM y CBM para S. cohnii productoras y no productoras de biofilm resultaron entre 0,05 y 0,2 g/dL. Mediante la curva de muerte se determino efecto bactericida observando una disminucion de ≥4 log de ufc (1h) tratado con 0,2 y 0,4% de NaClO. La formacion de biofilm para la cepa no tratada fue de DO: 0,12 y para la cepa tratada DO: 0,07 a las 18 h. Aplicar desinfectantes con amplio espectro de accion es importante, debido a que la eliminacion de bacterias puede prevenir su diseminacion y evitar la formacion de biofilms.
Palabras clave: Staphylococcus cohnii; Biofilms; Hipoclorito de sodio; Actividad antimicrobiana.
Summary
Persistence of bacteria in industrial equipment is favoured by biofilm formation. Sodium hypochlorite (NaClO) is routinely used as a disinfectant. The objective of the current study was to determine the inhibitory effect of NaClO on biofilm-producing and non-biofilm-producing S. cohnii strains, isolated from equipment in a fresh pasta factory in Tucuman, Argentina. The following parameters were assayed: production of biofilm, minimum inhibitory concentration (MIC), minimum bactericidal concentration (MBC) and NaClO death curves for both biofilm-producing and non-biofilm-producing S. cohnii strains. Four of the eight isolated Gram-positive cocci corresponded to S. cohnii. MIC and MBC values for biofilm-producing and non-biofilm-producing S. cohnii strains were between 0.05 and 0.2 g/dL. A bactericidal effect of 0.2 and 0.4% NaClO for 1 h was established with the death curve, showing a decrease in cfu of ≥4 log units. Biofilm production after 18 h for untreated strains gave an OD of 0.12, whereas the OD of treated strains was 0.07. The use of broad spectrum disinfectants is important, because elimination of bacteria helps prevent their propagation and avoid the formation of biofilms.
Keywords: Staphylococcus cohnii; Biofilms; Sodium hypochlorite; Antimicrobial activity.
Resumo
A persistência da bactéria em equipamento industrial e resultado do desenvolvimento de biofilmes. O hipoclorito de sodio (NaOCl) e rotineiramente utilizado como desinfetante. O objetivo do trabalho foi determinar o efeito inibitorio do NaClO sobre S. cohnii produtoras e nao produtoras de biofilmes isoladas de uma fabrica de massas frescas a partir de maquinarias de um estabelecimento de Tucuman, Argentina. Foram estudados: producao de biofilme, concentracao inibitoria minima (CIM), concentracao bactericida minima (CBM) e curva de tempo de morte com NaClO perante S. cohnii produtora e naoprodutora de biofilme. Os resultados obtidos demonstraram que quatro dos oito cocos Gram-positivos isolados corresponderam a S. cohnii. Os valores CIM e CBM para S. cohnii produtoras e nao produtoras de biofilme foram entre 0,05 e 0,2 g/dL. Atraves da curva de morte foi determinado um efeito bactericida observando uma diminuicao de ≥ 4 log de ufc (1h) tratado com 0,2 e 0,4% de NaClO. A formacao de biofilme, apos 18 h, para a cepa nao tratada foi de DO: 0,12, ao passo que para a cepa tratada foi de 0,07. A utilizacao de desinfetantes de amplo espectro de acao e importante, visto que a eliminação de bacterias pode prevenir sua propagação e evitar a formacao de biofilmes.
Palavras-Chave: Staphylococcus cohnii; Biofilmes; Hipoclorito de sódio; Atividade antimicrobiana.
Introduccion
Las enfermedades transmitidas por alimentos (ETAs) han sido reconocidas como un importante problema de salud publica a nivel mundial. Causan impacto en la caida de la productividad afectando a grandes industrias, pequenos negocios familiares y hasta simples consumidores.
La contaminacion microbiologica de los alimentos con potenciales patogenos pueden producir ETAs. La mayoria son infecciones ocasionadas por distintas bacterias, virus y parasitos. El establecimiento de bacterias adheridas a los alimentos o a las superficies en contacto produce serios problemas de contaminacion y numerosas perdidas economicas por los productos que se desechan (1).
La sobrevida de los microorganismos en este ambiente es persistente debido a su habilidad a desarrollar biofilms en las superficies de los equipamientos industriales, los cuales son la mayor fuente de contaminacion de alimentos (2-7).
Tanto en medios naturales como industriales donde existen bacterias se puede encontrar biofilm. Esta biopelicula es una capa viscosa de polisacarido extracelular. Puede desarrollarse sobre superficies hidrofobas o hidrofilas, bioticas o abioticas, incluyendo vidrios, acero, plastico y goma, materiales generalmente usados en el procesamiento de alimentos. Las bacterias inmersas en el biofilm son generalmente mas resistentes al estres ambiental y a los productos microbicidas que las mismas en estado planctonico (8-11).
Los estafilococos coagulasa negativos (SCN) constituyen el mayor componente de la microflora normal de humanos y pueden ser transferidos a los alimentos, a superficies de contacto o al ambiente de procesamiento de los mismos, sitios donde pueden persistir si poseen la capacidad de producir biofilm. En estudios previos realizados en muestras de leche cruda, se determino la presencia de Staphylococcus aureus (S. aureus) y SCN, siendo el 50% productores de biofilm (12-14). La formacion de esta biopelicula es importante para la supervivencia y virulencia de estafilococos en los alimentos. Numerosos autores han demostrado que Staphylococcus cohnii (S. cohnii) incluido en su biofilm es mas resistente a los desinfectantes que sus celulas planctonicas, en materiales como vidrio, plastico, goma y metal usados en la industria alimentaria (15-17).
En la actualidad la produccion y transformacion de alimentos se lleva a cabo, mayoritariamente, en grandes fabricas, con procesos continuos de produccion, permitiendo un consumo cada vez mas amplio de la poblacion. La higiene resulta esencial para conseguir alimentos inocuos y de buena calidad.
La concepcion higienica de los equipos presenta una triple finalidad: a) limitar la contaminacion microbiana b) mejorar la limpieza, la desinfeccion y el enjuagado y finalmente c) favorecer la conservacion y el mantenimiento. La higiene pasa a ser considerada como una fase mas del proceso productivo, estableciendose metodos eficaces para que el producto final sea optimo. Es muy importante mantener las condiciones higienicosanitarias teniendo en cuenta ciertos principios desde el ingreso de la materia prima hasta el producto terminado cumpliendo con las BPM (Buenas Practicas de Manufactura) siguiendo las normativas Nacionales e Internacionales e implementando el "Analisis de Peligros y Puntos de Control Critico" (APPCC) (18)(19).
La limpieza y la desinfeccion de superficies de trabajo son procesos claves en materia de seguridad y no garantizan siempre buenos resultados, basicamente por la aparicion de fenomenos de resistencia y adaptacion, lo que permite la supervivencia de los microorganismos, motivo por el cual es necesario eliminar todos los microorganismos de las superficies en contacto antes de que establezcan un biofilm que les servira de reservorio. El uso de agentes biocidas a nivel industrial y domestico seria un factor que contribuye a la eliminacion de cepas contaminantes, siendo herramientas utiles en la eliminacion y control de microorganismos patogenos con y sin resistencia bacteriana (10)(12)(20)(21).
En la industria alimentaria para desinfectar el equipamiento y maquinaria en contacto con los alimentos se utiliza el hipoclorito de sodio, de calcio o de litio. El hipoclorito de sodio (NaClO) es un desinfectante de nivel intermedio, contiene cloro en estado de oxidacion y por lo tanto es un oxidante fuerte, ademas de economico. Es generalmente considerado un oxidante no selectivo altamente destructivo, que reacciona con una gran variedad de compuestos subcelulares y afecta los procesos metabolicos. Actua sobre las membranas celulares, cambiando su permeabilidad, inhibe el transporte de sustancias, fragmenta las proteinas y reacciona con los nucleotidos (22)(23).
La resistencia de los microorganismos a los desinfectantes esta ligada a mecanismos intrinsecos, en respuesta a la asociacion de estos con la superficie a la que se adhieren favoreciendo la generacion de biofilm, cuya presencia, a su vez, esta ligada a deficiencias en los procedimientos de limpieza. La asociacion microorganismobiofilm genera: reduccion del acceso del desinfectante a las bacterias; interaccion quimica entre el desinfectante y la biopelicula; modulacion del microambiente; produccion de enzimas de degradacion y cambios geneticos entre celulas incluidas en la biopelicula (10)(20)(21)(24). Por lo anteriormente expuesto, el objetivo del presente trabajo fue determinar el efecto inhibitorio del hipoclorito de sodio sobre el crecimiento y la produccion de biofilm en cepas de S. cohnii aisladas de una fabrica de pastas.
Materiales y Metodos
Toma de muestra
El muestreo se realizo en una fabrica de pastas frescas de la Provincia de Tucuman, durante 3 dias consecutivos a primeras horas de la manana, antes comenzar el proceso de elaboracion.
Se tomaron dos muestras de cada una de las siguientes maquinarias: mezcladora, maquina de ravioles y cortadora de fideos, tambien de estante interno de la heladera, mesada, palo de amasar y masa recien preparada.
La toma de muestra se realizo con hisopos esteriles individuales cubriendo una superficie de 10 cm2. Cada hisopo se coloco en 1 mL de caldo BHI (infusion cerebro corazon) y se trasladaron al laboratorio procesandolos en el transcurso de 1 hora. Para el aislamiento cada muestra se sembro por duplicado en placas de Cisteina Lactosa Electrolito Deficiente (CLED), Agar Sangre y Manitol Salt Agar. Se incubaron las placas 24 h a 37 °C, se estudiaron macro y microscopicamente las colonias desarrolladas y se identificaron los cocos gram positivos siguiendo el esquema propuesto por la American Society of Microbiology (ASM) y Koneman et al. Para identificar los cocos gram positivos aislados se utilizo la metodologia de Kloos y Schleifer que ayuda a identificar a la mayor parte de SCN, basandose en una clave dicotomica simplificada con las siguientes pruebas: resistencia a novobiocina, hidrolisis de urea, fermentacion de sacarosa, xilosa, maltosa, trehalosa, manitol, celobiosa, rafinosa, fosfatasa y reduccion de nitrato, utilizacion de arginina. Se incluyeron controles positivos y negativos para cada prueba (25)(26).
Produccion de biofilm
En las ocho cepas de Staphylococcus sp. aisladas e identificadas se determino la produccion de biofilm siguiendo la tecnica en policubeta de O'Toole (27).
Se utilizo una policubeta de poliestireno, fondo plano para cultivo celular, esterilizada por radiacion. Para iniciar los ensayos las cepas se sembraron en caldo BHI e incubaron 18 h a 37 oC.
Para este estudio se preparo un inoculo estandarizado en caldo BHI con una DO de 0,01 a 540 nm (5 x 108 ufc/mL); el mismo se conservo a 4 oC asegurando el estado de quiescencia hasta iniciar el estudio de produccion de biofilm (no mas de una hora). En los pocillos de una policubeta de policarbonato se depositaron 100 µL por cuadriplicado de las suspensiones bacterianas, se incubo a 37 °C durante 18 h. Se elimino el medio por inversion, se lavo dos veces con buffer PBS (Na2HPO4 8,1 mM, KH2PO4, 1,5 mM, NaCl 140 mM, pH 7,2), se vacio el contenido y se dejo secar invertido sobre papel absorbente. Una vez seco, cuando el biofilm se observo como una membrana blanquecina y opaca, se fijo con metanol 7 min, se vacio por inversion y se dejo secar al aire, se coloreo con solucion acuosa de safranina 0,1%; al cabo de 4 min se invirtio la placa, se lavo con agua y luego se dejo secar (28). Se realizo la lectura mediante un lector de Microplaca versa Mac Microplate Rider a 490 nm. Se analizaron los promedios de las lecturas obtenidos para cada cepa y se comparo respecto al blanco para definir la produccion de biofilm. Se utilizo caldo BHI como blanco de lectura y el valor de corte entre negativos y positivos se establecio calculando 3 desvios estandar respecto al control negativo (29). Como control se utilizaron 2 cepas productoras de biofilm (263 y 1174) aisladas de mastitis bovinas cedidas por la Facultad de Veterinaria de la Universidad de Buenos Aires y una no productora (ATCC 918). Los criterios de clasificacion propuestos por Stepanovic et al. para determinar en las bacterias la produccion de biofilm (30) se muestran en la Tabla I.
Tabla I. Criterios de clasificacion propuesto por Stepanovic et al. para determinar en las bacterias la produccion de biofilm.

DOc (Densidad optica de corte): se define como 3 veces el valor de la desviacion estandar del control negativo, por encima de la media del control negativo a DO570.
Determinacion de la concentracion inhibitoria minima (CIM) en medio liquido de hipoclorito de sodio (NaClO) frente a dos cepas de S. cohnii, productor y no productor de biofilm en estado planctonico
Se utilizo hipoclorito de sodio (comercial 55 g Cl/L). A partir de esta solucion se preparo una solucion madre de 5 g/dL e inmediatamente se adicionaron a caldo MH (Mueller Hinton) obteniendose concentraciones finales de 0,05; 0,1; 0,2; 0,5; 1,0; 2,0; 3,0 y 4,0 g/dL.
Preparacion del inoculo
El inoculo preparado se comparo con la escala de Mc Farland N° 0,5, se diluyo 1/10 y se sembro para obtener una concentracion final de 105 ufc/mL. La inoculacion de la suspension estandarizada se realizo dentro de los 15 min para evitar variaciones en la concentracion bacteriana. Se incubaron 24 h a 37 °C. Se interpreto la CIM como la menor dilucion del desinfectante que inhibio el desarrollo a simple vista (31).
Determinacion de la concentracion bactericida minima (CBM) de NaClO sobre S. cohnii productor y no productor de biofilm en estado planctonico
De las diferentes diluciones ensayadas para la CIM en las que no se observo crecimiento por el Metodo de Dilucion en Caldo (Macrodilucion), se sembraron 100 µL en placas con agar MH y se disemino. Se incubo 24 h a 35-37 oC y se interpreto como CBM a la minima concentracion de hipoclorito que produjo la muerte de la mayoria (≥ 99,9%) de los organismos viables.
Determinacion de la actividad inhibitoria: bacteriostatica, bactericida o bacteriolitica por curva de tiempo de muerte para S. cohnii productor de biofilm
Para determinar la actividad bacteriostatica o bactericida se estudio el efecto del NaClO sobre el crecimiento bacteriano. Simultaneamente se realizo una curva de crecimiento sin el agregado del NaClO. Se trabajo con concentracion final de inoculo de 5 x 105 ufc/mL de acuerdo a las normas establecidas por CLSI, para ello se procedio de la siguiente manera: En 5 mL de MH caldo se coloco una cantidad suficiente de NaClO para obtener concentracion final de 0,2 y 0,4%, se inoculo con una suspension bacteriana para obtener la concentracion final de 5 x 105 ufc/mL (31). Los recuentos bacterianos se efectuaron aplicando la metodologia de Clark et al. en diferentes tiempos de incubacion: tiempo inicial (T0) y a las 2, 4, 12 y 18 h (32). En cada uno de los tiempos estipulados se efectuaron diluciones para realizar los recuentos bacterianos. Se interpreta que hay efecto bactericida cuando se disminuye ≥3 log10 ufc/mL entre 4 y 8 h respecto a la curva de crecimiento sin el agregado de NaClO.
Accion inhibitoria del NaClO en concentracion sub- CIM sobre el crecimiento bacteriano y la produccion del biofilm en una cepa seleccionada altamente productora del mismo
A 5 mL de MH caldo adicionado con NaClO en cantidad suficiente para obtener una concentracion final de 0,05% (Sub-CIM), se inoculo con una suspension S. cohnii productor de biofilm en una concentracion final de 5 x 108 ufc/mL; simultaneamente se trabajo con un control sin el agregado del NaClO. Se incubo realizandose recuento bacteriano y deteccion de biofilm a los tiempos 0, 2, 4, 12 y 18 h. Para evaluar el crecimiento bacteriano, se aspiro con micropipeta el contenido de la policubeta realizandose el recuento bacteriano por el metodo de las diluciones para determinar el numero de bacterias. Para evaluar la produccion de biofilm, luego de aspiradas las muestras se lavo con buffer fosfato 0,02 M, se fijo con metanol y se coloreo con safranina para luego realizar las lecturas mediante un lector de Microplaca versa Mac Microplate Rider a 490 nm. Se analizaron los promedios de las lecturas obtenidos para cada cepa y se comparo respecto al blanco para definir la produccion de biofilm. Se utilizo caldo BHI como blanco de lectura. Todos los cultivos para este estudio fueron estandarizados inoculando al 5% en caldo BHI con una DO inicial de aproximadamente 0,01. Esta dilucion se conservo a 4 oC asegurando el estado de quiescencia hasta iniciar el estudio de produccion de biofilm (no mas de una hora).
Resultados
Aislamiento e identificacion
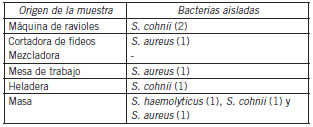
De los siete sitios de muestreo se aislaron 57 cepas, de los cuales solo ocho fueron cocos gram positivos identificandose como S. cohnii (4), S. aureus (3) y S. haemolyticus (1) (Fig. 1). Las especies identificadas de los diferentes sitios de muestreo se muestran en la Tabla II.

Figura 1. Numero de cocos grampositivos aislados de las muestras extraidas de la fabrica de pastas.
Tabla II. Cepas aisladas segun sitios de muestreo.
Deteccion de biofilm
Los S. aureus y el S. haemolyticus aislados fueron debilmente productores de biofilm por presentar ≤ 2 x DO segun la clasificacion de Stepanovic (30). De las cuatro S. cohnii ensayadas, tres resultaron fuertemente productoras de biofilm y la cepa aislada de la heladera se comporto como no productora.
Concentracion inhibitoria y bactericida minima de hipoclorito de sodio frente a S. cohnii productor y no de biofilm
En la Tabla III se muestran los resultados de CIM y CBM: En las cepas analizadas el hipoclorito presenta la misma CBM tanto en las cepas productoras y no productoras de biofilm en su estado plantonico.
Tabla III. CIM y CBM de cepas productoras y no productoras de biofilm.

Determinacion del tiempo de muerte de S. cohnii productor de biofilm tratado con hipoclorito de sodio.
Cinetica de la inhibicion de crecimiento Mediante la curva de muerte se observa una disminucion ≥4 log de ufc de S. cohnii al tratarlo con concentraciones de 0,2 y 0,4% de NaClO respectivamente, lo que indica que el NaClO en las dos concentraciones ensayadas (0,2 y 0,4%) tiene efecto bactericida (Fig. 2). Al evaluar el crecimiento bacteriano en presencia de NaClO al 0,05% se observo una injuria en la primera hora de contacto bajando 5 log ufc con respecto a la cepa sin tratamiento con desinfectante. A las 18 h alcanzo una poblacion semejante a la obtenida con la cepa control sin tratamiento con NaClO.

Figura 2. Cinetica de inhibicion de S. cohnii con concentraciones de 0,4, 0,2 y 0,05% de NaClO.
Cinetica de la inhibicion del crecimiento y de la inhibicion de la produccion de biofilm de S. cohnii tratado con hipoclorito de sodio
Al evaluar la produccion de biofilm se observa que la cepa no tratada con hipoclorito de sodio produce biofilm alcanzando una DO de 0.09 a partir de la primera hora de crecimiento progresando hasta las 18 h a una DO de 0,12. Cuando a la misma cepa se trata con NaClO en concentraciones sub-CIM se observa en la primera hora una leve produccion de biofilm obteniendose valores de DO: 0,02, alcanzando a las 18 h una DO: 0,07. Si bien la cepa tratada produce biofilm se observa una diferencia entre la tratada y la no tratada correspondiente a una DO: 0,05 de la formacion del mismo a las 18 h (Fig 3).

Figura 3. Cinetica de inhibicion de la produccion de biofilm de S. cohnii tratado con NaClO al 0,05%.
Discusion y Conclusiones
Durante las ultimas tres decadas se ha documentado el incremento de infecciones por SCN asociados a productos alimenticios, que pueden ser transferidos al alimento o a las superficies que estan en contacto con los mismos a traves de las manos de los manipuladores y que estos microorganismos poseen un importante factor de virulencia que es la formacion de biofilms (13).
En un estudio realizado en cepas aisladas de leche cruda por Citak et al. la produccion de biofilm fue positiva en 5,1% de S. aureus y 42,2% de SCN aislados. En el presente estudio de las 57 cepas aisladas tres fueron identificadas como S. aureus y cinco como SCN: cuatro S. cohnii y un S. haemolyticus siendo tres de ellas productores de biofilms (14).
Vasudevan et al. en un estudio realizado en mastitis bovina encontraron que el 50% de S. cohnii aislados fueron productores de biofilm y el 100% de los S. haemolitycus aislados en su estudio fueron no productores de biofilm. En el presente trabajo tres (3) de los cuatro (4) S. cohnii aislados en una fabrica de pastas fueron productores de biofilm, no asi el unico S. haemolitycus aislado (33).
Anderson et al. comprobaron que los compuestos clorados fueron bactericidas para E. coli O157 y Salmonella typhimurium, observando que el efecto bactericida del producto ensayado fue pH y concentracion dependiente (<1,25 mM) (34).
Ramesh y Holah evaluaron la capacidad de destruir Salmonella en superficies contaminadas y en celulas bacterianas en suspension y determinaron que el NaClO produce la reduccion del 100% de las Salmonellas. Asimismo, determinaron que los desinfectantes mas efectivos contra las celulas bacterianas en suspension pueden no ser efectivos cuando se tratan con este producto las celulas incluidas en el biofilm (12)(35).
En el presente ensayo, frente a S. cohnii se determino que el NaClO producia un 100% de muerte bacteriana y una disminucion en la DO de 0,05 en la formacion de biofilm a las 18 h. No se estudio el efecto de este producto sobre el biofilm formado.
El NaClO en concentracion de 0,2% presento accion bactericida frente a S. cohnii y al tratarlo en concentracion sub CIM (0,05) de NaClO a las 18 h alcanzo igual crecimiento que la cepa control, observandose una reduccion significativa en la produccion de biofilm con una disminucion de la DO de 0,06 entre la cepa control y la cepa tratada.
El empleo de este desinfectante, con un amplio espectro de accion es de gran importancia, determinandose que su uso puede eliminar estas bacterias, evitar su diseminacion y prevenir la formacion del biofilm.
En base a los resultados obtenidos en esta investigacion, se concluyo que es necesario implementar correctamente las Buenas Practicas de Manufactura siguiendo las normativas de la legislacion vigente asegurando productos inocuos para la salud del consumidor.
1. Gonzalez Flores T, Rojas Herrera RA. Enfermedades Emergentes: Enfermedades transmitidas por alimentos y PCR: prevencion y diagnostico. Salud Publica Mex 2005; 47: 388-90. [ Links ]
2. Donlan RM. Biofilms: Microbial life on surfaces. Emerg Infect Dis 2002; 9: 881-90. [ Links ]
3. Branda SS, Vik S, Friedman L, Kolter R. Biofilms: the matrix revisited. Trends Microbiol 2005; 13: 20-6. [ Links ]
4. Salgar R. Biopeliculas o biofilms en la industria alimentaria. Mundo Alimentario 2004; 30-1. [ Links ]
5. Vanegas M, Correa CN, Morales MA, Martinez A, Rugeles GL, Jimenez F. Resistencia a antibioticos de bacterias aisladas de biopeliculas en una planta de alimentos. Rev MVZ Cordoba 2009; 14 (2): 1677- 83. [ Links ]
6. Giaouris ED, Nychas GJ. The adherence of Salmonella enteritidis PT4 to stainless steel: the importance of the air-liquid interface and nutrient availability. Food Microbiol 2006; 23(8): 747-52. [ Links ]
7. Hood SK, Zottola EA. Adherence to stainless steel by foodborne microorganisms during growth in model systems. J Food Microbiol 1997; 37: 145-53. [ Links ]
8. Costerton JW, Stewart PS, Greenberg EP. Bacterial biofilms: A common cause of persistent infections. Science 1999; 284: 1318-22. [ Links ]
9. Chae MS, Schraft H. Comparative evaluation of adhesion and biofilm formation of different Listeria monocytogenes strains. Int J Food Microbiol 2000; 62 (1): 103-11. [ Links ]
10. Mah TF, O'Toole GA. Mechanisms of biofilm resistance to antimicrobial agents. TIMS 2001; 9: 34-9. [ Links ]
11. Stewart P, Costerton JW. Review antibiotic resistance of bacteria in biofilms. The Lancet 2001; (358)14: 135-8. [ Links ]
12. Holah JT, Kearney LR. Introduction to biofilms in the food industry. In: Biofilms: Science and Technology 1992; 223: 35-41. [ Links ]
13. Moretro T, Hermansen L, Holck AL, Sidhu MS, Rudi K, Langsrud S. Biofilm formation and the presence of the intercellular adhesion locus ica among Staphylococci from Food and Food Processing Environments. Appl Environ Microbiol 2003; 69(9): 5648-55. [ Links ]
14. Citak S, Varlik O, Gundogan N. Slime production and DNAse activity of Staphylococci isolated from raw milk. J Food Safety 2003; 23: 281-8. [ Links ]
15. Mettler E, Carpentier B. Variations over time of microbial load and physicochemical properties of floor materials after cleaning in food industry premises. J Food Prod 1998; 61(1): 57-65. [ Links ]
16. Ronner AB, Wong ACL. Biofilm development and sanitizer inactivation of Listeria monocytogenes and Salmonella Typhimurium on stainless steel and buna-N rubber. J Food Prot 1993; 56(9): 750-8. [ Links ]
17. Stewart PS. Theoretical aspects of antibiotic diffusion into microbial biofilms. Antimicrob Agents Chemother 1996; 40 (11): 2517-22. [ Links ]
18. Puig-Duran FJ. Autocontrol y auditoria de la higiene en la industria alimentaria. Madrid: Ed. Mundi-Prensa; 2006. [ Links ]
19. Casp Vanaclocha A. Diseño de Industrias Agroalimentarias, Madrid: Ed. Mundi-Prensa; 2005. [ Links ]
20. Aase B, Sundheim G, Langsrud S, Rorvik LM. Occurrence of and a possible mechanism for resistance to a quaternary ammonium compound in Listeria monocytogenes. Int J Food Microbiology 2000; 62: 57-63. [ Links ]
21. Fraise AP. Biocide abuse and antimicrobial resistance - a cause for concern? J Antimicrobial Chemother 2002; 49: 11-2. [ Links ]
22. Russell AD. Introduction of biocides into clinical practice and the practice and the impact on antibiotic resistant bacteria. J Appl Microbiol 2002; 92: 121s-35s. [ Links ]
23. Murtough S, Hiom SJ, Palmer M, Russell AD. A survey of disinfectant use in hospital pharmacy aseptic preparation areas. Pharmacy J 2000; 264: 446-8. [ Links ]
24. Chmielewski RAN, Frank JF. Biofilm formation and control in food processing facilities. Comp Rev Food Sci Food Safety 2003; 2: 22-32. [ Links ]
25. Koneman A, Dowell V, Sommers H. Diagnostico Microbiologico 3a Ed. Buenos Aires: Panamericana; 1997. [ Links ]
26. Kloos WE, Schleifer KH. Genus IV. Staphylococcus. In: Sneath PHA, Mair NS, Sharpe ME, Holt JG, eds. Bergey's manual of systematic bacteriology. Baltimore: Williams and Wilkins; 1986; 1013-35. [ Links ]
27. O'Toole G, Kaplan HB, Kolter R. Biofilm formation as microbial development. Annu Rev Microbiol 2000; 54: 49-79. [ Links ]
28. Christensen GD, Simpson WA, Younger JJ, Baddour LM, Barrett FF, Melton DM, et al. Adherence of coagulasenegative Staphylococci to plastic tissue culture plates: a quantitative model for the adherence of staphylococci to medical devices. J Clinical Microbiol 1985; 956- 1006. [ Links ]
29. Pfaller M, Davenport D, Bale M, Barrett M, Koontz F, Massanari RM. Development of the quantitative microtest for slime production by coagulase-negative staphylococci. Eur J Clin Microbial Infect Dis 1988; 7(1): 30-3. [ Links ]
30. Stepanovic S, Vukovic D, Dakic I, Savic B, Svabic-Vlahovic M. A modified microtiter-plate test for quantification of staphylococcal biofilm formation. J Microbiol Methods 2000; 40: 175-9. [ Links ]
31. NCCLS - Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria that Grow Aerobically; Approved Standard. Seventh Edition. NCCLS Document M7 - A7. Wayne, Pennsylvania: NCCLS 2006. [ Links ]
32. Clark WS, AR Brazis, JL Fowler, CK Johns, FE Nelson. Standard plate count methods. In: Marth M, Standard Methods for the examination of Dairy Produc-7ts. 4th edition. Washington: American Public Health Association 1978. p. 77-94. [ Links ]
33. Vasudevan P, Nair MM, Annamalai T, Venkitanarayanan KS. Phenotypic and genotypic characterization of bovine mastitis isolates of Staphylococcus aureus for biofilm. Vet Microbiol 2003; 92: 179-85. [ Links ]
34. Anderson RC, Harvey RB, Byrd JA, Callaway TR, Genovese KJ, Edrington TS, et al. Novel Preharvest Strategies Involving the Use of Experimental chlorate Preparations and Nitro-based compounds to prevent Colonization of Food-Producing Animals by Foodborne Pathogens. Poultry Science 2005; 84: 649-54. [ Links ]
35. Ramesh N, Joseph SW, Carr LE, Douglass LW, Wheaton FW. Evaluation of chemical disinfectants for the elimination of Salmonella biofilms from poultry transport containers. Poultry Science 2002; 81: 904-10. [ Links ]
Aceptado para su publicación el 24 de julio de 2013














