Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957
Acta bioquím. clín. latinoam. vol.47 no.4 La Plata dic. 2013
TOXICOLOGÍA
Acumulación de acetaldehído y estrés oxidativo en testículo luego de la intoxicación alcohólica en ratas
High levels of acetaldehyde and oxidative stress in rat testes after alcohol drinking
Acúmulo de acetaldeído e estresse oxidativo em testículo de ratos após intoxicação alcoólica
Leandro Néstor Quintans1a,b, María Eugenia Maciel1a,b, José Alberto Castro2 a,b, Gerardo Daniel Castro2 a,b
1 Doctor en Ciencia y Tecnología Mención Química.
2 Doctor en Ciencias Químicas
a Centro de Investigaciones Toxicológicas (CEITOX- UNIDEF, MINDEF-CONICET). Juan B. de La Salle 4397, B1603ALO Villa Martelli, Argentina
b Instituto de Investigación e Ingeniería Ambiental, Universidad Nacional de San Martín. 25 de Mayo y Francia, 1650 San Martín, Argentina.
CORRESPONDENCIA DR. GERARDO D. CASTRO Centro de Investigaciones Toxicológicas CEITOX-UNIDEF, MINDEF-CONICET Juan B. de La Salle 4397 B1603ALO VILLA MARTELLI, provincia de Buenos Aires E-mail: gcastro@citedef.gob.ar Tel: 54-11-4709-8100 ext 1139; Fax: 54-11-4709-5911
Resumen
En el hombre el consumo excesivo de alcohol está asociado con una disminución en la producción de testosterona y la atrofia testicular. Pudieron observarse consecuencias similares en estudios realizados in vitro en testículos aislados y la producción de testosterona, donde el acetaldehído mostró ser más potente que el alcohol para la supresión de la liberación de la hormona. Estudios previos de este laboratorio reportaron que la fracción microsomal del testículo de rata era capaz de metabolizar el etanol a metabolitos reactivos como el acetaldehído y los radicales libres 1-hidroxietilo. En este trabajo se presenta evidencia de que luego de una dosis única de etanol, el acetaldehído se acumula en el testículo durante las primeras seis horas posteriores al tratamiento para alcanzar concentraciones superiores a las plasmáticas aunque más bajas que en el hígado. Además se encontró que la actividad aldehído deshidrogenasa presente en el testículo es significativamente menor que en el hígado. El consumo de etanol en los animales produjo una susceptibilidad aumentada a la oxidación de los lípidos testiculares, que fue detectada por niveles aumentados de hidroperóxidos de lípidos. Los resultados sugieren que la oxidación in situ del etanol a acetaldehído y a radicales libres y la detoxificación deficiente podrían ser relevantes para explicar los efectos observados.
Palabras clave: Consumo de alcohol; Toxicidad reproductiva; Testículo; Estrés oxidativo; Acetaldehído.
Summary
Excessive alcohol consumption is associated with impaired testosterone production and testicular atrophy. Similar findings were observed in in vitro studies on testosterone production by isolated testes, being acetaldehyde more potent than alcohol in suppressing testosterone release. In previous laboratory studies, it was reported that rat testicular microsomes were able to bioactivate ethanol to reactive metabolites like acetaldehyde and 1-hydroxyethyl free radical. In this work, evidence is shown that after a single ethanol dose, acetaldehyde accumulates in testicular tissue during the first six hours post-treatment to reach concentrations higher than those in blood but lower than those in the liver. In agreement with those findings, it was reported that aldehyde dehydrogenase activity in cytosolic, mitochondrial and microsomal fractions is significantly smaller than in the corresponding liver counterparts. Ethanol drinking led to increased susceptibility of testicular lipids to oxidation as detected by increased levels of microsomal lipid hydroperoxides. Results suggest that in situ oxidation of ethanol to acetaldehyde and free radicals and their poor detoxification would be relevant to the effects observed.
Keywords: Alcohol drinking; Reproductive toxicity; Testis; Oxidative stress; Acetaldehyde.
Resumo
No homem, o consumo excessivo de álcool está associado a uma diminuição da produção de testosterona e atrofia testicular. Efeitos semelhantes foram observados em estudos realizados in vitro em testículos isolados e na produção de testosterona, em que o acetaldeído se mostrou mais potente do que o álcool para a supressão da liberação do hormônio. Estudos anteriores deste laboratório referiram que a fração microssomal do testículo de camundongo era capaz de metabolizar etanol para metabolitos reativos como o acetaldeído e os radicais livres 1-hidroxietil. Este trabalho apresenta evidência de que após uma dose única de etanol o acetaldeído se acumula no testículo durante as primeiras seis horas após o tratamento para atingir concentrações superiores às plasmáticas embora mais baixas que no fígado. Constatou-se também que a atividade aldeído desidrogenase presente no testículo é significativamente menor do que no fígado. O consumo de etanol nos animais produziu uma susceptibilidade aumentada à oxidação dos lipídeos testiculares, que foi detectada por níveis aumentados de hidroperóxidos de lipídeos. Os resultados sugerem que a oxidação in situ de etanol a acetaldeído e a radicais livres e a desintoxicação deficiente poderiam ser relevantes para explicar os efeitos observados.
Palavras-chave: Álcool; Toxicidade reprodutiva; Testículo; Estresse oxidativo; Acetaldeído.
Introducción
Un número importante de estudios epidemiológicos han puesto en evidencia que el consumo excesivo de alcohol está asociado con una disminución en la producción de testosterona y con la atrofia testicular (1-3).
Otros estudios, realizados con testículos de rata perfundidos demostraron que el etanol actúa solo en parte de un modo directo sobre el testículo, afectando la producción de hormona (4)(5). Posteriormente, se planteó como hipótesis que los efectos del etanol sobre la producción de testosterona estaban relacionados con la transformación metabólica a acetaldehído, puesto que este compuesto fue mucho más potente en su acción inhibidora, en el mismo sistema in vitro con preparados de testículo aislado (4)(6). Esta hipótesis sugirió claramente la necesidad de entender acerca de los procesos enzimáticos responsables del metabolismo del etanol a acetaldehído en las diferentes fracciones celulares, particularmente en la microsomal, ya que muy poca información hay disponible en la literatura (7)(8). Estudios previos de este laboratorio reportaron que los preparados microsomales de testículo de rata tenían la capacidad para oxidar el etanol a metabolitos reactivos como acetaldehído y radicales libres 1-hidroxietilo (9). En estos estudios se postuló la participación de varias enzimas microsomales tales como el CYP2E1, la P450 reductasa y otras enzimas con un comportamiento similar al de algunas peroxidasas o lipoxigenasas.
En este trabajo se presenta evidencia de que el acetaldehído puede acumularse transitoriamente en el testículo luego de la ingesta de alcohol como producto de la oxidación del etanol in situ y que esto está vinculado con una condición de estrés oxidativo, hecho reportado previamente por este y otros laboratorios.
Materiales y Métodos
Reactivos
El etanol (grado analítico) fue adquirido a Sintorgan. El acetaldehído se obtuvo de Fluka (Buchs, Suiza). Todos los demás productos químicos y solventes que se utilizaron en los experimentos fueron de la mayor calidad disponible y se obtuvieron de Sigma Co. (St. Louis, EE.UU.) y de Merck AG (Darmstadt, Alemania). Los reactivos para la determinación de las actividades glutatión S-transferasa y glutatión reductasa fueron de Sigma Co. (St. Louis, EE.UU.).
Animales y tratamientos
Se utilizaron ratas macho de la cepa Sprague-Dawley. Los procedimientos utilizados en el bioterio para la crianza, alojamiento, y manipulación de los animales fueron los establecidos por las guías de la Administración Nacional de Medicamentos, Alimentos y Tecnología Médica (ANMAT). La colonia original se obtuvo de Charles River (Wilmington, EE.UU.). Los animales se mantuvieron en una habitación con temperatura y humedad relativa controladas (23 ± 2 ºC, 35-65%) con ciclos de luz-oscuridad de doce horas (fase de luz: 6 a 18).
Para la administración de una dosis única de etanol, se utilizó la vía oral en agua (5 mL 200 g-1) en una dosis de 3,8 g kg-1. En el grupo control las calorías provistas por el alcohol fueron reemplazadas por sacarosa. El alimento balanceado se retiró 14 horas antes del tratamiento, pero los animales tuvieron acceso libre al agua de bebida. Se utilizaron seis animales por grupo (peso corporal: 250-270 g, edad: 7-8 semanas). Luego de cada tiempo de intoxicación los animales fueron sacrificados para el procesamiento de las muestras (10).
En el caso del tratamiento de los animales con la dieta líquida con etanol, las ratas (peso corporal: 125-150 gramos, edad: 5-6 semanas) se alimentaron con una dieta líquida nutricionalmente adecuada (dieta para rata estándar Lieber y De Carli, obtenida de Dyets Inc., EE.UU.) (11-13). Los animales se alojaron en jaulas individuales y fueron separados en dos grupos (seis animales en cada uno): etanol y control. Ambos grupos fueron alimentados con la misma dieta excepto que en el grupo control el etanol fue reemplazado por hidrato de carbono (dextrina-maltosa) para compensar las calorías. La dieta líquida proveyó 1 kcal/mL, donde el 35% del total de las calorías provino de grasa, 47% desde hidratos de carbono y el 18% desde proteínas. En los animales intoxicados, el etanol proveyó el 36% de las calorías, reemplazando isocalóricamente al hidrato de carbono. Esta dieta asegura un crecimiento continuo en todos los animales, con un hígado normal en los controles, mientras que en el grupo intoxicado con alcohol se desarrolla un hígado graso. Se llevó un registro diario del consumo de la dieta líquida, utilizando un tubo graduado como dispensador del alimento, así como de los cambios de peso corporal en ambos grupos. La alimentación con estas dietas se continuó por 28 días. La cantidad de etanol al comienzo del procedimiento fue de 30 g/L de la dieta líquida por los primeros dos días, 40 g/L en los dos días siguientes seguido por la fórmula final que contenía 50 g/L. La cantidad consumida fue 13-15 gramos etanol kg-1 por día (11-13).
Aislamiento de la fracción microsomal Y Citosólica desde testículo e hígado de rata
Los animales se sacrificaron por decapitación y los testículos e hígado se extrajeron rápidamente, procesándolos para obtener las fracciones microsomales desde cada homogenato mediante procedimientos de fraccionamiento celular (13). Los órganos se homogeneizaron con un homogenizador de vidrio-teflon tipo Potter-Elvehjem con cuatro volúmenes de solución buffer STKM (sacarosa 0,25 M en Tris-HCl 50 mM, MgCl2 5 mM y KCl 2,5 mM, pH 7,5). Todo el procedimiento se llevó a cabo a 2-4 ºC. Los homogenatos se centrifugaron a 9.000 g durante 20 min. Los sobrenadantes se centrifugaron luego a 105.000 g por una hora y se recuperaron los precipitados (pellets) de microsomas. Este preparado estaba esencialmente libre de contaminación cruzada con otras fracciones celulares. El sobrenadante se recentrifugó a 105.000 g durante una hora para obtener la fracción citosólica.
Determinación de etanol y acetaldehído en distintos tejidos y plasma de rata luego de la intoxicación con una dosis única de etanol
Los animales se sacrificaron por decapitación y sus testículos e hígado fueron removidos rápidamente y congelados a -80 ºC. Las muestras de sangre se obtuvieron por sangrado, colectadas en tubos con heparina y el plasma se separó por centrifugación, conservándolo congelado como los órganos hasta su uso. En el caso de la determinación de los niveles de etanol, las muestras congeladas de hígado y testículo (0,5 g) se trozaron rápidamente y se colocaron en viales de vidrio con tapa de neoprene y sellado con aro de aluminio. Para las muestras de plasma se empleó un volumen de 0,5 mL. En todos los casos, luego de agregar 1,5 mL de solución buffer fosfato pH 7,2 y dos mililitros de solución saturada de carbonato de potasio, las muestras se mantuvieron a 37 °C durante media hora con agitación suave, y luego una alícuota (100 µL) del espacio cabeza de cada vial se analizó por cromatografía gaseosa con detección por ionización de llama (GC-FID). Las condiciones del análisis cromatográfico fueron: columna, Supel-QTM PLOT, 30 m x 0,53 mm i.d. (Supelco, EE.UU.); temperatura 100 °C isotérmico, temperatura del inyector: 150 °C, del detector FID: 200 °C.
En el caso de la determinación de acetaldehído, se utilizó un gramo de cada tejido congelado o un mililitro de plasma. Luego de agregar 1 mL de buffer fosfato, 1 mL de solución saturada de ZnSO4 y 1 mL de solución saturada de NaCl, las muestras se procesaron como se describió antes (10)(14)(15).
Determinación de las actividades alcohol deshidrogenasa y aldehído deshidrogenasa en hígado y testículo de rata
La actividad alcohol deshidrogenasa (ADH) se midió en la fracción citosólica del testículo mediante la detección del NADH formado, a 340 nm. Bajo un exceso de alcohol, la velocidad de formación de NADH es proporcional a la concentración de enzima (16).
La actividad aldehído deshidrogenasa (ALDH) en el testículo se midió por el método descripto por Koivula y Koivusalo con modificaciones menores (17). Las fracciones mitocondriales empleadas para determinar la actividad enzimática se prepararon de acuerdo con esta técnica (14)(17). Las fracciones citosólica, microsomal o mitocondrial se resuspendieron en solución buffer pirofosfato pH 8, se agregó pirazol 1,67 mM y la mezcla (3 mL) se incubó a 37 ºC por 30 min. Inmediatamente luego de agregar propanal 6 mM y NAD+ 0,67 mM, se midió la absorbancia a 340 nm a intervalos de 15 segundos en cuvetas de cuarzo termostatizadas a 37 ºC. Cada valor obtenido para testículo se comparó con aquel del hígado del mismo animal (14).
Determinación de hidroperóxidos de lípidos por el método del naranja de xilenol
Los testículos (o pellets de microsomas) se homogeneizaron (1/6 p/v) en metanol grado HPLC en frío con un disgregador de tejidos tipo Ultra-Turrax (Jank & Kunkel, IKA-Werk, Stanfen, Alemania); luego se centrifugaron por 10 minutos a 1.000 g y el sobrenadante se usó para la determinación de los hidroperóxidos. El reactivo ferroso- naranja de xilenol (Fox) (naranja de xilenol 100 µM; sulfato ferroso amónico hexahidratado 0,25 mM; H2SO4 25 mM) se preparó inmediatamente antes de utilizarlo (18). Para la determinación de los hidroperóxidos se transfirieron alicuotas de extractos de tejido (270 µL) en tubos con tapa a rosca. Se corrió un blanco usando metanol en lugar del extracto. Con el propósito de discernir el aporte al color debido al peróxido de hidrógeno (u otras interferencias) respecto de lo debido a los hidroperóxidos de lípidos, se agregó trifenilfosfina (TPP), un agente reductor específico que no afecta al H2O2 (concentración final 0,1 mM), para reducir los hidroperóxidos de lípidos en un grupo de viales y en los otros se agregó metanol. Todos los viales se agitaron con vortex e incubaron a temperatura ambiente por 30 min, previo al agregado del reactivo Fox (2,7 mL). Luego de mezclar, las muestras se incubaron nuevamente (30 min, en la oscuridad y a temperatura ambiente). A partir de este tiempo se leyó la absorbancia del complejo a 560 nm cada 60 minutos. Los niveles de hidroperóxidos se determinaron por diferencia en los viales con y sin TPP. Se construyó una curva estándar con concentraciones diferentes de t-butilhidroperóxido (TBHP) en metanol. Los valores se expresaron como nmol de equivalentes de TBHP por gramo de tejido (14)(19).
Determinación del contenido de glutatión total y reducido
Los niveles de glutatión reducido y oxidado se midieron por el método descripto por Venturino et al. (20). El tejido fue congelado en nitrógeno líquido y luego pulverizado en un mortero de acero previamente enfriado. Luego el polvo se homogeneizó en 2,5 partes de agua y 2,5 partes de ácido tricloroacético (TCA) 10%, en ese orden y se centrifugó a 10.000 g por 10 min a 4 °C. Se midió y registró el volumen de sobrenadante obtenido, repartiendo luego dos alicuotas de 450 µL en tubos cónicos (para el análisis de glutatión total y de glutatión reducido). A cada tubo se agregó 400 µL de solución buffer de neutralización (fosfato 500 mM, pH 8). En el tubo para la medida del glutatión total se agregaron 25 µL de NADPH (4,2 mM en el buffer de reacción: fosfato 143 mM y EDTA 6,3 mM) y 25 µL of glutatión reductasa (24 U/mL en el buffer de reacción). En el tubo para la determinación de glutatión reducido, el volumen se completó con el buffer de reacción. Luego de agitar se incubó por 30 min a 25 °C. Posteriormente a ambos tubos se agregaron 900 µL de TCA 10%, agitando y centrifugando a 10.000 g por 10 min. Luego de mezclar 40 µL de sobrenadante con 180 µL de ácido 5,5'-ditiobis(2-nitrobenzoico) (DTNB) (1,67 mM en buffer fosfato 286 mM y EDTA 12,6 mM), se procedió a la medida por triplicado en una lectora de microplacas a 414 nm.
Determinación de la actividad glutatión S-transferasa (GST)
La determinación de la actividad GST se realizó por el método de Habig y colaboradores (21). La mezcla de reacción (200 µL) consistió en fosfato de potasio 0,1 M (pH 6,5), triton X-100 0,1%, glutatión 1 mM y fracción citosólica (5,8-5,9 mg proteína/mL). La reacción se llevó a cabo a 25 ºC (temperatura ambiente) y se inició con el agregado de 1-cloro-2,4-dinitrobenceno (CDNB) 1 mM. Paralelamente se corrió un control sin la muestra de citosol. La formación del tioeter se determinó por lectura de la absorbancia a 340 nm y la cuantificación se realizó utilizando el coeficiente de extinción molar del CDNB (9,6 mM-1cm-1). La actividad enzimática se expresó como nmol de glutatión conjugado formado por minuto por miligramo de proteína. Determinación de la actividad glutatión reductasa (GRed) La actividad GRed se determinó mediante el método de Carlberg y Mannervik, con alguna modificación menor (22). La mezcla de reacción (200 µL) consistió en fosfato de potasio 0,1 M (pH 7,6), NADPH 0,1 mM, EDTA 0,5 mM, glutatión oxidado (GSSG) 1 mM y fracción citosólica (4,8-5,0 mg proteína/mL). La actividad de la enzima se midió a través de la desaparición del NADPH a 340 nm y se expresó como nmol de NADPH oxidado por minuto por miligramo de proteína.
Determinación de la actividad glutatión peroxidasa (GPx)
La actividad GPx se ensayó mediante una versión modificada del método de Flohé y colaboradores, para su aplicación a una lectora de microplacas (23). La mezcla de reacción incluía 20 microlitros de fracción citosólica (4,8-5,0 mg proteína/mL), 120 µL de buffer de reacción (fosfato 100 mM, EDTA 1 mM y NaN3 1 mM), 20 µL de glutatión reducido 10 mM y glutatión reductasa (0,24 U/pocillo) y 20 µL de NADPH 1,5 mM. Se incubó a 37 ºC por 10 min. Luego se registró la absorbancia a 340 nm durante tres minutos. Posteriormente se agregó 20 µL de H2O2 1,5 mM y se siguió el cambio de absorbancia a 340 nm por 3 min. Se tuvo en cuenta la velocidad de reacción no enzimática en una incubación paralela sin el agregado de citosol. Para determinar la actividad de GPx se calculó la diferencia entre ambos valores, utilizando el coeficiente de extinción molar del NADPH (6,22 mM-1 cm-1).
Resultados
Niveles de etanol en testículo, hígado y plasma luego de la administración de una dosis única de etanol
Luego de la administración de una dosis única de etanol, las curvas de concentración del alcohol en testículo, hígado y plasma siguieron una forma similar, con un máximo a una hora luego de la intoxicación y disminuyendo lentamente hasta la desaparición a las 24 horas (Tabla I). En los animales control los niveles de etanol fueron muy bajos en cualquiera de los tiempos, para la dosis de sacarosa empleada (las concentraciones nunca excedieron 282 nmol/g en testículo, 133 nmol/g en hígado y 89 nmol/mL en plasma).
Tabla I. Niveles de etanol in vivo en hígado, testículo y plasma en función del tiempo, luego de la administración de una dosis única de etanol.
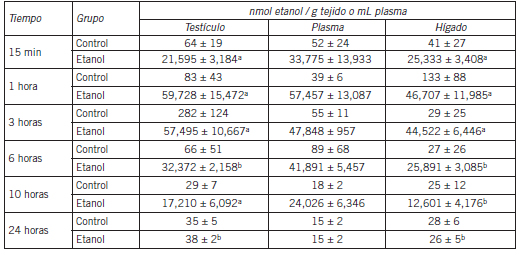
Los animales (seis por grupo) recibieron el alcohol p.o. (3,8 g/kg) como una solución en agua (5 mL 200 g-1). Cada valor representa el promedio ± DE desde seis muestras de tejido o plasma independientes.
a. p>0,05 comparado con plasma.
b. p<0,01 comparado con plasma.
Niveles de acetaldehído en testículo, hígado y plasma luego de la administración de una dosis única de etanol
Los resultados obtenidos muestran que luego de una exposición única al alcohol los niveles de acetaldehído en testículo aumentaron hasta alcanzar concentraciones significativamente más altas que las plasmáticas, permaneciendo así durante varias horas luego de la intoxicación (Tabla II). En los animales control los niveles de acetaldehído fueren siempre muy bajos, en cualquier tiempo medido y para esas dosis de sacarosa (las concentraciones nunca excedieron 0,4 nmol/g en testículo, 0,8 nmol/g en hígado o 0,4 nmol/mL en plasma).
Tabla II. Niveles de acetaldehído in vivo en hígado, testículo y plasma en función del tiempo, luego de la administración de una dosis única de etanol.

Los animales (seis por grupo) recibieron el alcohol p.o. (3,8 g/kg) como una solución en agua (5 mL 200 g-1). Cada valor representa el promedio ± DE desde seis muestras de tejido o plasma independientes.
a. p>0,05 comparado con plasma.
b. p<0,01 comparado con plasma.
Actividades alcohol deshidrogenasa y aldehído deshidrogenasa en testículo e hígado de rata
Las actividades de ambas enzimas, alcohol deshidrogenasa y aldehído deshidrogenasa, en testículo resultaron ser significativamente más bajas que las determinadas en el hígado de los mismos animales (Tabla III).
Tabla III. Actividades alcohol deshidrogenasa y aldehído deshidrogenasa en testículo e hígado de rata.
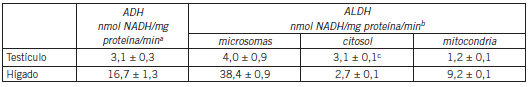
a. La actividad ADH se determinó en la fracción citosólica de testículo e hígado midiendo la formación de NADH a 340 nm. En presencia de un exceso de etanol, la reducción de NAD+ es proporcional a la concentración de la enzima. Cada valor es el promedio± DE de seis muestras de tejido independientes.
b. La actividad ALDH se determinó en las fracciones citosólica, mitocondrial y microsomal de testículo e hígado de rata midiendo la formación de NADH a 340 nm. Cada valor es el promedio ± DE de seis muestras de tejido independientes.
c. p<0,05 comparado con hígado.
Hidroperóxidos de lípidos en testículo de rata luego de la administración repetida (dieta líquida) o de una dosis única de etanol
Los niveles de hidroperóxidos de lípidos (expresados como equivalentes de TBHP) se midieron en homogenatos de testículo de ratas expuestas al etanol a través de la administración repetida de alcohol mediante la dieta líquida de Lieber y De Carli. Luego de incubar con el reactivo de Fox a diferentes tiempos y descontar la reacción con H2O2, se observó un aumento significativo de hidroperóxidos de lípidos en las ratas tratadas con etanol, comparando con los controles (Fig. 1). En otro experimento los animales recibieron una dosis única de alcohol. En la fracción microsomal de testículo se observó una diferencia pequeña pero significativa en la formación de hidroperóxidos de lípidos entre ratas tratadas y controles solo a dos y tres horas luego de comenzar la reacción con el reactivo Fox (Fig. 2).

Figura 1. Niveles de hidroperóxidos de lípidos en testículo de ratas expuestas repetidamente al alcohol mediante la dieta líquida. Los homogenatos de testículo de rata se incubaron con el reactivo del naranja de xilenol a temperatura ambiente a tiempos diferentes, como se describe en Materiales y Métodos. Los valores expresados corresponden a promedios ± DE. Se analizaron cuatro muestras por grupo, cada una de ellas compuesta por un homogenato de un lote independiente de testículo (de cinco animales).
*. p<0,01 comparado con su control.

Figura 2. Niveles de hidroperóxidos de lípidos en microsomas de testículo de ratas que recibieron una dosis única de etanol (3,8 g/kg). Los microsomas de testículo de rata se incubaron con el reactivo de naranja de xilenol a temperatura ambiente por distintos tiempos, como se describe en Materiales y Métodos. Los valores expresados corresponden a promedios ± DE. Se analizaron cuatro muestras por grupo, cada una de ellas compuesta por un homogenato de un lote independiente de testículo (de cinco animales).
*. p<0,05 comparado con su control.
#. p>0,05 comparado con su control.
Niveles de glutatión total y glutatión reducido en testículo e hígado de ratas que recibieron la administración repetida de etanol
Los niveles de glutatión total mostraron un incremento significativo en el hígado de los animales intoxicados con etanol crónicamente, mientras que en testículo se observó una disminución leve aunque significativa. En cambio, los niveles de glutatión reducido aumentaron en ambos tejidos. Para la forma oxidada del glutatión (GSSG) se observó una disminución del 35% en el testículo y un aumento significativo en el hígado (Tabla IV).
Tabla IV. Niveles de glutatión en testículo e hígado de ratas expuestas repetidamente al alcohol.

Los niveles de glutatión se midieron en hígado y testículo tal como se describe en Materiales y Métodos. Cada valor es el promedio ± DE de seis muestras de tejido independientes.
a. p<0,01 comparado con el control.
b. p<0,05 comparado con el control.
c. p>0,05 comparado con el control.
Actividades glutatión S-transferasa (GST), glutatión reductasa (GRed) y glutatión peroxidasa (Gpx) en testículo e hígado de ratas que recibieron la administración repetida de etanol
La actividad GST en testículo en los animales control resultó de una magnitud significativa cuando se la comparó con la del hígado de los mismos animales y la administración repetida de alcohol provocó una disminución en esa actividad. La actividad GRed aumentó alrededor de un 10% en los animales tratados con etanol, mientras que la actividad GPx no mostró cambios debidos a la ingestión de etanol (Tabla V). En el hígado de los mismos animales tanto GRed como GPx aumentaron significativamente como respuesta a la intoxicación alcohólica.
Tabla V. Actividades glutatión S-transferasa (GST), glutatión reductasa (GRed) y glutatión peroxidasa (GPx) en testículo e hígado de ratas expuestas repetidamente al etanol.

*. La actividad glutatión S-transferasa (GST) se determinó en la fracción citosólica de testículo e hígado (5,8-5,9 mg proteína/mL) mediante la formación del tioeter con CDNB y leyendo la absorbancia a 412 nm. La actividad glutatión reductasa (GRed) se determinó en la fracción citosólica de testículo e hígado (4,8-5,0 mg proteína/mL) midiendo la desaparición de NADPH at 340 nm. La actividad glutatión peroxidasa (GPx) se determinó en la fracción citosólica de testículo e hígado (6.5-6.9 mg proteína/mL), en una reacción iniciada por H2O2 y siguiendo el cambio de absorbancia a 340 nm. Cada valor es el promedio± DE de seis muestras de tejido independientes.
a. p<0,01 comparado con el control.
b. p<0,05 comparado con el control.
c. p>0,05 comparado con el control.
Discusión y Conclusiones
Distintos estudios han provisto evidencia concluyente que el etanol reduce los niveles de testosterona circulante en roedores y que directamente inhibe la acumulación de la hormona en testículos aislados o en células intersticiales (4)(5)(24)(25). Estos efectos fueron adjudicados por varios autores a la formación de acetaldehído en los testículos y en particular en sus células de Leydig (8)(24)(25).
La capacidad del testículo para metabolizar al etanol a acetaldehído ha sido bien documentada en modelos experimentales. Chiao y Van Thiel reportaron la presencia de ADH, Dafeldecker y Vallee identificaron una alcohol deshidrogenasa específica del testículo, y Juliá y colaboradores caracterizaron tres isoenzimas de la ADH (7)(26)(27).
Otra fuente de producción de acetaldehído desde el etanol presente en la fracción microsomal del testículo fue reportada por este laboratorio (9). En este caso la generación del metabolito dependió fuertemente de la presencia de NADPH y de oxígeno, y aparentemente involucra varias enzimas incluyendo el CYP2E1, la P450 reductasa y otras con un comportamiento del tipo lipoxigenasa o peroxidasa, a juzgar por su respuesta a diferentes inhibidores (9). Murono y Fisher-Simpson describieron en células de Leydig de rata purificadas la presencia de un sistema metabolizante de etanol dependiente de NADPH en la fracción microsomal que no era CYP2E1 (8). Sin embargo, es importante hacer notar que esta isoenzima del P450 fue detectada en estudios inmunohistoquímicos solamente en estas células y que su presencia se vinculó con la toxicidad selectiva en testículo de algunos compuestos que se oxidan mediante el CYP2E1, como el 1,3-butadieno (28)(29).
La formación de acetaldehído y de radicales libres hidroxilo y 1-hidroxietilo reportada en estudios previos (9) podrían ser relevantes en el caso de las células de Leydig puesto que el acetaldehído es capaz de inhibir la síntesis y secreción de testosterona en estas células a concentraciones tan bajas como 5 µM (6).
En los estudios presentes se reportó que luego de una dosis única de etanol, los niveles del mismo presentes en testículo fueron similares a los encontrados en hígado o plasma. Más importante aún, se observó que el acetaldehído presentó niveles aumentados significativamente por varias horas tanto en testículo como en hígado aunque no en plasma (Tabla II).
La presencia sostenida de acetaldehído en el testículo podría relacionarse en parte con una contribución desde la circulación sanguínea pero la generación in situ parece ser más importante, considerando el hecho que los niveles plasmáticos de acetaldehído permanecieron prácticamente constantes durante el periodo en que se incrementó en los testículos.
La contribución de la generación in situ de acetaldehído se debería a la presencia de ADH y de los mecanismos enzimáticos a nivel microsomal previamente descritos por este laboratorio (9). Las actividades de la aldehído deshidrogenasa y glutatión transferasa insuficientes serían responsables de la permanencia del acetaldehído en el testículo por varias horas luego de la intoxicación con alcohol. Es importante notar que la concentración de acetaldehído reportada en estos estudios fue de la misma magnitud que la vinculada con la disminución de la esteroideogénesis y la excreción de testosterona por células de Leydig en cultivo (24)(25).
Emanuele y Emanuele sugirieron claramente la necesidad de más estudios para comprender los mecanismos celulares subyacentes a los efectos tóxicos del etanol sobre el sistema reproductor masculino con el propósito de desarrollar estrategias efectivas para revertir o prevenir esos efectos (2).
En estos estudios el interés se ha enfocado en los mecanismos de generación de acetaldehído in situ, particularmente en la fracción microsomal. Este interés se debe al hecho de que este metabolismo también conduce a la formación de radicales libres y de que en distintos trabajos se demostró la ocurrencia de manifestaciones de estrés oxidativo. Estas incluyeron la determinación de peroxidación de lípidos a través de la formación de malondialdehído (MDA) (30)(31).
Grattagliano y colaboradores produjeron evidencia adicional para la ocurrencia de estrés oxidativo, mostrando que luego de una exposición repetida al alcohol no solo se observaba la formación de MDA si no que además había oxidación de proteínas y una disminución significativa del alfa tocoferol y del ácido ascórbico (32). Estos experimentos se realizaron con una dosis de alcohol del 3% por bebida durante ocho semanas, pero la compensación calórica en los controles en ese periodo se realizó con sacarosa. En este trabajo se observó la ocurrencia de estrés oxidativo bajo dos condiciones experimentales diferentes, una dosis única de alcohol y la otra por exposición de los animales a la dieta de Lieber y De Carli por 28 días. En ambos casos se encontró un incremento significativo en la formación de hidroperóxidos de lípidos, determinados por el método del naranja de xilenol.
En los presentes estudios, solo se encontraron cambios menores en los niveles de glutatión y una disminución en los de GSSG, atribuibles probablemente a un incremento en la actividad GRed. Las diferencias entre estos resultados y aquellos reportados por otros autores e incluso entre ellos probablemente reflejen los diferentes protocolos de intoxicación empleados. En el presente estudio, los experimentos se realizaron empleando el bien establecido modelo de la dieta líquida estándar de Lieber y De Carli. Gratagliano y colaboradores utilizaron sacarosa para la compensación calórica en los controles (32), mientras que Maneesh y colaboradores mantuvieron a los animales con una dieta de alimento balanceado y administraron el alcohol por vía oral (33). Sin embargo, en ambos estudios se pudo observar la ocurrencia de peroxidación lipídica.
En los experimentos presentes, los resultados obtenidos en el hígado de los mismos animales son similares a los reportados previamente por Oh y colaboradores (34). Los autores consideran que las diferencias observadas en la respuesta entre el hígado y el testículo hacia la intoxicación alcohólica reflejan diferencias en ambos órganos respecto al metabolismo del glutatión y la capacidad detoxificante (35).
En ambos experimentos, agudo y crónico, se observó peroxidación de lípidos en el testículo de la rata (Fig. 1) (Fig. 2). Esto demuestra que la formación de radicales libres durante el metabolismo microsomal del etanol excede la capacidad de los sistemas de detoxificación disponibles en el testículo. Todos estos hallazgos indican la relevancia potencial de estos sistemas metabolizantes microsomales para generar metabolitos reactivos que pueden afectar las funciones del testículo: acetaldehído y especies reactivas del oxígeno (9). La relevancia del estrés oxidativo en el testículo es considerable teniendo en cuenta que los espermatozoides son ricos en ácidos grasos poliinsaturados y sus membranas muy susceptibles a la peroxidación (36). Mas aún, se ha postulado la participación de especies reactivas de oxígeno en la inhibición de la motilidad de los espermatozoides y en la afectación de la fertilidad (36). Tanto el acetaldehído como el estrés oxidativo producido en estos mecanismos de oxidación a nivel microsomal podrían estar involucrados no solo en la disminución de la producción de testosterona, sino también en el incremento de la apoptosis observado en las células germinales del testículo de rata y en el incremento de los niveles testiculares de p53 mARN, provocado por la exposición al etanol (37).
AGRADECIMIENTOS
Este trabajo fue financiado por la Universidad Nacional de General San Martín (UNSAM) y con un subsidio de CONICET (PIP 11220090100128).
1. Adler RA. Clinical review 33: Clinically important effects of alcohol on endocrine function. J Clin Endocrinol Metab 1992; 74: 957-60. [ Links ]
2. Emanuele MA, Emanuele NV. Alcohol's effects on male reproduction. Alcohol Health Res World 1998; 22: 195-201. [ Links ]
3. Maneesh M, Dutta S, Chakrabarti A, Vasudevan DM. Alcohol abuse-duration dependent decrease in plasma testosterone and antioxidants in males. Indian J Physiol Pharmacol 2006; 50: 291-6. [ Links ]
4. Badr FM, Bartke A, Dalterio S, Bugler W. Suppression of testosterone production by ethyl alcohol: possible mode of action. Steroids 1977; 30: 647-57. [ Links ]
5. Cobb CF, Ennis MF, Van Thiel DH, Gavaler JS, Lester R. Acetaldehyde and ethanol are direct testicular toxins. Surg Forum 1978; 29: 641-4. [ Links ]
6. Van Thiel DH, Gavaler JS, Rosenblum E, Tarter RE. Ethanol, its metabolism and hepatotoxicity as well as its gonadal effects: effects of sex. Pharmacol Ther 1989; 41: 27-48. [ Links ]
7. Chiao YB, Van Thiel DH. Characterization of rat testicular alcohol dehydrogenase. Alcohol Alcohol 1986; 21: 9-15. [ Links ]
8. Murono EP, Fisher-Simpson V. Microsomal ethanol-oxidizing system in purified rat Leydig cells. Biochim Biophys Acta 1987; 918: 136-40. [ Links ]
9. Quintans LN, Castro GD, Castro JA. Oxidation of ethanol to acetaldehyde and free radicals by rat testicular microsomes. Arch Toxicol 2005; 79: 25-30. [ Links ]
10. Castro GD, Delgado de Layño AMA, Fanelli SL, Maciel ME, Díaz Gómez MI, Castro JA. Acetaldehyde accumulation in rat mammary tissue after an acute treatment with alcohol. J Appl Toxicol 2008; 28: 315-21. [ Links ]
11. Lieber CS, De Carli LM. Liquid diet technique of ethanol administration, 1989 update. Alcohol Alcohol 1989; 24: 197-211. [ Links ]
12. Lieber CS, De Carli LM. The feeding of alcohol in liquid diets decades of applications and 1982 update. Alcoholism Clin Exp Res 1982; 6: 523-31. [ Links ]
13. Castro GD, Delgado de Layño AMA, Costantini MH, Castro JA. Rat breast microsomal biotransformation of ethanol to acetaldehyde but not to free radicals. Its potential role in the association between alcohol drinking and breast tumor promotion. Teratog Carcinog Mutagen 2003; 23 (Suppl 1): 61-70. [ Links ]
14. Díaz Gómez MI, de Castro CR, Fanelli SL, Quintans LN, Costantini MH, Castro JA, et al. Biochemical and ultrastructural alterations in the rat ventral prostate due to repetitive alcohol drinking. J Appl Toxicol 2007; 27: 391-8. [ Links ]
15. Buthet LR, Bietto FM, Castro JA, Castro GD. Metabolism of ethanol to acetaldehyde by rat uterine horn subcellular fractions. Hum Exp Toxicol 2011; 30: 1785-94. [ Links ]
16. Racker E. Crystalline alcohol dehydrogenase from baker's yeast. J Biol Chem 1950; 184: 313-9. [ Links ]
17. Koivula T, Koivusalo M. Different forms of rat liver aldehyde dehydrogenase and their subcellular distribution. Biochim Biophys Acta 1975; 397: 9-23. [ Links ]
18. Nourooz-Zadeh J, Tajaddini-Sarmadi J, Wolf SP. Measurement of plasma hydroperoxide concentration by the ferrous oxidation-xylenol orange assay in conjunction with triphenylphosphine. Anal Biochem 1994; 220: 403-9. [ Links ]
19. Castro GD, de Castro CR, Maciel ME, Fanelli SL, de Ferreyra EC, Gómez MI, et al. Ethanol-induced oxidative stress and acetaldehyde formation in rat mammary tissue. Potential factors involved in alcohol drinking promotion of breast cancer. Toxicology 2006; 219: 208-19. [ Links ]
20. Venturino A, Anguiano OL, Gauna L, Cocca C, Bergoc RM, Pechen de D'Angelo AM. Thiols and polyamines in the potentiation of malathion toxicity in larval stages of the toad Bufo arenarum. Comp Biochem Physiol C Toxicol Pharmacol 2001; 130: 191-8. [ Links ]
21. Habig WH, Pabst MJ, Fleischner G, Gatmaitan Z, Arias IM, Jakoby WB. The identity of glutathione S-transferase B with ligandin, a major binding protein of liver. Proc Natl Acad Sci U S A 1974; 71: 3879-82. [ Links ]
22. Carlberg I, Mannervik B. Purification and characterization of the flavoenzyme glutathione reductase from rat liver. J Biol Chem 1975; 250: 5475-80. [ Links ]
23. Flohé L, Günzler WA. Assays of glutathione peroxidase. Methods Enzymol 1984; 105: 114-21. [ Links ]
24. Santucci L, Graham TO, Van Thiel DH. Inhibition of testosterone production by rat Leydig cells with ethanol and acetaldehyde: prevention of ethanol toxicity with 4-methylpyrazol. Alcohol Clin Exp Res 1983; 7: 135-9. [ Links ]
25. Van Thiel DH, Gavaler JS, Cobb CF, Santucci L, Graham TO. Ethanol, a Leydig cell toxin: evidence obtained in vivo and in vitro. Pharmacol Biochem Behav 1983; 18(Suppl.1): 317-323. [ Links ]
26. Dafeldecker WP, Vallee BL. Organ specific human alcohol dehydrogenase: isolation and characterization of isoenzymes from testis. Biochem Biophys Res Commun 1986; 134: 1056-63. [ Links ]
27. Juliá P, Farrés J, Parés X. Characterization of three isoenzymes of rat alcohol dehydrogenase. Time distribution and physical and enzymatic properties. Eur J Biochem 1987; 162: 179-89. [ Links ]
28. Jiang Y, Kuo Ch, Pernecky SJ, Piper WN. The detection of cytochrome P450 2E1 and its catalytic activity in rat testis. Biochem Biophys Res Commun 1998; 246: 578-83. [ Links ]
29. Healy LN, Pluta LJ, Recio L. Expression and distribution of cytochrome P4502E1 in B6C3F1 mouse liver and testes. Chem Biol Interact 1999; 121: 199-207. [ Links ]
30. Rosenblum ER, Gavaler JS, Van Thiel DH. Lipid peroxidation: a mechanism for alcohol-induced testicular injury. Free Rad Biol Med 1989; 7: 569-77. [ Links ]
31. Nordmann R, Ribière C, Rouach H. Implication of free radical mechanisms in ethanol-induced cellular injury. Free Rad Biol Med 1992; 12: 219-40. [ Links ]
32. Grattagliano I, Vendemiale G, Errico F, Bolognino AE, Lillo F, Salerno MT, et al. Chronic ethanol intake induces oxidative alterations in rat testis. J Appl Toxicol 1997; 17: 307-11. [ Links ]
33. Maneesh M, Jaalekshmi H, Dutta S, Chakrabarti A, Vasudevan DM. Effect of chronic ethanol administration on testicular antioxidant system and steroidogenic enzyme activity in rats. Indian J Exp Biol 2005; 43: 445-9. [ Links ]
34. Oh SI, Kim CI, Chun HJ, Park SC. Chronic ethanol consumption affects glutathione status in rat liver. J Nutr 1998; 128: 758-63. [ Links ]
35. Meister A. Glutathione metabolism. Methods Enzymol 1995; 251: 3-7. [ Links ]
36. Sikka SC. Relative impact of oxidative stress on male reproductive function. Curr Med Chem 2001; 8: 851-62. [ Links ]
37. Zhu Q, Meisinger J, Emanuele NV, Emanuele MA, La Paglia N, Van Thiel DH. Ethanol exposure enhances apoptosis within the testes. Alcohol Clin Exp Res 2000; 24: 1550-6. [ Links ]
Aceptado para su publicación el 8 de octubre de 2013














