Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957
Acta bioquím. clín. latinoam. vol.47 no.4 La Plata dic. 2013
TOXICOLOGÍA
Genotoxicidad en leucocitos por la quimioprofilaxis de sangre con Violeta de Genciana y su prevención con antioxidantes
Genotoxicity in leukocytes by blood chemoprophylaxis with Gentian Violet and its prevention with antioxidants
Genotoxicidade em leucócitos pela quimioprofilaxia de sangue com Violeta Genciana e sua prevenção com antioxidantes
María Isabel Díaz Gómez1ab, José Alberto Castro2ab
1 Dra. en Ciencias Químicas.
2 Dr. en Ciencias Químicas.
a Centro de Investigaciones Toxicológicas (UNIDEF, MINDEF-CONICET-CITEDEF). J.B. de La Salle 4397, B1603ALO, Villa Martelli, Buenos Aires, Argentina.
b Instituto de Investigación e Ingeniería Ambiental, Universidad Nacional de General San Martín (UNSAM). 25 de Mayo y Francia, B1650HMP San Martín, Buenos Aires, Argentina.
Correspondencia DR. JOSE A. CASTRO Centro de Investigaciones Toxicologicas (UNIDEF, MINDEF-CONICET). J. B. de La Salle 4397, B1603ALO VILLA MARTELLI, Buenos Aires, Argentina. Tel-Fax: 54-11-4709-5911 E-mail: jcastro@citedef.gob.ar
Resumen
El Violeta de Genciana (GV) se usa como aditivo en la sangre para eliminar el Trypanosoma cruzi en la quimioprofilaxis de la infección por enfermedad de Chagas vía transfusión sanguínea, cuando no es posible un control previo de laboratorio o bajo situaciones de emergencia. En estos estudios se encontraron efectos genotóxicos del GV con el ensayo Cometa, cuando se lo agregó a la sangre bajo las condiciones empleadas para esterilizarla para transfusión. El efecto genotóxico fue aún más intenso si la sangre se mantenía con GV por 48 horas. Los resultados obtenidos con el ensayo Cometa sugieren la formación de bases hidroxiladas de ADN como resultado de un ataque de especies reactivas de oxígeno y apoyan la genotoxicidad del GV y su potencial carcinogénico ya informado previamente. Los efectos genotóxicos observados en el ensayo Cometa fueron parcialmente prevenidos por administración de antioxidantes que ya tienen uso clínico seguro, como á-tocoferol, ácido lipoico o N-acetilcisteína. El ácido lipoico fue capaz también de reaccionar in vitro con GV. Los resultados sugieren un uso potencial de estos antioxidantes para prevenir los efectos secundarios no deseados del GV para el individuo receptor de la sangre.
Palabras clave: Violeta de Genciana; Enfermedad de Chagas; Transfusión sanguínea; Ensayo Cometa; Efectos genotóxicos; Antioxidantes.
Summary
Gentian violet (GV) is being used as blood additive to eliminate Trypanosoma cruzi in the chemoprophylaxis of Chagas disease infection via blood transfusion when prior laboratory control is not possible or under emergency circumstances in endemic areas. In these studies genotoxic effects of GV were found employing the Comet assay when GV was added to rat blood under the cisconditions employed to sterilize it for transfusion. The genotoxic effect was even more intense if blood was kept with GV for 48 hours. The positive results obtained in the Comet assay suggest the formation of DNA hydroxylated bases as result of a reactive oxygen species (ROS) attack and further confirm GV genotoxicity and its potential carcinogenic effects previously reported. Genotoxicity effects observed in the Comet assay were partially but significantly prevented by prior administration of antioxidants having safe clinical use such as á-tocopherol; lipoic acid or N-acetylcysteine. Lipoic acid was also able to chemically react in vitro with GV (eg. the one remaining in the transfusion mixture after it had enough time to eliminate the parasite from blood). Results would suggest the potential use of these antioxidants to prevent unwanted side effects of GV for the blood recipient.
Key words: Gentian Violet; Chagas' disease; Blood transfusion; Comet assay; Genotoxic effects; Antioxidants.
Resumo
O Violeta de Genciana (GV) é utilizado como aditivo no sangue para remover o Trypanosoma cruzi da sangue em quimioprofilaxia da infecção por doença de Chagas através de transfusão de sangue, quando não é possível controle prévio de laboratório ou em situações de emergência. Nestes estudos encontraram-se efeitos genotóxicos do GV utilizando o ensaio Cometa, quando o GV foi adicionado ao sangue sob as condições utilizadas para a esterilização para transfusão. O efeito genotóxico foi ainda mais intenso se o sangue era mantido durante 48 horas com GV. Os resultados obtidos com o ensaio Cometa sugerem a formação de bases de DNA hidroxiladas, como resultado de um ataque de espécies reativas de oxigênio e apoiam a genotoxicidade do GV e seu potencial carcinogênico já informado anteriormente. Efeitos genotóxicos observados no ensaio do Cometa foram parcialmente prevenidos por administração de antioxidantes que já têm uso clínico seguro, como á-tocoferol, o ácido lipoico ou N-acetilcisteína. O ácido lipoico também foi capaz de reagir in vitro com GV. Os resultados sugerem um uso potencial destes antioxidantes para prevenir os efeitos colaterais não desejados de GV para o indivíduo receptor do sangue.
Palavras-chave: Violeta Genciana; Doença de Chagas; Transfusão de sangue; Ensaio Cometa; Efeitos genotóxicos; Antioxidantes.
Introducción
Se estima que 15-16 millones de personas estan infectadas con Trypanosoma cruzi (T. cruzi) en America Latina y que 75-90 millones estan expuestos a la infeccion. El control de la enfermedad de Chagas debe llevarse a cabo interrumpiendo su transmision por vectores y en la transfusion sanguinea, mejorando las viviendas y las areas que rodean a las mismas, proveyendo educacion sanitaria a las poblaciones expuestas y tratando los casos agudos y los recientemente infectados (1). La infeccion por T. cruzi se extiende a traves de Norte, Centro y Sud America, afecta 21 paises y frecuentemente permanece sin diagnosticar. Ademas, el T. cruzi puede detectarse en la sangre de individuos infectados decadas despues de que la infeccion tuvo lugar y la transfusion sanguinea y el trasplante de organos es considerado el segundo modo mas comun de transmision de T. cruzi (2).
La transmision de la enfermedad de Chagas a traves de productos de la sangre no es unicamente un problema de las areas rurales en paises endemicos en America Latina. En efecto, un gran numero de personas infectadas por T. cruzi provenientes de areas rurales endemicas migran a zonas urbanas en paises endemicos y no endemicos (2-4). Los paises no endemicos que reciben inmigrantes provenientes de otros endemicos deberian desarrollar politicas preventivas para evitar la contaminacion de la sangre para transfusion con T. cruzi (2) (5-7). En areas altamente endemicas o donde no es posible (o no esta disponible) el control serologico, el riesgo de transmision del T. cruzi por transfusion sanguinea puede ser reducido por la adicion de Violeta de Genciana (GV) a la sangre a transfundir (3). Este tratamiento es capaz de eliminar el parasito en 24 horas (3)(8)(9). Sin embargo, la toxicidad a largo plazo de este agente para los receptores de la sangre es todavia un problema no resuelto (3)(10-12).
El desarrollo de tratamientos profilacticos alternativos que sean efectivos y seguros deberia ser de interes sanitario. Esfuerzos de este laboratorio en este sentido fueron informados anteriormente (13-15).
En el presente trabajo se informan resultados que evidencian que durante la exposicion de la sangre a GV bajo condiciones empleadas regularmente para la quimioprofilaxis contra la infeccion de la enfermedad de Chagas por transfusion, se producen efectos mutagenicos sobre el ADN de los globulos blancos de la sangre. Estas acciones deletereas fueron significativamente disminuidas cuando la sangre se obtuvo de animales pretratados con vitamina E, acido lipoico o N-acetil cisconditions teina. Se discuten las limitaciones potenciales y el valor de los resultados obtenidos para mejorar la quimioprofilaxis por GV para prevenir la infeccion de Chagas por transfusion, en emergencias importantes que ocurran en zonas endemicas y se discuten las ventajas, desventajas y dificultades para una eventual aplicacion practica que existiria en comparacion con otras alternativas que emplean metodos de diagnostico rapido por inmunocromatografia como modo para descartar sangre infectada.
Materiales y Métodos
Compuestos químicos
El acido lipoico o DL-6,8-acido tioctico (LA), el á-tocoferol anhidro (á-T), la N-acetil cisteina (NAC) y el Violeta de Genciana (GV) fueron adquiridos a Sigma-Aldrich (St. Louis, EE.UU.). Agarosa Ultra Pura y L.M.P. Agarosa fueron de Invitrogen, Life Technologies, Espana. Los otros compuestos usados fueron de grado reactivo analitico.
Animales
Se usaron ratas macho de la cepa Sprague Dawley (250-270 g de peso corporal) en todos los experimentos y la colonia de cria original fue de Charles River (Wilmington, EE.UU.). Los procedimientos usados para la cria, alojamiento y manipulacion de los animales fueron los establecidos por la Administracion Nacional de Medicamentos, Alimentos y Tecnologia Medica (ANMAT).
En el experimento con á-tocoferol, a las ratas se les administraron 575 mg/kg en aceite de oliva, y luego de 4 o 24 horas, se extrajo sangre via la vena cava (16). Cuando se probo el acido lipoico, en un experimento a las ratas se les administro 550 mg/kg en carboximetilcelulosa 0,1% por via oral intragastrica (po) y se les extrajo sangre a la media hora y en otro la dosis fue de 121 mg/kg en carboximetilcelulosa 0,1% y la sangre fue extraida a las 3 horas (17). Cuando se administro NAC se uso una dosis de 2000 mg/kg en agua, po, y la sangre se extrajo despues de 30 minutos (18). En todos los experimentos se usaron cinco ratas por grupo y se hicieron los controles correspondientes con aceite de oliva, carboximetilcelulosa o agua.
Ensayo Cometa
El ensayo Cometa se llevo a cabo en sangre venosa heparinizada (extraida de la vena cava inferior bajo anestesia suave con eter) proveniente de ratas sin pretratamiento (efecto de GV a 24 y 48 horas) o con pretratamiento con á-tocoferol, acido lipoico o NAC. El ensayo se realizo en tubos de ensayo que contenian 2 mL de sangre mas 0,3 mL de anticoagulante (citrato de sodio 81,3 mM, acido citrico.H2O 37,9 mM, glucosa 100 mM). Luego de agregar GV (50 µL del colorante de una solucion 0,0245 M) a la sangre extraida de los animales, la mezcla se dejo a 4 °C por 24 horas (o 48 horas en un caso). El experimento se realizo en duplicado para cada rata. Los controles con GV o para cada una de las otras drogas solas o sin GV se realizaron simultaneamente. Despues del periodo de incubacion las celulas se centrifugaron, se lavaron una vez con HBSS (KCl 5,0 mM; KH2PO4 0,3mM; NaCl 138,0 mM; NaHCO3 4mM; Na2HPO4 0,3mM, pH 7-7,5), se resuspendieron en HBSS, se separo una alicuota para evaluar el rendimiento celular y la viabilidad y el resto despues de centrifugar nuevamente se uso para llevar a cabo la electroforesis en gel de celulas individuales en medio alcalino (pH>13), single-cell gel electrophoresis (SCGE) o ensayo Cometa, el cual se realizo en duplicado para cada muestra. El ensayo SCGE se llevo a cabo esencialmente de acuerdo con Singh et al.(19). El pellet fue resuspendido en agarosa de bajo punto de fusion (0,5% en PBS) y 75 µL se depositaron sobre portaobjetos que habian sido cubiertos previamente con agarosa de punto de fusion normal (0,5% en PBS). Despues que la agarosa hubo solidificado (4 oC por 10 minutos), se aplico una segunda capa de agarosa de bajo punto de fusion de modo similar a la primera. Luego, los portaobjetos fueron sumergidos en una solucion lisante (NaCl 2,5 M, Na2EDTA 100 mM, Tris-HCl 10 mM, pH 10, que contenian 1% Triton X100 recien preparada y 10% DMSO) por al menos 1 hora a 4 oC y luego colocados en un aparato de electroforesis horizontal con buffer recien preparado (Na2EDTA 1 mM, NaOH 300 mM, pH>13). Despues de 20 minutos de pre-incubacion (para desenrollar el ADN), la electroforesis se llevo a cabo por 20 minutos a un voltaje fijo de 25 V (0,83 V/cm) y 300 mA, ajustado ya sea elevando o bajando el nivel del buffer de electroforesis en la cuba. Al final de la electroforesis, los portaobjetos se lavaron dos veces con buffer de neutralizacion (Tris-HCl 0,4 M, pH 7,5), se secaron a temperatura ambiente y se fijaron en etanol 100% por cinco minutos. Los portaobjetos se tineron con 40 µL de bromuro de etidio (20 µg/mL).
Detección de los cometas y análisis estadístico
Las celulas se analizaron 24 horas despues del tenido con un microscopio de fluorescencia Eclipse E 400 (Nikon, Japon) equipado con filtros de epifluorescencia y a una magnificacion de 20 x. La captacion de imagenes se realizo mediante un programa Nikon ACT-2U con una camara DS 5M digital. Se uso el software CASP adquirido desde http://www.casp.of.pl, para determinar Longitud de la cola, Intensidad de la cola y el Momento de la cola (20), todos parametros relacionados con el grado de dano al ADN en cada celula. Para cuantificar el dano al ADN, se analizaron un total de 50 celulas por portaobjetos.
Los resultados de cada experimento se analizaron usando el test ANOVA de una via. Para todos los analisis el criterio de significancia fue establecido a p<0,05 y los valores promedio fueron comparados mediante el Tukey's post hoc test. Los calculos se realizaron usando un software GraphPad (GraphPad Instat) (21). El rendimiento celular y la viabilidad de las suspensiones celulares se evaluaron con una tincion dual con diacetato de 5-6-carboxifluoresceina y bromuro de etidio. La viabilidad celular despues de los tratamientos fue siempre mayor del 80%.
Reducción del Violeta de Genciana por ácido lipoico
Para ensayar la reduccion del GV por acido lipoico, a una absorbancia de 590 nm, se usaron dos soluciones stock de los compuestos: Violeta de Genciana (10-4 M) y acido lipoico (5 x 10-3 M), ambos en buffer Tris pH 7,5. Se tomaron alicuotas de estas soluciones hasta alcanzar las concentraciones del ensayo. Simultaneamente se realizaron los controles correspondientes .
Resultados
1) Efecto del Violeta de Genciana sobre parámetros del ensayo Cometa a 24 h y 48 h en sangre de rata.
Se midio el efecto del GV sobre la induccion de roturas en las hebras del ADN en celulas individuales, usando el ensayo Cometa alcalino, en sangre entera. Se observo que el GV condujo a un incremento significativo de la presencia de imagenes de Cometa a ambos periodos de tiempo en la sangre proveniente de las ratas Sprague Dawley usadas y la diferencia en todos los parametros determinados: Longitud de la cola, % ADN en la cola y el Momento de la cola fue aun mayor a 48 horas (Tabla I).
Tabla I. Efecto del Violeta de Genciana (GV) sobre parámetros del ensayo Cometa a 24 y 48 horas en sangre de rata*.

* A la sangre extraída de las ratas, se agregó GV, se dejó por 24 ó 48 horas y el ensayo Cometa se llevó a cabo según se describe en Métodos.
Los datos son el promedio ± DE. a p<0,001 cuando se compara con Control.
2) Efecto del á-tocoferol, ácido lipoico o N-acetil cisteína sobre los efectos inducidos por el Violeta de Genciana en parámetros del ensayo Cometa en sangre de rata a 24 h.
Se midio el efecto de diferentes dosis y tiempos de administracion de los tres antioxidantes, nuevamente usando el ensayo Cometa alcalino y midiendo el efecto sobre los tres diferentes parametros ya mencionados. Bajo las condiciones experimentales empleadas, la administracion previa de á-T previno de manera significativa pero solo moderada la accion genotoxica del GV (Tabla II).Mas efectivo que el á-T mostro ser el LA. En un experimento inicial se probo una dosis menor (125 mg/kg) y se extrajo sangre a las 3 horas despues de la administracion de LA. Luego se incremento la dosis de LA (550 mg/kg) y se obtuvo sangre a la media hora despues del tratamiento y asi el grado de efecto preventivo del LA fue aumentado significativamente y fue mas notable comparativamente que el del á-T (Tabla III).
Tabla II. Prevención por pretratamiento con á-tocoferol de los efectos inducidos por el Violeta de Genciana (GV) en parámetros del ensayo Cometa (en sangre de rata a 24 horas)*.
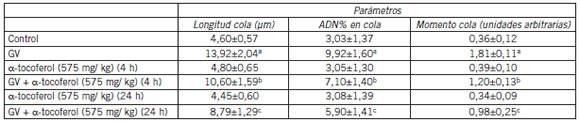
* Las ratas se trataron con á-T y se extrajo sangre a los dos tiempos indicados. El ensayo Cometa se llevó a cabo después de agregar GV a la sangre y dejar por 24 h según se describe en Métodos. Control se refiere a la sangre sin ninguna de las drogas. Los datos son el promedio ± DE.
El valor para la significancia del efecto total del tratamiento previo con á-T a los dos tiempos, obtenido por análisis de variancia fue p<0,001 para los tres parámetros medidos.
a p<0,001 cuando se compara con Control.
b p<0,001 cuando se compara con GV, c p<0,001 cuando se compara con GV.
Tabla III. Prevención por pretratamiento con ácido lipoico de los efectos inducidos por el Violeta de Genciana (GV) en parámetros del ensayo Cometa (en sangre de rata a 24 horas)*.

* Las ratas se trataron con LA a las dosis indicadas y se extrajo sangre a los dos tiempos indicados. El ensayo Cometa se llevó a cabo después de agregar GV a la sangre y dejar por 24 h según se describe en Métodos. Control se refiere a sangre sin ninguna de las drogas.
Los datos son el promedio ± DE.
El valor para la significancia del efecto total del tratamiento previo con LA a los dos tiempos y dosis, obtenido por análisis de variancia
fue p<0,001 para los tres parámetros medidos.
a p<0,001 cuando se compara con Control.
b p<0,001 cuando se compara con GV.
c p<0,001 cuando se compara con GV.
De manera interesante el NAC a una dosis de 2000 mg/kg y extrayendo sangre despues de 30 min, probo ser mas efectivo que el á-T o el LA, previniendo el efecto del GV en un 55% (Tabla IV).
Tabla IV. Prevención por pretratamiento con N-acetil cisteína (NAC) de los efectos inducidos por el Violeta de Genciana (GV) en parámetros del ensayo Cometa (en sangre de rata a 24 horas)*.
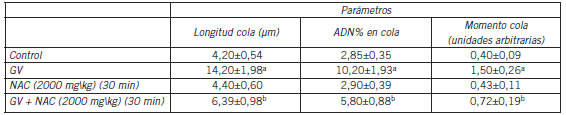
* Después de tratar las ratas con NAC a la dosis indicada la sangre se extrajo a la media hora, y el ensayo Cometa se llevó a cabo después de agregar GV a la sangre y dejar por 24 h según se describe en Métodos. Control se refiere a la sangre sin ninguna de las drogas. Los datos son el promedio ± DE.
El valor para la significancia del efecto total del tratamiento previo con NAC obtenido por análisis de variancia fue p<0,001 para los tres parámetros medidos.
a p<0,001 cuando se compara con Control.
b p<0,001 cuando se compara con GV.
3) Reducción del Violeta de Genciana por ácido lipoico.
Se observo que midiendo el efecto del acido lipoico sobre la absorbancia del GV a 590 nm, hay una disminucion marcada de la misma, que indica un efecto directo quimico destructivo y significativo sobre el GV (Fig. 1).

Figura 1. Reducción del Violeta de Genciana por ácido lipoico.
Se tomaron alícuotas de dos soluciones stock de los compuestos en buffer Tris pH 7,5 y se midió la absorbancia a 590 nm.
Discusión y Conclusiones
El uso de GV, primero informado por Nussenzweig et al. ya en 1953, fue indicado en areas endemicas carecientes de controles o bajo circunstancias de emergencia cuando el control no esta disponible cuando se necesita (22). El GV es capaz de eliminar el parasito en 24 horas (3)(8)(9).
El agregado de Violeta de Genciana tiene aun vigencia como modo de asegurar transfusiones en zonas endemicas, particularmente en emergencias importantes cuando el numero de dadores de sangre es critico. Asi lo senala explicitamente el Ministerio de Salud y Medio Ambiente de Argentina en su "Guia para la atencion del paciente infectado con Trypanosoma cruzi (Enfermedad de Chagas)". Este texto fue elaborado en 2005 y aprobado por Resolucion Ministerial No 1870 del 29/11/2006. En su texto, en el punto 5.1.4 senala: "En las zonas endemicas en las cuales el numero de dadores es critico y/o para casos de emergencia se recomienda mantener un stock permanente de sangre tratada con cristal violeta en una concentracion final de 125 mg por cada 500 cc a ser utilizada, como minimo, despues de 24 horas de tratamiento". I
dealmente lo conveniente es usar en transfusiones sangre libre de T. cruzi. Esa situacion no siempre se da en zonas endemicas y menos aun si la necesidad se da durante una emergencia grave (ej. terremotos, conflictos, accidentes importantes, etc.). No es facil, en esos casos, en zonas endemicas disponer de suficientes donantes sanos y en cantidad.
Sin embargo, la administracion intravenosa de GV causa depresion en el numero de globulos blancos (10). Ademas, se conoce que el GV es un mutageno, un toxico mitotico y un clastogeno. Estas conclusiones se obtuvieron al ensayar el GV con cepas de Salmonella typhimurium TA97 y TA104 (11) o ensayando su toxicidad citogenetica en celulas de hamster chino (CHO) (11)(23) . Este compuesto tambien se mostro que es carcinogenico para ratones macho y hembra de la cepa B6C3F1 (11).
En los presentes estudios se observaron efectos genotoxicos del GV en leucocitos de la sangre empleando el ensayo Cometa. Este ensayo es capaz de detectar con alta sensibilidad la produccion de bases hidroxiladas del ADN resultantes de un ataque por estres oxidativo (24). El efecto fue ensayado a 24 y 48 horas (Tabla I). El GV condujo a un incremento significativo de la presencia de imagenes de cometa a ambos tiempos en la sangre proveniente de las ratas Sprague Dawley usadas y la diferencia en todos los parametros determinados resulto aun mayor a las 48 horas. Estos resultados pueden tomarse como indicativos de que el GV puede tambien alterar el ADN proveniente de leucocitos de la sangre del individuo receptor despues de la transfusion para producir bases de ADN hidroxiladas. Si este proceso es suficientemente intenso, los leucocitos podrian morir, y esto explicaria la depresion en el conteo de los globulos blancos (10). Si, en cambio, este proceso es menos intenso y el dano no es reparado y ocurre en el ADN, pueden resultar celulas transformadas como resultado de la transfusion. En el presente trabajo se intento prevenir estos efectos genotoxicos del GV en el individuo receptor usando algunos antioxidantes como el á-tocoferol, el acido lipoico o N-acetil cisteina. Las bases racionales de esta estrategia se basan en el conocimiento de que los efectos daninos del GV se consideran vinculados a su capacidad para generar especies reactivas del oxigeno (ROS) capaces de danar no solo al ADN sino tambien proteinas y lipidos (10). Los antioxidantes se sabe que son capaces de bloquear los efectos pro-oxidantes daninos iniciados por los ROS (25)(26). Los tres antioxidantes seleccionados tienen uso aceptado clinicamente para prevenir o tratar efectos daninos de diversos compuestos mediados por ROS (25-27).
Estos ensayos solo pretenden evidenciar que estos antioxidantes son capaces de bloquear total o parcialmente los efectos genotoxicos del GV sobre los leucocitos. No significa que se pretenda tratar al donante con ellos antes de donar. Solo ilustran lo que sucederia en el receptor al recibirlo frente al GV que incorporo con la sangre tratada con este compuesto en las bolsas de transfusion.
Bajo las condiciones experimentales empleadas en el presente trabajo, la administracion previa de á-T previno de manera significativa pero solo moderada la accion genotoxica del GV (Tabla II). Mas efectivo que el á-T mostro ser el LA (Tabla III). En un experimento inicial se ensayo una dosis menor (125 mg/kg), extrayendo la sangre a las 3 horas despues de la administracion de LA. Luego se incremento la dosis de LA (550 mg/kg) y se obtuvo la sangre justo a la media hora despues resultando que el grado de los efectos preventivos del LA aumento significativamente. Es importante considerar que el LA, en contraste con el á-T, es degradado rapidamente bajo las condiciones in vivo (17).
El LA, sin embargo, tiene un beneficio adicional. En efecto, pudo observarse un efecto directo quimico destructivo y significativo sobre el GV (Fig. 1). Este comportamiento podria tener un significado practico importante si el LA se utilizara para bloquear los efectos mutagenicos potenciales del GV en el individuo receptor. El GV remanente presente despues de 24 horas de la accion tripanosomicida en la sangre del donante podria ser destruido por el LA no toxico antes de la transfusion pero tambien el LA podria administrarse al individuo receptor de la sangre antes de la transfusion. Ambos procedimientos pueden producir alternativamente un efecto preventivo por el LA (administrado bajo las formas farmaceuticas disponibles oxidadas) in vivo, atribuible a su rapida transformacion a la forma de acido dihidrolipoico (26). Esta forma reducida es un agente reductor poderoso capaz de regenerar á-T y tambien acido ascorbico, y esta propiedad esta ligada a la presencia de dos grupos sulfhidrilo vecinos presentes en su molecula (25)(26).
La interesante capacidad de este antioxidante que contiene grupos SH para prevenir la mutagenicidad del GV y para destruir quimicamente cualquier remanente de GV en la sangre posterior a la accion tripanosomicida llevo a ensayar el NAC para ver si este tenia un efecto potencial preventivo. El NAC es un antioxidante efectivo, contiene un grupo SH libre y es una fuente adecuada de niveles de glutation (GSH) en los tejidos(25) (26). Es menos toxico que el aminoacido relacionado cisteina y puede ser administrado ya sea oralmente o iv (26). A la dosis y tiempo empleados el NAC probo ser mas efectivo que el á-T o el LA (Tabla IV).
Todos estos experimentos preliminares abren la posibilidad de ofrecer una respuesta a los efectos que varios estudios previos mostraron concernientes a las acciones linfopenicas, mutagenicas y carcinogenicas del GV, cuando se lo usa como tripanosomicida durante la transfusion sanguinea en areas o circunstancias donde el control de la sangre no es posible. En efecto, existe la posibilidad de que despues de las 24 horas de exposicion de la sangre al GV necesarias para eliminar al T. cruzi, se efectue ya sea el agregado de LA o de NAC a la misma o la administracion de LA o de NAC al individuo receptor de la sangre. Existe tambien la posibilidad de hacer ambas cosas. Todas estas alternativas deben ser ensayadas rigurosamente porque la utilizacion del GV tiene la ventaja de poseer una interesante historia de uso para evitar la transmision de la enfermedad de Chagas por transfusion, que merece ser considerada cuando el control previo de la sangre o su disponibilidad no es factible.
Es conveniente en este punto analizar las potenciales ventajas, desventajas y dificultades para una eventual aplicacion practica de estas propuestas y compararlas con la realizacion de serologia rapida ej. por inmunocromatografia (IC) que permitiria excluir de transfusiones la sangre tratada (ver ej WL Check Chagas de Laboratorios Wiener).
1) La tecnica IC seria util para excluir dadores de sangre infectada con T. cruzi. En zonas endemicas por Chagas (o que lo han sido por anos) puede haber importante cantidad de personas con sangre infectada aunque los vectores hayan sido controlados. Se perderia una cantidad importante de dadores en momentos de alta necesidad.
2) Un resultado negativo por la tecnica IC no excluye la posibilidad de infeccion por T. cruzi. Se puede obtener un resultado falso negativo en muestras con niveles bajos de anticuerpos anti T. cruzi.
3) Pueden obtenerse resultados falsos positivos en las siguientes situaciones: enfermedades autoinmunes, tuberculosis, lupus eritematoso sistemico, embarazo, vacunacion contra hepatitis B y otras inmunizaciones, hemodialisis, enfermedad hepatica, otras parasitosis como leishmaniasis y otras enfermedades infecciosas diferentes a Chagas (HIV, HTLV, hepatitis C, hepatitis B, sifilis, etc.). Existen algunos datos aun limitados sobre estas interferencias. Estos falsos positivos conducirian a su vez a eliminar muestras utiles potencialmente, cosa que no ocurriria de usar como biocida al GV. De hecho se requiere ejecutar otros dos ensayos adicionales para confirmar.
4) Lo deseable para trabajo rapido es obtener sangre entera capilar. Ello implica tener que realizar la prueba inmediatamente. Si se empleara otro metodo de obtencion de sangre o suero o plasma (ej. puncion venosa), dificultaria la posibilidad de efectuar estos ensayos en situaciones de campo y se agregarian mas tiempos al proceso.
5) La ejecucion correcta y confiable del procedimiento debiera estar a cargo de un bioquimico o un laboratorista calificado y entrenado en la ejecucion e interpretacion concreta. Ello agrega complejidad al manejo de la emergencia.
6) Cada ensayo requiere leer los resultados entre los 25 y 35 minutos (despues de los 35 minutos pueden obtenerse resultados erroneos).
7) Muy recientemente Rodrigues Coura y Borges-Pereira explicitamente senalaron la gran necesidad de la existencia de un test rapido con alta sensibilidad, especificidad y estabilidad para ser empleado en condiciones de campo y en bancos de sangre en casos de emergencias en distintas areas geograficas en las cuales existen diferentes cepas y clones de T. cruzi circulando y esta necesidad no esta satisfecha aun (28).
Se concluye que es totalmente factible que cuando este tipo de tecnicas de diagnostico rapido sean aun mas rapidas, mas especificas y menos dependientes de personal calificado y que los bancos de sangre en todas las zonas (endemicas y no-endemicas) dispongan de suficiente material en emergencias, estos procedimientos reemplazaran al antiguo pero probadamente eficaz procedimiento que emplea GV. La administracion al receptor de antioxidante o su adicion a la sangre a transfundir despues de las 24 horas necesarias para eliminar al T. cruzi, podria mejorar el procedimiento que emplea solo GV.
Agradecimientos
Este trabajo fue apoyado economicamente por el Consejo Nacional de Investigaciones Cientificas y Tecnologicas (CONICET) y la Universidad Nacional de General San Martin (UNSAM).
Referencias bibliográficas
1. Coura JR, Dias JC. Epidemiology, control and surveillance of Chagas´ disease: 100 years after its discovery. Mem Inst Oswaldo Cruz 2009; 104 Suppl 1: 31-40. [ Links ]
2. Schmunis GA, Cruz JR. Safety of the blood supply in Latin America. Clin Microbiol 2005; 18: 12-29. [ Links ]
3. Moraes-Souza H, Bordin JD. Strategies for prevention of transfusion - associated Chagas' disease. Tranfus Med Revs 1996; 10: 161-70. [ Links ]
4. Flores-Chávez M, Fernández B, Puente S, Torres P, Rodríguez M, Monedero C, et al. Transfusional Chagas´ disease: parasitological and serological monitoring of an infected recipient and blood donor. Clin Infect Dis 2008; 46: e44-7. [ Links ]
5. Leiby DA, Herron Jr RM, Garratty G, Herwaldt BL. Tripanosoma cruzi parasitemia in US blood donors with serologic evidence of infection. J Infect Dis 2008; 198: 609-13. [ Links ]
6. Lescure MA, Jacques C, Guillon P, Maggioni S, Fattacioli MC, Mussat T. T Ending the heart transplanted patient. Soins 2008; 727: 31-3. [ Links ]
7. Manzardo C, Treviño B, Gómez i Prat J, Cabezos J, Monguí E, Clavería I, et al. Communicable diseases in the immigrant population attended to in a tropical medicine unit: epidemiological aspects and public health issues. Travel Med Infect Dis 2008; 6: 4-11. [ Links ]
8. Moncayo A, Silveira AC. Current epidemiological trends for Chagas disease in Latin America and future challenges in epidemiological surveillance and health policy. Mem Inst Osvaldo Cruz 2009; 104 (Suppl. 1): 17-30. [ Links ]
9. WHO. Special programme for Research and Training in Tropical Diseases. Meeting on development on trypanocidal compounds for sterilization of blood TDR/CHA/BS/84 1984; 3: 1-14.
10. Docampo R, Moreno SN. The metabolism and mode of action of gentian violet. Drug Metab Rev 1990; 22: 161-78. [ Links ]
11. Littlefield NA, Blackwell BN, Hewitt CC, Gaylor DW. Chronic toxicity and carcinogenicity studies of Gentian Violet in mice. Fundam Appl Toxicol 1985; 5: 902-12. [ Links ]
12. Aidoo A, Gao N, Neft RE, Schol HM, Hass BS, Minor TY et al. Evaluation of the genotoxicity of gentian violet in bacterial and mammalian cell systems. Teratog Carcinog Mutagen 1990; 10: 449-62. [ Links ]
13. Bernacchi AS, Franke De Cazzulo B, Castro JA. Trypanocidal action of 2,4-dichloro-6-phenylphenoxyethyl diethylamine hydrobromide (Lilly 18947.on Trypanosoma cruzi. Acta Pharmacol Sin 2002; 23: 399-404. [ Links ]
14. Esteva M, Ruiz AM, Stoka AM. Trypanosoma cruzi: methoprene is a potent agent to sterilize blood infected with trypomastigotes. Exp Parasitol 2002; 100: 248-51. [ Links ]
15. Franke de Cazzulo BM, Bernacchi A, Esteva MI, Ruiz AM, Castro JA, Cazzulo JJ. Trypanocidal effect of SKF525A, proadifen, on different developmental forms of Trypanosoma cruzi. Medicina (Buenos Aires) 1998; 58: 415-8. [ Links ]
16. Castro JA, Sasame H, Sussman JR, Gillette JR. Diverse effects of SKF 525A and antioxidants on CCl4-induced changes in liver microsomal P-450 content and ethylmorphine metabolism. Life Sci 1968; 7: 129-36. [ Links ]
17. Cremer DR, Rabeler R, Roberts A, Lynch B. Safety evaluation of á-lipoic acid (ALA). Regul Toxicol Pharmacol 2006; 46: 29-41. [ Links ]
18. Valles EG, de Castro CR, Castro JA. N‑acetyl cysteine is an early but also a late preventive agent against Carbon Tetrachloride‑induced liver necrosis. Toxicol Lett 1994; 71: 87‑95. [ Links ]
19. Singh NP, McCoy MT, Tice RR, Schneider EL. A simple technique for quatification of low levels of DNA damage in individual cells. Exp Cell Res 1998; 175: 184-91. [ Links ]
20. Olive PL, Banath JP, Durand RE. Heterogeneity in radiation- induced DNA damage and repair in tumor and normal cells using the comet assay. Radiat Res 1990; 122: 86-94. [ Links ]
21. Gad SC. Statistics for toxicologists. En: AW Hayes (Ed.), Principles and Methods in Toxicology. Philadelphia Taylor and Francis; 2001, pp. 285-364.
22. Nussenzweig V, Sonntag R, Biancalana A, De Freitas JP, Amato Neto V, Kloetzel J. Action of certain dyes on T. cruzi in vitro. The use of gentian violet to prevent the transmission of Chagas' disease by blood transfusion. Hospital 1953; 44: 731-44. [ Links ]
23. Au W, Pathak S, Collie CJ, Hsu TC. Cytogenetic toxicity of Gentian Violet and Crystal Violet on mammalian cells in vitro. Mutat Res 1978; 58: 269-76. [ Links ]
24. Hartman A, Agurell E, Beevers C, Brendler- Schwaab S, Burlinson B, Clay P, et al. Recommendations for conducting the in vivo alkaline Comet Assay. Mutagenesis 2003; 18: 45-51. [ Links ]
25. Flora SJ. Structural, chemical and biological aspects of antioxidants for strategies against metal and metalloid exposure. Oxid Med Cell Longev 2009; 2: 191-206. [ Links ]
26. Flora SJ. Arsenic-induced oxidative stress and its reversibility. Free Radic Biol Med 2011; 51: 257-81. [ Links ]
27. Kanter MZ. Comparison of oral and i.v. acetylcysteine in the treatment of acetaminophen poisoning. Am J Health Syst Pharm 2006; 63: 1821-7. [ Links ]
28. Rodrigues Coura J, Borges-Pereira J. Chagas disease. What is known and what should be improved: a systemic review. Rev Soc Bras Med Trop 2012; 45 (3): 286-96. [ Links ]
Aceptado para su publicación el 16 de agosto de 2013














