Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957
Acta bioquím. clín. latinoam. vol.47 no.4 La Plata dic. 2013
TEMAS DE INTERES
Guías de práctica del laboratorio clínico
Uso de marcadores tumorales en cáncer de testículo, próstata, colorrectal, mama y ovario
Capítulo 5
EDITADO POR
Catharine M. Sturgeon
Eleftherios P. Diamandis
Catharine M. Sturgeon
Department of Clinical Biochemistry, Royal Infirmary of Edinburgh, Edinburgh, Reino Unido.
Michael J. Duffy
Department of Pathology and Laboratory Medicine, St Vincent's University Hospital and UCD School of Medicine and Medical Science, Conway Institute of Biomolecular and Biomedical Research, University College Dublin, Dublin, Irlanda.
Ulf-Håkan Stenman
Department of Clinical Chemistry, Helsinki University Central Hospital, Helsinki, Finlandia.
Hans Lilja
Departments of Clinical Laboratories, Urology and Medicine, Memorial Sloan-Kettering Cancer Center, New York, NY 10021.
Nils Brünner
Section of Biomedicine, Department of Veterinary Pathobiology, Faculty of Life Sciences, University of Copenhagen, Dinamarca.
Daniel W. Chan
Departments of Pathology and Oncology, Johns Hopkins Medical Institutions, Baltimore, MD.
Richard Babaian
Department of Urology, The University of Texas M. D. Anderson Cancer Center, Houston, TX.
Robert C. Bast, Jr
Department of Experimental Therapeutics, University of Texas M. D. Anderson Cancer Center, Houston, TX.
Barry Dowell
Abbott Laboratories, Abbott Park, IL.
Francisco J. Esteva
Departments of Breast Medical Oncology, Molecular and Cellular Oncology, University of Texas M. D. Anderson Cancer Center, Houston, TX.
Caj Haglund
Department of Surgery, Helsinki University Central Hospital, Helsinki, Finlandia.
Nadia Harbeck
Frauenklinik der Technischen Universität München, Klinikum rechts der Isar, Munich, Alemania.
Daniel F. Hayes
Breast Oncology Program, University of Michigan Comprehensive Cancer Center, Ann Arbor, MI.
Mads Holten-Andersen
Section of Biomedicine, Department of Veterinary Pathobiology, Faculty of Life Sciences, University of Copenhagen, Dinamarca.
George G. Klee
Department of Laboratory Medicine and Pathology, Mayo Clinic College of Medicine, Rochester, MN.
Rolf Lamerz
Department of Medicine, Klinikum of the University Munich, Grosshadern, Alemania.
Leendert H. Looijenga
Laboratory of Experimental Patho-Oncology, Erasmus MC-University Medical Center Rotterdam, and Daniel den Hoed Cancer Center, Rotterdam, Holanda.
Rafael Molina
Laboratory of Biochemistry, Hospital Clinico Provincial, Barcelona, España.
Hans Jørgen Nielsen
Department of Surgical Gastroenterology, Hvidovre Hospital, Copenhagen, Dinamarca.
Harry Rittenhouse
Gen-Probe Inc, San Diego, CA.
Axel Semjonow
Prostate Center, Department of Urology, University Clinic Muenster, Muenster, Alemania.
Ie-Ming Shih
Departments of Pathology and Oncology, Johns Hopkins Medical Institutions, Baltimore, MD.
Paul Sibley
Siemens Medical Solutions Diagnostics, Glyn Rhonwy, Llanberis, Gwynedd, Reino Unido.
György Sölétormos
Department of Clinical Biochemistry, Hillerød Hospital, Hillerød, Dinamarca.
Carsten Stephan
Department of Urology, Charité Hospital, Universitätsmedizin Berlin, Berlin, Alemania.
Lori Sokoll
Departments of Pathology and Oncology, Johns Hopkins Medical Institutions, Baltimore, MD.
Barry R. Hoffman
Department of Pathology and Laboratory Medicine, Mount Sinai Hospital, and Department of Laboratory Medicine and Pathobiology, University of Toronto, Ontario, Canadá.
Eleftherios P. Diamandis
Department of Pathology and Laboratory Medicine, Mount Sinai Hospital, and Department of Laboratory. Medicine and Pathobiology, University of Toronto, Ontario, Canadá.
Copyright © 2011 by the American Association for Clinical Chemistry, Inc and the American Diabetes Association. Todos los derechos reservados. The National Academy of Clinical Biochemistry Board of Directors aprobó este documento (PID 6278) en enero de 2011.
La NACB es la Academia de la Asociación Norteamericana de Bioquímica Clínica.
Este documento ha sido traducido con permiso de la National Academy of Clinical Biochemistry (NACB).
La NACB no se hace responsable de la exactitud de la traducción. Los puntos de vista presentados son los de los autores y no necesariamente los de la NACB.
Tabla de Contenidos
1. Introducción
2. Marcadores Tumorales en Cáncer de Testículo
3. Marcadores Tumorales en Cáncer de Próstata
4. Marcadores Tumorales en Cáncer Colorrectal
5. Marcadores Tumorales en Cáncer de Mama
6. Marcadores Tumorales en Cáncer de Ovario
Referencias
Agradecimientos
Apéndice
Capítulo 5
Marcadores tumorales en cáncer de mama
Michael J. Duffy, Francisco J. Esteva, Nadia Harbeck, Daniel F. Hayes y Rafael Molina
Antecedentes
El cáncer de mama es el tipo de cáncer más común que afecta a mujeres de todo el mundo con aproximadamente un millón de casos nuevos que se diagnostican cada año (327). En 2007 se diagnosticó un número estimado de 180.000 mujeres con cáncer de mama en los Estados Unidos y aproximadamente 41.000 murieron a causa de esta enfermedad (118). En la actualidad, hay más de 2 millones de mujeres en los Estados Unidos que conviven con una historia de cáncer de mama (328). Mientras que la incidencia mundial de la enfermedad parece ser creciente, las tasas de mortalidad están decreciendo en algunos países occidentales, entre los que se encuentran Estados Unidos y el Reino Unido (329).
Los principales síntomas que presentan las mujeres con cáncer de mama sintomático son un bulto en la mama, cambios o secreciones en los pezones, y cambios en el contorno de la piel de los pezones. Un diagnóstico definitivo requiere de una biopsia y un análisis histopatológico. Los biomarcadores sanguíneos que se encuentran actualmente disponibles no tienen valor en el diagnóstico temprano del cáncer de mama.
El tratamiento primario para cáncer de mama localizado es la cirugía conservadora de mama y radiación o la mastectomía. Luego de un tratamiento primario, la mayoría de las mujeres con cáncer de mama reciben terapia adyuvante como quimioterapia, terapia hormonal o una combinación de ambas. Tanto la quimioterapia adyuvante como la terapia hormonal han demostrado reducir la recurrencia sistémica y la mortalidad por cáncer de mama (330). Por ejemplo, un meta-análisis de aproximadamente 145.000 mujeres que participaron en 194 pruebas aleatorias de terapia sistémica adyuvante concluyeron que la poliquimioterapia basada en la antraciclina reducía la tasa anual de mortalidad por cáncer de mama en 38% para mujeres menores de 50 años de edad al ser diagnosticadas, y en 20% para mujeres de 50 a 69 años también al ser diagnosticadas (330). Para pacientes positivos para receptores de estrógeno (ER), 5 años de tamoxifeno adyuvante redujeron las tasas anuales de cáncer de mama en 31% (330). Sin embargo, los pacientes con tumores ER negativos no se beneficiaron con el tamoxifeno adyuvante (331).
Debido a que no todos los pacientes con cáncer de mama pueden necesitar tratamiento adyuvante [por ej. aproximadamente 70% de las pacientes con ganglios linfáticos negativos se curan con cirugía y radioterapia (332)] y no todas las pacientes se benefician con este tratamiento, el manejo racional requiere que se disponga de marcadores pronósticos y predictivos. Las recomendaciones con relación al uso de los marcadores pronósticos y predictivos actualmente disponibles se discuten más abajo.
Luego de la terapia primaria, las pacientes con un diagnóstico de cáncer de mama usualmente reciben seguimiento a intervalos regulares. Históricamente, en la vigilancia se han incluido la historia clínica, el examen físico, mamografías, radiografías torácicas, pruebas de laboratorio y el uso de marcadores tumorales. Esta práctica se basa en el supuesto de que la detección temprana de enfermedad recurrente da lugar a un mejor resultado. Sin embargo, en la actualidad, no está claro cuál es el beneficio clínico de una vigilancia estrecha (333).
A pesar de que la terapia adyuvante mejora el resultado en los pacientes, del 25% al 30% de las mujeres con enfermedad con ganglios linfáticos negativos y al menos del 50% al 60% de aquellas con enfermedad con ganglios linfáticos positivos desarrollan enfermedad recurrente o metastásica (334). Entre las opciones de terapia para el cáncer de mama metastásico se encuentran la quimioterapia (por ej. basada en la antraciclina o el taxano), la terapia hormonal o las terapias dirigidas como el trastuzumab (Herceptina; Genentech, South San Francisco, CA), el lapatinib, o el bevacizumab, solos o combinados con quimioterapia (334)(335). En la actualidad, el cáncer de mama metastásico es considerado incurable y por lo tanto el objetivo del tratamiento es generalmente paliativo. Dentro de este contexto, el uso de niveles seriales de marcadores tumorales en suero es potencialmente útil para decidir el uso de un tipo particular de terapia, concluir su uso, o cambiar a una terapia alternativa.
Sobre la base de lo anteriormente presentado, está claro que el tratamiento óptimo de los pacientes con cáncer de mama requiere del uso de una serie de marcadores tumorales. El objetivo de este Capítulo es presentar las nuevas guías de la NACB sobre el uso de los marcadores tumorales tanto séricos como tisulares. También se ofrece un resumen de las guías publicadas por otros paneles de expertos sobre este tema.
Para preparar estas guías, se revisó la literatura relevante al uso de los marcadores tumorales en cáncer de mama. Se le prestó particular atención a las revisiones que incluyen revisiones sistemáticas, pruebas prospectivas aleatorias que incluían el uso de marcadores y guías emitidas por los paneles de expertos. Cada vez que fue posible, las recomendaciones de consenso del panel de la NACB estuvieron basadas en la evidencia disponible (es decir, estaban basadas en la evidencia).
Marcadores para cáncer de mama disponibles actualmente
La Tabla 11 presenta en una lista los marcadores tumorales séricos y tisulares más ampliamente investigados. También se presenta la fase de desarrollo de cada marcador así como el LOE para su uso clínico.
Tabla 11. Marcadores útiles y potencialmente útiles para cáncer de mama


Tabla 11. Marcadores útiles y potencialmente útiles para cáncer de mama (Continuación)

Abreviaturas: TPA, antígeno polipéptido tisular; TPS, antígeno específico polipéptido tisular; CMF: ciclofosfamida, metrotrexato, 5-fluorouracil; IHC, inmunohistoquímica; RT-PCR, reacción en cadena de la polimerasa con transcriptasa inversa.
*LOE (120): nivel 1, evidencia de un estudio único, controlado, de alto poder y controlado que está diseñado específicamente para realizar una prueba sobre el marcador o una evidencia de un meta-análisis, análisis conjunto o visión general de estudios nivel II ó III; evidencia de un estudio en el que los datos del marcador están determinados en relación a una prueba terapéutica prospectiva que se realiza para controlar hipótesis terapéutica pero no diseñado específicamente para probar la utilidad del marcador; nivel III, evidencia de grandes estudios prospectivos; nivel IV, evidencia de pequeños estudios retrospectivos; nivel V, evidencia de pequeños estudios piloto.
**Este efecto puede deberse a la amplificación del gen topoisomerasa IIa(619)(620) .
Marcadores tumorales en cáncer de mama: recomendaciones de la NACB
La Tabla 12 presenta un resumen de las recomendaciones de distintos paneles de expertos sobre el uso de marcadores tumorales en cáncer de mama. Esta Tabla también sintetiza las guías de la NACB acerca del uso de marcadores en este tipo de cáncer. Más abajo, se presenta una discusión mucho más detallada acerca de los marcadores con más utilidad clínica enumerados en la Tabla 12.
Tabla 12. Recomendaciones para el uso de marcadores en cáncer de mama por diferentes grupos de expertos
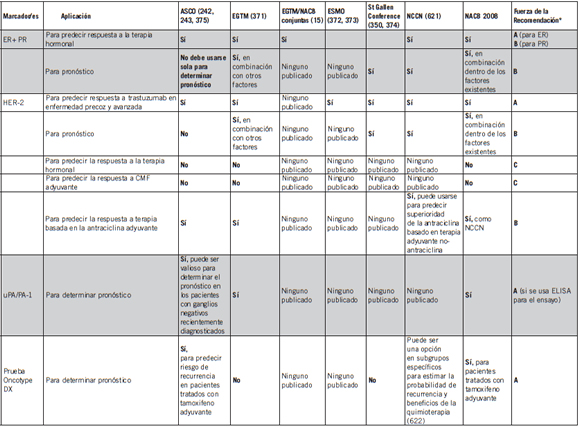

Abreviaturas. ASCO, American Society of Clinical Oncology; EGTM, European Group on Tumor Markers; NACB, National Academy of Clinical Biochemistry, ESMO, European Society of Clinical Oncology; NCCN, National Comprehensive Cancer Network; NR, ninguna recomendación publicada; CGSC, Cancer Genetics Studies Consortium and US Preventive Services Task Force.
* Fuerza de la Recomendación (520): A = Alta [Mayor investigación es muy improbable que cambie nuestra confianza en la estimación del efecto]; B = Moderado [Mayor investigación es probable que tenga una impacto importante sobre nuestra confianza en la estimación del efecto y es probable que cambie la estimación; C = Baja [[Mayor investigación es muy probable que tenga un efecto importante en nuestra confianza en la estimación del efecto y es probable que cambie la estimación; D = Muy baja [Cualquier estimación del efecto es muy incierta].
** Las recomendaciones establecen los marcadores tumorales sin referir a marcadores específicos.
Receptores de Estrógenos y Progesterona
Todos los paneles de expertos de la ASCO, la EGTM, la European Society of Medical Oncology, y el St Gallen Conference Consensus Panel han recomendado el ensayo de rutina de los receptores de estrógeno (ER; es decir ER-á) y los receptores de progesterona (PR) en todos los cánceres de mama con diagnóstico reciente (Tabla 12). El Panel de la NACB coincide con estas recomendaciones. El objetivo primario de la determinación de ER y PR es seleccionar para una probable respuesta a la terapia endócrina, tanto en pacientes con cáncer de mama precoz como avanzado. Asimismo, en combinación con otros factores, los ER y PR también pueden usarse con fines pronósticos. Sin embargo, como predictores de resultado de los pacientes, los receptores de hormonas son factores relativamente débiles y tienen poco valor clínico en los pacientes negativos para ganglios linfáticos. Los receptores de hormonas por consiguiente no deben usarse solos para la determinación del resultado en el cáncer de mama. Sin embargo, en combinación con los factores pronósticos establecidos, los receptores de hormona pueden usarse para predecir el riesgo de recurrencia. La determinación de ER-beta no tiene aplicación clínica en la actualidad.
Ensayo recomendado para ER y PR
El ER (es decir, ER-a) y el PR se pueden medir por ensayo de unión del ligando, ELISA o inmunohistoquímica. En la Tabla 13 se sintetizan las ventajas y desventajas de estos diferentes ensayos. Es importante notar que la mayoría de los datos clínicos relativos tanto a ER como a PR se derivaron de ensayos bioquímicos (unión del ligando y ELISA). Sin embargo, algunos informes recientes han demostrado que la determinación inmunohistoquímica de ER ofrece información clínica como mínimo tan poderosa como la que se obtiene con los ensayos bioquímicos (336-341). De hecho, un informe resaltó que el uso de la inmunohistoquímica para determinar ER era superior al uso de los ensayos bioquímicos para predecir una respuesta a la terapia (336). Si se lo compara con el ER, existen menos datos disponibles acerca del valor de PR, tal como lo determina la inmunohistoquímica (341-343).
Tabla 13. Ventajas y desventajas de los diferentes ensayos para receptores de hormonas

Abreviaturas: ELISA, ensayo de inmunoabsorción ligado a la enzimas; ER, receptor de estrógenos.
*En tumores que les fueron extirpados a pacientes que reciben tamoxifeno, cuando los niveles endógenos de ligando esteroide son altos, o cuando se encuentra presente insuficiente cáncer de mama en la masa tisular.
Como con el ER, el poder predictivo de PR determinado por la inmunoquímica parece ser superior al que se obtuvo usando ensayos de unión de ligandos (343). Debido a esta facilidad en el uso y aplicación para una amplia variedad de tumores (por Ej, tumores pequeños, así como tumores grandes y tejido en parafina y tejido congelado), el panel de la NACB recomienda el uso de IHC para la determinación tanto de ER como de PR.
Se deben tener en cuenta los siguientes puntos al determinar ER y PR por inmunohistoquímica. Debería haberse demostrado que los ensayos inmunohistoquímicos usados den valores que se correlacionan con los ensayos bioquímicos y deberían ser validados tanto para fines predictivos como pronósticos. Entre los anticuerpos validados se incluyen el 6F11 MAb (Novocastra, Burlingame, CA, y Newcastle, Reino Unido) o el anticuerpo ID5 (Dako, Glostrup, Dinamarca) para ER y anticuerpo 1A6 (Novocastra), PR88 (Biogenex, Menarini Diagnostics, Finch-Hampstead, Berkshire, Reino Unido) o el anticuerpo monoclonal 1294 (Dako, Glostrup, Dinamarca) para PR (336)(337)(343-345). En cada examen se deberían incluir controles internos. Previamente se ha recomendado un control tisular por células cancerígenas receptoras positivas y células epiteliales benignas adyacentes (345).
Es esencial la participación en un Programa de Evaluación Externa de la Calidad (PEEC) (344)(345). La puntuación de tinción puede basarse tanto en el porcentaje de tinción celular como en una combinación del porcentaje de tinción celular más la intensidad de la tinción. Se debería informar una puntuación semi-cuantitativa en lugar de un valor negativo o positivo (344) (345). Es importante decir que se ha informado que los pacientes con niveles de ER bajos (por Ej. tinción en 1% a 10% de las células) responden a la terapia endócrina (336). Sólo se debe evaluar la tinción nuclear. El informe debe mencionar la fuente de anticuerpos primarios así como el tipo de tejido usado (por Ej., en parafina o congelado) (345).
Recomendación 1 del Panel de Cáncer de Mama DE La NACB: ER y PR como Marcadores Predictivos y Pronósticos
ER y PR deben medirse en todos los pacientes con cáncer de mama. El objetivo primario que tiene la medición de estos receptores es identificar a los pacientes con cáncer de mama que pueden ser tratados con terapia hormonal [LOE, I; SOR, A]. En combinación con los factores pronósticos establecidos (es decir, estadio del tumor, grado del tumor y número de metástasis de ganglios linfáticos), el ER y el PR también pueden usarse para determinar pronóstico en el corto plazo en los pacientes con cáncer de mama recientemente diagnosticado [LOE, III; SOR, B].
HER-2 (c-erbB-2)
De acuerdo con el ASCO (243), un panel conjunto de ASCO/CAP (346) y de la NCCN (347), el panel de la NACB también recomienda la determinación de HER-2 en todos los pacientes recientemente diagnosticados con cáncer de mama invasivo (Tabla 12). En la actualidad, el propósito primario de la determinación de HER-2 es seleccionar a los pacientes que pueden ser tratados con trastuzumab tanto en cáncer de mama precoz como avanzado. En combinación con otros factores, el HER-2 también puede ser usado para determinar el pronóstico. Existen en la actualidad insuficientes datos para recomendar HER-2 como predictor de una respuesta a la terapia endocrina adyuvante o a la ciclofosfamida, el metotrexato, y la quimioterapia adyuvante basada en 5-fluorouracil (CMF) (243), (348-351). Sin embargo, el HER-2 puede usarse para predecir la superioridad de la quimioterapia adyuvante basada en la antraciclina por sobre CMF (243) (348-350) (352). En la actualidad existen insuficientes datos disponibles para recomendar el uso de rutina de la prueba de HER-2 en suero. Sin embargo, hallazgos preliminares sugieren que el HER-2 en suero puede ser valioso para el control de los pacientes con cáncer de mama avanzado que estén bajo tratamiento con trastuzumab (353).
Ensayos recomendados para HER-2
Se usan dos tipos principales de ensayos para detectar HER-2 en tumores de mama (es decir, IHC y FISH (354-360)).
Las ventajas y desventajas de estos métodos se sintetizan en la Tabla 14 (354-360). Luego de una revisión sistemática de la literatura, un panel conjunto de la ASCO/CAP publicó recientemente guías integradas para las pruebas HER-2 en pacientes con cáncer de mama invasivo (346).
Tabla 14. Ventajas y desventajas de distintos ensayos para inmunohistoquímica de HER-2

Abreviatura: FISH, hibridización in situ con fluorescencia.
NOTA: Datos sintetizados de las referencias (354-360).
Las siguientes son algunas de las conclusiones clave. Tal como se las lleva a cabo en la actualidad, aproximadamente 20% de las pruebas HER-2 pueden ser imprecisas. Cuando se usan ensayos debidamente validados, los datos existentes no muestran ninguna superioridad clara de IHC o FISH para predecir la respuesta a trastuzumab. El HER-2 debe medirse en el componente invasivo del cáncer de mama. Los laboratorios que realizan ensayos HER-2 deben mostrar al menos 95% de concordancia con otra prueba validada. La validación de los ensayos o las modificaciones, el uso de procedimientos operativos estándares y el cumplimiento con nuevos criterios de pruebas deben ser controlados por medio del uso de estrictos estándares de acreditación de laboratorio, pruebas de proficiencia y competencia (346).
El panel ASCO/CAP recomendó el siguiente algoritmo para definir el estado de HER-2: la positividad HER-2 se definió como la tinción IHC de 3+ (tinción de membrana uniforme e intensa con > 30% de células cancerígenas invasivas), un valor FISH > 6 HER- 2 copias de gen por núcleo, o un coeficiente FISH (HER-2/CEP 17) > 2,2 (CEP, sonda centrométrica para cromosoma 17); la negatividad HER-2 se definió como un score IHC de 0 ó 1+, un valor FISH > 4 HER-2 copias gen por núcleo, o un coeficiente FISH > 1,8; HER-2 IHC fue considerado dudoso con un score de 2+ (es decir, una tinción de membrana completa que es no-uniforme o débil en intensidad con distribución de circunferencia clara en al menos 10% de las células). El rango ambiguo para FISH fue un coeficiente HER- 2/CEP 17 de 1,8 a 2,2 o un número de copia gen promedio de 4,0 a 6,0 para aquellos ensayos sin una sonda interna. Para las muestras con scores de IHC ambiguos, se debe realizar FISH. Para las muestras con resultados FISH ambiguos, la prueba debe repetirse o se deben contar células adicionales. El panel de la NACB apoya estas recomendaciones.
En la actualidad, la FDA ha aprobado ensayos para detectar HER-2 en cáncer de mama. Dos de estos ensayos se basan en el IHC (Dako Corporation, Carpinteria, CA, y Ventana Medical Systems, Inc, Tucson, AZ) y dos en FISH (Ventana Medical Systems, Inc, y Vysis Inc, Downers Grove, IL). Los dos ensayos IHC se aprobaron originariamente para identificar a las mujeres con cáncer de mama avanzado para terapia con trastuzumab. Las pruebas basadas en FISH originariamente se aprobaron para la selección de mujeres con enfermedad con ganglios negativos con riesgo alto de progresión y para respuesta a terapia basada en la doxorubicina. Más recientemente, también se han aprobado estas pruebas para la selección de mujeres con cáncer de mama metastásico a las que se les realizará tratamiento con trastuzumab. En 2008, la FDA otorgó aprobación precomercial para un nuevo ensayo de hibridización in situ cromogénico (Invitrogen Corporation, Carlsbad, CA) para identificar a los pacientes aptos para trastuzumab. La FDA aprobó una prueba basada en HER-2 en suero para el seguimiento y control de los pacientes con cáncer de mama avanzado (Siemens Healthcare Diagnostics, Deerfield, IL)
uPA y PAI-1
Los resultados de una análisis conjunto que incluyó a más de 8.000 pacientes han demostrado que tanto uPA y PAI-1 son factores pronósticos en cáncer de mama fuertes (riesgo relativo>2) e independientes (es decir, independientes de las metástasis de ganglios, del tamaño del tumor, y el estado del receptor hormonal) (361). Para los pacientes con ganglios axilares negativos, el impacto pronóstico de estas dos proteínas ha sido validado usando tanto una prueba prospectiva aleatoria (estudio Chemo No) y un análisis en grupo de estudios retrospectivos y prospectivos a pequeña escala (361)(362). uPA y PAI-1 por lo tanto son los primeros factores biológicos en el cáncer de mama a los que se les valida su valor pronóstico usando estudios de evidencia de nivel 1 (363).
El panel de la NACB por lo tanto establece que se puedan llevar a cabo las pruebas de uPA y PAI-1 para identificar a los pacientes negativos para ganglios linfáticos que no necesitan o que probablemente no se beneficien con la quimioterapia adyuvante. Se debe realizar la medición de ambas proteínas ya que la información que ofrece la combinación es superior a la de una sola (361)(364). Los pacientes negativos para ganglios linfáticos con bajos niveles tanto de uPA como de PAI-1 tienen un bajo riesgo de recidiva de la enfermedad y por lo tanto se les pueden evitar los efectos adversos tóxicos y los costos de la quimioterapia adyuvante. A las mujeres que son negativas para ganglios linfáticos con altos niveles tanto de uPA como de PAI-1 se las debe tratar con quimioterapia adyuvante. De hecho, los resultados de la prueba Chemo No trial (362) así como datos de amplios estudios retrospectivos recientes (364)(365) sugieren que los pacientes con altos niveles de uPA/PAI-1 logran un mayor beneficio de la quimioterapia adyuvante.
Recomendación 2 del Panel de Cáncer de Mama de la NACB: HER-2 como Marcador Predictivo y Pronóstico
HER-2 debe medirse en todos los pacientes con cáncer de mama invasivo. El objetivo primario de la medición de HER-2 es seleccionar a los pacientes con cáncer de mama que puedan ser tratados con trastuzumab [LOE, I; SOR, A]. El HER-2 también puede identificar a los pacientes que se benefician preferentemente con la quimioterapia adyuvante basada en la antraciclina [LOE, II/III; SOR, B].
Ensayos recomendados para uPA y PAI-1
La medición tanto de uPA y PAI-1 se debe realizar usando un ELISA validado. Algunos estudios ELISA han pasado una validación técnica (366) mientras que algunos también han sido evaluados en un esquema de PEEC (367). Para determinar el pronóstico en cáncer de mama, el panel de la NACB recomienda el uso de un ELISA que haya sido validado tanto técnica como clínicamente (por ej. de American Diagnostic Inc, Stamford, CT). Se recomienda la extracción de tejido tumoral con Triton X-100 (Sigma Aldrich, St. Louis, MO) (368). Es importante notar que para realizar un ELISA para uPA o PAI-1 una porción representativa de cáncer de mama con tumor fresco (es decir, no fijo en formalina) (>200 a 300 mg) debe ser guardado en nitrógeno líquido inmediatamente luego del diagnóstico histológico. Recientemente, se ha descripto un microensayo usando mínimamente 100 mg de tejido tumoral para la medición de uPA y PAI-1 (369)(370). Este ensayo también puede usar material de dos o tres biopsias medulares o cinco a 10 criosecciones de un grosor de 90-µm. A pesar de que no fueron todavía validados clínicamente, los datos preliminares mostraron que los niveles de uPA y PAI-1 en biopsias medulares tenían una buena correlación con los niveles correspondientes en tejido removido quirúrgicamente. Ya que la determinación inmunohistoquímica de uPA/PAI-1 no se ha validado clínicamente todavía, no se puede recomendar esta metodología, en el presente, para la determinación de rutina de estas proteínas en cáncer de mama.
Recomendación 3 del Panel de Cáncer de Mama de la NACB: uPA y PAI-1 para la determinación del pronóstico
uPA y PAI-1 pueden usarse para identificar a los pacientes con cáncer de mama con ganglios linfáticos negativos que no necesiten o para los que la quimioterapia adyuvante probablemente no sea beneficiosa. uPA y PAI-1 deben medirse por un ELISA validado usando extractos de tumor fresco o fresco congelado [LOE, I; SOR, A].
Sobre la base de la evidencia presente, el panel de la NACB no recomienda la realización de pruebas de rutina de CA 15-3 (o BR 27.29) en pacientes asintomáticos luego del diagnóstico de cáncer de mama operable. No obstante, el panel quisiera destacar que hay una serie de pequeños estudios que sugieren que el inicio temprano de la terapia basado en niveles crecientes de marcadores en suero puede dar lugar a un resultado mejorado (376- 378). A pesar de que estos estudios no ofrecen un alto nivel de evidencia acerca de que el tratamiento precoz basado en el aumento de los niveles de marcadores tumorales impacta positivamente sobre el resultado del paciente, algunos médicos y pacientes pueden querer que se determinen niveles seriados de CA 15-3 (o BR 27.29) luego de la cirugía primaria. La decisión final acerca de usar o no usar CA 15-3 (BR 27.29) en esta situación la debe tomar el médico consultando al paciente. De acuerdo con ASCO y NCCN, el CA 15-3 (o BR 27.29) no debe usarse solo en la terapia de control en enfermedad avanzada (242)(243)(347)(375). El panel de EGTM recomienda que para los pacientes con enfermedad metastásica se deben determinar los marcadores antes de cada ciclo de quimioterapia y al menos cada 3 meses para pacientes que reciben terapia hormonal (371). El panel de la NACB establece que CA 15-3 o BR 27.29 en combinación con el diagnóstico por imágenes y el examen clínico pueden usarse para controlar la quimioterapia en pacientes con cáncer de mama avanzado. Estos marcadores pueden ser de particular ayuda en los pacientes con enfermedad no-evaluable. En tales pacientes, dos aumentos sucesivos (por ej. cada uno >30%) pueden indicar enfermedad progresiva y pueden dar lugar a un cese de la terapia, cambio en la misma, o el ingreso del paciente en pruebas clínicas que evalúen nuevos tratamientos anti-cáncer. No obstante, como con los marcadores durante la vigilancia posquirúrgica, no hay una definición universalmente aceptada o validada clínicamente de un aumento significativo desde el punto de vista clínico en la concentración de los marcadores durante la terapia de una enfermedad avanzada. Es importante recordar que luego del comienzo de la quimioterapia, se puede presentar un aumento transitorio en los niveles de marcador en suero (379)(380). Tales incrementos o saltos usualmente cesan dentro de las 6 a 12 semanas luego del comienzo de la quimioterapia. Los aumentos en los niveles de los marcadores no relacionados con la progresión del tumor también pueden presentarse como resultado de ciertas enfermedades benignas (381). Estos aumentos pueden ser transitorios o progresivos dependiendo de si la enfermedad benigna es de corta duración o no.
Ensayos recomendados para CA 15-3/BR 27.29
La FDA ha aprobado algunos ensayos CA 15-3 y BR 27.29 disponibles comercialmente.
CEA Como para CA 15-3 y BR 27.29, el panel de la NACB no recomienda el uso de CEA en la vigilancia de los pacientes con cáncer de mama diagnosticado. Para controlar a los pacientes con enfermedad avanzada, no se debe usar el CEA solo. Para controlar a los pacientes con enfermedad no-evaluable, el CEA puede ocasionalmente ser informativo cuando CA 15-3/BR 27.29 no lo son. Como marcador para cáncer de mama, el CEA es generalmente menos sensible que CA 15-3/BR 27.29 pero en ocasiones, puede ser informativo cuando los niveles de marcadores relativos a MUC-1 permanecen por debajo del punto de corte.
Recomendación 4 del Panel de Cáncer de Mama de la NACB: CA 15-3 y BR 27.29 en Vigilancia posquirúrgica y terapia de control en enfermedad avanzada.
El CA 15-3 y el BR 27.29 no deben usarse de rutina para la detección temprana de recidivas/metástasis en pacientes asintomáticos con cáncer de mama diagnosticado. No obstante, debido a que algunos pacientes y médicos también pueden desear tener estas mediciones, la decisión final acerca de si usar CA 15-3 o BR 27.29 o no, la debe tomar el médico junto con el paciente [LOE, III; SOR, B]. En combinación con la radiología y un examen médico, se pueden usar CA 15-3 ó BR 27.29 para controlar la quimioterapia en pacientes con cáncer de mama avanzado. Para pacientes con enfermedad no evaluable, los aumentos sostenidos en las concentraciones de los marcadores sugieren enfermedad progresiva [LOE, III; SOR, B].
Ensayo recomendado para CEA
La FDA ha aprobado algunos ensayos CEA disponibles comercialmente.
CA 15-3/BR 27.29
Los ensayos en suero CA 15-3 y BR 27.29 (también conocidos como CA 27.29) detectan el mismo antígeno (esto es, la proteína MUC1) y ofrecen información clínica similar. Sin embargo, el CA 15-3 se ha investigado más ampliamente que el BR 27.29. Existen puntos de vista contrapuestos acerca del valor de CA 15-3 y BR 27.29 en la supervisión posquirúrgica de los pacientes asintomáticos que han pasado por una cirugía curativa (15)(242)(243)(371-375). A pesar de que los niveles crecientes de CA 15-3 ó BR 27.29 pueden detectar pre-clínicamente enfermedad metastásica distante en aproximadamente 70% de los pacientes asintomáticos, no hay ningún estudio de alta evidencia que muestre que el diagnóstico temprano de la enfermedad progresiva seguida por el inicio de la terapia impacte positivamente en la sobrevida del paciente o en la calidad de vida. Además, no hay definición universalmente aceptada o clínicamente validada de un aumento en el marcador tumoral clínicamente significativo. Un aumento confirmado de al menos 25%, sin embargo, se interpreta ampliamente como representativo de un aumento significativo desde el punto de vista clínico.
Recomendación 5 del Panel de cáncer de mama de la NACB: CEA en vigilancia posquirúrgica y control de terapia en enfermedad avanzada
No debe usarse el CEA rutinariamente para la detección temprana de recidivas/metástasis en pacientes con cáncer de mama diagnosticado. No obstante, debido a que algunos pacientes y médicos también pueden desear tener estas mediciones, la decisión final acerca de usar CEA la debe tomar el médico en conjunto con el paciente. [LOE, III; SOR, B]. Sumado a la radiología y al examen médico, se puede usar CEA para controlar la quimioterapia en pacientes con cáncer de mama avanzado. Para pacientes con enfermedad no evaluable, los incrementos sostenidos en las concentraciones de los marcadores sugieren enfermedad progresiva [LOE, III; SOR, B].
BRCA1 y BRCA2 De acuerdo al Grupo de Trabajo del Cancer Genetics Studies Consortium (CGSC) "se recomienda realizar screening tempranos de mama y ovario para individuos con mutaciones de BRCA1 y screening de cáncer de mama temprano para aquellos con mutaciones de BRCA2" (382). Sin embargo, no se realizó ninguna recomendación a favor o en contra de cirugía profiláctica (por ej. mastectomía u ooferectomía). Las guías además establecieron que "estas cirugías son una opción para los portadores de mutación, pero falta evidencia de los beneficios, y los informes de caso han documentado la ocurrencia de cáncer luego de la cirugía profiláctica. Se recomienda que a los individuos que estén considerando la realización de pruebas genéticas se los asesore acerca de la eficacia desconocida de las mediciones para reducir el riesgo y se les pueda ofrecer asistencia a los individuos con mutaciones que predisponen para el cáncer cada vez que sea posible dentro del contexto de los protocolos de investigación diseñados para evaluar los resultados clínicos" (382). Es importante resaltar que estas guías estuvieron basadas en la opinión de expertos solamente.
En 2003, un panel de ASCO publicó una declaración de políticas detallada relativa a la realización de pruebas genéticas para susceptibilidad al cáncer (324). Esta declaración incluía recomendaciones en las siguientes áreas: indicaciones para pruebas genéticas, regulación de la realización de las pruebas, reembolsos por seguros, protección ante la discriminación, asuntos de confidencialidad asociados con la realización de pruebas genéticas, desafíos de la educación continua, y temas especiales de investigación que rodean a la realización de pruebas genéticas de tejidos humanos.
De acuerdo al panel de consenso de 2005 de la 8va St Gallen Conference, las decisiones de tratamiento para mujeres con mutaciones en los genes BRCA1 o BRCA2 "tienen que incluir la consideración de mastectomía bilateral con reconstrucción quirúrgica plástica, ooforectomía profiláctica, quimio-prevención y vigilancia intensificada" (350). El panel de la NACB apoya las declaraciones publicadas por CGSC, ASCO, US Preventive Services Task Force, y el St Gallen Consensus Panel (324)(350)(382-384).
Recomendación 6 del Panel de Cáncer de Mama de la NACB: Pruebas de mutación de BRCA1 y BRCA2 para identificar mujeres con riesgo de desarrollar cáncer de mama.
Las pruebas de mutación de BRCA 1 y BRCA2 pueden usarse para identificar a aquellas mujeres que se encuentran en riesgo de desarrollar cáncer de mama u ovario en familias de alto riesgo. En aquellas con tales mutaciones, el screening debe comenzar a los 25 a 30 años de edad. No obstante, existen datos insuficientes para recomendar una estrategia de supervisión/screening específica para mujeres jóvenes en alto riesgo. Se debe ofrecer asesoramiento conveniente a cualquier individuo que esté considerando la realización de pruebas de BRCA1/2 [LOE, opinión de expertos; SOR, B].
Firmas de gen multigénicas
Perfil de Expresión del Gen
El perfil de expresión del gen usa tecnología de micromatices para medir la expresión de miles de genes. Se han descripto al menos ocho firmas de genes para predecir el resultado en los pacientes con cáncer de mama [para una revisión, ver (385)]. A pesar de que estas firmas contienen algunos genes que se superponen, la mayoría ofrece información pronóstica similar (386). En uno de los primeros estudios de micromatices, van't Veer y col. (387) describieron una firma de 70 genes que predecía de manera correcta la aparición posterior de metástasis distante en 65 a 78 pacientes con cáncer de mama de ganglios linfáticos negativos recientemente diagnosticados menores de 55 años de edad que no habían recibido tratamiento sistémico. La aplicación de esta firma a un conjunto independiente de 19 cánceres de mama dio por resultado sólo dos clasificaciones incorrectas. Esta firma de 70 genes fue posteriormente validada tanto interna (388) como externamente (389). En los estudios de validación interno y externo, el impacto pronóstico de la firma del gen fue independiente de los factores pronósticos convencionales para cáncer de mama. En la actualidad, esta firma de 70 genes está siendo sometida a una validación prospectiva como parte de la prueba Microarray for Node-Negative Disease Avoids Chemotherapy (390). El objetivo primario de esta prueba es establecer si los pacientes con cáncer de mama de ganglios linfáticos negativos con bajo riesgo de recurrencia basado en la anterior firma de genes pero en riesgo de recurrencia basada en factores clinicopatológicos pueden evitar quimioterapia adyuvante de manera segura sin afectar la sobrevida libre de metástasis.
Recomendación 7 del Panel de cáncer de mama de la NACB: Perfil de expresión genética, determinado por micromati z para predecir el resultado
Ninguna de las firmas de genes basadas en micromatiz disponibles actualmente debe usarse de rutina para predecir el resultado en el paciente [LOE, III; SOR, B].
Prueba Oncotype DX
El Oncotype DX (Genomic Health, Redwood City, CA) es un ensayo de genes múltiples que cuantifica la posibilidad de recurrencia de cáncer de mama en mujeres con cáncer de mama en estadio temprano, recientemente diagnosticadas (para un revisión, ver ref. (391). En vez de usar tecnología de micromatiz, esta prueba usa RT-PCR para medir la expresión de 21 genes (16 genes asociados al cáncer y cinco genes control). Sobre la base de la expresión de estos genes, se calculó un score de recurrencia (RS) que predecía riesgo bajo, intermedio y alto de metástasis distante para pacientes ER positivos, tratados con tamoxifeno adyuvante (392). Se validó RS de manera prospectiva en una población independiente de pacientes ER-positivos para ganglios linfáticos tratados con tamoxifeno adyuvante, como parte de la prueba de B14 National Surgical Adjuvant Breast and Bowel Project (392). En este estudio de validación, la RS fue un predictor independiente de resultado de pacientes. El impacto pronóstico independiente del RS se confirmó posteriormente en un estudio de caso control basado en la población (393). Mientras que un bajo RS predijo un buen resultado en pacientes tratados con tamoxifeno adyuvante, se halló que un RS alto estaba asociado con un resultado favorable en pacientes tratados con quimioterapia neoadyuvante o adyuvante (394)(395). Una ventaja particular de esta prueba es que se puede llevar a cabo en tejido formolado incluido en parafina.
En la actualidad, al RS se le está realizando una validación prospectiva como parte de la prueba Trial Assigning Individualized Options for Treatment (396). En esta prueba, se están asignando pacientes con RS intermedio de manera aleatoria para recibir terapia sola o terapia hormonal más quimioterapia. El objetivo es establecer si la quimioterapia adyuvante mejora la sobrevida en el grupo de pacientes con el score intermedio. Además, en esta prueba, los pacientes con RS luego de la terapia con tamoxifeno recibirán tratamiento endócrino mientras que a aquellos con RS alto se les aplicará quimioterapia y terapia hormonal.
Recomendación 8 del Panel de cáncer de mama de la NACB: Prueba Oncotype DX para predecir el resultado
La prueba Oncotype DX puede usarse para predecir recurrencia en pacientes ER-positivos con ganglios linfáticos negativos que reciben tamoxifeno adyuvante. Los pacientes para los que se había anticipado que tendrían un buen resultado posiblemente puedan evitar pasar por tratamiento con quimioterapia adyuvante [LOE, I/II; SOR, A]. La prueba Oncotype DX puede usarse también para predecir el beneficio de la quimioterapia adyuvante (CMF o 5-fluorouracilo y metotrexato) en pacientes ER-positivos con ganglios negativos (es decir, pacientes con score de alta recurrencia parecen obtener mayores beneficios de la quimioterapia que aquellos con scores bajos) [LOE, III; SOR, B].
Puntos clave: marcadores tumorales en cáncer de mama
Los marcadores en cáncer de mama mejor validados están todos basados en tejido e incluyen ER, PR, HER-2, uPA, y PAI-1. El ensayo de ER, PR, y HER-2 es ahora obligatorio para todos los pacientes con cáncer de mama recientemente diagnosticado. La medición de uPA y PAI-1, a pesar de estar técnicamente y clínicamente validada (361-363)(366)(367), no se encuentra actualmente con un uso clínico generalizado, principalmente debido al requisito de una mínima cantidad de tejido fresco o recientemente congelado. Sin embargo, el ensayo de estas proteínas puede usarse para ayudar en la selección de pacientes con cáncer de mama con ganglios negativos que no necesiten quimioterapia adyuvante. De modo similar, la prueba Oncotype DX puede usarse para predecir la recurrencia en pacientes ERpositivos con ganglios linfáticos negativos que reciben tamoxifeno adyuvante. Aunque tiene un amplio uso en la vigilancia postquirúrgica y en la terapia de control en enfermedad avanzada, el valor clínico de CA 15-3 y de otros marcadores en suero no ha sido validados todavía por un estudio de evidencia nivel I.
Referencias bibliográficas
327. Pisani P, Bray F, Parkin DM. Estimates of the worldwide prevalence of cancer for 25 sites in the adult population. Int J Cancer 2002; 97: 72-81. [ Links ]
328. Hewitt M, Breen N, Devesa S. Cancer prevalence and survivorship issues: analyses of the 1992 National Health Interview Survey. J Natl Cancer Inst 1999; 91:1480-6. [ Links ]
329. Peto R, Boreham J, Clarke M, Davies C, Beral V. UK and USA breast cancer deaths down 25% in year 2000 at ages 20-69 years. Lancet 2000; 355:1822. [ Links ]
330. Early Breast Cancer Trialists' Collaborative Group (EBCTCG). Effects of chemotherapy and hormonal therapy for early breast cancer on recurrence and 15-year survival: an overview of the randomised trials. Lancet 2005; 365:1687-717. [ Links ]
331. Early Breast Cancer Trialists' Collaborative Group. Tamoxifen for early breast cancer: an overview of the randomised trials. Lancet 1998; 351:1451-67. [ Links ]
332. Morris AD, Morris RD, Wilson JF, White J, Steinberg S, Okunieff P, et al. Breast-conserving therapy vs mastectomy in Tumor Markers.qxd 6/22/10 7:51 PM early-stage breast cancer: a meta-analysis of 10-year survival. Cancer J Sci Am 1997; 3:6-12. [ Links ]
333. Khatcheressian JL, Wolff AC, Smith TJ, Grunfeld E, Muss HB, Vogel VG, et al. American Society of Clinical Oncology 2006 update of the breast cancer follow-up and management guidelines in the adjuvant setting. J Clin Oncol 2006; 24:5091-7. [ Links ]
334. Bernard-Marty C, Cardoso F, Piccart MJ. Facts and controversies in systemic treatment of metastatic breast cancer. Oncologist 2004; 9:617-32. [ Links ]
335. Colozza M, de Azambuja E, Cardoso F, Bernard C, Piccart MJ. Breast cancer: achievements in adjuvant systemic therapies in the pre-genomic era. Oncologist 2006; 11:111-25. [ Links ]
336. Harvey JM, Clark GM, Osborne CK, Allred DC. Estrogen receptor status by immunohistochemistry is superior to the ligandbinding assay for predicting response to adjuvant endocrine therapy in breast cancer. J Clin Oncol 1999; 17:1474-81. [ Links ]
337. Elledge RM, Green S, Pugh R, Allred DC, Clark GM, Hill J, et al. Estrogen receptor (ER) and progesterone receptor (PgR), by ligand-binding assay compared with ER, PgR and pS2, by immuno-histochemistry in predicting response to tamoxifen in metastatic breast cancer: a Southwest Oncology Group Study. Int J Cancer 2000; 89:111-7. [ Links ]
338. McCarty KS, Jr., Miller LS, Cox EB, Konrath J, Mc- Carty KS, Sr. Estrogen receptor analyses. Correlation of biochemical and immunohistochemical methods using monoclonal antireceptor antibodies. Arch Pathol Lab Med 1985; 109:716-21. [ Links ]
339. Barnes DM, Harris WH, Smith P, Millis RR, Rubens RD. Immunohistochemical determination of oestrogen receptor: comparison of different methods of assessment of staining and correlation with clinical outcome of breast cancer patients. Br J Cancer 1996; 74:1445-51. [ Links ]
340. Pertschuk LP, Feldman JG, Kim YD, Braithwaite L, Schneider F, Braverman AS, Axiotis C. Estrogen receptor immunocytochemistry in paraffin embedded tissues with ER1D5 predicts breast cancer endocrine response more accurately than H222Sp gamma in frozen sections or cytosol-based ligand-binding assays. Cancer 1996; 77:2514-9. [ Links ]
341. Fisher ER, Anderson S, Dean S, Dabbs D, Fisher B, Siderits R, et al. Solving the dilemma of the immunohistochemical and other methods used for scoring estrogen receptor and progesterone receptor in patients with invasive breast carcinoma. Cancer 2005; 103:164-73. [ Links ]
342. Chebil G, Bendahl PO, Ferno M. Estrogen and progesterone receptor assay in paraffin-embedded breast cancer—reproducibility of assessment. Acta Oncol 2003; 42:43-7.
343. Mohsin SK, Weiss H, Havighurst T, Clark GM, Berardo M, Roanh lD, et al. Progesterone receptor by immunohistochemistry and clinical outcome in breast cancer: a validation study. Mod Pathol 2004;17:1545-54. [ Links ]
344. Leake R, Barnes D, Pinder S, Ellis I, Anderson L, Anderson T, et al. Immunohistochemical detection of steroid receptors in breast cancer: a working protocol. UK Receptor Group, UK NEQAS, The Scottish Breast Cancer Pathology Group, and The Receptor and Biomarker Study Group of the EORTC. J Clin Pathol 2000;53:634-5. [ Links ]
345. Fitzgibbons PL, Page DL,Weaver D, Thor AD, Allred DC, Clark GM, et al. Prognostic factors in breast cancer. College of American Pathologists Consensus Statement 1999. Arch Pathol Lab Med 2000; 124:966- 78. [ Links ]
346. Wolff AC, Hammond ME, Schwartz JN, Hagerty KL, Allred DC, Cote RJ, et al. American Society of Clinical Oncology/College of American Pathologists guideline recommendations for human epidermal growth factor receptor 2 testing in breast cancer. J Clin Oncol 2007; 25:118-45. [ Links ]
347. National Comprehensive Cancer Network (NCCN) Clinical Practice Guidelines in Oncology, Breast Cancer. Version 2, 2007. http://www.nccn.org/patients/patient_gls/_english/_breast/contents.asp (Accessed 14 April 2007). [ Links ]
348. Yamauchi H, Stearns V, Hayes DF. When is a tumor marker ready for prime time? A case study of c-erbB-2 as a predictive factor in breast cancer. J Clin Oncol 2001; 19:2334-56. [ Links ]
349. Duffy MJ. Predictive markers in breast and other cancers: a review. Clin Chem 2005; 51:494-503. [ Links ]
350. Goldhirsch A, Wood WC, Gelber RD, Coates AS, Thurlimann B, Senn HJ. Meeting highlights: updated international expert consensus on the primary therapy of early breast cancer. J Clin Oncol 2003; 21:3357-65. [ Links ]
351. Gennari A, Sormani MP, Pronzato P, Puntoni M, Colozza M, Pfeffer U, Bruzzi P. HER2 status and efficacy of adjuvant anthracyclines in early breast cancer: a pooled analysis of randomized trials. J Natl Cancer Inst 2008; 100:14-20. [ Links ]
352. Pritchard KI, Shepherd LE, O'Malley FP, Andrulis IL, Tu D, Bramwell VH, Levine MN. HER2 and responsiveness of breast cancer to adjuvant chemotherapy. N Engl J Med 2006; 354: 2103-11. [ Links ]
353. Esteva FJ, Cheli CD, Fritsche H, Fornier M, Slamon D, Thiel RP, et al. Clinical utility of serum HER2/ neu in monitoring and prediction of progression-free survival in metastatic breast cancer patients treated with trastuzumab-based therapies. Breast Cancer Res 2005;7:R436-R443. [ Links ]
354. Bartlett J, Mallon E, Cooke T. The clinical evaluation of HER-2 status: which test to use? J Pathol 2003; 199:411-7. [ Links ]
355. Pauletti G, Dandekar S, Rong H, Ramos L, Peng H, Seshadri R, Slamon DJ. Assessment of methods for tissue-based detection of the HER-2/neu alteration in human breast cancer: a direct comparison of fluorescence in situ hybridization and immunohistochemistry. J Clin Oncol 2000;18:3651-64. [ Links ]
356. Press MF, Hung G, Godolphin W, Slamon DJ. Sensitivity of HER-2/neu antibodies in archival tissue samples: potential source of error in immunohistochemical studies of oncogene expression. Cancer Res 1994; 54:2771-7. [ Links ]
357. Press MF, Slamon DJ, Flom KJ, Park J, Zhou JY, Bernstein L. Evaluation of HER-2/neu gene amplification and overexpression: comparison of frequently used assay methods in a molecularly characterized cohort of breast cancer specimens. J Clin Oncol 2002; 20:3095-105. [ Links ]
358. Bartlett JMS, Going JJ, Mallon EA, Watters AD, Reeves JR, Stanton P, et al. Evaluating HER-2 amplification and over expression in breast cancer. J Pathol 2001; 195:422-8. [ Links ]
359. Birner P, Oberhuber G, Stani J, Reithofer C, Samonigg H, Hausmaninger H, et al. Evaluation of the United States Food and Drug Administration-approved scoring and test system of HER-2 protein expression in breast cancer. Clin Cancer Res 2001; 7:1669-75. [ Links ]
360. Yaziji H, Goldstein LC, Barry TS, Werling R, Hwang H, Ellis GK, et al. HER-2 testing in breast cancer using parallel tissuebased methods. JAMA 2004; 291:1972-7. [ Links ]
361. Look MP, van Putten WL, Duffy MJ, Harbeck N, Christensen IJ, Thomssen C, et al. Pooled analysis of prognostic impact of urokinase-type plasminogen activator and its inhibitor PAI-1 in 8377 breast cancer patients. J Natl Cancer Inst 2002; 94:116-28. [ Links ]
362. Janicke F, Prechtl A, Thomssen C, Harbeck N, Meisner C, Untch M, et al. Randomized adjuvant chemotherapy trial in high-risk, Tumor Markers.qxd 6/22/10 7:51 lymph node-negative breast cancer patients identified by urokinase-type plasminogen activator and plasminogen activator inhibitor type 1. J Natl Cancer Inst 2001; 93:913-20. [ Links ]
363. Duffy MJ. Urokinase plasminogen activator and its inhibitor, PAI-1, as prognostic markers in breast cancer: from pilot to level 1 evidence studies. Clin Chem 2002; 48:1194-7. [ Links ]
364. Harbeck N, Kates RE, Schmitt M. Clinical relevance of invasion factors urokinase-type plasminogen activator and plasminogen activator inhibitor type 1 for individualized therapy decisions in primary breast cancer is greatest when used in combination. J Clin Oncol 2002; 20:1000-7. [ Links ]
365. Harbeck N, Kates RE, Look MP, Meijer-van Gelder ME, Klijn JG, Kruger A, et al. Enhanced benefit from adjuvant chemotherapy in breast cancer patients classified high-risk according to urokinase-type plasminogen activator (uPA) and plasminogen activator inhibitor type 1 (n = 3424). Cancer Res 2002; 62:4617-22. [ Links ]
366. Benraad TJ, Geurts-Moespot J, Grondahl-Hansen J, Schmitt M, Heuvel JJ, de Witte JH, et al. Immunoassays (ELISA) of urokinase-type plasminogen activator (uPA): report of an EORTC/BIOMED-1 workshop. Eur J Cancer 1996; 32A:1371-81. [ Links ]
367. Sweep CG, Geurts-Moespot J, Grebenschikov N, de Witte JH, Heuvel JJ, Schmitt M, et al. External quality assessment of trans-European multicentre antigen determinations (enzyme-linked immunosorbent assay) of urokinase-type plasminogen activator (uPA) and its type 1 inhibitor (PAI-1) in human breast cancer tissue extracts. Br J Cancer 1998; 78:1434-41. [ Links ]
368. Janicke F, Pache L, Schmitt M, Ulm K, Thomssen C, Prechtl A, Graeff H. Both the cytosols and detergent extracts of breast cancer tissues are suited to evaluate the prognostic impact of the urokinase-type plasminogen activator and its inhibitor, plasminogen activator inhibitor type 1. Cancer Res 1994; 54:2527-30. [ Links ]
369. Abraha RS, Thomssen C, Harbeck N, Mueller V, Baack K, Schmitt M, et al. Micromethod for determination of uPA and PAI-1 from preoperative core-needle biopsies in breast cancer. Breast Cancer Res Treat 2003; 82:S144. [ Links ]
370. Schmitt M, Lienert S, Prechtel D, Sedlaczek E, Welk ARU, et al. The urokinase protease system as a target for breast cancer prognosis and therapy: technical considerations. Procedure for the quantitative determination of urokinase (uPA) and its inhibitor PAI-1 in human breast cancer tissue extracts by ELISA, Vol.: Breast Cancer Protocols, 2005. [ Links ]
371. Molina R, Barak V, van DA, Duffy MJ, Einarsson R, Gion M, et al. Tumor markers in breast cancer - European Group on Tumor Markers recommendations. Tumour Biol 2005; 26: 281-93. [ Links ]
372. Pestalozzi BC, Luporsi-Gely E, Jost LM, Bergh J. ESMO Minimum Clinical Recommendations for diagnosis, adjuvant treatment and follow-up of primary breast cancer. Ann Oncol 2005; 16 Suppl 1:i7-i9. [ Links ]
373. Kataja VV, Colleoni M, Bergh J. ESMO Minimum Clinical Recommendations for diagnosis, treatment and follow-up of locally recurrent or metastatic breast cancer (MBC). Ann Oncol 2005;16 Suppl 1:i10-i12. [ Links ]
374. Goldhirsch A, Wood WC, Gelber RD, Coates AS, Thurlimann B, Senn HJ. Progress and promise: highlights of the international expert consensus on the primary therapy of early breast cancer 2007. Ann Oncol 2007; 18:1133-44. [ Links ]
375. Harris L, Fritsche H, Mennel R, Norton L, Ravdin P, Taube S, et al. American Society of Clinical Oncology 2007 Update of Recommendations for the Use of Tumor Markers in Breast Cancer. J Clin Oncol 2007:In press. [e-pub ahead of print]. [ Links ]
376. Jager W. The early detection of disseminated (metastasized) breast cancer by serial tumour marker measurements. Eur J Cancer Prev 1993;2 Suppl 3:133-9. [ Links ]
377. Nicolini A, Anselmi L, Michelassi C, Carpi A. Prolonged survival by ‘early' salvage treatment of breast cancer patients: a retrospective 6-year study. Br J Cancer 1997; 76:1106-11.
378. Kovner F, Merimsky O, Hareuveni M, Wigler N, Chaitchik S. Treatment of disease-negative but mucin-like carcinoma-associated antigen-positive breast cancer patients with tamoxifen: preliminary results of a prospective controlled randomized trial. Cancer Chemother Pharmacol 1994; 35:80-3. [ Links ]
379. Hayes DF, Kiang DT, Korzum AH, Tondini C,Wood WC, Kufe DW. CA15-3 and CEA spikes during chemotherapy for metastatic breast cancer. Proc Am Soc Clin Oncol 1998; 7:38. [ Links ]
380. Yasasever V, Dincer M, Camlica H, Karaloglu D, Dalay N. Utility of CA 153 and CEA in monitoring breast cancer patients with bone metastases: special emphasis on "spiking" phenomena. Clin Biochem 1997; 30:53-6. [ Links ]
381. Duffy MJ. Serum tumor markers in breast cancer: are they of clinical value? Clin Chem 2006; 52:345-51. [ Links ]
382. Burke W, Daly M, Garber J, Botkin J, Kahn MJ, Lynch P, et al. Recommendations for follow-up care of individuals with an inherited predisposition to cancer. II. BRCA1 and BRCA2. Cancer Genetics Studies Consortium. JAMA 1997; 277:997-1003. [ Links ]
383. Nelson HD, Huffman LH, Fu R, Harris EL. Genetic risk assessment and BRCA mutation testing for breast and ovarian cancer susceptibility: systematic evidence review for the U.S. Preventive Services Task Force. Ann Intern Med 2005; 143: 362-79. [ Links ]
384. US Preventive Services Task Force. Genetic risk assessment and BRCA mutation testing for breast and ovarian cancer susceptibility: Recommendation statement. Ann Intern Med 2005; 143:355-61. [ Links ]
385. Sotiriou C, Piccart MJ. Taking gene-expression profiling to the clinic: when will molecular signatures become relevant to patient care? Nat Rev Cancer 2007; 7:545-53. [ Links ]
386. Fan C, Oh DS, Wessels L, Weigelt B, Nuyten DS, Nobel AB, et al. Concordance among gene-expression-based predictors for breast cancer. N Engl J Med 2006; 355:560-9. [ Links ]
387. van't Veer LJ, Dai H, van dV, M.J., He YD, Hart AA, Mao M, et al. Gene expression profiling predicts clinical outcome of breast cancer. Nature 2002; 415:530-6. [ Links ]
388. van de Vijver MJ, He YD, van't Veer LJ, Dai H, Hart AA,Voskuil DW, et al. A gene-expression signature as a predictor of survival in breast cancer. N Engl J Med 2002; 347:1999-2009. [ Links ]
389. Buyse M, Loi S, van't Veer L, Viale G, Delorenzi M, Glas AM, et al. Validation and clinical utility of a 70-gene prognostic signature for women with node-negative breast cancer. J Natl Cancer Inst 2006;98:1183-92. [ Links ]
390. Cardoso F, Van't Veer L, Rutgers E, Loi S, Mook S, Piccart-Gebhart MJ. Clinical application of the 70- gene profile: the MINDACT trial. J Clin Oncol 2008; 26:729-35. [ Links ]
391. Paik S. Development and clinical utility of a 21-gene recurrence score prognostic assay in patients with early breast cancer treated with tamoxifen. Oncologist 2007; 12:631-5. [ Links ]
392. Paik S, Shak S, Tang G, Kim C, Baker J, Cronin M, et al. A multigene assay to predict recurrence of tamoxifen- treated node-negative breast cancer. N Engl J Med 2005; 347:2817-26. [ Links ]
393. Habel LA, Shak S, Jacobs MK, Capra A, Alexander C, Pho M, et al. A population-based study of tumor gene expression and risk of breast cancer death among lymph node-negative patients. Breast Cancer Res 2006;8:R25. Tumor Markers.qxd 6/22/10 7:51 [ Links ]
394. Gianni L, Zambetti M, Clark K, Baker J, Cronin M,Wu J, et al. Gene expression profiles in paraffin-embedded core biopsy tissue predict response to chemotherapy in women with locally advanced breast cancer. J Clin Oncol 2005; 23:7265-77. [ Links ]
395. Paik S, Tang G, Shak S, Kim C, Baker J, Kim W, et al. Gene expression and benefit of chemotherapy in women with nodenegative, estrogen receptor-positive breast cancer. J Clin Oncol 2006; 24: 3726-34. [ Links ]
396. Sparano JA, Paik S. Development of the 21-gene assay and its application in clinical practice and clinical trials. J Clin Oncol 2008; 26:721-8. [ Links ]














