Services on Demand
Journal
Article
Indicators
-
 Cited by SciELO
Cited by SciELO
Related links
-
 Similars in
SciELO
Similars in
SciELO  uBio
uBio
Share
Acta bioquímica clínica latinoamericana
Print version ISSN 0325-2957
Acta bioquím. clín. latinoam. vol.48 no.3 La Plata Sept. 2014
BIOQUÍMICA CLÍNICA
Microproteínas urinarias en diabéticos tipo 2 normoalbuminúricos*
Urinary microproteins in normoalbuminuric type 2 diabetic patients
Microproteínas urinárias em diabéticos tipo 2 normoalbuminúricos
María Laura Facio1, Norma Ferrari2, Fernando Segovia3, Pablo Bresciani1, Fabio Lombardo4, Susana Fraind1, Mariel Alejandre5, María del Carmen Maselli1, Marcela Pandolfo1, Silvia Gasparini1, Margarita Angerosa5, Marco Pizzolato5, Leticia Madalena5
1 Bioquímico.
2 Médico Especialista en Nutrición. Diabetólogo.
3 Médico Nefrólogo.
4 Médico Diabetólogo.
5 Doctor en Bioquímica.
* Departamento de Bioquímica Clínica. Laboratorio de Proteínas. INFIBIOC. Hospital de Clínicas "José de San Martín". Facultad de Farmacia y Bioquímica. Universidad de Buenos Aires. Ciudad Autónoma de Buenos Aires, Argentina.
CORRESPONDENCIA DRA. MARÍA LAURA FACIO Departamento de Bioquímica Clínica Facultad de Farmacia y Bioquímica Universidad de Buenos Aires Junín 956 1113 CIUDAD AUTÓNOMA DE BUENOS AIRES, Argentina
Resumen
En pacientes diabéticos tipo 2 normoalbuminúricos se observa la presencia de Microproteínas Urinarias (MU) en el rango 68-25 kDa. El objetivo del trabajo fue identificar en distintos estadios de la nefropatía diabética si dicho rango corresponde a un marcador de daño tubular. Se estudiaron 119 orinas espontáneas de pacientes diabéticos tipo 2; se les midió la relación albúmina/creatinina urinaria y la creatinina sérica. Se dividieron en 5 grupos: 71 normoalbuminúricos, 28 microalbuminúricos, 12 macroalbuminúricos, 2 urémicos en pre-diálisis y 6 en hemodiálisis. Las MU se detectaron en geles de poliacrilamida en 2 dimensiones para uso clínico y se analizaron con el programa Image J 1.30v. La identificación de las MU se realizó por "immunoblotting" o por espectrometría de masa MALDI-TOF-TOF. El 66% de los normoalbuminúricos presentaron las siguientes MU: orosomucoide, fragmento de 35 kDa de la cadena pesada H4 del inter alfa I inhibidor de tripsina y Beta Trace, las cuales no reflejaron daño tubular debido a que la concentración de las mismas no se incrementó en los pacientes en hemodiálisis, en comparación con los normoalbuminúricos. Dichas proteínas están vinculadas al endotelio vascular y podrían constituir un marcador urinario vascular-tubular renal de utilidad clínica en patologías sistémicas con riesgo cardiovascular y funcionalidad renal conservada.
Palabras clave: Diabetes tipo 2; Nefropatía diabética; Electroforesis bidimensional en orina; Zinc-alfa2-glicoproteina; Péptido LG3; Prostaglandina D2 sintasa; Inter-alfa-tripsina inhibidor H4; Endotelio vascular.
Summary
Urinary excretion of microproteins (MU) was detected in normoalbuminuric type 2 diabetic patients, in the range of 68-25 kDa using SDS-PAGE with silver staining. The purpose of this study was to identify MU in diabetic patients in different grades of diabetic nephropathy, in order to clarify the diagnostic relevance as a marker of renal tubular damage. In the spontaneous urine of 119 type 2 diabetic patients, urinary albumin, urinary creatinine and serum were determined. Five groups were formed: 71 normoalbuminuric, 28 microalbuminuric, 12 macroalbuminuric, 2 in pre-dialysis and 6 in hemodialysis. The MU were separated by two-dimensional polyacrylamid gel electrophoresis for clinical use (2D UC) and were identified by immunoblotting or MALDI-TOF-TOF mass spectrometry and analyzed using Image J version 1.30v. Of the normoalbuminurics patients studied, 66% excreted the following MU: orosomucoid, 35 kDa fragment of inter-alpha-trypsin inhibitor heavy chain H4 (ITIH4) and Beta Trace; but their concentrations did not reflect tubular damage because they exhibited a progressive downregulation. These proteins are involved in vascular endothelium, and they could be a marker of renal tubular-microvascular disease that would be useful in systemic diseases with cardiovascular risk and with preserved renal function.
Key words: Type 2 diabetes; Diabetic nephropathy; Two-dimensional electrophoresis urine; Zinc-alpha 2 glycoprotein; LG3 peptide; Prostaglandine D2 sinthase; Inter-alpha-trypsin inhibitor H4; Vascular endothelium.
Resumo
Em pacientes diabéticos tipo 2 "normoalbuminúricos" se observa a presença de microproteínas urinárias (MU) em um intervalo compreendido entre 68 e 25 kDa. O objetivo do trabalho é identificar em distintos estágios da nefropatia diabética se tal intervalo corresponde a um marcador de dano tubular. Foram estudadas 119 amostras de urina espontânea de pacientes diabéticos tipo 2; foi medida a reação albumina/creatinina urinária e a creatinina sérica. Dividiram-se em 5 grupos: 71 normoalbuminúricos, 28 microalbuminúricos, 12 macroalbuminúricos, 2 urêmicos pré-dialise e 6 em hemodiálise. Foram detectadas as MU em géis de poliacrilamida em duas dimensões para o uso clínico e analisadas com o programa Image J versão 1.30v. A identificação das MU foi realizada por "immunoblotting" ou por espectrometria de massa MALDI-TOF-TOF. 66% de normoalbuminúricos apresentaram as seguintes MU: orosomucoide, Fragmento de 35 kDa da cadeia pesada H4 do interalfa inibidor da tripsina e Beta Trace, as quais não mostraram dano tubular devido a que a concentração das mesmas não está aumentada nos pacientes em hemodiálise, em comparação com os normoalbuminúricos. Estas proteínas estão envolvidas com o endotélio vascular e poderiam constituir um marcador urinário vascular-tubular renal de utilidade clínica em patologias sistêmicas com risco cardiovascular e funcionalidade renal conservada.
Palavras-chave: Diabete tipo 2; Nefropatia diabética; Eletroforese bidimensional em urina; Zinco-alfa2-glicoproteína; Peptídeo LG3; Prostaglandina D2 sintase; Inter-alfa-tripsina inibidor H4; Endotélio vascular.
Introducción
Las Microproteínas Urinarias (MU) son proteínas séricas que ultrafiltran a través del glomérulo y son reabsorbidas y catabolizadas, prácticamente en su totalidad, en el túbulo contorneado próximal (TP). Frente a una disfunción del TP las MU se eliminan por orina. La detección de alguna de ellas permite caracterizar el tipo de proteinuria, siendo de utilidad como marcadoras de daño tubular. Entre las proteínas que pueden evaluarse para este fin, las más reconocidas son la alfa-1 microproteína (A1m), la proteína transportadora del retinol (RBP) y la beta-2 microglobulina (B2m). También existen otras MU que no son marcadoras de daño tubular porque son influenciadas por otros factores, como por ejemplo, las cadenas livianas libres de inmunoglobulinas policlonales.
El perfil de excreción de las MU se modifica dependiendo de la patología que lo origina o del mecanismo involucrado en el daño renal (1-4). La detección de proteinuria tubular es de importancia diagnóstica ya que puede preceder a la glucosuria, aminoaciduria o fosfaturia, y a menudo es el primer y único signo de disfunción tubular (5).
El compartimento tubulointersticial es afectado en forma primaria o secundaria y es un importante factor pronóstico de enfermedad renal. En las alteraciones renales en las que los túbulos y/o el intersticio son el blanco primario del proceso patogénico, la etiología es variable e incluye procesos obstructivos, infecciones, tóxicos (incluyendo medicamentos), isquemia, enfermedades metabólicas (como diabetes, hiperuricemia), radiación, daño mediado por mecanismos inmunes (como en rechazo del trasplante renal) e infiltración en enfermedades linfoproliferativas (6). En las enfermedades glomerulares y vasculares de acuerdo al tiempo de evolución y la severidad de las alteraciones, se puede observar desde daño tubular agudo, hasta atrofia, edema, inflamación tubular, o fibrosis intersticial. El daño tubular o intersticial agudo asociado a estas enfermedades puede manifestarse como insuficiencia renal aguda, y el daño crónico es un buen reflejo del avance de las lesiones irreversibles y, por lo tanto, un buen indicador pronóstico en enfermedades glomerulares y vasculares crónicas (7).
Las MU constituyen importantes indicadores de disfunción tubular en patologías glomerulares primarias y secundarias, donde los cambios túbulointersticiales son consecuencia de la progresión de la falla renal. El daño tubular se puede presentar en desórdenes renales con proteinuria glomerular por el efecto adverso de la sobrecarga proteica y por la eventual actividad biológica que las mismas puedan ejercer en su microentorno (8).
La proteinuria en general es un factor de riesgo independiente de la progresión de la enfermedad glomerular crónica y está asociada a la extensión del daño hacia el túbulointersticio. Por lo tanto, es importante detectar una proteinuria tubular porque puede indicar un signo precoz inicial de daño tubular o la progresión del daño glomerular (8).
Actualmente, en el Laboratorio Clínico, el daño tubular se detecta por el método cualitativo de uroproteinograma con posterior inmunofijación con antisuero anti-beta 2 microglobulina (B2m). En estudios anteriores se concluyó que la sensibilidad del método es baja cuando se la compara con la cuantificación de B2m por inmunoturbidimetría (9). Además, es sabido que la B2m no debería ser la única proteína a evaluar en la definición del daño tubular debido a que no es estable en orinas ácidas (10). Otra proteína que podría ser cuantificada en orina para definir daño tubular es la alfa 1 microglobulina (A1m), pero se reporta que la A1m, RBP y B2m son detectadas con diferente sensibilidad según el tipo de patologías, demostrando que la integridad funcional del TP puede estar comprometida por diferentes mecanismos (1).
Otro método para caracterizar el tipo de proteinuria, es la separación por peso molecular (SDS-PAGE), que permite definir proteinurias glomerulares y/o tubulares pero no puede ser utilizado para definir una proteinuria "tipo mielomatosa". La separación de MU por SDS-PAGE ofrece una mayor resolución que el uroproteinograma. A grandes rasgos define dos tipos de "proteinuria tubular", uno con proteínas desde 68 a 12 kDa y otro desde 68 a 25 kDa (11). Boesken et al. ya lo habían caracterizado con el nombre de tipo I micromolecular asociada con disfunción tubular severa/crónica (nefritis intersticial, episodios de rechazo de trasplante renal) y tipo II micromolecular, frecuentemente asociada con proteinuria glomerular en gloméruloesclerosis hipertensiva/diabética, respectivamente (12).
Bazzi et al. también detectaron estas diferencias según los dos tipos de perfiles de Microproteínas I y II, en glomerulopatías primarias. Mostraron el valor predictivo de estos perfiles a la falla renal crónica. Pacientes con síndrome nefrótico y funcionalidad renal normal y Microproteínas tipo II presentaban mejor curva de sobrevida que los que tenían inicialmente el perfil de Microproteínas completo (Tipo I) (8).
Estos resultados motivaron a este grupo de trabajo a la realización de otros estudios, con el fin de resolver si ese perfil tipo II definía o no un daño tubular. Se concluyó que cuando por el SDS-PAGE se detectaba el tipo II, era perfil tubular, ya que cuantitativamente la A1m se encontraba elevada (11).
Además, se implementó el método de Electroforesis Bidimensional de utilidad clínica (2DUC) para abrir el espectro de MU, permitiendo visualizar un grupo de proteínas que no parecen responder a un patrón estrictamente glomerular o tubular (13).
La diabetes Mellitus (DBT) puede producir Nefropatía Diabética (ND), la cual es la responsable del 44% de la falla renal terminal en los Estados Unidos (14). En los estadios iniciales de la ND se producen alteraciones funcionales que se manifiestan clínicamente por la detección de microalbuminuria. En estudios propios realizados en pacientes diabéticos tipo 2 con normoalbuminuria se observó la presencia de MU en un rango comprendido entre 68 y 25 kDa. El objetivo de este trabajo fue identificar dichas MU en pacientes con diabetes tipo 2 en distintos estadios de la ND con el fin de evaluar si dicho rango de MU corresponde a un marcador de daño tubular.
Materiales y Métodos
MUESTRAS
Se procesaron 119 muestras de orina espontánea de pacientes con diabetes Mellitus tipo 2. A 111 orinas se les midió la relación albúmina/creatinina urinaria y creatinina sérica en un equipo de Roche-Alemania, Cobas C501 (Tokio, Japón). Se dosaron: albúmina (inmunoturbidimétrico) y creatinina (Jaffé cinético con compensación y blanco de muestra). Los pacientes fueron distribuidos en 5 grupos según el siguiente diseño clínico: 71 normoalbuminúricos (Grupo 1, menor de 30 mg de albúmina/g de creatinina urinaria), 28 microalbúminuricos (Grupo 2, entre 30-300 mg/g) y 12 macroalbuminúricos (Grupo 3, mayor de 300 mg/g). De las 119 muestras de orina, 2 pertenecían a pacientes urémicos en estado de pre-diálisis (Grupo 4), y 6 a pacientes en hemodiálisis (Grupo 5).
PROCEDIMIENTO
A todas las muestras de orina se les realizó el método de SDS-PAGE con coloración argéntica (15) y se clasificó la proteinuria según el siguiente esquema: Fisiológica, sólo cuando se observó la banda de albúmina (68 kDa); MU tipo I (perfil completo, entre 68-12 kDa); MU tipo II (perfil incompleto, entre 68-25 kDa); Glomerular, albúmina y transferrina; Perfil Mixto incompleto (Glomerular y MU II), Perfil Mixto completo (Glomerular y MU I). Se realizó la electroforesis bidimensional para uso clínico (2D UC) a cinco orinas, cada una representativa de un grupo junto con un control interno. La electroforesis 2D UC consta de una primera separación electroforética en acetato de celulosa gelatinizado (Cellogel-Biosystem), buffer veronal pH 8,6; Fi 0,05 (Helena) y una segunda dimensión en gel de poliacrilamida en condiciones desnaturalizantes con dodecil sulfato de sodio (SDS-PAGE) al 12,5% de concentración final. Los geles se corrieron en Mini protean 3 System Bio-Rad, buffer de corrida continuo Tris glicina con SDS (13). A ambos lados de cada 2D UC se corrieron en una dimensión de SDS-PAGE, la misma muestra y el control interno, este último corresponde a una orina con patrón tubular completo, como control de coloración y para analizar los "spots" en las distintas 2D UC.
IDENTIFICACIÓN DE PROTEÍNAS:
- "Immunoblotting" con antisueros específicos anti: IgG (Beckman), Albúmina (Beckman), Alfa 1 antitripsina (Beckman), Orosomucoide (Dako), Alfa 1 microglobulina (Beckman), cadenas livianas de inmunoglobulinas Kappa (Biocientifica), cadenas livianas de inmunoglobulinas Lambda (Biocientífica), Beta 2 microglobulina (Dako) y como segundo anticuerpo anti-IgG de cabra o conejo (Sigma) marcado con peroxidasa, según correspondiese.
- Espectrometría de masa (MS): Se procesó un spot coloreado con tinción argéntica y un blanco del mismo gel. Se digirió in gel utilizando tripsina como enzima proteolítica. El extractivo de cada una de las muestras se sometió a análisis en el Espectrómetro de Masas tipo MALDI-TOF-TOF, modelo 4800 plus de ABSciex (Concord, Canadá). Los datos fueron obtenidos en Modo Reflectron, seguido de la fragmentación de las señales más importantes. Se utilizó el programa Mascot PMF para la identificación de las proteínas a través de las masas moleculares de los péptidos (M+H+). Para el análisis de los espectros MS/MS se utilizó el programa MS/MS Ion Search de Mascot y el programa Paragom de Protein Pilot.
EVALUACIÓN DE GELES DE ELECTROFORESIS BIDIMENSIONAL
Se procedió a escanear los geles. Mediante el programa analizador de imágenes Image J versión 1.3v se analizaron los "spots" de las muestras, relativo a la banda de 25 kDa del control interno, que permitió corregir las inevitables variaciones en las coloraciones que se observan entre geles. De cada mancha se obtuvo el valor relativo de Absorbancias (R). Cabe destacar que la variable R tuvo relación directa con la concentración de cada spot ya que en todos los geles se sembró la misma cantidad de muestra.
Resultados
El 66% de los pacientes normoalbuminúricos presentaron por el SDS-PAGE, MU entre 68-25 kDa con funcionalidad renal normal (Tabla I) (Fig. 1A).
Tabla I. Distintos perfiles uroproteicos por SDS-PAGE y valores de creatinina sérica en 5 grupos de pacientes diabéticos tipo 2.
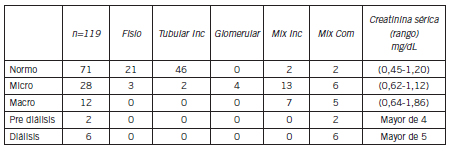
Figura 1. Porcentaje de distintos perfiles uroproteicos en pacientes con diabetes tipo 2.
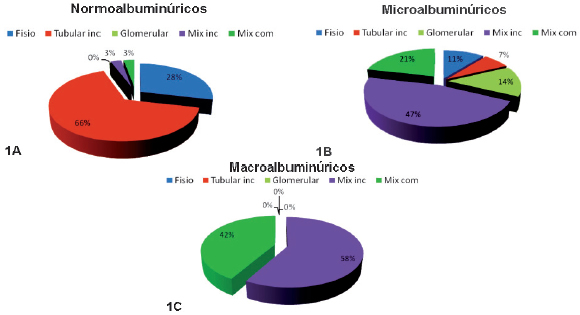
1A) Normoalbuminúricos, 1B) Microalbuminúricos y 1C) Macroalbuminúricos.
Fisio: Fisiológico, Tubular inc: Microproteínas entre 68-25 kDa, Mix inc: Proteinuria mixta con microproteínas entre 68-25 kDa, Mix com: Proteinuria mixta con microproteínas entre 68-12 kDa
En la Figura 2 se observan orinas de pacientes con diabetes tipo 2 normo, micro y macroalbuminúricos sin MU.
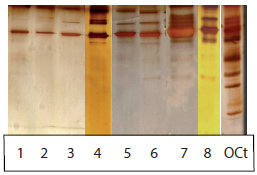
Figura 2. Orinas de pacientes con diabetes tipo 2 sin microproteínas urinarias.
1, 2 y 3: Normoalbuminúricos; 4,5 y 6: Microalbuminúricos; 7 y 8: Macroalbuminúricos. OCt: orina control tubular.
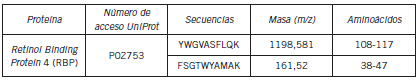
Se realizó el "immunoblotting" a una orina de un paciente en hemodiálisis que presentaba perfil mixto completo, donde se confirmó la identificación de proteínas cuya presencia ya es conocida en la orina (Fig. 3). La identificación de la banda de 20 kDa, que corresponde a la proteína que liga el retinol (RBP), fue confirmada por espectrometría de masa (Tabla II).
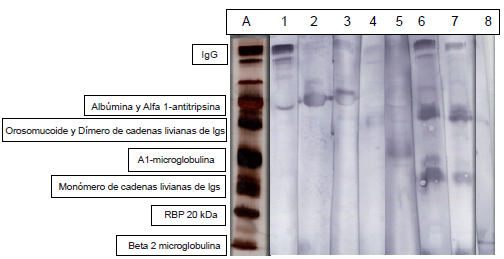
Figura 3. Orina de paciente diabético tipo 2 en hemodiálisis.
"Immunoblotting" frente a antisuero anti-: 1. IgG, 2. Albúmina, 3. Alfa 1-antitripsina, 4. Orosomucoide, 5. Alfa 1 microglobulina, 6. Cadenas livianas de inmunoglobulinas (Igs) Kappa, 7. Cadenas livianas de inmunoglobulinas (Igs) Lambda y 8. Beta 2 microglobulina. A: SDS-PAGE con tinción argéntica.
Tabla II. Identificación por Espectrometría de Masa MALDI-TOF-TOF de la banda de 20 kDa. Secuencias de péptidos de mayor confiabilidad.
Se realizó la electroforesis 2D UC a una orina de cada grupo de los distintos estadios de la ND que presentaban MU con el fin de identificarlas y observar sus modificaciones cuantitativas. Además de las bandas visualizadas en el SDS-PAGE en una dimensión (1D), que también se confirman en la electroforesis 2D UC, se abre el espectro y se evidencia un grupo de proteínas con movilidad electroforética entre alfa-1 y alfa-2 globulinas y un PM entre 70 y 40 kDa aproximadamente, que corresponden al orosomucoide (Oroso) de 41 kDa, a la alfa-1 antitripsina (A1AT) con un PM comprendido entre 45 y 65 kDa que se identificaron por immunoblotting (Fig. 3), a la glicoproteína alfa-2 que precipita con sales de zinc (ZAG) con un PM aproximado de 43 kDa y que se identificó por espectrometría de masa (MS) (13) y a la proteína que une la vitamina D (DBP) con un PM comprendido entre 50-58 kDa, según bibliografía (16). Además, se abre el espectro proteico con movilidad electroforética en beta 1 a tres proteínas con peso molecular 35, 29 y 23 kDa correspondientes al fragmento de 35 kDa de la inter-alfa I inhibidor de tripsina cadena pesada H4 (ITIH4), prostaglandina D2 sintasa tipo-lipocalina o Beta Trace (BT) de 29 kDa y al fragmento del perlecan C-terminal LG3 (23 kDa) (Fig. 4). Dichas proteínas fueron identificadas por espectrometría de masas (Tabla III).
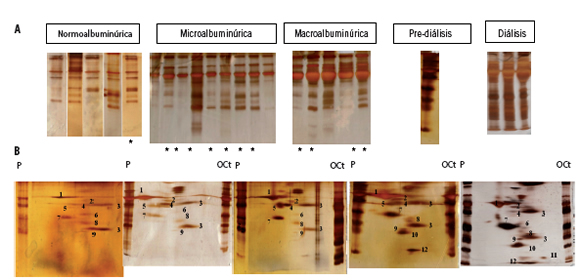
Figura 4. Perfil proteico urinario de pacientes con diabetes tipo 2 en distintos estadios de la ND.
A) Orinas de 23 pacientes SDSPAGE en una dimensión. (*) Pacientes DBT e Hipertensos. B) SDSPAGE 2D UC. Orinas de 5 pacientes con DBT tipo 2, uno por cada estadio de la ND. P: Paciente, OCt: Orina control tubular.
1. Albúmina (68 kDa), 2. Proteína que une la Vitamina D (55 kDa), 3. Cadenas livianas de inmunoglobulinas policlonales (44 y 22 kDa), 4. Zinc-alfa 2 glicoproteína, 5. Orosomucoide (40 kDa), 6. Inter alfa tripsina inhibidor cadena pesada H4 (35 kDa), 7. Alfa 1 microglobulina (30 kDa), 8. Prostanglandina-H2 D-isomerasa o Beta Trace, 9. Péptido LG3 (23 kDa) y 10. Proteína que une el Retinol (20 kDa), 11. Lisozima (14 kDa), 12. Beta 2 microglobulina (12 kDa).
Tabla III. Referencias de Figura 6.
En la Figura 5 se representó R en escala logarítmica, con el objeto de compactar el rango de escala, en función del grado progresivo de daño renal. Se observa que las proteínas marcadoras de daño tubular, A1m, RBP y Beta 2 microglobulina, aumentan su concentración en orina conforme aumenta el daño renal, con el aumento del compromiso del tubulointersticio, mientras que las proteínas Oroso, ITIH4 y BT, disminuyen su concentración en la falla renal terminal.
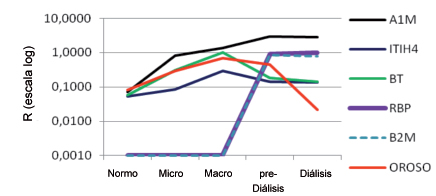
Figura 5. Análisis de Electroforesis Bidimensional en los distintos estadios de la ND: normo, micro, macroalbuminúricos, pre-diálisis y diálisis.
A1M: Alfa 1 microglobulina, ITIH4: Alfa 1 tripsina Inhibidor cadena pesada H4, BT: Beta Trace, RBP: Proteína que liga el Retinol, B2M: Beta 2 microglobulina, OROSO: Orosomucoide
Discusión y Conclusiones
La nefropatía diabética es una complicación que se presenta en el 10% de los pacientes con diabetes tipo 2. En la etapa inicial o subclínica, hay cambios funcionales y estructurales; la detección precoz de estos cambios permite predecir el desarrollo de la enfermedad y a través de la intervención terapéutica, prevenir o retrasar su progresión. En las orinas de los pacientes normoalbuminúricos, el 66% presentaron MU: un grupo "satélite" de la albúmina (similares en carga y peso molecular), entre las que se encuentra el Oroso, la A1AT, la ZAG y la proteína que une la Vitamina D y otro grupo que denominamos "las tres Marías" con movilidad electroforética en beta 1 que corresponden a ITIH4, BT y LG3.
El Oroso no solo es una proteína de síntesis hepática, sino que también puede ser sintetizado por otros tejidos o células, tales como el endotelio vascular (17). Si bien su función en este tipo de endotelio no está claramente definida, interviene en la permeabilidad selectiva de la barrera de filtración glomerular aportando cargas negativas al glicocálix del endotelio (18). Además, es un poderoso predictor de mortalidad cardiovascular (CV) en pacientes normoalbuminúricos con diabetes tipo 2 (19).
La ZAG está involucrada principalmente en la depleción de ácidos grasos desde el tejido adiposo, subsecuentemente llamada "factor movilizador de lípidos" (20). La BT cataliza la isomerización de la prostaglandina H2 a prostaglandina D2 y está involucrada en varias acciones fisiológicas como la regulación del sueño, la inhibición de la agregación plaquetaria y la inducción de la vasodilatación (21-24).
En pacientes con angina pectoris, la concentración plasmática de BT en la vena cardíaca mayor fue más grande que en las arterias coronarias, sugiriendo que la BT es biosintetizada y secretada por el miocardio o en las células endoteliales escleróticas (25). Además, la fuerza de rozamiento o la tensión entre la sangre que circula y la pared vascular (fluid shear stress) fue reportado que aumenta la producción de la expresión del ARNm de BT en células vasculares endoteliales (26). Hirawa N et al. en 2001 demostraron la excreción urinaria incrementada de BT en pacientes con estadio temprano de ND (27). El péptido LG3 es un fragmento del Perlecán, un proteoglicano ampliamente expresado en estadios de desarrollo temprano, en muchos tejidos vascularizados y en el cartílago avascular, que interactúa con otros componentes de la membrana basal glomerular (MBG), y varios factores de crecimiento durante la vasculogénesis (28)(29). La célula endotelial apoptótica libera proteasa, las cuales inducen proteólisis de la MBG, una característica de la vasculopatía crónica del trasplante (30)(31). La proteólisis del perlecán de la MBG lleva a la producción de un fragmento activo carboxilo terminal (LG3) antiapoptótico en las células del músculo liso vascular y en fibroblastos (32)(33). El LG3 aparentemente aumenta su concentración en los distintos estadios de la ND, aun en los dializados, coincidentemente con el avance del daño renal (Fig. 4).
La ITIH4 es una proteína de fase aguda sintetizada principalmente por el hígado (34). La proteína de 120 kDa fue propuesta como precursora de péptidos bioactivos generados por la calicreína plasmática (35). La ITIH4 genera dos fragmentos, uno carboxilo terminal de 35 kDa y el otro de 85 kDa. El de 35 kDa, el cual está O-glicosilado, permanece intacto mientras que el de 85 kDa se continúa fraccionando (36). Los niveles de calicreína tisular están incrementados tempranamente en el riñón de ratas con diabetes tipo 2 inducida por estreptozotocina, y disminuyen los niveles en estadios más avanzados de la enfermedad (37). Esto estaría en concordancia con los aparentes niveles aumentados del fragmento de 35 kDa y con la subsiguiente disminución conforme al avance de la nefropatía (Fig. 4)(Fig. 5).
La A1m está presente en el tejido conectivo perivascular de muchos órganos. La A1m-matriz está distribuida en la interface entre células y el entorno externo (38)(39). Por inmunorreactividad, la A1m fue revelada en fibras elásticas del tejido conectivo de piel, colon y pulmón, y en la lámina elástica interna de los vasos sanguíneos (40).
En las lesiones ateroescleróticas la reacción inflamatoria está presente, y se han detectado subtipos de IgG, sugiriendo la participación de células policlonales B, además de la detección de ARNm de interleuquina 6, 1 alfa y 1 beta (41).
Además, la presencia de cadenas livianas policlonales constituye un marcador de daño vascular reversible con disfunción renal que precede a la progresión de la falla renal irreversible (42).
Jain et al. demostraron por electroforesis bidimensional convencional y espectrometría de masas en muestras de orina de pacientes con diabetes tipo 2 microalbuminúricos, la presencia de proteínas adicionales, como la ZAG, el Oroso, la A1AT y la IgG (43).
Las proteínas ZAG, Oroso, ITIH4, BT, LG3, A1m y cadenas livianas de inmunoglobulinas policlonales parecen tener como denominador común al endotelio vascular, ya que algunas como la ZAG y el Oroso intervienen en la permeabilidad vascular. La BT sintetiza prostaglandina D2 importante en la relajación del músculo liso arterial, el péptido LG3 es generado de un proteoglicano a partir de proteasa de la célula endotelial apoptótica, y el fragmento ITIH4 de 35 kDa es generado por la calicreína, la cual forma parte del sistema calicreína-kinina implicado a nivel circulatorio sistémico y renal, semejante al sistema renina-angiotensina pero con efectos opuestos. Se podría decir que este grupo de proteínas parecen reflejar un cambio en el endotelio vascular y una interacción entre la célula endotelial y la matriz extracelular.
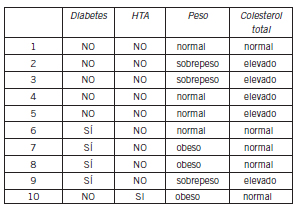
Basturk T et al. (44) observaron que la presencia de proteinuria tubular puede ser un indicador temprano de enfermedad renal diabética en pacientes normoalbuminúricos. Schultz et al. reportaron que los marcadores de disfunción tubular no predicen el riesgo de microalbuminuria en diabetes tipo 1 (45). El tratamiento con perindopril/indapamida tuvo un efecto beneficioso sobre el daño tubular en la ND (44). En la Figura 6 y en la Tabla III, se observan orinas de pacientes sin y con diabetes sin tratamiento hipoglucemiante, ni hipertensivo, ni hipocolesterolémico. Se observa que las MU también están presentes en pacientes no DBT pero con otros factores de riesgo CV tales como la obesidad, la hipertensión arterial sistémica (HTA) y la hipercolesterolemia.

Figura 6. Orinas de pacientes normoalbuminúricos, sin tratamiento.
OCt: orina control tubular. Del 1 al 10 ver referencias en Tabla III.
La injuria tubular está presente en estadios tempranos de nefropatía hipertensiva y puede preceder al daño glomerular (46). Por otra parte, la microalbuminuria y la proteinuria de origen tubular son predictores de riesgo de morbi-mortalidad CV en hipertensión esencial. En un estudio de 3529 pacientes hipertensos no diabéticos, la microalbuminuria y la proteinuria tubular incrementaron la incidencia de eventos cardiovasculares. La normalización de la microalbuminuria, de la proteinuria tubular o de la macroproteinuria durante el tratamiento con inhibidores de la enzima convertidora de angiotensina (IECA), correlacionó con la reducción de los eventos cardiovasculares. Los pacientes con microalbuminuria y proteinuria tubular tuvieron peor pronóstico al ser comparados con los que tenían solamente microalbuminuria o proteinuria tubular (47).
La técnica propuesta de 2D UC, abre el espectro de proteínas urinarias, las cuales no se detectan actualmente por los métodos de rutina empleados en el Laboratorio Clínico. Estas podrían reflejar un daño a nivel vascular y túbulointersticial, y ser de importancia en la detección precoz y en el seguimiento de los distintos tipos de nefropatías.
En un modelo de co-cultivo de células humanas de tejido microvascular endotelial y epitelio tubular proximal, se demostró la existencia de una compleja red de comunicación entre las mismas, que terminaría afectando la función de la célula tubular proximal renal (48).
Finalmente, se concluye que la metodología implementada permite identificar a las MU en el estadio temprano previo a la microalbuminuria en la ND, las cuales se podrían evaluar por SDS-PAGE 1D. Si bien el porcentaje de pacientes con el perfil de MU entre 68-25 kDa es alto en comparación con los pacientes que progresan a la ND, es de importancia clínica tener en cuenta otros factores de riesgo CV debido a que las MU podrían estar reflejando una alteración en la microvasculatura renal y/o sistémica y no significar una progresión a la ND. Las MU detectadas en los pacientes con diabetes tipo 2 normoalbuminúricos no son marcadoras de daño tubular, debido a que en el estadio de falla renal avanzada, estas no aumentan su concentración y muy por el contrario, algunas hasta disminuyen su valor. Por otra parte, estas proteínas estarían estrecha mente vinculadas con el endotelio vascular y podrían reflejar una reacción inflamatoria en el endotelio glomerular y peritubular, conjuntamente con la presencia de modificaciones hemodinámicas en el riñón, y estar comprometiendo el mecanismo de reabsorción tubular de dichas proteínas. Este perfil vascular-tubular urinario sería de utilidad en patologías sistémicas con riesgo CV y funcionalidad renal conservada.
AGRADECIMIENTOS
El presente trabajo fue realizado con el Subsidio de la Secretaría de Ciencia y Técnica de la Universidad de Buenos Aires (UBACyT-CB05).
1. Bernard A, Thielemans N, Lauwerys R. Urinary protein 1 or Clara cell protein: A new sensitive marker of proximal tubular dysfunction. Kidney Int 1994; 46 (Supl 47): 34-7. [ Links ]
2. Holm J, Nielsen N, Hemmingsen L. Retinopathy in Type II diabetes mellitus associated with above-normal urinary excretion of RBP. Kidney Int 1994; 46 (Supl 47): 105-8. [ Links ]
3. Madalena L, Facio M, Bresciani P, Fraind S, Alejandre M, Pandolfo M, et al. Excreción de proteínas de bajo peso molecular en pacientes con proteinuria a cadena liviana como marcadoras de disfunción renal. Acta Bioquím Clín Latinoam 2004; 38 (1): 17-22. [ Links ]
4. Teppo A, Honkanen E, Ahonen J, Grönhagen-Riska C. Changes of urinary a-1 microglobulin in the assesment of prognosis in renal transplant recipients. Transplantation 2000; 70 (8): 1158-9. [ Links ]
5. Piscator M. Early detection in tubular dysfunction. Kidney Int 1991; 40 (Supl 34): S5-S1. [ Links ]
6. Gregory MJ, Schwartz GJ. Diagnosis and treatment of renal tubular disorders. Seminars in Nephrology 1998; 18 (3): 317-29. [ Links ]
7. Bohle A, Müller G, Wehrmann M, Mackensen-Haen S, Cheng Xiao J. Pathogenesis of chronic renal failure in the primary glomerulopathies, renal vasculopathies, and chronic interstitial nephritides. Kidney Int 1996; 49 (Supl 54): 2-9. [ Links ]
8. Bazzi C, Petrini C, Rizza V, Arrigo G, Beltrame A, D´Amico G. Characterization of proteinuria in primary Glomerulonephritides. SDS-PAGE Patterns: Clinical significance and prognostic value of low molecular weight ("tubular") proteins. Am J Kidney Dis 1997; 29 (1): 27-35. [ Links ]
9. Facio ML, Madalena LB, Bragantini G, Fraind S, Bresciani P, Pizzolato M. Determinación de microproteínas urinarias en orinas sin concentrar. Acta Bioquím Clín Latinoam 2000; 36 (3): 285-92. [ Links ]
10. Bernard A, Moureau D, Lauwerys R. Comparison of retinol-binding protein and Beta 2-microglobulin determination in urine for the early detection of tubular proteinuria. Clin Chim Acta 1982; 126: 1-7. [ Links ]
11. Facio ML, Madalena LB, Bresciani PD, Pandolfo M, Kairúz A, Alejandre ME, et al. Evaluación del perfil tubular renal mediante electroforesis en gel de poliacrilamida con dodecil sulfato de sodio. Acta Bioquím Clín Latinoam 2006; 40 (3): 383-90. [ Links ]
12. Boesken WH. Diagnostic significance of SDS-PAA-electrophoresis of urinary proteins: different forms of proteinuria and their correlation to renal diseases. Curr Prob Clin Biochem 1979; 9: 235-48. [ Links ]
13. Facio ML, Madalena LB, Fraind S, Alejandre ME, Bresciani P, Pizzolato M. Electroforesis bidimensional en orina: una alternativa para el laboratorio clínico. Acta Bioquím Clín Latinoam 2013; 47 (1): 37-46. [ Links ]
14. Centers for Disease Control and Prevention (CDC). Incidence of end-stage renal disease attributed to diabetes among persons with diagnosed diabetesUnited States and Puerto Rico, 1996-2007. MMWR Morb Mortal Wkly Rep 2010; 59: 1361-6. [ Links ]
15. Switzer RC, Switzer RC 3rd, Merril CR, Shifrin S. A highly sensitive silver stain for detecting proteins and peptides in polyacrylamide gels. Anal Biochem 1979; 98 (1): 231-7. [ Links ]
16. Lapin A, Gabl F, Kopsa H. Diagnostic use of analysis of proteins by a practicable sodium dodecyl-electrophoresis method and rapid two-dimensional electrophoresis. Electrophoresis 1989; 10: 589-95. [ Links ]
17. Sôrensson J, Matejka G, Ohlson M, Haraldsson B. Human endothelial cells produce orosomucoid, an important component of the capillary barrier. Am J Physiol 1999; 276: H530-H534. [ Links ]
18. Camici M. Renal glomerular permselectivity and vascular endothelium. Biomedicine & Pharmacother 2005; 59: 30-7. [ Links ]
19. Cristiansen MS, Hommel E, Magid E, Rasmunssen-Feldt B. Orosomucoid in urine is a powerful predictor of cardiovascular mortality in normoalbuminuric patients with type 2 diabetes at five years of follow-up. Diabetología 2005; 48: 386-93. [ Links ]
20. Bao Y, Bing C, Hunter L, Jenkins JR, Wabitsch M, Trayhurn P. Zinc-a2-glycoprotein, a lipid mobilizing factor, is expressed and secreted by human (SGBS) adipocytes. FEBS Lett 2005; 579: 41-7. [ Links ]
21. Urade Y, Fujimoto N, Hayaishi O. Purification and characterization of rat brain prostaglandin D synthase. J Biol Chem 1985; 260: 12410 -5. [ Links ]
22. Hayaishi O, Urade Y. Prostaglandin D2 in sleep-wake regulation: Recent progress and perspectives. Neuroscientist 2002; 8: 12-5. [ Links ]
23. Bushfield M, McNicol A, MacIntyre DE. Inhibition of platelet-activating-factor-induced human platelet activation by prostaglandin D2: Differential sensitivity of platelet transduction processes and functional response to inhibition by cyclic AMP. Biochem J 1985; 232: 267-71. [ Links ]
24. Braun M, Schror K. Prostaglandin D2 relaxes bovine coronary arteries by endothelium-dependent nitric oxide-mediated cGMP formation. Circ Res 1992; 71: 1305-13. [ Links ]
25. Inoue T, Takayanagi K, Morooka S, Uehara Y, Nakajima H, Urade Y, et al. Serum prostaglandin D synthasa level after coronary angioplasty may predict occurrence of retenosis. Tromb Haemost 2001; 85: 165-70. [ Links ]
26. Taba Y, Sasaguri T, Miyagi M, Abumiya T, Ikeda T, Mitsumata M, et al. Fluid shear stress induces lipocalin-type prostaglandin D2 synthasa expression in vascular endotelial cells. Circ Res 2000; 86: 967-73. [ Links ]
27. Hirawa N, Uehara Y, Ikeda T, Seiki K, Nakajima H, Urade Y, et al. Urinary prostanglandin D syntasa (beta trace) excretion increases in the early stage of diabetes mellitus. Nephron 2001; 42: 1201-7. [ Links ]
28. Yurchenco PD, Amenta PS, Patton BL. Basement membrane assembly, stability and activities observed through a developmental lens. Matrix Biol 2004; 22 (7): 521-38. [ Links ]
29. Hassell J, Yamada Y, Arikawa-Hirasawa E. Role of perlecan in skeletal development and diseases. Glycoconj J 2002; 19(4-5): 263-7. [ Links ]
30. Cailhier JF, Sirois I, Laplante P, Lepage S, Pshezhetsky AV, Hébert MJ, et al. Caspase-3 activation triggers extracellular cathepsin L release and endorepellin proteolysis. J Biol Chem 2008; 283: 27220-9. [ Links ]
31. Joosten SA, Sijpkens YW, van Ham V, van den Heuvel B, van Kooten C, Paul LC, et al. Antibody response against the glomerular basement membrane protein agrin in patients with transplant glomerulopathy. Am J Transplant 2005; 5: 383-93. [ Links ]
32. Raymond MA, Désormeaux A, Laplante P, Landry K, Pshezhetsky AV, Hébert MJ, et al. Apoptosis of endothelial cells triggers a caspase-dependent anti-apoptotic paracrine loop active on VSMC. FASEB J 2004; 18: 705-7. [ Links ]
33. Laplante P, Raymond MA, Labelle A, Abe J, Iozzo RV, Hébert MJ. Perlecan proteolysis induces an alpha2beta1 integrin- and Src family kinase-dependent anti-apoptotic pathway in fibroblasts in the absence of focal adhesion kinase activation. J Biol Chem 2006; 281: 30383-92. [ Links ]
34. Piñeiro M, Alava N, González-Ramón J, Lasierra L, Larrad A, Piñeiro F, et al. ITIH4 serum concentration increases during acute phase processes in human patients and is upregulated by interleukin 6 in hepatocarcinoma HepG2 cells. Biochem. Biophys Res Commun 1999; 263: 224-9. [ Links ]
35. Nishimura H, Kakizaki I, Muta T, Sasaki N, Yamashita T, Nagasawa S, et al. cDNA and deduced amino acid sequence of human PK-120, a plasma kallikrein-sensitive glycoprotein. FEBS Lett 1995; 357: 207-11. [ Links ]
36. Pu XP, Iwamoto A, Nishimura H, Nagasawa S. Purification and characterization of a novel substrate for plasma kallikrein (PK-120) in human plasma. Biochim Biophys Acta 1994; 1208: 338-43. [ Links ]
37. Campbell DJ, Kladis A, Zhang Y, Jenkins AJ, Prior DL, Yii M, et al. Increased tissue kallikrein levels in type 2 diabetes. Diabetología 2010; 53 (4): 779-85. [ Links ]
38. Logdberg LE, Akerstrom B, Badve S. Tissue distribution of the lipocalin alpha 1-microglobulin in the developing human fetus. J Histochem Cytochem 2000; 48: 1545-52. [ Links ]
39. Berggard I, Enghild JJ, Badve S, Salafia CM, Logdberg LE, Akerstrom B. Histologic distribution and biochemical properties of a1-microglobulin in human placenta. Am J Reprod Immunol 1999; 41: 52- 60. [ Links ]
40. Odum L, Nielsen HW. Human protein HC (a1-microglobulin) and inter-alpha-trypsin inhibitor in connective tissue. Histochem J 1994; 26: 799- 803. [ Links ]
41. Shiga R. Immunoglobulin in atherosclerotic lesions of human aorta. Jpn Heart J 1999; 40(6): 765-73. [ Links ]
42. Fiori P, Giannetti Luigi M, Iurato L, Tammaro C, Esposito G, Monaco M. Polyclonal light chains in cerebrovascular disease. Neuropsychiatr Dis Treat 2010; 6: 533-7. [ Links ]
43. Jain S, Rajput A, Kumar Y, Uppuluri N, Arvind AS, Tatu U. Proteomic analysis of urinary protein markers for accurate prediction of diabetic kidney disorder. J Assoc Physicians India 2005; 53: 513 - 20. [ Links ]
44. Basturk T, Altuntas Y, Kurklu A, Aydin L, Eren N, Unsal A. Urinary N-acetyl B glucosaminidase as an earlier marker of diabetic nephropathy and influence of low-dose perindopril/indapamide combination. Ren Fail 2006; 28 (2): 125-8. [ Links ]
45. Schultz CJ, Dalton RN, Neil HA, Konopelska-Bahu T, Dunger DB. Markers of renal tubular dysfunction measured annually do not predict risk of microalbuminuria in the first few years after diagnosis of Type I diabetes. Diabetologia 2001; 44 (2): 224-9. [ Links ]
46. Tylicki L, Manitus J, Lysiak-Szydlowska W, Rutkowski B. Tubular injury: the first symptom of hipertensive kidney involvement. Med Sci Monit 2003; 9 (4): 187-93. [ Links ]
47. Schrader J, Luders S, Kulschewski A, Hammersen F, Zuchner C, Venneklaas U, et al. MARPLE Study Group Microalbuminuria and tubular proteinuria as risk predictors of cardiovascular morbidity and mortality in essential hypertension: final results of a prospective long-term study. (MARPLE Study). J Hypert 2006; 24 (3): 541-8. [ Links ]
48. Aydin S, Signorelli S, Lechleitner T, Joannidis M, Pleban C, Perco P, et al. Influence of microvascular endothelial cells on transcriptional regulation of proximal tubular epithelial cells. Am J Physiol Cell Physiol 2008; 294: C543-C554. [ Links ]
Recibido: 10 de diciembre de 2013
Aceptado: 9 de mayo de 2014














