Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957
Acta bioquím. clín. latinoam. vol.48 no.3 La Plata set. 2014
BIOQUÍMICA CLÍNICA
Estudio transversal bioquímico clínico en pacientes con artritis reumatoidea y su relación con el tabaquismo*
Clinical laboratory transversal study in patients with rheumatoid arthritis and its relationship with smoking habits
Estudo transversal bioquímico clínico em pacientes com artrite reumatóide e sua relação com o tabagismo
Marcela Benhaim1*, Liliana Doglia2*, Viviana Canella1*, Susana López1**, Julio Hofman3**, Marta Espósito3**
1 Bioquímica.
2 Lic. en Análisis Clínicos.
3 Médico.
* Facultad de Ciencias Exactas, Químicas y Naturales, Universidad de Morón. Cabildo 134 Morón (1708) Pcia. Buenos Aires, Argentina. exactas@unimoron.edu.ar, marcelabdec@hotmail.com
** Hospital Interzonal General de Agudos Eva Perón.
CORRESPONDENCIA BIOQ. MARCELA BENHAIM Facultad de Ciencias Exactas, Químicas y Naturales Universidad de Morón Cabildo 134 1708 MORÓN - Pcia. Buenos Aires, Argentina E-mail: marcelabdec@hotmail.comexactas@unimoron.edu.ar
* Este trabajo es parte de un proyecto de investigación llevado adelante por la Facultad de Ciencias Exactas, Químicas y Naturales y la Secretaría de Ciencia y Tecnología de la Universidad de Morón, conjuntamente con el Laboratorio del HIGA Eva Perón (PID 09-004/10).
Resumen
En una población de pacientes con artritis reumatoidea (AR) se estudió la relación de esta patología con el tabaquismo, su perfil hormonal, la concentración de interleuquina 6 (IL 6) y la coexistencia de fibromialgia. Casi en el 50% de los pacientes, los valores de IL 6 fueron seis veces superiores al valor considerado normal. El hábito del tabaco, la edad y el tipo de tratamiento no influyeron en los valores de IL 6. En el subgrupo de pacientes con fibromialgia se observaron tanto altos niveles de IL 6 como bajos niveles de dehidroepiandrosterona (DHEA).
Palabras clave: Artritis reumatoidea; Fibromialgia; Status hormonal; Tabaquismo; Interleuquina 6.
Summary
The relation between rheumatoid arthritis and smoking habits, hormonal status, interleuquin-6 levels and fibromyalgia in a population of patients was analyzed. Almost 50% showed IL6 values six times higher than the normal level. Smoking habits, age and the type of treatment did not influence IL-6 concentrations. Patients with fibromyalgia had high levels of IL6 as well as low dehydroepiandrosterone values.
Key words: Rheumatoid arthritis; Fibromyalgia; Hormonal status; Smoking habits; Interleuquin 6.
Resumo
Estuda-se numa população de pacientes com artrite reumatóide a relação desta patologia com o tabagismo, seu perfil hormonal, a concentração de interleucina 6 e a coexistência de fibromialgia. Quase no 50% dos pacientes os valores de IL 6 foram seis vezes superiores ao valor considerado normal. O hábito de fumar, a idade e o tipo de tratamento não influíram nos valores de IL 6. No subgrupo de pacientes com fibromialgia observa-se tanto altos níveis de IL 6 como baixos níveis de DHEA.
Palavras-chave: Artrite reumatóide; Fibromialgia; Status hormonal; Tabagismo; Interleuquina 6.
Introducción
La artritis reumatoidea (AR) es la artritis inflamatoria más común, que afecta al 0,8% de la población adulta en todo el mundo. Suele iniciarse entre los 30 y los 50 años. Es responsable de grandes gastos en salud con un gran impacto económico por el nivel elevado de deterioro funcional. Si no se la trata dentro de los tres años de realizado el diagnóstico, entre un 20 y un 30% del total de las personas con AR llegan a la discapacidad permanente (1).
Se ha comprobado que el sexo femenino, los antecedentes familiares de AR, la edad avanzada, la exposición a los silicatos y el tabaquismo favorecen la predisposición a sufrir la enfermedad (2).
Algunos estudios han mostrado que los pacientes con AR presentan una mayor severidad de la enfermedad si son fumadores (3). La explicación parece residir en un gen, según revelan investigadores del Staffordshire Rheumatology Center del Reino Unido (4). Asimismo, científicos de la Universidad de Alabama, en Birmingham, EE.UU., indican que el tabaquismo aumenta el riesgo de padecer AR en mujeres posmenopáusicas (5).
La interleuquina 6 (IL 6) pertenece a una amplia familia de citoquinas con intensa actividad pro-inflamatoria y conocida implicancia en la fisiopatología de la AR. Algunos autores proponen a la IL 6 como marcador de actividad de la enfermedad, particularmente cuando se sospecha actividad subclínica. De la actividad inflamatoria persistente depende el mal pronóstico articular (6-9).
Se ha demostrado que fumar cigarrillos eleva de 2 a 4 veces el riesgo de padecer AR. En presencia de epitope compartido (marcador de mal pronóstico) dicho hábito eleva el riesgo para sufrir AR 21 veces y en más de 5 veces la posibilidad de presentar anticuerpos anticitrulinados (anti-CCP). Por otra parte, los tabaquistas con AR tienen doble posibilidad de presentar factor reumatoideo (+) respecto de las personas que no fuman. Esto es particularmente notorio en sujetos que han fumado por muchos años con una intensidad de tan solo 5 a 6 cigarrillos por día. Llamativamente, ser ex fumador no exime del riesgo, ya que el efecto se mantiene por un lapso de 10 a 19 años después de abandonar el hábito.
Pocos trabajos han abordado el impacto del tabaquismo en la evolución de la enfermedad y su relación con la presencia de títulos elevados de IL 6. La mayoría de ellos sólo logró demostrar que fumar se asocia con enfermedad erosiva, con presencia de nódulos y vasculitis. Por otra parte, no pocas veces los pacientes con AR padecen una fibromialgia (FM) asociada. Distintos investigadores han encontrado en pacientes con FM primaria niveles elevados de IL 6 en tejidos e incluso en sangre, así como alteraciones en los ejes adrenal, tiroideo, somatotrófico, modificaciones en las vías serotoninérgica y noradrenérgica central, en el metabolismo de la fenilalanina y valores altos de prolactina (10-16).
En estudios previos hechos por este mismo equipo de investigación se ha detectado que la hormona dehidroepiandrosterona (DHEA) se encontraba frecuentemente baja en pacientes con enfermedades autoinmunes y, asimismo, se han registrado aumentos de prolactina en pacientes con fibromialgia (17).
El presente trabajo intenta focalizarse en la artritis reumatoidea, planteando si el tabaquismo, que es un factor que aumenta el riesgo de padecer AR, modifica los valores de IL 6. También se pretendieron detectar las posibles interrelaciones entre tabaquismo, FM, actividad de la enfermedad, factores hormonales y la IL 6.
La hipótesis de trabajo fue que el tabaquismo en pacientes con AR puede tener una correlación con los valores de IL 6, los índices de actividad de la enfermedad, los diversos tratamientos, la presencia de FM y ciertos patrones de cambio en los ejes hormonales. Para verificar esta hipótesis se plantearon los siguientes objetivos:
• evaluar potenciales relaciones entre consumo de cigarrillos y actividad persistente en una muestra hospitalaria del Conurbano Bonaerense de pacientes con AR en tratamiento;
• conocer si existe relación entre el consumo de cigarrillos y los niveles elevados de IL 6 en dicha población;
• evaluar potenciales relaciones entre FM y actividad persistente;
• conocer si existe elevación mayor de IL 6 en los pacientes con AR y FM que en aquellos sin FM;
• evaluar alteraciones de los distintos ejes neuroendocrinos en ambas subpoblaciones (con y sin FM);
• evaluar alteraciones de los distintos ejes neuroendocrinos en las subpoblaciones con y sin consumo de tabaco.
Materiales y Métodos
El estudio fue observacional, transversal y analítico. Para diagnóstico de AR se utilizaron los criterios del Colegio Americano de Reumatología (American College of Rheumatology, ACR) de 1987 (18). Para diagnóstico de FM se utilizaron los criterios ACR de 1992 (19). Para pacientes con 6 a 10 puntos dolorosos se generó el término "rasgo fibromiálgico". Para tabaquismo se definieron los términos "tabaco activo" (incluye ex fumadores), "activo actual", "tabaco pasivo" (incluye ex fumadores), "activo y pasivo" y "sólo pasivo". Se evaluó con encuesta auto-administrada.
Se tomó como población de estudio a los pacientes con diagnóstico de AR atendidos consecutivamente entre marzo y junio de 2009 en un Hospital Interzonal de Agudos del Conurbano Bonaerense (HIGA Eva Perón).
A todos los pacientes incluidos en el trabajo se les realizó la historia clínica completa habitual en la que normalmente se recaban datos de adicciones, entre ellas el consumo de tabaco, informando a los pacientes que estos datos podrían ser utilizados para un estudio de investigación, manteniendo el anonimato conforme a la práctica médica habitual y acorde al secreto médico, constando en todos los casos que los pacientes aceptaban participar. Este procedimiento fue avalado por el Comité de Ética del Hospital.
Como criterios de inclusión se consideraron los pacientes que cumplían con los siguientes requisitos:
1) Que tuviesen diagnóstico de AR según criterios del ACR 87 con algún tipo de tratamiento,
2) Que habitasen en el área programática del Hospital,
3) Que hubieran aceptado participar en el estudio.
Como criterios de exclusión se consideraron las siguientes premisas:
1) Que no hubiesen recibido corticoides parenterales o infiltraciones cuatro semanas antes de ser seleccionados,
2) Que no hubiesen incurrido en alcoholismo y/o abuso de drogas.
Como variables para perfil clínico se usaron las siguientes: edad, sexo, nacionalidad, escolaridad, ocupación, tiempos evolutivos (a la primera consulta, desde el diagnóstico), tiempo de inicio del primer medicamento antirreumático modificador de la enfermedad (DMARD), tipo de tratamiento, número de articulaciones dolorosas (NAD), número de articulaciones tumefactas (NAT), índice compuesto de actividad, basado en el conteo de 28 articulaciones (DAS 28 de 3 y 4 variables) y escala visual análoga de dolor y actividad (VAS), PCR (proteína C reactiva) y VSG (velocidad de sedimentación globular).
Para evaluar la variable tabaquismo se llevó a cabo una encuesta auto-administrada en la que se emplearon las siguientes variables: fumadores activos (ex fumadores y actuales) y pasivos; tiempo e intensidad de exposición.
Para el estudio analítico específico se propusieron las siguientes características:
Para el análisis comparativo:
I. Se establecieron comparaciones entre 2 grupos definidos según tipo de exposición: fumadores vs. no fumadores.
II. Se establecieron comparaciones entre 2 grupos definidos según concurrencia o no de FM: portadores de FM vs. no portadores.
III. Se estratificó en 4 grupos: 1) Fumador con FM; 2) No fumador con FM; 3) Fumador sin FM; 4) No fumador sin FM,
Las variables consideradas fueron:
1. Demográficas: Edad en años (numérica continua); Sexo (categórica dicotómica).
2. De exposición tóxica: Tabaco (sí/no categórica dicotómica).
3. Variables propias de la enfermedad: Tiempo de evolución al diagnóstico; Tiempo de evolución al primer DMAR.
4. Exposición al tratamiento: Tratamientos combinados con DMAR sí/no (categórica dicotómica) (DMAR + biológico se consideró tratamiento combinado); Tratamiento concurrente con esteroides sí/no (categórica dicotómica).
5. Variables de actividad clínica: Número de articulaciones dolorosas (numérica discreta); Número de articulaciones inflamadas (numérica discreta); Escala visual analógica de actividad por el paciente (numérica continua); eritrosedimentación (numérica continua); PCR (numérica continua).
En el laboratorio del HIGA Eva Perón se procesaron todas las muestras para determinar IL 6, TSH, cortisol plasmático, DHEA y otras variables para el seguimiento de la enfermedad, como, por ejemplo, eritrosedimentación y PCR. Las muestras sanguíneas se centrifugaron post extracción. Se almacenaron a -20 ºC y fueron procesadas simultáneamente. Para la determinación cuantitativa de IL 6, TSH, cortisol y DHEA se utilizó la técnica de quimioluminiscencia, ensayo inmunométrico enzimático secuencial, realizado con el autoanalizador Siemens Immulite 1000 LK6PZ (Florida, EE.UU.).
En todos los casos en el laboratorio se realizaron controles de calidad internos, y controles externos provenientes de la Federación Bioquímica de la Provincia de Buenos Aires (PEEC), del Ministerio de Salud de la Provincia de Buenos Aires y del ProgBA CEMIC.
Para procesar estadísticamente los resultados se utilizaron métodos gráficos de estudio de distribuciones (box-plot) (20) (21), medias, medianas, prevalencias, ODDS ratio, coeficiente de correlación de Spearman, test de Mann Whitney. Se utilizó el software SPSS 17.0 (22).
Resultados
Los resultados obtenidos se muestran en las Tablas I a V. En la Tabla I se indican los valores de TSH, DHEA, cortisol, IL 6 y eritrosedimentación en la población estudiada. La Tabla II agrupa las respectivas variables demográficas. Las Tablas III y IV muestran los valores de exposición al tratamiento en la población analizada. La relación de cada paciente con el tabaquismo se resume en la Tabla V.
Tabla I. Valores de TSH, DHEA, cortisol, IL 6 y eritrosedimentación en la población analizada.

Tabla II. Variables demográficas en la población analizada.
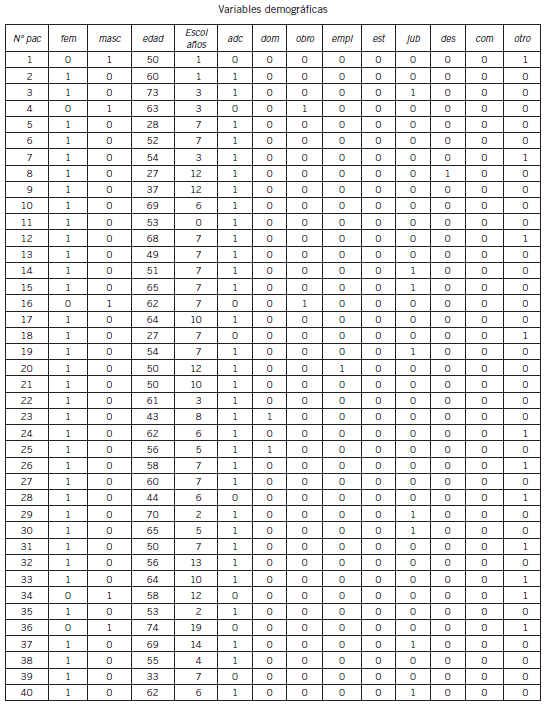
Escol: escolaridad, adc: ama de casa, dom: empleada doméstica, obro: obrero, emp: empleado, est: estudiante, jub: jubilado, des: desempleado, com: comerciante.
Tabla III. Valores de exposición al tratamiento en la población analizada.
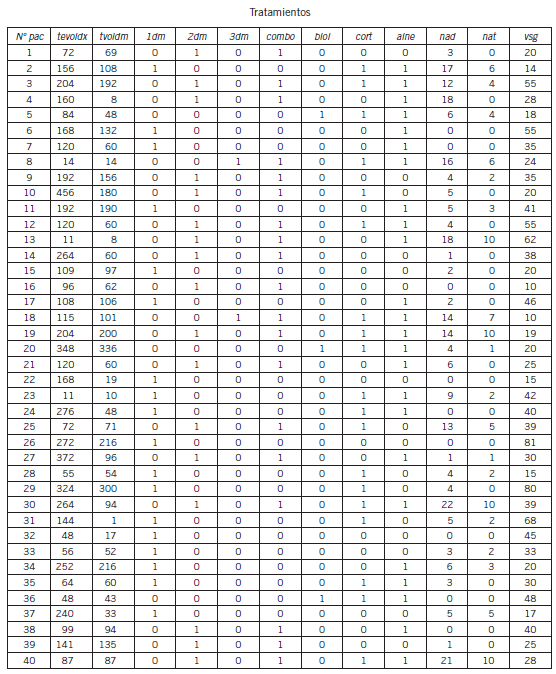
Abreviaturas: N° pac: número de paciente; tevoldx: tiempo de evolución al diagnóstico; tevoldm tiempo de evolución al DMARD; 1dm: tiempo de evolución al primer DMARD; 2dm: tiempo de evolución al segundo DMARD; 3dm: tiempo de evolución al tercer DMARD; combo: tratamiento combinado; biol: biológico; cort: corticoides; aine: droga antiinflamatoria no esteroidea; nad: número de articulaciones dolorosas; nat: número de articulaciones tumefactas; vsg: velocidad de sedimentación globular
Tabla IV. Valores de exposición al tratamiento en la población analizada (Cont.).
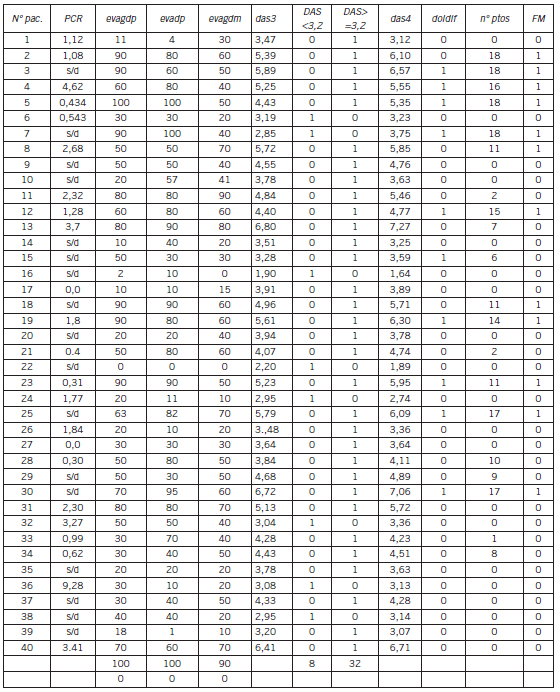
Abreviaturas: N° pac.: número de paciente; PCR: proteína C reactiva; evagdp: EVA del estado general por el paciente; evadp: EVA de dolor por el paciente; evagdm: EVA del estado general por el médico; das3: DAS 28 con 3 variables; das4: DAS 28 con 4 variables; doldif: dolor difuso (0 = ausente; 1 = presente); FM: fibromialgia; s/d: sin datos.
Tabla V. Relación con el tabaquismo en la población estudiada.
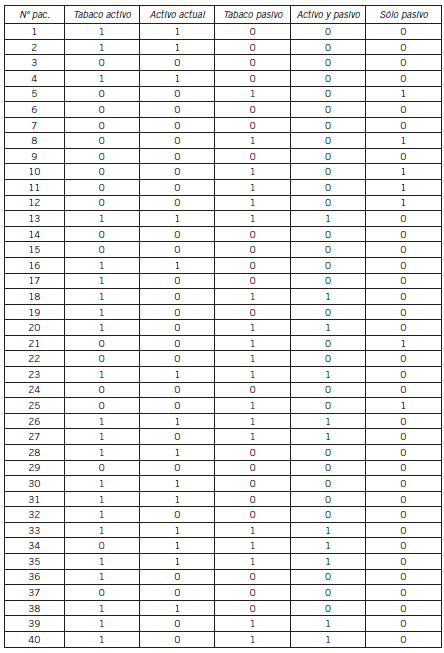
Las características de la población en estudio fueron las siguientes: sexo femenino 87,5% (35/40); sexo masculino 12,5% (5/40); edad: mediana 55,5 años R (27-74); amas de casa: 80% (32/40); tiempo de evolución de la enfermedad: mediana 120 meses desde el diagnóstico, R (11-456); tiempo de evolución desde el primer DMARD: mediana 150,5 meses, R (3-336); tratamiento con corticoides: 47,5% (19/40); tratamiento 1 DMARD: 45% (18/40); tratamiento combinado: 47,5% (19/4); tratamiento biológico: 7,5% (3/40); mediana DAS 28 (3): 3,92 (1,9-6,8); mediana DAS 28 (4): 4, R(1,64- 7,27); con fibromialgia: 30% (12/40); con rasgos de fibromialgias: 12,5% (5/40); tabaquismo activo: 35% (14/40).
La IL 6 para la totalidad de la muestra se indica en la Figura 1. Se observa que presenta una mediana de 19,05 pg/mL (6,1-128), con un rango intercuartilo de 16,2. Se destaca que todos los pacientes tuvieron valores altos de IL 6. La proporción resultó ser la siguiente: IL 6<10, 23%; 10≤IL 6≤20, 30%, IL 6>20, 47%.
Fig. 1. Concentración de IL 6 en la totalidad de la muestra.
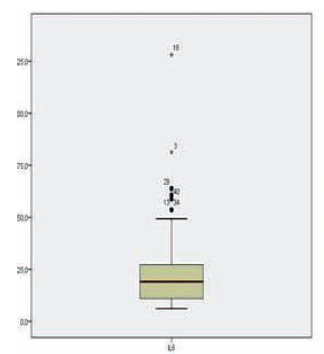
La mediana de IL 6 en los pacientes clínicamente inactivos (22,5%) fue de 20,5 pg/mL (8,5-49,3), con rango intercuartil=14,8.
Los pacientes con más de 6 puntos dolorosos (FM + rasgo FM) tuvieron casi 9 veces más probabilidad de tener IL 6 =10 que el resto (OR= 8,53 IC 95%=0,95-76,62 p=0,03. No hubo correlación entre la edad, los distintos tiempos evolutivos, la eritrosedimentación y los niveles de IL 6. Los datos se agrupan en la Tabla VI.
Tabla VI. Relación de los niveles de IL 6 con la edad, los tiempos evolutivos de la enfermedad y la eritrosedimentación de los pacientes.
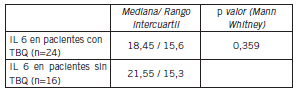
En la Figura 2 se indica la correlación clínica con la IL 6. El DAS 28 se correlacionó con mayores niveles de IL 6, coeficiente de correlación de Spearman 0,371 (p=0,018). En cuanto a la comparación de la IL 6 en relación al tabaquismo (Fig. 3), los valores se indican en la Tabla VII.
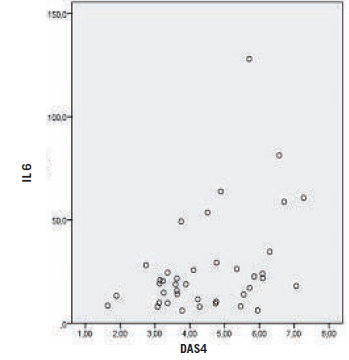
Fig. 2. Correlación clínica con la IL 6.
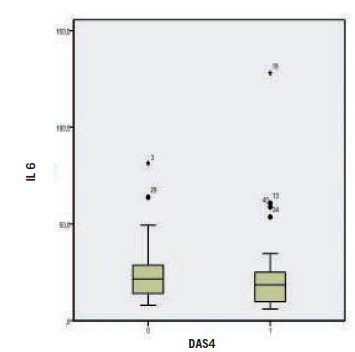
Fig. 3. Concentración de la IL 6 según tabaquismo.
Tabla VII. Datos de los niveles de IL 6 en relación con el hábito del tabaquismo
Con respecto a la comparación en relación a la fibromialgia (Fig. 4), los datos se agrupan en la Tabla VIII.
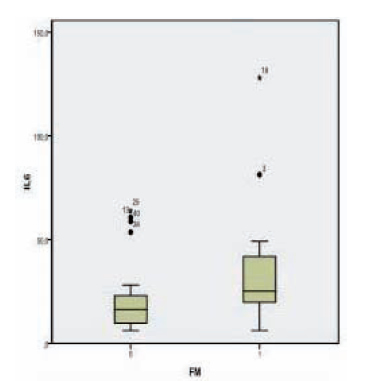
Fig. 4. Concentración de la IL 6 según la fibromialgia.
Tabla VIII. Relación de los niveles de IL 6 con la fibromialgia.

Se encontraron valores de DHEA <15 μg/dL en el 75% de pacientes con FM (VN: mujeres 15- 350 μg/dL y hombres 35- 440 μg/dL). Aquellos individuos que tuvieron valores superiores a 15 presentaban menos puntos activos de fibromialgia. El cortisol plasmático presentó una media de 13,37 μg/mL (rango de 1,09-35,1) y el 17,9% de la muestra tuvo valores superiores a 20 μg/mL.
Discusión y Conclusiones
La AR fue una de las primeras enfermedades inflamatorias en que se describió un importante aumento de la expresión de IL 6, detectable tanto en plasma como en tejido sinovial. El aumento en plasma fluctúa rápidamente en sentido concordante con la actividad, la severidad y la respuesta positiva a las terapias, del mismo modo que su marcador indirecto, la PCR.
En el tejido sinovial, tanto las células mononucleares del infiltrado como los fibroblastos sinoviales o sinoviocitos parecen contribuir a la síntesis excesiva de IL 6. Más reciente es el conocimiento de una forma de diferenciación o polarización de las células T efectoras proinflamatorias denominada Th17 por su producción de IL 17. La diferenciación T depende del conjunto de citoquinas presentes en su medio durante su activación por células presentadoras de antígeno.
Así, la forma Th1 depende fundamentalmente de IL 12, la Th2 de IL 4 y la diferenciación Th17 y Treg (reguladoras), del factor de crecimiento transformador beta (TGFß). En presencia de TGFß, el destino de la célula T hacia proinflamatoria (Th17) o antiinflamatoria (Treg) depende de la presencia en el medio de citoquinas proinflamatorias, fundamentalmente IL 6. Esta última no sólo favorece la generación de células Th17, sino que bloquea la diferenciación de células Treg, de efectos antiinflamatorios e inmunosupresores.
Actualmente algunos datos apuntan a la polarización Th17 como el mecanismo central que explicaría la participación de las células T en la AR. La IL 17 es una citoquina abundante en el medio reumatoide con importantes acciones proinflamatorias, de amplio espectro sobre múltiples tipos celulares. Esto, junto con la escasa presencia en la AR de los fenotipos Th1 y Th2, subraya la potencial importancia de este mecanismo efector T. Sin embargo, tanto la importancia de las células Th17 como de la IL 6 en su diferenciación en la AR debe ser confirmada. El bloqueo paralelo de la diferenciación Treg inducido por la IL 6 puede ser también un factor importante, ya que estas células son deficitarias o disfuncionales en la AR y su recuperación se ha observado durante la respuesta terapéutica a agentes anti-TNFa. En la población estudiada se pudo constatar que la presencia de valores altos de IL 6 fue la regla, incluso en pacientes con remisión clínica o con baja actividad (todos presentaron más de 5 pg/mL).
La mediana de IL 6 fue de 19,05 (rango de 6,1-128). La mediana de los pacientes clínicamente inactivos (22,5%) fue de 20,5 pg/mL. Casi el 50% de los pacientes tuvo valores de IL 6 cuya cifra representaba seis veces el valor de referencia para la población normal o aún más. Se observó asimismo que el DAS 28 correlacionó con mayores niveles de IL 6 (coeficiente de Spearman: 0,371).
Algunos autores proponen a la IL 6 como marcador de actividad de la enfermedad, particularmente cuando se sospecha actividad subclínica. En virtud de los valores hallados en esta investigación, se coincide en que la IL 6 podría ser utilizada como biomarcador útil adicional de respuesta al tratamiento, particularmente cuando se sospecha baja actividad clínica. Los estudios en las últimas dos décadas asociaron el tabaquismo con la AR, en especial en los hombres. Los hombres fumadores mostraron casi el doble de riesgo de desarrollar AR y el efecto fue casi el mismo en los ex fumadores. Al analizar el FR positivo, el equipo halló que el riesgo se cuadruplicaba en los fumadores, se triplicaba en los que alguna vez habían fumado y se multiplicaba por 2,5 en los ex fumadores.
Fumar también aumentó el riesgo de desarrollar AR en las mujeres, aunque no tanto. Las mujeres fumadoras, ex fumadoras y que alguna vez habían fumado tenían entre 1,2 y 1,3 veces más probabilidad de desarrollar AR, fueran o no FR positivas. Los hombres que habían fumado por lo menos 20 cigarrillos diarios durante 20 años eran 2,3 veces más propensos a tener AR; en las mujeres, ese riesgo aumentaba 1,75 veces. Fumar está asociado a la producción de FR. La relación entre el FR, la AR y el tabaquismo sería distinta en las mujeres debido a factores hormonales (1). Estos datos constatan lo que ya se venía pensando sobre la artritis reumatoidea el ambiente y la genética son dos factores involucrados en el origen de esta enfermedad.
En un estudio llevado a cabo por investigadores del Instituto Karolinska en Estocolmo (23) participaron 858 personas con artritis reumatoidea, 612 mujeres y 1048 hombres sanos. A todos los sujetos se les realizó un análisis de sangre para estudiar su ADN y completaron cuestionarios sobre sus hábitos, como tabaco y estilo de vida. El análisis de ADN se llevó a cabo para evaluar la presencia de un gen que produce una proteína denominada epítopo compartido (EC), en los sujetos con artritis, y la presencia del factor reumatoideo. La hipótesis que se planteaba consistía en que aquellas personas con esta proteína podrían tener un riesgo mayor de desarrollar artritis reumatoidea porque la EC interactúa sobre la respuesta inmunológica. Tras analizar todos los datos, se detectó una interacción entre el tabaco y la presencia del gen EC sólo en aquellos sujetos artríticos con factor reumatoideo positivo (proteína presente sólo en algunos casos de artritis), pero no en aquellos pacientes sin esta proteína.
También se observó que las personas que nunca habían fumado pero que eran genéticamente propensas a la artritis, por producir la proteína EC, tenían un riesgo 2,8 veces mayor de sufrir esta enfermedad. Sin embargo, esa probabilidad era similar en aquellos sujetos fumadores y que no portaban los genes productores de EC. No obstante, aquellos individuos fumadores y con una copia del gen EC tenían hasta siete veces más posibilidades de sufrir artritis. El mayor riesgo lo presentaron los fumadores con doble copia genética EC; la probabilidad de desarrollar la enfermedad era hasta 15,7 veces superior.
Según una investigación realizada por un grupo de expertos españoles y presentada en el Congreso EULAR (Liga Europea contra las Enfermedades Reumáticas), los cigarrillos son un factor de riesgo para padecer artritis reumatoidea y tienen la misma influencia en el desarrollo de esta enfermedad que el factor genético más conocido hasta la fecha: el HLA. En los 40 pacientes con AR involucrados en el presente estudio se verifica que el 75% es o ha sido fumador, un 57,5% ha sido clasificado como fumador activo y un 17,5% como fumador pasivo.
Por otra parte, se observó una asociación significativa entre IL 6, tabaco y estrés. En pacientes fumadores, se produce un desequilibrio en la producción de citoquinas (24). Boström et al. (25) no observaron diferencias estadísticamente significativas en los niveles de IL 6 en fluido gingival crevicular entre fumadores, ex fumadores y no fumadores, en pacientes con periodontitis moderada a severa. Por el contrario, Tappia et al. (14) encontraron elevadas concentraciones de IL 6 en el plasma de fumadores, al igual que en las células alveolares de donantes sanos estimuladas con glicoproteína del tabaco, una glicoproteína rica en fenol, presente en las hojas y el humo del tabaco.
En la población de pacientes con AR estudiada en este trabajo no se encontraron diferencias significativas en los valores de IL 6 entre fumadores y no fumadores
Utilizando el test de Mann Whitney se verificó una diferencia estadísticamente significativa (20) (21) entre la mediana (con mayor valor) de niveles de IL 6 en el subgrupo de pacientes con FM con respecto a los pacientes sin FM, coincidente con la bibliografía. La asociación de altos niveles de IL 6 en el subgrupo de pacientes con FM sugiere que la presencia de esta última responde a actividad de la AR.
La DHEA es una hormona que funciona como precursora de andrógenos y estrógenos. Los niveles de esta hormona comienzan a disminuir después de los treinta años y se ha reportado que éstos son bajos en algunas personas con anorexia, enfermedades renales en etapa terminal, diabetes tipo 2 (diabetes que no depende de la insulina), SIDA, insuficiencia suprarrenal, y en pacientes gravemente enfermos. La DHEA es un esteroide adrenal con actividad androgénica débil liberado bajo el control de la ACTH y tiene una acción opuesta a la de los esteroides; por lo tanto, tiene acción anabólica, aumenta la fuerza muscular, disminuye la glucemia, aumenta la densidad mineral ósea, disminuye la prevalencia de necrosis avascular y la susceptibilidad a las infecciones. Actúa en el sistema inmunitario incrementando las concentraciones de interferón gamma, así como la producción de IL 2. Un estudio reciente demostró que la DHEA a dosis de 200 mg/día redujo significativamente los títulos de IL 10.
En algunos trabajos se concluye que el eje hipotálamo-hipofisario-adrenal de pacientes con artritis reumatoidea no puede responder adecuadamente a citoquinas inflamatorias aun dentro del primer año de comenzada la enfermedad; y que la activación crónica del eje durante el curso de la misma puede ser uno de los factores que lleva a la disminución progresiva en la producción de andrógenos adrenales. En el presente estudio se observó que casi el 50% de los pacientes tuvo valores de DHEA menores a 15 μg/dL. Varios estudios muestran que las personas con AR son más propensas a desarrollar FM, pero las personas con FM no tienen más probabilidades que cualquier otra persona de desarrollar AR. Algunos científicos creen que el dolor crónico, proveniente de la AR o de otras fuentes, puede llevar a la FM, causando cambios en la forma en que el sistema nervioso percibe y procesa el dolor. Independientemente de por qué alguien tiene ambas condiciones, el dolor de la artritis reumatoidea puede desencadenar brotes de FM y hacer los síntomas más difíciles de controlar.
La FM a menudo es concurrente (hasta del 25 al 65% de los casos) con otras afecciones reumáticas, como la artritis reumatoidea, el lupus eritematoso sistémico y la espondilitis anquilosante. En pacientes que, además de AR, presentaron FM o rasgos de FM, se observaron valores de DHEA <15 μg/dL en el 75% de los casos; el 25% restante, que no tenía valores tan bajos, presentaba menos puntos activos de FM.
Este equipo de investigación en un estudio anterior de enfermedades reumáticas no había detectado valores de DHEA <15 μg/dL en pacientes que sufrían únicamente fibromialgia; y valores bajos eran frecuentes en pacientes con AR. En este nuevo trabajo parece demostrarse que en la asociación de AR y FM se verifica una disminución muy notoria de DHEA , ya que se da en el 75% de los casos (24).
Con respecto a los valores de cortisol plasmático hallados en esta población, resultaron sin diferencias estadísticamente significativas con respecto a los encontrados en el estudio previo en pacientes con enfermedades reumáticas (la media es de 13,37 μg/mL y anteriormente fue de 14,23 μg/mL). No se halló correlación de valores altos de cortisol con tabaquismo.
Se concluye que:
La presencia de valores altos de interleuquina 6 fue la regla, incluso en pacientes con remisión clínica o con baja actividad. Casi en un 50%, los pacientes tuvieron valores de IL 6 seis veces superiores con respecto al valor considerado normal. El ser tabaquista no influyó en los valores de IL 6. Tampoco influyeron la edad ni el tipo de tratamiento. Se observaron altos niveles de IL 6 en el subgrupo de pacientes con fibromialgia. Casi el 50% de los pacientes tuvo valores de DHEA <15 μg/dL. Se observaron bajos niveles de DHEA en pacientes con fibromialgia.
1. Lawrence RC, Felson DT, Helmick CG, Arnold LM, Choi H, Deyo RA, et al. Estimates of the prevalence of arthritis and other rheumatic conditions in the United States. Part II. Arthritis Rheum 2008; 58(1): 26-35. [ Links ]
2. Rindfleisch JA, Muller D. Diagnosis and management of rheumatoid arthritis. Am Fam Physician 2005; 72(6): 1037-47. [ Links ]
3. Kallberg H, Ding B, Padyukov L, Bengtsson C, Ronnelid J, Klareskog L, et al. Smoking is a major preventable risk factor for rheumatoid arthritis: estimations of risks after various exposures to cigarette smoke. Ann Rheum Dis 2011; 70 (3): 508-11. [ Links ]
4. Mattey DL, Hutchinson D, Dawes PT, Brownfield A, Alldersea J, Fryer AA, et al. Smoking and disease severity in rheumatoid arthritis: Association with polymorphism at the glutathione S-transferase M1 locus. Arthritis Rheum 2002; 46: 640-6. [ Links ]
5. Criswell LA, Merlino LA, Cerhan JR, Mikuls TR, Mudano AS, Burma M, et al. Cigarette smoking and the risk of rheumatoid arthritis among postmenopausal women. Am J Med 2002; 112: 465-71. [ Links ]
6. Pablos Álvarez JL. La interleucina 6 en la fisiopatología de la artritis reumatoide. Reumatol Clin 2009; 5(1): 34-9. [ Links ]
7. Carrillo de Albornoz Sainz A, García Kass A, Bascones Martínez A. Papel de la IL-6 y TNF-a en la enfermedad periodontal. Av Periodon Implantol 2006; 18 (2): 83-9. [ Links ]
8. Van Snick J. Interleuquin-6: an overview. Ann Rev Immunol 1990; 8: 253-78. [ Links ]
9. Akira S, Taga T, Kishimoto T. Interleukin-6 in Biology and Medicine. Adv Immunol 1993; 54: 1-78. [ Links ]
10. Bazzichi I, Rossi A, Massimetti G, Giannaccini C, Giuliano T, De Feo F, et al. Cytokine patterns in fibromyalgia and their correlation with clinical manifestations. S Clin Exp Rheumat 2007; 25 (2): 225-30. [ Links ]
11. Lucas HJ, Braunch CM, Settas L, Theohaudes TC. Fibromyalgia: new concepts of pathogenesis and treatment. Int J Immunopathol Pharmacol 2006; 19 (1): 5-10. [ Links ]
12. Guo A, Karalcoc M, Erdogan S, Nas K, Cevik R, Sarac AJ. Regional cerebral blood flow and cytokines in young females with fibromyalgia. Clin Exp Rheumatol 2002; 20 (6): 753-60. [ Links ]
13. Wolfe F, Michaud K. Severe rheumatoid arthritis worse outcomes comorbid illness and socio demographic disadvantange characterize RA patients with fibromyalgia. J Rheumatolol 2004; 31: 695-700. [ Links ]
14. Tappia PS, Troughton KL, Langley-Evans SC, Grimble RF. Cigarette smoking influences cytokine production and antioxidant defenses. Clinical Sci 1995; 88: 485-9. [ Links ]
15. Van Vollenhoven RF, Engleman EG, McGuire JL. An open study of dehydroepiandrosterone in systemic lupus erythematosus. Arthritis Rheum 1994; 37: 1305. [ Links ]
16. Yunus MB. The prevalence of fibromyalgia in other chronic pain conditions. Pain Res Treat 2012; 2012: 1-8. [ Links ]
17. Benhaim M, Canella V, Cavallero H, Doglia L, Espósito M, Hofman J, Olivi J. Estudio psiconeuroinmunológico y hormonal en pacientes con enfermedades reumáticas. Inmanencia 2012; 2: 32-40. [ Links ]
18. Arnett FC, Edworthy SM, Bloch DA, McShane DJ, Fries JF, Cooper NS, et al. The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis. Arthritis Rheum 1988; 31: 315-24. [ Links ]
19. Hochberg MC, Chang RW, Dwosh I, Lindsey S, Pincus T, Wolfe F. The American College of Rheumatology 1991 revised criteria for the classification of global functional status in rheumatoid arthritis. Arthritis Rheum 1992; 35(5): 498-502. [ Links ]
20. Moore DS. Estadística aplicada básica, 2a edición. Barcelona: Editorial Antoni Bosch; 2004. [ Links ]
21. Marques de Cantu MJ. Probabilidad y estadística. México: Mc Graw Hill; 1991. [ Links ]
22. Norusis MM. SPSS 17.0 Guide to Data Analysis. Prentice Hall Publ; 2008. [ Links ]
23. Padyukov L, Silva C, Stolt P, Alfredsson L, Klareskog L. A gene-environment interaction between smoking and shared epitope genes in HLA-DR provides a high risk of seropositive rheumatoid arthritis. Arthritis Rheum 2004; 50: 3085-92. [ Links ]
24. Giannopoulou C, Kamma JJ, Mombelli A. Effect of inflammation, smoking and stress on gingival crevicular fluid cytokine level. J Clin Periodontol 2003; 30: 145-53. [ Links ]
25. Bostrom L, Linder LE, Bergstrom J. Smoking and GCF levels of IL-1beta and IL-1ra in periodontal disease. J Clin Periodontol 2000; 27(4): 250-5. [ Links ]
Recibido: 6 de septiembre de 2012
Aceptado: 18 de julio de 2014














