Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957
Acta bioquím. clín. latinoam. vol.49 no.1 La Plata mar. 2015
TOXICOLOGÍA
Enfermedad de Chagas: Contribuciones del Centro de Investigaciones Toxicológicas
Chagas disease: The contribution of the Center for Toxicological Research
Doença de Chagas: Contribuições do Centro de Investigações Toxicológicas
José Alberto Castro1ab, María Montalto de Mecca1ac, María Isabel Díaz Gómez1ab, Gerardo Daniel Castro1ab
1 Doctor en Ciencias Químicas.
a Centro de Investigaciones Toxicológicas (CEITOX- UNIDEF). CITEDEF. Juan B. de La Salle 4397, B1603ALO Villa Martelli, Buenos Aires. Argentina.
b Instituto de Investigación e Ingeniería Ambiental. Universidad Nacional de San Martín (UNSAM). Avenida 25 de Mayo y Francia, B1650HMP San Martín, Buenos Aires, Argentina.
c Cátedra de Toxicología y Química Legal. Facultad de Ciencias Exactas y Naturales (FCEN), Universidad de Buenos Aires. Ciudad Universitaria, Pabellón 2, 4° piso, C1428EGA Ciudad Autónoma de Buenos Aires, Argentina.
CORRESPONDENCIA DR. JOSÉ A. CASTRO Centro de Investigaciones Toxicológicas CITEDEF Juan B. de la Salle 4397 B1603ALO VILLA MARTELLI, provincia de Buenos Aires E-mail: jcastro@citedef.gob.ar Tel.: 54-11-4709-8100 interno 1239. Fax 5411-4709-5911
Resumen
La quimioterapia de la enfermedad de Chagas cuenta en la actualidad con el empleo de dos fármacos solamente: Nifurtimox y Benznidazol. Nifurtimox es un nitrofurano y Benznidazol es un compuesto nitroimidazólico. El uso de estas drogas para tratar la fase aguda de la enfermedad se acepta ampliamente. Sin embargo, su utilización en el tratamiento de la fase crónica no está exenta de cuestionamientos serios. Los efectos colaterales de ambas son un inconveniente mayor en su uso, y frecuentemente fuerza a los médicos a detener el tratamiento. Los estudios de toxicidad experimentales con Nifurtimox evidenciaron neurotoxicidad, daño testicular, toxicidad ovárica y efectos deletéreos en corazón, tejido mamario, adrenales, colon y esófago. Para el Benznidazol, se observaron efectos deletéreos en adrenales, colon y esófago. También inhibe el metabolismo de varios xenobióticos transformados por el sistema del citocromo P450 y sus metabolitos reaccionan con los componentes fetales in vivo. Ambas drogas exhibieron efectos mutagénicos significativos y se demostró en algunos estudios que eran carcinogénicas o tumorigénicas. Los efectos tóxicos de ambos fármacos dependen de la reducción enzimática de su grupo nitro. En este trabajo se resume la actividad de este laboratorio en el esfuerzo por comprender los mecanismos de la acción tóxica de estos fármacos.
Palabras clave: Benznidazol; Nifurtimox; Enfermedad de Chagas; Quimioterapia; Quimioprofilaxis; Violeta de Genciana; Tripanosomiasis americana.
Summary
Chemotherapy of Chagas disease is currently performed by the use of only two drugs: Nifurtimox and Benznidazole. Nifurtimox is a nitrofurane and Benznidazole is a nitroimidazole compound. The use of these drugs to treat the acute phase of the disease is now widely accepted. However, their use in the treatment of the chronic phase is not without serious consequences. The side effects of both drugs are a major drawback in their use and often force physicians to stop treatment. In the case of Nifurtimox, experimental toxicity studies showed neurotoxicity, testicular damage, ovarian toxicity and deleterious effects in heart, breast tissue, adrenals, colon and esophagus. Benznidazole deleterious effects were observed in adrenals, colon and esophagus. It also inhibits the metabolism of various xenobiotics transformed by cytochrome P450 and its metabolites react with fetal components in vivo. Both drugs exhibited significant mutagenic effects and in some studies, they demonstrated to be carcinogenic or tumorigenic. Toxic effects of both drugs are dependent on the enzymatic reduction of the nitro group. This paper summarizes this laboratory's activity in an effort to understand the mechanisms of these drugs' toxic action.
Key words: Benznidazole; Nifurtimox; Chagas' disease; Chemotherapy; Chemoprophylaxis; Gentian violet; American tripanosomiasis.
Resumo
A quimioterapia da doença de Chagas tem atualmente com o uso de apenas dois medicamentos: nifurtimox e benzonidazol. Nifurtimox é um nitrofuran e benzonidazol é um composto nitroimidazólico. A utilização destes fármacos para o tratamento da fase aguda da doença é agora amplamente aceite. No entanto, a sua utilização no tratamento da fase crónica não é sem dúvida graves. Os efeitos colaterais de ambas são uma grande desvantagem na sua utilização, e frequentemente médicos força para interromper o tratamento. Estudos experimentais com Nifurtimox mostraram neurotoxicidade, lesão testicular, toxicidade ovariana e efeitos deletérios no coração, tecido mamário, adrenal, cólon e esôfago. Para benzonidazole efeitos deletérios foram observadas em supra-renal, cólon e esofágica. Também inibe o metabolismo de vários xenobióticos transformadas pelo citocromo P450 e seus metabolitos reagem com componentes fetal in vivo. Ambos os fármacos apresentaram efeitos mutagênicos significativos demonstrado em alguns estudos que eram cancerígenas ou tumorigenic. Os efeitos tóxicos de ambas as drogas são dependentes da redução enzimática do grupo nitro. Neste trabalho a atividade do nosso laboratório no esforço para compreender os mecanismos de ação tóxica dessas drogas é resumida.
Palavras chave: Benzonidazole; Nifurtimox; Doença de Chagas; Quimioterapia; Quimioprofilaxia; Violeta Genciana; Tripanossomíase americana.
Los mecanismos de la toxicidad en la quimioterapia y la quimioprofilaxis del Mal de Chagas
La actividad de investigación vinculada con los fármacos empleados en la quimioterapia del Mal de Chagas, Nifurtimox y Benznidazol, comenzó en el CEITOX en 1983. La motivación para encarar esas actividades tuvo origen en que uno de los autores (J.A.C.) por primera y única vez en su vida vio en detalle un grupo de viviendas muy precarias (ranchos) repletas de vinchucas (Triatoma infestans) donde vivían familias muy pobres. La impresión fue muy grande y el deseo de hacer algo que tuviera que ver con ese problema también. En esa época en el bioterio del CEITOX se empleaba bromuro de metilo para esterilizar la viruta de las camas de las ratas. Fue así que se llevaron a cabo estudios colaborativos con un laboratorio vecino que iniciaba una línea de trabajo en entomotoxicología. Ensayado sobre las vinchucas y sus huevos, los mató aún en concentraciones muy diluidas. El anhídrido sulfuroso también lo hacía pero era menos potente. El entusiasmo fue grande e hizo que fuera de interés estudiar el mecanismo de la alquilación que ocurría en sus componentes tisulares (1). Su efectividad hizo incluso que se lo ensayara según un procedimiento empleado en EE.UU. para el control de termitas en las casas; "encarpar" un rancho y gasearlo. No se tocaba nada de lo que había adentro (ello sí era un problema serio con el malation).
Se realizaron experiencias en campo en Catamarca, comparando ambos procesos (el de malation y el de bromuro de metilo). No obstante, había varias limitaciones importantes en el CEITOX para encarar el desafío de hacer un aporte relevante hacia la enfermedad de Chagas. Por un lado, el laboratorio se había propuesto tratar de aportar en el conocimiento acerca de "¿Por qué los tóxicos son tóxicos?" y ello se encaraba empleando un sistema modelo muy adecuado: el tetracloruro de carbono (CCl4) y su efecto necrogénico en el hígado de la rata. Estas investigaciones contaban con el financiamiento de un proyecto aprobado por los National Institutes of Health (NIH) de EE.UU. La competencia era enorme; un gran número de laboratorios muy relevantes de ese país y de Europa también eran muy activos en el tema. No era fácil desviar esfuerzos y cumplir con ese proyecto. Surgió una posibilidad de hacer algo sobre los fármacos antichagas cuando llegaron al CEITOX dos nuevos investigadores. También fue posible concretar un enfoque "peculiar" del proyecto presentado al NIH. La idea era que una vez entendidas supuestamente las razones mecanísticas de "¿Por qué los tóxicos son tóxicos?" con el sistema modelo del CCl4 (chemically induced free radical cell injury) podría verificarse qué efectos tendrían estos compuestos en distintos órganos/distintas especies/ distintos seres vivos, etc. También verificar si los tratamientos que se desarrollaban eran eficaces y finalmente, ver si las reglas de toxicidad aprendidas con el modelo CCl4 - Hígado podían aplicarse conceptualmente a efectos de distintos tóxicos actuando sobre distintos órganos y de distintos seres vivos.
Esto dio cabida a investigaciones para aportar en los temas vinculados con Mal de Chagas.
¿Por qué no usar al Benznidazol y al Nifurtimox como ejemplos de distintos tóxicos actuando sobre distintos órganos?
¿Por qué no estudiar si las reglas aprendidas también se aplicarían cuando un compuesto tóxico actúa sobre otros seres vivos, como el Triatoma infestans o el Tripanosoma cruzi?
Esto fue lo que finalmente se hizo. En parte fue posible por interacción con otros laboratorios, puesto que en el CEITOX se criaban ratas y ratones únicamente pero no se disponía de vinchucas o T. cruzi. El aporte se volvió factible por tener el laboratorio una formación más general y orientada al "metabolismo de sustancia extrañas al organismo" y a la "toxicidad mediada por la generación de radicales libres" y contando con el aporte de formación en Química, Bioquímica, Histología, Histoquímica y Microscopia electrónica. Los resultados obtenidos desde el inicio y hasta el año 2006 fueron descriptos en varias revisiones bibliográficas (2-5). Un resumen de las contribuciones que resultaron de mayor interés sobre el tema se desarrolla a continuación.
La bioactivación a metabolitos reactivos
Un primer punto importante de los estudios efectuados a lo largo de los años fue el poder establecer que tanto el Nifurtimox como el Benznidazol requerían de un paso metabólico de nitrorreducción para ejercer su acción tóxica. Esos estudios emplearon además observaciones con microscopia electrónica de transmisión, que permitieron ubicar la organela celular donde ocurría el proceso de nitrorreducción a metabolitos reactivos. Esos estudios se realizaron en distintos órganos como hígado, placenta, ovarios, adrenales, colon, esófago, páncreas, corazón, mama, y aún con materia fecal. Estudios anteriores de Docampo, et al. habían permitido establecer que Nifurtimox se bioactivaba en microsomas hepáticos y que generaba un proceso de "ciclo redox" con la generación de especies reactivas de oxígeno (redox cycling) pero que ello no sucedía en el caso de la nitrorreducción de Benznidazol (6). Un segundo aspecto relevante de los estudios realizados en el CEITOX fue establecer que durante su nitrorreducción anaeróbica el Benznidazol generaba metabolitos reactivos que se unían al ADN, proteínas y lípidos. Nifurtimox, en cambio, solo después del ciclo redox y la generación de especies reactivas del oxígeno (ROS) producía alteraciones en proteínas, lípidos y ADN (2-5).
Era de mucho interés también estudiar en distintos órganos qué organelas y qué enzimas participaban en los procesos de nitrorreducción activantes, causantes de los efectos tóxicos observados. En el hígado, la bioactivación predomina en el retículo endoplasmático (microsomas) pero también ocurre en el citosol y aún en núcleos. En el caso del Benznidazol la contribución mayor es de los microsomas hepáticos y el proceso involucra en mayor proporción a la P450-reductasa y en parte al P450. En citosol el metabolismo es menos intenso y participan en una proporción mucho menor la xantino óxidorreductasa (XOR) y la aldehído oxidasa (AO). La bioactivación del Benznidazol se inhibe totalmente en presencia de oxígeno y se bloquea cuando hay suficiente glutatión en el medio (7). Esto último es crítico para entender otros experimentos que se analizarían más adelante. En el caso del Nifurtimox la actividad nitrorreductasa hepática también fue observada en microsomas, núcleos y citosol. La primera requirió participación de P450-reductasa, acompañada de una mayor proporción de P450 (28%). En citosol actúan en menor proporción XO y AO (8).
Los procesos de bioactivación de Nifurtimox y Benznidazol por la P450 reductasa se estimularon preferentemente por la presencia simultánea de FAD y la bioactivación citosólica por XO fue inhibida por alopurinol (7-9). Conocer en qué medida se pueden modular o combinar alguno de estos dos procesos bioactivantes para disminuir efectos tóxicos o lograr una mejor quimioprofilaxis o quimioterapia, luce atractivo. Es importante tener en cuenta que durante estos procesos de nitrorreducción no solamente ocurren etapas de bioactivación, que más adelante se analizará cómo tienen vínculo con los efectos tóxicos, sino que es relevante para definir la concentración de los fármacos en el organismo. Ello es válido particularmente para el caso de la nitrorreducción hepática y para la que ocurre a nivel de la fracción microsomal. Pero no solo el metabolismo hepático es determinante en este efecto. También lo es la metabolización en la materia fecal. Esta es marcadamente intensa tanto en la rata como en los seres humanos (10). Otro aspecto de interés tuvo que ver con la evaluación de los factores que modulan esos metabolismos nitrorreductivos microsomales hepáticos de ambos, Nifurtimox y Benznidazol. La base racional de ese interés era obvia, ya que la duración de la presencia en el organismo de ambos antichagásicos y su toxicidad eran reguladas por el metabolismo.
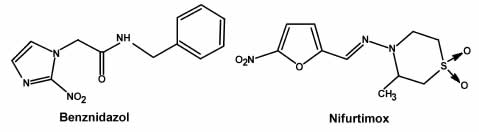
Figura 1. Benznidazol y Nifurtimox.
Lo primero que surgió como crítico conocer fue cómo variaba la nitrorreducción hepática microsomal con la edad del animal (11)(12). Es que en farmacología y toxicología experimental es conocido que las ratas recién nacidas tienen una actividad enzimática hepática microsomal muy baja, mediada por P450 y P450 reductasa. Esta capacidad va aumentando hasta llegar a su máximo alrededor de los 30 días de edad y posteriormente comienza a disminuir, y a los 600 días de edad solo es un 50-60% de la máxima. Observaciones hechas sobre la actividad nitrorreductasa microsomal hepática de Benznidazol y Nifurtimox mostraron que era significativamente más baja en los recién nacidos y un poco después también (11)(12). Puede inferirse entonces que el tiempo ideal para hacer un tratamiento con Nifurtimox o Benznidazol es poco después del nacimiento, si ello es posible (11)(12). Más aún, el recién nacido carece en su materia fecal de la capacidad de biotransformación de sustancias extrañas al organismo y en el laboratorio se había demostrado la degradación nitrorreductiva relevante que tiene lugar en la materia fecal del adulto (10). De allí que esa propuesta hecha en 1987 fuera central para lo que hoy está establecido para seres humanos: tanto Benznidazol como Nifurtimox son más efectivos y con menos efectos tóxicos laterales en los niños que en los adultos jóvenes.
El metabolismo activante también está involucrado en la quimioterapia de estos fármacos. Así lo demuestran el efecto señalado por Docampo y Moreno en 1986 para la acción del Nifurtimox sobre T. cruzi (6) y el que tiene el Benznidazol sobre el parásito, por el cual sus metabolitos atacan el ADN (nuclear y kinetoplástico) y sus proteínas y lípidos (13). Estos trabajos señalan justamente que la bioactivación nitrorreductiva a metabolitos reactivos es el paso clave de la acción quimioterápica.
El riesgo mutagénico y carcinogénico
Un esfuerzo importante del laboratorio se dirigió a demostrar que ambos compuestos tienen efectos mutagénicos, ya sea inducidos por la capacidad de los metabolitos reactivos de Benznidazol de unirse covalentemente al ADN y proteínas nucleares (14) o, en el caso de Nifurtimox, porque se pudo verificar que preparados de núcleos (libres de contaminación) bioactivan a este antichagásico por nitrorreducción (15) y que ello puede producir un ciclo redox cercano al ADN y las proteínas nucleares y conducir a un riesgo mutagénico y eventualmente carcinogénico (16). El proceso no solo podía generar ROS, también se pudo observar que se producían pequeñas cantidades de especies reactivas de nitrógeno (17). Nifurtimox también tiene la capacidad para reaccionar químicamente con grupos sulfhidrilos de la coenzima A, el ácido lipoico reducido, el glutatión y la cisteína (18). Ello implica que afectaría los procesos de desintoxicación mediados por glutatión y la glutatión transferasa y también las defensas contra especies reactivas de oxígeno a través de la glutatión peroxidasa, así como el riesgo de inhibir enzimas que poseen grupos sulfhidrilos críticos para su actividad (ej la O6-metilguanina demetilasa que interviene en procesos de reparación del ADN) (18).
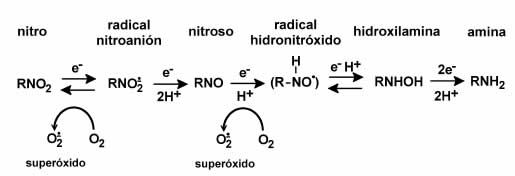
Figura 2. Caminos metabólicos nitrorreductivos posibles del Nifurtimox y del Benznidazol.
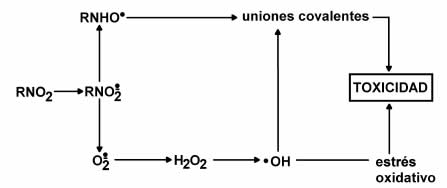
Figura 3. Hipótesis de trabajo sobre los mecanismos de acción tóxica para Benznidazol y Nifurtimox.
De allí que no fuera sorpresa que el Nifurtimox aumentara la formación de micronúcleos en la médula ósea de ratón cuando se lo administra por vía oral. Es decir, ambos, Nifurtimox y Benznidazol son mutagénicos y potencialmente podrán iniciar un proceso de carcinogénesis (2-5)(16). En el CEITOX se intentó establecer cuáles deberían haber sido las condiciones experimentales que permitieran evaluar el riesgo carcinógenico en las condiciones más adecuadas. Para ello se estudió cómo variaba el metabolismo nitrorreductivo microsomal bioactivante de Benznidazol y de Nifurtimox en distintas especies que se emplean habitualmente en ensayos de carcinogenicidad (rata, ratón, hámster, cobayo). De esos trabajos surgió que las especies que habrían sido más convenientes para esos estudios son el ratón y el hámster (19).
Estos animales tienen una mayor capacidad bioactivante de ambos fármacos. También fue interesante que esa capacidad no variara con el sexo del animal empleado de esas dos especies. En cambio, la rata difiere fuertemente en esa capacidad, siendo significativamente mayor en el macho (19). En el caso del Nifurtimox, Bayer había hecho estudios de carcinogenicidad en ratas de ambos sexos. Los resultados se informaron mezclando datos de ambos sexos pero generaban dudas acerca de un potencial riesgo de cáncer mamario. Ello sugirió que era importante estudiar el metabolismo nitrorreductivo de ambos, Nifurtimox y Benznidazol, en fracciones celulares de tejido mamario de rata (20)(21).
El tejido mamario tiene una actividad muy alta (la mayor en su organismo) de XO. Solo Nifurtimox se metabolizó por nitrorreducción en el citosol. También, solo Nifurtimox se metabolizó en microsomas mamarios y con participación del P450 y de la P450 reductasa. Posteriormente se comparó la actividad nitrorreductiva del tejido mamario de ambos fármacos con la de la nitrorreducción de otros compuestos nitrofuránicos de conocida actividad carcinogénica mamaria en la rata (nitrofurazona; nitrofurantoína; furazolidona) y con un nitroimidazol como el metronidazol. En general, estos nitrofuranos carcinogénicos se nitrorreducían con mayor intensidad que el Nifurtimox (21). En cambio, no hubo nitrorreducción bioactivante de los nitroimidazoles (20)(21). Esto sugiere que los procesos de "ciclo redox" que surgen de la nitrorreducción de los nitrofuranos podrían estar involucrados en la capacidad carcinogénica que poseen.
Riesgo tóxico sobre la reproducción
Siendo el sistema reproductor en ambos sexos un blanco frecuente de los tóxicos, resultó de interés estudiar este tipo de riesgo para el Nifurtimox y el Benznidazol (22). Se pudo detectar la actividad nitrorreductasa microsomal y citosólica en testículos para el caso de Nifurtimox pero no para el caso del Benznidazol. La citosólica estaba mediada por XOR. Se encontró en cambio que los metabolitos reactivos de Benznidazol se unían covalentemente a proteínas y fosfolípidos testiculares (22). Lo más relevante fue evidenciar por microscopia electrónica que el Nifurtimox dañaba intensamente las células de Sertoli, dilatando su retículo endoplasmático y la membrana nuclear y alteraba la forma y tamaño de las mitocondrias, aumentaba la actividad lisosomal y producía el despegue de los ribosomas del RER. Benznidazol produjo alteraciones de características similares pero muchísimo menos intensas y que solo ocurrían en algunas células (22).
También se estudió el efecto de ambos fármacos sobre los ovarios (23). En este caso se observó la actividad nitrorreductasa activante de Nifurtimox y Benznidazol. Para el Benznidazol esa actividad solo se observó en la fracción mitocondrial y se inhibió parcialmente por monóxido de carbono. En el caso del Nifurtimox la actividad fue mayor en mitocondrias pero también estuvo presente en microsomas y en el citosol. La enzima microsomal se inhibió totalmente por acción del monóxido de carbono mientras que la mitocondrial solo lo hizo parcialmente. La actividad citosólica era mediada por XO. Para el ovario se postuló que la bioactivación estaría mediada por la participación de P450, flavoenzimas y alguna enzima con complejos hierro-azufre también. La microscopía electrónica de transmisión detectó que ambas quimioterapias producían efectos degenerativos a nivel ultraestructural en distintos tipos de células ováricas. Ellos incluyeron hinchazón, disrupción, desorganización, y pérdida de componentes en su matriz mitocondrial. Estos procesos ocurrían en cualquier etapa del ciclo estral de la rata. Todas estas alteraciones pueden afectar potencialmente el potencial reproductivo (23).
Un aspecto de particular preocupación derivó de tener conocimiento de que algunos médicos consideraban la posibilidad de emplear Benznidazol (o Nifurtimox) en mujeres embarazadas chagásicas, para prevenir la infección en el recién nacido. Esto sucedía a fines de la década del setenta. Se decidió entonces estudiar si el Benznidazol era capaz de atravesar la barrera transplacentaria de ratas preñadas y ello permitió establecer que el fármaco llegaba al feto (24). Más aún, en el feto se bioactivaba y sus metabolitos reactivos se unían covalentemente a las proteínas fetales, además de las maternas. Esto condujo a que se alertara acerca de riesgos potenciales para el feto (24). Hoy ya es parte de las precauciones establecidas para el uso del Benznidazol. Es más seguro esperar el parto y tratar al niño, dado que en él la toxicidad del fármaco es mucho menor y más efectiva (11)(12) y tratar a la madre separadamente.
Toxicidad en el sistema endocrino
Se realizaron estudios sobre los efectos de Nifurtimox y Benznidazol en las adrenales de rata (26)(27). El efecto observado fue muy distinto con cada antichagásico. En los estudios por microscopía electrónica pudo observarse que Nifurtimox afecta la glándula adrenal en sus zonas fasciculata y reticularis pero no en la glomerulosa. Las alteraciones involucraban las mitocondrias, núcleos, el aparato de Golgi y el retículo endoplásmico pero fueron más intensas en mitocondrias. Otro tanto pasó con la actividad Nifurtimox-nitrorreductasa. Fue más intensa en mitocondrias que en el citosol o en el retículo endoplasmático. Se estudió allí la participación de la P450 reductasa, el P450 (menor) y de la XO (25). Benznidazol también afectó las adrenales de la rata en sus zonas fasciculata y reticularis y no en la glomerulosa pero reflejó un efecto muy distinto al Nifurtimox (26) consistente en una gran acumulación de lípidos (probablemente una hormona) y también alteraciones en núcleos, retículo endoplasmático y mitocondrias. La capacidad nitrorreductiva de Benznidazol fue mayor en mitocondrias que en microsomas y no se encontró actividad actividad de XO o de AO en el citosol. Participaría, de modo limitado, el P450 y en el proceso reductivo se formarían los metabolitos reactivos que reducen el daño en cada organela (26).
También se efectuaron estudios sobre efectos de Nifurtimox en el páncreas de rata (27). Allí se pudieron observar alteraciones ultraestructurales en el retículo endoplasmático y núcleos de las células acinares y en las células beta. Además, pudo verificarse que el páncreas de la rata tenía actividad nitrorreductasa para el fármaco en la fracción microsomal de sus homogenatos y también XO en sus fracciones citosólicas. La administración de Nifurtimox condujo además a una disminución del contenido de grupos sulfhidrilos en sus proteínas y a la producción de alteraciones atribuibles a estrés oxidativo (27).
Efectos tóxicos de los fármacos en sitios blancos de la enfermedad
La enfermedad de Chagas crónica compromete seriamente algunos órganos del tracto digestivo (esófago y colon) y también al corazón. Se comenzaron a analizar posibles interacciones tóxicas de Nifurtimox y Benznidazol sobre órganos que frecuentemente están comprometidos durante la etapa crónica de la enfermedad de Chagas (28-32). Tal es el caso del colon, que se manifiesta como megacolon. El interés deriva de que el empleo actual de ambas quimioterapias en etapas crónicas de la enfermedad podría agregar un daño al propio de la enfermedad, que deba tenerse en cuenta. En estudios sobre la ultraestructura del colon de rata se pudo observar que Nifurtimox puede producir alteraciones en las células de la mucosa colónica (28). Básicamente ellos involucran una dilatación moderada del retículo endoplasmático y una intensa dilatación de su complejo de Golgi. Esas alteraciones se correlacionaron con una capacidad de la fracción microsomal colónica para nitrorreducir a Nifurtimox y promover el ciclo redox perjudicial. Dada la conocida participación del complejo de Golgi en la síntesis y almacenamiento de productos de secreción celular es de esperar que Nifurtimox produzca alteraciones en estos procesos (28).
El tratamiento con Benznidazol también produjo alteraciones ultraestructurales significativas (29). Condujo a la secreción abundante de mucus a nivel de las celulas Goblet y a la dilatación del retículo endoplasmático y el aparato de Golgi en las células epiteliales. También en este caso hubo una correlación entre los daños observados y la capacidad de la fracción microsomal del tejido colónico para generar metabolitos reactivos de Benznidazol que se ligan covalentemente proteínas y otros compuestos celulares (29). Es por lo tanto factible que tanto Benznidazol como Nifurtimox ejerzan acciones adicionales a las que la enfermedad crónica en sí produce en el colon. Se efectuaron también estudios sobre los efectos de la administración oral del Benznidazol en el esófago de la rata (30). En ese caso los estudios de la ultraestrucutura evidenciaron el despegue de ribosomas del retículo endoplásmico rugoso, acompañado de conglomeración de polirribosomas y de una reducción de la presencia de desmosomas. También se observó una disminución del número de bacterias que se encuentran presentes en la superficie del esófago. También se observó la presencia de actividad nitrorreductasa de Benznidazol en las fracciones microsomales y citosólicas de homogenatos de mucosa esofágica. La actividad microsomal involucró a la P450 reductasa en tanto que la citosólica estuvo mediada por XOR (30).
Un aspecto que fue de particular preocupación en este laboratorio tuvo que ver con el riesgo toxicológico que podría tener el empleo de ambas quimioterapias en enfermos crónicos chagásicos que pudieran tener ya problemas cardiológicos. Esto constituyó un motivo para efectuar estudios sobre la cardiotoxicidad potencial de ambos fármacos (31)(32). Inicialmente se estudió si las fracciones celulares de tejido cardíaco eran capaces de bioactivar por nitrorreducción al Nifurtimox (31). Se pudo establecer que la fracción microsomal tiene actividad NADPH dependiente y que estaba involucrado el P450 y la P450 reductasa. No se detectó una actividad citosólica capaz de nitrorreducirlo. También se pudo establecer que como resultado de ese proceso se verificaba un ciclo redox con formación de carbonilos proteicos y la disminución del contenido de grupos sulfhidrilos proteicos. Ello parecía razonable dado que el proceso para el caso de Nifurtimox no solo no es inhibido por la presencia de oxígeno sino que lo estimula para conducir al ciclo redox. Se postuló que este mecanismo podía conducir a daños ultraestructurales en el tejido cardíaco. Así sucedió (31). Después de 24 horas de la administración de una dosis única de Nifurtimox se encontró en el tejido cardíaco una marcada vacuolización citoplasmática, separación y pérdida de miofibrillas e hinchazón en sus mitocondrias (31).
Estos hallazgos condujeron a la necesidad de ver si algo equivalente pasaría con Benznidazol (32). Si bien se observó la presencia de una nitrorreductasa microsomal para Benznidazol, solo puede ocurrir en medio anaerobio y no en presencia de oxígeno. No hubo metabolismo nitrorreductivo en el citosol. Tampoco se encontraron efectos adversos detectables en la ultraestructura, por microscopia electrónica de transmisión (32). Esto sugiere que el uso del Benznidazol que se está haciendo en los chagásicos crónicos tiene menos riesgo cardíaco tóxico (o ninguno) que el empleo de Nifurtimox cuando puede existir alguna cardiopatía de base.
Los fármacos antichagas y las defensas antioxidantes
Es interesante señalar que también pudo demostrarse que el Nifurtimox tiene capacidad para reaccionar de un modo directo con distintos compuestos biológicamente relevantes que contienen grupos sulfhidrilos en su estructura, por ejemplo coenzima A, glutatión reducido, cisteína y ácido dihidrolipoico. En esa reacción química directa se forma nitrito y se producen aductos. Ello podría contribuir a explicar la disminución del contenido de grupos SH mencionado anteriormente como también la inhibición de enzimas sulfidrílicas relevantes (18)(33). Benznidazol también puede reaccionar con grupos sulfidrilo pero para ello requiere un metabolismo nitrorreductivo activante previo, tal cual se evidenció en el caso del glutatión. Una aplicación interesante de estos resultados es que permitieron entender el efecto de los metabolitos reactivos sobre las enzimas que metabolizan fármacos como el pentobarbital, y que conducen a una prolongación preocupante en el tiempo de sueño. Esto pudo bloquearse con distintos compuestos tiólicos (ej. cisteína, N-acetil cisteína, penicilanina) previamente administrados al animal (33).
Es importante analizar otra consecuencia importante de este tipo de reacciones entre metabolitos reactivos de Benznidazol y el glutatión. Si bien los efectos iniciales del Benznidazol conducen a la formación de metabolitos reactivos que se unen covalentemente a componentes celulares críticos (como fue claramente establecido por este laboratorio tanto para el mamífero como para el T. cruzi), esto no excluye que en etapas del proceso posteriores puedan verificarse procesos de estrés oxidativo. Ello no ocurrió en las primeras diez horas posteriores a la administración de Benznidazol a la rata pero había posibilidades predecibles de que sí podían ocurrir posteriormente, como resultado del consumo de glutatión que esos metabolitos reactivos producen (34). Esto ocurrió en el caso de Nifurtimox, como lo evidenciaron estudios de otros autores. En ese caso el estrés oxidativo ocurre más tempranamente (34). Esta posibilidad de efectos adicionales debido a alteraciones producidas por interacciones covalentes de metabolitos reactivos de Benznidazol y estrés oxidativo adicional es mucho más probable durante los tratamientos repetitivos del Benznidazol de un mes de duración. En tal caso debería establecerse porque si fuese así podrían ayudar los tratamientos coadyuvantes con antioxidantes (con vitamina E u otros).
Aspectos farmacocinéticos
Una línea de trabajo en el CEITOX se orientó a tratar de desarrollar una metodología que pudiera emplearse en un laboratorio que no cuente con equipamiento muy sofisticado para determinar en sangre al Benznidazol. El ideal podría ser HPLC/MS-MS pero ello no es común en zonas de enfermedad endémica. Se recurrió al empleo de HPLC/UV y se generó así un procedimiento de uso razonablemente simple (35). Se lo aplicó para demostrar que el empleo de Benznidazol en ratas jóvenes conduce a niveles mayores de Benznidazol en sangre y más persistentes que en ratas adultas (12). Ello fue coherente con lo que se había propuesto muchos años antes para emplear en seres humanos. Esto es, la terapéutica debe ser más efectiva y con menor toxicidad en el organismo joven (11)(12).
Fármacos antichagas y consumo de alcohol
Otro aporte tuvo que ver con intentar explicar por qué es incompatible el consumo de alcohol con el empleo de Nifurtimox o Benznidazol (36). En las recomendaciones de uso de los fabricantes se lo menciona repetidamente pero no se dice la razón. Se realizaron estudios dirigidos a entender las causas, específicamente si ello tenía que ver con un potencial efecto inductor del consumo de alcohol sobre los procesos de nitrorreducción activante de Benznidazol o de Nifurtimox. Especialmente teniendo en cuenta que el hígado es el órgano más relevante de los procesos de bioactivación y desintoxicación de estos fármacos, a través de su actividad microsomal P450 dependiente. El consumo de alcohol indujo la activación de ambos fármacos en ratas macho y lo hizo con mayor intensidad para Benznidazol que para Nifurtimox (11% para Nifurtimox y 41% para Benznidazol) (36). Este incremento fue atribuido a una elevación de la P450-reductasa. Sin embrago, esto no ocurrió en las ratas hembras. Se concluyó que la incompatibilidad solo puede explicarse parcialmente en término de estos procesos inductivos (36).
Alternativas quimioterápicas
Paralelamente a la descripción del perfil toxicológico de cada uno de los fármacos, existió otra línea de investigación que apuntó a imaginar que se podía hacer para disponer de otros tratamientos menos tóxicos o agentes que pudieran ser útiles en la quimioprofilaxis de la enfermedad. Por ejemplo, mediante una asociación fructífera con el laboratorio del Dr. J.J. Cazzulo en la UNSAM, este laboratorio pudo efectuar estudios sobre acciones de distintos compuestos sobre el T. cruzi con la expectativa de visualizar modos de eliminarlo y tener así potenciales nuevas quimioterapias o quimioprofilaxis.
Los resultados obtenidos con dos inhibidores clásicos de metabolismos mediados por el P450, tales como el compuesto SKF 525A (2,2-difenilpentanoato de 2-dietilaminoetilo) y el Lilly 18947 (2,4-dicloro- 6-fenilfenoxietil dietilamina) mostraron que ambos eran tripanomicidas efectivos contra T. cruzi. (37)(38). Esto era de esperar teniendo en cuenta que dicho citocromo está involucrado en la síntesis del ergosterol de sus membranas. Esto sugirió que compuestos con esta acción inhibidora podrían utilizarse en la quimioprofilaxis de la enfermedad. Otro intento estuvo basado en que otros autores habían demostrado que el T. cruzi contenía calmodulina y que se había verificado que sustancias con capacidad anticalmodulínica (por ejemplo, clorpromazina y flufenazina) eran capaces de disminuir la movilidad de parásito.
Fue entonces que se ensayó otra anticalmodulina sobre el T. cruzi, la trifluorperazina (39). Sin embargo, se verificó que su acción era atribuible fundamentalmente a una disrupción de la función mitocondrial en el parásito. Otro objetivo fue encontrar sustitutos del Violeta de Genciana que se utiliza en la quimioprofilaxis de sangre para transfusiones en emergencias que ocurren en zonas endémicas y que involucran numerosas personas. Los resultados obtenidos fueron útiles para visualizar las "debilidades" del T. cruzi que podrían explotarse con el objeto de eliminarlo. Recientemente se hizo un intento de mejorar la quimioprofilaxis existente, que emplea al Violeta de Genciana (40). La razón de su uso es que tiene muchos años de empleo aceptable como aditivo a la sangre para eliminar al T. cruzi en transfusiones, cuando no es posible un control previo de laboratorio o bien bajo situaciones de emergencia. Su empleo genera preocupación por tener una marcada genotoxicidad en ensayos bacterianos y ser potencialmente carcinogénico. Lo primero que se hizo en el CEITOX fue confirmar mediante el ensayo Cometa que ese efecto mutagénico ocurría cuando se lo agrega a la sangre bajo las condiciones empleadas para esterilizarla para transfusiones. Los resultados obtenidos con el ensayo Cometa sugieren la formación de bases hidroxiladas del ADN como resultado de un ataque de especies reactivas de oxígeno y apoyan la genotoxicidad del Violeta de Genciana y su potencial carcinogenicidad (40). Lo interesante es que esos efectos puedan ser prevenidos por la administración de antioxidantes que ya tienen uso clínico seguro como el ácido lipoico, el alfa tocoferol o la N-acetilcisteína. Como el procedimiento de eliminación del T. cruzi se efectúa previamente en la sangre del donante, existe la posibilidad de proteger al receptor de esa sangre con estos antioxidantes y de ese modo obviar los cuestionamientos existentes sobre el empleo del Violeta de Genciana. Ese fue el objetivo, ya que eliminaría los cuestionamientos existentes (40).
Conclusiones
La enfermedad de Chagas como problema sanitario involucra varios factores relacionados entre sí, que incluyen la política de salud pública, factores puramente científicos y tecnológicos, económicos, educacionales, y otros. Sin embargo, la necesidad más urgente es encontrar nuevas drogas más seguras y efectivas para el tratamiento de esta enfermedad. Los dos fármacos disponibles no son completamente efectivos y por otra parte han sido cuestionados por sus importantes efectos colaterales tóxicos. Este desafío permanece en la comunidad científica, que incluye pero no se limita obviamente a los toxicólogos. Las compañías farmacéuticas no hacen una inversión suficiente en el desarrollo de drogas para las enfermedades tropicales. La razón principal de este fenómeno es económica. El desarrollo de una nueva droga requiere usualmente de decenas de millones de dólares para lograr un producto exitoso y la perspectiva de un retorno económico razonable es baja.
Actualmente existen esfuerzos intensos de la comunidad científica para establecer nuevos tratamientos o drogas. Sin embargo, tanto el Benznidazol como el Nifurtimox serán todavía las únicas drogas disponibles por algún tiempo. Es importante por lo tanto disponer del mejor conocimiento posible sobre sus mecanismos de acción terapéutica y tóxica. Las líneas de investigación desarrolladas en el CEITOX a lo largo de casi tres décadas siempre apuntaron a esos objetivos. Esta revisión pretende solamente aportar conocimiento para que los médicos que prescriben tengan a mano un resumen de los efectos adversos de las drogas que les permitan tomar decisiones riesgo-beneficio apropiadas.
1. Castro JA, Zerba EN, de Licastro SA, Picollo MI, Wood EJ, Ruveda MA, et al. Toxicity of methyl bromide and other gaseous insecticides to Triatoma infestans. Acta Physiol Lat Am 1976; 26: 106-14. [ Links ]
2. Castro JA, Diaz de Toranzo EG. Toxic effects of nifurtimox and benznidazole, two drugs used against American trypanosomiasis (Chagas' disease). Biomed Environ Sci 1988; 1: 19-33. [ Links ]
3. Castro JA. Toxicology in problem detection and as problem solving for tropical diseases. The Latin American example of Chagas' disease. Proceedings of the Third Congress of Toxicology in Developing Countries 1996; 1: 109-24. [ Links ]
4. Castro JA. Contribution of Toxicology to the problem of Chagas´ disease (American Trypanosomiasis). A year 2000 update. Biomed Environ Sci 2000; 13: 271-9. [ Links ]
5. Castro JA, de Mecca MM, Bartel LC. Toxic side effects of drugs used to treat Chagas' disease (American trypanosomiasis). Hum Exp Toxicol 2006; 25: 471-9. [ Links ]
6. Docampo R, Mason RP, Mottley C, Muniz RP. Generation of free radicals induced by nifurtimox in mammalian tissues. J Biol Chem 1981; 256: 10930-3. [ Links ]
7. Masana M, de Toranzo EGD, Castro JA. Reductive metabolism and activation of Benznidazole. Biochem Pharmacol 1984; 33: 1041-5. [ Links ]
8. Masana M, de Toranzo EGD, Castro JA. Studies on Nifurtimox nitroreductase activity in liver and other rat tissues. Arch Int Pharmacodyn Ther 1984; 270: 4-10. [ Links ]
9. Masana M, de Toranzo EG, Castro JA. Reductive metabolism and activation of benznidazole, a drug against Chagas' disease. Dev Toxicol Environ Sci 1983; 11: 383-6. [ Links ]
10. de Toranzo EGD, Masana M, Castro JA. Nitroreduction of Benznidazole and Nifurtimox by rat and human feces. Res Commun Chem Pathol Pharmacol 1983; 41: 341-4. [ Links ]
11. Aguilar EG, de Arranz CK, de Toranzo EG, Castro, JA. Liver microsomal Benznidazole and Nifurtimox nitroreductase activity in male rats of different age. Arch Int Pharmacodyn Ther 1987; 289: 11-7. [ Links ]
12. Bulffer RF, Castro JA, Fanelli SL. Benznidazole levels in blood vary with age in rats. Mem Inst Oswaldo Cruz 2011; 106: 374-7. [ Links ]
13. Díaz de Toranzo EG, Castro JA, de Cazzulo BMF, Cazzulo JJ. Interaction of Benznidazole reactive metabolites with nuclear and kinetoplastic DNA; proteins and lipids from Trypanosoma cruzi. Experientia 1988; 44: 880-1. [ Links ]
14. Gorla N, Diaz Gomez MI, Castro JA. Interaction of Benznidazole reactive metabolites with rat liver deoxyribonucleic acid and nuclear proteins. Arch Int Pharmacodyn Ther 1986; 280: 22-31. [ Links ]
15. de Toranzo EGD, Herrera DM, Castro JA. Rat liver nuclear Nifurtimox nitroreductase activity. Res Commun Mol Pathol Pharmacol 1997; 98: 249-54. [ Links ]
16. Gorla NB, Castro JA. Micronucleus formation in bone marrow of mice treated with Nifurtimox or Benznidazole. Toxicol Lett 1985; 25: 259-63. [ Links ]
17. Montalto de Mecca M, Diaz EG, Castro JA. Nifurtimox biotransformation to reactive metabolites or nitrite in liver subcellular fractions and model systems. Toxicol Lett 2002; 136: 1-8. [ Links ]
18. Díaz EG, de Mecca MM, Castro JA. Reactions of Nifurtimox with critical thiol-containing biomolecules. Their potential toxicological relevance. J Applied Toxicol 2004; 24: 189-95. [ Links ]
19. Aguilar EG, Koldobsky C, de Toranzo EG, Castro JA. Species and sex differences in the liver microsomal nitroreductive biotransformation of Nifurtimox and Benznidazole. Arch Int Pharmacodyn Ther 1987; 287: 181-7. [ Links ]
20. Bartel LC, Montalto de Mecca M, de Castro CR, Bietto FM, Castro JA. Metabolization of nifurtimox and benznidazole in cellular fractions of rat mammary tissue. Hum Exp Toxicol 2010; 29: 813-22. [ Links ]
21. Bartel LC, Montalto de Mecca M, Castro JA. Nitroreductive metabolic activation of some carcinogenic nitro heterocyclic food contaminants in rat mammary tissue cellular fractions. Food Chem Toxicol 2009; 47: 140-4. [ Links ]
22. Bernacchi AS, de Castro CR, de Toranzo EGD, Castro JA. Effects of Nifurtimox or Benznidazole administration on rat testes: ultrastructural observation and biochemical studies. Exp Mol Pathol 1986; 45: 245-56. [ Links ]
23. de Castro CR, de Toranzo EGD, Bernacchi AS, Carbone M, Castro JA. Ultrastructural alterations in ovaries from Nifurtimox or Benznidazole-treated rats. Their relation to ovarian nitroreductive biotransformation of both drugs. Exp Mol Pathol 1989; 50: 385-97. [ Links ]
24. de Toranzo EGD, Masana M, Castro JA. Administration of Benznidazole, a chemotherapeutic agent against Chagas' disease to pregnants rats. Covalent binding of reactive metabolites to fetal and maternal proteins. Arch Int Pharmacodyn Ther 1984; 272: 17-23. [ Links ]
25. de Castro CR, de Toranzo EGD, Carbone M, Castro JA. Ultrastructural effects of Nifurtimox on rat adrenal cortex related to reductive biotransformation. Exp Mol Pathol 1990; 52: 98-108. [ Links ]
26. de Castro CR, de Toranzo EGD, Castro JA. Benznidazole- induced ultrastructural alterations in rat adrenal cortex. Mechanistic studies. Toxicology 1992; 74: 223-32. [ Links ]
27. de Mecca MM, Fanelli SL, Bartel LC, de Castro CR, Díaz EG, Castro JA. Nifurtimox nitroreductase activity in different cellular fractions from male rat pancreas. Biochemical and ultrastructural alterations. Life Sci 2007; 81: 144-52. [ Links ]
28. Montalto de Mecca MM, Rodríguez de Castro C, Díaz EG, Castro JA. Alteraciones ultraestructurales en la mucosa del colon de ratas tratadas con Nifurtimox. Medicina (Buenos Aires) 2001; 61: 67-72. [ Links ]
29. Díaz EG, de Castro CR, de Mecca MM, Castro JA. Benznidazole-induced ultrastructural and biochemical alterations in the rat colon. Acta Pharmacol Sin 2000; 21: 961-6. [ Links ]
30. de Castro CR, de Mecca MM, Fanelli SL, de Ferreyra EC, Diaz EG, Castro JA. Benznidazole-induced ultrastructural and biochemical alterations in rat esophagus. Toxicology 2003; 191: 189-98. [ Links ]
31. Bartel LC, de Mecca MM, Fanelli SL, Rodríguez de Castro C, Díaz EG, Castro JA. Early Nifurtimox induced biochemical and ultrastructural alterations in rat heart. Human Exp Toxicol 2007; 26: 781-8. [ Links ]
32. Mecca MM, Bartel LC, Castro CR, Castro JA. Benznidazole biotransformation in rat heart microsomal fraction without observable ultrastructural alterations: comparison to Nifurtimox-induced cardiac effects. Mem Inst Oswaldo Cruz 2008; 103: 549-53. [ Links ]
33. Montalto de Mecca M, Bernacchi AS, Castro JA. Prevention of benznidazole-induced prolonging effect on the pentobarbital sleeping time of rats using different thiol-containing compounds. Res Commun Mol Pathol Pharmacol 2000; 108: 39-48. [ Links ]
34. Castro GD, Castro JA. Studies on pentane evolution by rats treated with Nifurtimox or Benznidazole. Toxicology 1985; 35: 319-26. [ Links ]
35. Bulffer RF, Castro JA, Fanelli SL. Metodología UV para la determinación de los antichagásicos Nifurtimox y Benznidazol en sangre. Acta Bioquím Clín Latinoam 2011; 45: 463-70. [ Links ]
36. de Mecca MM, Bartel LC, Castro JA. Effect of chronic alcohol drinking on rat liver microsomal nitroreductive metabolism of nifurtimox and benznidazole. Hum Exp Toxicol 2013; 32: 1305-10. [ Links ]
37. Franke De Cazzulo BM, Bernacchi A, Esteva MI, Ruiz AM, Castro JA, Cazzulo JJ. Trypanocidal effect of SKF525A, proadifen, on different developmental forms of Trypanosoma cruzi. Medicina (Buenos Aires) 1998; 58: 415-8. [ Links ]
38. Bernacchi AS, Franke De Cazzulo B, Castro JA. Trypanocidal action of 2,4-dichloro-6-phenylphenoxyethyl diethylamine hydrobromide (Lilly 18947) on Trypanosoma cruzi. Acta Pharmacol Sin 2002; 23: 399-404. [ Links ]
39. Lacuara JL, de Barioglio SR, de Oliva PP, Bernacchi AS, de Culasso AF, Castro JA, et al. Disruption of mitochondrial function as the basis of the trypanocidal effect of trifluoperazine on Trypanosoma cruzi. Experientia 1991; 47: 612-6. [ Links ]
40. Díaz Gómez MI, Castro JA. Genotoxicidad en leucocitos por la quimioprofilaxis de sangre con Violeta de Genciana y su prevención con antioxidantes. Acta Bioquím Clín Latinoam 2013; 47: 719-26. [ Links ]
Recibido: 4 de agosto de 2014
Aceptado: 26 de noviembre de 2014













