Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957
Acta bioquím. clín. latinoam. vol.49 no.3 La Plata set. 2015
BIOLOGÍA CELULAR
Estudio comparativo del aislamiento de exosomas derivados de células madre mesenquimales humanas para uso clínico
Comparative study of isolated human mesenchymal stem cell derived exosomes for clinical use
Estudo comparativo do isolamento de exossomos derivados de celulas-tronco mesenquimais humanas para uso clinico
Verónica Alvarez1a*, Rebeca Blazquez1b*, Francisco Miguel Sanchez-Margallo1c*, Olga DelaRosa2c, Inmaculada Jorge3c, Angelo Tapia1c, Javier García Casado1c
a Medical Laboratory Technician
b MSc.
c PhD.
1 Stem Cell Therapy Unit, Minimally Invasive Surgery Centre Jesus Uson, Cáceres, España.
2 Research and Development Department, TiGenix SA, Parque Tecnológico de Madrid, Madrid, España.
3 Cardiovascular Proteomics Laboratory, Centro Nacional de Investigaciones Cardiovasculares, Madrid, España.
CORRESPONDENCIA PhD. JAVIER G. CASADO Stem Cell Therapy Unit Minimally Invasive Surgery Centre Jesus Uson Ctra. N-521 Km 41,8, 10071, CACERES, España. Correo electrónico: jgarcia@ccmijesususon.com
* Los tres autores contribuyeron igualmente en este artículo y deben ser considerados como primeros autores. El Dr. Javier G. Casado contribuyó en la concepción, la supervisión experimental, la escritura del manuscrito y la financiación. Las Dras. Olga DelaRosa e Inmaculada Jorge realizaron el estudio de espectrometría de masa, el análisis de los datos proteómicos y la supervisión y escritura del manuscrito. El Dr. Angelo Tapia contribuyó en la supervisión experimental y elaboración del manuscrito.
Resumen
Los exosomas son microvesículas derivadas de la exocitosis que son liberados al espacio extracelular. Las funciones de los exosomas dependen en gran medida de la célula de la cual provienen. Los exosomas derivados de células madre mesenquimales (Mesenchymal Stem Cells, MSCs), al igual que las células de origen, poseen un enorme potencial terapéutico que favorece la regeneración tisular y reduce la inflamación. Los prometedores resultados preclínicos que emplean estos exosomas han abierto las puertas a la futura aplicación clínica de estas vesículas. El diseño de nuevos protocolos que permitan el aislamiento de exosomas para su aplicación clínica es una necesidad actual teniendo en cuenta el enorme interés que ha surgido a raíz de los prometedores resultados en ensayos preclínicos. El objetivo de este trabajo ha sido comparar, en términos de rendimiento, tamaño y pureza, diferentes métodos de aislamiento de exosomas a partir de MSCs humanas. Los resultados obtenidos demuestran que el uso de filtros concentradores para sobrenadantes de cultivos podría ser una alternativa a los protocolos convencionales basados en la ultracentrifugación. Los resultados de este trabajo permiten orientar en el diseño de protocolos para la obtención de exosomas derivados de MSCs en grado clínico.
Palabras clave: Exosomas; Células madre mesenquimales; Aislamiento y purificación.
Summary
Exosomes are small membranous vesicles secreted to the extracellular space by most cell types through an exocytic process. Exosomes’ functions vary depending on cell source. Mesenchymal stem-cell (MSCs) derived exosomes, as MSCs, present a huge therapeutic potential, as they can be used in tissue regeneration and modulating inflammatory processes. The promising results obtained with these exosomes in different preclinical trials have opened the door to the future clinical application of these microvesicles. The design of new protocols for the isolation of exosomes is currently a need. The aim of this work was to compare -in terms of efficiency, size and purity- different isolation protocols for human MSCs-derived exosomes. These results demonstrate that the use of concentrator filters for MSCs supernatants could be an alternative to conventional protocols based on ultracentrifugation. The results of this work will be used to guide in the design of protocols to be applied on a clinical-grade production of exosomes.
Keywords: Exosomes; Mesenchymal stem cells; Isolation and purification.
Resumo
Os exossomos sao microvesiculas derivadas apos exocitose que sao liberadas no espaco extracelular. As funcoes dos exossomos dependem, em grande medida, da celula da qual provem. Os exossomos derivados de celulas-tronco mesenquimais (Mesenchymal Stem Cells, MSCs), tal como as celulas de origem, possuem enorme potencial terapeutico, favorecendo a regeneracao ou reparo tissular e reduzindo a inflamacao,. Os promissores resultados pre-clinicos, utilizando estes exossomos, abriram as portas para a futura aplicacao clinica destas vesiculas. A criacao de novos protocolos que permitam o isolamento de exossomos para a sua aplicacao clinica e uma necessidade actual, levando em consideracao o enorme interesse surgido em torno dos resultados promissores em ensaios pre-clinicos. O objetivo deste trabalho foi comparar, em termos de rendimento, tamanho e pureza, diferentes metodos de isolamento de exossomos a partir de MSCs humanas. Os resultados obtidos demonstram que o uso de filtros concentradores para sobrenadantes de culturas poderia ser uma alternativa aos protocolos convencionais baseados na ultracentrifugacao. Os resultados deste trabalho fornecem uma orientacao na criacao de protocolos para a obtencao de exossomos derivados de MSCs em grau clinico.
Palavras-chave: Exossomos; Células-tronco mesenquimais; Isolamento e purificação.
Introducción
Los exosomas son microvesículas que se originan del compartimento endosomal por fusión de cuerpos multivesiculares con la membrana plasmática. Por otro lado, los términos microvesículas, ectosomas o vesículas liberadas corresponderían a partículas directamente originadas de la membrana plasmática (1). Aunque la bibliografía indica que los exosomas son partículas con un diámetro menor de 100 nm y las microvesículas partículas mayores de 100 nm, según la International Society for Extracellular Vesicles (ISEV), la estricta separación por tamaño u origen aún no ha sido exactamente establecida, ni existe consenso sobre los marcadores que puedan distinguir el origen de estas vesículas (1).
Los exosomas son secretados por la mayoría de los tipos celulares y se pueden aislar tanto de sobrenadantes de células en cultivo como de diferentes fluidos biológicos (2). Se ha demostrado que los exosomas están involucrados en las relaciones intercelulares, permitiendo el intercambio de proteínas y lípidos entre las células productoras de exosomas y las células de destino (3). Estas microvesículas contienen ARN, micro-ARN y proteínas procedentes de sus células de origen, que les confieren un mecanismo de señalización importante en procesos fisiológicos, incluyendo la progresión tumoral, la angiogénesis y la modulación de la respuesta inmune (4-7). Existen diferentes métodos para el aislamiento de exosomas, aunque el más extendido es la ultracentrifugación. Este método a menudo se combina con gradientes de sacarosa y requiere de un equipamiento adecuado. Existen también otros métodos que incluyen la cromatografía líquida de alta resolución (High-Performance Liquid Chromatography, HPLC), ultrafiltración, precipitación con polímeros e inmunoseparación basada en partículas magnéticas (1). El uso de exosomas para el tratamiento de diferentes patologías se ha estudiado a nivel preclínico donde la seguridad, eficacia y tolerabilidad se ha demostrado ampliamente (4)(8)(9). En los últimos años, se han iniciado ensayos clínicos empleando exosomas derivados de células dendríticas para el tratamiento de pacientes con cáncer (5).
Actualmente, el potencial terapéutico de exosomas derivados de células madre mesenquimales (Mesenchymal Stem Cells, MSCs) para el tratamiento de patologías de origen cardiovascular se ha demostrado en modelos animales (6). En este sentido, se han empleado exosomas procedentes de médula ósea en un modelo murino de isquemia-reperfusión miocárdica resultando un efecto beneficioso sobre la reducción del daño tisular (9). Por otro lado, también se ha demostrado el efecto proangiogénico de exosomas derivados de células madre hematopoyéticas (7). En los últimos años se ha demostrado ampliamente que el efecto beneficioso del trasplante de MSCs viene mediado, al menos en parte, por un efecto paracrino(10). En los ensayos con modelos murinos de infarto, se ha comprobado experimentalmente que el efecto terapéutico de las MSCs (entre un 50% y un 80%) se debe a factores paracrinos (11). Por tanto, los actuales ensayos preclínicos con exosomas derivados de MSCs van dirigidos a la aplicación local de éstos para favorecer de manera directa o indirecta la reparación de tejidos. Además, el efecto inmunomodulador mediado por factores solubles se ha demostrado en células NK, linfocitos T, células γδ, dendríticas y células NKT (12-16). En cuanto a las características morfológicas de estos exosomas, se ha demostrado recientemente que, en el caso de exosomas derivados de MSCs de origen adiposo, el tamaño de éstos es relativamente superior a otros exosomas previamente descritos (17). En el trabajo de Katsuda et al, se demuestra que esta clase de exosomas presentan un tamaño entre 150 y 200 nm cuando se analizan con el método de nanoparticle tracking analysis. Por otro lado, estos exosomas presentan similitudes con otros exosomas aislados de otros tipos celulares (p. ej. CD9 y CD81), sin embargo, también expresan otras moléculas de adhesión entre las que se incluyen CD29, CD44 y CD73 cuya expresión también se ha detectado en la superficie de la célula de origen (18).
El objetivo de este trabajo se ha centrado en la evaluación de tres métodos de enriquecimiento y aislamiento de exosomas derivados de MSCs humanas. Esta evaluación se ha realizado comparando las diferentes metodologías en términos de rendimiento, tamaño de partícula y pureza, y considerando (o teniendo en cuenta) también otros factores como los tiempos de ensayos, uso de equipamiento y coste de materiales. Por último, es importante indicar que los resultados que se presentan en este trabajo se han obtenido empleando células que actualmente se están administrando en ensayos clínicos (ADMIRE-CD, NCT01541579). Por tanto, los resultados de este trabajo tienen una enorme relevancia para el diseño de protocolos de aislamiento de exosomas en grado clínico.
Materiales y Métodos
AISLAMIENTO, EXPANSION Y CARACTERIZACION DE CELULAS MADRE MESENQUIMALES HUMANAS DERIVADAS DE TEJIDO ADIPOSO.
Las MSCs derivadas de tejido adiposo fueron aisladas de lipoaspirados humanos de donantes adultos sanos según protocolos anteriormente descritos (19). Estas células fueron obtenidas tras el consentimiento informado y bajo los auspicios de los comités de ética e investigación correspondientes. En este trabajo se utilizaron las mismas líneas celulares empleadas en la publicación de DelaRosa et al (19). El informe del Comité de Bioética recogió todos los procedimientos experimentales desarrollados en el presente trabajo y el citado artículo. Para realizar el análisis inmunofenotípico de las células mediante citometría de flujo se utilizaron anticuerpos monoclonales comerciales, siendo estas células negativas para CD14, CD31, CD45 y positivas para CD29, CD59, CD73, CD90 y CD105. Los ensayos de diferenciación para comprobar la multipotencialidad de las células aisladas se realizaron cuando éstas alcanzaron un 80% de confluencia siguiendo los protocolos anteriormente descritos por Casado et al. Para ello se reemplazó el medio de cultivo de las expansiones por los medios de diferenciación durante 21 días (20).
RECOLECCION DE SOBRENADANTES DE CELULAS MADRE MESENQUIMALES HUMANAS DERIVADAS DE TEJIDO ADIPOSO.
Una vez alcanzado el 80% de confluencia en los cultivos, se lavaron los frascos de cultivo con tampón fosfato salino (Phosphate Buffer Saline, PBS) 1X para eliminar los restos de suero fetal bovino y se añadió DMEM con 1% penicilina/estreptomicina, 1% de L-glutamina y 1% de Insulina-Transferrina y Selenito (Insulin-Transferrin- Selenium, ITS). Las células se incubaron con este medio durante 6 días y se recogió el sobrenadante del cultivo para posteriormente volver a añadir el mismo medio de cultivo y seguir colectando el sobrenadante. Los sobrenadantes de MSCs derivadas de tejido adiposo fueron centrifugados para eliminar los restos celulares a 1000 xg durante 10 minutos, y una segunda centrifugación a 5000 xg durante 20 minutos. Una vez centrifugados fueron filtrados empleando filtros estériles de acetato de celulosa de 0,22 μm (Millipore).
AISLAMIENTO DE EXOSOMAS MEDIANTE CONCENTRADORES DE 3000 MWCO.
En este caso los concentradores usados fueron Amicon ® Ultra (Merck Millipore) con un peso molecular límite (Molecular Weight CutOff, MWCO) de 3 kDa. Para comenzar el aislamiento se lavó el filtro; para ello se introdujeron 20 mL de PBS estéril, se centrifugó 20 minutos a 4000 xg en una Multifuge 1 L-R (Thermo) con rotor oscilante 75002005 para eliminar los posibles restos de glicerina y de azida sódica; posteriormente se eliminó el PBS de la parte superior del filtro y se desechó la parte inferior del concentrador. Posteriormente se introdujeron en el tubo 15 mL de sobrenadantes de MSCs derivadas de tejido adiposo y se centrifugó a 4000 xg durante 60 minutos a 4 ºC, se eliminaron los restos y se congeló el sobrenadante concentrado a -20 ºC para posteriores análisis.
AISLAMIENTO DE EXOSOMAS MEDIANTE CONCENTRADORES DE 50000 MWCO.
Los concentradores usados fueron Vivaspin 20 (Sartorius Stendim Biotech) con un MWCO de 50kDa. Para comenzar el aislamiento se lavó el filtro con PBS; para ello se introdujeron 20 mL de PBS estéril, se centrifugó a 5000 xg durante 20 minutos, se eliminó el PBS de la parte superior del filtro y se desechó la parte inferior del concentrador. Se añadieron 20 mL de los sobrenadantes de MSCs derivadas de tejido adiposo y se centrifugó a 5000 xg durante 40 minutos a 4 ºC. Una vez centrifugados, se recogió todo el volumen resultante de la parte superior del filtro y se congeló a -20 ºC para posteriores análisis.
AISLAMIENTO DE EXOSOMAS MEDIANTE ULTRACENTRIFUGACION.
Una vez centrifugados los exosomas para eliminar restos celulares se introdujeron 20 mL de los sobrenadantes con exosomas en tubos especiales para ultracentrífuga (Beckman Coulter) y se centrifugaron a 100000 x g durante 6 horas en una ultracentrífuga Optima L- 90K, (Beckman Coulter) con rotor de ángulo fijo modelo 70.1 Ti, posteriormente se eliminó el sobrenadante y se resuspendió el precipitado resultante en 250 μL de PBS. Para mejorar la disolución del pellet, se dejó toda la noche a 4 ºC en agitación. Tras la disolución de todo el pellet, éste se congeló a -20 ºC para posteriores análisis.
CUANTIFICACION DE PROTEINAS MEDIANTE EL METODO DE BRADFORD.
La concentración de proteínas obtenida fue cuantificada mediante el método de Bradford. Brevemente, se añadieron 180 μL de reactivo de Bradford (Quick StartTM Bradford Dye Reagent, Bio-Rad) y 20 μL de muestra. Se incubó durante 5 minutos y se midió la absorbancia a 595 nm en un espectrofotómetro de placas (Biotek, modelo Synergy™ Mx). Las absorbancias se extrapolaron a valores de concentración empleando una recta patrón de seroalbúmina bovina (Bovine Seroalbumine, BSA).
CARACTERIZACION Y CUANTIFICACION DE EXOSOMAS MEDIANTE NANOSIGHT
La concentración y el tamaño de los exosomas purificados se determinaron mediante el análisis de nanopartículas que ofrece el equipo NanoSight (NanoSight Ltd, Amesbury, UK), el cual relaciona el movimiento browniano con el tamaño de la partícula. Los resultados de esta medida se analizaron con el software de análisis propio del equipo (Nanoparticle Tracking Analysis software, versión 2.2). La configuración del equipo para dicho análisis fue la siguiente: Fotogramas procesados: 899 de 900. Fotogramas por segundo: 30. Calibración: 166nm/pixel. Desenfoque automático: Auto. Umbral de detección: 4 Multi. Tamaño mínimo esperado: Auto. Tamaño mínimo de seguimiento: 100 nm. Temperatura: 24-28 ºC. Viscosidad: 0,80-0,95 cP.
ANALISIS PROTEOMICO BASADO EN ESPECTROMETRIA DE MASA
Para identificar y determinar de manera semicuantitativa el perfil de proteínas procedentes de los tres tipos de aislamientos, las muestras se analizaron mediante proteómica de alta resolución. La digestión de las proteínas se realizó empleando el método descrito por Bonzon-Kulichenko et al. Brevemente, se preparó un pool de 50 μg de proteínas procedentes de diferentes aislamientos de un mismo donante. Este pool de proteínas fue resuspendido en 75 μL de un tampón compuesto por 5% SDS, 10% glicerol, 25 mM Tris-Cl, 10 mM DTT y 0,01% azul de bromofenol a pH 6,8. Las muestras se separaron en un gel convencional de SDSpoliacrilamida. Las bandas de las proteínas se visualizaron mediante una tinción de Coomassie, se cortaron y digirieron a 37 ºC con 60 ng/μL de tripsina en una relación de 5:1 proteína:tripsina (w/w) en 50 mM de bicarbonato amónico, pH 8,8 con 10% (v/v) de acetonitrilo y 0,01% (w/v) 5-ciclohexil-1-pentil-â-D maltósido (21). Los péptidos resultantes fueron analizados por espectrometría de masa en tándem (LC-MS/MS) usando un sistema Easy-nLC 1000 acoplado a un quadruple-Orbitrap hybrid mass spectrometer (Q-Exactive, Thermo Scientific, San José, CA). La identificación de proteínas se realizó con SEQUEST (Protein Discoverer 1.3.0.339, Thermo Scientific) usando la base de datos de Swissprot (Uniprot release 2012-5). Los resultados de SEQUEST fueron validados como se describe en el trabajo de Navarro P et al (22). Los resultados obtenidos, tanto de identificación de proteínas como de observación semicuantitativa fueron a continuación analizados empleando la herramienta Gene-Ontology (23). Esta herramienta es un recurso para obtener una clasificación sobre las funciones biológicas de las proteínas identificadas. En este trabajo se ha realizado la clasificación de las diferentes proteínas identificadas en los distintos métodos aplicando la clasificación "Cellular Component". Dentro de esta clasificación, se determinó el porcentaje de proteínas que según Gene-Ontology se clasificaban dentro del término "Extracellular Vesicular Exosome" (GO:0070062).
ANALISIS ESTADISTICO
Para la comparación de los diferentes métodos de aislamiento de exosomas en cuanto a tamaño, número y concentración de partículas, se realizó en primer lugar un estudio de la normalidad en la distribución de las distintas variables, así como de la homogeneidad de varianzas. Tras confirmar la distribución normal y heterocedasticidad de las tres variables, condiciones inapropiadas para aplicar el análisis de varianzas (ANOVA), se optó por realizar la prueba no paramétrica de Kruskal-Wallis para contrastar las medianas de los distintos grupos. En los casos en los que se obtuvo un p-valor significativo en esta prueba, se realizó un posterior contraste múltiple no paramétrico penalizado mediante la U de Mann-Whitney. Así, el p-valor considerado para cada comparación fue el obtenido tras aplicar la penalización correspondiente a la fórmula 1-(1-p)c, donde p es el p-valor original y c es el número de comparaciones realizadas. Todos los p-valores inferiores a 0,05 se consideraron significativos.
Resultados
CARACTERIZACION FENOTIPICA Y FUNCIONAL DE CELULAS MADRE MESENQUIMALES DERIVADAS DE TEJIDO ADIPOSO.
Tras realizar el análisis fenotípico de las células se comprobó que éstas expresan los marcadores de superficie de MSCs, siendo negativas para marcadores de células endoteliales y linfoides (datos no mostrados). En los ensayos de diferenciación se realizó una observación microscópica y se comprobó que las células aisladas se diferenciaron a los tres linajes, demostrando así su multipotencialidad (datos no mostrados).
COMPARACION DE LOS METODOS DE AISLAMIENTO DE EXOSOMAS EN TERMINOS DE CONCENTRACION DE PROTEINAS
Los volúmenes obtenidos en las centrifugaciones con los diferentes métodos de aislamiento oscilaron entre los 150 y 300 μL finales tanto en los aislamientos mediante ultracentrifugación como en los aislamientos con filtros concentradores. El volumen resultante de los diferentes métodos de aislamiento se empleó para determinar mediante el método de Bradford la concentración de proteínas totales. La mediana y rango intercuartílico de la concentración de proteínas obtenida con cada uno de los diferentes métodos de aislamiento de exosomas fueron de 476,24 μg/mL (367,41 μg/mL - 611,63 μg/mL) para los concentradores de 3000 MWCO, 114,99 μg/mL (57,08 μg/mL - 228,82 μg/mL) para los concentradores de 50000 MWCO y 82,52 μg/mL (55,89 μg/mL - 114,75 μg/mL) para el método de la ultracentrífuga (Figura 1). Así, puede observarse que cuando se emplearon los concentradores de 3000 MWCO se alcanzó una concentración proteica hasta 5,8 veces mayor que en el aislamiento mediante ultracentrifugación, y más del cuádruple de la obtenida con los concentradores de 50000 MWCO, existiendo por tanto una diferencia estadísticamente significativa entre la concentración de proteínas alcanzada con los concentradores de 3000 MWCO y la obtenida mediante los otros dos métodos.
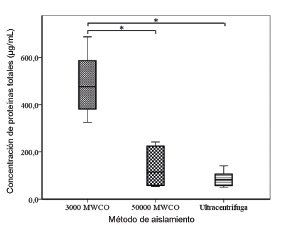
Figura 1. Medida de concentracion de proteinas en exosomas aislados mediante los diferentes metodos estudiados. La proteina total de los concentrados de exosomas obtenidos con los diferentes metodos de aislamiento se determino mediante el metodo de Bradford, extrapolando los valores de absorbancia a partir de una recta patron de seroalbumina bovina. En la grafica se muestran las medidas obtenidas (n=6) a traves de un diagrama de cajas, en el que la base de las cajas se corresponde al primer cuartil, y la tapa de la caja, al tercer cuartil. En el centro de la caja se encuentra la mediana. Los asteriscos indican diferencias estadisticamente significativas (p≤0,05) entre los grupos.
COMPARACION DE LOS METODOS DE AISLAMIENTO DE EXOSOMAS EN TERMINOS DE TAMANO DE PARTICULAS
Tras la cuantificación de las proteínas, se realizó una caracterización y cuantificación de las microvesículas mediante el equipo NanoSight, siendo analizadas mediante el software propio del equipo (Nanoparticle Tracking Analysis software, versión 2.2). Con este equipo, además de analizar el número de partículas se pudo cuantificar la distribución de éstas y el tamaño, permitiendo caracterizar las vesículas liberadas por las células. En la figura 2A se muestran tres imágenes representativas de los análisis realizados en los diferentes exosomas aislados con los tres métodos. Con los tres métodos, el tamaño de las vesículas osciló entre 167 y 282 nm, con diferencias significativas en el tamaño de las partículas dependiendo del método de aislamiento. La mediana y rango intercuartílico del tamaño de las vesículas correspondientes al promedio de cada muestra fue de 181 nm (170 nm - 193,5 nm) para los concentradores de 3000 MWCO, 208,5 nm (178 nm - 229,75 nm) para los concentradores de 50000 MWCO y 239 nm (224,5 nm - 275,25 nm) para el método de la ultracentrífuga (Figura 2B). Con estos resultados se pudo comprobar que el tamaño de las partículas varía dependiendo del método de aislamiento, encontrándose partículas de menor tamaño en métodos en los que el tamaño del poro también es menor. De esta forma, se observaron diferencias significativas al comparar el grupo de los concentradores de 3000 MWCO (con el que se obtuvo el tamaño de partículas más bajo) con el método de la ultracentrifugación (que arrojó los valores más elevados para el tamaño de las partículas).
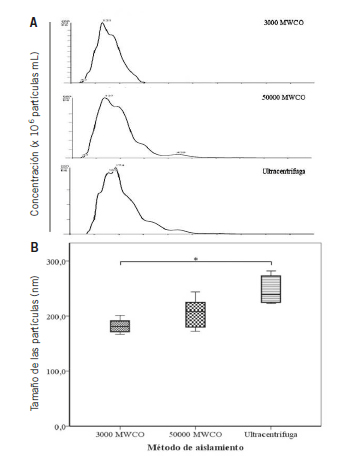
Figura 2. Determinacion del tamano de las particulas presentes en las muestras obtenidas mediante los diferentes metodos estudiados. El tamano de las particulas presentes en los concentrados de exosomas obtenidos con los diferentes metodos de aislamiento se determino mediante el analisis proporcionado por el software del equipo NanoSight. En la grafica (A) se muestran las imagenes representativas del analisis obtenido del NanoSight, procedentes de una misma muestra y aisladas mediante diferentes metodos. La escala del eje X, hace referencia a 100 nm por division. La escala del eje Y representa la concentracion de particulas expresadas en particulas por mL. En la grafica (B) se muestra la representacion grafica y estadistica de las medidas obtenidas (n=6) a traves de un diagrama de cajas, en el que la base de las cajas corresponde con el primer cuartil, y la tapa de la caja, con el tercer cuartil. En el centro de la caja se encuentra la mediana. Los asteriscos indican diferencias estadisticamente significativas (p≤0,05) entre los grupos.
COMPARACION DE LOS METODOS DE AISLAMIENTO DE EXOSOMAS EN TERMINOS DE NUMERO DE PARTICULAS
Se determinó, además, el número de partículas por volumen empleando el equipo NanoSight y éste osciló entre 6,40 x 109 partículas/mL y 15,28 x 109 partículas/mL para los diferentes grupos. La mediana y el rango intercuartílico del número de partículas fue de 13,11 partículas/mL (10,86 partículas/mL - 14,86 partículas/ mL) para los concentradores de 3000 MWCO, 10,26 partículas/mL (9,54 partículas/mL - 11 partículas/ mL) para los concentradores de 50000 MWCO y 9,27 partículas/mL (8,47 partículas/mL - 9,54 partículas/ mL) para el método de la ultracentrífuga. En este caso, el número de partículas aisladas con los concentradores de 3000 MWCO fue significativamente más elevado que el alcanzado con la ultracentrifugación. Con los concentradores de 50000 MWCO se obtuvo un número de partículas intermedio entre los dos métodos anteriores (Figura 3).

Figura 3. Determinacion del numero de particulas en las muestras de exosomas aislados mediante los diferentes metodos estudiados. El numero de particulas presente en los concentrados de exosomas obtenidos con los diferentes metodos de aislamiento se determino mediante el analisis proporcionado por el software del equipo NanoSight. En la grafica se muestran las medidas obtenidas (n=6) a traves de un diagrama de cajas, en el que la base de las cajas corresponde con el primer cuartil, y la tapa de la caja, con el tercer cuartil. En el centro de la caja se encuentra la mediana. Los asteriscos indican diferencias estadisticamente significativas (p≤0,05) entre los grupos.
COMPARATIVA DE LOS METODOS DE AISLAMIENTO DE EXOSOMAS MEDIANTE PROTEOMICA
Los resultados obtenidos del análisis mediante proteómica permitieron identificar 345 proteínas en el caso de los aislamientos realizados con el concentrador de 3000 MWCO, un total de 307 proteínas en los aislamientos con el concentrador de 50000 MWCO y 172 proteínas en el aislamiento realizado mediante ultracentrifugación. En cada uno de los aislamiento se realizó la semicuantificación del número de péptidos correspondientes a cada una de las proteínas identificadas (resultados no mostrados). El total de las proteínas identificadas (tomando el código de acceso de Uniprot), fue analizado con la herramienta bioinformática Gene Ontology (27). Los resultados de este análisis se centraron en determinar el porcentaje de proteínas que se clasificaban como proteínas propias de los exosomas (denominadas según Gene Ontology como Extracellular Vesicular Exosome). Los resultados de esta clasificación demostraron que, para el concentrador de 3000 MWCO, un 65,22% de las proteínas correspondían al grupo de proteínas relacionadas con vesículas exosomales. Empleando los concentradores de 50000 MWCO, el porcentaje fue de 73,98%. Por último, en el caso de los aislamientos mediante ultracentrifugación, el porcentaje de proteínas relacionadas con vesículas exosomales fue de 67,44% (Figura 4).

Figura 4. Caracterizacion proteomica del perfil proteico analizado en los diferentes concentrados de exosomas. El total de proteinas identificadas mediante espectrometria de masas fueron clasificadas empleando la herramienta informatica Gene Ontology. En la grafica se muestra, para cada uno de los metodos utilizados, el porcentaje de proteinas relacionadas con vesiculas exosomales (GO:0070062) sobre el total de proteinas identificadas de cada muestra.
Discusión y Conclusiones
El objetivo de este trabajo se ha centrado en la evaluación de diferentes protocolos de aislamiento de exosomas derivados de MSCs. En este trabajo se han comparado tres protocolos de aislamiento que permiten la obtención de exosomas aplicables para la práctica clínica. Concretamente, se han analizado los diferentes productos obtenidos en términos de concentración, tamaño y pureza. En el primero de los protocolos se emplearon concentradores de 3000 MWCO. Este tipo de concentradores se ha descrito previamente para la obtención de concentrados de diferentes exosomas (24). Para el segundo de los protocolos se emplearon concentradores de 50000 MWCO los cuales se han descrito previamente para el aislamiento de exosomas tumorales (25) y procedentes de orina (26). Por último, el método de aislamiento empleando ultracentrifugación se ha descrito ampliamente para exosomas de diferente origen. El objetivo de este estudio ha sido orientar desde el punto de vista metodológico en el desarrollo de métodos de aislamiento de exosomas de MSCs para su futura aplicación clínica.
Actualmente, los resultados publicados tanto en ensayos in vitro como en modelos preclínicos indican que estos exosomas poseen un enorme potencial terapéutico en el tratamiento de enfermedades de base inmunológica y en patologías asociadas a daño tisular. Por un lado, los ensayos preclínicos en modelos de infarto agudo de miocardio han demostrado que el tratamiento con exosomas derivados de MSCs favorece la recuperación funcional del tejido cardíaco (27). Por otro lado, con respecto al papel inmunomodulador de estos exosomas, este grupo de investigación ha demostrado que poseen un efecto regulador similar al que está descrito para las propias células, con un efecto inhibidor sobre la activación, secreción y proliferación de linfocitos T (28).
Los resultados que se presentan en este trabajo indican que el uso de concentradores comerciales con un menor tamaño de poro y centrifugados a menor velocidad permite la obtención de un mayor número de exosomas con menor tamaño y mayor pureza. Esta observación confirma el trabajo publicado por Cvjetkovic et al en el que los autores comparan la influencia del rotor y el tiempo de centrifugación para el aislamiento y purificación de microvesículas. En ese artículo se demostró que centrifugaciones demasiado largas (superiores a 4 horas), deberían evitarse para reducir la contaminación excesiva de proteínas solubles. También observaron que tiempos muy inferiores a 70 minutos son insuficientes para el aislamiento de exosomas (29). Por el contrario, el método de la ultracentrifugación para el aislamiento de exosomas, el cual es un método ampliamente utilizado en la mayoría de trabajos, da como resultado unas concentraciones más bajas y una pureza inferior. En relación con el método seleccionado para el aislamiento de exosomas con ultracentrifugación, es importante indicar que en este trabajo se ha aplicado la ultracentrifigación sin gradientes de densidad en sacarosa (normalmente se emplea una dilución de sacarosa al 30%). De acuerdo con la experiencia de los autores, el rendimiento obtenido en el aislamiento de exosomas de MSCs cuando se aplican gradientes de densidad de sacarosa al 30% es significativamente inferior que sin aplicar dicho gradiente (resultados no mostrados). Puesto que el objetivo principal de este trabajo era comparar diferentes métodos de aislamiento de exosomas para su futura aplicación clínica, se decidió descartar el método de aislamiento de ultracentrifugación en gradiente de densidad. Este método, a pesar de proporcionar un alto grado de pureza, presentaba unos rendimientos demasiado bajos para su posterior aplicación clínica. En este sentido, es interesante destacar de los resultados un aspecto como el de la pureza de las muestras obtenidas mediante ultracentrifugación. Según se puede observar en la Figura 2B, el perfil de tamaño de las vesículas aisladas mediante ultracentrifugación fue mayor de 220 nm. Estos resultados resultan llamativos si se tiene en cuenta que los sobrenadantes ultracentrifugados han sido sometidos a un proceso de filtración empleando filtros de 0,22 μm. Similares perfiles de tamaño se han observado en el caso de exosomas derivados de placenta aislados mediante ultracentrifugación (30). En el caso de los exosomas de placenta, se demuestra que las muestras ultracentrifugadas y previamente filtradas a 0,22 μm daban como resultado un perfil de vesículas con tamaños superiores a 220 nm. Este grado de pureza incrementó significativamente cuando los sobrenadantes fueron sometidos a una ultracentrifugación en gradiente de sacarosa, obteniéndose partículas con un tamaño de partículas entre 50 nm y 150 nm. Tanto los resultados publicados por Sarker S et al (30) como los publicados en el presente trabajo parecen indicar que los aislamientos realizados mediante ultracentrifugación sin gradiente de sacarosa dan como resultado una población de vesículas de tamaño heterogéneo en comparación con los aislamientos realizados mediante un gradiente de sacarosa. Además, el hecho de que puedan ser detectadas vesículas con tamaños superiores a 0,22 micras (a pesar del prefiltrado de los sobrenadantes) podría deberse a un proceso de agregación de vesículas tras el aislamiento (31).
Un aspecto favorable del uso de concentradores en contra del uso de ultracentrífuga radica en el coste elevado de los equipos de ultracentrifugación, mientras que los protocolos en los que se emplean filtros concentradores sólo requieren centrífugas convencionales de menor coste y ampliamente disponibles en clínicas, hospitales y centros de investigación. Por último, es importante comentar en esta discusión el creciente interés de la industria en la producción de vesículas extracelulares. Al día de hoy, tres empresas (Capricor Inc, Anosys Inc. y ReNeuron Group PLKC) se están especializando en el desarrollo de terapias basadas en vesículas extracelulares aisladas de diferentes fuentes (células derivadas de cardiosferas, células madre neurales y células dendríticas). Sorprende que, a pesar del potencial terapéutico de estas vesículas, el impacto que tienen actualmente en la industria y en el desarrollo de ensayos clínicos sea aún muy limitado. Una de las razones que limitan la incorporación de las vesículas extracelulares en ensayos clínicos es la necesidad de un proceso de estandarización en el aislamiento de éstas. En este sentido, aunque la ultracentrifugación se ha considerado tradicionalmente como el método que proporciona un mayor grado de pureza en el aislamiento de exosomas, este método, desde el punto de vista industrial, es costoso en términos de tiempo y energía. Los métodos basados en la filtración podrían ser una alternativa para el procesamiento a gran escala de sobrenadantes de cultivos celulares aunque para una aplicación terapéutica este material biológico debe ser producido bajo condiciones controladas y siguiendo la normativa de buenas prácticas de manufactura (en inglés, GMP). El establecimiento de buenas prácticas de manufactura para la obtención de exosomas con métodos de filtración requiere unos controles de calidad que tengan en cuenta el tamaño de las vesículas, presencia/ ausencia de marcadores bioquímicos, ausencia de contaminantes (p. ej. agregados de proteínas), esterilidad y estabilidad del producto final, métodos para optimizar el almacenamiento del producto y por último, métodos analíticos que sirvan para controlar todos los aspectos anteriormente enumerados (32).
A pesar de que el trabajo aquí presentado, al tratarse de un desarrollo experimental in vitro, tiene evidentes limitaciones, los autores consideran que el aspecto más interesante y novedoso de los resultados radica en el enfoque hacia una futura aplicación clínica de exosomas derivados de MSCs. Los ensayos preclínicos que se están realizando actualmente en este grupo de investigación permitirán además obtener una prueba de concepto para determinar dos parámetros fundamentales en terapias avanzadas como son la seguridad y eficacia de este nuevo producto, con un importante potencial terapéutico enfocado al tratamiento en patologías asociadas a procesos inflamatorios.
AGRADECIMIENTOS
Este trabajo fue financiado en parte por un contrato a Rebeca Blázquez (TE12066), un contrato a Javier G. Casado (TA13042) y un proyecto a Javier G. Casado (IB13123), financiados por el Gobierno de Extremadura y cofinanciados por el Fondo Social Europeo.
1. Witwer KW, Buzás EI, Bemis LT, Bora A, Lässer C, Lötvall J, et al. Standardization of sample collection, isolation and analysis methods in extracellular vesicle research. J Extracell Vesicles 2013; 2: 20360. [ Links ]
2. Simpson RJ, Lim JW, Moritz RL, Mathivanan S. Exosomes: proteomic insights and diagnostic potential. Expert Rev Proteomics 2009; 6(3): 267-83. [ Links ]
3. Maguire G, Friedman P, McCarthy D, Friedman R, Maniotis A. Stem Cell Released Molecules and Exosomes in Tissue Engineering. Procedia Eng 2013;59: 270-8. [ Links ]
4. Pêche H, Renaudin K, Beriou G, Merieau E, Amigorena S, Cuturi MC. Induction of tolerance by exosomes and short-term immunosuppression in a fully MHC-mismatched rat cardiac allograft model. Am J Transplant 2006; 6(7): 1541-50. [ Links ]
5. Viaud S, Théry C, Ploix S, Tursz T, Lapierre V, Lantz O, et al. Dendritic cell-derived exosomes for cancer immunotherapy: what’s next? Cancer Res 2010; 70(4): 1281-5.
6. Lai RC, Chen TS, Lim SK. Mesenchymal stem cell exosome: a novel stem cell-based therapy for cardiovascular disease. Regen Med 2011 ; 6(4): 481-92. [ Links ]
7. Sahoo S, Klychko E, Thorne T, Misener S, Schultz KM, Millay M, et al. Exosomes from human CD34(+) stem cells mediate their proangiogenic paracrine activity. Circ Res 2011; 109(7): 724-8. [ Links ]
8. Beauvillain C, Juste MO, Dion S, Pierre J, Dimier-Poisson I. Exosomes are an effective vaccine against congenital toxoplasmosis in mice. Vaccine 2009; 27(11): 1750-7. [ Links ]
9. Lai RC, Arslan F, Lee MM, Sze NSK, Choo A, Chen TS, et al. Exosome secreted by MSC reduces myocardial ischemia/reperfusion injury. Stem Cell Res 2010; 4(3): 214-22. [ Links ]
10. Sanz-Ruiz R, Fernández-Avilés F. [Stimulating factors for cardiac repair: when the ischemic myocardium asks for help]. Med Clínica 2012 ; 138(10): 435-7. [ Links ]
11. Chimenti I, Smith RR, Li T-S, Gerstenblith G, Messina E, Giacomello A, et al. Relative roles of direct regeneration versus paracrine effects of human cardiosphere-derived cells transplanted into infarcted mice. Circ Res 2010; 106(5): 971-80. [ Links ]
12. Casado JG, Tarazona R, Sanchez-Margallo FM. NK and MSCs crosstalk: the sense of immunomodulation and their sensitivity. StemCell Rev 2013; 9(2): 184-9. [ Links ]
13. DelaRosa O, Sánchez-Correa B, Morgado S, Ramírez C, del Río B, Menta R, et al. Human adipose-derived stem cells impair natural killer cell function and exhibit low susceptibility to natural killer-mediated lysis. Stem Cells Dev 2012; 21(8): 1333-43. [ Links ]
14. Rasmusson I, Uhlin M, Le Blanc K, Levitsky V. Mesenchymal stem cells fail to trigger effector functions of cytotoxic T lymphocytes. J Leukoc Biol 2007; 82(4): 887-93. [ Links ]
15. Prigione I, Benvenuto F, Bocca P, Battistini L, Uccelli A, Pistoia V. Reciprocal interactions between human mesenchymal stem cells and gammadelta T cells or invariant natural killer T cells. Stem Cells 2009; 27(3): 693-702. [ Links ]
16. Chen L, Zhang W, Yue H, Han Q, Chen B, Shi M, et al. Effects of human mesenchymal stem cells on the differentiation of dendritic cells from CD34+ cells. Stem Cells Dev 2007; 16(5): 719-31. [ Links ]
17. Katsuda T, Tsuchiya R, Kosaka N, Yoshioka Y, Takagaki K, Oki K, et al. Human adipose tissue-derived mesenchymal stem cells secrete functional neprilysin-bound exosomes. Sci Rep 2013; 3. [ Links ]
18. Yu B, Zhang X, Li X. Exosomes derived from mesenchymal stem cells. Int J Mol Sci 2014; 15(3): 4142-57. [ Links ]
19. DelaRosa O, Lombardo E, Beraza A, Mancheño-Corvo P, Ramirez C, Menta R, et al. Requirement of IFN-gamma- mediated indoleamine 2,3-dioxygenase expression in the modulation of lymphocyte proliferation by human adipose-derived stem cells. Tissue Eng Part 2009; 15(10): 2795-806. [ Links ]
20. Casado JG, Gomez-Mauricio G, Alvarez V, Mijares J, Tarazona R, Bernad A, et al. Comparative phenotypic and molecular characterization of porcine mesenchymal stem cells from different sources for translational studies in a large animal model. Vet Immunol Immunopathol 2012; 147(1-2): 104-12. [ Links ]
21. Bonzon-Kulichenko E, Pérez-Hernández D, Núñez E, Martínez-Acedo P, Navarro P, Trevisan-Herraz M, et al. A robust method for quantitative high-throughput analysis of proteomes by 18O labeling. Mol Cell Proteomics 2011; 10(1): M110.003335. [ Links ]
22. Navarro P, Vázquez J. A refined method to calculate false discovery rates for peptide identification using decoy databases. J Proteome Res 2009; 8(4): 1792-6. [ Links ]
23. Ashburner M, Ball CA, Blake JA, Botstein D, Butler H, Cherry JM, et al. Gene ontology: tool for the unification of biology. The Gene Ontology Consortium. Nat Genet 2000; 25(1): 25-9. [ Links ]
24. Hooper C, Sainz-Fuertes R, Lynham S, Hye A, Killick R, Warley A, et al. Wnt3a induces exosome secretion from primary cultured rat microglia. BMC Neurosci 2012; 13:144. [ Links ]
25. Gastpar R, Gehrmann M, Bausero MA, Asea A, Gross C, Schroeder JA, et al. Heat shock protein 70 surface-positive tumor exosomes stimulate migratory and cytolytic activity of natural killer cells. Cancer Res 2005; 65(12): 5238-47. [ Links ]
26. Alvarez ML, Khosroheidari M, KanchiRavi R, DiStefano JK. Comparison of protein, microRNA, and mRNA yields using different methods of urinary exosome isolation for the discovery of kidney disease biomarkers. Kidney Int 2012; 82(9): 1024-32. [ Links ]
27. Ibrahim AG-E, Cheng K, Marbán E. Exosomes as critical agents of cardiac regeneration triggered by cell therapy. Stem Cell Rep 2014; 2(5): 606-19. [ Links ]
28. Blazquez R, Sanchez-Margallo FM, de la Rosa O, Dalemans W, Alvarez V, Tarazona R, et al. Immunomodulatory Potential of Human Adipose Mesenchymal Stem Cells Derived Exosomes on in vitro Stimulated T Cells. Front Immunol 2014; 5: 556. [ Links ]
29. Cvjetkovic A, Lötvall J, Lässer C. The influence of rotor type and centrifugation time on the yield and purity of extracellular vesicles. J Extracell Vesicles 2014; 3. [ Links ]
30. Sarker S, Scholz-Romero K, Perez A, Illanes SE, Mitchell MD, Rice GE, et al. Placenta-derived exosomes continuously increase in maternal circulation over the first trimester of pregnancy. J Transl Med 2014; 12: 204. [ Links ]
31. Lane RE, Korbie D, Anderson W, Vaidyanathan R, Trau M. Analysis of exosome purification methods using a model liposome system and tunable-resistive pulse sensing. Sci Rep 2015; 5: 7639. [ Links ]
32. James A Smith, Kelvin S. Ng., Benjamin E. Mead, Sue Dopson, Brock Reeve, James Edwards, et al. Extracellular Vesicles Commercial Potential As Byproducts of Cell Manufacturing for Research and Therapeutic Use [Internet]. BioProcess International. Disponible en: http://www.bioprocessintl.com/manufacturing/cell-therapies/extracellular-vesicles-commercial-potential-as-byproducts-of-cell-manufacturing-for-research-and-therapeutic-use/. Fecha de acceso 15 de junio de 2015. [ Links ]
Recibido: 15 de diciembre de 2014
Aceptado: 16 de julio de 2015














