Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957
Acta bioquím. clín. latinoam. vol.49 no.4 La Plata dic. 2015
HEMATOLOGÍA
Evaluación de los parámetros de desempeño de un contador hematológico
Evaluation of performance parameters of an automated hematology analyzer
Avaliação dos parâmetros de desempenho de um analisador da hematologia
Jesica Parés1, Natalia Borda1, Sergio Damián Santiago1, Cristina Benito1, Claudio Aranda1
1 Bioquímica/o.
* División Laboratorio. Hospital Carlos G. Durand. Avenida Díaz Vélez 5044, CABA. Argentina.
CORRESPONDENCIA BIOQ. JESICA PARES División Laboratorio. Hospital Carlos G. Durand. Avenida Díaz Vélez 5044, CABA. Argentina E-mail: jesipares@hotmail.com
Resumen
El primer paso para obtener seguridad en los resultados emitidos por el laboratorio clínico es confirmar que los procedimientos de medida utilizados tienen un desempeño analítico aceptable. Para conseguirlo se verificó el contador hematológico Beckman Coulter LH 750 de acuerdo con las especificaciones del fabricante y con los requisitos de calidad de este laboratorio. Los parámetros de desempeño evaluados, tanto en modo manual como automático, fueron: porcentaje de arrastre, según protocolo CLSI H26-A2, precisión en condiciones de repetibilidad, precisión en condiciones de precisión intermedia y veracidad, según protocolo CLSI EP15-A2 utilizando controles BIO-RAD, intervalo de medición, según protocolo CLSI EP6-A, límite de cuantificación, según protocolo CLSI EP17-A2 e intervalos de referencia, según protocolo CLSI EP28-A3C. Los datos se analizaron mediante LinChecker y GraphPad 5. En los ensayos realizados se cumplió con las especificaciones estipuladas por el fabricante, como así también con el requisito de calidad de este laboratorio que es variabilidad biológica mínima. También se verificaron los intervalos de referencia para individuos adultos. De esta manera, se logró realizar la verificación del contador hematológico, evidenciando que los parámetros analíticos evaluados tienen un desempeño aceptable.
Palabras clave: Contador hematológico; Verificación; Arrastre; Precisión en condiciones de repetibilidad; Precisión en condiciones de precisión intermedia; Veracidad; Intervalo de medición; Límite de cuantificación; Intervalos de referencia.
Summary
The first step for safety in the results issued by the clinical laboratory is to confirm that all analytical measurement procedures have shown an acceptable analytical performance. A quality performance evaluation of automated hematology analyzer Beckman Coulter LH 750 was performed according to the quality requirements of our laboratory and manufacturer's specifications. The performance parameters evaluated by both manual and automatic mode were: carryover according to CLSI H26-A2 protocol; repeatability, intermediate precision and trueness according to CLSI EP15-A2 protocol and using BIO-RAD controls; linearity according to CLSI EP6-A protocol; quantification limits according to CLSI EP17-A2 protocol; and reference intervals according to CLSI EP28-A3C protocol. Data were analyzed using LinChecker and GraphPad5 programs. The tests performed complied with the requirements stipulated by the manufacturer and the quality requirements of our laboratory like minimal biological variability. Reference intervals for adult individuals were also checked. Consequently, performance evaluation of the automated hematology analyzer showed that the assessed laboratory parameters have acceptable performance.
Key words: Automated hematology analyzer; Verification; Carryover; Repeatability; Intermediate precision; Trueness; Linearity; Quantification limits; Reference intervals.
Resumo
O primeiro passo para obter segurança nos resultados emitidos pelo laboratório clínico é confirmar que os processos de medição utilizados tenham um desempenho analítico aceitável. Para obtê-los foi verificado o analisador hematológico Beckman Coulter LH 750 de acordo com as especificações do fabricante e os requisitos de qualidade deste laboratório. Os parâmetros de desempenho avaliados, tanto em modo manual quanto automático, foram: percentual de arrastamento, de acordo com o protocolo CLSI H26-A2, em condições de repetitibidade, precisão em condições de precisão intermediária e veracidade, conforme o protocolo CLSI EP15-A2 usando controles Bio-Rad, intervalo de medição segundo o protocolo CLSI EP6-A, limite de quantificação, de acordo com CLSI EP- 17-A2 e intervalos de referência, de acordo com o protocolo CLSI EP28-A3C. Os dados foram analisados através de LinChecker e GraphPad 5. Nos ensaios realizados foram obsevadas as especificações estabelecidas pelo fabricante, bem como a exigência de qualidade deste laboratório que é variabilidade biológica mínima. Os intervalos de referência para indivíduos adultos também foram verificados. Desta forma, foi possível realizar a verificação do analisador hematológico, que demonstra que os parâmetros analíticos avaliados têm um desempenho aceitável.
Palavras-chave: Analisador hematológico; Verificação; Arrastamento; Precisão em condições de repetitividade; Precisão em condições de precisão intermediária; Veracidade; Intervalo de medição; Limite de quantificação; Intervalos de referência.
Introducción
El principal objetivo del laboratorio clínico es generar resultados confiables y útiles para preservar la salud del paciente. El primer paso para lograrlo es confirmar que los procedimientos de medida utilizados tienen un desempeño analítico aceptable. Por ello, antes de emitir resultados con un determinado autoanalizador, es aconsejable realizar la verificación del mismo. Además, el proceso de verificación es un requisito necesario para alcanzar la acreditación de un sistema de calidad bajo la norma ISO 15189 (1). Las guías de la CLSI (Clinical & Laboratory Standard Institute) proveen información sobre los parámetros de desempeño a evaluar y el modo de proceder, logrando unificar criterios. En el área de hematología, la verificación del contador hematológico incluye la determinación del porcentaje de arrastre, de la precisión en condiciones de repetibilidad, de la precisión en condiciones de precisión intermedia, de la veracidad, del intervalo de medición, del límite de cuantificación y del intervalo de referencia. En los protocolos de verificación es importante respetar el orden mencionado; aceptar el porcentaje de arrastre para luego continuar evaluando la precisión en condiciones de repetibilidad y así sucesivamente. Durante el transcurso de los ensayos se debe calibrar y controlar de la forma estipulada por el fabricante. El objetivo del presente trabajo fue verificar un contador hematológico de acuerdo con las especificaciones del fabricante y los requisitos de calidad de este laboratorio.
Materiales y Métodos
El contador hematológico Beckman Coulter LH 750 (Estados Unidos, Miami) brinda la posibilidad de procesar muestras en modo automático (MA) y en modo manual (MM). En el primer caso, la homogenización y pasaje de la muestra para su posterior análisis se realiza de manera automatizada, en cambio, en MM, esto depende del operador y es el modo elegido para el procesamiento de muestras con un volumen menor a 1 mililitro.
Se realizó la verificación de ambos modos evaluando en cada uno: porcentaje de arrastre, precisión en condiciones de repetibilidad, precisión en condiciones de precisión intermedia, veracidad, intervalo de medición, límite de cuantificación e intervalos de referencia.
PORCENTAJE DE ARRASTRE
Según la guía H26-A2 (2) se realiza para leucocitos, plaquetas, eritrocitos y hemoglobina. Luego de obtener un pool de muestras de sangre entera anticoagulada con EDTA K2, de alta concentración del analito estudiado (HTV) y otro de baja concentración (LTV), se separó cada uno en tres tubos y se procesó en el orden: HTV1, HTV2, HTV3, LTV1, LTV2, LTV3. Se aplicó la fórmula: 100*LTV1-LTV3/ (HTV3-LTV3) y el resultado obtenido se comparó con el permitido por el fabricante (3).
PRECISIÓN EN CONDICIONES DE REPETIBILIDAD (Sr)
La precisión en condiciones de repetibilidad, también llamada precisión intracorrida o intraserie, es la precisión de medida bajo un conjunto de condiciones de repetibilidad que incluye el mismo procedimiento de medida, el mismo laboratorio, el mismo operador y el mismo autoanalizador, así como repeticiones en un intervalo corto de tiempo. Según la guía EP15-A2 (4) se evaluó para los parámetros que mide el contador hematológico: el recuento de leucocitos, eritrocitos y plaquetas y dosaje de hemoglobina. Se procesaron por triplicado los tres niveles de los controles internos LiquichekTM Hematology Control© BIORAD (Estados Unidos, California) durante cinco días. En caso de obtenerse un resultado aberrante se repitieron los triplicados, descartando la corrida de ese día y adicionando un día al esquema. Para cada nivel de control se aplicó la fórmula A de la Figura 1. Con el valor del coeficiente de variación porcentual obtenido en condiciones de repetibilidad (CVrf), que figura en las especificaciones del fabricante (3), y la media de los 15 datos (Xt), se calcula el desvío estándar en condiciones de repetibilidad (órf) según: órf = CVrf * Xt/100. Para aceptar el ensayo el resultado de Sr debe ser menor al valor de verificación de la precisión en condiciones de repetibilidad (V.V.Sr), calculado según fórmula B de la Figura 1.

Figura 1. Fórmulas utilizadas para los ensayos de precisión en condiciones de repetibilidad y precisión en condiciones de precisión intermedia.
PRECISIÓN EN CONDICIONES DE PRECISIÓN INTERMEDIA (Si)
La precisión en condiciones de precisión intermedia, también llamada precisión intralaboratorio o total, es la precisión de medida bajo un conjunto de condiciones de precisión intermedia que incluye el mismo procedimiento de medida, el mismo laboratorio y el mismo autoanalizador, así como repeticiones en un intervalo prolongado de tiempo. Con los datos obtenidos para determinar la Sr se calculó para cada nivel de control la varianza entre corridas (Sb2) según la fórmula C de la Figura 1, y luego se aplicó la fórmula D de la misma para calcular Si. Con el valor del coeficiente de variación porcentual obtenido en condiciones de precisión intermedia (CVif), que figura en las especificaciones del fabricante (3), y el valor de Xt, se calcula el desvío estándar en condiciones de precisión intermedia (óif) según: óif = CVif * Xt / 100. Para aceptar el ensayo el resultado debe ser menor al valor de verificación de la precisión en condiciones de precisión intermedia (V.V.Si), calculado según la fórmula E de la Figura 1. Los grados de libertad efectivos (T) se calculan como indica la fórmula F de dicha figura, y el punto de porcentaje para una distribución Chi cuadrado con un falso rechazo del 5% (C) se extrae de tabla según el valor de T (Tabla I).
Tabla I. Distribución Chi cuadrado.

VERACIDAD
La veracidad es la proximidad entre la media de un número infinito de valores medidos repetidos y un valor de referencia. Haber utilizado en los ensayos de Sr y Si materiales de control que participan de un esquema interlaboratorial, permite usar los mismos datos para determinar la veracidad, debido a que en un programa de control de calidad interlaboratorio los controles son medidos por varios laboratorios y la media determinada por el grupo de pares se utiliza como valor asignado. Para que este valor sea confiable, el número de laboratorios participantes debe ser mayor a diez, para los parámetros evaluados en este trabajo el número de laboratorios participantes fue siempre mayor a 39. Con los datos obtenidos para determinar la Sr se calculó para cada nivel de control la media de los 15 datos (Xt) y el desvío estándar (Sx) según fórmula A de la Figura 2. La incertidumbre asociada (Sa) se calculó como indica la fórmula B de la misma. El intervalo de verificación (IV) se obtuvo como se observa en la fórmula C de la Figura 2. Para aceptar el ensayo, la mejor estimación del valor verdadero, que se obtiene del valor de la media acumulada del grupo par (Xacum), obtenida del reporte del programa de control de calidad interlaboratorio, Unity, debe encontrarse dentro del IV. También se calculó el sesgo % y el coeficiente de variación obtenido en condiciones de precisión intermedia (Cvi) según la fórmula D y E de la Figura 2 respectivamente. El requisito de calidad seleccionado para este laboratorio fue variabilidad biológica mínima (5), los valores de error total permitido (ETp%) según el mismo son: leucocitos: 23,17%; eritrocitos: 6,61%; plaquetas: 20,15%; hemoglobina: 6,29%. Con estos valores y los datos de sesgo % y Cvi se calculó el sigma de cada método para cada concentración evaluada (fórmula F de la Figura 2).
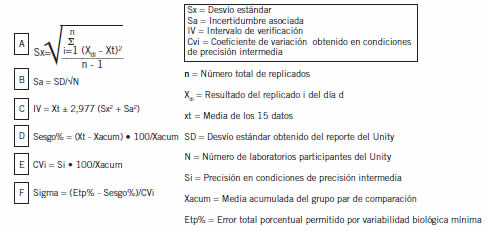
Figura 2. Fórmulas utilizadas para el ensayo de veracidad.
INTERVALO DE MEDICIÓN
Según protocolo EP6-A (6) se evaluó para el recuento de leucocitos y plaquetas. Se procesaron 5 muestras por duplicado de concentraciones equidistantes. La muestra de 0% se obtuvo con diluyente del analizador y la de 100%, en el caso de leucocitos, era una muestra de sangre entera anticoagulada con EDTA K2 con una concentración del analito cercana a la máxima evaluada por el fabricante. En el caso de plaquetas, se trataba de un concentrado plaquetario obtenido por plaquetoféresis. La concentración de 50% se obtuvo a partir de la adición de volúmenes iguales de las muestras de 0 y 100%, la de 25% a partir de las muestras de 0 y 50% y la de 75% a partir de las muestras de 50 y 100%. Los resultados de los replicados se graficaron en función de los valores teóricos. Si se obtiene una recta el ensayo se considera estadísticamente lineal, de lo contrario hay que evaluar la linealidad clínica, para lo cual, en la curva obtenida se determina cuál es el punto que más se aleja de la recta teórica, se calcula esa diferencia y se expresa en porcentaje. Este es el máximo error de no linealidad que debe ser menor al 50% del error total porcentual permitido por variabilidad biológica mínima. Los datos se analizaron mediante LinChecker (Philippe Marquis, Estados Unidos).
LÍMITE DE CUANTIFICACIÓN (LQ)
El recuento de leucocitos y plaquetas a concentraciones cercanas a cero tiene un gran impacto en las decisiones clínicas, por lo cual debe calcularse la menor cantidad de analito cuantificable con una exactitud aceptable, llamado límite de cuantificación. Según protocolo EP17-A2(7)
INTERVALOS DE REFERENCIA (IR)
En la guía EP28-A3C (8) se plantean tres opciones para transferir los IR cuando el sistema analítico es comparable. Se optó por validar los IR del laboratorio analizando un número pequeño de individuos (n=20). Se procesaron muestras de sangre entera anticoagulada con EDTA K2 de 20 mujeres y 20 hombres saludables para verificar los IR ya existentes de hemoglobina, glóbulos rojos y hematocrito, para los demás parámetros del hemograma se procesaron muestras de 10 mujeres y 10 hombres saludables. Se evaluó la presencia de posibles outliers mediante el test de Dixon. Luego se analizaron los datos contabilizando el número de valores que cayeron fuera del intervalo propuesto.
Resultados
El porcentaje de arrastre obtenido para MM y MA respectivamente fue: leucocitos 0,32% y 0,15%, plaquetas 0,25% y 0,49%, eritrocitos 0,48% y 0,29% y hemoglobina 0,33% y 0,17%. Estos resultados fueron menores al límite informado por el fabricante (2,00% para leucocitos, plaquetas y hemoglobina y 1,00% para eritrocitos). Los ensayos de precisión en condiciones de repetibilidad y de precisión en condiciones de precisión intermedia fueron aceptados para todos los niveles de control, de todos los parámetros, en ambos modos. Los ensayos de veracidad, en modo automático, fueron aceptados a excepción del nivel 2 de control para leucocitos y eritrocitos y el nivel 1 de control parahemoglobina (Tabla II). En modo manual fueron aceptados, a excepción del nivel 1 y 3 de control para eritrocitos, el nivel 1 y 2 de control para hemoglobina y los tres niveles de control para plaquetas. A pesar de los ensayos rechazados, la evaluación del desempeño de los métodos, en ambos modos, demostró sesgos % menores al 50% del Etp% y arrojó sigmas mayores a 5 para todos los parámetros (Tabla III), reflejando el excelente desempeño de los métodos (9) y permitiendo aceptar los ensayos.
Tabla II. Resultados de los ensayos de precisión en condiciones de repetibilidad, de precisión en condiciones de precisión intermedia y veracidad, en modo automático, para el recuento de leucocitos, eritrocitos y plaquetas y dosaje de hemoglobina utilizando tres niveles de los controles LiquicheckTM Hematology Control® BIO-RAD.

Tabla III. Evaluación del desempeño del recuento de leucocitos, eritrocitos y plaquetas y dosajes de hemoglobina en modo automático.

Para leucocitos y plaquetas en ambos modos, se verificó linealidad clínica hasta el límite informado por el fabricante (400 103 leucocitos/μL y 3.000 103 plaquetas/ μL) (Figuras 3 y 4).

Figura 3. Intervalo de medición del recuento de leucocitos en modo automático.
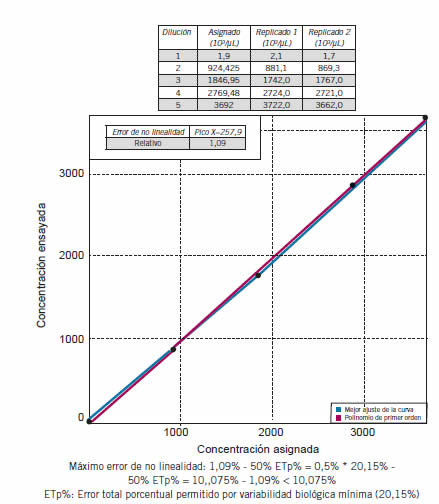
Figura 4. Intervalo de medición del recuento de plaquetas en modo automático.
El LQ obtenido para MM y MA respectivamente fue: 0,2 y 0,1 103 leucocitos/μL y 21 y 5,5 103 plaquetas/μL. (Figura 5).

Figura 5. Perfiles de precisión del recuento de leucocitos (izquierda) y plaquetas (derecha) en modo automático.
Al analizar los datos provenientes de los individuos saludables para validar los IR, no se detectaron outliers y un máximo de dos valores se encontraron fuera del intervalo propuesto, por lo tanto, los IR se consideran validados para el laboratorio (Tabla IV).
Tabla IV. Intervalos de referencia del hemograma validados.

Discusión y Conclusiones
Para corroborar que los procedimientos de medida tienen el desempeño analítico declarado por el fabricante y que cumplen con los requisitos de calidad del laboratorio es necesario verificar los autoanalizadores. En hematología, el protocolo de verificación del contador hematológico comprende: la determinación del porcentaje de arrastre, precisión en condiciones de repetibilidad, precisión en condiciones de precisión intermedia, veracidad, intervalo de medición, límite de cuantificación e intervalo de referencia. Si el valor del porcentaje de arrastre obtenido en el laboratorio es mayor al informado por el fabricante se debe contactar a la empresa y no se puede continuar evaluando los demás parámetros de desempeño. La guía EP15-A2 desarrolla un protocolo para verificar que un método se desempeña de acuerdo a las especificaciones del fabricante a un costo razonable. Brinda las herramientas para evaluar precisión en condiciones de repetibilidad, precisión en condiciones de precisión intermedia y veracidad. Para llevar a cabo estos tres ensayos se selecciona un material con tres niveles de concentración distinta, las cuales deben representar niveles de decisión médica. Para los ensayos de precisión en condiciones de repetibilidad y precisión en condiciones de precisión intermedia pueden utilizarse materiales de control que participen en un esquema interlaboratorio o muestras de pacientes. Para evaluar veracidad pueden emplearse: materiales certificados de referencia, muestras que hayan participado en un esquema de evaluación externa de la calidad, materiales de control que participen en un esquema interlaboratorio o controles comerciales de tercera opinión con valor asignado. La elección dependerá de la disponibilidad, costos y de la incertidumbre asociada a la asignación del valor verdadero de cada material. En este laboratorio se procesan muestras de pacientes con trastornos hematológicos que pueden tener un elevado recuento de leucocitos y plaquetas, por lo cual, resulta imperioso verificar el intervalo de medición informado por el fabricante, ya que esto permite saber hasta qué valor del analito se puede medir sin realizar dilución. La mayor problemática consiste en conseguir la muestra de concentración alta (100%). Si se evalúa el 80% del rango de medición realizado por el fabricante puede considerarse que se cubrió todo el rango. De lo contrario, puede evaluarse un rango más chico, en cuyo caso, la mayor concentración procesada será el límite superior del rango de medición, a partir del cual habrá que diluir, aunque no coincida con el informado por el fabricante.
En pacientes sometidos a tratamiento quimioterápico o a transplante de médula ósea, se hace indispensable una correcta cuantificación de leucocitos en concentraciones bajas. Asimismo, la cuantificación de plaquetas es de vital importancia en la predicción del riesgo de hemorragias como en la decisión de transfusiones. Debido a esto, el recuento correcto de los mismos a muy bajas concentraciones tiene gran importancia clínica, por lo cual debe calcularse el límite de cuantificación para el recuento de leucocitos y plaquetas. Luego de realizar estos ensayos, se puede concluir que se completó la verificación del contador hematológico de acuerdo a las especificaciones del fabricante y a los requisitos de calidad de nuestro laboratorio, permitiendo aceptar el autoanalizador para realizar los hemogramas del servicio.
AGRADECIMIENTOS
Los autores agradecen a G Migliarino consultores por la capacitación brindada.
Referencias bibliográficas
1. ISO 15189:2012. Medical Laboratories. Requirements for Quality and Competence. [ Links ]
2. CLSI document H26-A2. Validation, Verification and Quality Assurance of Automated Hematology Analyzers; Approved Standard-Second Edition (ISBN 1-56238- 728-6). [ Links ]
3. Fernandez T, Domack LB, Montes D, Pineiro R, Landrum E, Vital E. Performance evaluation of the Coulter LH 750 hematology analyzer. Lab Hematol 2001; 7: 217-28. [ Links ]
4. CLSI publication EP15-A2. User Verification of Performance for Precision and Trueness; Approved Guideline- Second Edition (ISBN 1-56238-574-7). [ Links ]
5. Westgard JO. Prácticas Básicas de Control de la Calidad. Edición Wallace Coulter. Madison WI: Westgard QC; 2013. [ Links ]
6. NCCLS document EP6-A. Evaluation of the Linearity of Quantitative Measurement Procedures: A Statistical Approach; Approved Guideline (ISBN 1-56238-498-8). [ Links ]
7. NCCLS document EP17-A2. Evaluation of Detection Capability for Clinical Laboratory Measurements Procedures; Approved Guideline - Second Edition (ISBN 1-56238-795-2). [ Links ]
8. CLSi EP 28-A3C (Formerly C 28-A3). Defining, Establishing, and Verifying Reference Intervals in the Clinical Laboratory; Approved Guideline - Third Edition (ISBN 1-56238-682-4). [ Links ]
9. Westgard JO. Six Sigma Quality Design and Control. Second Edition. Madison WI: Westgard QC; 2006. [ Links ]
10. CLSI document H20-A2. Reference Leukocyte (WBC) Differential Count (Proportional) and Evaluation of Instrumental Methods; Approved Standard-Second Edition (ISBN 1-56238-628-X). [ Links ]
11. Guzel O, Guner E. ISO 15189 Accreditation: Requirements for quality and competence of medical laboratories, experience of a laboratory I. Clin Biochem 2009; 42: 274-8. [ Links ]
12. Gulderen Y. ISO 15189 Accreditation: Requirements for quality and competence of medical laboratories, experience of a laboratory II. Clin Biochem 2009; 42: 279-83. [ Links ]
Recibido: 2 de julio de 2015
Aceptado: 12 de noviembre de 2015














