Servicios Personalizados
Revista
Articulo
Indicadores
-
 Citado por SciELO
Citado por SciELO
Links relacionados
-
 Similares en
SciELO
Similares en
SciELO  uBio
uBio
Compartir
Acta bioquímica clínica latinoamericana
versión impresa ISSN 0325-2957versión On-line ISSN 1851-6114
Acta bioquím. clín. latinoam. vol.50 no.1 La Plata mar. 2016
INMUNOLOGÍA
Avances en las inmunoterapias para alergias alimentarias
New insights in immunotherapies for food allergies
Novas perspectivas em imunoterapias para alergias alimentares
Paola Lorena Smaldini1*, María Lucía Orsini Delgado2*, Carlos Alberto Fossati1*, Guillermo Horacio Docena1*
1 Doctor de la Facultad de Ciencias Exactas.
2 Licenciada en Bioquímica.
* Instituto de Estudios Inmunológicos y Fisiopatológicos-IIFP, Departamento de Ciencias Biológicas, Facultad de Ciencias Exactas, Universidad Nacional de La Plata. Argentina.
CORRESPONDENCIA DRA. PAOLA SMALDINI Instituto de Estudios Inmunológicos y Fisiopatológicos-IIFP, Departamento de Ciencias Biológicas, Facultad de Ciencias Exactas, Universidad Nacional de La Plata. 1900 LA PLATA, Argentina. Tel: +54 221 425 0497 E-mail: psmaldini@biol.unlp.edu.ar
Resumen
Las enfermedades alérgicas son las inmunopatologías que con mayor prevalencia se presentan en el mundo. Pueden o no estar mediadas por anticuerpos IgE, sin embargo estas últimas son las que más intensamente se han estudiado por el riesgo que presentan para la vida del paciente. Si bien el único tratamiento que logra revertir estos mecanismos es la no exposición al alergeno, esto no siempre es posible. Por esta razón, y a partir del mayor conocimiento alcanzado del sistema inmune de mucosas junto al desarrollo de modelos animales de alergia, existe un marcado interés en la especialidad para el desarrollo de inmunoterapias que controlen y reviertan el estado de alergia. A partir de los ensayos pre-clínicos en animales y la aplicación de protocolos terapéuticos en ensayos clínicos, se han desarrollado terapias mucosales que logran inducir mecanismos de tolerancia específicos del alergeno, los cuales son capaces de revertir la sensibilización alérgica. Dado que el principal escollo siguen siendo las reacciones adversas inducidas durante el tratamiento, se requiere profundizar los estudios para desarrollar protocolos terapéuticos más seguros. En este punto la medicina traslacional encuentra un campo próspero para fortalecer las interacciones entre la ciencia básica, la aplicada y la clínica.
Palabras clave: Alergias; Inmunoglobulina E; Inmunoterapia; Tolerancia; Linfocitos T regulatorios; Modelo murino.
Summary
Allergic diseases are the most prevalent immunopathologies worldwide. Although different mechanisms –IgE-independent or IgE-dependent– can be involved in the immunopathogenesis, the latter are the most studied reactions since they can be life-threatening. Nowadays, allergen avoidance is the unique effective treatment for allergic patients. However, this is rather difficult to implement. For this reason, and based on the new insights into the mucosal immune system and the development of animal models of allergy, there is an increasing interest in developing novel therapies to control or reverse allergic disorders. Pre-clinical studies and clinical trials have been successful to prove that immunotherapies may accomplish mucosal mechanisms of allergen-specific tolerance, which are able to revoke the allergic sensitization. Since the main obstacle in these therapies still has adverse reactions induced during treatment, further studies are required to explore safe and effective therapeutic protocols. At this point, translational medicine is a flourishing field in the areas of basic science, applied science, and clinical research.
Key words: Allergies; Immunoglobulin-E; Immunotherapy; Tolerance; Regulatory T cells; Mouse model.
Resumo
As doenças alérgicas são as imunopatologias mais prevalentes em todo o mundo. Embora possam estar mediadas ou não por anticorpos IgE, estas últimas são as reacções mais intensamente estudadas, devido ao risco que apresentam para a vida do paciente. Ainda que o único tratamento eficaz para reverter este mecanismos seja a não exposição dos pacientes ao alergeno, isto nem sempre é possível. Por este motivo, e com base nas novas perspectivas sobre o sistema imune de mucosas, junto com o desenvolvimento de modelos e para o animais de alergia, existe um interesse crescente na especialidade para o desenvolvimento de imunoterapias que controlem e revertam o estado de alergia. A partir de estudos pré-clínicos em animais e a aplicação de protocolos terapêuticos em ensaios clínico, foram desenvolvidas terapias mucosas que conseguem induzir mecanismos de tolerância específicos do alergeno, que são capazes de reverter a sensibilização alérgica. Devido a que o principal obstáculo nestas terapias continuam sendo as reações adversas induzidas durante o tratamento, é necessário realizar mais estudos para desenvolver protocolos terapêuticos mais seguros. Neste ponto, medicina translacional é um campo próspero para fortalecer as interações entre a ciência básica, a aplicada e a clínica.
Palavras-chave: Alergias; Imunoglobulina-E; Imunoterapia; Tolerância; Linfócitos T reguladores; Modelo murino.
Introducción
Se define el término alergia como “respuesta alterada o excesiva”. Desde la época de los egipcios se reconoce a este tipo de enfermedades, y actualmente se sabe que las enfermedades alérgicas agrupan a un conjunto de entidades clínicas que son las consecuencia de fallas en la activación o regulación de la respuesta inmune frente a exposiciones repetitivas con antígenos inocuos y ampliamente distribuidos en la naturaleza. Gell y Coombs sistematizaron y clasificaron estas reacciones en 5 tipos de reacciones de hipersensibilidad (1), en base al tiempo de demora en la aparición de los síntomas y la dosis de antígeno necesaria para su inducción. Actualmente, y sobre la base del conocimiento de los mecanismos moleculares y celulares involucrados, los mecanismos de hipersensibilidad se clasifican en 4 tipos, incluidos en los descriptos por Gell y Coombs. Una reacción alérgica puede ser originada por cualquiera de los 4 mecanismos de hipersensibilidad, e inclusive es común observar que varios de ellos se presentan en forma simultánea o secuencial en el tiempo. Esto determina que en numerosas ocasiones se identifiquen más de un elemento inmunopatogénico, células y/o moléculas, lo cual explica la heterogeneidad y variabilidad en la presentación de las alergias. Este hecho suele dificultar el diagnóstico en numerosas ocasiones. En particular interesa describir las reacciones de hipersensibilidad tipo I o inmediatas o mediadas por anticuerpos IgE, dado que pueden ser las más frecuentes y potencialmente graves, con posibilidades de ocasionar la muerte del paciente. Esta es la razón por la cual por un lado el diagnóstico se centra en la detección de anticuerpos IgE, y por otro permite clasificar a las alergias según estén mediadas por IgE o no mediadas por IgE.
La secreción exacerbada de IgE es producto de una activación de linfocitos B (LB) a células plasmáticas productoras de anticuerpos con la colaboración de los linfocitos T (LT) CD4+ o colaboradores de fenotipo Th2 (LT Th2). La IgE producida y secretada por las células plasmáticas pasa a circulación sistémica y se une a los receptores de alta afinidad presentes en mastocitos (en tejidos), basófilos (en circulación) y eosinófilos (en tejidos y circulación), generando células sensibilizadas que serán las responsables de la inducción de una respuesta inflamatoria frente a sucesivas exposiciones al alergeno (Fig. 1).

Figura 1. Esquema correspondiente a las fases en una reacción alérgica, (a) fase de sensibilización y (b) fase efectora. (Figura adaptada de copyright © The Mc-Graw Hill Companies, Inc.)
Por lo tanto, una respuesta alérgica consta de una fase inicial o inductora denominada fase de sensibilización, que ocurre con los primeros contactos con el alergeno y en la que se induce la síntesis de IgE, y una fase tardía o efectora, producto del contacto de las células previamente sensibilizadas con el alergeno, cuya activación genera la inflamación en el tejido. Esto determina que para que se induzca una reacción alérgica es necesario que existan múltiples exposiciones al alergeno.
Por lo tanto, para que se genere el foco inflamatorio es necesario que los anticuerpos IgE se encuentren anclados a sus receptores específicos de alta afinidad en la membrana plasmática de las células. La posterior activación celular requiere que el alergeno sea capaz de entrecruzar al menos dos moléculas de IgE, de manera de facilitar el acercamiento de los receptores de IgE y la interacción entre sus dominios transmembrana y citosólicos. Este paso inicial dispara una compleja red de mecanismos de señalización intracelular que culminan con la activación del citoesqueleto y las fibras de actina. El movimiento intracelular de los gránulos citoplasmáticos que contienen componentes con actividad pro-inflamatoria (histamina, proteasas, proteoglicanos, citoquinas, etc.) culmina con la fusión a la membrana plasmática y la posterior liberación de su contenido al espacio extracelular. Como consecuencia de este proceso se genera un foco inflamatorio agudo, principalmente por la presencia de la histamina que se une a sus receptores en células endoteliales, de la musculatura lisa, etc. Al mismo tiempo, se induce en la célula activada la síntesis de citoquinas, quimoquinas, prostaglandinas, leucotrienos, factores de crecimiento, etc. sustancias que van a sostener el foco inflamatorio a tiempos más prolongados (Fig. 2).

Figura 2. Esquema del proceso inflamatorio desarrollado por la degranulación y liberación de mediadores químicos al torrente sanguíneo; con la consecuente aparición de signos clínicos en diversos órganos. (Figura adaptada de copyright © The Mc-Graw Hill Companies, Inc.)
Es importante destacar que un individuo no nace alérgico, sino que tiene una predisposición genética y la interacción con el medio ambiente determina que en algún momento de su vida pueda manifestarse la reacción alérgica. Esta forma de expresión de la patología determina que se trate de una enfermedad multifactorial. Lo llamativo es que su incidencia se ha incrementado notablemente en las últimas décadas, a razón de duplicarse por cada década transcurrida. Este fenómeno no puede atribuirse a cambios en la constitución genética de los individuos, sino que las causas deben buscarse en los factores ambientales disparadores. Así, la hipótesis de la higiene, finalmente establecida en 1989 (2), y luego reformulada en el 2000 (3), hace referencia a que principalmente en países industrializados o de hábitos de vida occidental, la menor exposición a microorganismos intracelulares patógenos, como consecuencia de mejores planes de vacunación, nuevas generaciones de antibióticos, hábitos de vida con menor contacto con la naturaleza, etc., junto a una mayor exposición a alergenos (hábitos de vida más intra-domiciliarios, mayor número de horas de trabajo en lugares cerrados con calefacción o refrigeración cerrada, alfombras en los hogares, etc.) ha determinado que el sistema inmune no sea regulado adecuadamente, y que la base genética de susceptibilidad se manifieste en un mayor porcentaje de la población.
Actualmente existen reportes de incidencia de las alergias que alcanzan cifras de hasta un 35-40% de la población, lo cual significa cientos de millones de individuos afectados (4–8). Esto determina que se trate de las inmunopatologías más prevalentes en el mundo y que sean un problema sanitario importante que afecta los hábitos de vida, el desarrollo psico-social del paciente y las políticas de salud en numerosos países.
ALERGIA ALIMENTARIA
La alergia alimentaria es un síndrome que comprende diversas entidades clínicas que afectan a diferentes sistemas y órganos, y son el resultado de la pérdida de tolerancia hacia las proteínas de la dieta. Por lo tanto las alergias alimentarias no constituyen una única patología, sino que involucran diferentes entidades clínicas: enterocolitis, esofagitis eosinofílica, proctocolitis, gastroenteropatía eosinofílica, anafilaxia, el síndrome de alergia oral, dermatitis atópica, eccema, etc. En todos los casos se trata de reacciones adversas no tóxicas en la que el sistema inmune se activa frente a los antígenos dietarios. Compromete principalmente al tracto gastrointestinal, aunque también puede afectar la piel, árbol respiratorio o inclusive tratarse de un fenómeno sistémico conocido como anafilaxia. Se presenta mayoritariamente en edad pediátrica (5-6%) y en menor medida en adultos (1-4%) (4)(9). Las alergias alimentarias constituyen la primera manifestación de una alergia en un individuo susceptible. En estos casos se induce frente a las primeras exposiciones a los alimentos, razón por la cual la alergia a leche de vaca es la principal alergia alimentaria en numerosas regiones del mundo, incluida la Argentina.
Al igual que las reacciones alérgicas en general, éstas son muy complejas, heterogéneas y pueden ser causadas por mecanismos IgE-dependientes o IgE-independientes (10)(11). Si bien cualquier alimento puede potencialmente ser alergénico, se han identificado 8 como los responsables de producir el 90% de las reacciones alérgicas. Estos alimentos constituyen el denominado grupo de los “Grandes 8” y son: la leche y sus derivados, el huevo y sus derivados, el maní y sus derivados, el trigo y sus derivados, los frutos secos, la soja, los pescados y los mariscos. En Argentina los principales alergenos alimentarios son la leche y el huevo.
Es importante al momento del diagnóstico diferenciar una alergia alimentaria, mediada por un mecanismo inmunológico, de una intolerancia alimentaria, no mediada por el sistema inmune, de una reacción adversa tóxica, en la que algún componente del alimento tiene por sí mismo un efecto tóxico. Asimismo, el pronóstico y tratamiento de cada una de estas reacciones puede ser diferente.
INMUNIDAD DE MUCOSAS Y ALERGIA ALIMENTARIA
Se denomina sistema inmune de mucosas (SIM) al conjunto de elementos del sistema inmune (células, moléculas, tejidos y órganos) asociados a una determinada mucosa. Se han caracterizado el SIM de la cavidad oral (salival, conjuntival, laríngeo, etc.), gastrointestinal (esófago, estómago e intestino), de la piel, respiratorio (nasal, traqueal, bronquial), genitourinario, etc.
En las últimas décadas se han realizado notables avances en la comprensión de los mecanismos inmunológicos subyacentes en las mucosas, y han permitido comprender por qué aproximadamente el 80% de los LB y de los LT se encuentran concentrados en estos tejidos. El hecho que la mayoría de los microorganismos ingresen al organismo por las mucosas, junto a la permanente y dinámica exposición que las mismas tienen a diferentes tipos de antígenos (dietarios y ambientales), ha determinado que evolutivamente estos tejidos presenten una muy intensa actividad inmunológica. Por lo tanto, las mucosas además de cumplir con funciones básicas de intercambio de nutrientes y metabolitos, constituyen un sitio central para el sistema inmune, en el cual se regula su activación o silenciamiento dependiendo de las características del antígeno. De esta manera, el intestino es la principal mucosa en la cual se inducen los mecanismos que permiten preservar ciertos antígenos que ingresan por la vía oral (antígenos dietarios y componentes de la microbiota) (12), a través de la denominada tolerancia oral (13). Sin embargo, al mismo tiempo, y frente a la presencia de microorganismos patógenos, el SIM es capaz de inducir una fuerte y específica activación inmunológica que permita su control y eliminación, para evitar la formación de un foco infeccioso que dé origen a un proceso inflamatorio. Es decir, que en la mucosa intestinal se “decide” contra qué antígenos se monta una respuesta inmune activa, y con cuáles se inducen los mecanismos de tolerancia. Este escenario determina que el SIM intestinal sea el más complejo de todos, y que aún no sea del todo comprendido.
Es sabido actualmente que la tolerancia oral es un estado de “no respuesta” o no activación inmunológica que se induce en el intestino y afecta el compartimiento sistémico. Este fenómeno es mediado por distintos mecanismos, entre los cuales se incluye la participación de LT con propiedades regulatorias, o LT regulatorios (Treg), como los principales elementos celulares. Estas células se generan en las mucosas (ganglios linfáticos drenantes) y controlan la inmunidad innata y la adaptativa a través de mecanismos mediados por contactos célula-célula, a través de CTLA-4, LAG-3, etc., o por factores solubles, mediante la secreción de IL-10, TGF-β e IL-35. Dado que se han caracterizado fenotípica y funcionalmente distintos Treg no se ha establecido si constituyen múltiples sub-poblaciones que actúan en diferentes tejidos y entornos, o se trata de una única población de Treg caracterizada por su plasticidad funcional. La mayoría de los Treg se caracterizan como linfocitos T CD4+ CD25+ FoxP3+ (14)(15). Recientemente se han caracterizado otras células regulatorias (células dendríticas tolerogénicas, linfocitos B, células NK) aunque se cree que los Treg son las dominantes en el control de la inmunidad innata y adaptativa.
En los últimos años se ha determinado que en los individuos alérgicos existen fallas en los mecanismos de tolerancia frente a ciertos antígenos dietarios y ambientales. Se postula que ésta sería la causa de la inducción exacerbada de una respuesta inmune mediada por LT Th2. Las citoquinas Th2 (IL-4, IL-5, IL-9, IL-13, IL-33, etc.) secretadas son las responsables de la activación y diferenciación de los LB a células plasmáticas productoras de IgE, maduración de mastocitos, basófilos y eosinófilos, secreción de moco y demás mecanismos que median las reacciones inflamatorias alérgicas.
Distintos trabajos reflejan deficiencias a diferentes niveles en los mecanismos de tolerancia en pacientes con alergia alimentaria y asma. De esta manera, niveles reducidos de Treg, IL-10 o TGF-β, o defectos en la expresión de receptores de quimoquinas (imposibilitan el tráfico al sitio de acción) podrían ser los responsables de la exacerbada producción de mecanismos Th2-dependientes en pacientes con alergia alimentaria y asma (16–20).
Se han descripto deficiencias cuantitativas a nivel de células Treg en sangre periférica de pacientes asmáticos, con una tendencia a revertir estos defectos al ser tratados con glucocorticoides por vía intranasal (21). Asimismo, se observó que células Treg provenientes de pacientes alérgicos al polen de abedul presentan una capacidad disminuida de inhibir la proliferación celular y la secreción de citoquinas Th2 (IL-5 e IL-13) (22) (23). Este defecto en la regulación del sistema inmune también se observó en pacientes pediátricos con alergia alimentaria mediada por IgE, en los que se detectó menor expresión génica de Foxp3 e IL-10 en células mononucleares de sangre periférica, en comparación con individuos no alérgicos y pacientes alérgicos que lograron revertir la alergia (16).
Este nuevo paradigma en la comprensión de las alergias ha determinado que en los últimos años se hayan producidos avances en el desarrollo de nuevas inmunoterapias correctivas que buscan restablecer la tolerancia a través de un incremento cuantitativo y/o funcional de las células Treg.
Tratamiento de las enfermedades alérgicas
Hasta el momento el único tratamiento efectivo para tratar las alergias alimentarias consiste en la restricción dietaria y la consiguiente eliminación del estimulo inmunológico. Si bien parece un procedimiento simple de implementar, en muchas situaciones es complicado asegurar su efectividad. Aproximadamente el 50% de los pacientes con alergia alimentaria sufre reacciones accidentales cada 3-5 años por el contacto con productos alimenticios y no alimenticios que contienen al componente alergénico. Esto puede ser originado por distintas causas: contaminación del alimento con alergenos (utensilios en restaurantes, durante la manufactura o procesamiento, etc.), desconocimiento de la presencia de un alergeno en la composición del alimento (caseinatos indicando proteínas de la leche, ovomucoide para proteínas de huevo, emulsificantes para proteínas de soja, etc.), errores u omisiones en el etiquetado, etiquetado poco claro (emulsificante, espesante, saborizante, etc.), o por reactividades cruzadas con otros alergenos que determinan que el sistema inmune reconozca a dos sustancias distintas como si fueran iguales o similares. Muchas de estas reacciones accidentales suelen ser graves y de no tratarse adecuadamente (auto-aplicación de adrenalina) ponen en riesgo la vida de los pacientes. Así es como en Estados Unidos se calcula que el número de muertes por anafilaxia inducida por la ingesta de maní es de aproximadamente 200 por año (24). Estos inconvenientes se deben básicamente a que la dieta restrictiva no es un tratamiento correctivo.
Por otro lado, existen los tratamientos farmacológicos sintomáticos (anti-histamínicos, corticoides, anti-leucotrienos, etc.) que tampoco corrigen el defecto inmunológico, ni aseguran una remisión a largo plazo; sólo revierten el proceso inflamatorio, actuando a distintos niveles. En conjunto, todos estos factores han determinado que en la última década se hayan profundizado los estudios para optimizar terapias que se han aplicado desde hace más de 100 años, ya que han demostrado, con disímil eficiencia, que resultan correctivas del defecto inmunológico. El primer trabajo que describe estas inmunoterapias (IT) data de 1911, en el que Noon administró en forma subcutánea extractos de pólenes en cantidades crecientes con la consiguiente desaparición de las manifestaciones clínicas (25). A pesar del desconocimiento absoluto de las bases moleculares y celulares que operaban en los mismos se lograron gradualmente importantes avances en el control de alergias por picaduras de insectos y pólenes. Posteriormente y sobre la base de una mejor comprensión de los mecanismos subyacentes (descubrimiento de los anticuerpos IgE e IgG4 bloqueantes) se continuaron aplicando este tipo de procedimientos, aunque con disímil eficiencia. Finalmente, la caracterización de los mecanismos inmunológicos que operan en las mucosas y su regulación fue determinante para el desarrollo de protocolos más eficaces en cuanto al control de diferentes reacciones alérgicas, y la minimización de las reacciones adversas (Fig. 3). Esto ha determinado que actualmente se estén desarrollando ensayos clínicos en pacientes con alergia al maní, siendo éste uno de los alergenos mas anafilácticos que existe (26)(27).

Figura 3. Línea del tiempo de los mecanismos de inmunoterapia propuestos.
(Adaptado de Mechanisms of immunotherapy: a historical perspective. Shakir y col. 2010. Annals of allergy, asthma & immunology).
INMUNOTERAPIAS EN ALERGIA ALIMENTARIA
Estos procedimientos terapéuticos denominados IT desensibilizantes consisten en la administración controlada y escalonada de cantidades crecientes del alergeno nocivo hasta dosis que permiten tolerar la exposición natural al alergeno. Actualmente es sabido que estos procedimientos que operan sobre los SIM inducen algunos de los mecanismos que median la tolerancia inmunológica. De esta manera la IT basada en la administración oral del alergeno, denominada IT oral, permite instaurar mecanismos de tolerancia a nivel intestinal; la IT nasal permite instaurar mecanismos de tolerancia a nivel bronquial, capaces de controlar el SIM intestinal. Sin embargo, no se conocen completamente los mecanismos que gobiernan estos tratamientos, y esto ha generado en los últimos años un marcado interés en su estudio en todo el mundo, principalmente en asma y alergia alimentaria.
A pesar de los avances logrados en los últimos tiempos en el desarrollo de las IT, los principales obstáculos de las mismas, y principalmente en pacientes con alergia alimentaria, continúan siendo las reacciones adversas que se producen al exponer el paciente sensibilizado al alergeno nocivo. En todos los ensayos clínicos realizados se observa la aparición de al menos un 10% de pacientes que deben abandonar el tratamiento por la aparición de reacciones adversas. Este escollo ha determinado que para las alergias alimentarias no existe hasta el momento un protocolo estandarizado y aprobado para aplicar en pacientes con alergia IgE-mediada. El desarrollo más reciente ha sido la IT sublingual, que permitió reducir las reacciones tóxicas por la menor dosis de alergeno que se emplea en la administración sublingual, en comparación con el tratamiento oral. Aquí, el transporte del alergeno por el estómago y el intestino significan su degradación parcial hasta alcanzar la mucosa del intestino delgado, duodeno principalmente, donde es absorbido (28)(29). En cambio, en la IT sublingual el alergeno es absorbido en la mucosa bucal en su forma nativa, y como tal es captado por las células dendríticas subyacentes para luego activar los LT específicos. Sin embargo, a pesar de disminuir los signos clínicos post-administración del alergeno, distintos trabajos han demostrado que los protocolos actuales muestran una eficiencia menor en la inducción de Treg con respecto a la IT oral (30)(31). Protocolos de este tipo se han aplicado en pacientes alérgicos al huevo, leche o maní (32), y se han evidenciado importantes resultados, tal como un incremento en el umbral de tolerancia frente a la exposición al alergeno o al alimento alergénico, descenso en los niveles de IgE específica e incremento en los niveles de IgG1 e IgG4 específicos bloqueantes, negativización de las pruebas cutáneas, inducción de Treg periféricos junto a un descenso en los niveles de IL-4 y aumento de IL-10 y TGF-β, y mantenimiento de un estado de no respuesta al alergeno durante tiempos variables una vez finalizada la IT (33–36). Es decir, que actualmente se están estudiando distintos procedimientos terapéuticos correctivos para las alergias alimentarias, los que han logrado inducir dos tipos de mecanismos para controlar las reacciones alérgicas mediadas por IgE: desensibilización y tolerancia.
Con respecto a la IT para la alergia alimentaria a proteínas de la leche bovina, principal alergia alimentaria en el mundo, se han observado importantes avances en los resultados alcanzados desde sus inicios hasta la actualidad (37–39). El primer ensayo de IT oral en pacientes, realizado al azar y con placebo, se realizó en el año 2008 sobre 20 pacientes con alergia a leche de vaca (ALV) IgE-mediada (40). El principal logro fue incrementar el umbral de tolerancia a la leche de vaca (50-100 veces superior para el grupo tratado con respecto al control). Sin embargo, alrededor de un 20% de los pacientes debieron suspender el tratamiento por las reacciones adversas inducidas. Desde estos primeros trabajos hasta los actuales se puede observar en la bibliografía que en todos los ensayos clínicos en pacientes con ALV se observan reacciones adversas, muchas de las cuales suelen ser sistémicas (41)(42). Todos estos factores determinan que resta aún mucho camino por recorrer para hallar una terapia oral segura y eficaz (43).
Con respecto a la IT sublingual, si bien existen sólidas evidencias experimentales sobre su eficacia en alergia a diversos pólenes (44), en alergia alimentaria existen muy pocos estudios clínicos y se han realizado en alergia a avellana, kiwi, pera, maní (33)(45)(46) y leche de vaca (47)(48). Se ha realizado un único estudio que compara la IT oral con la sublingual para pacientes con ALV (49), en el cual se demuestra que la principal ventaja de la IT sublingual con respecto a la oral es la menor cantidad de alergeno que se requiere (100-400 veces) para inducir los mecanismos de tolerancia. Esto, además, determina que se observen menor cantidad de reacciones adversas (1 de 10 pacientes para IT sublingual, respecto de 14 de 20 para IT oral). En otro trabajo reciente en fase I, se trataron 11 pacientes con ALV IgE-mediada con el anticuerpo anti-IgE humano recombinante Omalizumab, junto a la IT oral. El objetivo de este protocolo fue inducir una rápida desensibilización, administrando mayores cantidades del alergeno con mayor frecuencia, y evitando las reacciones adversas mediante la aplicación del anticuerpo a-IgE que logra disminuir en forma inmediata los niveles séricos de IgE (50). Mediante esta combinación los pacientes lograron tolerar dosis de proteínas de leche de vaca de hasta 2000 mg de leche en 7-11 semanas, con un 1% de reacciones tóxicas suaves que no determinaron el abandono del tratamiento. Además, la mayoría de los pacientes (10/11) continuaron con una dieta normal luego del tratamiento. Por lo tanto, se considera que se han logrado importantes avances en el desarrollo de terapias inmunomodulatorias, pero mayores esfuerzos deben realizarse para incrementar la seguridad de las mismas.
Aportes desde los modelos animales. Medicina traslacional
El desarrollo de modelos animales de enfermedades alérgicas provee una herramienta esencial para el estudio de su patogénesis y para el desarrollo de nuevas estrategias terapéuticas. A pesar que la especie animal más ampliamente empleada es ratón, se dispone de modelos en otras especies como rata, cerdo, perros, etc.
Los modelos animales de alergia alimentaria han sido principalmente aplicados al estudio de la fase efectora de las alergias, dado que, al no existir la alergia en la especie ratón, ésta debe inducirse en forma artificial mediante el empleo de adyuvantes pro-Th2 (hidróxido de aluminio, toxina colérica, enterotoxina B de Staphylococcus, etc.). Desde los primeros modelos estudiados se han producido importantes avances en el desarrollo de los mismos, a tal punto que actualmente reflejan muy ajustadamente lo que ocurre en pacientes con alergia alimentaria. Los más avanzados, aunque no son los más empleados, inducen el proceso inflamatorio en la mucosa intestinal (mediante el empleo de toxina colérica). Otros en cambio, inducen una sensibilización sistémica, como es el caso de la administración intraperitoneal del alergeno junto al hidróxido de aluminio, y finalmente se han desarrollado modelos, aunque muy pocos, en los que se induce la sensibilización alérgica administrando únicamente el alergeno, sin adyuvante, y en determinadas cepas de ratones (51–53).
En particular, se describirán los modelos de alergia alimentaria a leche de vaca, dado que la ALV es la más importante en Argentina, como se mencionó anteriormente, y en numerosas partes del mundo.
MODELOS ANIMALES DE ALERGIA A LECHE DE VACA
Este grupo ha realizado un aporte al desarrollo de un modelo murino de alergia alimentaria IgE-mediado a proteínas de leche de vaca (PLV), mediante la sensibilización de ratones BALB/c por vía intragástrica empleando como adyuvante mucosal a la toxina colérica (TC) (54–56). La administración repetitiva de PLV junto a TC, y un posterior desafío oral empleando únicamente PLV, permiten evidenciar la aparición en forma inmediata de signos clínicos que reflejan la existencia de mecanismos de hipersensibilidad (Fig. 4).

Figura 4. Esquema general del protocolo de sensibilización y tratamientos aplicados.
Este modelo guarda numerosas similitudes con la patología observada en humanos: el desafío oral induce en forma inmediata signos clínicos locales y sistémicos compatibles con la activación de mastocitos y basófilos, prueba cutánea positiva (demuestra la existencia en la piel de mastocitos sensibilizados con IgE específica), una respuesta inmune humoral con la síntesis de isotipos de inmunoglobulinas asociados a una activación Th2 (IgE e IgG1 específicos de leche de vaca), y niveles basales de IgG2a que reflejan una escasa activación Th1, aumento de histamina en sangre (demuestra la inducción de un proceso inflamatorio con activación de mastocitos y basófilos), expansión clonal de LT específicos de PLV con un fenotipo Th2 por la secreción aumentada de citoquinas Th2 (IL-5 e IL-13), junto a una reducida secreción de IFN-γ, activación mucosal del sistema inmune local con características Th2 (IL-5, IL-13, Gata-3, etc.), y un infiltrado mononuclear en la lámina propia del duodeno de los ratones. En conclusión, en este modelo de alergia alimentaria se induce una sensibilización en la mucosa intestinal, que se traduce en una respuesta sistémica Th2 responsable de la reacción alérgica que se produce al exponer los animales al alergeno por la vía oral. Estos hallazgos son los que se observan en pacientes con alergia alimentaria (57–60). Sobre la base de este modelo, se puede estudiar el desarrollo de IT tendientes a controlar la respuesta alérgica a través del estudio de protocolos de inmunomodulación, con la consiguiente inducción de una inmunidad Th1 específica, o de tolerancia, con la generación de Treg inducibles. Estos últimos permitirían controlar a los linfocitos Th2 y además restituir los mecanismos tolerogénicos deficitarios, como se mencionó anteriormente. Por lo tanto, estas IT correctivas se basan en el control que ejercen las diferentes sub-poblaciones de LT entre sí a través de la secreción de distintas citoquinas (Fig. 5).
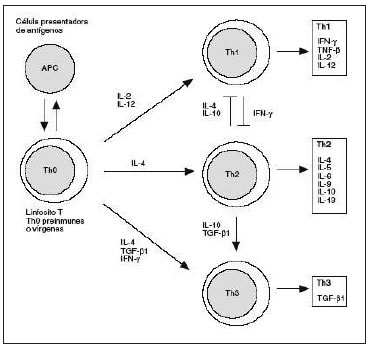
Figura 5. Mecanismos de inmunomodulación o de inducción de LT regulatorios.
Por otro lado, el estudio de diferentes microorganismos ha permitido identificar los componentes moleculares responsables de las propiedades adyuvantes. Se ha dilucidado que la gran mayoría de ellos son agonistas de los receptores de la inmunidad innata, principalmente receptores de tipo Toll, e inducen una respuesta adaptativa Th1. Estos hallazgos además, han posibilitado la formulación de nuevas vacunas empleando el componente procariota purificado, o modificado, junto al inmunógeno, lo que ha producido en los últimos años un enorme impulso a la vacunología. Si bien al momento sólo un adyuvante de este tipo está aprobado para su uso en vacunas en humanos (derivado del LPS o 3-O-deacyl-4’-monofosforil lípido A o MFL en la vacuna contra el virus del papiloma humano) existe un gran auge en el desarrollo de este tipo de componentes vacunales. Del mismo modo, estos hallazgos han impactado en el desarrollo de inmunoterapias modulatorias. El empleo de agonistas Toll junto a alergenos por diferentes vías mucosales permite revertir o prevenir una reacción alérgica a través de la modulación de los LT Th2. Por lo tanto, la IT inmunomoduladora y la IT tolerogénica constituyen IT correctivas que pueden modificar el curso de las alergias y otras inmunopatologías como la autoinmunidad. Se han realizado ensayos clínicos en pacientes con rinitis alérgica utilizando las secuencias nucleotídicas hipo-metiladas CpG por su afinidad por el TLR-9 (61)(62). A partir de estudios en modelos animales en los cuales la administración del CpG junto al alergeno induce una inmunidad Th1 que controla los mecanismos Th2 (63–65), se ha planteado el empleo de protocolos similares en pacientes alérgicos (66)(67).
APLICACIÓN DE IT INMUNOMODULATORIAS EN EL MODELO ANIMAL DE ALERGIA A LECHE DE VACA
Se ha estudiado el efecto que proteínas de membrana de bacterias del género Brucella ejercen sobre la respuesta alérgica en el modelo murino. Previamente, el grupo de la Dra Cassataro estudió las propiedades auto-adyuvantes de estas proteínas de membrana, denominadas Omp (Outer membrane proteins), para su empleo en la formulación de una vacuna para la brucelosis. Identificaron a las proteínas Omp-16 y Omp-19 de Brucella abortus con capacidad de inducir una inmunidad Th1 con una marcada producción de IIFN-γ (68)(69). A partir de estos resultados se elaboraron protocolos de inmunomodulación, en los cuales la administración de estas proteínas con capacidad adyuvante junto a las PLV promoviera la prevención o reversión del estado de alergia en el modelo en ratón. En este contexto, el empleo de Omp-16 por vía nasal u oral genera una respuesta Th1 específica de PLV que controla la respuesta Th2 que media la reacción alérgica. En la Figura 6 se muestran los protocolos aplicados, con los cuales se ha logrado controlar los signos clínicos de alergia luego del desafío oral, revertir la respuesta inmune humoral Th2, negativizar la prueba cutánea, e inducir una respuesta local y sistémica Th1 con una marcada producción de IFN-γ proveniente de LT CD4+ y LT CD8+. En ambos tratamientos, nasal y oral, se han logrado resultados similares. Además, es importante resaltar que la administración nasal de Omp-16 no indujo reacciones adversas a nivel de sistema nervioso central (55)(70).

Figura 6. Inmunomodulación de la respuesta alérgica mediante el empleo de Omp-16 por vía intranasal u oral. (a) Esquema de los protocolos experimentales; (b) signos clínicos inducidos luego del desafío oral con las proteínas de leche de vaca; (c) pruebas cutáneas con proteínas de leche de vaca; (d) monitoreo de IgE específicas sérica; (e) niveles de citoquinas secretadas por células de bazo estimuladas con proteínas de leche de vaca (Ibañez y col. “Unlipidated outer membrane protein Omp16 (U-Omp16) from Brucella spp. as nasal adjuvant induces a Th1 immune response and modulates the Th2 allergic response to cow’s milk proteins” y Smaldini y col. “Oral delivery of Brucella spp. recombinant protein U-Omp16 abrogates the IgE-mediated milk allergy”).
Dado que se empleó CpG como adyuvante pro- Th1 en un lote control de animales en tratamiento, se puede asegurar que Omp-16 induce una respuesta Th1 similar a la inducida por CpG. Si bien CpG es un candidato promisorio ampliamente estudiado en enfermedades alérgicas, al ser administrado por vía mucosal induce una fuerte respuesta Th1 y puede causar enfermedades autoinmunes (71). Por lo tanto, se concluye que el empleo de Omp recombinante como adyuvante mucosal genera importantes expectativas para futuros tratamientos inmunomodulatorios de las alergias.
APLICACIÓN DE IT TOLEROGÉNICAS EN EL MODELO ANIMAL DE ALERGIA A LECHE DE VACA
Como se ha mencionado anteriormente, los pacientes alérgicos a las proteínas de la leche de vaca que son tratados con una inmunoterapia oral muestran una mayor probabilidad de desarrollar tolerancia. Sin embargo, muchos de estos pacientes, y con los protocolos actuales en práctica, presentan reacciones adversas. Por esta razón es importante el aporte desde los modelos animales para desarrollar nuevas variantes a introducir en la inmunoterapia y luego transferirlos a ensayos clínicos. Como estudios pre-clínicos, el modelo murino de alergia a leche bovina es utilizado para estudiar el efecto de la administración oral (intragástrica y sublingual) de las PLV de forma preventiva (previo a la sensibilización alérgica), y como tratamiento desensibilizante (posterior a la sensibilización alérgica). Como puede verse en la Figura 7, en ambos tratamientos se observó una disminución de la respuesta alérgica, a través de la supresión de los signos clínicos post-desafío oral con PLV, negativización de la prueba cutánea, disminución de los niveles séricos de IgE específica y supresión de la secreción de citoquinas Th2 (IL-5 e IL-13) a partir de células de bazo estimuladas con PLV. A nivel de la mucosa intestinal se halló una disminución de las citoquinas Th2 (IL-5, IL-13), concomitante a un aumento de LT CD4+CD25+Foxp3+ productores de IL-10 y TGF-β o Treg. Asimismo, se observó que la inflamación presente en la mucosa intestinal de animales sensibilizados es revertida mediante la aplicación de estos tratamientos (72).

Figura 7. Inmunoterapia oral alergeno-específica. (a) esquemas de los protocolos aplicados; (b) signos clínicos inducidos luego del desafío oral con las proteínas de leche de vaca; (c) pruebas cutáneas con proteínas de leche de vaca; (d) monitoreo de IgE específicas sérica; (e) porcentaje de células Treg inducidas luego de cada tratamiento
(Smaldini y cols. “Immunotherapeutic Induction of IL-10- and TGF-β-Producing Tregs to Control the Allergic Response”).
Si bien en ambos tratamientos se obtuvieron resultados similares en cuanto al control de la respuesta alérgica y la inducción de Treg, la IT sublingual fue efectiva con cantidades 100 veces menor de PLV en comparación con el tratamiento intragástrico. La importancia de estos estudios radica en que demuestran que los Treg productores de IL-10 y/o TGF-β residentes en la mucosa duodenal son los responsables de revertir el estado de alergia. Dado que este tipo de estudios o resultados no es posible de realizarse en pacientes por cuestiones éticas, el empleo de modelos animales cobra relevancia para comprender los mecanismos subyacentes en las mucosas que dan origen al control de la inflamación alérgica. A partir de estas observaciones se puede considerar el estudio con protocolos experimentales que incluyen la administración mucosal, de péptidos provenientes de las proteínas alergénicas. El empleo de fracciones peptídicas en lugar del alergeno nativo, reduciría la posibilidad de instauración de reacciones adversas durante el tratamiento. El mapeo de epitopes B y T en los principales alergenos de la leche bovina ha permitido identificar péptidos que contienen un único epitope B, y de esta manera al no poder entrecruzar al menos dos moléculas de IgE en la superficie de mastocitos y basófilos, no se produce la activación celular. La presencia en estos péptidos de epitopes T posibilitará la inducción o expansión de Treg específicos.
En conclusión, los estudios básicos y aquellos basados en el empleo de animales de experimentación constituyen un aporte fundamental para la resolución de una patología crónica en creciente aumento, no sólo en su incidencia, sino también en la gravedad de su presentación. Estos avances realizados desde la ciencia básica pueden traducirse en la práctica en un importante beneficio para el paciente (Fig. 8).

Figura 8. Medicina traslacional y la transferencia de los conocimientos desde los ensayos pre-clínicos a la resolución de las alergias en los ensayos clínicos.
La medicina traslacional se refiere justamente al proceso de trasladar los conocimientos de la ciencia básica a la resolución de problemas médicos cotidianos. Por lo tanto las colaboraciones entre los grupos que hacen investigación básica y aplicada, con los que hacen investigación clínica permitirán avanzar en el mayor conocimiento de las patologías, y en el desarrollo de nuevos y más seguros tratamientos.
1. Gell PGH, Coombs RRA. Clinical Aspects of Immunology. 1st ed. Oxford, England: Blackwell; 1963. [ Links ]
2. Strachan DP. Hay fever, hygiene, and household size. BMJ 1989; 299 (6710): 1259–60.
3. Bach JF. The effect of infections on susceptibility to autoimmune and allergic diseases. N Engl J Med 2002; 347 (12): 911–20.
4. Rona RJ, Keil T, Summers C, Gislason D, Zuidmeer L, Sodergren E, et al. The prevalence of food allergy: A meta-analysis General approach. J Allergy Clin Immunol 2006; 20 (3): 638–46.
5. Sicherer SH, Muñoz-Furlong A, Godbold JH, Sampson HA. US prevalence of self-reported peanut, tree nut, and sesame allergy: 11-year follow-up. J Allergy Clin Immunol 2010; 125 (6): 1322–6. 4
6. Sicherer SH, Muñoz-Furlong A, Sampson HA. Prevalence of peanut and tree nut allergy in the United States determined by means of a random digit dial telephone survey: a 5-year follow-up study. J Allergy Clin Immunol 2003; 112 (6): 1203–7.
7. Devereux G. The increase in the prevalence of asthma and allergy: food for thought. Nat Rev Immunol 2006; 6 (11): 869–74.
8. Burks W, Tang M, Sicherer S, Muraro A, Eigenmann P a, Ebisawa M, et al. ICON: food allergy. J Allergy Clin Immunol 2012; 129 (4): 906–20.
9. Branum AM, Lukacs SL. Food allergy among children in the United States. Pediatrics 2009; 124 (6): 1549–55.
10. Sicherer SH, Sampson HA. Food allergy. J Allergy Clin Immunol 2010; 125 (2 Suppl 2): S116–25.
11. Wang J, Sampson HA. Food allergy. J Clin Invest 2011; 121 (3): 827–35.
12. Mayer L. Mucosal immunity. Pediatrics 2003; 111 (6 Pt 3): 1595–600.
13. Pabst O, Mowat AM. Oral tolerance to food protein. Mucosal Immunology 2012; 5 (3): 232–9.
14. Vignali DAA, Collison LW, Workman CJ. How regulatory T cells work. Nat Rev Immunol 2009; 8 (7): 523–32.
15. Schmidt A, Oberle N, Krammer PH. Molecular mechanisms of treg-mediated T cell suppression. Front Immunol 2012; 3: 51. [ Links ]
16. Krogulska A, Borowiec M, Polakowska E, Dynowski J, Młynarski W, Wasowska-Królikowska K. FOXP3, IL-10, and TGF-β genes expression in children with IgE-dependent food allergy. J Clin Immunol 2011; 31 (2): 205–15.
17. Shreffler WG, Wanich N, Moloney M, Nowak-wegrzyn A. Association of allergen-specific regulatory T cells with the onset of clinical tolerance to milk protein. Journal of Allergy and Clinical Immunology. American Academy of Allergy, Asthma & Immunology 2009; 123 (1): 43–52.e7.
18. Syed A, Garcia MA, Lyu S-C, Bucayu R, Kohli A, Ishida S, et al. Peanut oral immunotherapy results in increased antigen-induced regulatory T-cell function and hypomethylation of forkhead box protein 3 (FOXP3). J Allergy Clin Immunol 2014; 133 (2): 500–10.
19. Verhagen J, Akdis M, Traidl-Hoffmann C, Schmid-Grendelmeier P, Hijnen D, Knol EF, et al. Absence of T-regulatory cell expression and function in atopic dermatitis skin. J Allergy Clin Immunol 2006; 117 (1): 176–83.
20. Nguyen KD, Vanichsarn C, Fohner A, Nadeau KC. Selective deregulation in chemokine signaling pathways of CD4+CD25(hi)CD127(lo)/(-) regulatory T cells in human allergic asthma. J Allergy Clin Immunol 2009; 123 (4): 933–9.e10.
21. Provoost S, Maes T, van Durme YM, Gevaert P, Bachert C, Schmidt-Weber CB, et al. Decreased FOXP3 protein expression in patients with asthma. Allergy 2009; 64 (10): 1539–46.
22. Ling EM, Smith T, Nguyen XD, Pridgeon C, Dallman M, Arbery J, et al. Relation of CD4+CD25+ regulatory T-cell suppression of allergen-driven T-cell activation to atopic status and expression of allergic disease. Lancet 2004; 363 (9409): 608–15.
23. Grindebacke H, Wing K, Andersson A-C, Suri-Payer E, Rak S, Rudin A. Defective suppression of Th2 cytokines by CD4CD25 regulatory T cells in birch allergics during birch pollen season. Clin Exp Allergy 2004; 34 (9): 1364–72.
24. Sicherer SH, Leung DYM. Advances in allergic skin disease, anaphylaxis, and hypersensitivity reactions to foods, drugs, and insects in 2012. J Allergy Clin Immunol 2013; 131 (1): 55–66.
25. NOON L. Prophylactic inoculation against hay fever. International archives of allergy and applied immunology. 1953; 4 (4): 285–8.
26. Sun J, Hui X, Ying W, Liu D, Wang X. Efficacy of allergen-specific immunotherapy for peanut allergy: a meta-analysis of randomized controlled trials. Allergy and asthma proceedings: the official journal of regional and state allergy societies; 35 (2): 171–7.
27. Blumchen K, Ulbricht H, Staden U, Dobberstein K, Beschorner J, de Oliveira LCL, et al. Oral peanut immunotherapy in children with peanut anaphylaxis. J Allergy Clin Immunol 2010; 126(1): 83–91.e1.
28. Untersmayr E, Jensen-Jarolim E. The role of protein digestibility and antacids on food allergy outcomes. Journal of Allergy and Clinical Immunology 2010; 121 (6): 1301–10.
29. Pali-Schöll I, Herzog R, Wallmann J, Szalai K, Brunner R, Lukschal A. Antacids and dietary supplements with an influence on the gastric pH increase the risk for food sensitization. Clin Exp Allergy 2010; 40 (7): 1091–8.
30. Bonvalet M, Moussu H, Wambre E, Ricarte C, Horiot S, Rimaniol A-C, et al. Allergen-specific CD4+ T cell responses in peripheral blood do not predict the early onset of clinical efficacy during grass pollen sublingual immunotherapy. Clin Exp Allergy 2012; 42 (12): 1745–55.
31. Fleischer DM, Burks AW, Vickery BP, Scurlock AM, Wood RA, Jones SM, et al. Sublingual immunotherapy for peanut allergy: a randomized, double-blind, placebo-controlled multicenter tria. J Allergy Clin Immunol 2014; 131 (1): 119–27.
32. Wang J, Sampson HA. Review article Oral and sublingual immunotherapy for food allergy. Asian Pac J Allergy Immunol 2013; 31 (3): 198–209.
33. Kerzl R, Simonowa A, Ring J, Ollert M, Mempel M. Life-threatening anaphylaxis to kiwi fruit: protective sublingual allergen immunotherapy effect persists even after discontinuation. J Allergy Clin Immunol 2007; 119 (2): 507–8.
34. Buchanan AD, Green TD, Jones SM, Scurlock AM, Christie L, Althage KA, et al. Egg oral immunotherapy in nonanaphylactic children with egg allergy. J Allergy Clin Immunol 2007; 119 (1): 199–205.
35. Jones SM, Pons L, Roberts JL, Scurlock AM, Perry TT, Kulis M, et al. Clinical Efficacy and Immune Regulation With Peanut Oral Immunotherapy. J Allergy Clin Immunol 2010; 124 (2): 1–20.
36. Anagnostou K, Clark A, King Y, Islam S, Deighton J, Ewan P. Efficacy and safety of high-dose peanut oral immunotherapy with factors predicting outcome. Clinical and experimental allergy: journal of the British Society for Allergy and Clinical Immunology 2011; 41 (9): 1273–81.
37. Patriarca G, Nucera E, Roncallo C, Pollastrini E, Bartolozzi F, De Pasquale T, et al. Oral desensitizing treatment in food allergy: clinical and immunological results. Alimentary Pharmacology & Therapeutics 2003; 17 (3): 459–65.
38. Patriarca G, Schiavino D, Nucera E, Schinco G, Milani A, Gasbarrini GB. Food allergy in children: results of a standardized protocol for oral desensitization. Hepato-Gastroenterology 1998; 45 (19): 52–8.
39. Poisson A, Thomas G, Jean-Landais N, Giaufre E. Rapid acquired tolerance to cow’s milk by oral route in a case of severe childhood food allergy. Allergie et immunologie 1988; 20 (2): 67–8.
40. Skripak JM, Nash SD, Rowley H, Brereton NH, Oh S, Hamilton RG, et al. A randomized, double-blind, placebo-controlled study of milk oral immunotherapy for cow’s milk allergy. J Allergy Clin Immunol 2013;122 (6): 1154–60.
41. Martorell Aragonés A, Félix Toledo R, Cerdá Mir JC, Martorell Calatayud A. Oral rush desensitization to cow milk. Following of desensitized patients during three years. Allergologia et immunopathologia 2007; 35 (5): 174–6.
42. Staden U, Rolinck-Werninghaus C, Brewe F, Wahn U, Niggemann B, Beyer K. Specific oral tolerance induction in food allergy in children: efficacy and clinical patterns of reaction. Allergy 2007; 62(11): 1261–9.
43. Passalacqua G, Landi M, Pajno GB. Oral immunotherapy for cow’s milk allergy. Cur opinion allergy clib immunol 2012; 12 (3): 271–7.
44. Canonica GW, Cox L, Pawankar R, Baena-Cagnani CE, Blaiss M, Bonini S, et al. Sublingual immunotherapy: World Allergy Organization position paper 2013 update. The World Allergy Organization 2014; 7 (1): 6. [ Links ]
45. Webber CM, England RW. Oral allergy syndrome: a clinical, diagnostic, and therapeutic challenge. Annals of allergy, asthma & immunology: official publication of the American College of Allergy, Asthma, & Immunology 2010; 104 (2): 101–8.
46. Fernández-Rivas M, Garrido Fernández S, Nadal JA, Díaz de Durana MDA, García BE, González-Mancebo E, et al. Randomized double-blind, placebo-controlled trial of sublingual immunotherapy with a Pru p 3 quantified peach extract. Allergy 2009; 64 (6): 876–83.
47. Patriarca G, Nucera E, Pollastrini E, Roncallo C, De Pasquale T, Lombardo C, et al. Oral specific desensitization in food-allergic children. Digestive diseases and sciences 2007; 52 (7): 1662–72.
48. de Boissieu D, Dupont C. Sublingual immunotherapy for cow’s milk protein allergy: a preliminary report. Allergy 2006; 61 (10): 1238–9.
49. Keet CA, Frischmeyer-Guerrerio PA, Thyagarajan A, Schroeder JT, Hamilton RG, Boden S, et al. The safety and efficacy of sublingual and oral immunotherapy for milk allergy. J Allergy Clin Immunol 2011; 129 (2): 448-55. [ Links ]
50. Nadeau KC, Schneider LC, Hoyte L, Borras I, Umetsu DT. Rapid oral desensitization in combination with omalizumab therapy in patients with cow’s milk allergy. J Allergy Clin Immunol 2012; 127 (6): 1622–4.
51. van Halteren AG, van der Cammen MJ, Biewenga J, Savelkoul HF, Kraal G. IgE and mast cell response on intestinal allergen exposure: a murine model to study the onset of food allergy. J Allergy Clin Immunol 1997; 99 (1 Pt 1): 94–9.
52. Zhang Y, Shoda LK, Brayton KA, Estes DM, Palmer GH, Brown WC. Induction of interleukin-6 and interleukin-12 in bovine B lymphocytes, monocytes, and macrophages by a CpG oligodeoxynucleotide (ODN 2059) containing the GTCGTT motif. Journal of Interferon & Cytokine Research: The Official Journal of the International Society for Interferon and Cytokine Research. 2001; 21 (10): 871–81.
53. Gizzarelli F, Corinti S, Barletta B, Iacovacci P, Brunetto B, Butteroni C, et al. Evaluation of allergenicity of genetically modified soybean protein extract in a murine model of oral allergen-specific sensitization. Clin Exp Allergy 2006; 36 (2): 238–48.
54. Smaldini P, Curciarello R, Candreva A, Rey MA, Fossati CA, Petruccelli S, et al. In vivo evidence of cross-reactivity between cow’s milk and soybean proteins in a mouse model of food allergy. International archives of allergy and immunology 2012; 158 (4): 335–46.
55. Smaldini PL, Ibañez AE, Fossati CA, Cassataro J, Docena GH. Oral delivery of Brucella spp. recombinant protein U-Omp16 abrogates the IgE-mediated milk allergy. Human vaccines & immunotherapeutics 2014; 10 (7): 1–9.
56. Smaldini PL, Stanford J, Romanin DE, Fossati C, Docena GH. Down-regulation of NF-κB signaling by Gordonia bronchialis prevents the activation of gut epithelial cells. Innate immunity 2013; 20 (6): 626–38.
57. Wanich N, Nowak-Wegrzyn A, Sampson HA, Shreffler WG. Allergen-specific basophil suppression associated with clinical tolerance in patients with milk allergy. J Allergy Clin Immunol 2009; 123 (4): 789–94.e20.
58. Shek LPC, Bardina L, Castro R, Sampson HA, Beyer K. Humoral and cellular responses to cow milk proteins in patients with milk-induced IgE-mediated and non-IgE-mediated disorders. Allergy 2005; 60 (7): 912–9.
59. Vandezande LM, Wallaert B, Desreumaux P, Tsicopoulos A, Lamblin C, Tonnel AB, et al. Interleukin-5 immunoreactivity and mRNA expression in gut mucosa from patients with food allergy. Clin Exp Allergy 1999; 29 (5): 652–9.
60. Lillestøl K, Helgeland L, Arslan Lied G, Florvaag E, Valeur J, Lind R, et al. Indications of “atopic bowel” in patients with self-reported food hypersensitivity. Alimentary pharmacology & therapeutics 2010; 31 (10): 1112–22.
61. Klimek L, Schendzielorz P, Mueller P, Saudan P, Willers J. Immunotherapy of allergic rhinitis: new therapeutic opportunities with virus-like particles filled with CpG motifs. Am J Rhinol Allergy 2013; 27 (3): 206–12.
62. Broide DH. Immunomodulation of Allergic Disease. Annu Rev Med 2009; 60: 279–91.
63. Broide D, Stachnick G, Castaneda D, Nayar J, Miller M, Cho J, et al. Systemic administration of immunostimulatory DNA sequences mediates reversible inhibition of Th2 responses in a mouse model of asthma. J Clin Immunol 2001; 21 (3): 175–82.
64. Shirota H, Sano K, Kikuchi T, Tamura G, Shirato K. Regulation of murine airway eosinophilia and Th2 cells by antigen-conjugated CpG oligodeoxynucleotides as a novel antigen-specific immunomodulator. J Immunol (Baltimore, Md.: 1950) 2000; 164 (11): 5575–82.
65. Teshima R, Okunuki H, Sato Y, Akiyama H, Maitani T, Sawada J. Effect of oral administration of CpG ODN-OVA on WBB6F1-W/Wv mice. Allergology international: official journal of the Japanese Society of Allergology 2006; 55(1): 43–8.
66. Lycke N. Recent progress in mucosal vaccine development: potential and limitations. Nat Rev Immunol 2012; 12 (8): 592–605.
67. Shirota H, Klinman DM. Recent progress concerning CpG DNA and its use as a vaccine adjuvant. Expert review of vaccines 2014; 13 (2): 299–312.
68. Pasquevich KA, Estein SM, García Samartino C, Samartino CG, Zwerdling A, Coria LM, et al. Immunization with recombinant Brucella species outer membrane protein Omp16 or Omp19 in adjuvant induces specific CD4+ and CD8+ T cells as well as systemic and oral protection against Brucella abortus infection. Infection and Immunity 2009; 77(1): 436–45.
69. Pasquevich KA, García Samartino C, Coria LM, Estein SM, Zwerdling A, Ibañez AE, et al. The protein moiety of Brucella abortus outer membrane protein 16 is a new bacterial pathogen-associated molecular pattern that activates dendritic cells in vivo, induces a Th1 immune response, and is a promising self-adjuvanting vaccine against systemic a. J Immunol (Baltimore, Md.: 1950). 2010; 184 (9): 5200–12.
70. Ibañez AE, Smaldini P, Coria LM, Delpino MV, Pacífico LGG, Oliveira SC, et al. Unlipidated outer membrane protein Omp16 (U-Omp16) from Brucella spp. as nasal adjuvant induces a Th1 immune response and modulates the Th2 allergic response to cow’s milk proteins. PloS one 2013; 8 (7): e69438.
71. Hurtado PR, Jeffs L, Nitschke J, Patel M, Sarvestani G, Cassidy J, et al. CpG oligodeoxynucleotide stimulates production of anti-neutrophil cytoplasmic antibodies in ANCA associated vasculitis. BMC Immunol 2008; 34 (9):eCollection. [ Links ]
72. Smaldini P, Orsini Delgado M, Fossati CA, Docena GH. Orally-induced intestinal CD4+ CD25+ FoxP3+ Treg controlled undesired responses towards oral antigens and effectively dampen food allergic reactions. PloS one 2015; 10 (10): e0141116. [ Links ]
Recibido: 26 de enero de 2015.
Aceptado: 27 de noviembre de 2015.














